Бролуцизумаб
BrolucizumabФармакологическое действие
Механизм действия
Патологический ангиогенез в глазу и отёк сетчатки связан с повышенной активизацией сигнального пути фактора роста эндотелия сосудов A (VEGF-A). Бролуцизумаб с высокой аффинностью связывается с различными изоформами VEGF-A (в частности с VEGF110, VEGF121 и VEGF165), тем самым препятствуя связыванию VEGF-A с его рецепторами VEGFR-1 и VEGFR-2. Подавляя связывание VEGF-A, бролуцизумаб угнетает пролиферацию эндотелиальных клеток, тем самым уменьшая патологическую неоваскуляризацию и снижая проницаемость сосудов.
Фармакодинамика
Неоваскулярная (влажная) форма возрастной макулодистрофии (нВМД) характеризуется наличием патологической хориоидальной неоваскуляризации (ХНВ). Экссудация крови и жидкости из хориоидальных неоваскулярных мембран (ХНМ) может вызывать утолщение или отёк сетчатки и (или) суб/интраретинальное кровоизлияние, приводящие к снижению остроты зрения.
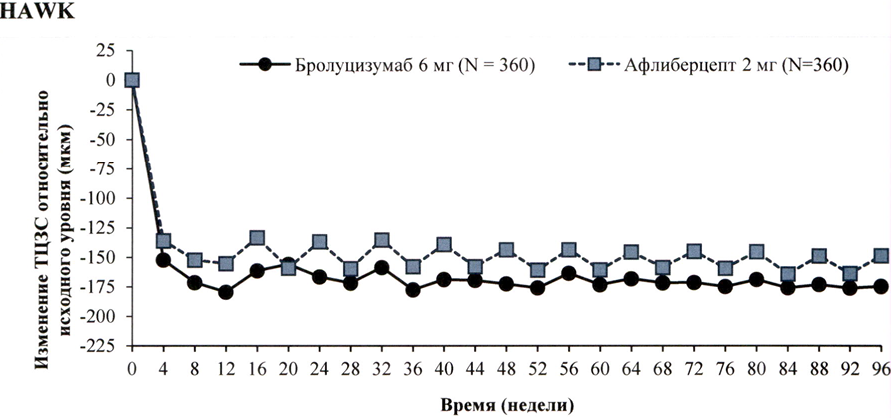
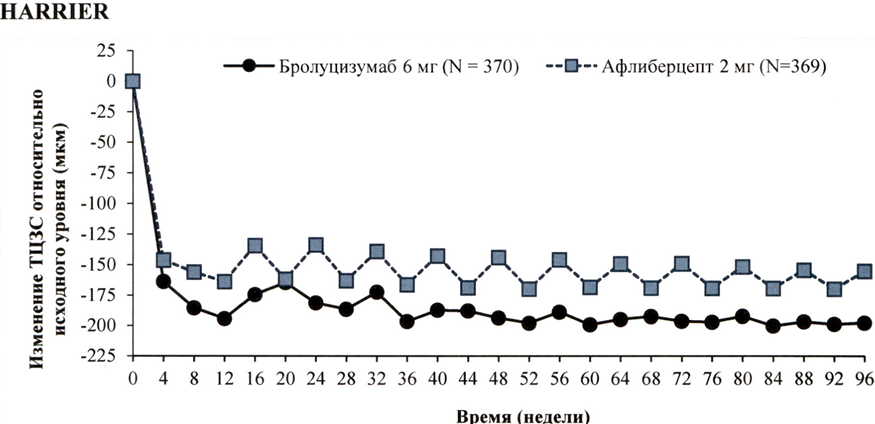
В исследованиях HAWK и HARRIER решение о лечении принималось на основании оценки активности заболевания, включающей оценку соответствующих анатомических параметров. У пациентов, получавших бролуцизумаб, уже через 4 недели после начала лечения и вплоть до 48 и 96 недель наблюдалось снижение толщины центральной зоны сетчатки (ТЦЗС) и количества интраретинальной/субретинальной жидкости (ИРЖ/СРЖ) или жидкости, находящейся под пигментным эпителием сетчатки (ПЭС). Снижение ТЦЗС и количества ИРЖ/СРЖ на 16 и 48 неделях в случае применения бролуцизумаба статистически значимо превышало соответствующее снижение в случае применения афлиберцепта (см. подраздел «Клиническая эффективность и безопасность»), В этих исследованиях уменьшение размера очага ХНВ, у пациентов, получавших бролуцизумаб, наблюдалось уже через 12 недель и сохранялось через 48 и 96 недель после начала лечения.
Клиническая эффективность и безопасность
Безопасность и эффективность бролуцизумаба оценивали в 2 рандомизированных многоцентровых двойных слепых исследованиях III фазы с активным контролем (HAWK и HARRIER) у пациентов с нВМД. В этих исследованиях лечение в течение 2 лет получали в общей сложности 1817 пациентов (1088 — бролуцизумаб; 729 — афлиберцепт). Возраст пациентов варьировал от 50 до 97 лет; средний возраст составил 76 лет.
В исследовании HAWK пациентов рандомизировали в отношении 1:1:1 в группы со следующими схемами лечения:
- бролуцизумаб 3 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В исследовании HARRIER пациентов рандомизировали в отношении 1:1 в группы со следующими схемами лечения:
- бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
- афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В обоих исследованиях пациенты из групп бролуцизумаба после 3 первых ежемесячных инъекций (0, 4 и 8 неделя), получали препарат каждые 12 недель с возможностью изменения интервала дозирования до 1 раза в 8 недель в зависимости от активности заболевания.
Активность заболевания оценивал врач в первый 12-недельный интервал (на 16 и 20 неделях) и в каждый из последующих плановых визитов, в рамках которых проводились инъекции с интервалом 12 недель. Пациентам, у которых в какой-либо из этих визитов выявляли активность заболевания (например, снижение остроты зрения, увеличение толщины центральной зоны сетчатки (ТЦЗС) и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС)), интервал между инъекциями уменьшали до 1 раза в 8 недель.
Результаты
Первичной конечной точкой эффективности в обоих исследованиях являлось изменение относительно исходного уровня максимальной корригированной остроты зрения (МКОЗ) к 48 неделе, которую оценивали по буквенной шкале ETDRS (исследование «Лечение диабетической ретинопатии на ранней стадии»). Основная цель заключалась в демонстрации не меньшей эффективности бролуцизумаба по сравнению с афлиберцептом. В обоих исследованиях было показано, что бролуцизумаб (применяемый по схеме 1 раз/12 нед/ 1 раз/8 нед) по своей эффективности не уступает афлиберцепту 2 мг (применяемому по схеме 1 раз/8 нед). Увеличение остроты зрения, достигнутое в течение первого года, сохранялось и в течение второго года.
Результаты обоих исследований представлены в табл. 1 и на рисунке 1 ниже.
Таблица 1. Результаты оценки остроты зрения на 48 и 96 неделях в исследованиях III фазы — исследования НА WK HARRIER
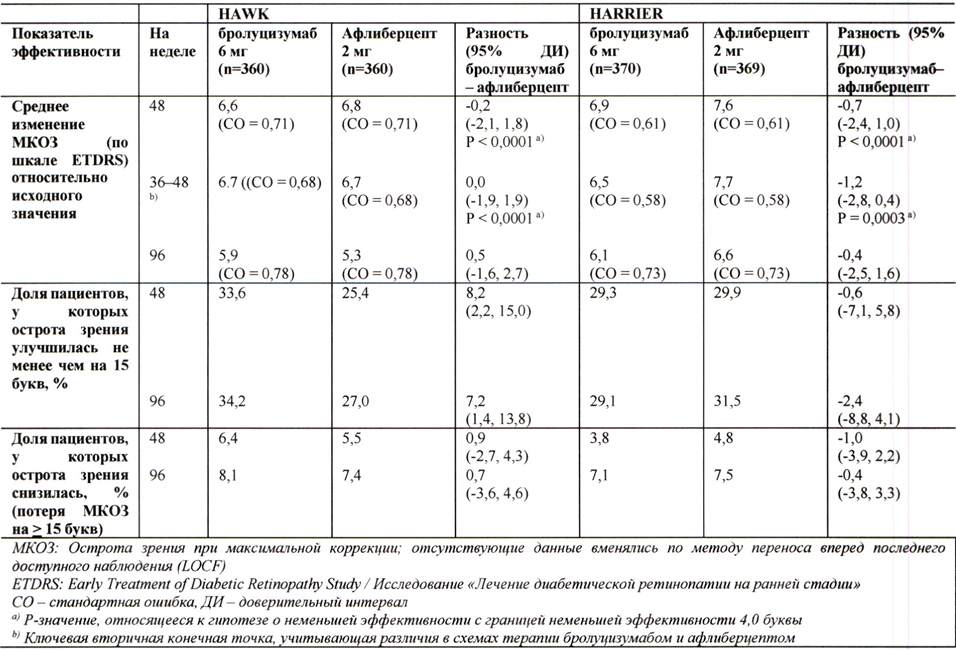
Рисунок 1. Среднее изменение остроты зрения от исходного уровня до 96 недели в исследованиях НАWK и HARRIER
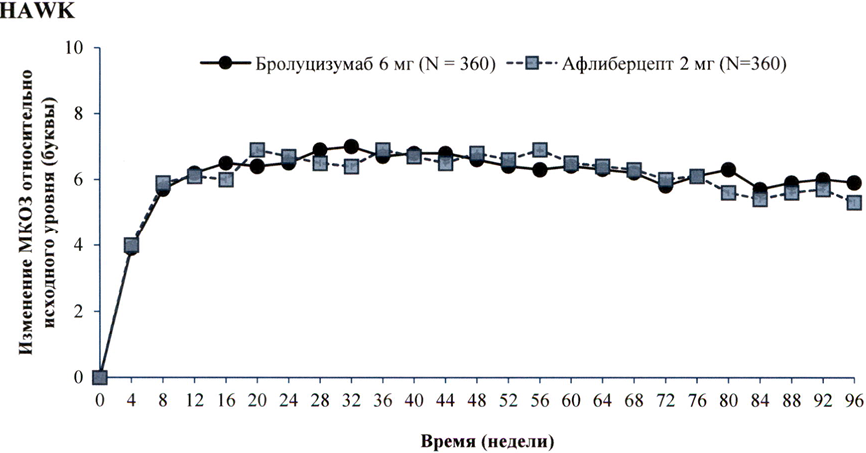
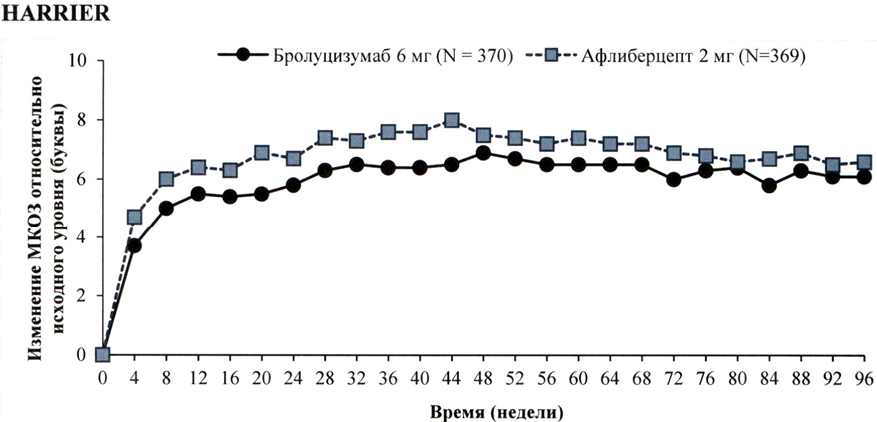
На 48 неделе такое увеличение остроты зрения в исследованиях HAWK и HARRIER было достигнуто у 56 % и 51 % пациентов, получавших бролуцизумаб 6 мг каждые 12 недель соответственно, а на неделе 96 — у 45 % и 39 % пациентов. Среди пациентов, которые по результатам оценки, проведённой в первом 12-недельном интервале, соответствовали критериям продолжения инъекций с интервалом 1 раз/12 недель, 85 % и 82 % пациентов продолжали получать препарат каждые 12 недель вплоть до 48 недели. Из числа пациентов, получавших препарат с интервалом 12 недель на 48 неделе, 82 % и 75 % пациентов продолжали получать препарат каждые 12 недель вплоть до 96 недели.
Терапевтические эффекты в изученных подгруппах (например, различающихся по возрасту, полу, расе, исходной остроте зрения, исходной толщине сетчатки, типу и размеру очага ХНВ, статусу жидкости), в обоих исследованиях в целом соответствовали эффектам, наблюдаемым в общей популяции пациентов, включённых в данные исследования.
Активность заболевания оценивали по изменениям остроты зрения и (или) анатомических параметров, включающих ТЦЗС и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС). На 16 неделе, когда проводили первую оценку активности заболевания для определения интервала между инъекциями, доля пациентов с активным заболеванием в группе бролуцизумаба 6 мг оказалась статистически значимо ниже, чем в группе афлиберцепта 2 мг.
В обоих исследованиях активность заболевания оценивали в течение всего исследования.
Значения анатомических параметров, свидетельствующих об активности заболевания, на 48 неделе и на 96 неделе в группе бролуцизумаба были ниже, чем в группе афлиберцепта 2 мг (табл. 2).
Таблица 2 Оценка активности заболевания в исследованиях НАWK и HARRIER вплоть до 96 недели
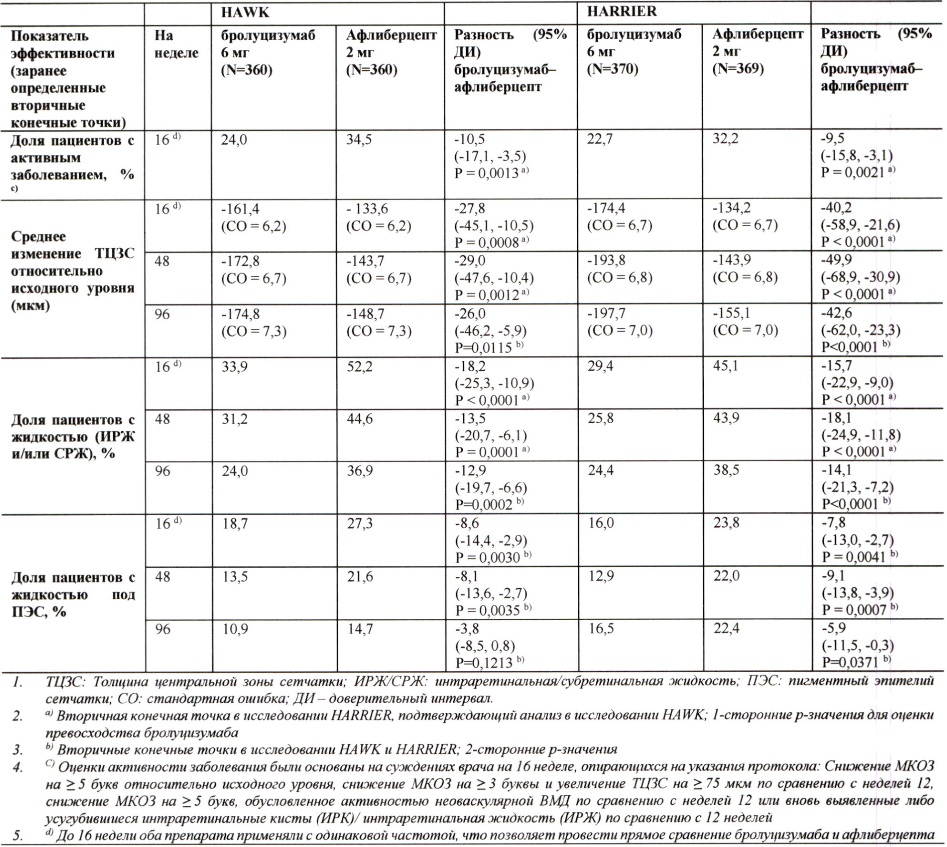
Рисунок 2. Изменение толщины центральной зоны сетчатки относительно исходного уровня до недели 96 в исследованиях НА WK и HARRIER
В обоих исследованиях применение бролуцизумаба приводило к клинически значимому улучшению относительно исходного уровня заранее определённой вторичной конечной точки эффективности, а именно исходов, оцениваемых самими пациентами по опроснику Национального института глаза для оценки зрительной функции (NEI VFQ-25). По величине эти изменения были примерно такими же, что и в ранее опубликованных исследованиях: МКОЗ увеличивалась на 15 букв. Улучшения, отмеченные пациентами, сохранялись и в течение второго года.
Клинически значимых различий между группами бролуцизумаба и афлиберцепта ни в изменениях общего показателя по шкале NEI VFQ-25, ни в изменениях показателей по отдельным подшкалам (зрение в целом, боль в глазу, зрение вблизь, зрение вдаль, социальное функционирование, психическое здоровье, ролевые трудности, зависимость, вождение автомобиля, цветное зрение и периферическое зрение) к 48 неделе относительно исходного уровня выявлено не было.
Фармакокинетика
Бролуцизумаб вводят непосредственно в стекловидное тело с тем, чтобы он оказывал местное воздействие в тканях глаза.
Всасывание/распределение
После интравитреального введения бролуцизумаба в дозе 6 мг в глаз пациентам с нВМД среднее значение Cmax свободного бролуцизумаба в плазме крови составляло 49,0 нг/мл (диапазон: 8,97–548 нг/мл); при этом Cmax достигалась через 1 день.
Биотрансформация/элиминация
Бролуцизумаб — это фрагмент моноклонального антитела, поэтому исследований метаболизма лекарственного препарата не проводили. Свободный бролуцизумаб представляет собой одноцепочечный фрагмент антитела и ожидается, что его выведение будет происходить за счёт мишень-опосредованного распределения через связывание со свободным эндогенным VEGF, пассивного выведения через почки и метаболизма, опосредованного протеолизом.
После интравитреальных инъекций бролуцизумаб выводился из крови с кажущимся периодом полувыведения, составлявшим 4,3 дня. Приблизительно через 4 недели после введения, системные концентрации у большинства пациентов находились на нижней границе предела количественного определения или ниже (<0,5 нг/мл). При применении бролуцизумаба в виде интравитреальных инъекций каждые 4 недели не наблюдалось накопления препарата в сыворотке крови.
Особые группы пациентов
Пожилые пациенты (65 лет или старше)
В клинических исследованиях HAWK и HARRIER приблизительно 90 % (978/1088) пациентов, рандомизированных в группу бролуцизумаба, находились в возрасте ≥65 лет, а приблизительно 60% (648/1088) — в возрасте ≥75 лет. Статистически значимых различий в эффективности и безопасности между подгруппами пациентов разного возраста в этих исследованиях не наблюдалось.
Раса / этническая принадлежность
В исследовании, в котором участвовали 24 пациента европеоидной расы и 26 пациентов-японцев, никаких различий в системной фармакокинетике после интравитреальной инъекции, связанных с этнической принадлежностью, выявлено не было.
Нарушения функции почек
Нарушения функции почек различной степени тяжести (от лёгких до тяжёлых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его системная концентрация определяется не столько скоростью его выведения, сколько скоростью его поступления в кровь из тканей глаза, а также в связи с низкой системной экспозицией свободного бролуцизумаба.
Системный клиренс бролуцизумаба оценивали у пациентов с нВМД, для которых имелись данные по фармакокинетическим параметрам бролуцизумаба в плазме крови и данные по клиренсу креатинина (КК). У пациентов с нарушением функции почек лёгкой степени (КК = 50–79 мл/мин (n = 13)) средние значения системного клиренса бролуцизумаба отличались не более чем на 15 % от соответствующих значений у лиц с нормальной функцией почек (КК ≥80 мл/мин (n = 25)). У пациентов с нарушением функции почек средней степени (КК = 30–49 мл/мин (n = 3)) средние значения системного клиренса бролуцизумаба были ниже, чем у пациентов с нормальной функцией почек, однако число таких пациентов было недостаточным для формирования заключения. Пациенты с нарушением функции почек тяжёлой степени (КК <30 мл/мин) в исследованиях не участвовали.
Нарушения функции печени
У пациентов с нарушениями функции печени применение бролуцизумаба не изучалось.
Нарушения функции печени различной степени тяжести (от лёгких до тяжёлых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его метаболизм происходит за счёт протеолиза и не зависит от функции печени.
Показания
Неоваскулярная (влажная) возрастная макулярная дегенерация.
Противопоказания
- Гиперчувствительность к брулуцизумабу;
- глазные или периокулярные инфекции;
- активное внутриглазное воспаление.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.Адекватных и строго контролируемых клинических исследований безопасности применения бролуцизумаба при беременности не проведено.
Исследования репродуктивной токсичности на животных являются недостаточными. Хотя системное воздействие после введения препарата в глаз очень незначительное, бролуцизумаб не следует применять во время беременности, если потенциальная польза не превышает потенциальный риск для плода.
Женщины с сохранённым репродуктивным потенциалом
Женщин с сохранённым репродуктивным потенциалом следует предупреждать о необходимости применять эффективные методы контрацепции (методы, обеспечивающие частоту беременности менее 1 %) во время лечения препаратом и в течение по крайней мере одного месяца после последней инъекции при прекращении лечения бролуцизумабом.
Применение в период грудного вскармливания
Неизвестно проникает ли бролуцизумаб в грудное молоко человека. Риск для ребёнка на грудном вскармливании исключить нельзя. Не рекомендуется применять бролуцизумаб во время кормления грудью. Не следует начинать кормление грудью в течение, по крайней мере, одного месяца после последней дозы при прекращении лечения бролуцизумабом. Решение о прекращении грудного вскармливания или воздержании от терапии бролуцизумабом следует принимать с учётом пользы грудного вскармливания для ребёнка и пользы терапии для женщины.
Фертильность
Исследования влияния на репродуктивную функцию и фертильность не проводились. Было показано, что подавление активности VEGF влияет на развитие фолликулов, функцию жёлтого тела и фертильность. Исходя из механизма действия ингибиторов VEGF, препарат может неблагоприятно влиять на репродуктивную функцию у женщин, а также на ранний и поздний эмбриогенез.
Способ применения и дозы
Интравитреально.
Побочные действия
Выборку для оценки безопасности в двух исследованиях III фазы HAWK и HARRIER составили 1088 пациентов, которые получали бролуцизумаб в общей сложности 96 недель; 730 пациентов получали препарат в рекомендованной дозе 6 мг.
К числу наиболее частых нежелательных лекарственных реакций, которые отмечались у >5 %, получавших бролуцизумаб в дозе 6 мг, относились снижение остроты зрения (7,3 %), катаракта (7,0 %), конъюнктивальное кровоизлияние (6,3 %) и плавающие помутнения стекловидного тела (5,1 %).
К числу менее частых нежелательных лекарственных реакций, которые отмечались у <1 % пациентов, получавших бролуцизумаб в дозе 6 мг, относились эндофтальмит, слепота, окклюзия артерии сетчатки и отслойка сетчатки.
Сводная таблица нежелательных лекарственных реакций, отмечавшихся в клинических исследованиях и полученные путём спонтанных сообщений и обзора литературы
Нежелательные реакции, отмечавшиеся в клинических исследованиях и полученные путём спонтанных сообщений и обзора литературы (табл. 3), представлены по системно-органным классам словаря MedDRA. Внутри каждого системно-органного класса нежелательные лекарственные реакции приведены в порядке уменьшения их частоты. Внутри каждой категории частоты нежелательные лекарственные реакции представлены в порядке уменьшения степени их серьёзности. Кроме того, для каждой нежелательной лекарственной реакции приведена соответствующая ей категория частоты в соответствии со следующими обозначениями (CIOMS III): очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1 000, < 1/100); редко (≥1/10 000, <1/1 000); очень редко (<1/10 000); неизвестно (невозможно установить частоту по имеющимся данным).
Таблица 3. Частота нежелательных лекарственных реакций в клинических исследованиях и полученных путём спонтанных сообщений и обзора литературы
| Нежелательные реакции | Бролуцизумаб (N = 730) | Афлиберцепт (N = 729) | Категория частоты |
Нарушения со стороны органа зрения | |||
| Снижение остроты зрения | 7,3 | 7,5 | Часто |
| Кровоизлияние в сетчатку | 4,1 | 3,2 | Часто |
| Увеит | 1,6 | 0,1 | Часто |
| Ирит | 1,2 | 0,3 | Часто |
| Отслойка стекловидного тела | 4,0 | 3,3 | Часто |
| Разрыв сетчатки | 1,2 | 0,7 | Часто |
| Катаракта | 7,0 | 11,1 | Часто |
| Конъюнктивальное кровоизлияние | 6,3 | 7,0 | Часто |
| Плавающие помутнения стекловидного тела | 5,1 | 2,9 | Часто |
| Боль в глазу | 4,9 | 6,2 | Часто |
| Повышение внутриглазного давления | 3,8 | 4,5 | Часто |
| Конъюнктивит | 3,3 | 1,6 | Часто |
| Разрыв пигментного эпителия сетчатки | 2,7 | 1,1 | Часто |
| Затуманивание зрения | 1,9 | 1,6 | Часто |
| Эрозия роговицы | 1,5 | 2,2 | Часто |
| Точечный кератит | 1,4 | 2,3 | Часто |
| Эндофтальмит | 0,7 | 0,1 | Нечасто |
| Слепота | 0,8 | 0,3 | Нечасто |
| Окклюзия артерии сетчатки | 0,8 | 0,1 | Нечасто |
| Отслойка сетчатки | 0,7 | 0,4 | Нечасто |
| Конъюнктивальная инъекция | 1,0 | 1,1 | Нечасто |
| Слезотечение | 1,0 | 1,1 | Нечасто |
| Атипичные ощущения в глазу | 0,8 | 1,8 | Нечасто |
| Отслойка пигментного эпителия сетчатки | 0,5 | 0,4 | Нечасто |
| Витрит | 0,4 | 0,4 | Нечасто |
| Воспалительная реакция во влаге передней камеры | 0,4 | 0 | Нечасто |
| Иридоциклит | 0,4 | 0,1 | Нечасто |
| Опалесценция влаги передней камеры | 0,3 | 0 | Нечасто |
| Отёк роговицы | 0,3 | 0 | Нечасто |
| Кровоизлияние в стекловидное тело | 0,1 | 0,4 | Нечасто |
| Окклюзия сосудов сетчатки | — | — | Неизвестно |
| Васкулит сетчатки | — | — | Неизвестно |
Нарушения со стороны иммунной системы | |||
| Гиперчувствительностьа) | 1,8 | 1,4 | Часто |
а Включая крапивницу, кожную сыпь, кожный зуд, эритему | |||
Иммуногенность
Как и любой терапевтический белок, бролуцизумаб может вызывать у пациентов иммунный ответ. Иммуногенность бролуцизумаба оценивали, изучая образцы плазмы крови. Данные по иммуногенности отражают процент пациентов, в образцах сыворотки которых иммуноанализ выявил антитела к бролуцизумабу. Обнаружение антител (иммунного ответа) в значительной степени зависит от чувствительности и специфичности используемого метода анализа, обращения с образцом, времени сбора образца, сопутствующих лекарственных препаратов и имеющегося у пациента заболевания. По названным причинам сравнение частот образования антител к бролуцизумабу и к другим терапевтическим белкам может привести к неверным выводам.
Антитела к ряду терапевтических белков, получаемых биотехнологическими методами, в том числе к одноцепочечным антителам, обнаруживались у лиц, ни разу не получавших такие белки, то есть ещё до начала лечения. Частота обнаружения антител к бролуцизумабу до начала лечения составляла 35–52 %. После применения препарата в течение 88 недель антитела к бролуцизумабу, возникшие на фоне лечения, обнаруживались у 23–25 % пациентов.
Антитела к бролуцизумабу не влияли на клиническую эффективность препарата. У пациентов, у которых на фоне лечения образовались антитела, наблюдалась повышенная частота внутриглазного воспаления. В настоящее время неясно, каким образом антитела к бролуцизумабу влияют на безопасность клинического применения препарата.
Передозировка
В случае передозировки, то есть введения препарата в объёме выше рекомендованного, может повышаться внутриглазное давление. В связи с этим, при передозировке следует контролировать внутриглазное давление и начинать надлежащее лечение, если лечащий врач сочтёт это необходимым.
Взаимодействие
Специальные исследования лекарственных взаимодействий не проводились.
Меры предосторожности
Прослеживаемость
Следует чётко обозначать наименование и серию вводимого препарата с целью обеспечения прослеживаемости биологических препаратов.
Эндофтальмит, внутриглазное воспаление, травматическая катаракта, отслойка сетчатки, васкулит сетчатки и/или окклюзия сосудов сетчатки
На фоне проведения интравитреальных инъекций, в том числе бролуцизумаба, отмечались случаи эндофтальмита, внутриглазного воспаления, травматической катаракты и отслойки сетчатки (см. раздел «Побочныее действия»). Инъекции препарата всегда следует проводить с соблюдением правил асептики.
При терапии бролуцизумабом были отмечены случаи васкулита сетчатки и/или окклюзии сосудов сетчатки, сопровождающиеся, как правило, внутриглазным воспалением (см. разделы «Противопоказания» и «Побочные действия»). При возникновении таких явлений лечение препаратом следует прекратить и незамедлительно обеспечить пациенту соответствующее лечение и наблюдение.
Пациентов следует предупреждать о необходимости незамедлительно сообщать врачу о любых симптомах, указывающих на явления, упомянутые выше.
Повышение внутриглазного давления
Как и в случае интравитреального введения других ингибиторов VEGF, в течение 30 минут после инъекции бролуцизумаба отмечалось преходящее повышение внутриглазного давления (см. раздел «Побочны действия»). Особую осторожность следует соблюдать у пациентов с неконтролируемой глаукомой (не следует вводить бролуцизумаб, если внутриглазное давление ≥30 мм рт. ст.). Следует контролировать внутриглазное давление и перфузию диска зрительного нерва и при необходимости проводить надлежащее лечение.
Двустороннее применение
Эффективность и безопасность инъекций бролуцизумаба одновременно в оба глаза не изучали.
Иммуногенность
Как и любой терапевтический белок, бролуцизумаб может вызывать у пациентов иммунный ответ (см. раздел «Побочные действия»). Врачу следует предупредить пациента о необходимости незамедлительно сообщать о появлении таких симптомов как боль в области глаза или дискомфорт, усиление красноты глаза, затуманивание или снижение зрения, увеличение количества плавающих частиц или повышенную чувствительность к свету (см. раздел «Побочные действия»).
Одновременное применение с другими анти-VEGF препаратами
Нет данных об одновременном применении бролуцизумаба с другими ингибиторами VEGF в одном глазу. Бролуцизумаб не следует применять одновременно с другими ингибиторами VEGF (системными и внутриглазными).
Приостановление применения:
Очередную инъекцию ингибитора VEGF следует отменить и не производить до следующей запланированной инъекции в следующих случаях:
- снижение МКОЗ на ≥30 букв по сравнению с последним определением;
- разрыв сетчатки;
- субретинальные кровоизлияния, затрагивающие центральную часть фовеа или если площадь кровоизлияния составляет ≥50 % площади поражения;
- в течение 28 дней до или после внутриглазного хирургического вмешательства.
Разрыв пигментного эпителия сетчатки
Пациенты с выявленной обширной и/или высокой отслойкой пигментного эпителия сетчатки входят в группу риска развития разрыва пигментного эпителия сетчатки при применении анти- VEGF препаратов у пациентов с нВМД.
Регматогенная отслойка сетчатки или макулярное отверстие
У пациентов с регматогенной отслойкой сетчатки или макулярным отверстием 3, 4 стадии лечение препаратом следует прекратить.
Системное действие препарата при интравитреалъном введении
При интравитреальном введении ингибиторов VEGF возможно развитие системных побочных эффектов, включая кровотечения внеглазной локализации и артериальные тромбоэмболии.
Существует вероятная теоретическая связь этих явлений с ингибированием VEGF.
Данные по безопасности применения препарата у пациентов с ВМД с инсультом, транзиторной ишемической атакой или инфарктом миокарда в анамнезе за последние 3 месяца ограничены.
У таких пациентов препарат следует применять с осторожностью.
Влияние на способность к вождению автотранспорта и управлению механизмами
После интравитреальной инъекции бролуцизумаба и связанного с ней исследования глаза у пациентов могут возникать временные нарушения зрения, в связи с чем им рекомендуется воздерживаться от управления транспортным средством и работы с механизмами до тех пор, пока зрительная функция не восстановится в достаточной степени.
Классификация
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Бролуцизумаб:
