ГИРНУО
Hyrnuo®Торговое наименование
ГИРНУО
Международное непатентованное наименование
Лекарственная форма
таблетки для перорального применения
Код АТХ
Листок-вкладыш: информация для пациента
ГИРНУО® (севабертиниб) таблетки для перорального применения
КРАТКОЕ ОПИСАНИЕ ИНФОРМАЦИИ ПО ПРИМЕНЕНИЮ
Данный краткий обзор не содержит всей информации, необходимой для безопасного и эффективного применения ГИРНУО. Смотрите полную информацию по применению ГИРНУО.
ГИРНУО® (севабертиниб) таблетки для перорального применения
Первоначальное одобрение в США: 2025
ПОКАЗАНИЯ И ПРИМЕНЕНИЕ
ГИРНУО — это ингибитор киназы, показанный для лечения взрослых пациентов с местнораспространённым или метастатическим немелкоклеточным раком лёгкого (НМКРЛ) немелкоклеточного типа, чьи опухоли имеют активирующие мутации в тирозинкиназном домене (ТКД) HER2 (ERBB2), выявленные одобренным FDA тестом, и которые получили предшествующую системную терапию. (1)
Это показание одобрено в соответствии с ускоренной процедурой одобрения на основании объективного показателя ответа (ОПО) и длительности ответа (ДО). Продолжение одобрения этого показания может зависеть от подтверждения и описания клинической пользы в подтверждающем исследовании.
ДОЗИРОВАНИЕ И СПОСОБ ПРИМЕНЕНИЯ
- Отбор пациентов: Выбирайте пациентов для лечения ГИРНУО на основе наличия активирующих мутаций HER2 (ERBB2) ТКД. (2.1)
- Рекомендуемая доза: 20 мг перорально два раза в день с пищей до прогрессирования заболевания или неприемлемой токсичности. Проглатывайте таблетки целиком. (2.2)
ЛЕКАРСТВЕННЫЕ ФОРМЫ И ДОЗИРОВКИ
Таблетки: 10 мг севабертиниба. (3)
ПРОТИВОПОКАЗАНИЯ
Нет. (4)
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
- Диарея: При первых признаках диареи или увеличения частоты дефекации рекомендуйте пациентам начать лечение противодиарейным средством и увеличить потребление жидкости и электролитов. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести. (5.1)
- Гепатотоксичность: Контролируйте функции печени, включая АЛТ, АСТ и общий билирубин в исходном состоянии перед введением ГИРНУО, каждые 2 недели в течение первого месяца, затем ежемесячно в дальнейшем по показаниям с более частым тестированием у пациентов, у которых развивается повышение трансаминаз. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести. (5.2)
- Интерстициальная болезнь лёгких (ИБЛ)/пневмонит: Контролируйте пациентов на предмет новых или ухудшающихся симптомов, указывающих на ИБЛ/пневмонит (например, одышка, кашель, лихорадка). Прекращайте ГИРНУО при подтверждении ИБЛ/пневмонита. (5.3)
- Офтальмологическая токсичность: Немедленно направляйте пациентов с новыми или ухудшающимися симптомами органов зрения к офтальмологу. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести. (5.4)
- Повышение уровня ферментов поджелудочной железы: Регулярно контролируйте уровни амилазы и липазы во время лечения. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести. (5.5)
- Эмбрио-фетальная токсичность: Может вызвать вред плоду. Информируйте пациентов о потенциальном риске для плода и необходимости использования эффективной контрацепции. (5.6, 8.1, 8.3)
НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
- Наиболее частые нежелательные реакции (>20%): диарея, сыпь, паронихия, стоматит и тошнота.
- Наиболее частые аномалии лабораторных показателей степени 3 или 4 (≥2%): снижение калия, повышение липазы, снижение лимфоцитов, снижение натрия, повышение амилазы, повышение АЛТ и повышение АСТ. (6.1)
Для сообщения о ПОДОЗРЕВАЕМЫХ НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ обратитесь в компанию Bayer HealthCare Pharmaceuticals Inc. по телефону 1-888-842-2937 или в FDA по телефону 1-800-FDA-1088 или www.fda.gov/medwatch.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
- Сильные ингибиторы CYP3A: Избегайте одновременного применения сильных ингибиторов CYP3A. Если одновременное применение неизбежно, снизьте дозу ГИРНУО. (2.4, 7.1).
- Умеренные ингибиторы CYP3A: Контролируйте пациентов на предмет усиления нежелательных реакций, связанных с ГИРНУО (2.3, 7.1)
- Сильные и умеренные индукторы CYP3A: Избегайте одновременного применения сильных или умеренных индукторов CYP3A. (7.1)
- Определённые субстраты CYP3A: Избегайте одновременного применения субстратов CYP3A, при которых минимальное увеличение концентрации может привести к серьёзным нежелательным реакциям, если в информации по применению субстрата CYP3A не рекомендуется иное. (7.2)
- Определённые субстраты P-гликопротеина: Ознакомьтесь с информацией по применению субстратов P-гликопротеина, при которых минимальное увеличение концентрации может привести к серьёзным нежелательным реакциям (7.2)
ПРИМЕНЕНИЕ В ОСОБЫХ ПОПУЛЯЦИЯХ
- Кормление грудью: Рекомендуйте не кормить грудью. (8.2)
Смотрите раздел 17 для получения ИНФОРМАЦИИ ПО КОНСУЛЬТИРОВАНИЮ ПАЦИЕНТОВ и одобренной FDA информации для пациентов.
Пересмотрено: [11/2025]
ПОЛНАЯ ИНФОРМАЦИЯ ПО ПРИМЕНЕНИЮ: ОГЛАВЛЕНИЕ
| Раздел | Подраздел |
| 1 | ПОКАЗАНИЯ И ПРИМЕНЕНИЕ |
| 2 | ДОЗИРОВАНИЕ И СПОСОБ ПРИМЕНЕНИЯ |
| 2.1 | Отбор пациентов |
| 2.2 | Рекомендуемое дозирование |
| 2.3 | Модификация дозирования при нежелательных реакциях |
| 2.4 | Модификация дозирования при сильных ингибиторах CYP3A |
| 3 | ЛЕКАРСТВЕННЫЕ ФОРМЫ И ДОЗИРОВКИ |
| 4 | ПРОТИВОПОКАЗАНИЯ |
| 5 | ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ |
| 5.1 | Диарея |
| 5.2 | Гепатотоксичность |
| 5.3 | Интерстициальная болезнь лёгких/Пневмонит |
| 5.4 | Офтальмологическая токсичность |
| 5.5 | Повышение уровня ферментов поджелудочной железы |
| 5.6 | Эмбрио-фетальная токсичность |
| 6 | НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ |
| 6.1 | Клиническое испытание |
| 7 | ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ |
| 7.1 | Эффект других лекарств на ГИРНУО |
| 7.2 | Эффекты ГИРНУО на другие лекарства |
| 8 | ПРИМЕНЕНИЕ В ОСОБЫХ ПОПУЛЯЦИЯХ |
| 8.1 | Беременность |
| 8.2 | Кормление грудью |
| 8.3 | Женщины и мужчины репродуктивного возраста |
| 8.4 | Применение у детей |
| 8.5 | Применение у пожилых пациентов |
| 11 | ОПИСАНИЕ |
| 12 | КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ |
| 12.1 | Механизм действия |
| 12.2 | Фармакодинамика |
| 12.3 | Фармакокинетика |
| 13 | ДОКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ |
| 13.1 | Канцерогенность, мутагенность, нарушение фертильности |
| 14 | КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ |
| 14.1 | НМКРЛ местнораспространённый или метастатический с активирующими мутациями HER2 ТКД |
| 16 | КАК ПОСТАВЛЯЕТСЯ/ХРАНЕНИЕ И ОБРАБОТКА |
| 17 | ИНФОРМАЦИЯ ПО КОНСУЛЬТИРОВАНИЮ ПАЦИЕНТОВ |
*Разделы или подразделы, пропущенные в полной информации по применению, здесь не указаны.
Полная информация по применению
1 Показания и применение
ГИРНУО показан для лечения взрослых пациентов с местнораспространённым или метастатическим немелкоклеточным раком лёгкого немелкоклеточного типа (НМКРЛ), чьи опухоли имеют активирующие мутации HER2 (ERBB2) в тирозинкиназном домене (ТКД), выявленные одобренным FDA тестом [смотрите Дозирование и способ применения (2.1)], и которые получили предшествующую системную терапию.
Это показание одобрено в соответствии с ускоренной процедурой одобрения на основании объективного показателя ответа (ОПО) и длительности ответа (ДО) [смотрите Клинические исследования (14)]. Продолжение одобрения этого показания может зависеть от подтверждения и описания клинической пользы в подтверждающем исследовании.
2 Дозирование и способ применения
2.1. Отбор пациентов
Выбирайте пациентов для лечения местнораспространённого или метастатического НМКРЛ немелкоклеточного типа на основе наличия активирующих мутаций HER2 (ERBB2) ТКД в образцах опухоли [смотрите Клинические исследования (14)].
Информация об одобренных FDA тестах доступна на http://www.fda.gov/CompanionDiagnostics.
2.2. Рекомендуемое дозирование
Рекомендуемая доза ГИРНУО составляет 20 мг перорально два раза в день с пищей до прогрессирования заболевания или неприемлемой токсичности [смотрите Клиническая фармакология (12.3)]. Проглатывайте таблетки целиком. Не разрезайте, не измельчайте и не пережёвывайте таблетки.
Пропущенная доза
Если доза пропущена, примите пропущенную дозу как только вспомните перед следующей запланированной дозой. Не принимайте 2 дозы одновременно, чтобы компенсировать пропущенную дозу.
Вывернутая доза
Если доза вывернута, не принимайте дополнительную дозу. Возобновите приём в следующее запланированное время.
2.3. Модификация дозирования при нежелательных реакциях
Рекомендуемые снижения дозы при нежелательных реакциях приведены в Таблице 1.
Таблица 1: Рекомендуемые снижения дозы ГИРНУО при нежелательных реакциях
| Модификация дозирования | Снижение дозы |
| Первое | 10 мг два раза в день |
| Второе | 10 мг один раз в день |
Окончательно прекращайте применение ГИРНУО у пациентов, которые не переносят 10 мг один раз в день.
Рекомендуемые модификации дозирования при нежелательных реакциях приведены в Таблице 2.
Таблица 2: Рекомендуемые модификации дозирования ГИРНУО при нежелательных реакциях
| Нежелательная реакция | Тяжесть | Модификация дозирования |
| Диарея [смотрите Предупреждения и меры предосторожности (5.1)] | Непереносимая степень 2 или степень 3 | • Прерывайте ГИРНУО до восстановления степени ≤1. • Возобновите ГИРНУО в той же дозе или следующей более низкой дозе. • При повторении возобновите ГИРНУО в следующей более низкой дозе. |
|
| Степень 4 | • Окончательно прекращайте ГИРНУО. |
| Гепатотоксичность [смотрите Предупреждения и меры предосторожности (5.2)] | Степень 2, 3 или 4 АЛТ и/или АСТ без повышения общего билирубина или степень 3 общий билирубин | • Прерывайте ГИРНУО до восстановления ≤ степень 1 или исходного уровня. • Возобновите ГИРНУО в следующей более низкой дозе. |
|
| АЛТ или АСТ ≥ 3 × ВПН с общим билирубином ≥ 2 × ВПН или степень 4 общий билирубин | • Окончательно прекращайте ГИРНУО. |
| Интерстициальная болезнь лёгких (ИБЛ)/пневмонит [смотрите Предупреждения и меры предосторожности (5.3)] | Любая степень | • Окончательно прекращайте ГИРНУО. |
| Офтальмологическая токсичность [смотрите Предупреждения и меры предосторожности (5.4)] | Степень 2 | • Прерывайте ГИРНУО до восстановления степени ≤1. • Возобновите ГИРНУО в следующей более низкой дозе. • При повторении окончательно прекращайте ГИРНУО. |
|
| Степень 3 или степень 4 | • Окончательно прекращайте ГИРНУО. |
| Повышение уровня ферментов поджелудочной железы [смотрите Предупреждения и меры предосторожности (5.5)] | Степень 3 | • Прерывайте ГИРНУО до восстановления степени ≤ 2 или исходного уровня. • Возобновите ГИРНУО в следующей более низкой дозе. |
|
| Степень 4 | • Окончательно прекращайте ГИРНУО. |
| Другие нежелательные реакции [смотрите Нежелательные реакции (6.1)] | Непереносимая или повторяющаяся степень 2 или степень 3 | • Прерывайте ГИРНУО до восстановления степени ≤1. • Возобновите ГИРНУО в той же дозе или следующей более низкой дозе. • При повторении возобновите ГИРНУО в следующей более низкой дозе. |
|
| Степень 4 | • Окончательно прекращайте ГИРНУО. |
a Степени основаны на Общей терминологии критериев для побочных эффектов Национального онкологического института (NCI CTCAE) версия 5.0.
2.4. Модификация дозирования при сильных ингибиторах CYP3A
Избегайте одновременного применения сильных ингибиторов CYP3A. Если одновременное применение неизбежно, снизьте дозу ГИРНУО как показано в Таблице 3. После прекращения приёма ингибитора CYP3A в течение 3-5 периодов полувыведения возобновите дозу ГИРНУО, которая использовалась перед инициированием ингибитора [смотрите Лекарственные взаимодействия (7.1)].
Таблица 3: Рекомендуемые модификации дозирования ГИРНУО при одновременном применении сильных ингибиторов CYP3A
| Текущая доза | Рекомендуемая доза |
| 20 мг два раза в день | 10 мг два раза в день |
| 10 мг два раза в день | 10 мг один раз в день |
| 10 мг один раз в день | Прерывайте ГИРНУО до прекращения приёма сильного ингибитора CYP3A |
3 Лекарственные формы и дозировки
Таблетки: красно-коричневые плёночные таблетки с оболочкой, круглые, двояковыпуклые, с тиснением "SE" с одной стороны и "10" с другой стороны, содержащие 10 мг севабертиниба.
4 Противопоказания
Нет.
5 Предупреждения и меры предосторожности
5.1. Диарея
ГИРНУО может вызвать тяжёлую диарею, которая может привести к обезвоживанию и дисбалансу электролитов. В объединённой популяции безопасности [смотрите Нежелательные реакции (6.1)] диарея была отмечена у 86% пациентов, получавших ГИРНУО, включая степень 3 у 15%. Средний время первого появления диареи любой степени составило четыре дня. Прерывание дозирования произошло у 15% пациентов, и снижение дозы произошло у 12% пациентов.
При первых признаках диареи или увеличения частоты дефекации рекомендуйте пациентам начать противодиарейное лечение (например, лоперамид [ознакомьтесь с полной информацией по применению]), и увеличить потребление жидкости и электролитов. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести [смотрите Дозирование и способ применения (2.3)].
5.2. Гепатотоксичность
ГИРНУО может вызвать тяжёлую гепатотоксичность, характеризующуюся повышением показателей функции печени. В объединённой популяции безопасности [смотрите Нежелательные реакции (6.1)] на основании данных нежелательных реакций гепатотоксичность была отмечена у 24% пациентов, лечившихся ГИРНУО, включая 3% степень 3. На основании лабораторных данных 35% пациентов, лечившихся ГИРНУО, испытали повышение аланинаминотрансферазы (АЛТ), включая 2,3% степень 3. Повышение аспартатаминотрансферазы (АСТ) произошло у 35% пациентов, лечившихся ГИРНУО, включая 2,3% степень 3. Повышение билирубина произошло у 12% пациентов, лечившихся ГИРНУО. Среднее время первого появления повышения АСТ или АЛТ составило 1,4 (диапазон 0,2-14,5) месяца. ГИРНУО был прерван для нежелательной реакции гепатотоксичности у 4,1% пациентов, доза была снижена у 4,1% и окончательно прекращена у 0,4%.
Контролируйте функции печени, включая АЛТ, АСТ и общий билирубин в исходном состоянии перед первым введением ГИРНУО, каждые 2 недели в течение первого месяца, затем ежемесячно в дальнейшем по показаниям с более частым тестированием у пациентов, у которых развивается повышение трансаминаз. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести нежелательной реакции [смотрите Дозирование и способ применения (2.3)].
5.3. Интерстициальная болезнь лёгких/Пневмонит
ГИРНУО может вызвать тяжёлую интерстициальную болезнь лёгких (ИБЛ)/пневмонит. В объединённой популяции безопасности [смотрите Нежелательные реакции (6.1)] ИБЛ/пневмонит произошёл у двух пациентов (0,7%) лечившихся ГИРНУО, включая 0,4% степень 3. Один пациент потребовал прерывания ГИРНУО.
Контролируйте пациентов на предмет новых или ухудшающихся симптомов, указывающих на ИБЛ/пневмонит (например, одышка, кашель, лихорадка). Прекращайте ГИРНУО при подтверждении ИБЛ/пневмонита [смотрите Дозирование и способ применения (2.3)].
5.4. Офтальмологическая токсичность
ГИРНУО может вызвать офтальмологическую токсичность. В объединённой популяции безопасности [смотрите Нежелательные реакции (6.1)] офтальмологическая токсичность произошла у 14% пациентов, лечившихся ГИРНУО, включая 11% степень 1, 2,6% степень 2 и 0,4% степень 3 (один случай микрокист эпителия роговицы с временной односторонней слепотой).
Незамедлительно направляйте пациентов с новыми или ухудшающимися симптомами органов зрения к офтальмологу. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести [смотрите Дозирование и способ применения (2.3)].
5.5. Повышение уровня ферментов поджелудочной железы
ГИРНУО может вызвать повышение уровней амилазы и липазы. В объединённой популяции безопасности [смотрите Нежелательные реакции (6.1)] на основании лабораторных данных повышение амилазы произошло у 32% пациентов, лечившихся ГИРНУО, включая 3,2% степень 3 или 4. Повышение липазы произошло у 40% пациентов, лечившихся ГИРНУО, включая 10% степень 3 или 4. Два пациента (0,7%) потребовали прерывания ГИРНУО из-за повышенной липазы и 3 (1,1%) потребовали прерывания ГИРНУО из-за повышенной амилазы. Среднее время начала повышения амилазы/липазы составило 1,4 месяца (диапазон 0,2-17 месяцев).
Регулярно контролируйте уровни амилазы и липазы во время лечения ГИРНУО. Прерывайте, снижайте дозу или окончательно прекращайте применение ГИРНУО в зависимости от тяжести [смотрите Дозирование и способ применения (2.3)].
5.6. Эмбрио-фетальная токсичность
На основе результатов исследований на животных и его механизма действия ГИРНУО может вызвать вред плоду при введении беременной женщине. В исследованиях эмбрио-фетального развития пероральное введение севабертиниба беременным крысам в период органогенеза привело к изменениям роста при материнском воздействии ≥0,18 раз человеческому воздействию на основе площади под кривой (AUC) при клинической дозе 20 мг два раза в день. Исследования на животных с нарушенным или истощённым HER2/EGFR и анализы in vitro продемонстрировали, что ингибирование HER2 и/или EGFR приводит к структурным аномалиям, изменению роста и эмбрио-фетальной и детской смертности.
Информируйте беременных женщин и женщин репродуктивного возраста о потенциальном риске для плода. Рекомендуйте женщинам репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы. Рекомендуйте мужчинам-пациентам с партнёршами репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы [смотрите Применение в особых популяциях (8.1, 8.3)].
6. Нежелательные реакции
Следующие клинически значимые нежелательные реакции обсуждаются более подробно в других разделах маркировки:
- Диарея [смотрите Предупреждения и меры предосторожности (5.1)]
- Гепатотоксичность [смотрите Предупреждения и меры предосторожности (5.2)]
- Интерстициальная болезнь лёгких (ИБЛ)/Пневмонит [смотрите Предупреждения и меры предосторожности (5.3)]
- Офтальмологическая токсичность [смотрите Предупреждения и меры предосторожности (5.4)]
- Повышение уровня ферментов поджелудочной железы [смотрите Предупреждения и меры предосторожности (5.5)]
6.1. Клиническое испытание
Поскольку клинические испытания проводятся в широко различающихся условиях, частота нежелательных реакций, наблюдаемая в клинических испытаниях лекарства, не может быть напрямую сравнена с частотой в клинических испытаниях другого лекарства и может не отражать частоту, наблюдаемую на практике.
Объединённая популяция безопасности в разделе ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ отражает воздействие ГИРНУО в дозе 20 мг перорально два раза в день у 268 пациентов с местнораспространённым или метастатическим НМКРЛ с мутациями HER2 и/или других мутаций из исследования SOHO-01 [смотрите Клинические исследования (14)]. Из 268 пациентов, получивших ГИРНУО, 35% подвергались воздействию более 6 месяцев и 12% более 1 года. В этой объединённой популяции безопасности наиболее частыми (>20%) нежелательными реакциями были диарея, сыпь, стоматит и паронихия. Наиболее частыми (≥2%) аномалиями лабораторных показателей степени 3 или 4 были снижение калия, повышение липазы, снижение количества лимфоцитов, снижение натрия, повышение амилазы, повышение АЛТ и повышение АСТ.
Безопасность ГИРНУО в дозе 20 мг перорально два раза в день оценивалась у 136 пациентов с местнораспространённым или метастатическим НМКРЛ с активирующими мутациями HER2, которые получили предшествующую системную терапию в исследовании SOHO-01 [смотрите Клинические исследования (14)]. Из 136 пациентов, получивших ГИРНУО, 46% подвергались воздействию более 6 месяцев и 15% более 1 года. Средний возраст пациентов, получивших ГИРНУО, составил 62 года (диапазон: 29-91); 63% женщины; 65% азиаты, 27% европейцы, 3,7% чёрные или афроамериканцы; и 2,2% были латинского или латиноамериканского происхождения.
Наиболее частыми нежелательными реакциями (>20%) у пациентов, получивших ГИРНУО, были диарея, сыпь, паронихия, стоматит и тошнота. Наиболее частыми аномалиями лабораторных показателей степени 3 или 4 (≥2%) были снижение калия, повышение липазы, снижение количества лимфоцитов, снижение натрия, повышение амилазы, повышение аспартатаминотрансферазы (АСТ) и повышение аланинаминотрансферазы (АЛТ).
Серьёзные нежелательные реакции произошли у 31% пациентов, получивших ГИРНУО. Серьёзные нежелательные реакции у ≥2% пациентов были диарея (6%), пневмония (3,7%), одышка (2,2%) и плевральный выпот (2,2%).
Окончательное прекращение ГИРНУО из-за нежелательной реакции произошло у 3,7% пациентов. Нежелательные реакции, которые привели к окончательному прекращению, были микрокисты эпителия роговицы, аномальная функция печени, удлинённый интервал QT на электрокардиограмме, боль в конечности и одышка (0,7%, 1 пациент каждая).
Прерывание дозирования ГИРНУО из-за нежелательной реакции произошло у 46% пациентов. Нежелательные реакции, которые привели к прерыванию дозирования >3% пациентов, были диарея, гипокалиемия, тошнота, снижение аппетита и пневмония.
Снижение дозы ГИРНУО из-за нежелательных реакций произошло у 28% пациентов. Нежелательные реакции, которые привели к снижению дозы >2% пациентов, были диарея, сыпь и гипокалиемия.
Таблица 4 суммирует нежелательные реакции в SOHO-01 (Группы D и E).
Таблица 4: Нежелательные реакции (≥10%) у пациентов с НМКРЛ с активирующими мутациями HER2, получивших ГИРНУО в SOHO-01 (Группы D и E)
| Нежелательная реакция | ГИРНУО N = 136 Все степени (%) | Степень 3 или 4 (%) |
| Нарушения со стороны желудочно-кишечного тракта | ||
| Диарея1 | 87 | 18 |
| Стоматит2 | 29 | 1,5 |
| Тошнота | 21 | 1,5 |
| Рвота | 15 | 2,2 |
| Абдоминальная боль3 | 10 | 0 |
| Нарушения со стороны кожи и подкожной ткани | ||
| Сыпь4 | 66 | 1,5 |
| Паронихия5 | 33 | 0 |
| Сухая кожа6 | 20 | 0 |
| Зуд | 14 | 1,5 |
| Нарушения обмена веществ и питания | ||
| Снижение аппетита | 18 | 2,9 |
| Исследования | ||
| Снижение веса | 19 | 0,7 |
| Общие нарушения и состояния введения препарата | ||
| Утомление7 | 13 | 0,7 |
| Нарушения со стороны органов зрения | ||
| Офтальмологическая токсичность8 | 16 | 0,7 |
| Нарушения со стороны дыхательной системы | ||
| Одышка9 | 10 | 1,5 |
* Оценено в соответствии с версией 5 NCI CTCAE.
** Все были степень 3, за исключением одышки (0,7%, степень 4).
1 Включает диарею, энтероколит.
2 Включает хейлит, изъязвления рта, воспаление слизистой оболочки, стоматит.
3 Включает боль в животе, боль в верхней части живота.
4 Включает дерматит акнеиформный, экзему, астеатотическую экзему, синдром ладонно-подошвенной эритродисестезии, сыпь, эритематозную сыпь, макулопапулёзную сыпь, зудящую сыпь, пустулёзную сыпь, отшелушивание кожи.
5 Включает врастающий ноготь, заболевание ногтей, ониходаскалия, онихолиз, онихомадезис, паронихия.
6 Включает сухую кожу, ксеродермию.
7 Включает астению, утомление.
8 Включает одностороннюю слепоту, катаракту, конъюнктивит, аллергический конъюнктивит, микрокисты эпителия роговицы, сухость глаза, выделения из глаза, боль в глазу, усиленную слёзотечение, гиперемию сосудов, повышенное внутриглазное давление, офтальмологическую токсичность, размытое зрение, снижение остроты зрения, нарушение зрения, ксерофтальмию.
9 Включает одышку, одышку при нагрузке.
Клинически значимые нежелательные реакции <10% пациентов, получивших ГИРНУО, включили отёк (8%), нарушение сердечного ритма (6%; включает аритмию, полную атриовентрикулярную блокаду, удлинённый интервал QT на электрокардиограмме, синусовую брадикардию, синусовую тахикардию, суправентрикулярные экстрасистолы, суправентрикулярную тахикардию, тахикардию) и алопецию (3,7%).
Таблица 5 суммирует аномалии лабораторных показателей, наблюдаемые в SOHO-01 (Группы D и E).
Таблица 5: Избранные аномалии лабораторных показателей (≥20%), ухудшившиеся от исходного уровня, у пациентов с НМКРЛ с активирующими мутациями HER2 в SOHO-01 (Группы D и E)
| Аномалия лабораторного показателя | ГИРНУО N=1361 Все степени (%) 2 | Степень 3 или 4 (%) |
| Гематология | ||
| Снижение гемоглобина | 47 | 1,5 |
| Снижение количества лимфоцитов | 32 | 6 |
| Снижение белых кровяных телец | 21 | 0,7 |
| Биохимия | ||
| Повышение липазы | 48 | 12 |
| Снижение калия | 45 | 13 |
| Повышение аспартатаминотрансферазы | 41 | 3 |
| Снижение магния | 40 | 0 |
| Повышение аланинаминотрансферазы | 37 | 3 |
| Повышение глюкозы3 | 36 | 0,7 |
| Снижение альбумина | 32 | 1,5 |
| Повышение амилазы | 31 | 3,8 |
| Снижение кальция | 28 | 1,5 |
| Повышение креатинина | 27 | 0 |
| Снижение натрия | 26 | 4,4 |
| Повышение щелочной фосфатазы | 24 | 0 |
| Повышение триглицеридов | 22 | 0 |
* Все были степень 3, за исключением снижения кальция (0,7%, степень 4) и повышения амилазы (1,5%; степень 4)
1 Знаменатель, используемый для расчёта частоты, варьировал от 103 до 135 на основе количества пациентов с исходным значением и по крайней мере одним значением после лечения.
2 Оценено в соответствии с версией 5 NCI CTCAE с использованием только числовых значений.
3 Оценено в соответствии с версией 4.03 NCI CTCAE с использованием только числовых значений.
Аномалии лабораторных показателей <20% пациентов, получивших ГИРНУО, включают повышение билирубина в крови (14%; все были степень 1 и 2).
7 Лекарственные взаимодействия
7.1. Эффект других лекарств на ГИРНУО
Таблица 6 описывает лекарственные взаимодействия, при которых одновременное применение другого лекарства влияет на ГИРНУО.
Таблица 6: Лекарственные взаимодействия, влияющие на ГИРНУО
Сильные и умеренные ингибиторы CYP3A
Предотвращение или управление:
- Сильные ингибиторы CYP3A:
- Избегайте одновременного применения ГИРНУО с сильными ингибиторами CYP3A.
- Если одновременное применение неизбежно, снизьте дозу ГИРНУО [смотрите Дозирование и способ применения (2.4)].
- Умеренные ингибиторы CYP3A:
- Контролируйте пациентов на предмет усиления нежелательных реакций, связанных с ГИРНУО [смотрите Дозирование и способ применения (2.3)].
Механизм и клинический эффект:
- Севабертиниб является субстратом CYP3A.
- Одновременное применение с сильным или умеренным ингибитором CYP3A может увеличить концентрацию севабертиниба в плазме [смотрите Клиническая фармакология (12.3)], что может увеличить риск нежелательных реакций, связанных с ГИРНУО.
Сильные и умеренные индукторы CYP3A
Предотвращение или управление:
- Избегайте одновременного применения ГИРНУО с сильными или умеренными индукторами CYP3A.
Механизм и клинический эффект:
- Севабертиниб является субстратом CYP3A.
- Одновременное применение с сильным или умеренным индуктором CYP3A может снизить концентрацию севабертиниба в плазме [смотрите Клиническая фармакология (12.3)], что может снизить эффективность ГИРНУО.
7.2. Эффекты ГИРНУО на другие лекарства
Таблица 7 описывает лекарственные взаимодействия, при которых одновременное применение ГИРНУО влияет на другое лекарство.
Таблица 7: Лекарственные взаимодействия ГИРНУО, влияющие на другие лекарства
Определённые субстраты CYP3A
Предотвращение или управление:
- Избегайте одновременного применения ГИРНУО с субстратами CYP3A, при которых минимальное увеличение концентрации может привести к серьёзным нежелательным реакциям, если в информации по применению субстрата CYP3A не рекомендуется иное.
Механизм и клинический эффект:
- Севабертиниб является слабым или умеренным ингибитором CYP3A.
- Севабертиниб увеличивает воздействие субстратов CYP3A [смотрите Клиническая фармакология (12.3)], что может увеличить риск нежелательных реакций, связанных с этими субстратами.
Определённые субстраты P-гликопротеина
Предотвращение или управление:
- Ознакомьтесь с информацией по применению субстратов P-гликопротеина, при которых минимальное увеличение концентрации может привести к серьёзным нежелательным реакциям.
Механизм и клинический эффект:
- Севабертиниб является ингибитором P-гликопротеина.
- Севабертиниб увеличивает воздействие субстратов P-гликопротеина [смотрите Клиническая фармакология (12.3)], что может увеличить риск нежелательных реакций, связанных с этими субстратами.
Субстраты CYP1A1
Предотвращение или управление:
- Ознакомьтесь с информацией по применению субстратов CYP1A1.
Механизм и клинический эффект:
- Севабертиниб является ингибитором CYP1A1 in vitro.
- Севабертиниб может увеличить воздействие субстратов CYP1A1 [смотрите Клиническая фармакология (12.3)], что может увеличить риск нежелательных реакций, связанных с этими субстратами.
8. Применение в особых популяциях
8.1. Беременность
Резюме риска
На основе результатов исследований на животных и его механизма действия [смотрите Клиническая фармакология (12.1)] ГИРНУО может вызвать вред плоду при введении беременной женщине. Нет доступных данных об использовании ГИРНУО у беременных женщин, чтобы информировать о риске, связанном с лекарством. В исследованиях эмбрио-фетального развития пероральное введение севабертиниба беременным крысам в период органогенеза привело к изменениям роста при материнском воздействии ≥0,18 раз человеческому воздействию на основе площади под кривой (AUC) при клинической дозе 20 мг два раза в день. Исследования на животных с нарушенным или истощённым HER2/EGFR и анализы in vitro продемонстрировали, что ингибирование HER2 и/или EGFR приводит к структурным аномалиям, изменению роста и эмбрио-фетальной и детской смертности (смотрите Данные). Информируйте беременных женщин о потенциальном риске для плода.
В общей популяции США предполагаемый фоновый риск основных врождённых дефектов и выкидышей в клинически признанных беременностях составляет 2-4% и 15-20% соответственно.
Данные
Данные животных
В исследованиях эмбрио-фетального развития севабертиниб вводили перорально беременным крысам в период органогенеза с 6-го по 17-й день беременности в дозах, варьирующихся от 1,5 до 11 мг/кг/день. Лечение севабертинибом привело к материнской токсичности (снижение массы тела и прироста массы тела) и снижению массы плода при ≥6 мг/кг/день (≥0,18 раз человеческому воздействию на основе AUC при клинической дозе).
Дополнительные доклинические данные
Оценка, основанная на литературе, эффектов на воспроизводство в модельных системах мышей с нарушенным или истощённым HER2/EGFR продемонстрировала, что HER2/EGFR критически важен в репродуктивных и развивающихся процессах, включая имплантацию бластоцисты, развитие плаценты и выживание и развитие эмбрионо-фетального/постнатального периода.
В анализе, основанном на индуцированных человеческих плюрипотентных стволовых клетках, севабертиниб снизил маркеры дифференцировки кардиомиоцитов и гепатоцитов.
8.2. Кормление грудью
Резюме риска
Нет данных о наличии севабертиниба или его метаболитов в грудном молоке человека или их воздействии на ребёнка, находящегося на грудном вскармливании, или на производство молока. На крысах севабертиниб или его метаболиты выделяются в молоко (смотрите Данные). Из-за потенциала серьёзных нежелательных реакций у детей, находящихся на грудном вскармливании, от ГИРНУО, рекомендуйте женщинам не кормить грудью во время лечения ГИРНУО и в течение 1 недели после последней дозы.
Данные
Данные животных
После введения радиомеченного севабертиниба лактирующим крысам севабертиниб или его метаболиты выделялись в молоко. Концентрации радиоактивности севабертиниба в молоке были в 13-26 раз выше, чем в плазме. Приблизительно 1,3% введённой дозы радиоактивности севабертиниба выделялось в молоко.
8.3. Женщины и мужчины репродуктивного возраста
ГИРНУО может вызвать вред плоду при введении беременной женщине [смотрите Применение в особых популяциях (8.1)].
Тестирование на беременность
Проверьте статус беременности у женщин репродуктивного возраста перед инициированием ГИРНУО.
Контрацепция
Женщины
Рекомендуйте женщинам репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы.
Мужчины
Рекомендуйте мужчинам с партнёршами репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы.
8.4. Применение у детей
Безопасность и эффективность ГИРНУО не установлены у детей.
8.5. Применение у пожилых пациентов
Из 268 пациентов с местнораспространённым или метастатическим НМКРЛ с активирующими мутациями HER2, получивших ГИРНУО в дозе 20 мг два раза в день в исследовании SOHO-01, 43% были в возрасте 65 лет и старше и 13% были в возрасте 75 лет и старше. Никаких общих различий в эффективности между этими пожилыми и более молодыми пациентами не наблюдалось. Диарея степени 3 была отмечена у 23% пациентов в возрасте ≥75 лет и у 14% пациентов <75 лет.
11 Описание
Таблетки ГИРНУО содержат севабертиниб, ингибитор киназы. Химическое название действующего вещества: 3-(3-хлоро-2-метоксианилино)-2-{3-[(2S)-1,4-диоксан-2-илметокси]пиридин-4-ил}-1,5,6,7-тетрагидро-4H-пиррол[3,2-c]пиридин-4-он гидрат. Молекулярная формула: C24H25ClN4O5 (безводный) и молекулярный вес: 484,93 г/моль (безводный).
Структурная формула показана ниже:
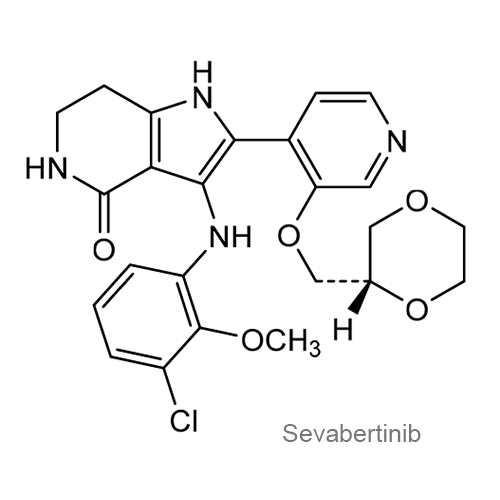
Севабертиниб присутствует в виде нестехиометрического гидрата в виде белого или почти белого до жёлтого или розоватого порошка. Он слегка растворим в водных растворах при pH 2 и практически нерастворим в водных растворах при pH 4,5 и выше.
Сила ГИРНУО основана на форме безводного вещества. Каждая таблетка ГИРНУО для перорального применения содержит 10 мг севабертиниба. Неактивные ингредиенты: микрокристаллическая целлюлоза, кросповидон, лактоза монозидрат и стеарат магния. Плёночная оболочка таблетки содержит оксид железа красный, гипромеллозу 5 сП и макрогол 3350.
12 Клиническая фармакология
12.1. Механизм действия
Севабертиниб является обратимым ингибитором киназы рецептора эпидермального фактора роста человека 2 (HER2). Он также проявляет активность против рецептора эпидермального фактора роста (EGFR).
In vitro севабертиниб ингибировал фосфорилирование HER2 и нижестоящую сигнализацию в раковых клетках с изменениями HER2 и пролиферацию раковых клеток, сверхэкспрессирующих дикий тип HER2 или имеющих мутации HER2.
In vivo севабертиниб продемонстрировал противоопухолевую активность в подкожных ксенотрансплантатных моделях мышей, полученных из опухолей НМКРЛ человека с активирующей мутацией экзона 20 HER2.
12.2. Фармакодинамика
Соотношение воздействие-ответ
Более высокое воздействие севабертиниба в диапазоне доз от 10 до 80 мг общей суточной дозы (0,25 до 2 раз рекомендуемой дозировки) было связано с повышенной частотой диареи (все степени и степень ≥3) и сыпи.
Сердечная электрофизиология
При 2-кратной максимальной рекомендуемой дозе среднее увеличение интервала QTc >20 мс не наблюдалось.
12.3. Фармакокинетика
Фармакокинетика севабертиниба наблюдалась в состоянии равновесия у пациентов с запущенным НМКРЛ с активирующими мутациями HER2 или EGFR при одобренной рекомендуемой дозировке и представлена как среднее (CV%), если не указано иное.
Максимальная концентрация севабертиниба (Cmax) составляет 902 (45%) нг/мл, а общее системное воздействие (AUC) составляет 6640 (50%) нг × ч/мл. Cmax и AUC севабертиниба увеличиваются пропорционально дозе в диапазоне от 10 мг до 80 мг (0,25 до 2 раз одобренной рекомендуемой суточной дозы). Накопление севабертиниба составляет приблизительно 1,7-кратное для AUC и 1,3-кратное для Cmax при одобренной рекомендуемой дозировке. Состояние равновесия достигается в течение 3 дней.
Абсорбция
Среднее время севабертиниба до максимальных концентраций (Tmax) составляет приблизительно 2 часа (0,5, 8,2 часа) после одной дозы.
Эффект пищи
Cmax севабертиниба снижается на 56%, а AUC снижается на 28% с высокожирной пищей (1000 калорий, 50% жира) у здоровых субъектов. Никаких клинически значимых различий в фармакокинетике севабертиниба не наблюдалось после введения низкожирной пищи (400 калорий, 25% жира).
Распределение
Кажущийся объём распределения севабертиниба составляет 28 л (42%). Связывание севабертиниба с белками плазмы составляет 95%. Соотношение концентраций в крови к плазме составляет 0,6.
Выведение
Эффективный период полувыведения севабертиниба составляет приблизительно 8 часов (33%) с кажущимся клиренсом 3,1 л/час (38%).
Метаболизм
Севабертиниб в основном метаболизируется CYP3A (основное), CYP1A1 (незначительное) и конъюгацией с глюкуроновой кислотой (незначительное).
Выделение
После одной пероральной дозы радиомеченого севабертиниба 40 мг здоровым субъектам приблизительно 84% дозы было восстановлено в кале (14% без изменений) и приблизительно 10% в моче (1,3% без изменений).
Особые популяции
Никаких клинически значимых эффектов на фармакокинетику севабертиниба не наблюдалось на основе возраста (18-91 год), расы (27% европеец, 65% азиат, 2,7% чёрный/афроамериканец), пола, массы тела (29-155 кг), статуса курения, eGFR 30 to <90 мл/мин, или лёгкого нарушения функции печени (АСТ >ВПН и общий билирубин ≤ ВПН; или общий билирубин >1 to 1,5 кратно ВПН и любой АСТ). Влияние тяжёлого нарушения функции почек (eGFR 15 to <30 мл/мин), терминальной стадии почечной недостаточности (eGFR <15 мл/мин), умеренного нарушения функции печени (общий билирубин >1,5 to 3 кратно ВПН и любой АСТ) или тяжёлого нарушения функции печени (общий билирубин >3 кратно ВПН и любой АСТ) на фармакокинетику севабертиниба неизвестно.
Исследования лекарственного взаимодействия
Клинические исследования
Сильные ингибиторы CYP3A: AUC севабертиниба увеличился в 2,3 раза, а Cmax в 1,6 раза после одновременного применения итраконазола (сильный ингибитор CYP3A) в дозе 200 мг один раз в день.
Сильные индукторы CYP3A: AUC севабертиниба снизился на 79%, а Cmax на 57% после одновременного применения карбамазепина (сильный индуктор CYP3A) в дозе 600 мг один раз в день.
Субстраты CYP3A: AUC мидазолама (субстрат CYP3A) увеличился в 2 раза, а Cmax в 1,8 раза после одновременного применения ГИРНУО 20 мг два раза в день.
Субстраты P-гликопротеина: AUC дабигатрана этексилата (субстрат P-гликопротеина) увеличился в 1,4 раза после одновременного применения ГИРНУО 20 мг два раза в день.
Субстраты BCRP: AUC розувастатина (субстрат BCRP) увеличился в 1,3 раза, а Cmax в 1,4 раза после одновременного применения ГИРНУО 20 мг два раза в день.
Другие лекарства: Никаких клинически значимых различий в фармакокинетике севабертиниба не наблюдалось при одновременном применении с эзомепразолом (ингибитор протонной помпы).
Исследования in vitro
Ферменты CYP450: Севабертиниб ингибирует CYP1A1 и CYP2C8, но не ингибирует CYP2A6, CYP2C9, CYP1A2, CYP2B6, CYP2D6, CYP2C19 или CYP2E1. Севабертиниб не индуцирует CYP1A2, CYP2B6 или CYP2C19.
Системы переносчиков: Севабертиниб является субстратом P-гликопротеина и BCRP. Севабертиниб ингибирует MATE1 и MATE2-K, но не ингибирует OATP1B1, OATP1B3, MRP2, OAT1, OAT3, OCT1 или OCT2.
13 Доклиническая токсикология
13.1. Канцерогенность, мутагенность, нарушение фертильности
Канцерогенность
Исследования канцерогенности с севабертинибом не проводились.
Мутагенность
Севабертиниб не был генотоксичен в бактериальном тесте обратной мутации (Ames), анализе микронуклеусов in vitro или анализе микронуклеусов in vivo на крысах.
Нарушение фертильности
Исследования фертильности с севабертинибом не проводились.
14 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
14.1. НМКРЛ местнораспространённый или метастатический с активирующими мутациями HER2 ТКД
Эффективность ГИРНУО оценивалась в SOHO-01 (NCT05099172), открытом, одногруппном, многоцентровом, многокогортном клиническом исследовании. Подходящие пациенты (группы D и E) должны были иметь ранее пролеченный местнораспространённый или метастатический НМКРЛ с активирующими мутациями HER2 (ERBB2) и Восточную кооперативную онкологическую группу статуса производительности (ECOG PS) 0 или 1. Активирующие мутации HER2 (ERBB2) определялись в ткани опухоли или плазме местными лабораториями перед включением в исследование. Пациенты с пролеченными, стабильными и бессимптомными метастазами в головной мозг были приемлемы. Пациенты с симптоматическими метастазами ЦНС, клинически значимым сердечным заболеванием и историей стероидозависимой интерстициальной болезни лёгких (ИБЛ)/пневмонита были исключены.
Пациенты получали ГИРНУО 20 мг перорально два раза в день до прогрессирования заболевания или неприемлемой токсичности. Основными результатами эффективности были подтверждённый объективный показатель ответа (ОПО) и длительность ответа (ДО), оценённые слепым независимым центральным пересмотром (BICR) с использованием RECIST v1.1.
Популяция эффективности включала 70 пациентов из группы D и 52 пациента из группы E с запущенным немелкоклеточным НМКРЛ с активирующими мутациями HER2 (ERBB2) тирозинкиназного домена (ТКД) на основе перспективного локального тестирования. Из 122 пациентов в этих объединённых когортах образцы ткани опухоли из 67,2% (82/122) пациентов были ретроспективно протестированы с использованием теста Oncomine™ Dx Target Test (Life Technologies Corporation). Хотя 92,7% (76/82) образцов были положительны для активирующих мутаций HER2 (ERBB2) ТКД, 7,3% (6/82) были неоценены, и не было образцов с отрицательным статусом для активирующих мутаций HER2 (ERBB2) ТКД.
НМКРЛ ранее пролеченный, наивный к терапии, нацеленной на HER2: Группа D
Эффективность оценивалась у 70 пациентов с местнораспространённым или метастатическим немелкоклеточным НМКРЛ с активирующими мутациями HER2 (ERBB2) ТКД, которые получили предшествующую системную терапию, но были наивны к терапии, нацеленной на мутации HER2. Исходные демографические и клинические характеристики популяции эффективности были: средний возраст 59 лет (диапазон 29-77 лет); 67% женщины; 70% азиаты, 23% европейцы, 1,4% чёрные или афроамериканцы, 6% раса не указана; 2,9% были латинского или латиноамериканского происхождения. Пациенты имели ECOG статус производительности либо 0 (39%), либо 1 (61%); 69% никогда не курили, 29% были бывшими курильщиками и 2,9% были текущими курильщиками. Все пациенты имели аденокарциному гистологию. Девяносто один процент (91%) пациентов имели стадию IV заболевания и 20% имели стабильные метастазы в головной мозг. Средняя численность предшествующих терапий составила 1 (диапазон 1-8); 94% пациентов получили предшествующую химиотерапию на основе платины, 71% получили предшествующую иммунотерапию, и 69% получили оба в комбинации. Среди пациентов 70% пациентов имели Y772_A775dup (YVMA) вставку экзона 20.
Результаты эффективности для SOHO-01 группы D представлены в таблице 8.
Таблица 8: Результаты эффективности для SOHO-01: Группа Da
| Параметр эффективности | ГИРНУО N=70 |
| Объективный показатель ответа (ОПО)a (95% CI) | 71% (59, 82) |
| Полный ответ | 2,9% |
| Частичный ответ | 69% |
| Длительность ответа (ДО)c | |
| N=50 | |
| Средний показатель, месяцы (95% CI)b | 9,2 (6,3, 15,0) |
| ДО ≥ 6 месяцевc | 54% |
| ДО ≥ 12 месяцевc | 18% |
CI — Доверительный интервал
a 95% CI ОПО рассчитан с использованием метода Clopper-Pearson.
b Оценка Kaplan-Meier.
c Наблюдаемая доля пациентов с ответом с длительностью ответа за пределы контрольной точки.
НМКРЛ ранее пролеченный, включая предшествующие конъюгаты антител и лекарств, нацеленные на HER2 (ADC): Группа E
Эффективность оценивалась у 52 пациентов с местнораспространённым или метастатическим немелкоклеточным НМКРЛ с активирующими мутациями HER2 (ERBB2) ТКД, которые получили предшествующую системную терапию, включая нацеленные на HER2 конъюгаты антител и лекарств.
Исходные демографические и клинические характеристики этой популяции эффективности были: средний возраст 65 лет (диапазон 35-91 год); 67% женщины; 62% азиаты, 27% европейцы, 6% чёрные или афроамериканцы, 6% раса не указана; 1,9% были латинского или латиноамериканского происхождения. Пациенты имели ECOG статус производительности либо 0 (29%), либо 1 (71%); 65% никогда не курили, и 35% были бывшими курильщиками. Все пациенты имели аденокарциному гистологию. Восемьдесят пять процентов (85%) пациентов имели стадию IV заболевания и 29% имели стабильные метастазы в головной мозг. Средняя численность предшествующих терапий составила 2 (диапазон 1-8), 77% пациентов получили предшествующую химиотерапию на основе платины, 56% получили предшествующую иммунотерапию, и 56% получили оба в комбинации. Среди пациентов 77% пациентов имели Y772_A775dup (YVMA) вставку экзона 20.
ОПО составил 38% (95% CI 25, 53), с 6% пациентов, имеющих полный ответ, и 33% пациентов, имеющих частичный ответ. Средняя ДО составила 7 месяцев (95% CI 5,6, NE); варьируя от 1+ до 17,2+ месяцев на основе наблюдаемой ДО. Наблюдаемая доля пациентов с ответом с ДО ≥6 месяцев и ≥12 месяцев составила 60% и 10% соответственно.
16 Как поставляется/хранение и обработка
Как поставляется
Таблетки ГИРНУО 10 мг поставляются в виде красно-коричневых плёночных таблеток с оболочкой, круглых, двояковыпуклых, с тиснением "SE" с одной стороны и "10" с другой стороны.
Таблетки ГИРНУО упакованы в бутылку HDPE из 120 таблеток, закрытую крышкой, устойчивой к открыванию детьми.
Хранение и обработка
Хранить при температуре 20°C до 25°C (68°F до 77°F); допускаются отклонения между 15°C до 30°C (59°F до 86°F) [смотрите контролируемую комнатную температуру USP].
17 Информация по консультированию пациентов
Рекомендуйте пациенту прочитать одобренную FDA информацию для пациентов (Информация для пациентов).
Диарея
Информируйте пациентов о том, что ГИРНУО может вызвать тяжёлую диарею. При первых признаках диареи или увеличении частоты дефекации рекомендуйте пациентам начать противодиарейное лечение (например, лоперамид), увеличить потребление жидкости и электролитов и немедленно связаться с лечащим врачом [смотрите Предупреждения и меры предосторожности (5.1)].
Гепатотоксичность
Информируйте пациентов о том, что ГИРНУО может вызвать тяжёлую гепатотоксичность, характеризующуюся повышением показателей функции печени. Информируйте пациентов, что им потребуется пройти лабораторные тесты для мониторинга функции печени. Рекомендуйте пациентам немедленно связаться с лечащим врачом при наличии признаков и симптомов гепатотоксичности [смотрите Предупреждения и меры предосторожности (5.2)].
Интерстициальная болезнь лёгких (ИБЛ)/Пневмонит
Информируйте пациентов о том, что ГИРНУО может вызвать тяжёлую ИБЛ/пневмонит. Рекомендуйте пациентам немедленно связаться с лечащим врачом при возникновении новых или ухудшающихся респираторных симптомов [смотрите Предупреждения и меры предосторожности (5.3)].
Офтальмологическая токсичность
Информируйте пациентов о том, что ГИРНУО может вызвать офтальмологическую токсичность. Рекомендуйте пациентам немедленно связаться с лечащим врачом при возникновении новых или ухудшающихся симптомов, связанных с органами зрения [смотрите Предупреждения и меры предосторожности (5.4)].
Повышение уровня ферментов поджелудочной железы
Информируйте пациентов о том, что ГИРНУО может вызвать повышение уровня ферментов поджелудочной железы. Информируйте пациентов, что им потребуется пройти лабораторные тесты для мониторинга функции поджелудочной железы. Рекомендуйте пациентам немедленно связаться с лечащим врачом при наличии признаков и симптомов, связанных с повышением уровня ферментов поджелудочной железы [смотрите Предупреждения и меры предосторожности (5.5)].
Эмбрио-фетальная токсичность
Информируйте беременных женщин и женщин репродуктивного возраста о потенциальном риске для плода. Рекомендуйте женщинам информировать лечащего врача об известной или предполагаемой беременности [смотрите Предупреждения и меры предосторожности (5.6) и Применение в особых популяциях (8.1, 8.3)].
Рекомендуйте женщинам репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы [смотрите Применение в особых популяциях (8.3)].
Рекомендуйте мужчинам-пациентам с партнёршами репродуктивного возраста использовать эффективную контрацепцию во время лечения ГИРНУО и в течение 1 недели после последней дозы [смотрите Применение в особых популяциях (8.3)].
Кормление грудью
Рекомендуйте женщинам не кормить грудью во время лечения ГИРНУО и в течение 1 недели после последней дозы [смотрите Применение в особых популяциях (8.2)].
Дозирование и способ применения
- Рекомендуйте пациентам принимать ГИРНУО два раза в день с пищей. Каждую таблетку следует проглотить целиком [смотрите Дозирование и способ применения (2.2)].
- Рекомендуйте пациентам, что если доза ГИРНУО пропущена, то следует принять пропущенную дозу как можно скорее, вспомнив об этом перед следующей запланированной дозой. Рекомендуйте пациентам не принимать две дозы одновременно, чтобы компенсировать пропущенную дозу [смотрите Дозирование и способ применения (2.2)].
- Рекомендуйте пациентам, что если доза ГИРНУО вывернута, не принимайте дополнительную дозу, но принимайте следующую дозу в следующее запланированное время [смотрите Дозирование и способ применения (2.2)].
Лекарственные взаимодействия
Рекомендуйте пациентам и опекунам информировать лечащего врача о всех одновременно принимаемых лекарствах, включая рецептурные лекарства, отпускаемые без рецепта препараты, витамины и травяные продукты. Информируйте пациентов избегать зверобоя, грейпфрута или сока грейпфрута во время приёма ГИРНУО [смотрите Лекарственные взаимодействия (7.1, 7.2)].
Производитель:
Bayer HealthCare Pharmaceuticals Inc.
Whippany, NJ 07981
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
ГИРНУО® (Гир-НУ-о)
[севабертиниб]
таблетки для перорального применения
Что такое ГИРНУО?
ГИРНУО — это рецептурное лекарство, которое используется для лечения взрослых с определённым типом рака лёгкого под названием немелкоклеточный рак лёгкого (НМКРЛ), который:
- распространился в пределах грудной клетки или на другие части тела, и
- имеет определённый аномальный ген рецептора эпидермального фактора роста человека 2 (HER2), и
- получили предшествующее лечение (системную терапию).
Лечащий врач проведёт тест, чтобы убедиться, что ГИРНУО вам подходит.
Неизвестно, является ли ГИРНУО безопасным и эффективным у детей.
Перед приёмом ГИРНУО расскажите своему лечащему врачу об всех ваших медицинских состояниях, включая, если у вас есть:
- проблемы с печенью.
- проблемы с лёгкими или дыхательные проблемы, помимо рака лёгкого.
- вы беременны или планируете забеременеть. ГИРНУО может нанести вред вашему нерождённому ребёнку.
Женщины, которые могут забеременеть:
- Ваш лечащий врач проведёт тест на беременность перед началом лечения ГИРНУО.
- Используйте эффективную контрацепцию (противозачаточные средства) во время лечения и в течение 1 недели после последней дозы ГИРНУО.
- Поговорите с лечащим врачом о методах контрацепции, которые могут быть для вас подходящими.
- Расскажите своему лечащему врачу немедленно, если вы забеременели или думаете, что вы можете быть беременны во время лечения ГИРНУО.
Мужчины с партнёршами женского пола, которые могут забеременеть:
- Используйте эффективную контрацепцию во время лечения и в течение 1 недели после последней дозы ГИРНУО.
- Поговорите с лечащим врачом о методах контрацепции, которые могут быть подходящими для вас и вашей партнёрши.
- вы кормите грудью или планируете кормить грудью. Неизвестно, проходит ли ГИРНУО в грудное молоко. Не кормите грудью во время лечения и в течение 1 недели после последней дозы ГИРНУО.
Расскажите своему лечащему врачу обо всех лекарствах, которые вы принимаете, включая рецептурные и безрецептурные лекарства, витамины и травяные добавки. ГИРНУО может влиять на то, как работают другие лекарства, и другие лекарства могут влиять на то, как работает ГИРНУО.
Знайте лекарства, которые вы принимаете. Ведите список с собой, чтобы показать своему лечащему врачу и фармацевту, когда вы получаете новое лекарство.
Как мне следует принимать ГИРНУО?
- Принимайте ГИРНУО ровно так, как вам скажет ваш лечащий врач.
- Не изменяйте дозу и не прекращайте приём ГИРНУО, если ваш лечащий врач вам не скажет.
- Принимайте ГИРНУО 2 раза в день с пищей.
- Проглатывайте таблетки ГИРНУО целиком со стаканом воды.
- Не разрезайте, не измельчайте и не пережёвывайте таблетки ГИРНУО.
- Если вы пропустили дозу ГИРНУО, примите предписанную дозу как можно скорее, вспомнив об этом перед следующей запланированной дозой. Не принимайте 2 дозы одновременно, чтобы компенсировать пропущенную дозу.
- Если вы вывернулись после приёма дозы ГИРНУО, не восполняйте дозу. Примите следующую дозу в обычное запланированное время.
Что мне следует избегать во время приёма ГИРНУО?
- Избегайте употребления грейпфрута или питья сока грейпфрута во время лечения ГИРНУО. Грейпфрут может увеличить количество ГИРНУО в крови.
Какие возможные побочные эффекты ГИРНУО?
ГИРНУО может вызвать серьёзные побочные эффекты, включая:
- диарея. Диарея является распространённой и может быть тяжёлой во время лечения ГИРНУО и обычно возникает в первую неделю лечения. Диарея может вызвать потерю жидкости в организме (обезвоживание) и электролитов (дисбаланс электролитов). При первых признаках диареи (жидкий стул) или увеличения частоты дефекации немедленно расскажите своему лечащему врачу, пейте много жидкости и начните лечение диареи как можно скорее. Перед началом приёма ГИРНУО у вас должно быть противодиарейное лекарство.
- проблемы с печенью. ГИРНУО может вызвать увеличение анализов функции печени, которое может быть тяжёлым. Ваш лечащий врач проведёт анализы крови для проверки функции печени перед началом приёма и во время лечения ГИРНУО. Расскажите своему лечащему врачу немедленно, если у вас развивались какие-либо признаки и симптомы проблем с печенью, включая:
- желтизну кожи или белков глаз (желтуху)
- тошноту или рвоту
- потерю аппетита
- тёмную мочу
- боль в правом верхнем углу живота
- бледные испражнения
- усталость или слабость
- проблемы с лёгкими. ГИРНУО может вызвать тяжёлые проблемы с лёгкими. Расскажите своему лечащему врачу немедленно, если у вас возникли новые или ухудшающиеся симптомы проблем с лёгкими во время лечения ГИРНУО, включая:
- кашель
- лихорадка
- одышка или затруднение дыхания
- проблемы с глазами. ГИРНУО может вызвать проблемы с глазами, которые могут привести к временной потере зрения. Ваш лечащий врач может направить вас к специалисту по зрению (офтальмологу), если у вас возникли новые или ухудшающиеся проблемы с глазами во время лечения ГИРНУО.
- проблемы с поджелудочной железой. ГИРНУО может вызвать увеличение определённых анализов поджелудочной железы (амилаза и липаза). Ваш лечащий врач проведёт анализы крови для проверки функции поджелудочной железы перед началом и во время лечения ГИРНУО. Расскажите своему лечащему врачу немедленно, если у вас возникли какие-либо признаки и симптомы проблем с поджелудочной железой, включая:
- боль в верхней части живота, которая может распространяться на спину и ухудшаться при еде
- потерю веса
- тошноту или рвоту
Ваш лечащий врач может изменить вашу дозу, временно остановить или полностью остановить ваше лечение ГИРНУО, если у вас есть определённые побочные эффекты.
Наиболее частые побочные эффекты ГИРНУО включают:
- сыпь
- изменения в определённых анализах крови
- проблемы с ногтями, включая инфекцию и воспаление
- язвы во рту
- тошноту
Это не все возможные побочные эффекты ГИРНУО.
Позвоните своему врачу за медицинским советом о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по номеру 1-800-FDA-1088.
Как мне следует хранить ГИРНУО?
- Храните ГИРНУО при комнатной температуре между 68°F до 77°F (20°C до 25°C).
- ГИРНУО поставляется в контейнере, устойчивом к открыванию детьми.
Держите ГИРНУО и все лекарства в недоступном для детей месте.
Общая информация о безопасном и эффективном применении ГИРНУО.
Лекарства иногда назначаются для целей, которые не указаны в листке-вкладыше информации для пациентов. Не используйте ГИРНУО по показаниям, для которого он не был назначен. Не давайте ГИРНУО другим людям, даже если у них есть такие же симптомы, которые у вас есть. Это может им навредить. Вы можете попросить информацию о ГИРНУО, которая написана для специалистов в области здравоохранения, у вашего лечащего врача или фармацевта.
Какие ингредиенты в ГИРНУО?
Активный ингредиент: севабертиниб
Неактивные ингредиенты: микрокристаллическая целлюлоза, кросповидон, лактоза монозидрат и стеарат магния.
Плёночная оболочка таблетки: оксид железа красный, гипромеллоза 5 сП и макрогол 3350.
Производитель: Bayer HealthCare Pharmaceuticals Inc., Whippany, NJ 07981 USA
Для получения дополнительной информации позвоните в Bayer HealthCare Pharmaceuticals Inc. по номеру 1-888-842-2937 или перейдите на www.HYRNUO-us.com
Эта информация для пациентов одобрена Управлением по контролю над продуктами и лекарствами США.
▼ Лекарственный препарат в настоящий момент не зарегистрирован в Российской Федерации. |
Форма выпуска
Таблетки для перорального применения.
Условия отпуска из аптек
Отпускают по рецепту
