Натрия тетраборат
ФормулаNa2B4O7
- Молярная масса: 201.2193 г/моль
- PubChem: 10219853
- CAS: 1303-96-4
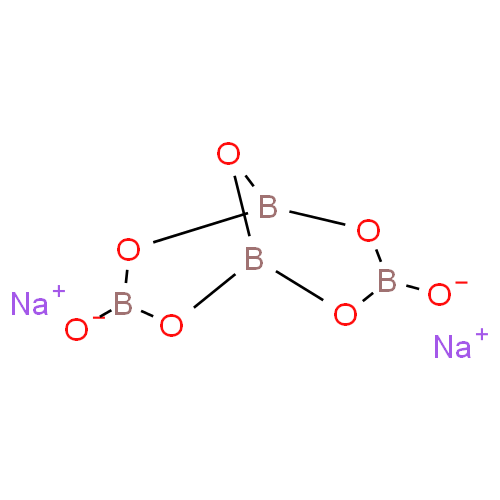 Структурная формула
Структурная формула
Характеристики и физические свойства
Натрия тетраборат, известный также как бура или боракс (от лат. borax), является неорганическим соединением и натриевой солью борной кислоты. Наиболее распространённое соединение бора, образующее ряд кристаллогидратов.
Молекулярная формула (форма без водных молекул):
Na₂B₄O₇
Молекулярная масса (безводная форма): 201,22 г/моль
Распространённые кристаллогидраты:
- Натрия тетраборат декагидрат: Na₂B₄O₇ · 10H₂O (молярная масса: 381,38 г/моль)
- Натрия тетраборат пентагидрат: Na₂B₄O₇ · 5H₂O
- Натрия тетраборат октагидрат: Na₂[B₄O₅(OH)₄] · 8H₂O
Структурные особенности:
Основная структурная единица соединения представлена тетраборатным анионом [B₄O₅(OH)₄]²⁻, содержащим четыре атома бора, скоординированные с семью атомами кислорода. Анион формирует сложную бициклическую структуру с уникальной геометрией. В этой структуре содержатся два четырёхкоординационных (тетраэдрических) атома бора и два трёхкоординационных (тригональных) атома бора. Два тетраэдрических атома бора связаны общим атомом кислорода, каждый из которых несёт отрицательный заряд благодаря дополнительным гидроксильным группам. Характерной особенностью структуры являются борксольные кольца — распространенные структурные мотивы в полиборатных ионах, образующие три кольца: два сочленённых искажённых шестиугольных кольца и одно искажённое восьмиугольное кольцо из чередующихся атомов бора и кислорода.
Физические свойства
Внешний вид и физическое состояние:
Бесцветные прозрачные, легко выветривающиеся кристаллы или белый кристаллический порошок. Растворим в воде (1:25 в холодной и 2:1 в кипящей воде), глицерине, нерастворим в спирте. Водные растворы имеют солоновато-щелочной вкус и щелочную реакцию.
Плотность:
- Безводная форма: ρ = 2,37 ± 0,01 г/см³ (при 25°C)
- Декагидрат: ρ = 1,73 г/см³ (при 20°C)
Температурные характеристики:
- Температура плавления: 741°C (для безводной формы)
- Температура разложения: 60°C для декагидрата при нагревании; гидратированная форма теряет кристаллизационную воду и переходит в стеклообразное состояние при повышенных температурах
- Точка кипения: 1575°C (с разложением)
Кислотно-щелочные свойства:
Водные растворы натрия тетрабората являются щелочными вследствие гидролиза: Na₂B₄O₇ + 7H₂O → 2NaOH + 4H₃BO₃. Величина pH растворов составляет 9,0–10,5 в зависимости от концентрации. Для раствора концентрацией 10 г/л pH достигает значения 9,2.
Оптические свойства:
Показатель преломления светлого кристаллического вещества составляет 1,501.
История открытия и историческое значение
Древние периоды:
Натрия тетраборат известен человечеству с глубокой древности. Наиболее ранние свидетельства использования боратов датируются примерно 875 годом до нашей эры, когда арабские врачи применяли борные соединения (бораты) в качестве внутренних лекарственных средств. В древнем Египте, примерно 4000 лет назад, борат натрия использовался при мумификации, а также в очищении и консервировании мумий благодаря его выраженным антисептическим и гидрофильным свойствам. На Ближнем Востоке около 3000 года до нашей эры вещество нашло применение в металлургии для рафинирования драгоценных металлов (золота и серебра), а также в производстве керамики и стекла в качестве флюса для понижения температуры плавления песка.
Средневековая эпоха:
Обширные сведения о боратах содержатся в трудах средневековых арабских и персидских алхимиков периода с 800 по 1200 годы нашей эры. Персидский учёный Джабир ибн Хайян, один из известнейших алхимиков того времени, подробно описал свойства бурата. Соединение широко использовалось как флюс при металлообработке и для медицинских целей. В этот период борат стал товаром высокой стоимости в торговле, особенно в Европе, где его доступность была крайне ограничена.
В XIII веке нашей эры венецианский купец Марко Поло возвращался из Востока с образцами белых кристаллов буры, что ознаменовало введение этого вещества в европейскую торговлю и практику.
Начало научного описания:
В 1702 году нидерландский врач В. Гомберг (W. Homberg) впервые получил борную кислоту (H₃BO₃, известную как «гомберговская успокаивающая соль») путём нагревания буры с серной кислотой, создав тем самым первый химический синтез производного боратного соединения.
Значимый прогресс в химическом понимании состава буры произошёл в 1747 году, когда французский химик Т. Барон определил, что боракс содержит гомберговскую соль (борную кислоту) и соду, правильно идентифицировав тетраборат натрия как натриевую соль борной кислоты.
Окончательное выделение элементарного бора:
Центральным событием в истории химии бора стало независимое выделение элементарного бора в 1808 году. Французские химики Жозеф Луи Гей-Люссак и Луи Жак Тенар в Париже, а также сэр Хемфри Дэви в Лондоне параллельно выполнили восстановление элементарного бора из буры путём нагревания с металлическим калием. 21 июня 1808 года Гей-Люссак и Тенар объявили о своёмоткрытии элементарного бора, что существенно расширило химическое понимание боратных соединений.
Боракс стал широко распространён в повседневной жизни в конце XIX века после того, как компания «Pacific Coast Borax Company» Фрэнсиса Марион Смита начала активно продвигать и популяризировать разнообразные применения вещества под торговой маркой «20 Mule Team Borax», названной по методу первоначальной доставки натрия тетрабората из калифорнийских и невадских пустынь на мулах. Это событие навсегда изменило глобальное восприятие и использование буры как в домашних хозяйствах, так и в промышленности.
Заключение
Натрия тетраборат представляет собой историческое и чрезвычайно важное неорганическое соединение, прошедшее многовековой путь от древних эмпирических методов использования в медицине и металлургии до современного статуса ключевого компонента в стекловидной и керамической промышленности, аналитической химии и многочисленных прикладных приложениях. Уникальная структура с характерным тетраборатным анионом и выраженные физико-химические свойства обеспечивают надёжную основу для разнообразных промышленных и исследовательских приложений.
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Натрия тетраборат:
Информация о действующем веществе Натрия тетраборат предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях.
