Континия®
Continia®Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
раствор для внутриглазного введения
Фармакотерапевтическая группа
Код АТХ
Листок-вкладыш — информация для пациента
▼ Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к специалистам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях. Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Континия®, 40 мг/мл, раствор для внутриглазного введения
Действующее вещество: афлиберцепт
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нём содержатся важные для Вас сведения.
Сохраните листок-вкладыш. Возможно, Вам понадобится прочитать его ещё раз.
Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу.
Если у Вас возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе не перечисленные в разделе 4 данного листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Континия®, и для чего его применяют.
- О чём следует знать перед применением препарата Континия®.
- Применение препарата Континия®.
- Возможные нежелательные реакции.
- Хранение препарата Континия®.
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат Континия®, и для чего его применяют.
Препарат Континия® содержит действующее вещество афлиберцепт. Афлиберцепт относится к группе лекарственных средств, которые применяются в офтальмологии при заболеваниях сетчатки глаза и препятствуют новообразованию сосудов (неоваскуляризации).
Показания к применению
Препарат Континия® показан к применению у взрослых с 18 лет:
- для лечения неоваскулярной («влажной») формы возрастной макулярной дегенерации («влажной» формы ВМД);
- для лечения ухудшения зрения, вызванного макулярным отёком вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или её ветвей (ОВЦВС));
- для лечения ухудшения зрения, вызванного диабетическим макулярным отёком (ДМО);
- для лечения ухудшения зрения, вызванного миопической хориоидальной неоваскуляризацией (миопической ХНВ).
«Влажная» форма ВМД и миопическая ХНВ могут возникать в результате роста аномальных кровеносных сосудов в глазу. Образовавшиеся аномальные кровеносные сосуды могут способствовать проникновению компонентов крови в глаз и, как следствие, повреждению тканей глаза и ухудшению зрения.
При ОЦВС возникает закупорка главного кровеносного сосуда или его ветвей, по которому кровь отводится от сетчатки глаза.
В ответ на это повышаются уровни сосудистого эндотелиального фактора роста (VEGF), способствуя тем самым попаданию жидкости в сетчатку, а затем и отёку макулы (часть сетчатки, которая отвечает за чёткость зрения). Это называется макулярным отёком сетчатки. Когда макула отекает из-за наличия в ней жидкости, центральное зрение становится замутнённым.
При ОВЦВС блокируется одна или несколько ветвей главного кровеносного сосуда, по которому кровь отводится от сетчатки. В ответ на это повышаются уровни VEGF, способствуя тем самым попаданию жидкости в сетчатку, и, как следствие, макулярному отеку сетчатки.
ДМО — это отёк сетчатки, возникающий у пациентов, страдающих сахарным диабетом, из-за просачивания жидкости из кровеносных сосудов в области макулы. Макула — это часть сетчатки, которая отвечает за чёткость зрения. Когда макула отекает из-за наличия в ней жидкости, центральное зрение становится замутнённым.
Препарат Континия® является высокотехнологичным лекарственным препаратом, содержащим белок, производимый с использованием клеток яичника китайского хомячка (ЯКХ, СНО) по технологии рекомбинантной ДНК.
Способ действия препарата Континия®
Действующее вещество препарата Континия® — афлиберцепт — блокирует активность группы факторов, известных как сосудистый эндотелиальный фактор роста А (VEGF-А) и плацентарный фактор роста (P1GF). Препарат Континия® продемонстрировал способность останавливать рост новых аномальных кровеносных сосудов в глазу, из которых часто просачивается жидкость или может возникнуть кровоизлияние. Препарат Континия® может помочь предотвратить ухудшение зрения или во многих случаях — улучшить его, если его потеря связана с «влажной» формой ВМД, ОЦВС, ОВЦВС, ДМО и миопической ХНВ.
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к лечащему врачу-офтальмологу.
2. О чём следует знать перед применением препарата Континия®.
Противопоказания
Не применяйте препарат Континия®:
- если у Вас аллергия на афлиберцепт или любые другие компоненты препарата (перечисленные в разделе 6 листка-вкладыша);
- если у Вас выявлена активная инфекция или имеется подозрение на инфекцию внутри глаза или вокруг него (глазная или периокулярная инфекция);
- если у Вас есть активный воспалительный процесс внутри глаза (проявляется болью и покраснением в глазу);
- если Ваш возраст менее 18 лет.
Особые указания и меры предосторожности
Перед применением препарата Континия® обязательно сообщите лечащему врачу, если:
- у Вас глаукома — заболевание глаза, связанное с высоким давлением в глазу;
- ранее Вы наблюдали кратковременные вспышки света или плавающие пятна и их размер или число внезапно увеличивается (признаки разрыва или отслоения сетчатки);
- Вы перенесли хирургическую операцию на глазах в течение последних 4 недель или Вам планируется хирургическая операция на глазах в течение последующих 4 недель;
- у Вас тяжёлая форма ОЦВС или ОВЦВС (ишемическая ОЦВС или ОВЦВС (вызванная сужением просвета сосуда с прекращением кровотока)). В этом случае Вам не рекомендуется лечение препаратом Континия®.
Незамедлительно сообщите Вашему врачу, если у Вас появились.
- боль в глазу;
- повышенный дискомфорт в глазу;
- усиление покраснения глаза;
- снижение чёткости или остроты зрения;
- повышенная чувствительность к свету.
Это могут быть симптомы инфекции, воспаления внутри глаза (эндофтальмит) или других осложнений. Важно как можно скорее диагностировать любые симптомы и начать лечение.
Кроме того. Вам важно знать, что:
- Безопасность и эффективность препарата Континия® при введении одновременно в оба глаза не изучалась. Применение лекарственного препарата подобным образом может привести к повышенному риску возникновения нежелательных реакций.
- Инъекции препарата Континия® могут вызвать повышение внутриглазного давления у некоторых пациентов в течение 60 минут после инъекции. Ваш лечащий врач будет контролировать возникновение данного состояния после каждой инъекции.
- Врач проверит наличие у Вас других факторов риска, которые повышают вероятность разрыва или отслоения одного из слоев эпителия сетчатки глаза (отслоение или разрыв сетчатки, а также отслоение или разрыв пигментного эпителия сетчатки). В таких случаях препарат Континия® следует применять с осторожностью.
- Препарат Континия® не следует применять во время беременности, если потенциальная польза для матери не превышает потенциальный риск для будущего ребёнка.
- Женщины, способные забеременеть, должны использовать эффективные средства контрацепции в период лечения и, по крайней мере, в течение 3 месяцев после последней инъекции препарата Континия®.
- Системное применение веществ, схожих с действующим веществом препарата Континия® (ингибиторов VEGF), может быть связано с риском образования сгустков крови, которые блокируют кровеносные сосуды (артериальные тромбоэмболические события). Нарушение кровотока в сосудах может привести к инфаркту или инсульту. Существует теоретический риск развития подобных событий и после введения препарата Континия® в глаз. Имеются ограниченные данные по безопасности лечения пациентов с ОЦВС, ОВЦВС, ДМО или миопической ХНВ, перенёсших инсульт, микроинсульт (транзиторная ишемическая атака) или инфаркт в течение последних 6 месяцев. Если что- либо из перечисленного выше применимо к Вам, сообщите об этом лечащему врачу. В таких случаях препарат Континия® следует применять с осторожностью.
Дети и подростки
Применение препарата Континия® у детей и подростков до 18 лет не изучалось, поскольку безопасность и эффективность применения препарата у данной возрастной группы не установлены вследствие того, что данный препарат показан для лечения заболеваний (ВМД, ОЦВС, ОВЦВС, ДМО и миопическая ХНВ), встречающихся в основном у взрослых.
Другие препараты и препарат Континия®
Сообщите лечащему врачу о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Сочетанное применение фотодинамической терапии вертепорфином и препарата Континия® не изучалось, следовательно, профиль безопасности неизвестен.
Беременность, грудное вскармливание и фертильность
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом лечения препаратом проконсультируйтесь с лечащим врачом.
Женщины с детородным потенциалом (способные забеременеть)
Женщины, способные забеременеть, должны использовать надёжные методы контрацепции в период лечения и по крайней мере в течение 3 месяцев после последней интравитреальной инъекции афлиберцепта.
Беременность
Данные по применению афлиберцепта у беременных женщин отсутствуют. В исследованиях на животных было продемонстрировано неблагоприятное воздействие на эмбрион (эмбриофетотоксичность).
Несмотря на то, что препарат Континия® после внутриглазного введения в очень незначительных количествах может попадать в системный кровоток, препарат не следует применять при беременности, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода.
Грудное вскармливание
Неизвестно, проникает ли афлиберцепт в грудное молоко. Риск для ребёнка при грудном вскармливании не может быть исключён.
Препарат Континия® не рекомендуется применять при грудном вскармливании. Врач примет решение о прерывании грудного вскармливания или воздержании от лечения препаратом Континия®, принимая во внимание пользу грудного вскармливания для ребёнка и пользу лечения для матери.
Фертильность (способность к зачатию)
Результаты исследований на животных показывают, что афлиберцепт может повлиять на способность к зачатию (фертильность) особей мужского и женского пола, однако такие эффекты маловероятны после внутриглазного введения препарата с учётом очень низкого воздействия на организм.
Управление транспортными средствами и работа с механизмами
Применение препарата Континия® может вызвать временные нарушения зрения. Воздержитесь от управления транспортными средствами и работы с механизмами до достаточного восстановления чёткости зрительного восприятия.
Препарат Континия® содержит натрий
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, то есть по сути не содержит натрия.
3. Применение препарата Континия®.
Препарат Континия® вводится врачом. Всегда следуйте его рекомендациям. При появлении сомнений проконсультируйтесь с лечащим врачом.
Рекомендуемая доза
Рекомендуемая доза составляет 2 мг афлиберцепта (0,05 мл раствора препарата Континия®).
Путь и (или) способ введения
Инъекции должны проводиться врачом, который имеет опыт проведения внутриглазных инъекций, в чистых и стерильных (асептических) условиях.
Лечащий врач введёт препарат Континия® в глаз.
Перед инъекцией врач обработает кожу вокруг глаза, веки и поверхность глаза бактерицидными средствами (для предотвращения инфекции). Врач закапает Вам глазные капли (местное обезболивающее средство), чтобы уменьшить или предотвратить боль от инъекции.
Сразу после инъекции врач оценит Ваше состояние и некоторое время после введения будет наблюдать за вашим состоянием.
Если после проведения инъекции у Вас возникли такие симптомы, как боль в глазу, покраснение глаза, светобоязнь, затуманивание зрения, необходимо сразу сообщить об этом лечащему врачу.
Продолжительность терапии
Продолжительность лечения и режим дозирования будут определены врачом в зависимости от Вашего диагноза и ответа на лечение. Врач будет регулярно наблюдать за Вашим состоянием, чтобы удостовериться, что лечение препаратом Континия® оказывает желаемый эффект. В зависимости от Вашей реакции на лечение препаратом Континия® врач может увеличивать или уменьшать интервалы между инъекциями.
Если Вам ввели препарата Континия® больше, чем следовало
В случае, если врач ввёл препарат Континия® больше, чем следовало, у Вас может повыситься давление внутри глаза. Врач будет наблюдать за Вашим состоянием после каждой инъекции.
Если Вы пропустили визит к врачу для инъекции препарата Континия®
Если Вы пропустили очередной визит для введения препарата Континия®, посетите Вашего лечащего врача для обследования и проведения инъекции.
Если Вы собираетесь прекратить лечение препаратом Континия®
Если Вы планируете прекратить лечение препаратом Континия®, проконсультируйтесь с лечащим врачом.
При наличии вопросов по применению препарата обратитесь к своему лечащему врачу.
4. Возможные нежелательные реакции.
Подобно всем лекарственным препаратам, препарат Континия® может вызывать нежелательные реакции, однако, они возникают не у всех.
Возможно развитие аллергических реакций (реакции гиперчувствительности). Они могут быть серьёзными. Немедленно обратитесь к врачу в случае их возникновения.
При введении препарата Континия® могут возникнуть некоторые нежелательные реакции, связанные с инъекцией, оказывающие влияние на глаза. Некоторые из них могут быть серьёзными и включают в себя слепоту, серьезное воспаление или инфекцию внутри глаза (эндофтальмит), отслоение светочувствительного слоя в задней части глаза (отслоение сетчатки), помутнение хрусталика (катаракта), кровотечение в глазу (кровоизлияние в стекловидное тело), отделение гелеобразного вещества внутри глаза от сетчатки (отслоение стекловидного тела) и повышение внутриглазного давления (см. раздел 2 «О чем следует знать перед применением препарата Контития®). Данные серьёзные нежелательные реакции, оказывающие влияние на глаза, наблюдались менее чем при 1 из 1 900 инъекций в рамках клинических исследований.
Если после инъекции Вы почувствуете резкое ухудшение зрения или усиление боли и покраснение, то немедленно обратитесь к Вашему лечащему врачу.
Возможные нежелательные реакции, которые могут наблюдаться при применении препарата Континия®
Очень часто — могут возникать у более чем 1 человека из 10:
- снижение остроты зрения;
- кровоизлияние в задней части глаза (кровоизлияние в сетчатку);
- кровотечение из мелких кровеносных сосудов, расположенных во внешних слоях глаза (субконъюнктивальное кровоизлияние);
- боль в глазу.
Часто — могут возникать не более чем у 1 человека из 10:
- разрыв или отслоение одного из слоёв сетчатки глаза, приводящее к вспышкам света и плавающим помутнениям, иногда прогрессирующее до потери зрения (разрыв пигментного эпителия сетчатки* или отслоение пигментного эпителия сетчатки);
- изменения ткани сетчатой оболочки (дегенерация сетчатки);
- кровоизлияния в стекловидное тело;
- помутнение хрусталика (катаракта);
- повреждение поверхностного (эпителиального) слоя глазного яблока (эрозия роговицы, микроэрозии роговицы);
- повышение внутриглазного давления;
- затуманивание зрения;
- движущиеся пятна в поле зрения (плавающие помутнения внутриглазной структуры — стекловидного тела);
- отслоение гелеобразного вещества внутри глаза от сетчатки (отслойка стекловидного тела, приводящее к вспышкам света и плавающим помутнениям);
- боль в месте введения;
- чувство инородного тела в глазу;
- слезотечение;
- припухлость (отёк)века;
- кровоизлияния в месте введения;
- повреждение прозрачного слоя наружной оболочки глаза (роговица) (эрозии и микроэрозии роговицы); поверхностное воспаление роговицы (точечный кератит);
- покраснение глаза (инъекция конъюнктивы век, инъекция конъюнктивы глазного яблока);
*Состояния, связанные, как известно, с «влажной» формой ВМД. Наблюдались только у пациентов с «влажной» формой ВМД
Нечасто — могут возникать не более чем у 1 человека из 100:
- аллергические реакции — гиперчувствительность (сыпь, зуд, крапивница и в отдельных случаях — тяжёлые анафилактические/анафилактоидные реакции)
- серьёзное воспаление или инфекция внутри глаза (эндофтальмит, инфекционный и неинфекционный);
- отслоение или разрыв светочувствительного слоя в задней части глаза (отслойка сетчатки, разрыв сетчатки);
- воспаление радужной оболочки или других частей глаза (ирит, увеит, иридоциклит, опалесценция передней камеры (воспалительная реакция во влаге передней камеры));
- помутнение хрусталика;
- повреждение поверхности прозрачного слоя наружной оболочки глаза (дефект эпителия роговицы);
- раздражение в месте введения;
- аномальные ощущения в глазу;
- раздражение века;
- припухлость переднего слоя глазного яблока (отёк роговицы).
Редко — могут возникать не более чем у 1 человека из 1 000:
- слепота;
- помутнение хрусталика из-за травмы (травматическая катаракта);
- воспаление гелеобразной субстанции внутри глаза — стекловидного тела (витреит);
- гной в глазу (гипопион).
В клинических исследованиях отмечалось увеличение частоты кровотечений из мелких кровеносных сосудов в наружных слоях глаза (субконъюнктивальных кровоизлияний) у пациентов с «влажной» формой ВМД, получавших антитромботические препараты. Такая повышенная частота была сопоставима между пациентами, получавшими ранибизумаб и препарат Континия®.
Системное применение веществ, схожих с действующим веществом препарата Континия® (ингибиторов VEGF), может быть связано с риском образования сгустков крови, которые блокируют кровеносные сосуды (артериальные тромбоэмболические события). Это может привести к инфаркту или инсульту. Существует теоретический риск развития подобных событий и после введения препарата Континия® в глаз.
Как и в случае со всеми терапевтическими белками, при применении препарата Континия® существует вероятность развития иммунной реакции (образования антител).
Сообщения о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь со своим лечащим врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов, выявленным на территории государства — члена Евразийского экономического союза. Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1
Телефон: +7 (800) 550-99-03
Электронная почта: pharm@roszdravnadzor.gov.ru
Сайт в информационно-телекоммуникационной сети «Интернет»:
https://www.roszdravnadzor.gov.ru
Республика Беларусь
Республиканское Унитарное Предприятие «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь
Адрес: 22003 7, г. Минск, пер. Товарищеский, 2а
Тел.: +375 17 231-85-14
Факс: +375 17 252-53-58
Электронная почта: rcpl@rceth.by
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.rceth.by
Республика Казахстан
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
Адрес: 010000, г. Астана, район Байконыр, ул. А. Иманова, д. 13
Телефон: +7 (7172) 235-135
Электронная почта: farm@dari.kz
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.ndda.kz
Республика Армения
«Центр экспертизы лекарств и медицинских технологий» ГНКО
Адрес: 0051, г. Ереван, проспект Комитаса, д. 49/4
Телефон: (+374 10) 20-05-05, (+374 96) 22-05-05
Электронная почта: info@ampra.am, vigilance@pharm.am
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.pharm.am
Кыргызская Республика
Департамент лекарственных средств и медицинских изделий при Министерстве здравоохранения Кыргызской Республики
Адрес: 720044, г. Бишкек, ул. 3-линия, д. 25
Телефон: 0800-800-26-26, + 996 (312) 21-92-78
Электронная почта: pharm@dlsmi.kg
Сайт в информационно-телекоммуникационной сети «Интернет»:
https://dlsmi.kg/ru/registration/
5. Хранение препарата Континия®.
Храните препарат в недоступном для ребёнка месте так, чтобы ребёнок не мог увидеть его.
Не применяйте препарат после истечения срока годности (срока хранения), указанного на картонной пачке и этикетке флакона/картонной пачке, этикетке блистера и этикетке шприца после «Годен до».
Датой истечения срока годности является последний день данного месяца.
Хранить при температуре от 2 до 8 °C в оригинальной упаковке (пачке картонной) для защиты от света. Не замораживать.
Перед применением невскрытый флакон в оригинальной упаковке (пачке картонной) может храниться при температуре не выше 25 °C до 24 часов.
Не выбрасывайте (не выливайте) препарат в канализацию или с бытовыми отходами. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведения.
Препарат Континия® содержит
Действующее вещество: афлиберцепт.
Каждый мл раствора содержит 40 мг афлиберцепта.
Каждый флакон содержит 11,12 мг афлиберцепта в 0,278 мл раствора.
Извлекаемый объём одного флакона составляет 0,1 мл раствора, что эквивалентно 4 мг афлиберцепта. Данный извлекаемый объём раствора позволяет обеспечить введение разовой дозы 2 мг афлиберцепта, что составляет 0,05 мл раствора.
Прочими ингредиентами (вспомогательными веществами) являются: гистидин, натрия хлорид, сахароза, полисорбат 20, хлороводородная кислота (для коррекции pH), вода для инъекций.
Препарат Континия® содержит натрий (см. раздел 2 «О чём следует знать перед применением препарата Контития®).
Внешний вид препарата Континия® и содержимое упаковки
Раствор для внутриглазного введения.
Препарат представляет собой прозрачную или слегка опалесцирующую, от бесцветного до коричневато-жёлтого цвета жидкость.
По 0,278 мл препарата* во флакон из стекла I гидролитического класса, укупоренный пробкой резиновой, с обкаткой колпачком алюминиево-пластиковым с контролем первого вскрытия.
На каждый флакон наклеивают этикетку самоклеящуюся.
*Препарат производится с избытком наполнения в целях обеспечения извлекаемого объёма не менее 0,1 мл.
1 флакон с препаратом вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом и игла, снабжённая фильтром для извлечения препарата из флакона, вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка и игла, снабжённая фильтром для извлечения препарата из флакона, вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом в комплекте с иглой, снабжённой фильтром, для извлечения препарата из флакона, иглой для инъекций, шприцем — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Каждый компонент расходных медицинских материалов (игла с фильтром, игла для инъекций, шприц) помещен в стерильную одноразовую упаковку.
Держатель регистрационного удостоверения
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., район Петушинский, п. Вольгинский, ул. Заводская, стр. 273
Тел.: +7 (49243) 72-5-20, 72-5-14
Адрес электронной почты: generium@generium.ru
Производитель (выпускающий контроль качества)
Российская Федерация
АО «ГЕНЕРИУМ»
Владимирская обл., район Петушинский, и. Вольгинский, ул. Заводская, стр. 273
или
Российская Федерация
ООО «Генериум-Некст»
г. Москва, вн. тер. г. муниципальный округ Силино, г. Зеленоград, ул. Конструктора Лукина, д. 14,стр. 12
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к местному представителю держателя регистрационного удостоверения:
в Российской Федерации
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., район Петушинский, п. Вольгинский, ул. Заводская, стр. 273
Тел.: +7 (49243) 72-5-20, 72-5-14
Адрес электронной почты: generium@generium.ru
в Республике Беларусь
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., район Петушинский, п. Вольгинский, ул. Заводская, стр. 273
Тел.: 8-820-007-33338
Адрес электронной почты: generium@generium.ru
в Республике Казахстан
Республика Казахстан
ТОО «Карагандинский фармацевтический комплекс»
100009, г. Караганда, ул. Газалиева, стр. 16
Тел./факс: +7 (7212) 43 7002
Тел.: +7 (7212) 908042
Адрес электронной почты: kphk@kphk.kz
в Республике Армения
Республика Армения
ООО «Арго-Фарм»,
г. Ереван, ул. Сундукяна 13/9
Тел.: +374 (10) 744080, +374 (77)489875
Адрес электронной почты: info@argopharm.am
в Кыргызской Республике:
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., район Петушинский, п. Вольгинский, ул. Заводская, стр. 273
Тел. +80033322274
Адрес электронной почты: generium@generium.ru
Листок-вкладыш пересмотрен
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайте Союза: https://eec.eaeunion.org.
(линия отрыва или отреза)
Следующие сведения предназначены исключительно для медицинских работников:
Режим дозирования и способ применения
Содержимое флакона необходимо использовать только для одной инъекции. Препарат Континия® должен вводить только врач, имеющий соответствующую квалификацию и опыт выполнения интравитреальных инъекций.
Режим дозирования
Неоваскулярная («влажная») форма возрастной макулярной дегенерации («влажная» форма ВМД)
Рекомендованная доза препарата Континия® составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Лечение препаратом Континия® начинают с введения с трех последовательных ежемесячных инъекций, после этого следующую инъекцию выполняют через два месяца.
В дальнейшем двухмесячные интервалы между инъекциями препарата Континия® могут быть сохранены или увеличены в режиме «лечить и увеличивать интервал» на основании оценки результатов изменения остроты зрения и/или анатомических показателей лечащим врачом. При использовании режима «лечить и увеличивать интервал» к последующим интервалам между инъекциями препарата Континия® добавляют по 2 или 4 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей.
В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены.
Контрольные обследования между инъекциями обычно не требуются, однако, если врач считает их необходимыми, они могут проводиться чаще, чем инъекции.
Исследования, в которых интервалы между инъекциями афлиберцепта превышали четыре месяца или были менее четырёх недель, не проводились.
Макулярный отёк вследствие окклюзии вен сетчатки (центральной вены сетчатки (ОЦВС) или её ветвей (ОВЦВС))
Рекомендованная доза препарата Континия® составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
После начальной инъекции лечение проводится ежемесячно. Интервал между двумя инъекциями должен быть не менее одного месяца.
Если не наблюдается улучшения остроты зрения и анатомических показателей после непрерывного лечения, лечение препаратом Континия® должно быть прекращено.
Ежемесячные инъекции продолжают до достижения максимально возможной остроты зрения и/или отсутствия признаков активности заболевания. Для этого необходимо проведение трех и более последовательных ежемесячных инъекций.
Терапия может быть продолжена в режиме «лечить и увеличивать интервал» при постепенном увеличении интервала между инъекциями для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей, однако данных, позволяющих установить длительность интервалов, недостаточно. В случае ухудшения остроты зрения и анатомических показателей интервалы между инъекциями должны быть соответственно сокращены.
Мониторинг и выбор схемы лечения осуществляются лечащим врачом на основании индивидуального ответа пациента.
Мониторинг проявлений активности заболевания может включать в себя стандартный офтальмологический осмотр, функциональную диагностику или использование методов визуализации (оптической когерентной томографии или флюоресцентной ангиографии).
Диабетический макулярный отёк (ДМО)
Рекомендованная доза препарата Континия® составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Терапию препаратом Континия® начинают с одной ежемесячной инъекции в течение первых пяти месяцев, после чего инъекции проводят каждые два месяца.
Двухмесячные интервалы между инъекциями препарата Континия® могут быть сохранены или интервалы могут быть установлены индивидуально на основании оценки результатов изменения остроты зрения и/или анатомических показателей лечащим врачом. Например, при использовании режима «лечить и увеличивать интервал» к интервалам между инъекциями обычно добавляют по 2 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей. Данные по применению препарата Континия® с интервалами между инъекциями, превышающими четыре месяца, ограничены. В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены. Исследования, в которых интервалы между инъекциями составляли менее четырёх недель, не проводились.
Сроки контрольных обследований определяются лечащим врачом.
Если результаты остроты зрения и анатомические показатели указывают на отсутствие эффекта от проводимого лечения, терапию препаратом Континия® следует прекратить.
Миопическая хориоидальная неоваскуляризаця (миопическая ХНВ)
Рекомендованная доза препарата Континия® — однократная интравитреальная инъекция 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Если результаты остроты зрения и анатомические показатели указывают на сохранение заболевания, возможно введение дополнительных инъекций. Рецидивы должны лечиться как новое проявление заболевания.
Сроки контрольных обследований определяются лечащим врачом.
Интервал между двумя дозами должен составлять не менее одного месяца.
Особые группы пациентов
Пациенты пожилого возраста
Соблюдения каких-либо специальных условий не требуется. Опыт лечения пациентов старше 75 лет с ДМО ограничен.
Пациенты с нарушением функции почек
Никаких специальных исследований с участием пациентов с почечной недостаточностью. получающих афлиберцепт, не проводилось. На основании доступных данных, коррекции дозы у таких пациентов не требуется.
Пациенты с нарушением функции печени
Никаких специальных исследований с участием пациентов с печёночной недостаточностью, получающих афлиберцепт, не проводилось. На основании доступных данных, коррекции дозы у таких пациентов не требуется.
Дети
Безопасность и эффективность афлиберцепта у детей и подростков не изучалась. Препарат Континия® не показан к применению у данной группы пациентов.
Способ применения
Препарат Континия® предназначен только для введения в стекловидное тело.
Интравитреальные инъекции должны проводиться в соответствии с медицинскими стандартами и действующими рекомендациями квалифицированным врачом, имеющим опыт проведения таких инъекций. В целом необходимо обеспечить адекватную анестезию и асептические условия, включая применение местных бактерицидных средств широкого спектра действия (например, наносить повидон-йод на кожу вокруг глаза, веко и поверхность глаза). Рекомендуется дезинфекция рук хирурга, применение стерильных перчаток и салфеток и стерильного расширителя век (или его эквивалента).
Инъекционную иглу следует вводить на 3,5–4,0 мм кзади от лимба в полость стекловидного тела, избегая горизонтального меридиана и направляя иглу в центр глазного яблока. Объём вводимого раствора 0,05 мл. Следующая инъекция проводится в другой участок склеры.
Сразу после интравитреальной инъекции состояние пациента необходимо контролировать на предмет повышения внутриглазного давления. Адекватный мониторинг может включать проверку перфузии диска зрительного нерва или офтальмотонометрию. При необходимости следует обеспечить доступность стерильного оборудования для парацентеза.
После проведения интравитреальной инъекции пациента следует предупредить о необходимости безотлагательно сообщать о любых симптомах, которые могут свидетельствовать о развитии эндофтальмита (например, боль в глазу, конъюнктивальная или перикорнеальная инъекция, светобоязнь, затуманивание зрения).
Каждый флакон следует использовать только для одной интравитреальной инъекции. Извлечение нескольких доз из одного флакона может привести к увеличению риска контаминации и последующему развитию инфекции.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг (эквивалентную 0,05 мл раствора для инъекции). Извлекаемый объём флакона — это объём, который может быть извлечён из флакона и не используется полностью. Извлекаемый объём флакона составляет не менее 0,1 мл.
Введение полного объёма флакона может привести к передозировке.
Перед применением следует внимательно осмотреть флакон. При нарушении целостности флакона, значительном изменении цвета, помутнении, обнаружении видимых частиц препарат нельзя применять, и он должен быть утилизирован.
Фильтровальная игла не должна использоваться для инъекций. Фильтровальная игла не пирогенна и не подлежит стерилизации методом автоклавирования. При нарушении целостности индивидуальной упаковки фильтровальную иглу применять нельзя. После использования фильтровальная игла утилизируется в контейнер для сбора отходов класса А (малоопасные отходы). Повторное использование фильтровальной иглы может привести к развитию инфекции или другого заболевания/поражения.
Для интравитреальной инъекции следует использовать иглу для инъекций.
Инструкции по использованию флакона:
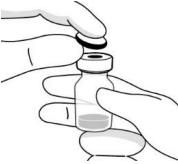
| Удаляют пластиковый колпачок и дезинфицируют внешнюю часть резиновой пробки флакона. |
| |
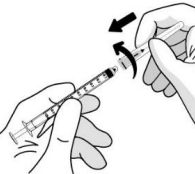
| Присоединяют фильтровальную иглу к стерильному шприцу на 1 мл с люэровским наконечником. |
|
|
|
|
|
|
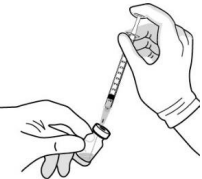
| Фильтровальную иглу вводят через центр пробки флакона до тех пор, пока она полностью не войдёт во флакон и её конец не коснётся края флакона. |
|
|
|
|
|
|
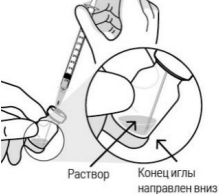
| Соблюдая правила асептики, извлекают содержимое флакона с препаратом Континия в шприц, немного наклоняя флакон для полного извлечения препарата. Для предотвращения попадания воздуха необходимо убедиться, что конец иглы погружен в жидкость. При отборе раствора продолжают наклонять флакон, следя за тем, чтобы конец иглы был погружен в жидкость. |
| |
| Убедившись, что шток поршня достаточно оттянут назад при заборе раствора из флакона, фильтровальную иглу полностью опустошают. | ||
| Фильтровальную иглу снимают и утилизируют. Примечание: фильтровальная игла не используется для интравитреальной инъекции. | ||
| Соблюдая правила асептики, иглу для инъекции плотно присоединяют к кончику шприца с люэровским наконечником. |
| |
| Держа шприц иглой вверх, проверяют раствор на наличие пузырьков. Если они имеются, осторожно встряхивают шприц, постукивая по нему пальцем до тех пор, пока все пузырьки не поднимутся наверх. |
| |
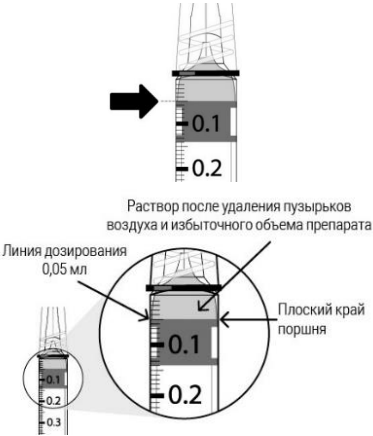
| Медленно надавливая на поршень так, чтобы его плоский край достиг метки 0,05 мл на шприце, удаляют все пузырьки и избыточный объём препарата. |
| |
Флакон предназначен только для однократного использования. Извлечение нескольких доз из одного флакона может привести к увеличению риска контаминации и последующему развитию инфекции. Весь оставшийся лекарственный препарат или отходы необходимо уничтожить в установленном порядке.
Передозировка
Симптомы
В клинических исследованиях применялись дозы до 4 мг с интервалом 1 месяц, наблюдались отдельные случаи передозировки при применении дозы 8 мг.
Передозировка с введением большего объёма раствора может приводить к повышению внутриглазного давления.
Лечение
В случае передозировки следует контролировать внутриглазное давление, при необходимости лечащий врач должен начать адекватную терапию по его коррекции.
Общая характеристика лекарственного препарата
▼ Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях. Порядок сообщения о нежелательных реакциях представлен в разделе 4.8.
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Континия, 40 мг/мл, раствор для внутриглазного введения.
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: афлиберцепт*.
Каждый мл раствора содержит 40 мг афлиберцепта.
Каждый флакон содержит 11,12 мг афлиберцепта в 0,278 мл раствора.
Извлекаемый объём одного флакона составляет 0,1 мл раствора, что эквивалентно 4 мг афлиберцепта. Данный извлекаемый объём раствора позволяет обеспечить введение разовой дозы 2 мг афлиберцепта, что составляет 0,05 мл раствора.
*Афлиберцепт — это рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов человеческих рецепторов сосудистого эндотелиального фактора роста VEGF 1 (VEGFR-1) и VEGF 2 (VEGFR-2), соединённых с Fc-фрагментом человеческого иммуноглобулина G (IgGl), полученный в клетках яичника китайского хомячка (CHO) К1 с помощью технологии рекомбинантной ДНК.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий (см. раздел 4.4.).
Полный перечень вспомогательных веществ приведён в разделе 6.1.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Раствор для внутриглазного введения.
Прозрачная или слегка опалесцирующая, от бесцветного до коричневато-жёлтого цвета жидкость.
4. КЛИНИЧЕСКИЕ ДАННЫЕ
4.1. Показания к применению
Препарат Континия показан к применению у взрослых с 18 лет:
- для лечения неоваскулярной («влажной») формы возрастной макулярной дегенерации («влажной» формы ВМД);
- для лечения ухудшения зрения, вызванного макулярным отёком вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или её ветвей (ОВЦВС));
- для лечения ухудшения зрения, вызванного диабетическим макулярным отёком (ДМО);
- для лечения ухудшения зрения, вызванного миопической хориоидальной неоваскуляризацией (миопической ХНВ).
4.2. Режим дозирования и способ применения
Содержимое флакона необходимо использовать только для одной инъекции. Препарат Континия должен вводить только врач, имеющий соответствующую квалификацию и опыт выполнения интравитреальных инъекций.
Режим дозирования
Неоваскулярная («влажная») форма возрастной макулярной дегенерации («влажная» форма ВМД)
Рекомендованная доза препарата Континия составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Лечение препаратом Континия начинают с введения трех последовательных ежемесячных инъекций, после этого следующую инъекцию выполняют через два месяца.
В дальнейшем двухмесячные интервалы между инъекциями препарата Континия могут быть сохранены или увеличены в режиме «лечить и увеличивать интервал» на основании оценки результатов изменения остроты зрения и/или анатомических показателей лечащим врачом. При использовании режима «лечить и увеличивать интервал» к последующим интервалам между инъекциями препарата Континия добавляют по 2 или 4 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей.
В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены.
Контрольные обследования между инъекциями обычно не требуются, однако, если врач считает их необходимым, они могут проводиться чаще, чем инъекции.
Исследования, в которых интервалы между инъекциями афлиберцепта превышали четыре месяца или были менее четырёх недель, не проводились (см. раздел 5.1.).
Макулярный отёк вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или её ветвей (ОВЦВС))
Рекомендованная доза препарата Континия составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
После начальной инъекции лечение проводится ежемесячно. Интервал между двумя инъекциями должен быть не менее одного месяца.
Если не наблюдается улучшения остроты зрения и анатомических показателей после непрерывного лечения, лечение препаратом Континия должно быть прекращено.
Ежемесячные инъекции продолжают до достижения максимально возможной остроты зрения и/или отсутствия признаков активности заболевания. Для этого необходимо проведение трех и более последовательных ежемесячных инъекций.
Терапия может быть продолжена в режиме «лечить и увеличивать интервал» при постепенном увеличении интервала между инъекциями для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей, однако данных, позволяющих установить длительность интервалов, недостаточно. В случае ухудшения остроты зрения и анатомических показателей интервалы между инъекциями должны быть соответственно сокращены.
Мониторинг и выбор схемы лечения осуществляются лечащим врачом на основании индивидуального ответа пациента.
Мониторинг проявлений активности заболевания может включать в себя стандартный офтальмологический осмотр, функциональную диагностику или использование методов визуализации (оптической когерентной томографии или флюоресцентной ангиографии).
Диабетический макулярный отёк (ДМО)
Рекомендованная доза препарата Континия составляет 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Терапию препаратом Континия начинают с одной ежемесячной инъекции в течение первых пяти месяцев, после чего инъекции проводят каждые два месяца.
Двухмесячные интервалы между инъекциями препарата Континия могут быть сохранены или интервалы могут быть установлены индивидуально на основании оценки результатов изменения остроты зрения и/или анатомических показателей лечащим врачом. Например, при использовании режима «лечить и увеличивать интервал» к интервалам между инъекциями обычно добавляют по 2 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей. Данные по применению препарата Континия с интервалами между инъекциями, превышающими четыре месяца, ограничены. В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены. Исследования, в которых интервалы между инъекциями составляли менее четырёх недель, не проводились (см. раздел 5.1.).
Сроки контрольных обследований определяются лечащим врачом.
Если результаты остроты зрения и анатомические показатели указывают на отсутствие эффекта от проводимого лечения, терапию препаратом Континия следует прекратить.
Миопической хориоидальная неоваскуляризаця (миопическая ХНВ)
Рекомендованная доза препарата Континия — однократная интравитреальная инъекция 2 мг афлиберцепта, что эквивалентно 0,05 мл раствора.
Если результаты остроты зрения и анатомические показатели указывают на сохранение заболевания, возможно введение дополнительных инъекций. Рецидивы должны лечиться как новое проявление заболевания.
Сроки контрольных обследований определяются лечащим врачом.
Интервал между двумя дозами должен составлять не менее одного месяца.
Особые группы пациентов
Пациенты пожилого возраста
Соблюдения каких-либо специальных условий не требуется. Опыт лечения пациентов старше 75 лет с ДМО ограничен.
Пациенты с нарушением функции почек
Никаких специальных исследований с участием пациентов с почечной недостаточностью, получающих афлиберцепт, не проводилось.
На основании доступных данных, коррекции дозы у таких пациентов не требуется (см. раздел 5.2).
Пациенты с нарушением функции печени
Никаких специальных исследований с участием пациентов с печёночной недостаточностью, получающих афлиберцепт, не проводилось.
На основании доступных данных, коррекции дозы у таких пациентов не требуется (см. раздел 5.2).
Дети
Безопасность и эффективность афлиберцепта у детей и подростков не изучалась.
Препарат Континия не показан к применению у данной группы пациентов.
Способ применения
Препарат Континия предназначен только для введения в стекловидное тело. Содержимое флакона необходимо использовать только для одной инъекции.
Интравитреальные инъекции должны проводиться в соответствии с медицинскими стандартами и действующими рекомендациями квалифицированным врачом, имеющим опыт проведения таких инъекций. В целом необходимо обеспечить адекватную анестезию и асептические условия, включая применение местных бактерицидных средств широкого спектра действия (например, наносить повидон-йод на кожу вокруг глаза, веко и поверхность глаза). Рекомендуется дезинфекция рук хирурга, применение стерильных перчаток и салфеток и стерильного расширителя век (или его эквивалента).
Инъекционную иглу следует вводить на 3,5–4,0 мм кзади от лимба в полость стекловидного тела, избегая горизонтального меридиана и направляя иглу в центр глазного яблока. Объём вводимого раствора 0,05 мл. Следующая инъекция проводится в другой участок склеры.
Сразу после интравитреальной инъекции состояние пациента необходимо контролировать на предмет повышения внутриглазного давления. Адекватный мониторинг может включать проверку перфузии диска зрительного нерва или офтальмотонометрию. При необходимости следует обеспечить доступность стерильного оборудования для парацентеза.
После проведения интравитреальной инъекции пациента следует предупредить о необходимости безотлагательно сообщать о любых симптомах, которые могут свидетельствовать о развитии эндофтальмита (например, боль в глазу, конъюнктивальная или перикорнеальная инъекция, светобоязнь, затуманивание зрения).
Каждый флакон следует использовать только для одной интравитреальной инъекции. Извлечение нескольких доз из одного флакона может привести к увеличению риска контаминации и последующему развитию инфекции.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг (эквивалентную 0,05 мл раствора для инъекции). Извлекаемый объём флакона — это объем, который может быть извлечён из флакона и не используется полностью. Лекарственный препарат производится с избытком наполнения в целях обеспечения извлекаемого объёма не менее 0,1 мл. Избыточный объём должен быть удалён до введения рекомендуемой дозы (см. раздел 6.6.).
Введение полного объёма флакона может привести к передозировке. Для удаления пузырьков воздуха и избыточного объёма лекарственного препарата из шприца следует медленно нажать на поршень так, чтобы его плоский край достиг метки 0,05 мл на шприце (эквивалентной 0,05 мл, т.е. 2 мг афлиберцепта) (см. разделы 4.9. и 6.6.).
После инъекции весь неиспользованный препарат должен быть утилизирован.
Инструкции по обращению с лекарственным препаратом перед введением см. в разделе 6.6.
4.3. Противопоказания
- Гиперчувствительность к афлиберцепту или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
- Активная или подозреваемая интра- или периокулярная инфекция.
- Активное тяжёлое внутриглазное воспаление.
- Возраст до 18 лет.
4.4. Особые указания и меры предосторожности при применении
Прослеживаемость
Для улучшения прослеживаемости биологических лекарственных препаратов необходимо точно документировать торговое наименование и номер серии применяемого препарата в медицинской документации пациента.
С осторожностью
- при лечении пациентов с плохо контролируемой глаукомой (не следует вводить препарат Континия при внутриглазном давлении ≥30 мм рт. ст.);
- у пациентов, перенёсших инсульт, транзиторную ишемическую атаку или инфаркт миокарда в течение последних 6 месяцев (при лечении ОЦВС, ОВЦВС, ДМО или миопической ХНВ);
- у пациентов с факторами риска нарушения целостности пигментного эпителия сетчатки.
Реакции, обусловленные интравитреальным введением
Была выявлена связь интравитреальных инъекций, включая инъекции афлиберцепта, с развитием эндофтальмита, воспалительной реакции со стороны стекловидного тела, регматогенной отслойки сетчатки, разрыва сетчатки, ятрогенной травматической катаракты (см. раздел 4.8.). При введении препарата Континия всегда следует соблюдать соответствующую технику асептического проведения инъекций. Кроме того, пациенты должны находиться под наблюдением в течение недели после проведённой инъекции для выявления первых признаков воспаления и своевременного назначения необходимой терапии. Следует информировать пациентов о необходимости немедленно сообщать врачу о любых симптомах, свидетельствующих о развитии эндофтальмита или любой другой реакции, указанной выше.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг (что эквивалентно 0,05 мл раствора для инъекции). Избыточный объём лекарственного препарата должен быть удалён до инъекции (см. разделы 4.2 и 6.6.).
Наблюдались случаи повышения внутриглазного давления в первые 60 минут после интравитреальных инъекций, включая инъекции афлиберцепта (см. раздел 4.8.). При лечении пациентов с плохо контролируемой глаукомой необходимы особые меры предосторожности (не следует вводить препарат Континия при внутриглазном давлении > 30 мм рт. ст.). Во всех случаях необходим контроль внутриглазного давления и перфузии диска зрительного нерва с назначением соответствующей состоянию терапии.
Иммуногенность
Поскольку препарат Континия представляет собой белок с терапевтическими свойствами, существует вероятность проявления иммуногенности (см. раздел 4.8.). Следует информировать пациентов о необходимости сообщать врачу о любых признаках или симптомах внутриглазного воспаления, таких как боль, светобоязнь или конъюнктивальная, или перикорнеальная инъекция, которые могут быть клиническими проявлениями гиперчувствительности к препарату.
Системные эффекты
После интравитреальных инъекций ингибиторов VEGF были отмечены системные нежелательные явления, в том числе кровоизлияния вне органа зрения и тромбоэмболия артерий. Существует теоретический риск связи этих явлений с ингибированием VEGF. Имеются ограниченные данные по безопасности применения афлиберцепта пациентами с ОЦВС, ОВЦВС, ДМО или миопической ХНВ, имеющими в анамнезе инсульт, транзиторную ишемическую атаку или инфаркт миокарда за период в 6 месяцев до начала терапии. При лечении таких пациентов следует соблюдать осторожность.
Прочее
Как и в случае интравитреального введения других анти-VEGF препаратов при ВМД, ОЦВС, ОВЦВС, ДМО и миопической ХНВ, следует принять во внимание следующее:
- Безопасность и эффективность препарата Континия при введении одновременно в оба глаза систематически не изучалась (см. раздел 5.1.). Одновременное билатеральное введение может привести к повышению системной экспозиции препарата, что, в свою очередь, повышает риск системных нежелательных явлений.
- Отсутствуют сведения об одновременном применении препарата Континия с другими анти-VEGF препаратами (системными или офтальмологическими).
- Факторы риска, связанные с нарушением целостности слоя пигментных клеток после анти-VEGF терапии «влажной» формы ВМД, включают обширную и/или выраженную отслойку пигментного эпителия сетчатки. В начале терапии препаратом Континия следует соблюдать осторожность при назначении препарата пациентам с факторами риска развития разрывов пигментного эпителия сетчатки.
- Пациентам с регматогенной отслойкой сетчатки или с макулярными разрывами 3 или 4 стадии от лечения следует воздержаться.
- В случае разрыва сетчатки инъекция должна быть отменена, лечение не следует возобновлять до адекватного восстановления разрыва.
- От инъекции следует воздержаться до следующей запланированной по графику инъекции в случае:
- снижения максимально корригированной остроты зрения (МКОЗ) ≥30 букв по сравнению с последней оценкой остроты зрения;
- субретинальных кровоизлияний, затрагивающих центральную ямку, или если размер кровоизлияния составляет ≥50 % от общей области поражения.
- От инъекции следует воздержаться на период 28 дней до планируемого и 28 дней после проведённого интраокулярного хирургического вмешательства.
- Препарат Континия не следует применять при беременности, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода (см. раздел 4.6.).
- Женщины репродуктивного возраста должны использовать эффективные средства контрацепции в период лечения и, по крайней мере, в течение 3 месяцев после последней интравитреальной инъекции афлиберцепта (см. раздел 4.6.).
- Опыт лечения пациентов с ишемической ОЦВС и ОВЦВС ограничен. При наличии у пациентов клинических признаков необратимых изменений зрительных функций на фоне ишемии терапия афлиберцептом не рекомендована.
Популяции, данные по которым ограничены
Опыт лечения ДМО у пациентов с сахарным диабетом 1-го типа, у пациентов с уровнем гликированного гемоглобина более 12 %, у пациентов с пролиферативной диабетической ретинопатией ограничен.
Применение препарата Континия у пациентов с активными системными инфекциями или у пациентов с сопутствующими заболеваниями глаз, такими как отслойка сетчатки или разрыв макулы не изучалось. Опыт лечения препаратом Континия пациентов с сахарным диабетом и неконтролируемой гипертензией отсутствует. Это должно учитываться лечащим врачом при ведении таких пациентов.
Опыт применения препарата Континия для лечения миопической ХНВ у пациентов неазиатской популяции, у пациентов, ранее проходивших лечение миопической ХНВ, а также у пациентов с поражением экстрафовеальной области отсутствует.
Вспомогательные вещества
Данный препарат содержит менее 1 ммоль (23 мг) натрия в разовой дозе (0,47 мг — 0,05 мл), то есть, по сути, не содержит натрия.
4.5. Взаимодействия с другими лекарственными препаратами и другие виды взаимодействия
Исследования в отношении межлекарственных взаимодействий не проводились.
Сочетанное применение фотодинамической терапии (ФДТ) вертепорфином и афлиберцепта не изучалось, следовательно, профиль безопасности неизвестен.
4.6. Фертильность, беременность и лактация
Женщины с детородным потенциалом
Женщины репродуктивного возраста должны использовать эффективные средства контрацепции в период лечения и по крайней мере в течение 3 месяцев после последней интравитреальной инъекции афлиберцепта (см. раздел 4.4.).
Беременность
Данные по применению афлиберцепта у беременных женщин отсутствуют. В исследованиях на животных была продемонстрирована эмбрио-фетотоксичность.
Несмотря на то, что системная экспозиция после внутриглазного введения афлиберцепта очень мала, препарат не следует применять при беременности, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода (см. раздел 4.4.).
Лактация
Неизвестно, проникает ли афлиберцепт в грудное молоко. Риск для ребёнка при грудном вскармливании не может быть исключён.
Препарат Континия не рекомендуется применять при грудном вскармливании. Необходимо принять решение о прерывании грудного вскармливания или воздержаться от терапии препаратом Континия, принимая во внимание пользу грудного вскармливания для ребёнка и пользу лечения для матери.
Фертильность
Результаты исследований на животных с высокой системной экспозицией препарата показывают, что афлиберцепт может нарушать фертильность особей мужского и женского пола. Такие эффекты маловероятны после внутриглазного введения препарата с учётом очень низкой системной экспозиции.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Применение препарата Континия оказывает слабое влияние на способность управлять транспортными средствами и работать с механизмами вследствие возможных временных нарушений зрения, связанных как с инъекцией, так и с процедурой обследования. Если после проведения инъекции у пациента возникли временные нарушения зрения, то пациенту не рекомендуется управлять автомобилем или работать с механизмами до восстановления четкости зрительного восприятия.
4.8. Нежелательные реакции
Резюме профиля безопасности
3102 пациента, принимавших участие в восьми исследованиях III фазы, составили популяцию по оценке безопасности. Из них 2501 пациент получал рекомендованную дозу 2 мг.
Серьёзные офтальмологические нежелательные реакции, возникшие в исследуемом глазу и связанные с процедурой введения, отмечались менее чем в 1 случае на 1900 интравитреальных инъекций афлиберцепта и включали слепоту, эндофтальмит, отслойку сетчатки, ятрогенную травматическую катаракту, катаракту, кровоизлияние в стекловидное тело, отслойку стекловидного тела и повышение внутриглазного давления (см. раздел 4.4.).
Наиболее распространённые нежелательные реакции (по крайней мере у 5 % пациентов, получавших терапию афлиберцептом) включали субконъюнктивальное кровоизлияние (25 %), снижение остроты зрения (11 %), кровоизлияние в сетчатку (11 %), боль в глазу (10 %), катаракту (8 %), повышение внутриглазного давления (8 %), отслойку стекловидного тела (7 %) и плавающие помутнения стекловидного тела (7 %).
Табличное резюме нежелательных реакций
Данные по безопасности, приведённые ниже, включают все нежелательные реакции, отмеченные в восьми исследованиях III фазы при лечении по показаниям «влажная» форма ВМД, ОЦВС, ОВЦВС, ДМО и миопическая ХНВ с указанием возможности наличия причинно-следственной связи с процедурой введения или лекарственным препаратом.
Нежелательные реакции, представленные ниже, перечислены в соответствии с частотой возникновения в клинических исследованиях и классифицированы по системно-органным классам (СОК). Частота возникновения нежелательных реакций определялась в соответствии с классификацией Всемирной Организации Здравоохранения: очень часто (≥1/10), часто (>1/100, но <1/10), нечасто (≥1/1,000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (< 1/10000), частота неизвестна (на основании имеющихся данных оценить частоту невозможно).
В каждой частотной группе нежелательные реакции представлены в порядке убывания тяжести.
| Системно-органные классы | |
| Нарушения со стороны иммунной системы | |
| Нечасто | гиперчувствительность1 |
| Нарушения со стороны органа зрения | |
| Очень часто | снижение остроты зрения, кровоизлияние в сетчатку, субконъюнктивальное кровоизлияние, боль в глазу |
| Часто | разрыв пигментного эпителия сетчатки2, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияния в стекловидное тело, катаракта, кортикальная катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, микроэрозии роговицы, повышение внутриглазного давления, затуманивание зрения, плавающие помутнения стекловидного тела, отслойка стекловидного тела, боль в месте введения, чувство инородного тела в глазу, слезотечение, отёк века, кровоизлияния в месте введения, точечный кератит, инъекция конъюнктивы век, инъекция конъюнктивы глазного яблока |
| Нечасто | эндофтальмит3, отслойка сетчатки, разрыв сетчатки, ирит, увеит, иридоциклит, помутнение хрусталика, дефект эпителия роговицы, раздражение в месте введения, аномальная чувствительность тканей глаза, раздражение века, воспалительная реакция во влаге передней камеры, отёк роговицы |
| Редко | слепота, травматическая катаракта, воспалительная реакция со стороны стекловидного тела (витреит), гипопион |
1 — в пострегистрационном периоде сообщения о реакциях гиперчувствительности включали сыпь, зуд, крапивницу и в отдельных случаях — тяжёлые анафилактические/анафилактоидные реакции;
2 — состояния, связанные, как известно, с «влажной» формой ВМД. Наблюдались только в исследованиях с «влажной» формой ВМД;
3 — инфекционный и неинфекционный эндофтальмит.
Описание отдельных нежелательных реакций
В исследованиях III фазы при «влажной» форме ВМД отмечено повышение частоты возникновения субконъюнктивальных кровоизлияний у пациентов, получающих антитромботические препараты. Повышение частоты возникновения данного явления было сопоставимым у пациентов, получающих ранибизумаб и афлиберцепт.
Артериальные тромбоэмболические события (АТС) являются нежелательными явлениями, потенциально связанными с системным ингибированием VEGF. Теоретически существует риск АТС, включая инсульт и инфаркт миокарда, после интравитреального введения ингибиторов VEGF.
В клинических исследованиях афлиберцепта у пациентов с «влажной» формой ВМД, ДМО, ОЦВС, ОВЦВС и миопической ХНВ наблюдалась низкая частота возникновения АТС. По каждому из показаний не наблюдалось значительной разницы между группами пациентов, получавшими афлиберцепт, и пациентами соответствующих контрольных групп.
Как и все терапевтические белки, афлиберцепт обладает иммуногенным потенциалом.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза — риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1
Телефон: +7 (800) 550-99-03
Электронная почта: phann@roszdravnadzor.gov.ru
Сайт в информационно-телекоммуникационной сети «Интернет»: https://www.roszdravnadzor.gov.ru
Республика Беларусь
Республиканское Унитарное Предприятие «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь
Адрес: 220037, г. Минск, пер. Товарищеский, д. 2а
Тел.:+375 17 231-85-14
Факс.: +375 17 252-53-58
Электронная почта: rcpl@rceth.by
Сайт в информационно-телекоммуникационной сети «Интернет»: https://www.rceth.by
Республика Казахстан
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
Адрес: 010000, г. Астана, район Байконыр, ул. А. Иманова, д. 13
Телефон: +7 (7172) 235-135
Электронная почта: farm@dari.kz
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.ndda.kz
Республика Армения
«Центр экспертизы лекарств и медицинских технологий» ТИКО
Адрес: 0051, г. Ереван, проспект Комитаса, д. 49/5
Телефон: (+374 10) 20-05-05, (+374 96) 22-05-05
Электронная почта: info@ampra.am, vigilance@pharm.am
Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.pharm.am
Кыргызская Республика
Департамент лекарственных средств и медицинских изделий при Министерстве здравоохранения Кыргызской Республики
Адрес: 720044, г. Бишкек, ул. 3-линия, д. 25
Телефон: 0800-800-26-26, + 996 (312) 21-92-78
Электронная почта: pharm@dlsmi.kg
Сайт в информационно-телекоммуникационной сети «Интернет»:
https://dlsmi.kg/ru/registration/
4.9. Передозировка
Симптомы
В клинических исследованиях применялись дозы до 4 мг с интервалом 1 месяц, наблюдались отдельные случаи передозировки при применении дозы 8 мг.
Передозировка с введением большего объёма раствора может приводить к повышению внутриглазного давления (см. разделы 4.2. и 4.4.).
Лечение
В случае передозировки следует контролировать внутриглазное давление, при необходимости лечащий врач должен начать адекватную терапию по его коррекции (см. раздел 6.6.).
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: Средства, применяемые в офтальмологии; средства, применяемые при заболеваниях сосудистой оболочки глаза; средства, препятствующие неоваскуляризации.
Код ATX: S01LA05.
Препарат Континия является биоаналогом (биоподобным лекарственным препаратом).
Механизм действия
Афлиберцепт — это рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов человеческих рецепторов VEGF 1 (VEGFR-1) и 2 (VEGFR-2), соединённых с Fc-фрагментом человеческого иммуноглобулина G (IgGl).
Афлиберцепт производится клетками К1 яичника китайского хомячка (ЯКХ; СНО) по технологии рекомбинантной ДНК.
Афлиберцепт действует как растворимый рецептор-ловушка, который связывает VEGF-A (сосудистый эндотелиальный фактор роста А) и P1GF (плацентарный фактор роста) с более высокой аффинностью, чем их естественные рецепторы, и, таким образом, может ингибировать связывание и активацию этих родственных VEGF рецепторов.
Фармакодинамические эффекты
VEGF-А и P1GF являются членами семейства VEGF ангиогенных факторов, которые обладают мощным митогенным, хемотаксическим действием в отношении клеток эндотелия и повышают проницаемость сосудов. VEGF действует через два типа тирозинкиназных рецепторов, VEGFR-1 и VEGFR-2, представленных на поверхности эндотелиальных клеток. P1GF связывается только с VEGFR-1, которые также присутствуют на поверхности лейкоцитов. Избыточная активация VEGF-А этих рецепторов может приводить к патологической неоваскуляризации и избыточной проницаемости сосудов. В этих процессах P1GF может проявлять синергизм с VEGF-А, а также стимулирует инфильтрацию лейкоцитов и сосудистое воспаление.
VEGF-А и P1GF являются членами семейства VEGF ангиогенных факторов, которые обладают мощным митогенным, хемотаксическим действием в отношении клеток эндотелия и повышают проницаемость сосудов. VEGF действует через два типа тирозинкиназных рецепторов, VEGFR-1 и VEGFR-2, представленных на поверхности эндотелиальных клеток. P1GF связывается только с VEGFR-1, которые также присутствуют на поверхности лейкоцитов. Избыточная активация VEGF-А этих рецепторов может приводить к патологической неоваскуляризации и избыточной проницаемости сосудов. В этих процессах P1GF может проявлять синергизм с VEGF-А, а также стимулирует инфильтрацию лейкоцитов и сосудистое воспаление.
Клиническая эффективность и безопасность
Неоваскулярная («влажная») форма возрастной макулярной дегенерации («влажная» форма ВМД)
«Влажная» форма ВМД характеризуется патологической неоваскуляризацией хориоидеи. Просачивание крови и жидкости из патологически неоваскуляризированной хориоидеи может вызвать утолщение центральной зоны сетчатки (ЦЗС) или отёк и/или кровоизлияния в сетчатку/субретинальное пространство, что приводит к снижению остроты зрения.
Безопасность и эффективность афлиберцепта при «влажной» форме ВМД оценивалась в двух рандомизированных многоцентровых двойных маскированных исследованиях с активным контролем VIEW1 и VIEW2. В этих исследованиях 2412 пациентов были рандомизированы в соотношении 1:1:1:1 на получение афлиберцепта (1817 пациентов) или ранибизумаба в следующих режимах:
- Афлиберцепт 2 мг каждые 8 недель после 3 первоначальных ежемесячных инъекций (афлиберцепт 2Q8);
- Афлиберцепт 2 мг каждые 4 недели (афлибергепт 2Q4);
- Афлиберцепт 0,5 мг каждые 4 недели (афлиберцепт 0,5Q4);
- Ранибизумаб 0,5 мг каждые 4 недели (ранибизумаб 0,5Q4).
В исследования были включены пациенты в возрасте от 49 до 99 лет, средний возраст составил 76 лет. Около 89 % пациентов (1616 из 1817), рандомизированных в группы афлиберцепта, были в возрасте 65 лет или старше, около 63 % (1139 из 1817) — в возрасте 75 лет или старше.
На втором году исследований пациенты продолжали получать препараты в той же дозе, которая была назначена им исходно, но в модифицированном режиме дозирования, который, согласно протоколу, основывался на результатах изменения остроты зрения и анатомических показателей, при этом максимальный интервал между инъекциями составлял не более 12 недель.
В обоих исследованиях первичной конечной точкой эффективности была доля пациентов, соответствовавших требованиям протокола, у которых поддерживалась острота зрения, что подразумевало потерю менее 15 букв по шкале ETDRS (Early Treatment Diabetic Retinopathy Study, Исследование раннего лечения диабетической ретинопатии (ДР)) на 52-й неделе по сравнению с исходным состоянием.
В исследовании VIEW1 на 52-й неделе острота зрения поддерживалась у 95,1 % пациентов, получавших препарат афлиберцепт 2 мг каждые 8 недель после 3 первоначальных ежемесячных инъекций, по сравнению с 94,4 % пациентов, получавших ранибизумаб 0,5 мг каждые 4 недели.
В исследовании VIEW2 на 52-й неделе острота зрения поддерживалась у 95,6 % пациентов, получавших афлиберцепт 2 мг каждые 8 недель после 3 первоначальных ежемесячных инъекций, по сравнению с 94,4 % пациентов, получавших ранибизумаб 0,5 мг каждые 4 недели.
В обоих исследованиях было показано, что афлиберцепт и ранибизумаб, применявшийся в дозе 0,5 мг каждые 4 недели, сопоставимы по клинической эффективности.
Подробное описание результатов анализа объединенных данных обоих исследований приведено в Таблице 1.
Таблица 1: Оценка эффективности на 52-й и 9б-й неделе; комбинированные данные исследований VIEW1 и VIEW2
| Оценка эффективности | Афлиберцепт 2 мг каждые 8 недель после 3 первоначальных ежемесячных инъекций (N=607) | Ранибизумаб 0,5 мг каждые 4 недели (N=595) | ||
| 52 неделя | 96 неделя | 52 неделя | 96 неделя | |
| Среднее число инъекций | 7,6 | 11,2 | 12,3 | 16,5 |
| Среднее число инъекций (недели 52–96) |
| 4,2 |
| 4,7 |
| Доля пациентов с потерей <15 букв с МКОЗ по сравнению с исходным состоянием | 95,33 % | 92,42 % | 94,42 % | 91,60 % |
| Среднее изменение МКОЗ, измеренной по шкале ETDRS по сравнению с исходным состоянием | 8,40 | 7,62 | 8,74 | 7,89 |
| Доля пациентов, прибавивших >15 букв по шкале ETDRS по сравнению с исходным состоянием | 30,97 % | 33,44 % | 32,44 % | 31,60% |
У пациентов, получавших терапию афлиберцептом (по одной инъекции каждые 8 недель после 3 первоначальных ежемесячных инъекций), толщина центральной зоны сетчатки (ТЦЗС) и средний размер области патологической неоваскуляризации уменьшились вскоре после начала лечения, что соответствует результатам, полученным при применении ранибизумаба в дозе 0,5 мг каждый месяц.
Достигнутое уменьшение размера зоны патологической неоваскуляризации и ТЦЗС оставалось стабильным на втором году исследований до последней оценки на 96-й неделе, при этом 2-4% пациентов требовались все инъекции на ежемесячной основе, а трети пациентов — по крайней мере одна инъекция с интервалом лечения один месяц.
В обоих исследованиях было отмечено уменьшение зоны патологической неоваскуляризации во всех группах с разными режимами дозирования.
Безопасность и эффективность применения афлиберцепта по схеме «лечить и увеличивать интервал» (с изменением интервала между инъекциями на 2 и 4 недели) при «влажной» форме ВМД оценивалась в многоцентровом рандомизированном открытом исследовании ALTAIR длительностью 96 недель у 247 пациентов из Японии, ранее не получавших терапию.
В исследовании все пациенты получали по 1 инъекции афлиберцепта 2 мг в течение трех последовательных месяцев, затем 1 инъекцию через 2 месяца. На 16-й неделе пациенты были рандомизированы в соотношении 1:1 на две группы для получения афлиберцепта по следующим схемам:
- «лечить и увеличить интервал» с изменением интервала на 2 недели;
- «лечить и увеличить интервал» с изменением интервала на 4 недели.
Интервалы между инъекциями увеличивали или уменьшали на основании критериев оценки остроты зрения и/или анатомических показателей, установленных протоколом исследования. Максимальный интервал между инъекциями в обеих группах составлял 16 недель.
Первичной конечной точкой эффективности являлось среднее изменение МКОЗ к 52-й неделе по сравнению с исходным состоянием. Вторичными конечными точками эффективности были доля пациентов со снижением остроты зрения менее чем на 15 букв, и доля пациентов, у которых МКОЗ увеличилась, по крайней мере, на 15 букв к 52-й неделе по сравнению с исходным состоянием.
На 52-й неделе улучшение зрения относительно исходного состояния составило в среднем +9,0 букв у пациентов в группе с изменением интервалов между инъекциями на 2 недели и +8,4 букв у пациентов в группе с изменением интервалов между инъекциями на 4 недели (разность средних значений изменения остроты зрения, выраженная в буквах и определённая методом наименьших квадратов (95 % ДИ): -0,4 (-3,8; 3,0), ковариационный анализ). Доли пациентов со снижением остроты зрения менее чем на 15 букв были сопоставимы в обеих группах (96,7 % в группе с изменением интервалов между инъекциями на 2 недели и 95,9 % в группе с изменением интервалов между инъекциями на 4 недели). Доля пациентов, у которых на 52-й неделе зрение улучшилось на 15 и более букв, составила 32,5% в группе с изменением интервалов между инъекциями на 2 недели и 30,9 % в группе с изменением интервалов на 4 недели. Доля пациентов, у которых интервал между инъекциями был увеличен до 12 недель или более, составила 42,3 % в группе с изменением интервалов между инъекциями на 2 недели и 49,6 % в группе с изменением интервалов между инъекциями на 4 недели. Кроме того, в группе с изменением интервала на 4 недели у 40,7 % пациентов интервалы между инъекциями были увеличены до 16 недель. На последнем визите (до 52-й недели включительно) было установлено, что у 56,8 % и 57,8 % пациентов в группах с изменением интервала на 2 и 4 недели соответственно, следующий интервал между инъекциями составляет 12 недель и более.
На 52-й неделе согласно данным оптической когерентной томографии (ОКТ) отмечалось среднее уменьшение ТЦЗС на -134,4 и -126,1 микрон у пациентов в группах с изменением интервалов между инъекциями на 2 и 4 недели соответственно; доли пациентов, у которых отсутствовала ретинальная жидкость на ОКТ, составили 68,3 % и 69,1 % соответственно.
Уменьшение ТЦЗС сохранялось в обеих группах и на втором году исследования ALTAIR. Улучшение зрения относительно исходного состояния поддерживалось до момента финальной оценки на 96-й неделе и составило в среднем +7,6 букв у пациентов в группе с изменением интервалов между инъекциями на 2 недели и +6,1 букв у пациентов в группе с изменением интервалов между инъекциями на 4 недели. Доля пациентов с увеличенными интервалами между инъекциями до 12 недель или более составила 56,9 % и 60,2 % соответственно, а на последнем визите, предшествующем 96-й неделе, было установлено, что у 64,9 % и 61,2 % пациентов (в группах с изменением интервала на 2 и 4 недели соответственно), следующий интервал между инъекциями составляет 12 недель или более. На втором году лечения пациенты в группах с изменением интервала на 2 и 4 недели получили в среднем 3,6 и 3,7 инъекций соответственно. За два года терапии пациенты получили в среднем 10,4 инъекции.
Применение афлиберцепта согласно схеме, использованной в исследовании ALTAIR, показало сопоставимые результаты с исследованиями VIEW1 и VIEW2.
Профиль безопасности в отношении офтальмологических и системных нежелательных явлений в исследовании ALTAIR был сопоставим с профилем безопасности, зарегистрированным в основных исследованиях VIEW1 и VIEW2.
Эффективность и безопасность применения афлиберцепта в режиме «лечить и увеличивать интервал», инициированном на первом году терапии (после 3 ежемесячных загрузочных инъекций и 1 инъекции через 2 месяца) в сравнении с таковым, инициированном после первого года лечения при «влажной» форме ВМД, оценивалось в многоцентровом рандомизированном открытом исследовании неменьшей эффективности и безопасности с активным контролем ARIES длительностью 104 недели у 269 пациентов, ранее не получавших терапию.
В рамках данного исследования также была проанализирована доля пациентов с потребностью в проведении более частых инъекций на основании решения исследователя. 62 пациента из 269 получали инъекции чаще, чем каждые 8 недель по крайней мере один раз в течение исследования. Такие пациенты оставались в исследовании и получали лечение в соответствии с клинической оценкой исследователя, но не чаще чем каждые 4 недели. Интервалы между инъекциями для этих пациентов в дальнейшем могли быть снова увеличены. Средний интервал между инъекциями после принятия решения о более частом введении афлиберцепта для таких пациентов составил 6,1 недели.
На 104-й неделе исследования у пациентов с потребностью в проведении более частых инъекций афлиберцепта по крайней мере один раз в течение исследования, ТЦЗС оставалась выше по сравнению с общей когортой, но среднее уменьшение ТЦЗС по сравнению с исходным составило -160,4 микрон, что было аналогично показателям пациентов, получавших препарат с интервалом между инъекциями каждые 8 недель и реже.
На 104-й неделе исследования у пациентов с потребностью в проведении более частых инъекций по крайней мере один раз в течение исследования МКОЗ была ниже по сравнению с пациентами, которым не требовалось увеличение интенсивности лечения. В данной подгруппе пациентов среднее изменение МКОЗ от исходного к концу исследования составило +2,3 ± 15,6 букв. Среди пациентов, получавших более частое лечение афлиберцептом. у 85,5 % пациентов отмечалось сохранение зрения, то есть отсутствие снижения остроты зрения на >15 букв; улучшение зрения на >15 букв отмечалось у 19,4 % пациентов.
Профиль безопасности у пациентов, у которых интервал между инъекциями препарата был короче, чем каждые 8 недель, был сопоставим с профилем безопасности в исследованиях VIEW1 и VIEW2.
Макулярный отёк, развившийся вследствие окклюзии центральной вены сетчатки (ОЦВС) или её ветвей (ОВЦВС)
При ОЦВС и ОВЦВС развивается ишемия сетчатки, что является сигналом к высвобождению VEGF, что, в свою очередь, приводит к дестабилизации плотных контактов и стимулирует пролиферацию эндотелиальных клеток. Повышенная экспрессия VEGF связана с такими осложнениями, как нарушение гематоофтальмического барьера, отёк сетчатки вследствие повышенной проницаемости сосудов, неоваскуляризация.
Безопасность и эффективность афлиберцепта оценивались в двух рандомизированных многоцентровых двойных маскированных контролируемых исследованиях COPERNICUS и GALILEO, включавших 358 пациентов с макулярным отёком, развившимся вследствие ОЦВС. В обоих исследованиях пациенты были рандомизированы в соотношении 3:2 для получения 2 мг афлиберцепта каждые 4 недели (217 пациентов) (группа афлиберцепта 2Q4), или в контрольную группу для получения имитаций инъекций каждые 4 недели в течение 6 месяцев.
В исследования были включены пациенты в возрасте от 22 до 89 лет, средний возраст составил 64 года. В исследованиях по показанию ОЦВС примерно 52 % пациентов (112 из 217), рандомизированных в группу афлиберцепта, были в возрасте 65 лет или старше, и примерно 18 % (38 из 217) — в возрасте 75 лет или старше.
После 6 последовательных ежемесячных инъекций пациенты продолжали получать лечение только в том случае, если они соответствовали заранее определённым критериям для продолжения терапии, за исключением пациентов контрольной группы в исследовании GALILEO, которые продолжали получать имитации инъекций до 52-й недели. С этого момента всем пациентам терапия проводилась в том случае, если они соответствовали заранее определённым критериям.
В обоих исследованиях первичной конечной точкой эффективности являлась доля пациентов, у которых МКОЗ увеличилась, по крайней мере, на 15 букв через 24 недели по сравнению с исходным состоянием. Вторичной конечной точкой было изменение остроты зрения на 24-й неделе по сравнению с исходным состоянием.
Различия между группами были статистически значимыми в пользу афлиберцепта в обоих исследованиях. Улучшение МКОЗ было достигнуто через 3 месяца с последующей стабилизацией остроты зрения и ТЦЗС до 6-го месяца. Статистически значимые различия сохранялись вплоть до 52-й недели.
Подробное описание результатов анализа обоих исследований приведено в Таблице 2.
Таблица 2: Оценка эффективности в исследованиях COPERNICUS и GALILEO на 24-й, 52й и 76/100-й неделе
| Оценка эффективности | Доля пациентов, прибавивших >15 букв по сравнению с исходным состоянием | Среднее изменение МКОЗ по шкале ETDRS по сравнению с исходным состоянием (СО1) | ||
| COPERNICUS | 24 недели | Контроль (N=73) | 12% | -4,0(18,0) |
| афлиберцепт 2 мг каждые 4 недели (N=l 14) | 56% | 17,3 (12,8) | ||
| 52 недели | Контроль2 (N=73) | 30% | 3,8(17,1) | |
| афлиберцепт 2 мг (N=l 14) | 55 % | 16,2 (17,4) | ||
| 100 недель | Контроль2,3 (N=73) | 23,3 % | 1,5(17,7) | |
| афлиберцепт3 2 мг (N=l 14) | 49,1 % | 13,0(17,7) | ||
| GALILEO | 24 недели | Контроль (N=68) | 22% | 3,3(14,1) |
| афлиберцепт 2 мг каждые 4 недели (N=103) | 60% | 18,0(12,2) | ||
| 52 недели | Контроль (N=68) | 32% | 3,8(18,1) | |
| афлиберцепт 2 мг (N=103) | 60% | 16,9(14,8) | ||
| 76 недель | Контроль4 (N=68) | 29,4 % | 6,2(17,7) | |
| афлиберцепт4 2 мг (N=103) | 57,3 % | 13,7(17,8) | ||
1 СО: стандартное отклонение
2 В исследовании COPERNICUS пациенты контрольной группы могли получать афлиберцепт по необходимости (PRN) каждые 4 недели в течение периода с 24 по 52 неделю, пациенты посещали врача каждые 4 недели.
3 В исследовании COPERNICUS и контрольная группа, и группа афлиберцепта 2 мг получали афлиберцепт 2 мг по необходимости (PRN) каждые 4 недели с 52 по 96 неделю: пациенты в обязательном порядке посещали врача каждый квартал, но при необходимости могли приходить на приём каждые 4 недели.
4В исследовании GALILEO с 52 по 68 неделю и контрольная группа, и группа афлиберцепта 2 мг получали афлиберцепт 2 мг по необходимости (PRN) каждые 8 недель, пациенты приходили на приём в обязательном порядке каждые 8 недель.
Безопасность и эффективность афлиберцепта оценивались в рандомизированном многоцентровом двойном маскированном контролируемом исследовании VIBRANT, включавшем 181 пациента с макулярным отёком, развившимся вследствие ОВЦВС, в том числе гемиретинальную ОЦВС. В данном исследовании пациенты были рандомизированы в соотношении 1:1 для получения афлиберцепта в дозе 2 мг каждые 8 недель после 6 первоначальных ежемесячных инъекций (91 пациент), или в группу пациентов, изначально получавших лазерную коагуляцию (группа активного контроля).
В исследование были включены пациенты в возрасте от 42 до 94 лет, средний возраст составил 65 лет. В исследовании по показанию ОВЦВС примерно 58 % пациентов (53 из 91), рандомизированных в группу афлиберцепта, были в возрасте 65 лет или старше, и примерно 23 % (21 из 91) — в возрасте 75 лет или старше.
Начиная с 12-й недели, пациенты группы активного контроля могли получать дополнительную лазерную коагуляцию, называемую «терапией спасения» с минимальным интервалом 12 недель. Начиная с 24-й недели, пациенты группы активного контроля, удовлетворяющие заранее определённым критериям, могли получать «терапию спасения» афлиберцептом в дозе 2 мг каждые 4 недели в течение 3 месяцев, затем каждые 8 недель. В исследовании VIBRANT первичной конечной точкой эффективности являлась доля пациентов, у которых МКОЗ увеличилась, по крайней мере, на 15 букв через 24 недели по сравнению с исходным состоянием, этот показатель в группе афлиберцепта превосходил показатель в группе активного контроля.
В исследовании VIBRANT вторичной конечной точкой было улучшение остроты зрения на 24-й неделе по сравнению с исходным состоянием, которое было статистически значимым в пользу афлиберцепта. Улучшение зрения происходило быстро и достигало максимального значения на 3-й месяц, с последующим сохранением достигнутых значений до 12-го месяца.
Начиная с 24-й недели, 67 пациентов группы активного контроля получали «терапию спасения» афлиберцептом (группа Активный контроль / афлиберцепт 2 мг), что привело к улучшению остроты зрения в среднем на 5 букв с 24-й недели по 52-ю неделю.
Подробное описание результатов анализа исследования VIBRANT приведено в Таблице 3.
Таблица 3: Оценка эффективности в исследовании VIBRANT на 24-й и 52-й неделе
| Оценка эффективности | Доля пациентов, прибавивших >15 букв по сравнению с исходным состоянием | Среднее изменение МКОЗ по шкале ETDRS по сравнению с исходным состоянием (СО1) | |
| 24 недели | афлиберцепт 2 мг каждые 4 недели (N=91) | 52,7 % | 17,0(11,9) |
| Активный контроль (N=90) | 26,7 % | 6,9 (12,9) | |
| 52 недели | афлиберцепт 2 мг каждые 8 недель (N=91)2 | 57,1 % | 17,1(13,1) |
| Активный контроль / афлиберцепт 2 мг (N=90)3 | 41,1 % | 12,2(11,9) | |
1 СО: стандартное отклонение
2 Интервал лечения для всех пациентов группы афлиберцепт был увеличен до 8 недель в течение периода с 24-й по 48-ю неделю.
3Начиная с 24 недели, пациенты группы активного контроля, удовлетворяющие по крайней мере одному из заранее определённых критериев, могли получать «терапию спасения» афлиберцептом (всего 67 пациентов). Фиксированный режим «терапии спасения» афлиберцепт — афлиберцепт в дозе 2 мг каждые 4 недели в течение 3 месяцев, затем интравитреальные инъекции каждые 8 недель.
У пациентов, получивших 6 последовательных ежемесячных инъекций 2 мг афлиберцепта, отмечался стойкий, быстрый и выраженный морфологический ответ (измеряемый улучшением средних показателей ТЦЗС). На 24-й неделе уменьшение ТЦЗС статистически значимо превосходило таковое в контрольной группе во всех трех исследованиях (COPERNICUS (ОЦВС): -457 микрон относительно -145 микрон, GALILEO (ОЦВС): -449 микрон относительно -169 микрон, VIBRANT (ОВЦВС): -280 микрон относительно 128 микрон). Достигнутое уменьшение ТЦЗС сохранялось до конца каждого исследования: до 100 недель в исследовании COPERNICUS, до 76 недель в исследовании GALILEO и до 52 недель в исследовании VIBRANT.
Диабетический макулярный отёк (ДМО)
ДМО развивается вследствие ДР и характеризуется повышением проницаемости сосудов и повреждением капилляров сетчатки, что может привести к потере остроты зрения.
Безопасность и эффективность афлиберцепта у пациентов с ДМО оценивались в двух рандомизированных многоцентровых двойных маскированных исследованиях с активным контролем, VIVID-DME и VISTA-DME. Всего было рандомизировано 862 пациента, из них 576 пациентов были рандомизированы в группы афлиберцепта. В каждом исследовании пациенты были случайным образом распределены на три группы в соотношении 1:1:1:
- афлиберцепт 2 мг каждые 8 недель после 5 первоначальных ежемесячных инъекций;
- афлиберцепт 2 мг каждые 4 недели;
- лазерная коагуляция в макуле (активный контроль).
В исследования были включены пациенты в возрасте от 23 до 87 лет, средний возраст составил 63 года. В исследованиях III фазы по показанию ДМО примерно 47 % пациентов (268 из 576), рандомизированных в группы афлиберцепт, были в возрасте 65 лет или старше, и примерно 9 % (52 из 576) — в возрасте 75 лет или старше.
Большинство пациентов, включённых в оба исследования, имели диабет II типа.
Начиная с 24-й недели пациенты, удовлетворяющие заранее определённым пороговым значениям потери зрения, могли получать дополнительную терапию: пациенты в группах афлиберцепт могли получать лазерную коагуляцию, а пациенты ь контрольной группе — терапию афлиберцептом.
В обоих исследованиях первичной конечной точкой эффективности являлось среднее значение изменения МКОЗ на 52-й неделе по сравнению с исходным состоянием. Данный показатель в группах афлиберцепта 2 мг каждые 8 недель после 5 первоначальных ежемесячных инъекций и афлиберцепт 2 мг каждые 4 недели был статистически значимым и превосходил показатели в контрольной группе. Это преимущество сохранялось до 100-й недели.
Подробное описание результатов исследований VIVID-DME и VISTA-DME приведено в Таблице 4.
Таблица 4: Оценка эффективности на 52-й и 100-й неделе в исследованиях VIVID-DME и VISTA-DME
| Оценка эффективности | Среднее изменение МКОЗ по шкале ETDRS по сравнению с исходным состоянием | Доля пациентов, прибавивших >15 букв по сравнению с исходным состоянием | ||
| VIVID-DME
| 52 неделя | афлиберцепт 2 мг каждые 8 недель1 (N=135) | 10,7 | 33 % |
| афлиберцепт 2 мг каждые 4 недели (N=136) | 10,5 | 32% | ||
| Активный контроль (лазер) (N=132) | 1,2 | 9% | ||
| 100 неделя | афлиберцепт 2 мг каждые 8 недель 1 (N=135) | 9,4 | 31,1 % | |
| афлиберцепт 2 мг каждые 4 недели (N=136) | 11,4 | 38,2 % | ||
| Активный контроль (лазер) (N=132) | 0,7 | 12,1 % | ||
| VISTA-DME | 52 неделя | афлиберцепт 2 мг каждые 8 недель 1 (N=151) | 10,7 | 31 % |
| афлиберцепт 2 мг каждые 4 недели (N=154) | 12,5 | 42% | ||
| Активный контроль (лазер) (N=154) | 0,2 | 8% | ||
| 100 неделя | афлиберцепт 2 мг каждые 8 недель 1 (N=151) | И,1 | 33,1 % | |
| афлиберцепт 2 мг каждые 4 недели (N=154) | 11,5 | 38,3 % | ||
| Активный контроль (лазер) (N=154) | 0,9 | 13,0 % | ||
1 После 5 первоначальных ежемесячных инъекций
В исследованиях VIVID-DME и VISTA-DME 36 (9 %) и 197 (43 %) пациентов соответственно получали предшествующую анти-VEGF терапию, с периодом отмывки 3 месяца и более. Эффекты от лечения в подгруппах пациентов, получавших предварительную терапию ингибиторами VEGF, были схожими с эффектами, наблюдавшимися у пациентов, впервые получавших терапию ингибиторами VEGF. Пациенты с билатеральным поражением могли получать анти-VEGF терапию другого глаза, если лечащий врач считал это необходимым. В исследовании VISTA-DME 217 (70,7 %) пациентам, получавшим афлиберцепт, выполнялись инъекции афлиберцепта в оба глаза до 100-й недели; в исследовании V1V1D-DME 97 135.6 %) пациентам, получавшим афлиберцепт, выполнялись инъекции различных анти-VEGF препаратов в другой глаз. Показатели эффективности терапии в различных подгруппах (например, подгруппы пациентов, стратифицированных по возрасту, полу, расе, исходному уровню HbAlc, исходной остроте зрения, предшествующему назначению анти-VEGF терапии) были сопоставимы с показателями для общей популяции, как в отдельных исследованиях, так и в обобщённом анализе.
Вскоре после начала терапии у пациентов, получавших терапию афлиберцептом, наблюдался быстрый и выраженный ответ со стороны морфологических показателей (ТЦЗС, уровень по шкале оценки тяжести ДР (DRSS)). В исследованиях VIVID-DME и VISTA-DME среднее уменьшение ТЦЗС по сравнению с исходными показателями на 52-й неделе было статистически значимо более выраженным в группе афлиберцепта по сравнению с группой лазерной терапии: -192,4 микрон и -183,1 микрон в группе афлиберцепт 2 мг каждые 8 недель после 5 первоначальных ежемесячных инъекций и -66,2 микрон и -73,3 микрон в группе лазерной терапии, соответственно.
В исследованиях VIVID-DME и VISTA-DME улучшение течения ДР на 2 и более уровня по шкале DRSS оценивалось предварительно установленным способом. У 73,7% и 98,3% пациентов в исследованиях VIVID-DME и VISTA-DME соответственно, была произведена оценка тяжести течения ДР по шкале DRSS. К 52-й неделе исследования улучшение течения ДР на 2 и более уровня по шкале DRSS наблюдалось у 27,7% и 29,1% пациентов при терапии афлиберцептом каждые 8 недель после 5 первоначальных ежемесячных инъекций и у 7,5% и 14,3% пациентов, получавших терапию лазером. На 100-й неделе исследований данный показатель составил 32,6% и 37,1% в группах афлиберцепта (проведение инъекций каждые 8 недель после 5 первоначальных ежемесячных инъекций) и 8,2% и 15,6% в контрольных группах.
В независимом сравнительном исследовании (DRCR.net Protocol Т) применялся гибкий режим дозирования, основанный на строгих критериях ОКТ и изменениях зрения при повторном лечении. В группе лечения афлиберцептом (224 пациента) результатом такого режима лечения являлось получение пациентами в среднем 9,2 инъекций, что сопоставимо с полученным количеством инъекций в группах афлиберцепт 2 мг каждые 8 недель после 5 первоначальных ежемесячных инъекций в исследованиях VIVID-DME и VISTA-DME. Общая эффективность в группе лечения афлиберцептом в исследовании Protocol Т была также сравнима с эффективностью в группах афлиберцепт 2 мг каждые 8 недель после 5 первоначальных ежемесячных инъекций в исследованиях VIVID-DME и VISTA-DME. В исследовании Protocol Т наблюдалось улучшение зрения в среднем на 13,3 букв, у 42 % зрение улучшилось по крайней мере на 15 букв по сравнению с исходным состоянием. Оценка безопасности показала, что общая частота встречаемости офтальмологических и неофтальмологических нежелательных явлений (включая АТС) была сопоставима во всех группах лечения в каждом исследовании и между исследованиями.
Эффективность афлиберцепта 2 мг у пациентов с ДМО в трех различных режимах дозирования после предшествующего лечения в фиксированном режиме (5 ежемесячных загрузочных инъекций с последующим введением каждые 2 месяца) в течение минимум 1 года оценивалась в рандомизированном многоцентровом открытом исследовании неменьшей эффективности с активным контролем VIOLET длительностью 100 недель.
В исследовании сравнивалась эффективность режимов применения афлиберцепта 2 мг «лечить и увеличивать интервал» (2Т&Е, минимальные интервалы между инъекциями составляли 8 недель и постепенно увеличивались в зависимости от клинических и анатомических исходов) и применения афлиберцепта 2 мг, вводимого по необходимости (pro re nata) (2PRN, пациенты наблюдались каждые 4 недели и получали инъекции по
необходимости в зависимости от клинических и анатомических исходов ), с режимом введения афлиберцепта 2 мг каждые 8 недель (2Q8) в течение второго и третьего года терапии.
Рекомендуемый шаг увеличения интервалов между инъекциями в исследовании составил 2 недели. В группе 2Т&Е решение об увеличении и уменьшении интервалов между инъекциями оставалось на усмотрение исследователя.
Первичной конечной точкой эффективности являлось изменение МКОЗ к 52-й неделе по сравнению с исходным. Данный показатель составил 0,5 ± 6,7 буквы в группе 2Т&Е и 1,7 ± 6,8 буквы в группе 2PRN по сравнению с 0,4 ± 6,7 буквы в группе 2Q8, достигнув статистически неменьшей эффективности (р <0,0001 для обеих групп; NI в пределах 4 букв). Значения изменения МКОЗ на 100-й неделе по сравнению с исходным уровнем соответствовали результатам 52й недели: -0,1 ±9,1 букв в группе 2Т&Е и 1,8 ± 9,0 букв в группе 2PRN по сравнению с 0,1 ± 7,2 буквы в группе 2Q8.
Среднее количество инъекций за 100 недель исследования составило 12,3, 10,0 и 11,5 для 2Q8, 2Т&Е и 2PRN, соответственно.
На 52-й и 100-й неделе, то есть на втором и третьем году лечения, средние изменения ТЦЗС были сопоставимы для режимов введения препарата «лечить и увеличивать интервал» (2Т&Е), режима введения препарата по необходимости (2PRN) и режима 2Q8, соответственно, -2,1, 2,2 и -18,8 микрон на 52-й неделе и 2,3,-13,9 и -15,5 микрон на 100-й неделе.
Профиль безопасности в отношении офтальмологических и системных нежелательных явлений трех режимов дозирования был сопоставим с профилем безопасности, отмеченным в регистрационных исследованиях VIVID и VISTA.
Миопическая хориоидальная неоваскуляризация (миопическая ХНВ)
Миопическая ХНВ является частой причиной потери зрения у взрослых с патологической миопией. Она проявляется возникновением «лаковых трещин», являющихся следствием разрывов мембраны Бруха, и представляет собой наиболее угрожающее зрению явление при патологической миопии. Безопасность и эффективность афлиберцепта у ранее не получавших лечение пациентов с миопической ХНВ оценивались в рандомизированном многоцентровом двойном маскированном контролируемом исследовании MYRROR. Пациенты были рандомизированы в соотношении 3:1 для получения 2 мг афлиберцепта интравитреально или для получения имитаций инъекций единожды в начале исследования с дополнительными инъекциями в случае сохранения заболевания или рецидива до 24-й недели. Начиная с 24-й недели пациенты, получавшие имитации инъекций, могли получить первую дозу афлиберцепта. Затем пациенты обеих групп могли получать дополнительные инъекции в случае сохранения заболевания или рецидива.
Всего лечение и оценка эффективности были проведены у 121 пациента, из них 90 пациентов получали афлиберцепт. В исследование были включены пациенты в возрасте от 27 до 83 лет, средний возраст составил 58 лет. В исследовании по показанию миопическая ХНВ примерно 36 % (33 из 91) пациентов, рандомизированных в группу афлиберцепта, были в возрасте 65 лет или старше, и примерно 10 % (9 из 91) — в возрасте 75 лет или старше.
Различия между группами были статистически значимыми в пользу афлиберцепта по первичной конечной точке (изменение МКОЗ) и подтверждающими по вторичной конечной точке (доля пациентов, у которых МКОЗ увеличилась не менее чем на 15 букв) на 24-й неделе по сравнению с исходным состоянием. Различия по обеим конечным точкам сохранялись до 48-й недели.
Подробное описание результатов исследования MYRROR приведено в Таблице 5.
Таблица 5: Оценка эффективности на 24-й неделе (первичный анализ) и 4о-й неделе в исследовании MYRROR
| Оценка эффективности | MYRROR | |||
| 24 неделя | 48 неделя | |||
| Афлиберцепт 2 мг (N=90) | Имитация инъекции (N=31) | Афлиберцепт 2 мг (N=90) | Имитация инъекции /афлиберцепт 2 мг (N=31) | |
| Среднее изменение МКОЗ по шкале ETDRS по сравнению с исходным состоянием (СО1) | 12,1 (8,3) | -2,0 (9,7) | 13,5 (8,8) | 3,9(14,3) |
| Доля пациентов, прибавивших >15 букв по шкале ETDRS по сравнению с исходным состоянием | 38,9 % | 9,7 % | 50,0 % | 29,0 % |
1СО: стандартное отклонение.
В исследовании MYRROR у пациентов, получавших терапию афлиберцептом (одна инъекция в начале терапии, с дополнительными инъекциями в случае сохранения заболевания или рецидива), ТЦЗС уменьшилась вскоре после начала лечения, на 24-й неделе было статистически значимо превосходящим в группе афлиберцепта (-79 и -4 микрон для группы афлиберцепта 2 мг и контрольной группы, соответственно) и сохранялось до 48-й недели. Кроме того, снизился средний размер поражения ХНВ.
5.2. Фармакокинетические свойства
Афлиберцепт вводится непосредственно в стекловидное тело для оказания локального воздействия.
Абсорбция
После интравитреального введения афлиберцепт медленно всасывается в системный кровоток, где обнаруживается в основном в виде неактивного стабильного комплекса с VEGF; при этом только свободный афлиберцепт может связывать эндогенный VEGF.
В исследовании фармакокинетики с частым отбором проб у 6 пациентов с неоваскулярной «влажной» формой ВМД максимальные плазменные концентрации свободного афлиберцепта (системная Cmax) в течение 1–3 дней после интравитреальной инъекции дозы 2 мг были низкими, в среднем примерно 0,02 мкг/мл (диапазон от 0 до 0,054), и были неопределимы через две недели после инъекции практически у всех пациентов. Афлиберцепт не кумулирует в плазме крови при интравитреальном введении каждые 4 недели.
Распределение
Средние максимальные плазменные концентрации свободного афлиберцепта примерно в 50500 раз ниже, чем концентрации, необходимые для ингибирования биологической активности VEGF в системном кровотоке на 50 % на животных моделях, у которых изменения артериального давления наблюдались после достижения концентрации свободного афлиберцепта в системном кровотоке около 10 мкг/мл, давление возвращалось к нормальным значениям при снижении концентрации ниже 1 мкг/мл. Ожидается, что средняя плазменная концентрация свободного афлиберцепта после интравитреальной инъекции 2 мг афлиберцепта пациентам будет более чем в 100 раз ниже, чем концентрация афлиберцепта, необходимая для связывания половины системного VEGF (2,91 мкг/мл) у здоровых
добровольцев. Таким образом, развитие системных (фармакодинамических эффектов, таких как изменения артериального давления, маловероятно.
Величина средней Стах свободного афлиберцепта в плазме согласно результатам фармакокинетических дополнительных исследований с участием пациентов с ОЦВС, ОВЦВС, ДМО и миопической ХНВ находилась в диапазоне от 0,03 до 0,05 мкг/мл, индивидуальные значения не превышали 0,14 мкг/мл. Впоследствии плазменные концентрации свободного афлиберцепта снижались до значений ниже или близких к нижнему пределу количественного определения, как правило, в течение одной недели. По истечении 4 недель, перед следующим применением у всех пациентов концентрации были неопределяемы.
Биотрансформация
Поскольку Континия — белковый препарат, никаких исследований его метаболизма не проводилось.
Элиминация
Свободный афлиберцепт связывается с VEGF с образованием стабильного инертного комплекса. Ожидается, что, как и другие крупные белки, и свободный, и связанный афлиберцепт будет выводиться из организма путём протеолитического катаболизма.
Лица пожилого возраста
Соблюдение каких-либо специальных условий не требуется. Опыт применения у пациентов с ДМО старше 75 лет ограничен.
Почечная недостаточность
Никаких специальных исследований с участием пациентов с нарушенной функцией почек, получающих афлиберцепт, не проводилось.
Анализ фармакокинетических данных исследования VIEW2 показал, что у 40 % пациентов с нарушениями функции почек (24 % — лёгкой степени, 15 % — умеренной степени и 1 % — тяжёлой степени) после интравитреального введения каждые 4 или 8 недель различий в плазменных концентрациях активного вещества не отмечалось.
Схожие результаты были получены у пациентов с ОЦВС в исследовании GALILEO, у пациентов с ДМО в исследовании VIVID-DME и у пациентов с миопической ХНВ в исследовании MYRROR.
Дети
Афлиберцепт не применяется у данной группы пациентов по показаниям «влажная» форма ВМД, ОЦВС, ОВЦВС, ДМО и миопическая ХНВ.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1. Перечень вспомогательных веществ
Гистидин
Натрия хлорид
Сахароза
Полисорбат 20
Хлороводородная кислота (для коррекции pH)
Вода для инъекций.
6.2. Несовместимость
В связи с отсутствием исследований совместимости, данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
6.3.Срок годности (срок хранения)
18 месяцев.
6.4. Особые меры предосторожности при хранении
Хранить при температуре от 2 до 8 °C в оригинальной упаковке (пачке картонной) для защиты от света. Не замораживать.
Перед применением невскрытый флакон в оригинальной упаковке (пачке картонной) может храниться при температуре не выше 25 °C до 24 часов.
6.5. Характер и содержание упаковки
По 0,278 мл препарата* во флакон из стекла I гидролитического класса, укупоренный пробкой резиновой, с обкаткой колпачком алюминиево-пластиковым с контролем первого вскрытия.
На каждый флакон наклеивают этикетку самоклеящуюся.
*Препарат производится с избытком наполнения в целях обеспечения извлекаемого объёма не менее 0,1 мл.
1 флакон с препаратом вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом и игла, снабжённая фильтром для извлечения препарата из флакона, вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка и игла, снабжённая фильтром для извлечения препарата из флакона, вместе с листком-вкладышем — в пачке из картона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Или
1 флакон с препаратом в комплекте с иглой, снабжённой фильтром, для извлечения препарата из флакона, иглой для инъекций, шприцем — в контурной ячейковой упаковке из плёнки полимерной.
1 контурная ячейковая упаковка вместе с листком-вкладышем — в пачке из кантона. Для контроля первого вскрытия допускается нанесение этикеток самоклеящихся на клапаны пачки.
Каждый компонент расходных медицинских материалов (игла с фильтром, игла для инъекций, шприц) помещён в стерильную одноразовую упаковку.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Каждый флакон следует использовать только для одной интравитреальной инъекции.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг (эквивалентную 0,05 мл раствора для инъекции). Извлекаемый объём флакона — это объем, который может быть извлечён из флакона и не используется полностью. Лекарственный препарат производится с избытком наполнения в целях обеспечения извлекаемого объёма не менее 0,10 мл.
Перед применением следует внимательно осмотреть флакон. При нарушении целостности флакона, значительном изменении цвета, помутнении, обнаружении видимых частиц препарат нельзя применять, и он должен быть утилизирован.
Фильтровальная игла не должна использоваться для инъекций. Фильтровальная игла не пирогенна и не подлежит стерилизации методом автоклавирования. При нарушении целостности индивидуальной упаковки фильтровальную иглу применять нельзя. После использования фильтровальная игла утилизируется в контейнер для сбора отходов класса А (малоопасные отходы). Повторное использование фильтровальной иглы может привести к развитию инфекции или другого заболевания/поражения.
Для интравитреальной инъекции следует использовать иглу для инъекций.
Инструкции по использованию флакона:
| Удаляют пластиковый колпачок и дезинфицируют внешнюю часть резиновой пробки флакона. |
| |
| Присоединяют фильтровальную иглу к стерильному шприцу на 1 мл с люэровским наконечником. |
|
|
|
|
|
|
| Фильтровальную иглу вводят через центр пробки флакона до тех пор, пока она полностью не войдёт во флакон и её конец не коснётся края флакона. |
|
|
|
|
|
|
| Соблюдая правила асептики, извлекают содержимое флакона с препаратом Континия в шприц, немного наклоняя флакон для полного извлечения препарата. Для предотвращения попадания воздуха необходимо убедиться, что конец иглы погружен в жидкость. При отборе раствора продолжают наклонять флакон, следя за тем, чтобы конец иглы был погружен в жидкость. |
| |
| Убедившись, что шток поршня достаточно оттянут назад при заборе раствора из флакона, фильтровальную иглу полностью опустошают. | ||
| Фильтровальную иглу снимают и утилизируют. Примечание: фильтровальная игла не используется для интравитреальной инъекции. | ||
| Соблюдая правила асептики, иглу для инъекции плотно присоединяют к кончику шприца с люэровским наконечником. |
| |
| Держа шприц иглой вверх, проверяют раствор на наличие пузырьков. Если они имеются, осторожно встряхивают шприц, постукивая по нему пальцем до тех пор, пока все пузырьки не поднимутся наверх. |
| |
| Медленно надавливая на поршень так, чтобы его плоский край достиг метки 0,05 мл на шприце, удаляют все пузырьки и избыточный объём препарата. |
| |
Флакон предназначен только для однократного использования. Извлечение нескольких доз из одного флакона может привести к увеличению риска контаминации и последующему развитию инфекции. Весь оставшийся лекарственный препарат или отходы следует уничтожить в установленном порядке.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
АО «ГЕНЕРИУМ»,
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273
Тел.: +7 (49243) 72-5-20, 72-5-14
Адрес электронной почты: generium@generium.ru
7.1 Представитель держателя регистрационного удостоверения на территории Союза
Претензии потребителей направлять по адресу:
в Российской Федерации
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273
Тел.: +7 (49243) 72-5-20, 72-5-14
Адрес электронной почты: generium@generium.ru
в Республике Беларусь
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Заводская, стр. 273
Тел.: 8-820-007-33338
Адрес электронной почты: generium@generium.ru
в Республике Казахстан
Республика Казахстан
ТОО «Карагандинский фармацевтический комплекс»
100009, г. Караганда, ул. Газалиева, стр. 16
Тел./факс: +7 (7212) 43 7002
Тел.: +7 (7212) 908042
Адрес электронной почты: kphk@kphk.kz
в Республике Армения
Республика Армения
ООО «Арго-Фарм»,
г. Ереван, ул. Сундукяна 13/9
Тел.: +374 (10) 744080, +374 (77)489875.
Адрес электронной почты: info@argopharm.am
в Кыргызской Республике:
Российская Федерация
АО «ГЕНЕРИУМ»
601125, Владимирская обл., район Петушинский, п. Вольгинский, ул. Заводская, стр. 273
Тел. +80033322274
Адрес электронной почты: generium@generium.ru
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ. ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации:
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
Общая характеристика лекарственного препарата Континия доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» https ://еес. eaunion.org/.
Форма выпуска
Раствор для внутриглазного введения, 40 мг/мл.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
ГЕНЕРИУМ, ЗАО, Российская Федерация
Генериум-Некст, ООО, Российская Федерация
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Континия: