Масиза
MasizaРегистрационный номер
Торговое наименование
Масиза
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
В 1 мл препарата содержится:
действующее вещество: лираглутид 6 мг (в одной предварительно заполненной шприц-ручке объёмом 3 мл содержится 18 мг лираглутида);
вспомогательные вещества: пропиленгликоль, натрия гидрофосфата дигидрат, фенол, хлористоводородной кислоты раствор 0,2М или натрия гидроксида раствор 1М (для коррекции pH), вода для инъекций.
Описание
Прозрачная или опалесцирующая бесцветная или слегка жёлтая жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Лираглутид представляет собой ацилированный аналог человеческого ГПП-1, произведённый методом биотехнологии рекомбинантной ДНК с использованием штамма E.coli, имеющий 97 % гомологичности аминокислотной последовательности эндогенному человеческому ГПП-1, который, в свою очередь, связывается и активирует рецептор ГПП- 1 (ГПП-1 Р). Лираглутид устойчив к метаболическому распаду, период его полувыведения из плазмы после подкожного введения составляет 13 ч. Фармакокинетический профиль лираглутида, позволяющий вводить его пациентам 1 раз в сутки, является результатом самоассоциации, в результате которой происходит замедленное всасывание препарата; связывания с белками плазмы; а также устойчивости дипептидилпептидазеЛ (ДППЛ) и нейтральной эндопептидазе (НЭП).
ГПП-1 является физиологическим регулятором аппетита и потребления пищи, а ГПП-1 Р расположены в нескольких областях головного мозга, участвующих в процессах регуляции аппетита. В исследованиях на животных периферическое введение лираглутида приводило к захвату препарата в специфических областях головного мозга, включая гипоталамус, где лираглутид посредством специфической активации рецепторов ГПП-1Р усиливал сигналы насыщения и ослаблял сигналы голода, тем самым приводя к уменьшению массы тела.
Рецепторы ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек. В экспериментах на мышах с атеросклерозом лираглутид предупреждал дальнейшее развитие аортальных бляшек и снижал в них воспаление. В дополнение, лираглутид оказывал благоприятный эффект на липиды в плазме. Лираглутид не уменьшал размер уже существующих бляшек.
Лираглутид уменьшает массу тела у человека преимущественно посредством уменьшения массы жировой ткани. Уменьшение массы тела происходит за счёт уменьшения потребления пищи. Лираглутид не увеличивает 24-часовой расход энергии. Лираглутид регулирует аппетит при помощи усиления чувства наполнения желудка и насыщения, одновременно ослабляя чувство голода и уменьшая предполагаемое потребление пищи.
Лираглутид стимулирует секрецию инсулина и уменьшает неоправданно высокую секрецию глюкагона глюкозозависимым образом, а также улучшает функцию бета-клеток поджелудочной железы, что приводит к снижению концентрации глюкозы натощак и после приёма пищи. Механизм снижения концентрации глюкозы также включает небольшую задержку опорожнения желудка.
В долгосрочных клинических исследованиях (КИ) с участием пациентов с избыточной массой тела и ожирением применение лираглутида в сочетании с низкокалорийной диетой и усиленной физической активностью приводило к значительному снижению массы тела.
Влияние на аппетит, потребление калорий и расход энергии, опорожнение желудка и концентрацию глюкозы натощак и после приёма пищи
Фармакодинамические эффекты лираглутида изучались в пятинедельном фармакологическом КИ с участием 49 пациентов с ожирением (индекс массы тела (ИМТ) 3040 кг/м2) без сахарного диабета (СД).
Аппетит, потребление калорий и расход энергии
Считается, что снижение массы тела при применении лираглутида связано с регулированием аппетита и количества потребляемой пищи. Аппетит оценивали перед и в течение 5 ч после стандартизированного завтрака; неограниченное потребление пищи оценивали во время последующего обеда. По сравнению с плацебо лираглутид увеличивал чувство насыщения и наполнения желудка после приёма пищи и уменьшал чувство голода и оценочное количество предполагаемого потребления пищи, а также
уменьшал неограниченное потребление пищи. При оценке с помощью респираторной камеры не было отмечено связанного с терапией увеличения 24-часового расхода энергии.
Опорожнение желудка
Применение лираглутида приводило к небольшой задержке опорожнения желудка в течение первого часа после приёма пищи, в результате чего уменьшалась скорость повышения концентрации глюкозы, а также общая концентрация глюкозы в крови после приёма пищи.
Концентрации глюкозы, инсулина и глюкагона натощак и после приёма пищи
Концентрации глюкозы, инсулина и глюкагона натощак и после приёма пищи оценивали перед и в течение 5 ч после стандартизированного приёма пищи. По сравнению с плацебо, лираглутид уменьшал концентрацию глюкозы натощак и после приёма пищи (AUС0–60 мин) в течение первого часа после приёма пищи, а также уменьшал 5-часовую AUCглюкозы и нарастающую концентрацию глюкозы (AUС0–300 мин). Кроме того, по сравнению с плацебо лираглутид уменьшал постпрандиальные концентрации глюкагона (AUС0–300 мин) и инсулина (AUС0–60 мин) и нарастающую концентрацию инсулина (AUС0–60 мин) после приёма пищи.
Концентрации глюкозы и инсулина натощак и нарастающие концентрации глюкозы и инсулина также оценивали во время перорального теста толерантности к глюкозе (ПТТГ) с 75 г глюкозы до начала терапии и через 1 год терапии у 3731 пациента с избыточной массой тела и с ожирением, а также с наличием или отсутствием преддиабета. По сравнению с плацебо лираглутид уменьшал концентрацию натощак и нарастающую концентрацию глюкозы. Эффект был более выраженным у пациентов с преддиабетом. Кроме того, по сравнению с плацебо лираглутид уменьшал концентрацию инсулина натощак и увеличивал нарастающую концентрацию инсулина.
После 160 недель продолжающейся терапии лираглутидом 3,0 мг AUC глюкозы плазмы снизилась, в то время как при применении плацебо оставалась неизменной. Дополнительно AUC инсулина оставалась относительно стабильной в течение 160- недельного периода лечения лираглутидом 3,0 мг, в то время как при применении плацебо наблюдалось её снижение. Все изученные эффекты от проводимой терапии были статистически значимыми в пользу лираглутида 3,0 мг.
Влияние на концентрацию глюкозы натощак и нарастающую концентрацию глюкозы у пациентов с сахарным диабетом 2 (СД2) типа с избыточной массой тела и ожирением
По сравнению с плацебо лираглутид снижал концентрацию глюкозы натощак и среднюю нарастающую постпрандиальную концентрацию глюкозы (через 90 минут после приёма пищи, среднее значение для 3-х приёмов пищи в сутки).
Функция бета-клеток поджелудочной железы
КИ продолжительностью до одного года с применением лираглутида у пациентов с избыточной массой тела, а также наличием или отсутствием СД продемонстрировали улучшение и сохранение функции бета-клеток поджелудочной железы. Это было показано с использованием таких методов измерения, как гомеостатическая модель оценки функции бета-клеток (HOMA-B) и соотношение концентраций проинсулина и инсулина.
Клиническая эффективность и безопасность
Эффективность и безопасность применения лираглутида для длительной коррекции массы тела в сочетании с низкокалорийной диетой и усилением физической активности была изучена в 4-х рандомизированных двойных слепых плацебо-контролируемых исследованиях 3 фазы SCALE включавших в общей сложности 5358 взрослых пациентов.
Масса тела
По сравнению с плацебо при применении лираглутида было достигнуто более выраженное снижение массы тела у пациентов с ожирением/ избыточной массой тела во всех исследованных группах, в том числе с наличием или отсутствием предиабета, СД2 и обструктивным апноэ во сне средней или тяжёлой степени. Кроме того, среди популяции исследования большая часть пациентов достигла снижения массы тела ≥5 % и ≥10 % при применении лираглутида по сравнению с плацебо. Значительное снижение массы тела наблюдалось также в КИ, в котором пациенты достигли среднего показателя снижения массы тела 6,0 % с помощью низкокалорийной диеты в течение 12 недель до начала лечения лираглутидом. В этом исследовании большее количество пациентов сохранили потерю массы тела, которая была достигнута до начала лечения лираглутидом по сравнении с плацебо (81,4 % и 48,9 %, соответственно).
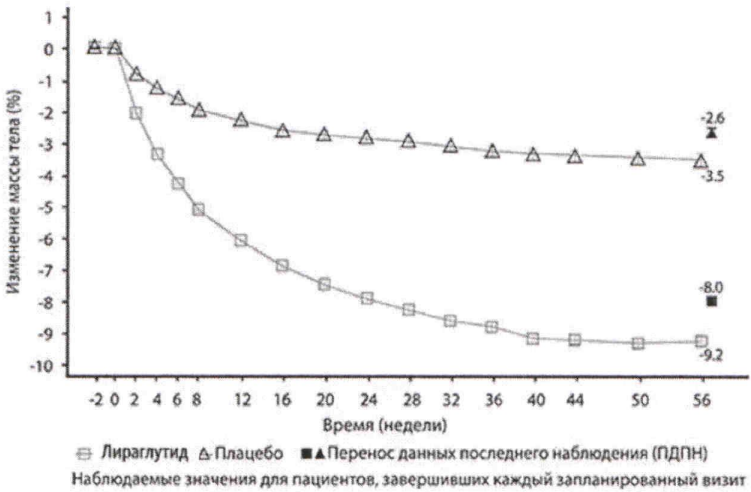
Рисунок 1. Изменение массы тела ( %) в динамике по сравнению с исходным значением у пациентов (0-56 недели).
В КИ длительностью 160 недель пациенты, получавшие лираглутид, достигли более значительной потери массы тела по сравнению с пациентами, получавшими плацебо. В основном потеря массы тела произошла в первый год и удерживалась на протяжении 160 недель.
В КИ длительностью 160 недель средний процент изменения массы тела и доля пациентов, достигших потери массы тела от исходного значения до 160 недели не менее чем на 5 % и более 10 %, были также значительными по сравнению с плацебо.
Снижение массы тела после 12 недель терапии лираглутидом (3,0 мг).
В двух исследованиях продолжительностью 56 недель после 12 недель терапии лираглутидом в дозе 3,0 мг 67,5 % и 50,4 % пациентов достигли снижения массы тела не менее чем на 5 %. Среднее снижение массы тела у этих пациентов, завершивших исследование, составило 11,2 % по сравнению с исходным значением. У пациентов, достигших снижения массы тела менее чем на 5 % после 12 недель терапии в дозе 3,0 мг и завершивших исследование (1 год), среднее снижение массы тела составило 3,8 %.
Контроль гликемии
Терапия лираглутидом существенно улучшала гликемические показатели в субпопуляциях с нормогликемией, предиабетом и СД2.
СД2 развился у 0,2 % пациентов, получавших лираглутид, по сравнению с 1,1 % в группе плацебо. У 69,2 % пациентов с предиабетом наблюдалось обратное развитие этого состояния при применении лираглутида по сравнению с 32,7 % в группе плацебо. На 160-й неделе при продолжении лечения диагноз СД2 был поставлен 3 % пациентов, получавшим лираглутид и 11 % пациентов, получавшим плацебо. По сравнению с плацебо время до развития СД2 при применении лираглутида 3,0 мг было в 2,7 раза больше, а относительный риск (ОР) развития СД2 при применении лираглутида равен 0,2. На 160-й неделе в группе лираглутида 3,0 мг у 65,9 % пациентов с предиабетом наблюдалось обратное развитие этого состояния до нормогликемии по сравнению с 36,3 % в группе плацебо.
В одном из исследований 69,2 % и 56,5 % пациентов с ожирением и СД2, получавших лираглутид, достигли целевого значения HbA1c <7 % и <6,5 %, соответственно, по сравнению с 27,2 % и 15,0 % у пациентов, получавших плацебо.
Кардиометаболические параметры
По сравнению с плацебо лираглутид значительно улучшал показатели систолического артериального давления (АД), окружности талии и концентрации липидов натощак.
В КИ длительностью 160 недель среднее уменьшение окружности талии составило 8,2 см при применении лираглутида и 4,0 см при применении плацебо; уменьшение показателей систолического и диастолического АД составило 4,3 мм рт. ст и 1,5 мм рт. ст при применении лираглутида и 2,7 мм рт. ст и 1,8 мм рт. ст при применении плацебо, соответственно; уменьшение концентрации холестерина ЛПНП составило 3,1 ммоль/л при применении лираглутида и 0.7 ммоль/л при применении плацебо; увеличение концентрации холестерина ЛПВП составило 2,3 ммоль/л при применении лираглутида и 0,5 ммоль/л при применении плацебо.
Индекс апноэ-гипноэ (ИАГ)
По сравнению с плацебо при применении лираглутида наблюдалось существенное снижение тяжести обструктивного апноэ во сне, которая оценивалась по изменению ИАГ относительно исходного значения.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела после терапии лираглутидом. В КИ у 2,5 % пациентов, получавших лираглутид, появились антитела. Образование антител не привело к снижению эффективности лираглутида.
Оценка сердечно-сосудистых событий
Большие сердечно-сосудистые события (БССС) были оценены группой внешних независимых экспертов и определены как инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода и смерть по причине сердечно-сосудистой патологии. В 5 двойных слепых контролируемых КИ П и Ш фазы с применением лираглутида было отмечено 6 БССС у пациентов, получавших лираглутид, и 10 БССС — у получавших плацебо пациентов. ОР с 95 % ДИ составил 0,33 при применении лираглутида по сравнению с плацебо. В КИ Ш фазы среднее увеличение частоты сердечных сокращений (ЧСС) составило 2,5 удара в минуту у пациентов, получавших лираглутид. Наибольшее увеличение ЧСС наблюдалось после 6 недель терапии. Это увеличение было обратимым и исчезало после прекращения терапии лираглутидом.
Было проведено многоцентровое, плацебо-контролируемое, двойное слепое КИ «Эффект и воздействие лираглутида при сахарном диабете: оценка сердечно-сосудистых рисков» (LEADER®). По сравнению с плацебо лираглутид 1,8 мг существенно снижал риск развития БССС (рисунок 2). ОР развития БССС был стабильно ниже 1 для всех трех сердечно-сосудистых событий.
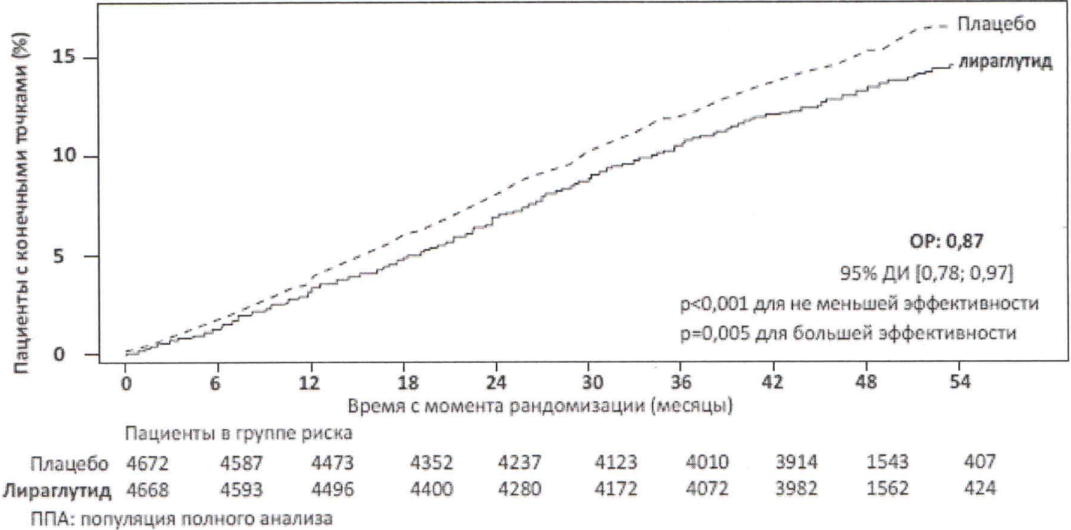
Рисунок 2. График Каплан-Мейера — время до возникновения первого БССС — Популяция полного анализа (ППА).
Лираглутид 1,8 мг существенно снижал риск развития расширенных БССС (первичные БССС, нестабильная стенокардия, приводящая к госпитализации, реваскуляция миокарда или госпитализация по причине сердечной недостаточности) и прочих вторичных конечных точек.
Дети и подростки
Европейское агентство лекарственных средств отложило обязательство по предоставлению результатов исследований лираглутида в одной или нескольких группах детей для лечения ожирения (см. Способ применения и дозы).
В двойном слепом КИ по сравнению эффективности и безопасности лираглутида относительно плацебо в отношении снижения массы тела у подростков в возрасте 12 лет и старше с ожирением лираглутид превосходил плацебо в снижении стандартного отклонения ИМТ (измеренного для оценки снижения массы тела) после 56 недель лечения. Большее количество пациентов достигло >5 % и >10 % снижения ИМТ на терапии лираглутидом, чем пациенты, получавшие плацебо, при более значительном снижении среднего ИМТ и массы тела. В течение 26 недель последующего наблюдения без применения препарата наблюдалось восстановление массы тела при применении лираглутида по сравнению с плацебо (оценивалось как изменение стандартного отклонения ИМТ).
Исходя из переносимости, для большинства пациентов (82,4 %) доза лираглутида была увеличена, и они продолжили получать дозу 3,0 мг, для остальных пациентов доза была увеличена, и они продолжили получать лираглутид в диапазоне доз от 2,4 мг до 0,6 мг.
После 56 недель терапии лираглутидом не было выявлено влияния на рост или половое развитие. Было проведено исследование с 16-недельным двойным слепым периодом и 36- недельным открытым периодом для оценки эффективности и безопасности лираглутида у детей и подростков с синдромом Прадера-Вилли и ожирением. В исследование были включены 32 пациента в возрасте от 12 до <18 лет (часть А) и 24 пациента в возрасте от 6 до <12 лет (часть В). Пациенты были рандомизированы в соотношении 2:1 для получения терапии лираглутидом или плацебо. У пациентов с массой тела менее 45 кг увеличение дозы начинали с более низкой дозы; 0,3 мг вместо 0,6 мг с повышением до максимальной дозы 2,4 мг.
Установленная разница средней оценки стандартного отклонения ИМТ (SDSHMT) после 16 недель (часть А: -0,20 против -0,13, часть В: -0,50 против -0,44) и после 52 недель (часть А -0,31 против -0,17, часть В: -0,73 против -0,67) была сопоставимой на терапии лираглутида и плацебо.
В ходе исследований не было выявлено никаких дополнительных рисков в отношении безопасности препарата.
Результаты определяемых пациентами показателей
Лираглутид по сравнению с плацебо улучшал определяемые пациентами оценки по нескольким показателям. Было отмечено значительное улучшение общей оценки по Упрощенному опроснику влияния массы тела на качество жизни (TWQoL-Lite) и по всем шкалам опросника для оценки качества жизни SF-36. что указывает на положительное влияние на физический и психологический компоненты качества жизни.
Фармакокинетика
Всасывание
Всасывание лираглутида после подкожного введения происходит медленно, время достижения максимальной концентрации (tmax) - около 11 ч после введения. У пациентов с ожирением (ИМТ 30–40 кг/м2) после введения лираглутида в дозе 3,0 мг средняя равновесная концентрация лираглутида (AUCt/24) достигает приблизительно 31 нмоль/л. В диапазоне доз от 0,6 мг до 3,0 мг экспозиция лираглутида увеличивается пропорционально дозе. Абсолютная биодоступность лираглутида после подкожного введения составляет приблизительно 55 %.
Распределение
Средний кажущийся объём распределения после подкожного введения лираглутида в дозе 3,0 мг составляет 20–25 л (у лиц с массой тела около 100 кг). Лираглутид в значительной степени связывается с белками плазмы крови (>98 %).
Метаболизм
На протяжении 24 ч после введения здоровым добровольцам однократной дозы [3H]-лираглутида главным компонентом в плазме оставался неизменённый лираглутид. Были обнаружены 2 метаболита (≤9 % и ≤5 % от уровня общей радиоактивности в плазме крови).
Элиминация
Лираглутид метаболизируется эндогенно подобно крупным белкам без участия какого- либо специфического органа в качестве основного пути выведения. После введения дозы [3H]-лираглутида неизменённый лираглутид не определялся в моче или кале. Лишь незначительная часть введённой радиоактивности в виде метаболитов лираглутида выводилась почками или через кишечник (6 % и 5 %, соответственно). Радиоактивные вещества выделяются почками или через кишечник, в основном, в течение первых 6–8 дней и представляют собой 3 метаболита.
Средний клиренс после подкожного введения 3,0 мг лираглутида составляет приблизительно 0,9–1,4 л/ч, период полувыведения составляет примерно 13 ч.
Особые группы пациентов
Пациенты пожилого возраста
Коррекция дозы с учётом возраста не требуется. Согласно результатам популяционного фармакокинетического анализа у пациентов с избыточной массой тела и ожирением в возрасте 18–82 лет возраст не оказывал клинически значимого влияния на фармакокинетику лираглутида при подкожном введении в дозе 3,0 мг.
Пол
Основываясь на данных популяционного фармакокинетического анализа, у женщин скорректированный по массе тела клиренс лираглутида после подкожного введения в дозе 3,0 мг на 24 % меньше, чем у мужчин. На основании данных по ответной реакции на воздействие препарата, коррекции дозы с учётом пола не требуется.
Этническая принадлежность
Согласно результатам популяционного фармакокинетического анализа, в который были включены данные исследований у пациентов с избыточной массой тела и ожирением европеоидной, негроидной, азиатской и латиноамериканской расовых групп, этническая принадлежность не оказывала клинически значимого влияния на фармакокинетику лираглутида при подкожном введении в дозе 3,0 мг.
Масса тела
Экспозиция лираглутида уменьшается при увеличении исходной массы тела. Применение лираглутида в дозе 3,0 мг ежедневно обеспечивает адекватную экспозицию в диапазоне массы тела 60–234 кг, согласно оценке ответной реакции на системную экспозицию препарата в клинических исследованиях. Экспозицию лираглутида у пациентов с массой тела больше 234 кг не изучали.
Пациенты с печёночной недостаточностью
Фармакокинетику лираглутида оценивали у пациентов с различной степенью нарушения функции печени в исследовании однократной дозы (0,75 мг). Наблюдалось снижение экспозиции лираглутида на 13–23 % у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести и значительное снижение экспозиции лираглутида (на 44 %) у пациентов с печёночной недостаточностью тяжёлой степени (>9 баллов по классификации Чайлд-Пью) в сравнении со здоровыми добровольцами.
Пациенты с почечной недостаточностью
В исследовании однократной дозы (0,75 мг) экспозиция лираглутида была меньше у пациентов с почечной недостаточностью по сравнению с лицами с нормальной функцией почек. Экспозиция лираглутида была меньше на 33 %, 14 %, 27 % и 26 %, соответственно, у пациентов с почечной недостаточностью лёгкой (клиренс креатинина (КК) 50–80 мл/мин), средней (КК 30–50 мл/мин), тяжёлой степени (КК <30 мл/мин) и у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе.
Дети и подростки
Фармакокинетические свойства лираглутида 3,0 мг оценивались в клинических исследованиях у подростков с ожирением в возрасте от 12 лет до 18 лет (134 пациента, масса тела 62–178 кг). Экспозиция лираглутида у подростков в возрасте от 12 до 18 лет была сопоставима с наблюдаемой у взрослых пациентов с ожирением.
Фармакокинетические свойства были также оценены в клиническом фармакологическом исследовании с участием детей с ожирением в возрасте от 7 лет до 11 лет (13 пациентов, масса тела 54–87 кг). Экспозиция лираглутида 3,0 мг у детей в возрасте от 7 лет до 11 лет была сопоставима с наблюдаемой у взрослых пациентов после поправки на массу тела.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В двухлетних исследованиях канцерогенности у крыс и мышей были выявлены опухоли С-клеток щитовидной железы, не приводившие к летальному исходу. Результаты, полученные в ходе исследований на грызунах, обусловлены тем, что грызуны проявляют особую чувствительность в отношении опосредуемого рецептором ГПП-1 не генотоксичного специфического механизма. Появления других новообразований, связанных с проводимой терапией, отмечено не было.
В исследованиях на животных не выявлено прямого неблагоприятного эффекта лираглутида на фертильность, но было отмечено незначительное увеличение частоты ранней эмбриональной смерти при применении самых высоких доз препарата.
У молодых крыс лираглутид вызывал задержку полового созревания как у самцов, так и у самок при клинически значимом воздействии. Эти задержки не повлияли на фертильность и репродуктивную способность обоих полов или на способность самок сохранять беременность.
Показания
Взрослые
Препарат Масиза показан в качестве дополнения к низкокалорийной диете и усиленной физической нагрузке для длительного применения с целью коррекции массы тела у взрослых пациентов с ИМТ:
- ≥30 кг/м2 (ожирение) или
- ≥27 кг/м2 до <30 кг/м2 (избыточная масса тела) при наличии хотя бы одного связанного с избыточной массой тела сопутствующего заболевания, такого как предиабет, сахарный диабет 2 типа, артериальная гипертензия, дислипидемия или синдром обструктивного апноэ во сне.
Подростки
Препарат Масиза может быть использован в качестве дополнения к здоровому питанию и усиленной физической нагрузке с целью коррекции массы тела у подростков в возрасте от 12 лет и старше с:
- массой тела свыше 60 кг и
- ожирением (ИМТ, соответствующий >30 кг/м2 для взрослых согласно международным пороговым значениям).*
* Пороговое значение ИМТ IOTF для ожирения в зависимости от пола в возрасте от 12 до 18 лет.
Таблица 1. Пороговое значение ИМТ IOTF для ожирения в зависимости от пола в возрасте от 12 до 18 лет
| Возраст (количество лет) | Индекс массы тела 30 кг/м2 | |
| Мужской пол | Женский пол | |
| 12 | 26,02 | 26,67 |
| 12,5 | 26,43 | 27,24 |
| 13 | 26,84 | 27,76 |
| 13,5 | 27,25 | 28,20 |
| 14 | 27,63 | 28,57 |
| 14,5 | 27,98 | 28.87 |
| 15 | 28,30 | 29,11 |
| 15,5 | 28,60 | 29,29 |
| 16 | 28,88 | 29,43 |
| 16,5 | 29,14 | 29,56 |
| 17 | 29,41 | 29,69 |
| 17,5 | 29,70 | 29,84 |
| 18 | 30,00 | 30,00 |
Противопоказания
- гиперчувствительность к лираглутиду или любому из вспомогательных веществ в составе препарата;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном; множественная эндокринная неоплазия 2 типа;
- тяжёлая депрессия, суицидальные мысли или поведение, в том числе в анамнезе.
- Противопоказано применение у следующих групп пациентов при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности: почечная недостаточность тяжёлой степени (КК < 30 мл/мин);
- печёночная недостаточность тяжёлой степени;
- детский возраст до 12 лет;
- подростки в возрасте от 12 до 18 лет с массой тела меньше или равной 60 кг;
- у пациентов в возрасте ≥75 лет;
- период беременности и грудного вскармливания;
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация));
- одновременное применение других препаратов для коррекции массы тела; применение в комбинации с другими агонистами рецепторов ГПП-1;
- вторичное ожирение на фоне эндокринологических заболеваний или расстройств пищевого поведения или на фоне применения лекарственных препаратов, которые могут привести к увеличению массы тела.
У пациентов с сахарным диабетом препарат Масиза не должен применяться в качестве заменителя инсулина.
Опыт применения лираглутида у пациентов с воспалительными заболеваниями кишечника и диабетическим парезом желудка ограничен. Применение лираглутида у таких пациентов не рекомендуется, поскольку оно связано с транзиторными нежелательными реакциями со стороны желудочно-кишечного тракта (ЖКТ), включая тошноту, рвоту и диарею.
С осторожностью
Препарат Масиза рекомендуется применять с осторожностью у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести, заболеваниями щитовидной железы и наличием острого панкреатита в анамнезе.
Применение при беременности и в период грудного вскармливания
Беременность
Данные по применению лираглутида у беременных женщин ограничены.
В исследованиях на животных была продемонстрирована репродуктивная токсичность. Потенциальный риск для человека неизвестен.
Применение препарата Масиза в период беременности противопоказано. При планировании или наступлении беременности терапию препаратом Масиза следует прекратить.
Период грудного вскармливания
Неизвестно, проникает ли лираглутид в грудное молоко у человека. В исследованиях на животных было продемонстрировано, что проникновение лираглутида и структурно близких метаболитов в грудное молоко является низким. В доклинических исследованиях было продемонстрировано связанное с терапией замедление роста новорождённых крысят, находящихся на грудном вскармливании. В связи с отсутствием опыта применения, препарат Масиза противопоказан во время грудного вскармливания.
Фертильность
За исключением незначительного уменьшения числа живых зародышей, результаты исследований на животных не указывают на наличие неблагоприятного влияния на фертильность.
Способ применения и дозы
Дозы
Взрослые
Начальная доза составляет 0,6 мг/сут. Дозу увеличивают до 3,0 мг/сут, прибавляя по 0,6 мг с интервалами не менее одной недели для улучшения желудочно-кишечной переносимости (см. таблицу 2). Если при увеличении дозы новая доза плохо переносится пациентом в течение 2 недель подряд, следует рассмотреть вопрос о прекращении терапии. Применение препарата в суточной дозе больше 3,0 мг не рекомендуется.
Терапию препаратом Масиза следует прекратить, если после 12 недель применения препарата в дозе 3,0 мг/сут потеря массы тела составила менее 5 % от исходного значения. Таблица 2. Схема увеличения дозы
|
| Доза | Недели |
| Увеличение дозы в течение 4 недель | 0,6 мг | 1 |
| 1,2 мг | 1 | |
| 1,8 мг | 1 | |
| 2,4 мг | 1 | |
| Терапевтическая доза | 3,0 мг | |
Подростки (>12 лет)
Для подростков в возрасте от 12 до 18 лет следует применять такой же режим увеличения дозы, как и для взрослых (см. таблицу 2). Дозу препарата следует увеличивать до тех пор, пока не будет достигнуто значение 3,0 мг (терапевтическая доза) или максимально переносимая доза. Применение препарата в суточной дозе больше 3,0 мг не рекомендуется.
Терапию препаратом Масиза следует прекратить и пересмотреть, если после 12 недель применения препарата в дозе 3,0 мг/сут или максимальной переносимой дозе пациенты потеряли менее 4 % от своего ИМТ или z-показателя ИМТ.
Пропущенная доза
Если после обычного времени введения дозы прошло менее 12 ч, пациент должен ввести дозу как можно быстрее. Если до обычного времени введения следующей дозы осталось менее 12 ч, пациент не должен вводить пропущенную дозу, а должен возобновить введение препарата со следующей запланированной дозы. Не следует вводить дополнительную или повышенную дозу для компенсации пропущенной дозы.
Пациенты с сахарным диабетом 2 типа
Препарат Масиза не следует применять в комбинации с другими агонистами рецепторов ГПП-1.
В начале терапии препаратом Масиза рекомендуется уменьшить дозу одновременно применяемого препарата инсулина или секретагогов инсулина (таких как препараты сульфонилмочевины) для уменьшения риска развития гипогликемии. Самоконтроль концентрации глюкозы крови может быть необходим для корректировки дозы инсулина или секретагогов инсулина (см. Особые указания).
Особые группы пациентов
Пациенты пожилого возраста (≥65 лет)
Не требуется коррекции дозы в зависимости от возраста. Опыт применения лираглутида у пациентов в возрасте ≥75 лет ограничен, применение препарата у этих пациентов не рекомендуется (см. Фармакокинетика и Противопоказания).
Пациенты с почечной недостаточностью
Не требуется коррекции дозы у пациентов с почечной недостаточностью лёгкой или средней степени (КК ≥30 мл/мин). Применение препарата Масиза у пациентов с почечной недостаточностью тяжёлой степени (КК <30 мл/мин), включая пациентов с терминальной стадией почечной недостаточности, противопоказано (см. Фармакокинетика и Противопоказания).
Пациенты с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести. Применение препарата Масиза у пациентов с печёночной недостаточностью тяжёлой степени противопоказано (см. Фармакокинетика и Противопоказания). У пациентов с печёночной недостаточностью лёгкой и средней степени тяжести препарат следует применять с осторожностью (см. Фармакокинетика и Противопоказания ).
Дети и подростки
Коррекции дозы для подростков и детей в возрасте от 12 лет и старше не требуется. Безопасность и эффективность препарата Масиза у детей младше 12 лет не установлены (см. Фармакокинетика).
Способ применения
Препарат Масиза предназначен только для подкожного введения. Его нельзя вводить внутривенно или внутримышечно.
Препарат Масиза вводят один раз в сутки в любое время, независимо от приёма пищи. Его следует вводить в область живота, бедра или плеча. Место и время инъекции могут быть изменены без коррекции дозы. Тем не менее, желательно делать инъекции примерно в одно и то же время суток после выбора наиболее удобного времени.
Следует постоянно менять места инъекций, чтобы уменьшить риск образования амилоидных отложений в месте инъекции (см. «Побочное действие»).
ИНСТРУКЦИЯ ДЛЯ ПАЦИЕНТОВ ПО ИСПОЛЬЗОВАНИЮ ШПРИЦ-РУЧКИ
Масиза
Внимательно прочитайте данную инструкцию перед использованием шприц-ручки Масиза.
Шприц-ручка Масиза содержит 18 мг лираглутида. Вы можете выбрать любую из пяти возможных доз: 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг или 3,0 мг.
Шприц-ручка Масиза разработана для использования с одноразовыми иглами длиной до 8 мм и толщиной до 32G (0,25/0,23 мм).
1. Подготовка шприц-ручки к инъекции
Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится лираглутид. Применение неправильного препарата может быть вредным для Вашего здоровья.
А Снимите колпачок со шприц-ручки.
В Проверьте, что раствор в Вашей ручке прозрачный, бесцветный или слегка желтоватый. Посмотрите в окно картриджа. Если раствор выглядит мутным, не используйте эту ручку.
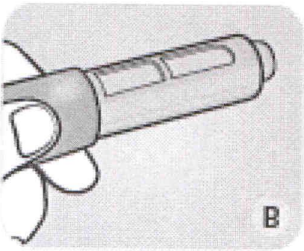
С Возьмите новую одноразовую иглу (иглы не входят в комплект препарата) и снимите с неё бумажную наклейку.
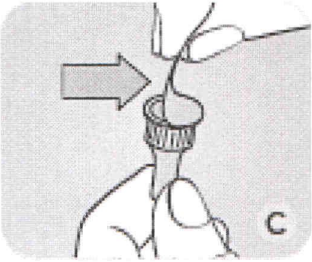
D Убедитесь, что игла прикручена верно к ручке: не снимая наружный колпачок иглы, аккуратно и плотно накрутите по часовой стрелке иглу на шприц-ручку
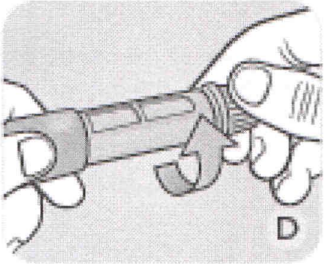
Е Игла имеет два колпачка. Вам необходимо снять оба колпачка. Если Вы забудете снять оба колпачка, Вы не сможете сделать инъекцию. Снимите наружный колпачок иглы и отложите его в сторону, не выбрасывая. Он Вам понадобится после инъекции, чтобы безопасно открутить игу от ручки.
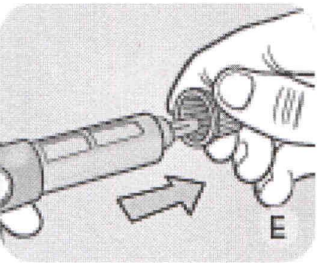
F Снимите внутренний колпачок иглы и выбросьте его.
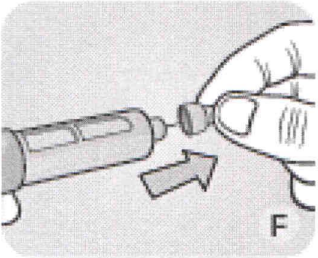
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Капля раствора может появиться на конце иглы. Это нормальное явление, но Вы все равно должны поверить работу новой шприц-ручки в первый раз.
Не накручивайте иглу на шприц-ручку до тех пор, пока Вы не готовы делать инъекцию.
При каждой инъекции всегда используйте новую иглу. Такая мера уменьшает риск загрязнения, инфицирования, вытекания препарата из шприц-ручки, закупоривания игл и гарантирует точность дозирования.
Обращайтесь с иглой аккуратно, чтобы не погнуть или не повредить её перед использованием.
Никогда не используйте погнутую или повреждённую иглу.
2. Проверка работы новой шприц-ручки
Всегда производите проверку' работы новой шприц-ручки, как показано ниже, прежде чем использовать новую шприц-ручку для инъекций.
Если Вы уже используете шприц-ручку, переходите к этапу 3 «Установка дозы».
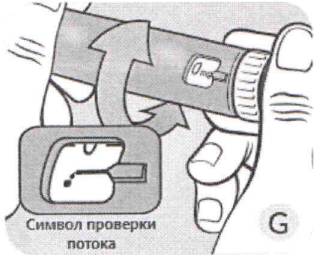
G Поворачивайте селектор дозы до тех пор, пока в индикаторном окошке символ проверки потока (.—) не встанет сразу после дозы «О». Убедитесь, что символ проверки потока находится напротив указателя дозы.
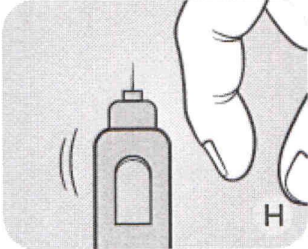
Н Держа шприц-ручку иглой вверх, несколько раз постучите по картриджу пальцем, чтобы пузырьки воздуха переместились в верхнюю часть картриджа.
I Удерживая шприц-ручку иглой вверх, нажимайте пусковую кнопку до тех пор, пока в индикаторном окошке напротив указателя дозы не появится 0 мг. «О» должен находиться напротив указателя дозы.
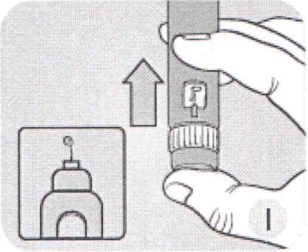
На конце иглы должна появиться капля препарата. Маленькая капля может оставаться на конце иглы, но она не будет введена Вам.
Если капля не появилась, повторяйте этап 2 «Проверка работы новой шприц-ручки» до тех пор, пока на конце иглы не появится капля лираглутида. Если после 6 повторов указанных операций капля препарата на конце иглы так и не появилась, поменяйте иглу на новую и повторите этап 2 «Проверка работы новой шприц-ручки» ещё раз.
Если капля препарата на конце иглы так и не появилась, это означает, что шприц-ручка неисправна, и Вы должны использовать новую шприц-ручку.
Всегда проверяйте наличие капли на конце иглы перед использованием новой шприц-ручки в первый раз. Это гарантирует наличие потока препарата. Если капля не появляется, Вы не сможете ввести лекарственный препарат, даже если счётчик дозы будет двигаться. Это может означать, что игла закупорена или повреждена.
Если Вы не проверили поток перед первой инъекцией препарата каждой шприц-ручки, Вы можете не получить назначенной дозы и ожидаемого эффекта от препарата Масиза.
3. Установка дозы
J Поворачивайте селектор дозы до тех пор, пока нужная доза (0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг или 3,0 мг) в индикаторном окошке не поравняется с указателем дозы (mg означает мг).
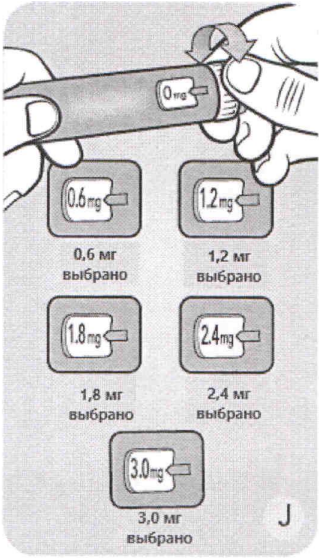
Исправить ошибочно установленную дозу можно путём вращения селектора дозы вперёд или назад до тех пор, пока цифры нужной Вам дозы в индикаторном окошке не поравняются с указателем дозы. Шприц-ручка может установить максимальную дозу в 3,0 мг.
Селектор дозы только меняет дозу. Количество установленных доз в мг показывают счётчик дозы и указатель дозы.
Вы можете выбрать до 3,0 мг в качестве дозы. Если селектор дозы остановился до того, как в индикаторном окошке напротив указателя дозы появилось 3,0 мг, это означает, что оставшегося в шприц-ручке лираглутида не хватает для введения полной дозы. Не считайте количество кликов ручки.
Всегда используйте счётчик дозы и указатель дозы, чтобы увидеть, сколько мг вы выбрали перед инъекцией препарата.
Не используйте шкалу картриджа. Она показывает приблизительное количество препарата, оставшегося в шприц-ручке.
Селектор дозы может установить только дозы 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг или 3,0 мг.
Установленная доза должна быть точно напротив указателя дозы для её корректного введения.
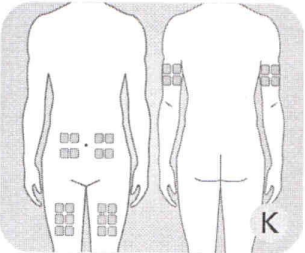
Выбор места введения препарата
К Указанные места (живот, передняя часть бедра или верхняя часть руки) являются наилучшим выбором для введения препарата. Отступите как минимум 5 см от пупка или имеющихся шрамов и синяков. Рекомендуется регулярно менять места для инъекций.
4.Введение препарата
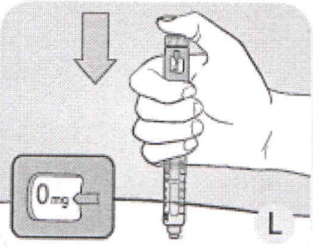
Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой.
L Убедитесь, что Вы видите счётчик дозы. Не закрывайте его пальцами, это может помешать инъекции.
Нажмите пусковую кнопку до упора и держите, пока в индикаторном окошке напротив указателя дозы не появится 0 мг. «О» должен быть напротив указателя дозы.
Продолжайте нажимать пусковую кнопку, при этом иглу оставляйте под кожей.
М Досчитайте медленно до 6, пока нажимаете пусковую кнопку.
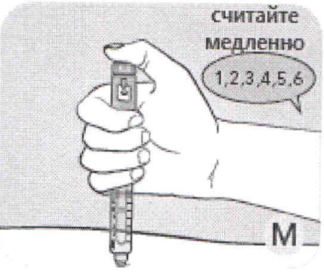
Если иглу извлечь быстрее, Вы можете увидеть струю препарата, выходящую из конца иглы. В этом случае полная доза не будет введена Вам.
N Извлеките иглу из-под кожи. Только после этого вы можете отпустить пусковую кнопку. Если в месте инъекции появилась капля крови, прижмите в этом месте спиртовую салфетку.
Вы можете увидеть каплю лираглутида на конце иглы. Это нормальное явление, которое никак не влияет на дозу препарата, которую Вы только что ввели.
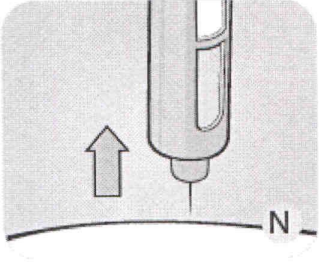
Всегда смотрите на счётчик дозы, чтобы знать, сколько мг вы вводите. Держите пусковую кнопку, пока счётчик дозы не покажет «О».
Как определить закупоренную или повреждённую иглу?
Если «О» не появился на счётчике дозы после продолжительного удерживания пусковой кнопки, используемая игла может быть закупорена или повреждена.
В этом случае Вы не получили никакой дозы препарата, даже если счётчик дозы передвинулся от изначального установленного значения.
Что делать при закупоренной игле?
Замените иглу, как указано в разделе 5 «Действия посоле инъекции» и повторите все этапы, начиная с этапа 1 «Подготовка шприц-ручки к инъекции». Убедитесь, что Вы выбрали полную дозу, которая Вам нужна.
Никогда не трогайте счётчик дозы во время инъекции. Это может помешать инъекции.
5. Действия после инъекции
О Всегда удаляйте иглу после каждой инъекции, чтобы обеспечить комфортное введение препарата и предотвратить закупоривание иглы. Если игла будет закупорена, Вы не сможете ввести препарат.
Введите конец иглы внутрь наружного колпачка иглы, не дотрагиваясь до иглы и колпачка.
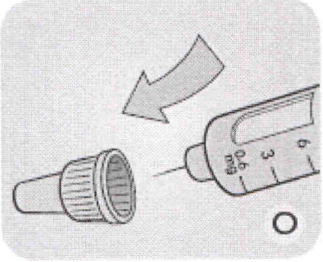
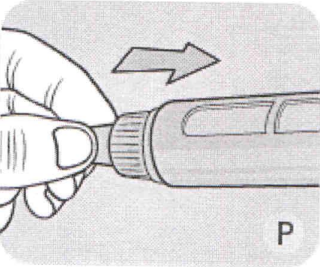
Р Когда игла полностью окажется внутри колпачка, осторожно наденьте колпачок. Затем открутите иглу, и выбросьте её, соблюдая меры предосторожности, в соответствии с инструкциями доктора, медсестры, фармацевта или местных властей.
Q Закрывайте шприц-ручку колпачком после каждого использования для защиты препарата от света.
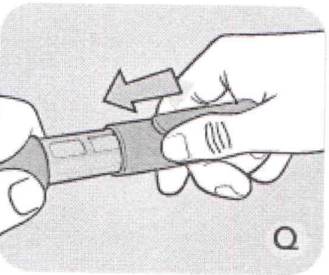
Если шприц-ручка пуста, выбросьте её без иглы, соблюдая меры предосторожности, в соответствии с инструкциями доктора, медсестры, фармацевта или местных властей.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Всегда удаляйте иглу после каждой инъекции. Это предотвратит закупоривание иглы, загрязнение, инфицирование, вытекание раствора и неточное дозирование препарата.
Другая важная информация
- Храните шприц-ручку в недоступном для всех, а в особенности для детей, месте.
- Не передавайте шприц-ручку и иглы другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы избежать случайных уколов и перекрёстного инфицирования.
Уход за шприц-ручкой
- Не оставляйте шприц-ручку в машине или другом месте, где может быть очень жарко или очень холодно.
- Не вводите препарат Масиза, если он был заморожен. Вы можете не получить желаемый эффект от препарата.
- Предохраняйте шприц-ручку от попадания пыли, загрязнений и всех видов жидкостей.
- Не погружайте шприц-ручку в жидкость, не мойте и не смазывайте её, так как это может повредить механизм. Шприц-ручку можно очищать тканью, смоченной мягким моющим средством.
- Не роняйте и не стучите Вашей шприц-ручкой по твёрдым поверхностям. Если Вы уронили шприц-ручку на твёрдую поверхность или у Вас появились сомнения в её полной исправности, прежде чем начать введение препарата, прикрепите новую одноразовую иглу и осуществите проверку работы шприц-ручки.
- Не пытайтесь самостоятельно наполнить шприц-ручку препаратом. Если шприц- ручка пуста, её необходимо выкинуть.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
Побочное действие
Безопасность лираглутида была оценена в 5 двойных слепых плацебо-контролируемых исследованиях, в которых приняли участие 5813 взрослых пациентов с ожирением или с избыточной массой тела и, как минимум, с одним связанным с избыточной массой тела сопутствующим заболеванием. В целом, нарушения со стороны ЖКТ являлись наиболее часто отмечаемыми нежелательным реакциями во время терапии лираглутидом (67,9 %) (см. Описание отдельных нежелательных реакций).
В таблице 3 представлен перечень нежелательных реакций, зарегистрированных в ходе исследований для взрослых пациентов. Нежелательные реакции распределены по группам в соответствии с системами органов MedDRA и частотой. Частота определена следующим образом: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10 000, но <1/1000), очень редко (<1/10 000), частота неизвестна (на основании имеющихся данных оценить невозможно).
| Класс систем органов в соответствии с MedDRA | Очень часто | Часто | Нечасто | Редко | Неизвестно |
|
| Нарушения со стороны иммунной системы |
|
|
| Анафилактические реакции |
|
|
| Нарушения метаболизма и питания |
| Гипогликемия* | Дегидратация |
|
|
|
| Психические нарушения |
| Бессонница** |
|
|
|
|
| Нарушения со стороны нервной системы | Головна я боль | Головокружение Дизгевзия |
|
|
|
|
| Нарушения со стороны сердца |
|
| Тахикардия |
|
|
|
| Нарушения со стороны ЖКТ | Тошнота Рвота Диарея Запор | Сухость во рту Диспепсия Гастрит Гастроэзофагеальна я рефлюксная болезнь Боли в верхней части живота Метеоризм Отрыжка Вздутие живота | Панкреатит*** Задержка опорожнения желудка**** |
| Кишечная непроходимость* |
|
| Нарушения со стороны печени и желчевыводящих путей |
| Холелитиаз*** | Холецистит*** |
| Холангит Холестатическа я желтуха |
|
| Нарушения со стороны кожи и подкожных тканей |
| Сыпь | Крапивница |
| Амилоидоз кожи |
|
| Нарушения со стороны почек и мочевыводящих путей |
|
|
| Острая почечная недостаточность Нарушение функции почек |
| |
| Общие расстройства и нарушения в месте введения |
| Реакции в месте введения Астения Утомляемость | Недомогание |
|
| |
| Лабораторные и инструментальные данные |
| Повышение активности липазы Повышение активности амилазы |
|
|
| |
*Гипогликемия (на основании отмеченных пациентами симптомов и не подтверждённая измерениями концентрации глюкозы в крови), отмеченная у пациентов без СД2, получавших лираглутид в сочетании с диетой и физическими нагрузками. Подробную информацию см. в Описание отдельных нежелательных реакций.
**Бессонницу отмечали во время первых 3-х месяцев терапии.
***см. Особые указания
****В соответствии с фазами 2, 3a и 3b контролируемого клинического исследования.
# HP из пост-регистрационных источников.
Описание отдельных нежелательных реакций
Гипогликемия у пациентов без СД2
В клинических исследованиях с участием пациентов с избыточной массой тела или ожирением без СД2, получавших терапию лираглутидом в сочетании с диетой и физическими нагрузками, тяжёлых гипогликемий (требующих оказания помощи третьим лицом) отмечено не было. О симптомах гипогликемии сообщали 1,6 % пациентов, получавших лираглутид, и 1,1 % пациентов, получавших плацебо; однако эти случаи не были подтверждены измерениями концентрации глюкозы крови. В большинстве случаев отмечалась лёгкая гипогликемия.
Гипогликемия у пациентов с СД 2
В клинических исследованиях с участием пациентов с избыточной массой тела или ожирением и СД2, получавших терапию лираглутидом в сочетании с диетой и физическими нагрузками, случаи тяжёлой гипогликемии (требующие оказания помощи третьим лицом) были отмечены у 0,7 % пациентов, получавших лираглутид, и только у пациентов, одновременно получавших терапию производными сульфонилмочевины. Также в этой группе пациентов подтверждённая гипогликемия была отмечена у 43,6 % пациентов, получавших лираглутид, и 27,3 % пациентов, получавших плацебо. Среди пациентов, не получавших одновременно препарат сульфонилмочевины, подтверждённая гипогликемия была отмечена у 15,7 % пациентов, получавших лираглутид, и у 7,6 % пациентов, получавших плацебо (концентрация глюкозы <3,9 ммоль/л в сочетании с симптомами).
Гипогликемия у пациентов с СД2, получающих инсулин
В клинических исследованиях с участием пациентов с избыточной массой тела или ожирением с СД2 типа, получавших терапию инсулином и лираглутидом 3,0 мг в сутки в сочетании с диетой и физическими нагрузками и до двух пероральных гипогликемических препаратов, тяжёлая гипогликемия (требующая оказания помощи третьим лицом) была отмечена у 1,5 % пациентов, получавших терапию лираглутидом 3,0 мг в сутки. В данном исследовании подтверждённая гипогликемия (определяемая как уровень глюкозы в плазме ≤3,9 ммоль/л, сопровождаемая симптомами) была зарегистрирована у 47,2 % пациентов, получавших терапию лираглутидом 3,0 мг в сутки, и у 51,8 % пациентов, получавших плацебо. Сообщалось о подтверждённых гипогликемических эпизодах среди пациентов, одновременно получавших производные сульфонилмочевины, у 60,9 % пациентов, получавших терапию лираглутидом 3,0 мг в сутки, и у 60,0 % пациентов, получавших плацебо.
Нежелательные реакции со стороны ЖКТ
Большинство реакций со стороны ЖКТ были лёгкой или средней степени тяжести, преходящими и, в большинстве случаев, не приводили к прекращению терапии. Реакции обычно возникали в первые недели терапии, и их проявления постепенно уменьшались в течение нескольких дней или недель при продолжении терапии.
У пациентов в возрасте ≥65 лет могут наблюдаться более выраженные проявления нежелательных реакций со стороны ЖКТ во время терапии лираглутидом.
У пациентов с почечной недостаточностью лёгкой или средней степени тяжести (КК ≥30 мл/мин) могут наблюдаться более выраженные проявления нежелательных реакций со стороны ЖКТ во время терапии лираглутидом.
Острая почечная недостаточность
У пациентов на терапии агонистом рецепторов ГПП-1 отмечались случаи острой почечной недостаточности. Большинство зарегистрированных случаев произошло у пациентов, которые испытывали тошноту, рвоту или диарею, приводившую к уменьшению объёма циркулирующей крови.
Аллергические реакции
В пострегистрационном периоде сообщалось о возникновении нескольких случаев анафилактических реакций с такими симптомами, как артериальная гипотензия, ощущение сердцебиения, одышка или периферические отёки. Анафилактические реакции потенциально могут быть угрожающими жизни. При подозрении на анафилактическую реакцию необходимо отменить терапию лираглутидом и не возобновлять лечение (см. Противопоказания).
Реакции в месте введения
Сообщалось о реакциях в месте введения у пациентов, получавших лираглутид. Эти реакции, как правило, были лёгкой степени, носили транзиторный характер и в большинстве случаев исчезали при продолжении терапии.
Амилоидоз кожи
В месте инъекции может возникнуть амилоидоз кожи (см. «Способ применения и дозы»).
Тахикардия
В клинических исследованиях тахикардия была отмечена у 0,6 % пациентов, получавших лираглутид, и у 0,1 % пациентов, получавших плацебо. Большинство реакций были лёгкой или средней степени тяжести. Реакции были единичными и в большинстве случаев проходили при продолжении терапии лираглутидом.
Дети и подростки
В клиническом исследовании, проведённом с участием подростков с ожирением в возрасте от 12 до 18 лет, 125 пациентов получали терапию лираглутидом в течение 56 недель.
В целом, частота развития, тип и степень тяжести нежелательных реакций у подростков с ожирением были сопоставимы с таковыми у взрослых пациентов. Рвота у подростков возникала в два раза чаще по сравнению со взрослыми пациентами.
Количество пациентов, сообщивших хотя бы об одном эпизоде клинически значимой гипогликемии, было выше в группе терапии лираглутидом (1,6 %) по сравнению с плацебо (0,8 %). Эпизодов тяжёлой гипогликемии в ходе исследования выявлено не было.
Передозировка
По данным клинических исследований и пострегистрационного применения лираглутида были зарегистрированы случаи передозировки при применении лираглутида в дозе до 72 мг (в 24 раза больше рекомендуемой дозы для коррекции массы тела). Пациенты отмечали сильную тошноту, сильную рвоту и тяжёлую гипогликемию.
В случае передозировки необходимо начать поддерживающую терапию в соответствии с клиническими признаками и симптомами.
Пациента следует наблюдать на предмет клинических признаков дегидратации и контролировать концентрацию глюкозы в крови.
Взаимодействие с другими лекарственными средствами
In vitro лираглутид показал очень низкую способность к лекарственному фармакокинетическому взаимодействию, обусловленному метаболизмом в системе цитохрома Р450 (CYP), а также связыванием с белками плазмы.
Небольшая задержка опорожнения желудка при применении лираглутида может влиять на всасывание одновременно применяемых препаратов для приёма внутрь. Исследования лекарственного взаимодействия не показали какого-либо клинически значимого замедления всасывания этих препаратов, поэтому коррекции дозы не требуется.
Исследования взаимодействия проводили с применением лираглутида в дозе 1,8 мг. Влияние на скорость опорожнения желудка было одинаковым при применении лираглутида в дозе 1,8 мг и 3,0 мг (AUC0–300 мин парацетамола). У нескольких пациентов, получавших лечение лираглутидом, отмечалось как минимум по одному эпизоду острой диареи. Диарея может оказывать влияние на всасывание пероральных лекарственных препаратов, которые применяются одновременно с лираглутидом.
Варфарин и другие производные кумарина.
Исследования по взаимодействию не проводились. Не может быть исключено клинически значимое взаимодействие с действующими веществами с низкой растворимостью или узким терапевтическим индексом, такими как варфарин. В начале лечения лираглутидом у пациентов, получающих варфарин или другие производные кумарина, рекомендуется чаще проводить мониторинг Международного нормализованного отношения (МНО).
Парацетамол (ацетаминофен)
Однократное применение парацетамола в дозе 1000 мг на фоне применения лираглутида не вызывает изменение системной экспозиции. Cmax парацетамола в плазме снизилась на 31 %, а среднее время достижения максимальной концентрации в плазме крови tmax увеличилось на 15 минут. При одновременном приёме лираглутида и парацетамола коррекция дозы последнего не требуется.
Аторвастатин
Однократное применение аторвастатина в дозе 40 мг на фоне использования лираглутида не вызывает изменения системной экспозиции. Таким образом, на фоне применения лираглутида коррекция дозы аторвастатина не требуется. Сmax аторвастатина в плазме снизилась на 38 %, а среднее значение tmax в плазме на фоне применения лираглутида увеличилось с 1 до 3 часов.
Гризеофульвин
Однократное применение гризеофульвина в дозе 500 мг на фоне применения лираглутида не вызывает изменения системной экспозиции. Cmax гризеофульвина возросла на 37 %, в то время как среднее значение tmax в плазме не изменилось. Коррекция дозы гризеофульвина и других лекарственных средств, имеющих низкую растворимость и высокую проницаемость, не требуется.
Дигоксин
При одновременном однократном введении дигоксина в дозе 1 мг и лираглутида отмечалось уменьшение площади под кривой AUC дигоксина на 16 %; Cmax дигоксина снизилась на 31 %. Среднее значение tmax дигоксина в плазме увеличилось с 1 до 1,5 ч. Исходя из полученных результатов, коррекция дозы дигоксина на фоне приёма лираглутида не требуется.
Лизиноприл
Однократное применение лизиноприла в дозе 20 мг на фоне применения лираглутида привело к уменьшению площади под кривой AUC лизиноприла на 15 % Cmax лизиноприла снизилась на 27 %. Среднее значение tmax лизиноприла в плазме на фоне приёма лираглутида увеличилось с 6 до 8 ч. Исходя из полученных результатов, коррекция дозы лизиноприла на фоне приёма лираглутида не требуется.
Пероральные контрацептивы
Cmax этинилэстрадиола и левоноргестрела после их однократного применения на фоне терапии лираглутидом снизилась на 12 % и 13 %, соответственно. Применение обоих препаратов вместе с лираглутидом сопровождалось увеличением tmax этих лекарственных средств на 1,5 часа. Клинически значимого эффекта на системную экспозицию этинилэстрадиола и левоноргестрела в организме лираглутид не оказывает. Таким образом, ожидаемый контрацептивный эффект обоих лекарственных средств на фоне терапии лираглутидом не изменяется.
Дети и подростки
Исследования взаимодействия были проведены только с участием взрослых.
Несовместимость
Лекарственные вещества, добавленные к препарату Масиза, могут вызвать разрушение лираглутида. В связи с отсутствием исследований совместимости данный лекарственный препарат нельзя смешивать с другими лекарственными препаратами.
Особые указания
Риск развития аспирации при проведении оперативных вмешательств под общей анестезией или глубокой седацией
Сообщалось о случаях аспирационной пневмонии у пациентов, получавших агонисты рецепторов ГПП-1 при проведении оперативных вмешательств под общей анестезией или глубокой седацией. Таким образом, следует учитывать повышенный риск присутствия остаточного желудочного содержимого из-за задержки опорожнения желудка перед выполнением процедуры под общим наркозом или глубокой седацией.
Контроль применения препарата
Для улучшения контроля применения биологического лекарственного препарата следует чётко указывать название и номер серии применяемого препарата.
Панкреатит
Применение агонистов рецепторов ГПП-1 ассоциировалось с риском развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Масиза должна быть немедленно прекращена; в случае подтверждения острого панкреатита терапию препаратом Масиза возобновлять не следует.
Реакции со стороны печени и желчевыводящих путей
При применении агонистов ГПП-1 Р возможно развитие желчекаменной болезни, холецистита, холангита и холестатической желтухи. При появлении абдоминальных симптомов, таких как боли в животе, следует принять соответствующие меры, например, при необходимости провести детальное обследование с целью выяснения причины с помощью визуализирующих диагностических методов и т.д.
Холелитиаз и холецистит
В клинических исследованиях была отмечена более высокая частота развития холелитиаза и холецистита у пациентов, получавших лираглутид. по сравнению с получавшими плацебо пациентами. Это может быть частично объяснено тем, что значительное снижение массы тела при применении лираглутида может увеличить риск развития холелитиаза и, следовательно, холецистита. Холелитиаз и холецистит могут привести к госпитализации и холецисэктомии. Пациенты должны быть проинформированы о характерных симптомах холелитиаза и холецистита.
Заболевания щитовидной железы
В ходе клинических исследований с участием пациентов с СД2 были отмечены со стороны щитовидной железы, включая увеличение концентрации кальцитонина в сыворотке крови, зоб и новообразования щитовидной железы, в особенности у пациентов, уже имеющих заболевания щитовидной железы. У пациентов с заболеваниями щитовидной железы препарат Масиза следует применять с осторожностью.
В постмаркетинговом периоде у пациентов, получавших терапию лираглутидом, были зарегистрированы случаи медуллярного рака щитовидной железы. Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения медуллярного рака щитовидной железы с применением лираглутида у 22 человека. Препарат Масиза противопоказан к применению у пациентов с медуллярным раком щитовидной железы в анамнезе, в том числе в семейном, и множественной эндокринной неоплазией 2 типа.
Необходимо проинформировать пациента о риске медуллярного рака щитовидной железы и о симптомах опухоли щитовидной железы (уплотнения в области шеи, дисфагия, одышка, непроходящая охриплость голоса).
Текущий контроль концентрации кальцитонина в сыворотке крови или ультразвуковое исследование (УЗИ) щитовидной железы не имеют существенного значения для раннего выявления медуллярного рака щитовидной железы у пациентов, применяющих препарат Масиза. Значительное повышение концентрации кальцитонина в сыворотке крови может свидетельствовать о наличии медуллярного рака щитовидной железы, пациенты с медуллярным раком щитовидной железы обычно имеют концентрацию кальцитонина более 50 нг/л. При выявлении повышения концентрации кальцитонина в сыворотке крови необходимо провести дальнейшее обследование пациента. Пациенты с узлами щитовидной железы, выявленными при медосмотре или при УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Тахикардия
В клинических исследованиях было отмечено увеличение частоты сердечных сокращений (см. Клиническая эффективность и безопасность). Следует проводить контроль частоты сердечных сокращений с интервалами, соответствующими обычной клинической практике. Пациентов следует проинформировать о симптомах тахикардии (ощущение сердцебиения в покое). У пациентов с клинически значимой постоянной тахикардией в состоянии покоя следует прекратить терапию препаратом Масиза.
Дегидратация
Признаки и симптомы дегидратации, включая нарушение функции почек и острую почечную недостаточность, были отмечены у пациентов, получавших терапию лираглутидом. Пациенты, получающие препарат Масиза, должны быть проинформированы о возможном риске обезвоживания в связи с нежелательными реакциями со стороны ЖКТ, и о необходимости профилактики гиповолемии.
Гипогликемия у пациентов с СД2
Риск развития гипогликемии может быть выше у пациентов с СД2, получающих лираглутид в комбинации с инсулином и/или производными сульфанилмочевины. Этот риск может быть уменьшен путём снижения дозы инсулина и/или производного сульфанилмочевины.
Дети и подростки
Сообщалось об эпизодах клинически значимой гипогликемии у подростков (>12 лет), получавших терапию лираглутидом. Пациенты должны быть проинформированы о характерных симптомах гипогликемии и соответствующих действиях.
Гипергликемия у пациентов с сахарным диабетом, получавших инсулин
У пациентов с СД препарат Масиза не должен применяться в качестве замены инсулина. Сообщалось о диабетическом кетоацидозе у инсулинозависимых пациентов после быстрой отмены или снижения дозы инсулина (см. Способ применения и дозы).
Вспомогательные вещества
Препарат Масиза содержит менее 1 ммоль (23 мг)/доза натрия, то есть, по сути, не содержит натрия.
Суицидальные мысли и поведение
В ходе клинических исследований 6 (0.23 %) из 3384 пациентов, получавших лираглутид, сообщили о появлении суицидальных мыслей, один из пациентов предпринял попытку суицида. У пациентов (1941 человек), получавших плацебо, это отмечено не было. Пациентов необходимо контролировать в отношении появления или ухудшения депрессии, суицидальных мыслей или поведения, и/или любых неожиданных изменений в настроении или поведении. У пациентов с суицидальными мыслями или поведением применение препарата Масиза следует прекратить.
Противопоказано применять препарат Масизы у пациентов с суицидальными попытками или активными суицидальными мыслями в анамнезе.
Рак молочной железы (РМЖ)
В ходе клинических исследований сообщалось о подтверждённом РМЖ у 14 (0,6 %) из 2379 женщин, получавших лираглутид, по сравнению с 3 (0,2 %) из 1300 женщин, получавших плацебо, включая инвазивный рак (11 случаев у женщин, получавших лираглутид, и 3 случая у женщин, получавших плацебо) и внутрипротоковая карцинома in situ (3 случая у женщин, получавших лираглутид, и 1 случай у женщины, получавшей плацебо). Большинство случаев рака были эстроген- и прогестерон зависимыми. Невозможно определить, были ли эти случаи связаны с применением лираглутида из-за их слишком небольшого количества. Кроме того, нет достаточных данных, чтобы определить, оказывает ли лираглутид влияние на уже существующие новообразования молочной железы.
Папиллярный рак щитовидной железы
В ходе клинических исследований сообщалось о подтверждённой папиллярной карциноме щитовидной железы у 7 (0,2 %) из 3291 пациентов, получавших лираглутид, по сравнению с отсутствием её в группе пациентов, получавших плацебо (1843 пациента). Из всех 24 случаев 4 карциномы были менее 1 см в наибольшем диаметре и 4 были диагностированы по результатам гистологии после проведённой по медицинским показаниям тиреоидэктомии.
Неоплазии ободочной и прямой кишки
В ходе клинических исследований сообщалось о подтверждённых доброкачественных неоплазиях ободочной и прямой кишки (преимущественно аденомах ободочной кишки) у 17 (0,5 %) из 3291 пациентов, получавших лираглутид, по сравнению с 4 (0,2 %) из 1843 пациентов, получавших плацебо. Было зарегистрировано два подтверждённых случая злокачественной карциномы ободочной и прямой кишки (0,1 %) у пациентов, получавших лираглутид, и ни одного у пациентов, получавших плацебо.
Нарушения сердечной проводимости
В ходе клинических исследований у 11 (0,3 %) из 32384 пациентов, получавших лираглутид, сообщалось о развитии нарушений сердечной проводимости, таких как атриовентрикулярная блокада 1 степени, блокада правой ножки пучка Гиса или блокада левой ножки пуска Гиса. У пациентов (1941 человек), получавших плацебо, о развитии нарушений сердечной проводимости не сообщалось.
Влияние на способность управлять транспортными средствами, механизмами.
Препарат Масиза не влияет или незначительно влияет на способность управления транспортными средствами и работу с механизмами. Однако существует риск возникновения головокружения, в основном, в течение первых 3 месяцев лечения препаратом Масиза. При возникновении головокружения следует соблюдать осторожность при управлении транспортным средством или работе с механизмами.
В связи с риском развития гипогликемии при применении препарата, особенно при комбинированном применении с препаратами сульфонилмочевины у пациентов с СД2, следует соблюдать осторожность при управлении транспортными средствами и механизмами.
Руководство по использованию
Препарат Масиза нельзя применять, если он выглядит иначе, чем прозрачная или опалесцирующая, бесцветная или слегка жёлтая жидкость.
Препарат Масиза нельзя использовать, если он был заморожен.
Препарат Масиза можно вводить при помощи игл длиной до 8 мм и толщиной до 32G. Шприц-ручка предназначена для использования в комбинации с одноразовыми инъекционными иглами. Инъекционные иглы не включены в упаковку.
Пациент должен быть проинформирован о том, что использованную иглу следует выбрасывать после каждой инъекции, а также о том, что нельзя хранить шприц-ручку с присоединённой иглой. Такая мера позволит предотвратить закупоривание игл, загрязнение, инфицирование и вытекание препарата из шприц-ручки, и гарантирует точность дозирования.
Весь оставшийся препарат и отходы следует уничтожить в соответствии с установленными национальным законодательством требованиями.
Форма выпуска
Раствор для подкожного введения 6 мг/мл.
По 3 мл в картриджи бесцветного нейтрального стекла I гидролитического класса с плунжерами резиновыми из бромбутилкаучука, укупоренные колпачками алюминиевыми с прокладками резиновыми из бромбутилкаучука. Картридж помещают в держатель для картриджей из полипропилена с нанесенной шкалой объёмов. Картридж вместе с держателем помещают в мультидозовую одноразовую шприц-ручку для многократных инъекций. На каждую мультидозовую одноразовую шприц-ручку для многократных инъекций наклеивают самоклеящуюся этикетку.
По 1 предварительно заполненной мультидозовой одноразовой шприц-ручке для многократных инъекций вместе с инструкцией по применению помещают в пачку из картона. На пачку может быть нанесена голограмма производителя в качестве этикетки первого вскрытия.
Каждая предварительно заполненная мультидозовая одноразовая шприц-ручка (3 мл) для многократных инъекций содержит 30 доз по 0.6 мг, 15 доз по 1,2 мг, 10 доз по 1.8 мг лираглутида, 7 доз по 2,4 мг или 6 доз по 3 мг.
Хранение
Хранить в недоступном для детей месте.
При температуре от 2 до 8 °C. Не замораживать.
После начала использования хранить шприц-ручку при температуре не выше 30 °C или в холодильнике (при температуре от 2 °C до 8 °C) не более 1 месяца.
Закрывать шприц-ручку колпачком для защиты от света.
Препарат Масиза следует предохранять от воздействия избыточного тепла и света.
Не использовать при изменении цвета раствора или при наличии видимых частиц.
Срок годности
2 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
CinnaGen, Co., Иран
Производитель
Исследовательская и производственная компания «СиннаГен Ко», Акционерное общество Закрытого Типа
Иран, провинция Алборз, г. Карадж, промышленная зона «Симин Дашт», пл. 3, ул. Шестая западная.
Владелец регистрационного удостоверения/Организация, принимающая претензии потребителей
ООО «ЭСЭНЭС», Россия
191014, г. Санкт-Петербург, вн.тер.г. Муниципальный Округ Литейный округ, пер. Басков, д.12 литера А, кв 16.
Тел.: +7 (901) 775-84-15.
Email: pv@snspharma.ru.
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Масиза:
