Радия хлорид, 223Ra
Лекарственная форма
раствор для внутривенного введения
Листок-вкладыш — информация для пациента
Радия хлорид, 223Ra, 1100 кБк/мл, раствор для внутривенного введения
Действующее вещество: радий-223 (в виде радия хлорида (223Ra))
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к врачу-радиологу.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к врачу- радиологу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка- вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Радия хлорид, 223Ra, и для чего его применяют.
- О чём следует знать перед применением препарата Радия хлорид, 223
- Применение препарата Радия хлорид, 223
- Возможные нежелательные реакции.
- Хранение препарата Радия хлорид, 223
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат Радия хлорид, 223Ra, и для чего его применяют.
Препарат Радия хлорид, 223Ra содержит действующее вещество — радий -223 (в виде радия хлорида (223Ra)) — хлорид изотопа радия-223 и относится к группе под названием «Терапевтические радиофармацевтические средства».
Показания к применению
Препарат Радия хлорид, 223Ra показан к применению у взрослых пациентов в возрасте от 18 лет для лечения кастрационно-резистентного рака предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Кастрационно-резистентный рак предстательной железы — это рак предстательной железы (железы мужской репродуктивной системы), который не поддаётся лечению, направленному на снижение содержания мужских гормонов. Препарат Радия хлорид, 223Ra применяется только тогда, когда заболевание распространилось на кости (но при этом не распространилось на другие внутренние органы) и вызывает симптомы (например, боль).
Способ действия препарата Радия хлорид, 223Ra
Препарат Радия хлорид, 223Ra содержит радиоактивный металл радий-223; этот металл имитирует кальций, который содержится в костях. При введении препарата пациенту радий-223 достигает кости, на которую распространился рак, и испускает т.н. «короткое излучение» (альфа-частицы). Это излучение убивает окружающие опухолевые клетки.
Если у Вас есть какие-либо вопросы о том, как работает препарат Радия хлорид, 223Ra, или о том, почему Вам назначили этот препарат, обратитесь к врачу-радиологу.
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к врачу.
2. О чём следует знать перед применением препарата Радия хлорид, 223Ra.
Противопоказания
Препарат Радия хлорид, 223Ra нельзя применять:
- если у Вас аллергия на радия хлорид (223Ra) или любые другие компоненты препарата (перечисленные в разделе 6 листка-вкладыша);
- в комбинации с абиратероном и преднизоном/преднизолоном (применяются для лечения рака предстательной железы).
Особые указания и меры предосторожности
Перед применением препарата Радия хлорид, 223Ra проконсультируйтесь с врачом-радиологом.
- Препарат Радия хлорид, 223Ra нельзя применять в комбинации с абиратероном и преднизоном/преднизолоном из-за возможного увеличения риска переломов костей или смерти.
- Если лечение препаратом Радия хлорид, 223Ra планируется начать после лечения абиратероном и преднизоном/преднизолоном, Вам необходимо подождать 5 дней, прежде чем начинать лечение данным препаратом.
- Если после лечения препаратом Радия хлорид, 223Ra планируется другое лечение по поводу рака (системная противоопухолевая терапия), Вам необходимо подождать не менее 30 дней, прежде чем начинать лечение.
- Препарат Радия хлорид, 223Ra может приводить к уменьшению образования клеток крови в костном мозге (т.е. вызывать подавление функции костного мозга). Перед началом лечения препаратом Радия хлорид, 223Ra и далее перед каждым последующим введением препарата врач-радиолог будет проводить Вам анализ крови. На основании результатов анализа врач-радиолог примет решение о том, можно ли начинать лечение препаратом Радия хлорид, 223Ra и следует ли его продолжать или остановить.
- Если у Вас уже наблюдается подавление функции костного мозга, например, если Вы ранее получали химиотерапию (другие лекарственные препараты для уничтожения опухолевых клеток) или лучевую терапию, Вы можете быть подвержены более высокому риску. Врач-радиолог будет назначать Вам препарат Радия хлорид, 223Ra с осторожностью.
- Если рак широко распространился на Ваши кости, Вы также можете быть подвержены более высокому риску угнетения функции костного мозга. В этом случае врач-радиолог будет назначать Вам препарат Радия хлорид, 223Ra с осторожностью.
- Имеющиеся ограниченные данные не предполагают каких-либо существенных различий в функции костного мозга у пациентов, получающих химиотерапию после лечения радия хлоридом (223Ra), по сравнению с пациентами, которые не получали радия хлорид (223Ra).
- Нет данных о безопасности и эффективности применения радия хлорида (223Ra) у пациентов с продолжительным воспалительным заболеванием кишечника (болезнью Крона) и продолжительным воспалительным заболеванием толстой кишки (язвенным колитом). Поскольку радия хлорид (223Ra) выводится из организма с калом, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Поэтому, если у Вас есть указанные заболевания, врач-радиолог будет назначать Вам препарат Радия хлорид, 223Ra с осторожностью.
- Если у Вас имеется давление на нервы спинного мозга, которое может быть вызвано опухолью или другим поражением (невыпеченная компрессия спинного мозга), или если у Вас есть подозрение на компрессию спинного мозга, перед назначением препарата Радия хлорид, 223Ra врач-радиолог сперва назначит Вам стандартное лечение для устранения компрессии спинного мозга.
- Если у Вас возник перелом кости, прежде чем начинать или продолжать лечение препаратом Радия хлорид, 223Ra, врач сначала стабилизирует Вам сломанную кость.
- Сообщите врачу-радиологу, если до начала лечения препаратом Радия хлорид, 223Ra Вы получали химиотерапию или принимали препараты из группы бисфосфонатов (например, золедроновую кислоту). В этом случае Вы можете быть подвержены повышенному риску отмирания кости челюсти (остеонекрозу челюсти, который в основном наблюдается у пациентов, получающих бисфосфонаты); врач-радиолог будет назначать Вам препарат Радия хлорид, 223Ra с осторожностью.
- Применение препарата Радия хлорид, 223Ra способствует длительному суммарному накоплению радиационного воздействия (облучения) в организме. Длительное суммарное накопление облучения может увеличить риск развития рака (в частности, рака костей и лейкоза) и наследственных пороков развития. Тем не менее, в клинических исследованиях, в которых за пациентами наблюдали до трёх лет после получения последней дозы радия хлорида (223Ra), не было зарегистрировано ни одного случая возникновения рака, вызванного применением радия хлорида (223Ra).
- При применении препарата Радия хлорид, 223Ra увеличивается риск развития поноса (диареи), тошноты и рвоты, что может привести к обезвоживанию (дегидратации) организма. Необходимо пить достаточно жидкости. Если у Вас развились тяжёлая диарея, тошнота и рвота, сообщите об этом врачу-радиологу.
- Сообщите врачу-радиологу, если у Вас есть нарушение функции почек или печени.
Дети и подростки
Безопасность и эффективность применения препарата Радия хлорид, 223Ra у детей в возрасте до 18 лет не установлены.
Другие препараты и препарат Радия хлорйд, 223Ra
Сообщите врачу-радиологу о том, что Вы применяете, недавно применяли или можете начать применять какие-либо другие препараты.
Не проводили исследования взаимодействия радия хлорида (223Ra) с другими препаратами.
Сообщите врачу-радиологу, если до начала лечения препаратом Радия хлорид, 223Ra Вы принимали или принимаете следующие лекарственные препараты:
- бисфосфонаты (например, золедроновая кислота) (препараты, влияющие на обмен веществ в кости);
- препараты кальция;
- фосфаты;
- витамин D.
Поскольку существует вероятность взаимодействия радия хлорида (223Ra) с кальцием и фосфатами, врач-радиолог может порекомендовать Вам приостановить приём препаратов, содержащих данные вещества и/или витамин D, за несколько дней до начала терапии препаратом Радия хлорид, 223Ra.
Нет данных о безопасности и эффективности применения радия хлорида (223Ra) и химиотерапии (других лекарственных препаратов для уничтожения опухолевых клеток). Такое одновременное применение может привести к повышению риска подавления функции костного мозга.
Беременность, грудное вскармливание и фертильность
Препарат Радия хлорид, 223Ra не применяется у женщин.
Мужчинам следует использовать надёжные методы контрацепции во время лечения препаратом Радия хлорид, 223Ra и в течение 6 месяцев после его окончания.
Существует риск того, что лечение препаратом Радия хлорид, 223Ra может повлиять на способность к зачатию. Перед началом лечения мужчинам следует проконсультироваться с врачом по поводу консервации образцов спермы. Это особенно важно, если в будущем Вы планируете заводить детей.
Управление транспортными средствами и работа с механизмами
Данные о влиянии радия хлорида (223Ra) на способность управлять транспортными средствами и работать с механизмами отсутствуют.
Препарат Радия хлорид, 223Ra содержит натрий
Данный препарат содержит 0,194 ммоль (или 4,5 мг) натрия в 1 мл.
Данный препарат может содержать до 2,35 моль (или 54 мг) натрия на дозу в зависимости от вводимого объёма. Это необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия.
3. Применение препарата Радия хлорид, 223Ra.
Существуют строгие законодательные требования к применению, обращению и утилизации таких лекарственных препаратов, как Радия хлорид, 223Ra. Применение препарата Радия хлорид, 223Ra осуществляется только в специализированных лечебных учреждениях. Препарат Радия хлорид, 223Ra будут вводить Вам только квалифицированные медицинские работники, специально обученные безопасному обращению с радиоактивными препаратами и имеющими на это особое разрешение.
Рекомендуемая доза
Доза препарата Радия хлорид, 223Ra, которую вы будете получать, зависит от массы Вашего тела. Врач-радиолог рассчитает необходимую Вам дозу препарата.
Рекомендуемая доза препарата Радия хлорид, 223Ra составляет 55 кБк (Бк — Беккерель — единица измерения радиоактивности) на килограмм массы тела (т.е. 55 кБк/кг).
Если Вы старше 65 лет, если у Вас нарушены функция почек или функция печени, Вам не потребуется изменение дозы препарата Радия хлорид, 223Ra.
Путь и (или) способ введения
Препарат Радия хлорид, 223Ra вводится в вену с помощью иглы (внутривенно). До и после введения препарата медицинский работник промоет иглу от инфузионной системы или катетер физиологическим раствором (изотоническим раствором натрия хлорида 0,9 %).
Продолжительность терапии
Препарат Радия хлорид, 223Ra будут вводить Вам 1 раз в 4 недели. В общей сложности Вы получите 6 доз препарата Радия хлорид, 223Ra, то есть Вам будет сделано 6 инъекций.
После введения препарата Радия хлорид, 223Ra
Следует соблюдать осторожность при обращении с такими материалами (например, с постельным бельём), которые вступают в контакт с биологическими жидкостями (например, с мочой, калом, рвотой и т. д.). Препарат Радия хлорид, 223Ra выводится из организма в основном с калом. Врач-радиолог сообщит Вам, нужно ли Вам принимать какие-либо особые меры предосторожности после применения этого лекарственного препарата.
Если Вам ввели препарата Радия хлорид, 223Ra больше, чем следовало
Вероятность передозировки препарата Радия хлорид, 223Ra крайне мала.
Тем не менее, если случайная передозировка все-таки произойдёт, врач-радиолог назначит Вам соответствующее поддерживающее лечение и проверит наличие у Вас изменений количества клеток крови и желудочно-кишечных симптомов (например, диареи, тошноты, рвоты).
Если у Вас возникнут какие-либо вопросы о применении препарата Радия хлорид, 223Ra, обратитесь к врачу-радиологу.
4. Возможные нежелательные реакции.
Подобно всем лекарственным препаратам препарат Радия хлорид, 223Ra может вызывать нежелательные реакции, однако они возникают не у всех.
Немедленно обратитесь за медицинской помощью, если у Вас возникли какие-либо из следующих серьёзных нежелательных реакций:
- Уменьшение количества тромбоцитов в крови (тромбоцитопения). Эта нежелательная реакция встречается очень часто и может возникать у более чем 1 человека из 10.
- Уменьшение количества нейтрофилов — разновидности лейкоцитов (нейтропения), что может привести к повышению риска развития инфекции. Эта нежелательная реакция встречается часто и может возникать не более чем у 1 человека из 10.
Сразу сообщите врачу-радиологу, если у Вас возникли какие-либо из нижеперечисленных симптомов — они могут служить признаками тромбоцитопении или нейтропении (см. выше):
- синяки неизвестного происхождения;
- более сильное кровотечение после травмы, чем обычно;
- жар, лихорадочное состояние;
- если Вы стали чаще болеть инфекционными заболеваниями.
Врач-радиолог проведёт Вам анализ крови до начала лечения препаратом Радия хлорид, CM223Ra и затем будет проводить анализы крови перед каждым последующим введением препарата. Это необходимо для того, чтобы проверить количество тромбоцитов и лейкоцитов у Вас в крови.
Другие возможные нежелательные реакции, которые могут наблюдаться при применении препарата Радия хлорид, 223Ra
Очень часто (могут возникать у более чем у 1 человека из 10):
- диарея;
- тошнота;
- рвота.
Из-за диареи, тошноты и рвоты Вы можете быть подвержены риску обезвоживания организма (дегидратации). Сразу сообщите врачу-радиологу, если у Вас возникли какие- либо из нижеперечисленных симптомов: о головокружение, о сильная жажда, о уменьшение объёма мочи и более редкое мочеиспускание, чем обычно, о сухость кожи.
Эти симптомы могут быть признаками обезвоживания организма. Важно избегать обезвоживания, соблюдая питьевой режим и потребляя достаточное количество жидкости. Часто (могут возникать не более чем у 1 человека из 10):
- уменьшение количества лейкоцитов (лейкопения);
- уменьшение количества всех клеток крови — эритроцитов, лейкоцитов и тромбоцитов (панцитопения);
- реакции в месте введения (например, покраснение кожи (эритема), боль и припухлость в месте ведения препарата).
Нечасто (могут возникать не более чем у 1 человека из 100):
- уменьшение количества лимфоцитов — разновидности лейкоцитов (лимфопения).
Применение препарата Радия хлорид, 223Ra способствует длительному суммарному накоплению радиационного воздействия (облучения) в организме. Длительное суммарное накопление облучения может увеличить риск развития рака (в частности, рака костей и лейкоза) и наследственных пороков развития. Тем не менее, в клинических исследованиях, в которых за пациентами наблюдали до трёх лет после получения последней дозы радия хлорида (223Ra), не было зарегистрировано ни одного случая возникновения рака, вызванного применением радия хлорида (223Ra).
Обратитесь к врачу-радиологу, если у Вас возникли боль, отёк или онемение челюсти, ощущение «тяжести» в челюсти или ощущение расшатывания зубов. Среди пациентов, получавших радия хлорид (223Ra), были зарегистрированы случаи отмирания кости челюсти (остеонекроза челюсти, который наиболее часто встречается у пациентов, получающих лекарственные препараты из группы бисфосфонатов). Все эти случаи были зарегистрированы только у пациентов, получавших бисфосфонаты до или одновременно с лечением радия хлоридом (223Ra) и получавших химиотерапию до лечения радия хлоридом (223Ra).
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом-радиологом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую через национальную систему сообщений государств — членов Евразийского экономического союза.
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Российская Федерация
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1.
Тел.: +7 800 550 99 03
Электронная почта: pharm@roszdravnadzor.gov.ru/
Сайт в информационно-телекоммуникационной сети «Интернет»: https://roszdravnadzor.gov.ru/
Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности данного препарата.
5. Хранение препарата Радия хлорид, 223Ra.
Вам не придётся хранить препарат Радия хлорид, 223Ra. Препарат Радия хлорид, 223Ra хранится под ответственностью специалиста в специально предназначенных для этого помещениях. Хранение радиофармацевтических препаратов осуществляется в соответствии с государственными правилами обращения с радиоактивными материалами. Следующие сведения предназначены исключительно для медицинских работников. Препарат нельзя применять после истечения срока годности (срока хранения), указанного на флаконе и защитном контейнере после «Годен до:».
6. Содержимое упаковки и прочие сведения.
Препарат Радия хлорид, 223Ra содержит
Действующее вещество: радий -223 (в виде радия хлорида (223Ra)).
Каждый мл раствора для внутривенного введения содержит 1100 кБк радия-223 в виде радия хлорида (223Ra) на референтную дату*.
Каждый флакон содержит 6 мл раствора (6600 кБк радия-223 в виде радия хлорида (223Ra) на референтную дату*).
* референтная дата — дата, установленная как «12:00 часов по московскому времени (UTC +3) через 7 дней после даты производства лекарственного препарата».
Прочими ингредиентами (вспомогательными веществами) являются: Натрия хлорид
Натрия цитрат
0,1 М раствор хлористоводородной кислоты
Вода для инъекций
Препарат Радия хлорид, 223Ra содержит натрий (см. раздел 2).
Внешний вид препарата Радия хлорид, 223Ra и содержимое упаковки
Раствор для внутривенного введения.
Прозрачная бесцветная жидкость.
Порциями по 6 мл с активностью 6600 кБк на референтную дату во флаконы для лекарственных средств из бесцветного стекла 1-ого гидролитического класса вместимостью 10 или 15 мл, герметично укупоренные хлорбутиловыми резиновыми пробками медицинскими без латекса и обжатые колпачками алюминиевыми. На флакон наклеивают этикетку.
Каждый флакон помещают в вольфрамовый или свинцовый контейнер. К контейнеру прилагают листок-вкладыш с таблицей значений коэффициента радиоактивного распада. По 1 вольфрамовому или свинцовому контейнеру с листком-вкладышем и сертификатом качества в упаковку типа А для радиоактивных веществ для транспортировки в лечебнопрофилактические медицинские организации.
Держатель регистрационного удостоверения
Российская Федерация
ООО «Простор Фарма»
123060, Российская Федерация, Москва, ул. Маршала Рыбалко, д. 2, корп. 6, эт. 5, пом. I, комн. 4, оф. 501.
Тел.: +7 926-490-40-71
e-mail: info@prostorfarma.ru
Производитель
Российская Федерация
Федеральное государственное автономное образовательное учреждение высшего образования «Уральский федеральный университет имени первого Президента России Б.Н. Ельцина»
Юридический адрес: 620002, Российская Федерация, Свердловская обл., г. Екатеринбург, ул. Мира, д. 19.
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к местному представителю держателя регистрационного удостоверения:
Российская Федерация
ООО «Простор Фарма»
Юридический адрес: 123060, Российская Федерация, Москва, ул. Маршала Рыбалко, д. 2, кори. 6, эт. 5, пом. I, комн. 4, оф. 501.
Тел.: +7 926-490-40-71
e-mail: info@prostorfarma.ru
Листок-вкладыш пересмотрен:
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайте Союза http://eec.eaunion.org/.
Следующие сведения предназначены исключительно для медицинских работников.
С целью обеспечения медицинских работников дополнительной научной и практической информацией о применении данного радиофармацевтического препарата в печатной версии листка-вкладыша после линии отрыва или отреза представлена общая характеристика лекарственного препарата Радия хлорид, 223Ra.
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Радия хлорид, 223Ra, 1100 кБк/мл, раствор для внутривенного введения.
2. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Действующее вещество: радий-223 (в виде радия хлорида (223Ra)).
Каждый мл раствора для внутривенного введения содержит 1100 кБк радия-223 в виде радия хлорида (223Ra) на референтную дату*.
Каждый флакон содержит 6 мл раствора (6600 кБк радия-223 в виде радия хлорида (223Ra) на референтную дату*).
* референтная дата — дата, установленная как «12:00 часов по московскому времени (UTC +3) через 7 дней после даты производства лекарственного препарата».
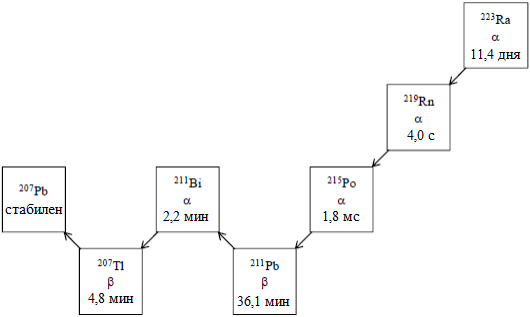
Радия хлорид (223Ra) испускает альфа-частицы и имеет период полураспада 11,4 дней. Удельная активность радия-223 1,9 МБк/нг.
Радиоактивный распад радия-223 до свинца-207 состоит из шести звеньев цепочки короткоживущих дочерних изотопов и сопровождается испусканием альфа-, бета- и гамма-частиц с разной вероятностью эмиссии и величиной энергии распада. Величина энергии альфа-излучения составляет 95,3 % (диапазон энергии 5,0–7,5 МэВ), величина энергии бета-излучения — 3,6 % (среднее значение энергии 0,445 МэВ и 0,492 МэВ), величина энергии гамма-излучения — 1,1 % (диапазон энергии 0,01–1,27 МэВ).
Рисунок 1. Цепочка радиоактивного распада радия-223 (с характером распада и параметрами периодов полураспада)
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий (см. раздел 4.4).
Полный перечень вспомогательных веществ приведён в разделе 6.1.
3. ЛЕКАРСТВЕННАЯ ФОРМА
Раствор для внутривенного введения.
Прозрачная бесцветная жидкость.
Значение pH от 6,0 до 8,0. Осмоляльность от 239 до 376 мОсмоль/кг.
4. КЛИНИЧЕСКИЕ ДАННЫЕ
4.1. Показания к применению
Препарат Радия хлорид, 223Ra показан к применению у взрослых пациентов для лечения кастрационно-резистентного рака предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
4.2. Режим дозирования и способ применения
Препарат Радия хлорид, 223Ra должен назначаться только врачом, имеющим опыт применения радиофармацевтических препаратов. Перед назначением препарата пациент должен пройти обследование. Применение препарата может осуществляться только в специализированных лечебных учреждениях персоналом, имеющим разрешение на обращение с радиофармацевтическими препаратами (см. раздел 6.6).
Режим дозирования
Активная доза радия хлорида (223Ra) составляет 55 кБк/кг. Назначается 6 инъекций препарата с интервалами в 4 недели.
Безопасность и эффективность радия хлорида (223Ra) при получении пациентом более 6-ти инъекций не изучались.
Инструкции по расчёту суммарного объёма вводимого раствора см. в части 12.
Особые группы пациентов
Пациенты пожилого возраста
В целом в клинических исследованиях не отмечалось значимых различий безопасности и эффективности радия хлорида (223Ra) у пожилых (65 лет и старше) пациентов в сравнении с более молодыми пациентами. Пациентам пожилого возраста коррекция дозы не требуется.
Пациенты с нарушением функции почек
В клиническом исследовании III фазы не наблюдалось значимых различий безопасности или эффективности радия хлорида (223Ra) у пациентов с нарушением функции почек лёгкой степени тяжести (клиренс креатинина (КК) 50–80 мл/мин) в сравнении с пациентами с нормальной функцией почек. Имеются ограниченные данные для пациентов с нарушением функции почек средней степени тяжести (КК 30–50 мл/мин). Нет данных для пациентов с тяжёлой (КК <30 мл/мин) или терминальной степенью нарушения функции почек. Однако, поскольку экскреция радия хлорида (223Ra) через почки является минимальной, и его выведение осуществляется, главным образом, через кишечник, предполагается, что нарушение функции почек не влияет на фармакокинетические показатели радия хлорида (223Ra). Пациентам с нарушением функции почек коррекция дозы не требуется.
Пациенты с нарушением функции печени
Безопасность и эффективность радия хлорида (223Ra) не изучалась у пациентов с нарушением функции печени.
Поскольку изотоп радия-223 не подвергается метаболизму в печени и не выводится с желчью, предполагается, что нарушение функции печени не влияет на фармакокинетические показатели радия хлорида (223Ra). Пациентам с нарушением функции печени коррекции дозы не требуется.
Дети
Безопасность и эффективность радия хлорида (223Ra) у детей в возрасте от 0 до 18 лет не установлены. Данные отсутствуют.
Способ применения
Препарат Радия хлорид, 223Ra предназначен для внутривенного введения. Препарат следует вводить медленно (как правило, до 1 минуты).
Иглу от инфузионной системы или катетер до и после введения препарата следует промыть изотоническим раствором натрия хлорида 0,9 %.
Инструкции по приготовлению лекарственного препарата перед применением см. в разделе 6.6 и части 12.
4.3. Противопоказания
- Гиперчувствительность к радия хлориду (223Ra) или любому из вспомогательных веществ, перечисленных в разделе 6.1;
- применение в комбинации с абиратерона ацетатом и преднизоном/преднизолоном (см. раздел 4.4).
4.4. Особые указания и меры предосторожности при применении
Комбинированное применение с абиратероном и преднизоном/преднизолоном
Применение радия хлорида (223Ra) в комбинации с абиратерона ацетатом и преднизоном/преднизолоном противопоказано.
Клиническая эффективность и безопасность одновременного начала терапии радия хлоридом (223Ra), абиратерона ацетатом и преднизоном/преднизолоном была оценена в рандомизированном плацебо-контролируемом многоцентровом исследовании фазы III у 806 пациентов с кастрационно-резистентным раком предстательной железы с костными метастазами, с отсутствием симптомов или симптомами лёгкой степени тяжести. Рандомизация в исследовании была раскрыта на раннем этапе в соответствии с рекомендациями Независимого комитета по мониторингу данных. Результаты предварительного анализа показали увеличение частоты переломов (28,6 % против 1,4 %) и летальных исходов (38,5 % против 35,5 %) у пациентов, получавших радия хлорид (223Ra) в сочетании с абиратерона ацетатом и преднизоном/преднизолоном, по сравнению с пациентами, получавшими плацебо плюс абиратерона ацетат и преднизон/преднизолон. Сопутствующее введение бисфосфонатов и деносумаба снижало частоту переломов у пациентов в обеих группах.
Данные о безопасном периоде, по истечении которого можно применять радия хлорид (223Ra) после лечения абиратерона ацетатом в комбинации с преднизоном/преднизолоном и наоборот, ограничены. Учитывая период полувыведения радия хлорида (223Ra) и абиратерона, терапию радия хлоридом (223Ra) не рекомендуется начинать в течение как минимум 5 дней после последнего применения абиратерона ацетата в комбинации с преднизоном/преднизолоном. Системную противоопухолевую терапию не следует начинать в течение как минимум 30 дней после последнего применения радия хлорида (223Ra).
Подавление функции костного мозга
Сообщалось о случаях подавления функции костного мозга (тромбоцитопения, нейтропения, лейкопения, панцитопения) у пациентов, получавших терапию радия хлоридом (223Ra) (см. раздел 4.8).
Следует проводить общий анализ крови у пациентов перед каждой инъекцией радия хлорида (223Ra). Перед первым введением препарата абсолютное число нейтрофилов (АЧН) должно быть >1,5 × 109/л, количество тромбоцитов >100 × 109/л и гемоглобин >10,0 г/дл. Перед последующими введениями препарата АЧН должно быть >1,0 × 109/л, количество тромбоцитов >50 × 109/л. Если, не смотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6-ти недель после последнего введения радия хлорида (223Ra), дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
В клинических исследованиях III фазы наблюдалось повышение частоты нежелательных реакций со стороны крови (нейтропения и тромбоцитопения) у пациентов со снижением функции костного мозга (например, после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии (НДЛТ)), или у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей по данным радиоизотопного исследования (см. раздел 4.8). При лечении таких пациентов следует соблюдать осторожность.
Эффективность и безопасность цитотоксической химиотерапии, проводившейся после терапии радия хлоридом (223Ra), не установлены. Имеющиеся ограниченные данные показывают, что пациенты, получавшие химиотерапию после терапии радия хлоридом (223Ra), имели сопоставимые гематологические показатели в сравнении с пациентами, получавшими химиотерапию после приёма плацебо (см. раздел 5.1).
Болезнь Крона и язвенный колит
Безопасность и эффективность радия хлорида (223Ra) у пациентов с болезнью Крона и язвенным колитом не изучались. Поскольку радия хлорид (223Ra) выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении радия хлорида (223Ra) пациентам с острым воспалительным заболеванием кишечника.
Компрессия спинного мозга
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии радия хлоридом (223Ra).
Переломы костей
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии радия хлоридом (223Ra).
Остеонекроз челюсти
У пациентов, получавших терапию бисфосфонатами и радия хлоридом (223Ra), не может исключаться повышенный риск остеонекроза челюсти (ОНЧ). В клиническом исследовании III фазы сообщалось о случаях остеонекроза челюсти у 0,67 % пациентов (4/600) в группе радия хлорида (223Ra) в сравнении с 0,33 % у пациентов (1/301) в группе, принимавшей плацебо. При этом все пациенты с остеонекрозом челюсти получали предшествующую или сопутствующую терапию бисфосфонатами (например, золедроновая кислота) и предшествующую химиотерапию (например, доцетаксел).
Вторичные злокачественные опухоли
Терапия радия хлоридом (223Ra) приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях радия хлорида (223Ra) не сообщалось о вторичных онкологических заболеваниях на фоне терапии радия хлоридом (223Ra) при последующем наблюдении до трёх лет.
Токсическое поражение желудочно-кишечного тракта
Терапия радия хлоридом (223Ra) увеличивает частоту случаев диареи, тошноты и рвоты (см. раздел 4.8). Это может быть причиной дегидратации. Необходимо следить за своевременным приёмом жидкости и контролировать водный баланс организма. В случае развития тяжёлой или стойкой диареи, тошноты и рвоты следует порекомендовать пациентам обращаться за медицинской помощью.
Лечение пациентов с признаками или симптомами дегидратации или гиповолемии должно быть начато как можно скорее.
Нарушение функции печени
Следует с осторожностью применять препарат Радия хлорид, 223Ra, у пациентов с нарушением функции печени.
Нарушение функции почек
Следует с осторожностью применять препарат Радия хлорид, 223Ra, у пациентов с нарушением функции почек тяжёлой степени тяжести (КК <30 мл/мин).
Вспомогательные вещества
Данный препарат содержит 0,194 ммоль (или 4,5 мг) натрия в 1 мл.
Данный препарат может содержать до 2,35 моль (или 54 мг) натрия на дозу в зависимости от вводимого объёма. Это необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Клинические исследования взаимодействия радия хлорида (223Ra) с другими препаратами не проводились.
Существует вероятность взаимодействия радия хлорида (223Ra) с кальцием и фосфатами. Следует прекратить приём препаратов, содержащих данные вещества и/или витамин D, за несколько дней до начала терапии радия хлоридом (223Ra).
Сочетанное проведение химиотерапии и терапии радия хлоридом (223Ra) может оказывать аддитивное воздействие на подавление функции костного мозга (см. раздел 4.4). Безопасность и эффективность сочетанной химиотерапии и терапии радия хлоридом (223Ra) не установлены.
4.6. Фертильность, беременность и лактация
Контрацепция у мужчин
Не проводилось исследований применения радия хлорида (223Ra) для оценки его влияния на репродуктивную функцию у животных.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надёжные методы контрацепции во время лечения и в течение 6 месяцев после терапии радия хлоридом (223Ra).
Беременность
Препарат Радия хлорид, 223Ra не применяется у женщин.
Лактация
Препарат Радия хлорид, 223Ra не применяется у женщин.
Фертильность
Данные о влиянии радия хлорида (223Ra) на фертильность человека отсутствуют.
Данные исследований на животных показали возможность риска негативного влияния радия хлорида (223Ra) на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Данные о влиянии радия хлорида (223Ra) на способность управлять транспортными средствами и работать с механизмами отсутствуют.
4.8. Нежелательные реакции
Резюме профиля безопасности
Общий профиль безопасности радия хлорида (223Ra) основывается на данных клинических исследований с участием 600 пациентов, получавших терапию в клинических исследованиях III фазы.
В клинических исследованиях наиболее частыми нежелательными реакциями (>10 % пациентов) были диарея, тошнота, рвота и тромбоцитопения.
Наиболее серьёзными нежелательными реакциями при применении радия хлорида (223Ra) были тромбоцитопения и нейтропения (см. раздел 4.4).
Табличное резюме нежелательных реакций
Перечисленные ниже нежелательные реакции, отмеченные при применении радия хлорида (223Ra) в ходе клинических исследований, представлены в соответствии с поражением органов и систем и распределены по частоте возникновения в соответствии со следующей градацией: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100). Для классификации и описания конкретной реакции, её синонимов и связанных с ней состояний используется наиболее подходящий термин из Медицинского словаря нормативно-правовой деятельности (MedDRA). В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
| Системно-органный класс в соответствии с MedDRA | Очень часто | Часто | Нечасто |
| Нарушения со стороны крови и лимфатической системы | Тромбоцитопения | Нейтропения, панцитопения, лейкопения | Лимфопения |
| Желудочно-кишечные нарушения | Диарея, рвота, тошнота | — | — |
| Общие нарушения и реакции в месте введения | — | Реакции в месте введения | — |
Описание отдельных нежелательных реакций
Тромбоцитопения и нейтропения
Тромбоцитопения (все степени) наблюдалась у 11,5 % пациентов, получавших терапию радия хлоридом (223Ra), и у 5,6 % пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 6,3 % пациентов, получавших радия хлорид (223Ra), и у 2 % пациентов, получавших плацебо (см. раздел 4.4). В целом, частота случаев тромбоцитопении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (2,8 % у пациентов, получавших радия хлорид (223Ra), в сравнении с 0,8 % у пациентов, получавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (8,9 % у пациентов, получавших радия хлорид (223Ra), в сравнении с 2,9 % у пациентов, принимавших плацебо).
У пациентов с распространённой диффузной инфильтрацией костей сообщалось о случаях тромбоцитопении (все степени) у 19,6 % пациентов, получавших радия хлорид (223Ra), и у 6,7 % пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 5,9 % пациентов, получавших радия хлорид (223Ra), и у 6,7 % пациентов, получавших плацебо (см. раздел 4.4).
Сообщалось о случаях нейтропении (все степени) у 5 % пациентов, получавших терапию радия хлоридом (223Ra), и у 1 % пациентов, получавших плацебо. Нейтропения 3-й и 4-й степени наблюдалась у 2,2 % пациентов, получавших радия хлорид (223Ra), и у 0,7 % пациентов, получавших плацебо. В целом частота случаев нейтропении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (0,8 % у пациентов, принимавших радия хлорид (223Ra), и 0,8 % у пациентов, принимавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (3,2 % у пациентов, принимавших радия хлорид (223Ra), и у 0,6 % у пациентов, принимавших плацебо).
В клиническом исследовании I фазы максимальное снижение количества нейтрофилов и тромбоцитов возникало через 2–3 недели после однократного внутривенного введения радия хлорида (223Ra).
Реакции в месте введения
Сообщалось о реакциях в месте введения 1-й и 2-й степени, которые включали эритему, боль и отёк, у 1,2 % пациентов, получавших радия хлорид (223Ra), и у 0 % пациентов, получавших плацебо.
Вторичные злокачественные опухоли
Терапия радия хлоридом (223Ra) приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях радия хлорида (223Ra) не сообщалось о вторичных онкологических заболеваниях на фоне терапии радия хлоридом (223Ra) при последующем наблюдении до трёх лет.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза — риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Российская Федерация
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1.
Тел.: +7 800 550 99 03
Электронная почта: pharm@roszdravnadzor.gov.ru/
Сайт в информационно-телекоммуникационной сети «Интернет»: https://roszdravnadzor.gov.ru/
4.9. Передозировка
Симптомы
Не сообщалось о случаях непреднамеренной передозировки радия хлоридом (223Ra) в клинических исследованиях.
Лечение
Специфический антидот отсутствует.
В случае непреднамеренной передозировки радия хлоридом (223Ra) следует принять стандартные поддерживающие меры, включая контроль токсического действия на систему крови и желудочно-кишечный тракт.
В клиническом исследовании I фазы оценивалась разовая активная доза радия хлорида (223Ra), которая составляла 276 кБк/кг. Ограничивающая дозу токсичность не наблюдалась.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: терапевтические радиофармацевтические средства; другие терапевтические радиофармацевтические средства.
Код ATX: V10XX03.
Механизм действия
Радия хлорид (223Ra) является препаратом, терапевтическое действие которого обусловлено эмиссией а-частиц.
Действующее вещество, изотоп радия-223 (радия хлорид (223Ra)), имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности, на костные метастатические очаги рака предстательной железы. Высокое линейное значение энергии переноса а-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы дезоксирибонуклеиновой кислоты (ДНК) и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие радия хлорида (223Ra) на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия а-частиц радия хлорида (223Ra) менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
5.2. Фармакокинетические свойства
Абсорбция
При внутривенном введении радия хлорида (223Ra) его биодоступность составляет 100 %. Распределение
После внутривенного введения изотоп радия (радий-223) быстро выводится из системного кровотока и накапливается в первую очередь в костях и костных метастазах или выделяется непосредственно в кишечник.
Около 20 % введённой дозы радия-233 хлорида оставалось в системном кровотоке через 15 минут после введения. Около 4 % введённой дозы радия хлорида (223Ra) оставалось в системном кровотоке через 4 часа после введения, снижаясь до менее 1 % через 24 часа. Объем распределения превышал объем циркулирующей крови, что свидетельствует о распределении в периферических полостях.
Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 минут после введения. Через 4 часа после введения средние значения радиоактивной дозы, определяющийся в костях и кишечнике, составляли около 61 % и 49 %, соответственно. Не отмечалось значительного накопления изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезёнка через 4 часа после инъекции.
Биотрансформация
Изотоп радия (радий-223) подвергается радиоактивному распаду и не метаболизируется. Элиминация
Изотоп радия в основном выводится из организма через кишечник. Около 5 % выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения радия хлорида (223Ra) (с учётом фактора распада) показывают, что 76 % введённой дозы выводятся из организма. На скорость выведения радия-223 из желудочно-кишечного тракта влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Линейной (нелинейность)
В исследованном диапазоне активности (51–276 кБк/кг) фармакокинетические показатели радия хлорида (223Ra) были линейными.
Дети
Безопасность и эффективность радия хлорида (223Ra) у детей в возрасте от 0 до 18 лет не изучались.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1. Перечень вспомогательных веществ
Натрия хлорид
Натрия цитрат
0,1 М раствор хлористоводородной кислоты
Вода для инъекций
6.2. Несовместимость
В связи с отсутствием исследований совместимости, данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
6.3. Срок годности (срок хранения)
21 сутки с даты производства.
6.4. Особые меры предосторожности при хранении
Хранить при температуре не выше 25 °C. Хранить в соответствии с СП 2.6.1.2612-10 «Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ — 99/2010)» и СанПиН 2.6.1.2523-09 «Нормы радиационной безопасности (НРБ — 99/2009)».
6.5. Характер и содержание первичной упаковки
Порциями по 6 мл с активностью 6600 кБк на референтную дату во флаконы для лекарственных средств из бесцветного стекла 1-ого гидролитического класса вместимостью 10 или 15 мл, герметично укупоренные хлорбутиловыми резиновыми пробками медицинскими без латекса и обжатые колпачками алюминиевыми. На флакон наклеивают этикетку.
Каждый флакон помещают в вольфрамовый или свинцовый контейнер. К контейнеру прилагают листок-вкладыш с таблицей значений коэффициента радиоактивного распада. По 1 вольфрамовому или свинцовому контейнеру с листком-вкладышем и сертификатом качества в упаковку типа А для радиоактивных веществ для транспортировки в лечебно-профилактические медицинские организации.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Общие указания
Работа с препаратом Радия хлорид, 223Ra должна осуществляться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/10). Радиофармацевтический препарат Радия хлорид, 223Ra могут получать, применять и назначать только квалифицированные сотрудники, имеющие соответствующую подготовку и разрешение на работу с радиоактивными веществами. Работа с препаратом, его хранение и утилизация должны осуществляться в специализированном лечебном учреждении, имеющем лицензию на право осуществления деятельности в области использования атомной энергии.
Применение препарата Радия хлорид, 223Ra должно отвечать требованиям радиационной безопасности и качества лекарственных препаратов. Применение препарата следует проводить с соблюдением правил асептики.
Радиационная защита
Изотоп радия-223 испускает преимущественно а-частицы, тем не менее, при распаде радия-223 и его дочерних изотопов образуется бета- и гама-излучение. Благодаря гамма- излучению, использование специальных приборов позволяет измерить радиоактивность препарата Радия хлорид, 223Ra и определить степень радиоактивного загрязнения. Сотрудникам, работающим с радиофармацевтическими препаратами и подвергающимся риску радиоактивного заражения в результате внешнего облучения или заражения от разлитых отходов жизнедеятельности пациентов (например, моча, кал, рвотные массы и др.) необходимо соблюдать меры радиационной защиты в соответствии с нормативными требованиями. Следует соблюдать осторожность при контакте с материалами (например, постельное белье), использовавшимися пациентами. Поскольку введённая активная доза препарата Радия хлорид, 223Ra, как правило, менее 8 МБк, воздействие внешнего облучения на персонал при контакте с пациентом, получающим терапию препаратом Радия хлорид, 223Ra, существенно ниже в сравнении с другими радиофармацевтическими препаратами, применяющимися с терапевтической целью. Тем не менее, следуя принципам ALARA («достижение результата с минимально возможным воздействием»), для минимизации радиационного воздействия на персонал рекомендуется до минимума сократить время, проводимое в зоне облучения, максимально увеличить расстояние до источника излучения, использовать средства радиационной защиты.
Весь оставшийся лекарственный препарат, упаковку и материалы, используемые при подготовке и введении препарата Радия хлорид, 223Ra, следует утилизировать как радиоактивные отходы в соответствии с нормативными требованиями.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
Российская Федерация
ООО «Простор Фарма»
123060, Российская Федерация, Москва, ул. Маршала Рыбалко, д. 2, кори. 6, эт. 5, пом. I, комн. 4, оф. 501.
Тел.: +7-926-490-40-71
e-mail: info@prostorfarma.ru
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Простор Фарма»
123060, Российская Федерация, Москва, ул. Маршала Рыбалко, д. 2, кори. 6, эт. 5, пом. I, комн. 4, оф. 501.
Тел.: +7-926-490-40-71
e-mail: info@prostorfarma.ru
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации:
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
11. ДОЗИМЕТРИЯ
Расчёт лучевой нагрузки основывается на клинических данных по биораспределению радия хлорида (223Ra). Расчёт проводился при помощи оценки экспоненциального моделирования дозы внутреннего облучения в органах (OLINDA/ЕХМ), программного обеспечения, основанного на алгоритме терапевтической дозы внутреннего облучения (ТДВО), широко используемого для имплантированных бета- и гамма-активных радионуклидов. Изотоп радия-223 испускает преимущественно α-частицы. Были сделаны дополнительные допущения для оптимального расчёта лучевой нагрузки радия хлорида (223Ra) для кишечника, красного костного мозга и костной ткани/остеогенных клеток с учётом биораспределения и характерных особенностей радия хлорида (223Ra).
| Орган-мишень | Альфа- излучение1 (Гр/МБк) | Бета- излучение (Гр/МБк) | Гамма- излучение (Гр/МБк) | Суммарная доза (Гр/МБк) | Коэффициент отклонения (%) |
| Надпочечники | 0,00000 | 0,00002 | 0,00009 | 0,00012 | 56 |
| Головной мозг | 0,00000 | 0,00002 | 0,00008 | 0,00010 | 80 |
| Молочная железа | 0,00000 | 0,00002 | 0,00003 | 0,00005 | 120 |
| Стенка желчного пузыря | 0,00000 | 0,00002 | 0,00021 | 0,00023 | 14 |
| Стенка нижнего отдела толстой кишки | 0,00000 | 0,04561 | 0,00085 | 0,04645 | 83 |
| Стенка тонкой кишки | 0,00319 | 0,00360 | 0,00047 | 0,00726 | 45 |
| Стенка желудка | 0,00000 | 0,00002 | 0,00011 | 0,00014 | 22 |
| Стенка верхнего отдела толстой кишки | 0,00000 | 0,03149 | 0,00082 | 0,03232 | 50 |
| Стенка сердца | 0,00161 | 0,00007 | 0,00005 | 0,00173 | 42 |
| Почки | 0,00299 | 0,00011 | 0,00011 | 0,00321 | 36 |
| Печень | 0,00279 | 0,00010 | 0,00008 | 0,00298 | 36 |
| Легкие | 0,00109 | 0,00007 | 0,00005 | 0,00121 | 2 — |
| Мышца | 0,00000 | 0,00002 | 0,00010 | 0,00012 | 41 |
| Яичники | 0,00000 | 0,00002 | 0,00046 | 0,00049 | 40 |
| Поджелудочная железа | 0,00000 | 0,00002 | 0,00009 | 0,00011 | 43 |
| Красный костный мозг | 0,13217 | 0,00642 | 0,00020 | 0,13879 | 41 |
| Остеогенные клетки | 1,13689 | 0,01487 | 0,00030 | 1,15206 | 41 |
| Кожа | 0,00000 | 0,00002 | 0,00005 | 0,00007 | 79 |
| Селезёнка | 0,00000 | 0,00002 | 0,00007 | 0,00009 | 54 |
| Яички | 0,00000 | 0,00002 | 0,00006 | 0,00008 | 59 |
| Тимус | 0,00000 | 0,00002 | 0,00003 | 0,00006 | 109 |
| Щитовидная железа | 0,00000 | 0,00002 | 0,00005 | 0,00007 | 96 |
| Стенка мочевого пузыря | 0,00371 | 0,00016 | 0,00016 | 0,00403 | 63 |
| Матка | 0,00000 | 0,00002 | 0,00023 | 0,00026 | 28 |
| Все тело | 0,02220 | 0,00081 | 0,00012 | 0,02312 | 16 |
Примечания: 1 — поскольку изотоп радия-223 не накапливается в большинстве мягких тканей, вклад альфа-излучения в суммарную дозу облучения для данных органов был установлен 0. 2 — лучевая нагрузка на лёгкие основывается на расчёте смоделированных данных, показывающих зависимость радиофармацевтической активности препарата в крови от времени, с использованием совокупных значений, полученных у всех пациентов.
В клинических исследованиях радия хлорида (223Ra) частота и тяжесть гематологических нежелательных реакций были значительно ниже, чем можно было бы ожидать, основываясь на лучевой нагрузке для красного костного мозга. Это может быть связано с пространственным распределением α-частиц, что приводит к неравномерному распределению дозы ионизирующего излучения в красном костном мозге.
12. ИНСТРУКЦИИ ПО ПРИГОТОВЛЕНИЮ РАДИОФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ
Перед применением следует внимательно осмотреть раствор. Препарат Радия хлорид, 223Ra представляет собой прозрачную бесцветную жидкость. При изменении цвета, обнаружении видимых частиц или дефекта упаковки препарат применять нельзя.
Препарат Радия хлорид, 223Ra представляет собой раствор, готовый к применению. Не следует разводить или смешивать препарат Радия хлорид, 223Ra с другими растворами.
Флакон с препаратом предназначен только для однократного применения.
При расчёте объёма, предназначенного для введения пациенту, необходимо учитывать:
- массу тела пациента, кг;
- уровень активной дозы (55 кБк/кг);
- активную концентрацию препарата на референтную дату (1100 кБк/мл); референтная дата указывается на этикетке флакона и свинцового контейнера;
- коэффициент радиоактивного распада радия-223. Таблица со значениями коэффициента радиоактивного распада находится в каждой упаковке препарата.
Следует подтвердить уровень радиоактивности препарата в каждом флаконе с помощью радиометрического дозиметра.
Суммарный объём вводимого раствора для каждого пациента рассчитывается по формуле:

В таблицах 3, 4, 5 представлены значения коэффициента радиоактивного распада радия-
223 для различных часовых зон относительно референтной даты.
| День N от референтной даты | Коэффициент радиоактивного распада радия-223 |
| -7 | 1,53 |
| -6 | 1,44 |
| -5 | 1,35 |
| -4 | 1,27 |
| -3 | 1,20 |
| -2 | 1,13 |
| -1 | 1,06 |
| 0 | 1,00 |
| 1 | 0,94 |
| 2 | 0,89 |
| 3 | 0,83 |
| 4 | 0,78 |
| 5 | 0,74 |
| 6 | 0,69 |
| 7 | 0,65 |
| 8 | 0,62 |
| 9 | 0,58 |
| 10 | 0,55 |
| И | 0,51 |
| 12 | 0,48 |
| 13 | 0,45 |
| 14 | 0,43 |
| День N от референтной даты | Коэффициент радиоактивного распада радия-223 |
| -7 | 1,5'4 |
| -6 | 1,45 |
| -5 | 1,36 |
| -4 | 1,28 |
| -3 | 1,21 |
| -2 | 1,14 |
| -1 | 1,07 |
| 0 | 1,01 |
| 1 | 0,95 |
| 2 | 0,89 |
| 3 | 0,84 |
| 4 | 0,79 |
| 5 | 0,74 |
| 6 | 0,70 |
| 7 | 0,66 |
| 8 | 0,62 |
| 9 | 0,58 |
| 10 | 0,55 |
| И | 0,52 |
| 12 | 0,49 |
| 13 | 0,46 |
| 14 | 0,43 |
| День N от референтной даты | Коэффициент радиоактивного распада цадия-223 |
| -7 | 1,56 |
| -6 | 1,46 |
| -5 | 1,38 |
| -4 | 1,30 |
| -3 | 1,22 |
| -2 | 1,15 |
| -1 | 1,08 |
| 0 | 1,02 |
| 1 | 0,96 |
| 2 | 0,90 |
| 3 | 0,85 |
| 4 | 0,80 |
| 5 | 0,75 |
| 6 | 0,71 |
| 7 | 0,67 |
| 8 | 0,63 |
| 9 | 0,59 |
| 10 | 0,56 |
| И | 0,52 |
| 12 | 0,49 |
| 13 | 0,46 |
| 14 | 0,44 |
Общая характеристика лекарственного препарата Радия хлорид, 223Ra доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет»: http://eec.eaunion.org/.
Форма выпуска
Раствор для внутривенного введения, 1100 кБк/мл.
Условия отпуска из аптек
Для лечебно-профилактических и санитарно-профилактических учреждений
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Радия хлорид, 223Ra:
