Церварикс®
, вакцинаРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
суспензия для внутримышечного введения.
Состав
На 1 прививочную дозу (0,5 мл):
| Наименование компонентов | Количество |
| Действующие вещества | |
| L1 протеин вируса папилломы человека типа 16(ВПЧ-16LI) | 20 мкг |
| L1 протеин вируса папилломы человека типа 18 (ВПЧ-18LI) | 20 мкг |
| Вспомогательные вещества | |
| 3-О-дезацил-4’- монофосфориллипида | 50 мкг |
| 0,5 мг | |
| 4,4 мг | |
| Натрия дигидрофосфата дигидрат | 0,624 мг |
| q.s. до 0,5 мл | |
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Практически во всех случаях цервикальный рак обусловлен персистенцией онкогенных вирусов папилломы человека. Вирусы папилломы человека 16 и 18 типов ответственны за возникновение более 70 % случаев рака шейки матки и 70 % случаев низкодифференнпрованной интраэпителиальной неоплазии вульвы (VIN 2/3) и влагалища (VaIN 2/3). Четыре наиболее распространённых типа ВПЧ высокого онкогенного риска ВПЧ-16, -18, -45 и -31 ответственны приблизительно за 76 % случаев плоскоклеточного рака шейки матки и 91 % случаев аденокарциномы.
После завершения курса первичной вакцинации формируется иммунологическая память к ВПЧ-16 и -18, что подтверждается вторичным ответом, который регистрируется после 6,8 лет. Анамнестический иммунный ответ также регистрировали в отношении родственных типов ВПЧ-45 и -31.
Эффективная защита была зарегистрирована в течение как минимум 9,4 лет после введения первой дозы вакцины. Исследования по изучению длительности защитного иммунитета продолжаются.
Профилактическая эффективность у женщин в возрасте от 15 до 25 лет
Выводы о клинической эффективности вакцины Церварикс® сделаны на основании результатов клинических исследований у 19 778 женщин в возрасте от 15 до 25 лет.
В клинических исследованиях эффективность вакцины оценивали по профилактике предраковых поражений CIN1+ (цервикальная интраэпителиальная неоплазия первой степени и выше), CIN2+ (цервикальная интраэпителиальная неоплазия второй степени и выше), CIN3+ (цервикальная интраэпителиальная неоплазия третьей степени и выше), ASC-US (атипичные клетки неясного значения); псрсистирующей в течение 6 и 12 месяцев ВПЧ-инфскции; V1N1 + (интраэпителиальная неоплазия вульвы первой степени и выше), VaINl + (интраэпителиальная неоплазия влагалища первой степени и выше).
В популяции исходно неиифицированных женщин (исследования НРV-001 /007/023) вакцина Церварикс® эффективно предотвращала:
- персистирующую в течение 6 и 12 месяцев ВПЧ-инфекцию, обусловленную ВПЧ-16/18, в более чем 98 % и 97 % случаев соответственно;
- поражения CIN1+, обусловленные ВПЧ-16, -18, в 100 % случаев;
- поражения CIN2+, обусловленные ВПЧ-16, -18, в 100 % случаев.
При этом эффективная защита против вышеуказанных вирусологических и/или цитологических состояний у исходно неинфицированных женщин сохранялась в течение 9,4 лет с момента введения первой дозы.
По результатам исследования (HPV-008, анализ в конце исследования) в популяции исходно неинфицированных женщин вакцина Церварикс® эффективно предотвращала:
- поражения CIN3+, обусловленные ВПЧ-16, -18, в 100 % случаев;
- поражения VIN1+ или VaINl+, обусловленные ВПЧ-16, -18, в более чем 75 % случаев (данные окончательного анализа исследования HPV-008).
В смешанной популяции (26 % исходно инфицированных женщин: текущая ВПЧ-инфекция или ВПЧ-инфекция в анамнезе) вакцина Церварикс® эффективно предотвращала:
- персистирующую в течение 6 месяцев ВПЧ-инфекцию, обусловленную ВПЧ-16, -18, более чем в 94 % случаев;
- поражения CIN1+, обусловленные ВПЧ-16, -18, в 98 % случаев;
- поражения CIN2+, обусловленные ВПЧ-16, -18, более чем в 98 % случаев. Вакцина Церварикс® не обеспечивала защиту от заболеваний, обусловленных генотипами ВПЧ, по которым женщины были ДНК-позитивны на момент включения в исследование. Однако те женщины, которые были уже инфицированы одним типом ВПЧ до вакцинации, были защищены от заболеваний, обусловленных другим вакцинным типом.
Вакцина Цсрварикс® обеспечивала эффективную защиту против инфицирования и предраковых состояний, обусловленных генотипами ВПЧ, не входящими в состав вакцины (ВПЧ-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68):
- 54 %-ная защита в отношении C1N2+ по 12 онкогенным типам (исключая ВПЧ-16 и -18) в популяции исходно нсинфицированных женщин;
- профилактическая эффективность вакцины Церварикс® против CIN2+ и CIN3+ у женщин с исходно отрицательной ПЦР по 14 онкогенным типам ВПЧ, независимо от типа ДНК в области поражения и
- независимо от серологического статуса, составила 65 % и более 93 %, соответственно.
Профилактическая эффективность у женщин 26 лет и старше
Эффективность вакцины Церварикс® оценивалась в двойном слепом рандомизированном клиническом исследовании, которое включало 5 777 женщин в возрасте 26 лет и старше. Профилактическая эффективность против персистирующей инфекции ВПЧ-16, -18 в течение 6 месяцев в комбинации с поражением CIN1+ составила у привитых более 81 %.
Иммуногенность вакцины
Иммуногенность вакцины Церварикс® оценивалась более чем у 5 000 женщин в возрасте от 9 до 55 лет.
Полный курс вакцинации (по схеме 0-1-6 месяцев) приводит к образованию специфических антител против ВПЧ-16 и ВПЧ-18 более чем у 99 % изначально ссронегативных женщин.
Индуцируемое вакциной Церварикс® среднее геометрическое титров IgG было выше, чем после перенесённой естественной ВПЧ-инфекции. Женщины, как серопозитивные, так и серонегативные, на момент введения первой дозы, развивали сходный иммунный ответ на вакцинацию. Иммуногенность у женщин от 15 до 25 лет.
Иммуногенность вакцины Церварикс® в течение 76 месяцев после введения первой дозы в исследовании НPV-001/007 у женщин в возрасте 15–25 лет.
В исследовании HPV-023 продолжительность изучения иммунного ответа составила приблизительно 113 месяцев (9,4 лет) после введения первой дозы вакцины. Результаты этого исследования показали, что 100 % женщин были ссропозитивными в течение 9,4 лет после курса первичной вакцинации.
Тигр антител достигал максимума к 7 месяцу наблюдения, затем несколько снижался, достигая плато к 18 месяцу, и оставался в 10 раз выше уровня антител при естественной ВПЧ-инфекции на протяжении всего периода наблюдения (113 месяцев). Сходные результаты были получены в исследовании HPV-008, где период наблюдения составил 48 месяцев.
Иммуногенность в других возрастных когортах
По данным объединённого анализа (исследования HPV -029, -030, -048), у девочек в возрасте 9 лет наблюдалась 99,7 %-я и 100 %-я сероконверсия к ВПЧ типов 16 и 18, соответственно, к 7 месяцу наблюдения (введены все три дозы вакцины). Среднее геометрическое титров антител было, по крайней мере, в 2 раза выше по сравнению с когортами девочек возраста 10–14 лет и 15–25 лет.
В двух клинических исследованиях (IIPV-012, -013) среди девочек 10–14 лет наблюдалась 100 %-я сероконверсия как к 16, так и к 18 типу ВПЧ к 7 месяцу наблюдения (введены все три дозы вакцины). Среднее геометрическое титров антител было, по крайней мере, в 2 раза выше в этой возрастной когорте по сравнению с когортой 15–25 лет.
В продолжающемся клиническом исследовании (HPV-070) среди девочек 9–14 лет, вакцинированных по 2-дозовой схеме (0–6 месяцев или 0–12 месяцев), у всех вакцинированных наблюдалась сероконверсия к вирусам таких типов как ВПЧ-16 и -18 через 1 месяц после введения второй дозы вакцины. Иммунный ответ у девочек 9–14 лет после введения двух доз вакцины был не менее эффективен, чем иммунный ответ у девушек 15–25 лет после введения трёх доз вакцины.
Вывод об эффективности 2-дозовой схемы введения вакцины Церварикс® был сделан на основании данных по иммуногенности, полученных среди девочек, вакцинированных в возрасте от 9 до 14 лет.
Иммуногенность у женщин 26 лет и старше
В клиническом исследовании III фазы (НPV-015) среди женщин 26 лет и старше к 48 месяцу, то есть через 42 месяца после завершения полной схемы вакцинации, у исходно серонегативных женщин в 100 % и 99,4 %, сохранялись высокие концентрации антител к ВПЧ-16 и ВПЧ-18, соответственно. Титр антител достигал максимума к 7 месяцу наблюдения, а затем постепенно понижался к 18 месяцу и стабилизировался, достигая плато к 48 месяцу.
В другом клиническом исследовании (МРУ-014), проведенном среди женщин 26–55 лет (N=362), все женщины были серопозитивными к ВПЧ-16 и -18 после введения третьей дозы вакцины (до 7 месяца). Среднее геометрическое тигров антител было ниже в данной популяции но сравнению с когортой вакцинированных возраста 15–25 лет. Однако все женщины оставались серопозитивными к ВПЧ-16, и практически все женщины оставались серопозитивными к ВПЧ-18 в период последующего наблюдения (до 48 месяца), при этом уровень антител был существенно выше, чем при естественной ВПЧ-инфекции.
Иммуногенность у ВИЧ-инфицированных женщин
В клиническом исследовании, проведенном у 120 ВИЧ-позитивных лиц без клинического проявления заболевания, в возрасте от 18 до 25 лет (60 участниц получили вакцину Церварикс®, все женщины, вакцинированные препаратом Церварикс®, были серопозитивны по отношению к ВПЧ-16 и -18 после третьей дозы (до 7 месяца), и серопозитивность для типов 16 и 18 сохранялась до 12 месяца. Среднее геометрическое титров было ниже в этой группе по сравнению с группой ВИЧ-негативных лиц, но в 15 раз превышало уровни антител, регистрируемые при естественной ВПЧ-инфекции.
При этом ВИЧ-позитивные лица в возрасте 18–25 лет хорошо переносили вакцинацию препаратом Церварикс®, и вакцинация не влияла на уровень CD4+ Т-лимфоцитов, показатели вирусной нагрузки и прогрессию ВИЧ-инфекции.
Показания
Профилактика персистирующей инфекции, предраковых поражений шейки матки, вульвы и влагалища, рака шейки матки, вульвы, влагалища (плоскоклеточного и аденокарциномы) у девочек и женщин от 9 до 45 лет, обусловленных вирусами папилломы человека высокого онкогенного риска.
Противопоказания
- повышенная чувствительность к любому из компонентов вакцины;
- реакции повышенной чувствительности на предшествующее введение Церварикса ®
Введение Церварикса® должно быть отложено у лиц с острым лихорадочным состоянием, вызванным в том числе обострением хронических заболеваний.
С осторожностью
Церварикс® следует с осторожностью применять при тромбоцитопении или нарушениях свёртывающей системы крови, поскольку во время внутримышечного введения возможно возникновение кровотечений.
В настоящее время нет данных о возможности подкожного введения Церварикса®.
Маловероятно, что Церварикс® может вызвать регрессию поражений, а также предотвратить прогрессирование заболевания, вызванного ВПЧ-16 и/или ВПЧ-18, имевшегося до начала вакцинации, в связи с чем применение вакцины с этой целью не показано. Клинические данные свидетельствуют, что Церварикс® безопасен и иммуногенен при назначении лицам, серопозитивным в отношении ВПЧ-16 и/или ВПЧ-18 типов, у которых при цитологическом исследовании не обнаружены признаки интраэпителиального поражения или имеются только атипичные плоские клетки неясного значения (ASC-US).
Вакцинация не предотвращает инфицирование и заболевания, обусловленные некоторыми типами ВПЧ.
Вакцинация является методом первичной профилактики и не отменяет необходимость проведения регулярных обследований у врача (вторичной профилактики).
В связи с возможностью развития в редких случаях анафилактической реакции, привитые должны находиться под медицинским наблюдением в течение 30 минут, а процедурные кабинеты должны быть обеспечены средствами противошоковой терапии.
У пациентов с иммунодефицитными состояниями, например, при ВИЧ-инфекции, адекватный иммунный ответ может быть не достигнут.
Применение при беременности и в период грудного вскармливания
Беременность
Воздействие вакцины Церварикс® на внутриутробную, перинатальную и постнатальную выживаемость и развитие изучено на животных моделях (крысы). Подобные исследования у животных не подтверждают наличие прямого или косвенного вредного воздействия на фертильность, беременность, внутриутробное развитие, роды или постнатальное развитие.
Данные о беременных женщинах, собранные в ходе клинических исследований, из реестров беременных женщин, в ходе эпидемиологических исследований, не дают оснований предполагать, что риск патологий среди новорождённых, включая пороки развития, изменится. Для заключения о наличии или отсутствии влияния вакцины Церварикс® на риск спонтанного аборта данных недостаточно.
Беременным женщинам и женщинам, планирующим беременность, рекомендуется отложить вакцинацию до завершения беременности.
Период грудного вскармливания
Воздействие на детей, находящихся па грудном вскармливании в момент вакцинации их матерей препаратом Церварикс®, в клинических исследованиях не оценивалось.
Данные серологических исследований показали, что возможно выделение антител к антигенам вакцины с молоком во время лактационного периода у крыс. Неизвестно, происходит ли аналогичная экскреция поствакцинальных антител с человеческим молоком. Применение вакцины Церварикс® в период грудного вскармливания возможно только в случае превышения ожидаемой пользы над риском.Способ применения и дозы
Способ введения
Вакцина Церварикс® вводится внутримышечно, в область дельтовидной мышцы.
Вакцину Церварикс® ни при каких обстоятельствах нельзя вводить внутривенно или внутрикожно. Данные о подкожном введении отсутствуют.
Перед использованием вакцину необходимо визуально проверить на отсутствие посторонних частиц и хорошо встряхнугь шприц или флакон, чтобы получить непрозрачную суспензию белого цвета. При хранении образуется белый осадок с прозрачной бесцветной надосадочной жидкостью, что не является ухудшением качества, после встряхивания осадок должен полностью разбиваться. Если вакцина не соответствует приведенному описанию или содержит посторонние частицы, се следует уничтожить.
Вакцину следует использовать сразу после извлечения из холодильника.
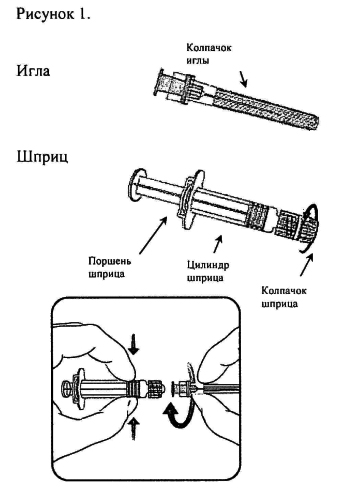
Инструкция по применению вакцины в шприце
- Открутите защитный колпачок шприца, поворачивая его против часовой стрелки (при этом следует удерживать шприц за цилиндр, избегая контакта с поршнем шприца).
- Крутящим движением по часовой стрелке соедините иглу со шприцем до момента, когда вы ощутите их защёлкивание друг на друге (см. рисунок 1).
- Удалите защитный колпачок с иглы (в отдельных случаях он может быть туго закреплён на игле).
- Введите вакцину.
Неиспользованный препарат и отходы от его использования должны быть уничтожены в соответствии с требованиями, принятыми в РФ.
Схемы вакцинации
Разовая доза для всех возрастов составляет 0,5 мл.
Выбор схемы вакцинации зависит от возраста вакцинируемого на момент введения первой дозы вакцины.
Возраст от 9 до 14 лет включительно
Вводят 2 дозы вакцины. Вторую дозу вводят через 5–13 месяцев после введения первой дозы.
Если у девочек данной возрастной группы вторая доза была введена ранее, чем через 5 месяцев после введения первой дозы, третья доза должна вводиться обязательно. В этом случае для данной возрастной группы рекомендована схема вакцинации, включающая введение 3 доз вакцины.
Возраст 15 лет и старше
Начиная с возраста 15 лет и старше, рекомендована исключительно схема вакцинации, включающая введение 3 доз вакцины.
Схема вакцинации, включающая введение 3 доз вакцины: 0-1-6 месяцев. При необходимости изменения графика вакцинации вторая доза может быть введена через 1–2,5 месяца после введения первой дозы, а третья доза — через 5–12 месяцев после введения первой дозы. Необходимость ревакцинации к настоящему времени не установлена. Установлено наличие анамнестического ответа на введение провокационной дозы
Побочное действие
В контролируемых исследованиях вакцины Церварикс® наиболее часто регистрировалась боль в месте инъекции.
Нежелательные реакции, приведённые ниже, сгруппированы по системам органов и частоте встречаемости: очень часто ≥10 %, часто от ≥1 % до <10 %, иногда от ≥0,1 % до <1 %, редко от ≥0,01 % до <0,1 %, очень редко, включая отдельные сообщения <0,01 %.
Со стороны нервной системы: очень часто — головная боль, иногда головокружение.
Со стороны желудочно-кишечного тракта: часто — тошнота, рвота, диарея, боли в области живота.
Со стороны кожи и её придатков: часто — зуд, сыпь, крапивница.
Со стороны костно-мышечной системы и соединительной ткани: очень часто — миалгия, часто — артралгия, редко — мышечная слабость.
Инфекционные осложнения: иногда — инфекции верхних дыхательных путей.
Со стороны организма в целом и связанные с местом введения: очень часто — чувство усталости, местные реакции, включающие боль, покраснение, припухлость; часто — лихорадка (>38 °C); иногда — прочие реакции в месте введения, включающие уплотнение, снижение местной чувствительности, зуд.
Передозировка
До настоящего времени о случаях передозировки не сообщалось.
Взаимодействие с другими лекарственными средствами
Данные о взаимодействии Церварикса® с другими вакцинами при их одновременном применении отсутствуют.
В ходе клинических исследований было установлено, что примерно 60 % женщин, получавших вакцину Церварикс®, применяли пероральные контрацептивы (ПОК). Данные об отрицательном влиянии ПОК на эффективность вакцины Церварикс® отсутствуют.
Предполагается, что у пациентов, получающих иммунодепрессанты, адекватный иммунный ответ может быть не достигнут.
Влияние на способность управлять транспортными средствами, механизмами
Специальных исследований о влиянии вакцины на способности к управлению автомобилем или работе с механизмами не проводилось. Однако, следует учитывать клиническое состояние пациенток и профиль нежелательных реакций.
Форма выпуска
Суспензия для внутримышечного введения.
По 0,5 мл во флаконе из нейтрального стекла тип Ⅰ (Евр. Ф.), укупоренном пробкой из синтетической бутиловой резины (Евр. Ф) и алюминиевым колпачком под обкатку, снабжённым защитной пластиковой крышечкой.
По 0,5 мл в шприце из нейтрального стекла тип Ⅰ (Евр. Ф.), Носик шприца закрыт защитным колпачком.
Комплектность
По 1 флакону в картонной пачке вместе с инструкцией по применению.
По 1 шприцу в блистере из поливинилхлорида (ПВХ), закрытом плёнкой из полиэтилентерефталата (ПЭТ). По 1 блистеру в картонной пачке вместе с инструкцией по применению.
По 1 шприцу с 1 иглой в пластиковом контейнере с канюлей, закрытой пластиковым колпачком, в блистере из ПВХ, закрытом плёнкой из ПЭТ. По 1 блистеру в картонной пачке вместе с инструкцией по применению.
По 1 шприцу с 2 иглами в пластиковых контейнерах с канюлями, закрытыми пластиковыми колпачками, в блистере из ПВХ, закрытом плёнкой из ПЭТ. По 1 блистеру в картонной пачке вместе с инструкцией по применению. Упаковка для лечебно-профилактических учреждений
Флаконы
По 10 флаконов в картонной пачке вместе с инструкцией по применению.
По 100 флаконов в картонной пачке вместе с инструкцией по применению.
Шприцы
По 5 шприцев в блистере из ПВХ, закрытом плёнкой из ПЭТ. По 2 блистера в картонной пачке вместе с инструкцией по применению.
По 10 шприцев в блистере из ПВХ, закрытом плёнкой из ПЭТ. По 1 блистеру в картонной пачке вместе с инструкцией по применению.
По 10 шприцев в картонной пачке со встроенным картонным лотком с защитной перфорацией от несанкционированного вскрытия вместе с инструкцией по применению.
Шприцы могут поставляться без иглы или в комплекте с 1 или 2 иглами в пластиковых контейнерах с канюлями, закрытыми пластиковым колпачком.
Хранение
Хранить при температуре от 2 до 8 °C. Не замораживать.
Хранить в защищённом от света месте.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
GlaxoSmithKline Biologicals, S.A., Бельгия
