Идельвион®
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
| 1 флакон с лиофилизатом содержит: | |||||
| Компонент | Количество | ||||
|---|---|---|---|---|---|
| Действующее вещество | |||||
| 250 ME | 500 ME | 1000 ME | 2000 ME | ||
| Вспомогательные вещества | |||||
| Натрия цитрата дигидрат | 18,4 мг | 18,4 мг | 18,4 мг | 36,8 мг | |
| 45 мг | 72,5 мг | 72,5 мг | 145 мг | ||
| 0,15 мг | 0,3 мг | 0,6 мг | 1,2 мг | ||
| 17,5 мг | 30 мг | 30 мг | 60 мг | ||
| Кислота хлористоводородная | q.s. для доведения pH до 6,8 | ||||
| 1 флакон с растворителем содержит: | |||||
| Вода для инъекций | 2,5 мл | 2,5 мл | 2,5 мл | 5 мл | |
Описание
Лиофилизат: цельная или растрескавшаяся плотная масса, от белого до светло-жёлтого цвета.
Восстановленный раствор: прозрачная или слегка опалесцирующая жидкость от бесцветного до жёлтого цвета.
Растворитель: бесцветная прозрачная жидкость.
Фармакологические свойства
Дозировка 250 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 100 МЕ/мл албутрепенонакога альфа.
Дозировка 500 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 200 МЕ/мл албутрепенонакога альфа.
Дозировка 1000 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 400 МЕ/мл албутрепенонакога альфа.
Дозировка 2000 ME: после восстановления 5 мл воды для инъекций раствор содержит 400 МЕ/мл албутрепенонакога альфа.
Албутрепенонаког альфа представляет собой очищенный белок, получаемый с помощью технологии рекомбинантной ДНК посредством гибридного слияния рекомбинантного альбумина с рекомбинантным фактором свёртывания крови Ⅸ. Гибридное слияние кДНК альбумина человека с кДНК факторфактор свёртывания крови Ⅸ свёртывания крови Ⅸ человека позволяет получать белок в виде отдельного рекомбинантного белка с гарантированной однородностью продукта, избегая химической конъюгации. Фрагмент рекомбинантного фактора Ⅸ идентичен аллельной форме Thr148 фактора Ⅸ, полученного из плазмы. Расщепляемый линкёр между рекомбинантным фактором Ⅸ и молекулами альбумина получают из эндогенного нативного «активационного пептида» в факторе Ⅸ.
Фармакодинамика
Препарат Идельвион® является рекомбинантным фактором свёртывания крови Ⅸ, соединённым с рекомбинантным альбумином, применяемым для лечения гемофилии B у взрослых и детей. Удлинение периода полувыведения албутрепенонаког альфа и усиление системного воздействия достигаются за счёт его гибридного слияния с рекомбинантным альбумином. Структурные и функциональные свойства рекомбинантного фактора свёртывания крови Ⅸ сходны с эндогенным фактором свёртывания крови Ⅸ. Альбумин — естественный, инертный белок-переносчик в плазме крови с периодом полувыведения около 20 дней. Гибридное слияние рекомбинантного фактора свёртывания крови Ⅸ с альбумином увеличивает период полувыведения фактора Ⅸ. При попадании в сосудистое русло препарат Идельвион® остаётся интактным до активации фактора Ⅸ. альбумин расщепляется, высвобождая активированный фактор Ⅸ (фактор Ⅸa), необходимый для нормального свёртывания крови.
Гемофилия B — сцепленное с полом наследственное нарушение свёртывания крови в связи с пониженным уровнем активности фактора Ⅸ, приводящее массивным кровоизлияниям в суставы, мышцы и внутренние органы, как спонтанно, так и в результате травм и оперативных вмешательств. При заместительной терапии уровни фактора Ⅸ в плазме крови повышаются, обеспечивая временную коррекцию дефицита фактора и уменьшает эпизоды кровотечений.
Фактор Ⅸ активируется под влиянием комплекса фактора Ⅶ/тканевого фактора во внешнем пути активации свёртывания крови, также, как и фактор Ⅺa во внутреннем пути коагуляции. Активированный фактор Ⅸ совместно с активированным фактором Ⅷ активирует фактор Ⅹ. Это, в конечном итоге, способствует превращению протромбина в тромбин. Затем тромбин превращает фибриноген в фибрин и формируется тромб. Активность фактора Ⅸ отсутствует или значительно снижена у пациентов с гемофилией В. поэтому таким пациентам может потребоваться заместительная терапия.
Общая информация о клинической эффективности и безопасности
С целью оценки эффективности лечения и профилактики эпизодов кровотечения было проведено исследование фазы 1/2 препарата Идельвион® у 17 пациентов (в возрасте от 13 до 46 лет). 13 пациентов в группе профилактики получали препарат Идельвион® еженедельно с целью профилактики приблизительно в течение 11 месяцев, 4 пациента в группе лечения по требованию получали препарат Идельвион® при возникновении эпизодов кровотечения. Все 85 случаев кровотечения были успешно устранены с помощью 1–2 доз препарата Идельвион®.
Эффективность препарата Идельвион® оценивали в открытой, неконтролируемой части исследования фазы 2/3, в которой 63 пациента мужского пола, ранее получавших лечение, в возрасте от 12 до 61 лет, получали препарат Идельвион® в качестве профилактики каждые 7, 10 и/или 14 дней и/или для лечения эпизодов кровотечений по требованию. У всех пациентов была гемофилия В тяжёлой (уровень фактора Ⅸ <1 %) или умеренной степени (уровень фактора Ⅸ ≤2 %). Сорок пациентов, ранее получавших лечение, получали препарат Идельвион® в качестве профилактики.
Пациенты, получавшие профилактическое лечение, начинали терапию с дозы 35–50 МЕ/кг один раз в неделю. Подгруппа пациентов была переведена на удлинённые интервалы между введениями препарата (каждые 10 или 14 дней) в рекомендованной дозе 75 МЕ/кг, либо дозу корректировали индивидуально. 21 пациентов, ранее получавших лечение, продолжали получать профилактическое лечение с удлинёнными 14-дневными интервалами между введениями препарата дополнительно в течение 98–575 дней (медиана: 386 дней). Из числа данных пациентов 8 (38 %) имели, как минимум, один эпизод кровотечения за 14-дневный период профилактики, тогда как при введении препарата с недельными интервалами случаев кровотечений не отмечалось. Медиана среднегодовой частоты кровотечений при 7-дневном профилактическом режиме применения препарата Идельвон® в отношении всех кровотечений составила 0,0 (диапазон 0–6), и при 14-дневном режиме профилактики — 1,08 (диапазон 0–9,1).
Долгосрочная эффективность и безопасность стандартного профилактического лечения была подтверждена в открытом продлённом исследовании продолжительностью до 5 лет. В данном исследовании 59 пациентов, ранее получавших лечение в возрасте ≥12 лет (54 взрослых и 5 подростков) получали препарат Идельвион® с целью профилактики и/или для лечения эпизодов кровотечений по требованию.
Пациенты, получавшие профилактическое лечение, начинали с дозы 35–50 МЕ/кг один раз в неделю или продолжали приём такой дозы. Подгруппа пациентов, переведённых на режим с продлённым интервалом терапии (каждые 10, 14 дней или 21 день) в рекомендованной дозе 75 МЕ/кг (10 или 14 дней) или 100 МЕ/кг (21 день). В конце исследования 14 (24%) пациентов, ранее получавших лечение, получали профилактическое лечение с 7-дневным интервалом, 11 (19 %), 25 (42 %) и 9 (15 %) пациентов, ранее получавших лечение, продолжали получать режим с продлённым интервалом в 10, 14 дней и 21 день, соответственно. В ходе исследования 2 (18 %) пациента, ранее получавших лечение, получавших терапию с 21-дневным режимом, были переведены обратно на режим с более частым применением препарата в связи с увеличением частоты геморрагических осложнений. Расчётная медиана среднегодовой частоты кровотечений при профилактическом лечении препаратом Идельвион® с 7-, 14- и 21-дневным интервалом (все кровотечения) составляла 1,3 случая (диапазон: 0–8 случаев), 0,9 случаев (диапазон: 0–13 случаев) и 0,3 случая (диапазон: 0–5 случаев), соответственно.
Имеющаяся в настоящее время информация поддерживает удлинение интервала между введениями препарата у некоторых пациентов, хотя это может быть связано с повышением риска кровотечений по сравнению с применением препарата с недельными интервалами. Следует отметить, что среднегодовая частота кровотечений не сопоставима между различными концентратами фактора и в различных клинических исследованиях.
Профилактика и контроль кровотечений у пациентов младше 12 лет, ранее получавших лечение
Эффективность препарата Идельвион® изучали в исследовании фазы 3, в котором 27 пациентов, ранее получавших лечение — мальчиков в возрасте 1–10 лет (медиана возраста 6,0 лет), 12 из них в возрасте <6 лет, получали препарат Идельвион® для профилактики и контроля эпизодов кровотечений. Все 27 пациентов получали еженедельное профилактическое лечение препаратом Идельвион®, в среднем, в течение 13,1 месяцев (9, 18 месяцев).
Из 106 эпизодов кровотечений большинство (94; 88,7 %) были купированы с помощью одной инъекции, 103; 97,2 % были купированы с помощью 1–2 инъекций. Гемостатическую эффективность при разрешении кровотечения оценивали, как «отличную» или «хорошую» в 96 % от всех эпизодов кровотечений.
Долгосрочная эффективность и безопасность стандартного профилактического лечения была подтверждена в открытом продлённом исследовании продолжительностью до 5 лет. В исследовании 24 пациента, ранее получавших лечение в возрасте <12 лет, получали препарат Идельвион® с целью профилактики и/или для лечения эпизодов кровотечений по требованию.
Пациенты, получавшие профилактическое лечение, продолжали получать дозу 35–50 МЕ/кг один раз в неделю. Подгруппа пациентов была переведена на режим с продлённым интервалом введения (каждые 10 или 14 дней) в рекомендованной дозе 75 МЕ/кг. В конце исследования 17 (71 %) ранее леченных пациентов, получали профилактическое лечение с 7-дневным интервалом, 3 (12 %) и 4 (17 %) ранее леченных пациентов продолжали получать режим с интервалом, продлённым до 10 и 14 дней, соответственно. В ходе исследования 4 (50 %) пациента, ранее леченных пациента, получавшие терапию с 14-дневным режимом, были переведены обратно на режим с более частым применением препарата в связи с увеличением частоты геморрагических осложнений. Расчётная медиана среднегодовой частоты кровотечений при профилактическом применении препарата Идельвион® с 7- и 14-дневным интервалом (все кровотечения) составила 2,0 случая (диапазон: 0–14 случаев) и 5,6 случая (диапазон: 0–8 случаев), соответственно.
Периоперационное лечение
Безопасность и эффективность препарата Идельвион® в периоперационных условиях оценивали в двух базовых исследованиях фазы 3 и в долгосрочном расширенном исследовании. Анализ эффективности в соответствии с протоколом включает 30 операций, проведённых у 21 пациента в возрасте от 5 до 58 лет, которым проводили обширные и малые хирургические вмешательства, стоматологические и другие инвазивные хирургические процедуры. Дозу подбирали индивидуально в зависимости от фармакокинетики у пациента и клинического ответа на лечение. При 96,7 % (n = 29) хирургических вмешательствах препарат вводили однократно болюсно в дозе от 14 до 163 МЕ/кг. Гемостатическую эффективность оценивали, как «отличную» или «хорошую» при всех исследуемых процедурах. В течение 14-дневного послеоперационного периода пациенты получали от 0 до 11 инфузий, общие дозы варьировали от 0 до 444 МЕ/кг.
Фармакокинетика
Взрослые пациенты
Фармакокинетику препарата Идельвион® оценивали после внутривенного введения однократной дозы 50 МЕ/кг. Фармакокинетические (ФК) параметры были основаны на активности фактора Ⅸ в плазме, измеренной с помощью одностадийного анализа коагулирующей активности (см. таблицу 1). Средняя величина активности фактора Ⅸ после однократной дозы 50 МЕ/кг препарата Идельвион® на 7 и 14 день составила 13,76 % и 6,10 % соответственно. Повторная оценка ФК параметров на протяжении до 30 недель показала стабильный профиль фармакокинетики, а постепенное восстановление активности в динамике было стабильным.
Минимальные уровни от 5–10 % были проанализированы в клинических исследованиях с целью обеспечения контроля кровотечений в период профилактики. Исходя из результатов ФК-имитации, время до достижения 5 % активности фактора Ⅸ в плазме крови после однократной инъекции 50 МЕ/кг препарата Идельвион® составляет 12,5 дней у взрослых пациентов.
| Параметр | Доза 50 МЕ/кг (n = 22) |
|---|---|
| ППАа (МЕ/дл)/(МЕ/кг) | 1,18 (0,86; 1.86) |
| Cmaxа(МЕ/дл) | 62,7 (40,5; 87,0) |
| AUC0–inf (ч × МЕ/дл) | 6638 (2810; 9921) |
| t½ (4) | 95,3 (51,5; 135,7) |
| КЛ (мл/ч/кг) | 0,875 (0,748; 1,294) |
а = скорректировано с учётом исходных уровней.
ППА = показатель повышения активности фактора Ⅸ; AUC = площадь под кривой зависимости активности фактора Ⅸ от времени; КЛ = клиренс, скорректированный с учётом массы тела; ½ = период полувыведения.
Пациенты детского возраста
Фармакокинетику препарата Идельвион® у детей и подростков (в возрасте от 1 года до 18 лет) оценивали после внутривенного введения однократной дозы 50 МЕ/кг. Фармакокинетические параметры основаны на активности фактора Ⅸ в плазме, измеренной с помощью одностадийного анализа коагулирующей активности (см. таблицу 2).
| Параметр | Возраст от 1 до 6 лет (n = 12) | Возраст от 6 до 12 лет (n = 15) | Возраст от 12 до 18 лет (n = 5) |
|---|---|---|---|
| ППАа (МЕ/дл)/(МЕ/кг) | 0,968 (0,660; 1,280) | 1,07(0,70; 1,47) | 1,11 (0.84; 1,61) |
| Cmaxа (МЕ/дл) | 48.2 (33,0; 64,0) | 50,5 (34,9; 73,6) | 55,3 (40,5; 80,3) |
| AUC0–inf (ч × МЕ/дл) | 4301 (2900; 8263) | 4718 (3212; 7720) | 4804 (2810; 9595) |
| t½ (ч) | 86,2 (72,6; 105,8) | 89,0 (62,1; 123,0) | 88,8 (51,5; 130,0) |
| КЛ (мл/ч/кг) | 1,16 (0,61; 1,72) | 1,06 (0.65; 1,56) | 1,04 (0,52; 1,67) |
а = скорректировано с учётом исходных уровней.
ППА = показатель повышения активности фактора Ⅸ; AUC = площадь под кривой зависимости активности фактора Ⅸ от времени; КЛ = клиренс, скорректированный с учётом массы тела; t½ = период полувыведения.
Минимальные уровни клинически значимой активности фактора Ⅸ от 5–10 % были проанализированы в клинических исследованиях с целью обеспечения контроля кровотечений в период профилактики. Исходя из результатов ФК-имитации, время до достижения 5 % активности фактора Ⅸ в плазме крови после однократной инъекции 50 МЕ/кг препарата Идельвион® составляет 7 дней у детей в возрасте от 1 до <6 лет, 9 дней от 6 до <12 лет и 11 дней от 12 до <18 лет.
Показания
Лечение и профилактика кровотечений у пациентов с гемофилией B (врождённый дефицит фактора свёртывания крови Ⅸ).
Препарат Идельвион® показан к применению во всех возрастных группах.
Противопоказания
Гиперчувствительность к действующему веществу, белкам хомяка или непереносимость любого из компонентов, входящих в состав препарата.
С осторожностью
- Заболевания печени
- послеоперационный период
- пациенты с риском развития тромбозов или диссеминированного внутрисосудистого свёртывания крови (ДВС-синдром)
- возраст до 1 года и более 65 лет (отсутствие данных об эффективности и безопасности).
Беременность и лактация
Доклинических исследований репродуктивной токсичности фактор свёртывания крови Ⅸ не проводилось. Учитывая, что гемофилия типа В очень редко наблюдается у женщин, отсутствуют данные об опыте применения препаратов фактора Ⅸ во время беременности и в период грудного вскармливания. В связи с этим во время беременности и в период грудного вскармливания препарат Идельвион® рекомендуется применять при наличии чётких клинических показаний.
Отсутствуют данные о влиянии препаратов фактора свёртывания крови Ⅸ на фертильность.
Способ применения и дозы
Только для внутривенного введения! Терапия препаратом Идельвион® должна проводиться врачами, имеющими опыт лечения пациентов с гемофилией B.
Пациенты, ранее не получавшие лечение
Безопасность и эффективность препарата Идельвион® у пациентов, ранее не получавших лечения, на сегодняшний день не установлены.
Контроль лечения
В ходе лечения рекомендуется определять уровень фактора Ⅸ для регулирования дозы и частоты повторных инфузий. У разных пациентов могут варьировать реакции на введение фактора Ⅸ с различными периодами полувыведения и восстановлением. Доза, рассчитанная, исходя из массы тела, может потребовать корректировки у пациентов с недостаточной или избыточной массой тела. В случае обширных хирургических вмешательств, в частности, тщательный контроль заместительной терапии посредством анализа свёртываемости крови (активность фактора Ⅸ в плазме крови) является обязательным.
При использовании активированного частичного тромбопластинового времени (АЧТВ) на основе in vitro одностадийного анализа коагулирующей активности для определения активности фактора Ⅸ в образцах крови пациентов результаты активности фактора свёртывания Ⅸ в плазме могут в значительной степени изменяться под влиянием типа АЧТВ-реагента и стандартного образца, используемых при количественном определении. Измерение с помощью одностадийного анализа коагулирующей активности с использованием АЧТВ-реагента на основе каолина или АЧТВ-реагента на основе Актина FS, скорее всего, приведёт к заниженному результату уровня активности. Это имеет особое значение при смене лаборатории и/или реагентов, используемых при количественном определении.
Режим дозирования
Дозы и продолжительность заместительной терапии препаратом Идельвион® зависят от степени тяжести дефицита фактора Ⅸ, локализации и выраженности кровотечения и клинического состояния пациента.
Количество вводимых единиц фактора Ⅸ измеряется в международных единицах (ME), что соответствует действующему стандарту Всемирной Организации Здравоохранения (ВОЗ) для препаратов, содержащих фактор свёртывания крови Ⅸ. Активность фактора Ⅸ в плазме выражается в процентах (относительно нормальной плазмы человека) или в ME (относительно международного стандарта содержания фактора Ⅸ в плазме).
1 ME активности фактора свёртывания крови Ⅸ эквивалентна количеству фактора Ⅸ в 1 мл нормальной плазмы человека.
Лечение по требованию
Расчёт необходимой дозы фактора Ⅸ основывается на эмпирически определённой закономерности, согласно которой 1 ME фактора свёртывания крови Ⅸ на килограмм массы тела повышает активность фактора Ⅸ в крови в среднем примерно на 1,3 МЕ/дл (1,3 % от исходной активности) у пациентов >12 лет и на 1,0 МЕ/дл (1,0 % от исходной активности) у пациентов <12 лет.
Необходимую дозу рассчитывают с использованием следующей формулы:
Необходимая доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (% от нормальной активности или МЕ/дл) × (обратная величина наблюдаемого восстановления (МЕ/кг на МЕ/дл)).
Ожидаемый уровень повышения фактора Ⅸ (МЕ/дл или % от нормальной активности) = Доза (ME) × Восстановление (МЕ/дл на МЕ/кг)/масса тела (кг)
При выборе дозы и частоты введения препарата следует всегда ориентироваться на клиническую эффективность в каждом индивидуальном случае.
Для пациентов <12 лет
Для постепенного восстановления 1 МЕ/дл на 1 МЕ/кг дозу рассчитывают следующим образом:
Доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (МЕ/дл) × 1 дл/кг.
Пример:
1. Максимальный уровень 50 % от нормальной активности требуется пациенту с массой тела 20 кг и тяжёлой гемофилией В.
Соответствующая доза составит 20 кг × 50 МЕ/дл × 1 дл/кг = 1000 ME.
2. Доза 1000 ME препарата Идельвион®, вводимая пациенту с массой тела 25 кг, должна обеспечить максимальное повышение уровня фактора свёртывания крови Ⅸ после инъекции 1000 МЕ/25 кг × 1,0 (МЕ/дл на МЕ/кг) = 40 МЕ/дл (40 % от нормальной активности).
Для пациентов ≥12 лет
Для постепенного восстановления 1,3 МЕ/дл на 1 МЕ/кг дозу рассчитывают следующим образом:
Доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (МЕ/дл) × 0,77 дл/кг.
Пример:
3. Максимальный уровень 50 % от нормальной активности требуется пациенту с массой тела 80 кг и тяжёлой гемофилией B.
Соответствующая доза составит 80 кг × 50 МЕ/дл × 0,77 дл/кг = 3080 ME.
4. Доза 2000 ME препарата Идельвион®, вводимая пациенту с массой тела 80 кг, должна обеспечить максимальное повышение уровня фактора свёртывания крови Ⅸ после инъекции 2000 ME × 1,3 (МЕ/дл на МЕ/кг)/80 кг = 32,5 МЕ/дл (32,5 % от нормальной активности).
Доза и частота введения должна рассчитываться с учётом клинической эффективности в каждом индивидуальном случае.
В случаях кровотечений, приведённых в таблице 3, активность фактора Ⅸ за соответствующий период времени не должна быть ниже указанного в таблице уровня активности плазмы (в % от нормального уровня или МЕ/дл). Таблица 3 может быть использована для расчёта доз препарата при кровотечениях и в хирургической практике.
| Тяжесть кровотечения / тип хирургического вмешательства | Требуемый уровень фактора Ⅸ (% или МЕ/дл) | Частота введения доз (часы) / продолжительность терапии (дни) |
|---|---|---|
| Кровотечение Слабовыраженный или умеренный гемартроз, внутримышечное кровотечение (кроме подвздошно-поясничной мышцы) или кровотечение в полости рта | 30–60 | Однократной дозы должно быть достаточно для большинства кровотечений. Повторное введение через 24–72 часа при наличии признаков продолжающегося кровотечения. |
| Массивные кровотечения Кровотечения, представляющие угрозу для жизни, кровотечения в глубоких мышцах, включая подвздошно-поясничную мышцу | 60–100 | Повторные инфузии каждые 24–72 часа в течение первой недели, затем поддерживающая доза еженедельно до прекращения кровотечения или заживления. |
| Малые хирургические вмешательства Включая неосложнённое удаление зубов | 50–80 (начальный уровень) | Однократной дозы может быть достаточно для большинства кровотечений. При необходимости повторную дозу можно вводить через 24–72 часа до прекращения кровотечения или заживления. |
| Большие хирургические вмешательства | 60–100 (начальный уровень) | Повторные инфузии каждые 24–72 часа в течение первой недели, затем поддерживающая доза 1–2 раза в неделю до прекращения кровотечения или заживления. |
Профилактическое лечение
После эпизода кровотечения следует строго соблюдать профилактический режим путём введения 2 доз препарата Идельвион® с интервалом не менее 24 часов между ними, возможен более длительный интервал, исходя из состояния пациента.
При долгосрочной профилактике кровотечений у пациентов с тяжёлой формой гемофилии B препарат Идельвион® обычно применяется в дозе от 35 до 50 МЕ/кг один раз в неделю. Некоторым пациентам, находящимся на контроле при введении препарата один раз в неделю, можно назначать до 75 МЕ/кг с интервалом от 10 или 14 дней. У пациентов старше 18 лет возможно увеличение интервала терапии (см. раздел «Фармакологические свойства. Фармакодинамика»).
В некоторых случаях, особенно у молодых пациентов, могут потребоваться более короткие интервалы или более высокие дозы.
Пациенты детского возраста
Для стандартной профилактики кровотечений рекомендованный режим дозирования составляет от 35 до 50 МЕ/кг один раз в неделю (см. раздел «Фармакологические свойства. Фармакодинамика» и раздел «Фармакологические свойства. Фармакокинетика»).
Способ введения
Восстановленный раствор вводят внутривенно медленно. Рекомендуемая скорость введения должна быть не более 5 мл/минуту.
Приготовление восстановленного раствора
Приготовление восстановленного раствора препарата следует проводить в асептических условиях. Для приготовления и введения препарата Идельвион® следует использовать только прилагаемые в комплекте растворитель и устройство для добавления растворителя Mix2Vial, так как в связи с адсорбцией фактора Ⅸ на внутренней поверхности некоторых устройств для введения лечение может оказаться неэффективным. Довести растворитель до комнатной температуры (около 25 °C). Убедиться, что крышки с флаконов с растворителем и препаратом удалены, пробки обработаны антисептическим раствором и высушены до открытия устройства для добавления растворителя Mix2Vial.
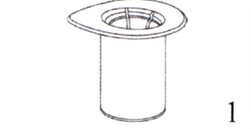
1. Снимите крышку с упаковки устройства для добавления растворителя со встроенным фильтром Mix2Vial. Не вынимайте устройство для добавления растворителя со встроенным фильтром Mix2Vial из блистерной упаковки!
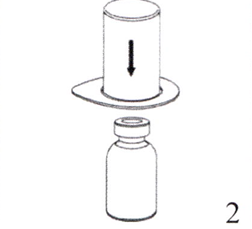
2. Поместите флакон с растворителем на ровную чистую поверхность, крепко удерживая его. Возьмите устройство Mix2Vial вместе с блистерной упаковкой и острым стержнем синей части устройства проткните пробку флакона с растворителем, надавливая вертикально вниз.
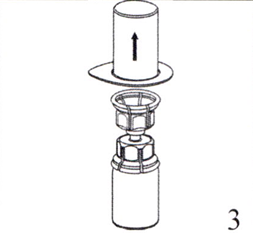
3. Аккуратно придерживая за край блистерной упаковки устройства Mix2Vial, снимите блистерную упаковку по направлению вертикально вверх. Убедитесь, что вы удалили только блистерную упаковку, а не само устройство Mix2Vial.
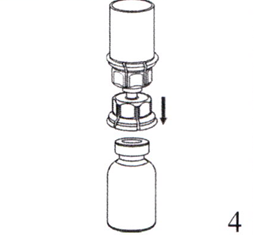
4. Поместите на ровную поверхность флакон с препаратом, и переверните над ним флакон с растворителем вместе с прикреплённым к нему устройством Mix2Vial, затем стержнем прозрачной части устройства для добавления растворителя проткните пробку флакона с препаратом, надавливая вертикально вниз. Растворитель автоматически переместится во флакон с препаратом.
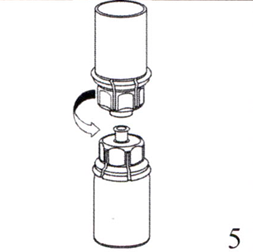
5. Одной рукой обхватите устройство для добавления растворителя Mix2Vial со стороны флакона с препаратом, другой — со стороны флакона с растворителем и, аккуратно развинтите устройство на две части, избегая сильного пенообразования при растворении лиофилизата. Флакон из под растворителя с синей частью присоединённого устройства для добавления растворителя Mix2Vial следует выбросить.
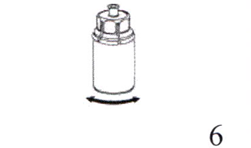
6. Аккуратно покрутите флакон с препаратом с присоединённым прозрачным устройством до полного растворения препарата. Не встряхивайте флакон.
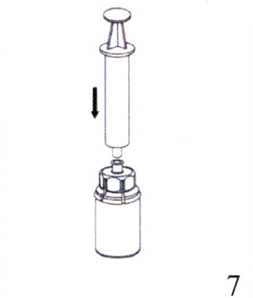
7. Наберите воздух в пустой стерильный шприц и, удерживая флакон с препаратом в вертикальном положении, присоедините шприц к наконечнику Люэра на устройстве Mix2Vial. Введите воздух во флакон с препаратом.
Набор и введение препарата
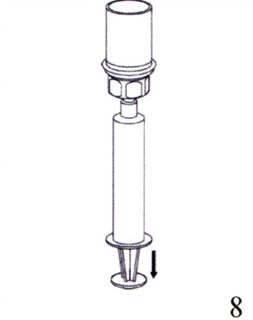
8. Нажимая на поршень шприца, переверните флакон вместе со шприцем. Плавно оттягивая поршень шприца, наберите в него восстановленный раствор.
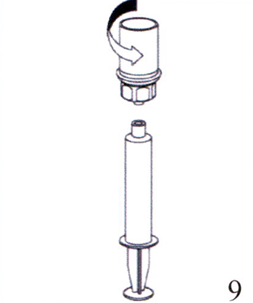
9. После того, как восстановленный раствор набран в шприц, обхватите цилиндр шприца (удерживая шприц вниз поршнем) и отсоедините прозрачное устройство Mix2Vial от шприца.
Восстановленный раствор должен быть прозрачным или слегка опалесцирующим, бесцветным или желтоватым. После фильтрования/извлечения (см. выше) и перед введением восстановленный раствор препарата следует проверить визуально на наличие механических включений и изменение цвета. Не использовать восстановленный раствор, если раствор помутнел или изменил цвет, а также, если в растворе наблюдаются механические включения! Восстановленный раствор готовят непосредственно перед применением. Неиспользованный раствор подлежит уничтожению.
При проведении инъекции не допускать попадания крови в шприц с препаратом, так как это может вызвать коагуляцию крови в шприце и попадания сгустков в кровоток пациента! Восстановленный раствор препарата Идельвион® дальнейшему разведению не подлежит. После восстановления химическая и физическая стабильность раствора во время использования сохраняется в течение 8 часов при температуре от 20 до 25 °C, однако форма выпуска не содержит консерванты, поэтому с микробиологической точки зрения препарат следует применять немедленно. Если его не использовали сразу, время и условия хранения до использования не должны превышать 4 часов при температуре не выше 25 °C.
Побочные эффекты
Гиперчувствительность или аллергические реакции (включая ангионевротический отёк, ощущение жжения и покалывания в месте введения, озноб, гиперемию, генерализованную крапивницу, головную боль, кожную сыпь, артериальную гипотензию, заторможенность, тошноту, беспокойство, тахикардию, ощущение сдавления в грудной клетке, звон в ушах, рвоту, свистящее дыхание) наблюдаются редко и могут прогрессировать вплоть до развития тяжёлой анафилаксии (включая шок). В некоторых случаях данные реакции прогрессировали до тяжёлой анафилаксии и возникали в тесной временной взаимосвязи с образованием ингибиторов фактора Ⅸ (см. также раздел «Особые указания»). Сообщалось о развитии нефротического синдрома после попытки индукции иммунной толерантности у пациентов с гемофилией типа В, наличием ингибиторов к фактору Ⅸ и случаев аллергических реакций в анамнезе.
Очень редко сообщалось об образовании антител к белкам хомяков.
У пациентов с гемофилией B могут образовываться нейтрализующие антитела (ингибиторы) к фактору свёртывания крови Ⅸ. При появлении таких ингибиторов состояние проявляется в виде недостаточного клинического ответа. В таких случаях рекомендуется связаться со специализированным центром по лечению гемофилии. Образование ингибиторов отмечалось, как и в продолжающемся клиническом исследовании с участием ранее не леченных пациентов, так и у ранее леченных пациентов в пострегистрационном периоде применения препарата Идельвион®.
Существует потенциальный риск развития эпизодов тромбоэмболии после введения препаратов, содержащих фактор Ⅸ, особенно высокий при применении препаратов низкой степени очистки. Применение препаратов фактора Ⅸ низкой степени очистки приводило к случаям инфаркта миокарда, диссеминированного внутрисосудистого свёртывания, венозного тромбоза и тромбоэмболии лёгочной артерии. Применение препаратов фактора Ⅸ с высокой степенью очистки редко приводило к подобным нежелательным реакциям.
Тип, частота и тяжесть нежелательных реакций у детей сопоставимы с таковыми у взрослых пациентов.
Табличный перечень нежелательных реакций
В ходе пяти открытых клинических исследований с участием 114 пациентов, получивших как минимум одну дозу препарата Идельвион®, в общем было выявлено 14 нежелательных реакций у 8 пациентов.
Ниже представлены нежелательные реакции с частотой возникновения согласно классификации MedDRA. Частота указана по следующим категориям: очень часто (≥1/10), часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000) очень редко (<1/10000), неизвестно (частота не может быть оценена на основании имеющихся данных).
| Классификация в соответствии с поражением органов и систем органов (MedDRA) | Нежелательные реакции | Частота встречаемости на пациента |
| Нарушения со стороны крови и лимфатической системы | Ингибирование фактора Ⅸ/образование ингибиторов | Частота неизвестна |
| Общие нарушения и реакции в месте введения | Реакции в месте введения | Часто |
| Нарушения со стороны иммунной системы | Гиперчувствительность | Нечасто |
| Нарушения со стороны нервной системы | Головная боль | Часто |
| Головокружение | Часто | |
| Нарушения со стороны кожи и подкожной клетчатки | Кожная сыпь | Нечасто |
| Экзема | Нечасто |
Описание отдельных нежелательных реакций
У одного пациента, ранее не получавшего лечения, в продолжающемся клиническом исследовании были выявлены высокие титры ингибиторов к фактору Ⅸ. Данных о частоте образования ингибиторов у пациентов, ранее не получавших лечение, недостаточно.
Применение у детей
Ожидается, что частота встречаемости, тип и степень тяжести нежелательных реакций у детей будут такими же, как у взрослых.
Передозировка
О случаях передозировки препаратом Идельвион® не сообщалось.
Взаимодействие
Исследования лекарственного взаимодействия препарата Идельвион® с другими лекарственными препаратами не проводилось. Для приготовления и введения препарата Идельвион® следует использовать только прилагаемые в комплекте растворитель и устройство для добавления растворителя Mix2Vial. Не следует смешивать препарат с другими лекарственными средствами в одном шприце.
Особые указания
Прослеживаемость
С целью улучшения прослеживаемости биологических лекарственных препаратов необходимо отчётливо указывать наименование и номер серии вводимого препарата.
Гиперчувствительность
Как и в случае внутривенного введения любого препарата, содержащего белок, при применении препарата Идельвион® возможно развитие аллергических реакций гиперчувствительности немедленного типа. Пациентов необходимо информировать о ранних симптомах реакций гиперчувствительности, таких как кожная сыпь, генерализованная крапивница, ощущение сдавления в грудной клетке, свистящее дыхание, артериальная гипотензияи анафилаксия. Рекомендуется, чтобы первоначальное введение препарата Идельвион® проводилось под медицинским наблюдением, при котором может быть оказана надлежащая медицинская помощь при аллергических реакциях. В случае возникновения симптомов аллергической реакции (в том числе анафилаксии) введение препарата следует немедленно прекратить и обеспечить соответствующие меры по оказанию медицинской помощи.
Ингибиторы фактора Ⅸ
У пациентов, получающих терапию препаратом Идельвион®, необходимо проводить мониторинг образования ингибиторов к фактору свёртывания крови Ⅸ, используя лабораторные и клинические методы. В литературе были отмечены случаи, демонстрирующие корреляцию между возникновением ингибиторов к фактору Ⅸ и аллергическими реакциями. Пациенты с аллергическими реакциями должны быть обследованы на наличие ингибиторов. Следует отметить, что пациенты с ингибиторами к фактору Ⅸ могут подвергаться повышенному риску развития анафилаксии при последующем введении фактора Ⅸ.
В связи с риском развития аллергических реакций после введения препарата, содержащего фактор Ⅸ, первоначальное введение фактора Ⅸ должно осуществляться под медицинским наблюдением с обеспечением соответствующих мер в случае развития аллергических реакций.
У пациентов с гемофилией B могут образовываться нейтрализующие антитела (ингибиторы) к фактору свёртывания крови Ⅸ. У пациентов с высоким содержанием ингибиторов к фактору Ⅸ применение препарата Идельвион® может оказаться неэффективным.
Тромбоэмболия
В связи с потенциальным риском развития тромботических осложнений при применении препарата необходимо проводить клиническое наблюдение за ранними симптомами возникновения тромбоэмболии и коагулопатии потребления и необходимую лабораторную диагностику у пациентов подверженных риску возникновения тромбоза или ДВС, включая пациентов с заболеванием печени, пациентов после оперативных вмешательств и новорождённых. В каждой из этих ситуаций пользу лечения препаратом Идельвион® необходимо сопоставлять с риском данных осложнений.
Сердечно-сосудистые заболевания
У пациентов из группы риска по развитию сердечно-сосудистых заболеваний применение препаратов фактора Ⅸ может повышать риск развития сердечно-сосудистых осложнений.
Осложнения, связанные с катетеризацией
При необходимости центрального венозного доступа (ЦВД) следует учитывать риск развития осложнений, связанных с ЦВД, включая местные инфекции, бактериемию и тромбоз в месте катетеризации.
Пациенты детского возраста
Перечисленные особые указания и меры предосторожности применимы как у взрослых, так и у детей.
Индукция иммунной толерантности
Безопасность и эффективность применения препарата Идельвион® для индукции иммунной толерантности не установлены.
Натрий
Следует учитывать, что препарат Идельвион® содержит около 25,8 мг (1,13 ммоль) натрия на дозу (масса тела 70 кг) при применении максимальной дозы (15 мл = 6000 ME). Это соответствует 1,29 % от максимальной суточной дозы, рекомендованной ВОЗ 2 г натрия в день у взрослых.
Влияние на способность управлять транспортными средствами или работать с механизмами
Препарат Идельвион® не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения, 250 МЕ, 500 МЕ, 1000 МЕ, 2000 МЕ.
Хранение
Хранить при температуре от 2 до 25 °C в защищённом от света месте.
Хранить в недоступном для детей месте.
Срок годности
3 года (лиофилизат).
5 лет (растворитель «Вода для инъекций»).
Примечание: срок годности комплекта определяется по наименьшему сроку годности одного из компонентов.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Идельвион:
