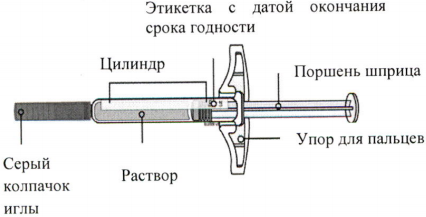
Иринэкс
IrinexРегистрационный номер
Торговое наименование
Иринэкс
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
1 мл препарата содержит:
действующее вещество: эренумаб 140 м г;
вспомогательные вещества: сахароза, полисорбат-80, уксусная кислота ледяная, натрия гидроксид, вода для инъекций.
Описание
Раствор от бесцветного до светло-жёлтого цвета.
Характеристика препарата
Эренумаб представляет собой человеческое моноклональное антитело класса G2 (IgG2), с высокой аффинностью связывающееся с рецептором кальцитонин-ген-родственного пептида (CGRP). Эренумаб состоит из 2 тяжёлых цепей, в каждой из которых содержится по 456 аминокислот, и 2 лёгких цепей подкласса лямбда, состоящих из 216 аминокислот. Приблизительная молекулярная масса составляет 150 кДа. Эренумаб производится по технологии рекомбинантной ДНК в клетках яичников китайского хомячка (СНО).
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Эренумаб — это человеческое моноклональное антитело, являющееся антагонистом рецептора CGRP, и не обладает значимой фармакологической активностью в отношении рецепторов адреномедуллина, кальцитонина и амилина, а также агонистической активностью в отношении рецептора CGRP.
CGRP — это нейропептид, модулирующий передачу ноцицептивных сигналов, и вазодилататор, связанный с патофизиологией мигрени. Показано, что в отличие от других нейропептидов, концентрация CGRP значительно увеличивается во время приступа мигрени и возвращается к норме после его разрешения. Внутривенное (в/в) введение CGRP вызывает у пациентов мигренеподобную головную боль, из чего можно предположить, что CGRP может являться причиной возникновения мигрени.
Рецептор к CGRP локализуется на участках, имеющих отношение к патофизиологии мигрени. Эренумаб является мощным и специфичным конкурентом CGRP за связывание с рецептором и тем самым подавляет его действие на рецептор.
Фармакодинамика
В рандомизированном двойном слепом плацебо-контролируемом исследовании по оценке эффективности однократного в/в введения эренумаба в дозе 140 мг у пациентов со стабильной стенокардией не отмечалось снижения переносимости физической нагрузки при нагрузочной ЭКГ-пробе (на тредмил-тесте) по сравнению с плацебо и усугубления ишемии миокарда.
Клинические данные
Эренумаб оценивался в 3 базовых исследованиях по изучению профилактического лечения эпизодической и хронической мигрени. В исследования были включены пациенты с мигренью с аурой или без ауры в анамнезе в соответствии с диагностическими критериями Международной классификации головной боли (the International Classification of Headache Disorders, ICHD-III).
Эренумаб продемонстрировал статистически и клинически значимые улучшения ключевых показателей эффективности по сравнению с плацебо.
Хроническая мигрень
Эренумаб оценивался в качестве монотерапии для профилактики хронической мигрени в рандомизированном многоцентровом 12-недельном плацебо-контролируемом двойном слепом исследовании у пациентов, страдающих мигренью с аурой или без неё (≥15 дней с головной болью в месяц и ≥8 дней мигрени в месяц).
В клиническом исследовании пациентов с хронической мигренью эффективность применения препарата оценивалась на основании изменения количества дней с мигренью в течение месяца (ДММ) к 3 месяцу по сравнению с таковым показателем до лечения эренумабом (исходный уровень). Вторичными показателями эффективности служили снижение количества ДММ на 50–100 % относительно исходного уровня (ответ ≥50 %), изменение относительно исходного уровня количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени. На рисунке 1 и в таблице 1 приведены ключевые результаты исследования. Анализ ежемесячных изменений показал, что среднемесячное количество дней с мигренью снизилось по сравнению с плацебо уже в первый месяц, а последующий анализ еженедельных изменений показал, что эффект эренумаба развивался уже на первой неделе после инъекции.
Рисунок 1. Динамика изменения количества ДММ относительно исходного уровня у пациентов с хронической мигреньюa.
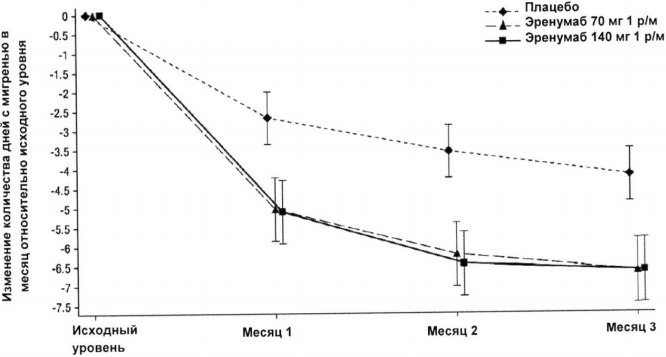
a Представлены среднеквадратичные средние значения и 95%-ные доверительные интервалы. Все p-значения для разницы в среднеквадратичных средних между группами эренумаба и плацебо, которые оценивали в месяц 3 (главный показатель эффективности), составляли <0,001.
| Эренумаб 70 мг (n = 188) | Эренумаб 140 мг (n = 187) | Плацебо (n = 281) | Межгрупповая разница/ Отношение шансов | pa | |
|---|---|---|---|---|---|
| ДММ | |||||
| Среднее изменениеb (95 % ДИ) | -6,6 (-7,5; -5,8) | -6,6 (-7,5; -5,8) | -4,2 (-4,9; -3,5) | 70 мг -2,5 (-3,5; -1,4) 140 мг -2,5 (-3,5; -1,4) | <0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 39,9 | 41,2 | 23,5 | ||
| Отношение шансовc (95 % ДИ) | 70 мг 2,18 (1,46; 3,27) 140 мг 2,34 (1,56; 3,51) | <0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 17,0 | 20,9 | 7,8 | ||
| Отношение шансов (95 % ДИ) | Не применимо | Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb (95 % ДИ) | -3,45 (-4,02; -2,87) | -4,13 (-4,70; -3,56) | -1,58 (-2,05;-1,11) | Не применимо | <0,001 |
| Результаты субъективных ответов пациентов | |||||
| HIT 6 | |||||
| Среднее изменениеb (95 % ДИ) | -5,6 (-6,5; -4,6) | -5,6 (-6,5;-4,6) | -3,1 (-3,9; -2,3) | 70 мг -2,5 (-3,7; -1,2) 140 мг -2,5 (-3,7; -1,2) | Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменениеb (95 % ДИ) | -19,4 (-25,2; -13,6) | -19,8 (-25,6; -14,0) | -7,55 (-12,4; -2,7) | 70 мг -11,9 (-19,3; -4,4) 140 мг -12,2 (-19,7; -4,8) | Не применимо |
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение к месяцу 3 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, среднемесячное значение на исходном уровне, факторы стратификации (регион [Северная Америка или Европа] и злоупотребление лекарственными препаратами [имеется или отсутствует]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % к 3 месяцу основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактической терапии, разница в сокращении ДММ, наблюдаемая между дозой 140 мг и плацебо, составляла -3,3 дня (95 % ДИ: -4,6; -2,1), а между дозой 70 мг и плацебо — -2,5 дня (95 % ДИ: -3,8; -1,2). У пациентов, у которых не было достигнуто клинического ответа на два или более метода профилактической терапии, разница ДММ составляла -4,3 дня (95 % ДИ: -5,8; -2,8) между дозой 140 мг и плацебо и -2,7 дня (95 % ДИ: -4,2; -1,2) между дозой 70 мг и плацебо соответственно. Доля пациентов, получавших эренумаб, которые достигли по меньшей мере 50 % сокращения ДММ, была выше по сравнению с группой плацебо среди пациентов, не достигших клинического ответа на один или несколько методов профилактической терапии (40,8% для дозы 140 мг и 34,7 % для дозы 70 мг против 17,3 % для плацебо), с отношением шансов 3,3 (95% ДИ: 2,0; 5,5) для дозы 140 мг и 2,6 (95 % ДИ: 1,6; 4,5) для дозы 70 мг. У пациентов, не достигших клинического ответа после применения двух или более методов профилактической терапии, доля составила 41,3 % для дозы 140 мг и 35,6 % для дозы 70 мг против 14,2 % для плацебо с отношением шансов 4,2 (95 % ДИ: 2,2; 7,9) и 3,5 (95 % ДИ: 1,8; 6,6) соответственно.
Эпизодическая мигрень
Эренумаб оценивался в качестве средства для профилактики эпизодической мигрени в рандомизированном многоцентровом 24-недельном плацебо-контролируемом двойном слепом исследовании у пациентов, страдающих мигренью с аурой или без неё (4–14 дней мигрени в месяц).
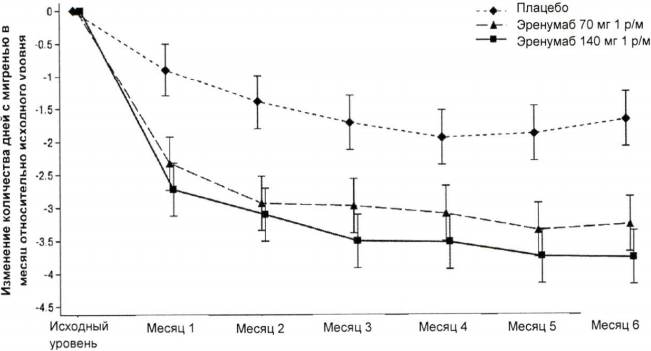
В клиническом исследовании пациентов с эпизодической мигренью эффективность применения препарата оценивалась на основании изменения среднемесячного количества дней с мигренью в течение месяцев 4–6 относительно исходного уровня. Вторичными показателями эффективности служили снижение на 50–100 % относительно исходного уровня среднего количества ДММ (ответ ≥50 %), изменение относительно исходного уровня среднего количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени, и изменение относительно исходного уровня показателей по двум доменам опросника MPFID (Дневник влияния мигрени на физическую активность), связанных с ухудшением физического состояния (УФС) и повседневной активностью (ПА). Опросник MPFID — это инструмент для оценки исходов, сообщаемых пациентами, который позволяет измерить влияние мигрени на физическое функционирование (физическую активность). Он содержит 13 пунктов для оценки влияния мигрени в течение прошедших 24 часов на два аспекта физического функционирования, представляющих интерес — влияние на повседневную активность (ПА: 7 пунктов, например трудности с выполнением действий, требующих концентрации внимания) и ухудшение физического состояния (УФС: 5 пунктов, например трудности с выполнением действий, требующих физических усилий), а также один общий пункт для оценки влияния на повседневную активность в целом. Пациенты ежедневно оценивают время, в течение которого они ощущали влияние мигрени, или уровень затруднений, связанных с мигренью. Показатели по шкале MPFID за месяц усредняются по дням с мигренью и без мигрени; при этом чем выше показатель, тем в большей степени мигрень влияет на домены ПА и УФС.
На рисунке 2 и в таблице 2 приведены ключевые результаты исследования.
Рисунок 2. Динамика изменения количества дней с мигренью в течение месяца относительно исходного уровня в исследовании пациентов с эпизодической мигренью.
| Эренумаб 70 мг (n = 312) | Эренумаб 140 мг (n = 318) | Плацебо (n = 316) | Межгрупповая разница/ Отношение шансов | р-значениеa | |
|---|---|---|---|---|---|
| Количество дней с мигренью в течение месяца (ДММ) | |||||
| Среднее изменениеb 95 % ДИ | -3,2 (-3,6; -2,9) | -3,7 (-4,0, -3,3) | -1,8 (-2,2, -1,5) | 70 мг 1,4 (-1,9; -0,92) 140 мг -1,9 (-2,3; -1,4) | <0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 43,3 | 50,0 | 26,6 | ||
| Отношение шансовc 95 % ДИ | Не применимо | <0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 20,8 | 22,0 | 7,9 | ||
| Отношение шансов 95 % ДИ | Не применимо | Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb 95 % ДИ | -1,1 (-1,3; -1,0) | -1,6 (-1,8; -1,4) | -0,2 (-0,4; 0,2) | 70 мг -0,9 (-1,2; -0,6) 140 мг -1,4 (-1,7; -1,1) | <0,001 |
| Показатель по домену ухудшения физического состояния шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -4,2 (-5,0; -3,5) | -4,8 (-5,6; -4,0) | -2,4 (-3,2; -1,6) | 70 мг -2,2 (-3,3; -1,2) 140 мг | <0,001 |
| Влияние на показатель по домену повседневной активности шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -5,5 (-6,3; -4,8) | -5,9 (-6,6; -5,1) | -3,3 (-4,1; -2,5) | -2,2 (-3,3, -1,2) -2,6 (-3,7; -1,5) | <0,001 |
| HIT 6 | |||||
| Среднее изменение 95 % ДИ | -6,7 (-7,4; -6,0) | -6,9 (-7,6; -6,3) | -4,6 (-5,3; -4,0) | 70 мг -2,1 (-3,0; -1,1) 140 мг -2,3 (-3,2; -1,3) | Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменение 95 % ДИ | -6,7 (-7,6; -5,9) | -7,5 (-8,3; -6,6) | -4,6 (-5,5; -3,8) | 70 мг -2,1 (-3,3; -0,9) 140 мг -2,8 (-4,0; -1,7) | Не применимо |
| Ответ по домену ухудшения физического состояния шкалы MPFID | |||||
| %f | 39,1 | 42,5 | 30,1 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,5 (1,1; 2,1) 140 мг 1,8 (1,2; 2,4) | ||||
| Ответ по влиянию на показатель по домену повседневной активности шкалы MPFID | |||||
| %f | 49,0 | 50,3 | 34,5 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,9 (1,3; 2,5) 140 мг 1,9 (1,4; 2,7) | ||||
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца; MPFID — дневник влияния мигрени на физическую активность.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение в месяцы 4–6 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, значение на исходном уровне, факторы стратификации (регион [Северная Америка или другой] и применение в прошлом лекарственных препаратов для профилактики мигрени [применялись, применялись в прошлом, применяются в настоящее время в качестве сопутствующих препаратов]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % в месяцы 4–6 основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
f Снижение на ≥5 среднего месячного показателя УФС и ПА по сравнению с исходным показателем.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактического лечения, разница сокращения ДММ, наблюдаемая между дозой 140 мг и плацебо, составила -2,5 (95 % ДИ: -3,4; -1,7) и между дозой 70 мг и плацебо -2,0 (95 % ДИ: -2,8; -1,2). Также доля пациентов, у которых достигнуто сокращение ДММ на 50 % была больше по сравнению с группой плацебо (39,7 % для 140 мг и 38,6 % для 70 мг, при отношении шансов 3,1 [95 % ДИ: 1,7; 5,5] и 2,9 [95 % ДИ: 1,6; 5,3] соответственно).
Фармакокинетика
Эренумаб характеризуется нелинейной кинетикой, что обусловлено его связыванием с рецептором CGRP. У здоровых добровольцев, которым подкожно (п/к) вводили препарат в дозе 70 мг или 140 мг, среднее значение максимальной концентрации (Cmax) составляло соответственно 6,1 мкг/мл и 15,8 мкг/мл (стандартное отклонение [SD]) 2,1 мкг/мл и 4,8 мкг/мл), а среднее значение площади под кривой «концентрация-время» (AUClast — 159 сут × мкг/мл и 505 сут × мкг/мл (SD 58 сут × мкг/мл и 139 сут × мкг/мл) соответственно.
У пациентов, получавших препарат в дозе 140 мг п/к каждые 4 недели, минимальная концентрация в сыворотке крови со временем увеличивалась менее чем в 2 раза и достигала равновесного состояния через 12 недель после начала лечения.
Всасывание
У здоровых добровольцев взрослого возраста, получавших однократную п/к инъекцию эренумаба в дозе 70 мг или 140 мг, медиана Cmax в плазме крови достигалась приблизительно через 6 дней, а расчётная абсолютная биодоступность составляла 82 %.
Распределение
После однократного в/в введения в дозе 140 мг средний объём распределения в терминальной фазе выведения (Vz) составлял около 3,86 л (SD = 0,77).
Метаболизм и выведение
Выведение эренумаба описывается двухфазной кривой. При низких концентрациях выведение происходит преимущественно за счёт насыщаемого связывания с мишенью (рецептором CGRP), в то время как при более высоких концентрациях выведение эренумаба происходит преимущественно за счёт неспецифического ненасыщаемого протеолиза. В период введения препарата эренумаб выводится преимущественно за счёт неспецифического протеолиза с эффективным периодом полувыведения 28 дней.
Фармакокинетика у особых групп пациентов
Пациенты с нарушениями функции почек
У пациентов с нарушением функции почек тяжёлой степени (рСКФ < 30 мл/мин/1,73 м2) исследований не проводилось. Не выявлены различия в фармакокинетике эренумаба у пациентов с нарушением функции почек лёгкой или средней степеней тяжести и пациентами с нормальной функцией почек по данным популяционного фармакокинетического анализа (см. раздел «Способ применения и дозы»).
Пациенты с нарушениями функции печени
Клинических исследований у пациентов с нарушением функции печени не проводилось.
Эренумаб, как человеческое моноклональное антитело, не метаболизируется изоферментами системы цитохрома Р450. Выведение через печень не является основным способом выведения эренумаба (см. раздел «Способ применения и дозы»).
Показания
Препарат применяется для профилактики мигрени у взрослых, которые имеют по крайней мере 4 дня мигрени в течение месяца.
Противопоказания
Гиперчувствительность к действующему веществу или к любому из компонентов препарата.
Детский возраст до 18 лет (опыт применения у детей отсутствует).
Применение при беременности и в период грудного вскармливания
Беременность
Данные по применению эренумаба беременными женщинами ограничены. Исследования на животных не выявили прямой или опосредованной репродуктивной токсичности эренумаба. В качестве меры предосторожности предпочтительно избегать применения препарата Иринэкс во время беременности.
Период грудного вскармливания
Неизвестно, проникает ли эренумаб в грудное молоко человека. Имеются данные о том, что IgG проникает в грудное молоко в течение первых нескольких дней после рождения ребёнка, затем концентрация IgG снижается до низких значений. Следовательно, в течение первых нескольких дней после рождения нельзя исключить риск для ребёнка, находящегося на грудном вскармливании.
В течение дальнейшего периода кормления грудью применение препарата следует рассматривать исключительно с точки зрения клинической необходимости.
Способ применения и дозы
Лечение должно начинаться врачами, имеющими опыт диагностики и лечения мигрени.
Препарат показан пациентам, которые имеют по крайней мере 4 дня мигрени в течение месяца в начале применения эренумаба.
Рекомендуемая доза — 70 мг 1 раз в 4 недели. У некоторых пациентов клинический эффект может достигаться при применении дозы 140 мг 1 раз в 4 недели.
Клинические исследования показали, что у большинства пациентов, отвечающих на терапию, эффект наступает в течение 3 месяцев. Следует рассмотреть возможность прекращения лечения у пациентов, у которых не получен ответ после 3 месяцев терапии. Рекомендуется регулярно оценивать необходимость продолжения лечения.
При пропуске очередной дозы рекомендуется возобновить лечение как можно раньше. В дальнейшем препарат применяется 1 раз в 4 недели, начиная с последней полученной дозы.
Препарат Иринэкс следует вводить подкожно (п/к).
Препарат Иринэкс предназначен для самостоятельного введения пациентом, прошедшим соответствующее обучение.
Введение должно осуществляться лицом, обученным технике введения препарата.
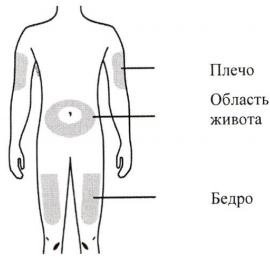
Препарат можно вводить в живот, бедро или во внешнюю область плеча (инъекцию в руку следует использовать только в том случае, если инъекцию проводит не пациент, а другой человек). Места инъекций следует менять и не следует делать инъекции в области чувствительной, красной, уплотнённой кожи или гематом.
Для введения дозы 140 мг следует провести две последовательные подкожные инъекции препарата Иринэкс по 70 мг каждая или одну подкожную инъекцию препарата Иринэкс 140 мг.
Подробные указания по хранению препарата, обращению с ним и технике введения приведены в разделе «Указания по применению препарата Иринэкс».
Особые группы пациентов
Применение у пациентов в возрасте 65 лет и старше
Препарат Иринэкс не изучался у пожилых пациентов. Коррекции дозы не требуется.
Почечная недостаточность/ печёночная недостаточность
У пациентов с почечной недостаточностью лёгкой и средней степени тяжести или печёночной недостаточностью коррекции дозы не требуется.
анУказания по применению препарата Иринэкс
Инструкция по применению препарата Иринэкс, раствор для подкожного введения 70 мг/мл, в предварительно заполненном шприце
Одноразовый предварительно заполненный шприц
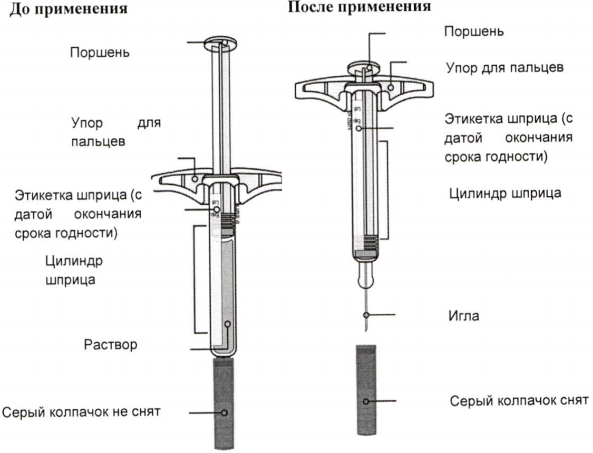
Важно! Внутри находится игла.
Важно
Перед применением препарата Иринэкс (предварительно заполненный шприц) ознакомьтесь с важной информацией:
Хранение
Храните препарат в недоступном и невидном для детей месте.
Храните препарат в оригинальной упаковке для защиты от света или физических повреждений.
Храните препарат в холодильнике при температуре 2–8 °C.
Вне холодильника длительность хранения препарата при комнатной температуре (до 25 °C) не должна превышать 14 дней.
Не убирайте препарат обратно в холодильник, после того как он был из него извлечён.
Не применяйте препарат, если он хранился при комнатной температуре (до 25 °C) в течение более 14 дней.
Препарат следует утилизировать в случае его хранения при более высокой температуре, либо более 14 дней.
Не подвергайте препарат воздействию экстремально низких или высоких температур.
Например, избегайте хранения препарата в машине.
Не замораживайте.
Применение
Не пытайтесь вводить препарат Иринэкс до того, как лечащий врач или медсестра не обучат Вас технике введения препарата.
Не применяйте препарат после истечения срока годности, указанного на упаковке.
Не встряхивайте шприц.
Не снимайте серый колпачок со шприца до тех пор, пока не будете готовы к введению препарата.
Не замораживайте препарат и не применяйте препарат, если он был заморожен.
Не используйте шприц, если он падал на твёрдую поверхность, так как часть шприца может быть повреждена, даже если Вы не видите каких-либо повреждений. В этом случае возьмите новый шприц и сообщите об этом лечащему врачу.
В сером колпачке иглы содержится натуральный латекс, что может вызвать аллергические реакции у лиц, имеющих аллергическую реакцию на латекс. Сообщите лечащему врачу, если у Вас есть аллергическая реакция на латекс.
За более подробной информацией или помощью обратитесь к лечащему врачу.
Шаг 1. Подготовка перед инъекцией
Ознакомьтесь с данной информацией до введения препарата.
Проверьте назначение врача.
Лечащий врач назначил Вам 140 мг.
Для введения дозы 140 мг Вам будет нужно полностью ввести содержимое одного предварительно заполненного шприца.
Чтобы избежать дискомфорта в месте инъекции, оставьте шприцы при комнатной температуре в течение минимум 30 минут до начала инъекции.
Не пытайтесь нагреть автоинжектор за счёт внешнего источника тепла, например горячей водой или в микроволновой печи.
Не оставляйте автоинжектор на прямом солнечном свете.
А) Достаньте предварительно заполненный шприц с препаратом Иринэкс из картонной пачки.
Возьмитесь за цилиндр шприца, чтобы достать его из упаковки.
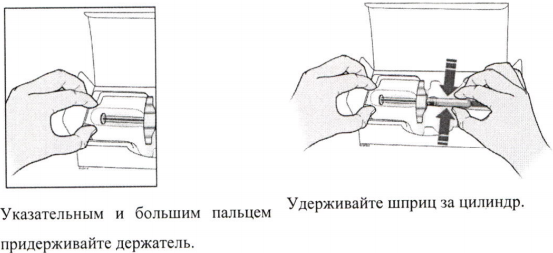
Б) Внимательно осмотрите предварительно заполненный шприц с препаратом Иринэкс.
Всегда держите шприц за цилиндр.
Убедитесь, что препарат в шприце является прозрачным бесцветным или светло-жёлтым раствором.
Оставьте шприц при комнатной температуре в течение минимум 30 минут до инъекции.
Не используйте шприц, если препарат в нем мутный или изменил цвет, а также содержит хлопья или частицы.
Не используйте шприц, если любая его часть имеет трещину или сломана.
Не используйте шприц, если его роняли.
Не используйте шприц, если серый колпачок иглы отсутствует или плохо закрыт.
Не используйте шприц, если срок годности, указанный на этикетке, истёк.
Во всех указанных случаях используйте новый шприц, а в случае сомнений обратитесь к лечащему врачу.
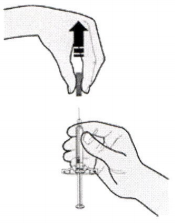
В) Приготовьте все материалы необходимые для инъекции. Тщательно вымойте руки с мылом.
На чистую, хорошо освещённую рабочую поверхность положите:
- 1 новый предварительно заполненный шприц,
- спиртовые салфетки,
- ватные шарики или марлевые тампоны,
- лейкопластырь,
- контейнер для утилизации острых предметов.

Г) Подготовьте и очистите место инъекции(й).
Инъекцию можно производить в:
- бедро,
- область живота, за исключением 5 см вокруг пупка,
- внешнюю поверхность плеча (только если инъекция проводится с посторонней помощью).
- 1 новый автоинжектор,
- спиртовые салфетки,
- ватные шарики или марлевые тампоны, лейкопластырь,
- контейнер для утилизации острых предметов.
- бедро,
- область живота, за исключением 5 см вокруг пупка,
- внешнюю поверхность плеча (только если инъекция проводится с посторонней помощью).
Очистите предполагаемое место инъекции спиртовой салфеткой и подождите, пока поверхность кожи станет сухой.
Не прикасайтесь к этой зоне до инъекции.
Проводите инъекцию каждый раз в различные места. Если Вы хотите вводить препарат в ту же самую область, убедитесь, что это не то же самое место предыдущей инъекции.
Не производите инъекцию в область повреждённой кожи (истончение, покраснение, раздражение, уплотнение, шелушение, сыпь, кровоизлияния). Избегайте введения в места с наличием шрамов и растяжек.
Шаг 2. Непосредственно перед введением
Д) Снимите серый колпачок с иглы в направлении от себя, когда будете готовы к инъекции. Не оставляйте серый колпачок снятым более 5 минут. Это может привести к высыханию препарата.
Наличие на конце иглы капли препарата является нормальным.
Не скручивайте и не сгибайте серый колпачок.
Не одевайте серый колпачок обратно на шприц.
Не снимайте серый колпачок с иглы до тех пор, пока Вы не будете готовы к инъекции.
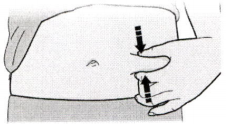
Е) Создайте складку кожи в месте введения, чтобы образовалась плотная поверхность для инъекции. Удерживайте кожу между большим и указательным пальцами, создавая зону около 5 см шириной.
Важно. Во время проведения самой инъекции продолжайте удерживать кожу в этом положении.
Шаг 3. Инъекция
Ж) Удерживая складку кожи, введите иглу шприца со снятым серым колпачком в кожу под углом 45–90 градусов.
Не помещайте палец на поршень, пока вводите иглу.
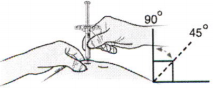
З) Медленно, не останавливаясь, надавите на поршень вниз, пока он не перестанет двигаться.
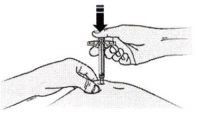
И) После этого уберите палец и плавно удалите шприц из кожи.
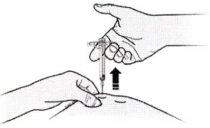
Важно. Если при удалении шприца Вы обнаружите, что в цилиндре остался раствор, значит Вы ввели неполную дозу. Сразу же сообщите об этом лечащему врачу.
Шаг 4. После инъекции
К) Утилизируйте использованный шприц и серый колпачок.
Положите использованный шприц в контейнер для утилизации острых предметов сразу после использования. Не бросайте в бытовой
мусор. Обсудите с лечащим врачом как правильно утилизировать шприц.
Не используйте шприц повторно.
Не следует повторно использовать шприц или контейнер для утилизации острых предметов или выбрасывать их в бытовой мусор.
Важно. Всегда храните контейнер для утилизации острых предметов в недоступном для детей месте.
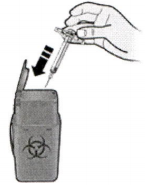
Л) Осмотрите место введения.
При появлении крови прижмите ватный шарик или марлевый тампон к месту инъекции. Не растирайте место инъекции. При необходимости используйте лейкопластырь.
Инструкция по применению препарата Иринэкс, раствор для подкожного введения 140 мг/мл, в предварительно заполненном шприце в автоинжекторе (шприц-ручке)
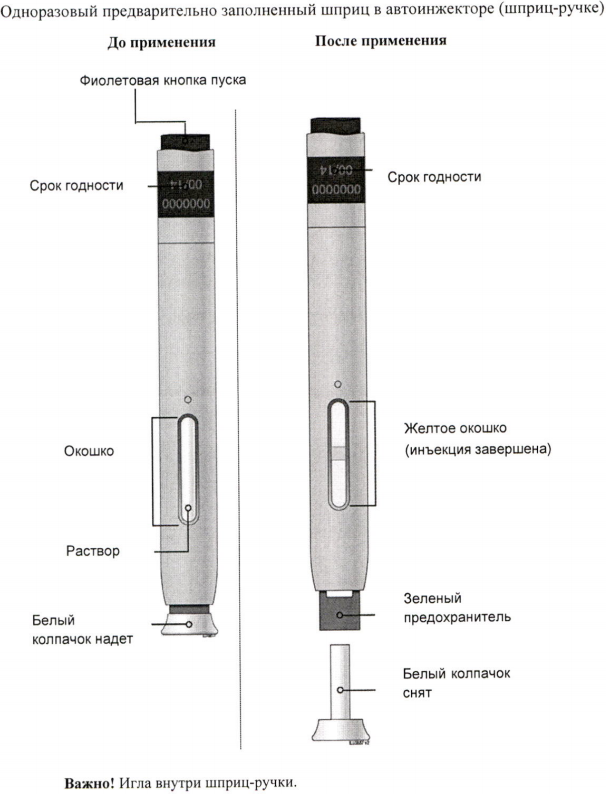
Важно
Перед применением препарата Иринэкс (предварительно заполненный шприц в автоинжекторе (шприц-ручке)) ознакомьтесь с важной информацией:
Хранение
Храните препарат в недоступном и невидном для детей месте.
Храните препарат в оригинальной упаковке для защиты от света или физических повреждений.
Храните препарат в холодильнике при температуре 2–8 °C.
Вне холодильника длительность хранения препарата при комнатной температуре (до 25 °C) не должна превышать 14 дней.
Не убирайте препарат обратно в холодильник, после того как он был из него извлечён. Не применяйте препарат, если он хранился при комнатной температуре (до 25 °C) в течение более 14 дней.
Препарат следует утилизировать в случае его хранения при более высокой температуре, либо более 14 дней.
Не подвергайте препарат воздействию экстремально низких или высоких температур. Например, избегайте хранения препарата в машине.
Не замораживайте.
Применение
Не пытайтесь вводить препарат Иринэкс до того, как лечащий врач или медсестра не обучат Вас технике введения препарата.
Не применяйте препарат после истечения срока годности, указанного на упаковке.
Не встряхивайте автоинжектор.
Не снимайте белый колпачок с автоинжектора до тех пор, пока не будете готовы к введению препарата.
Не замораживайте препарат и не применяйте препарат, если он был заморожен.
Не используйте автоинжектор, если он падал на твёрдую поверхность, так как часть автоинжектора может быть повреждена, даже если Вы не видите каких-либо повреждений. В этом случае возьмите новый автоинжектор и сообщите об этом лечащему врачу.
В оранжевом колпачке иглы содержится натуральный латекс, что может вызвать аллергические реакции у лиц, имеющих аллергическую реакцию на латекс. Сообщите лечащему врачу, если у Вас есть аллергическая реакция на латекс.
Шаг 1. Подготовка перед инъекцией
Ознакомьтесь с данной информацией до введения препарата.
Проверьте назначение врача.
Лечащий врач назначил 140 мг.
Для введения дозы 140 мг Вам будет нужно полностью ввести содержимое одной предварительно заполненной шприц-ручки.
Для введения дозы 140 мг понадобится 2 последовательные инъекции (2 предварительно заполненных шприц-ручки) по 70 мг каждая.
Чтобы избежать дискомфорта в месте инъекции, оставьте предварительно заполненную шприц-ручку при комнатной температуре в течение минимум 30 минут до начала инъекции.
А) Достаньте автоинжектор с препаратом Иринэкс из картонной пачки.
Аккуратно достаньте автоинжектор из картонной пачки в направлении вверх.
Оставьте автоинжектор при комнатной температуре в течение минимум 30 минут до инъекции.
Не убирайте автоинжектор обратно в холодильник после того, как препарат достиг комнатной температуры.
Не пытайтесь нагреть автоинжектор за счёт внешнего источника тепла, например горячей водой или в микроволновой печи.
Не оставляйте автоинжектор на прямом солнечном свете.
Не встряхивайте автоинжектор.
На этом этапе не снимайте с автоинжектора белый колпачок.
Б) Внимательно осмотрите предварительно заполненный шприц с препаратом Иринэкс.
Убедитесь, что препарат в окошке является прозрачным бесцветным или светло-жёлтым раствором.
Не используйте автоинжектор, если препарат в нем мутный или изменил цвет, а также содержит хлопья или частицы.
Не используйте автоинжектор, если любая его часть имеет трещину или сломана.
Не используйте автоинжектор, если его роняли.
Не используйте автоинжектор, если белый колпачок иглы отсутствует или плохо закрыт.
Не используйте автоинжектор, если срок годности, указанный на этикетке, истёк.
Во всех указанных случаях используйте новый автоинжектор, а в случае сомнений обратитесь к лечащему врачу.
В) Приготовьте все материалы необходимые для инъекции. Тщательно вымойте руки с мылом.
На чистую, хорошо освещённую рабочую поверхность положите:

Г) Подготовьте и очистите место инъекции(й).
Инъекцию можно производить в:
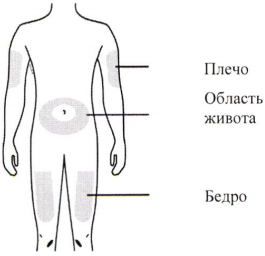
Очистите предполагаемое место инъекции спиртовой салфеткой и подождите, пока поверхность кожи станет сухой.
Не прикасайтесь к этой зоне до инъекции.
Проводите инъекцию каждый раз в различные места. Если Вы хотите вводить препарат в ту же самую область, убедитесь, что это не то же самое место предыдущей инъекции.
Не производите инъекцию в область повреждённой кожи (истончение, покраснение, раздражение, уплотнение, шелушение, сыпь, кровоизлияния). Избегайте введения в места с наличием шрамов и растяжек.
Шаг 2. Непосредственно перед введением
Д) Снимите белый колпачок с иглы в направлении от себя, когда будете готовы к инъекции. Не оставляйте белый колпачок снятым более 5 минут. Это может привести к высыханию препарата.
Наличие на конце иглы капли препарата является нормальным.
Не скручивайте и не сгибайте оранжевый колпачок.
Не одевайте оранжевый колпачок обратно на автоинжектор.
Не снимайте оранжевый колпачок с иглы до тех пор, пока Вы не будете готовы к инъекции.
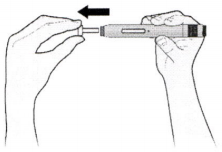
Е) Растяните или оттяните кожу в месте инъекции, чтобы создать твёрдую поверхность.
Метод с растяжением кожи
Уверенным движением растяните кожу, для чего нажмите на неё и разведите большой палец и указательный пальцы в разные стороны, создав область шириной около 5 см.
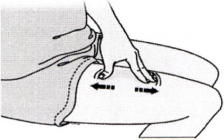
или
Метод с оттягиванием кожи
Оттяните кожу, зажав её большим и указательным пальцами и создав область шириной около 5 см.
Важно! Во время инъекции удерживайте кожу в растянутом или оттянутом состоянии.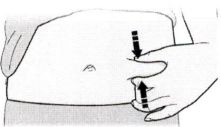
Шаг 3. Инъекция
Ж) Удерживайте кожу в растянутом или оттянутом состоянии. Подведите шприц-ручку со снятым оранжевым колпачком к коже под углом 90 градусов.
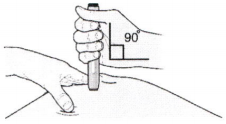
Важно! Пока не прикасайтесь к фиолетовой кнопке пуска.
З) Уверенным движением протолкните шприц ручку вниз, пока она не перестанет двигаться.
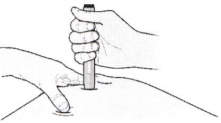

Важно! Необходимо протолкнуть автоинжектор вниз до конца, не касаясь фиолетовой кнопки пуска до тех пор, пока Вы не будете готовы сделать инъекцию.
И) Когда Вы будете готовы к инъекции, нажмите на серую кнопку пуска. При этом Вы услышите щелчок.
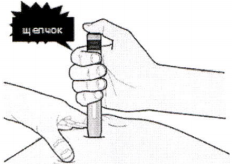
К) Продолжайте давить на кожу. Инъекция может занять около 15 секунд.
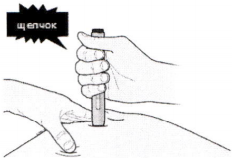
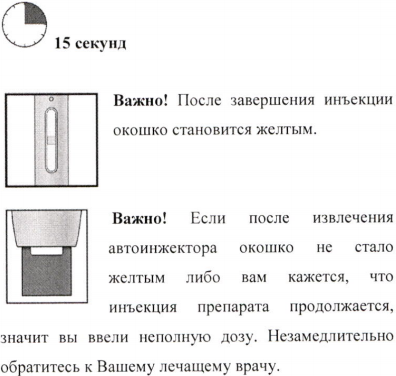
Шаг 4. После инъекции
К) Утилизируйте использованный автоинжектор и оранжевый колпачок.
Положите использованный автоинжектор в контейнер для утилизации острых предметов сразу после использования.
Обсудите с лечащим врачом как правильно утилизировать автоинжектор.
Не используйте автоинжектор повторно.
Не помещайте автоинжектор или контейнер для острых отходов в ёмкости для рециклинга и не выбрасывайте их вместе с бытовым мусором.
Важно. Всегда храните контейнер для утилизации острых предметов в недоступном и невидном для детей месте.
Л) Осмотрите место введения.
При появлении крови прижмите ватный шарик или марлевый тампон к месту инъекции.
Не растирайте место инъекции. При необходимости используйте лейкопластырь.
Побочное действие
Краткий обзор профиля безопасности
В общей сложности в ходе регистрационных исследований эренумаб применялся более чем у 2500 пациентов (более 2600 пациенто-лет). Из них более 1300 пациентов применяли препарат не менее 12 месяцев.
Сообщалось о нежелательных реакциях для 70 мг и 140 мг: реакции в месте введения (5,6 %/4,5 %), запор (1,3 %/3,2 %), мышечные спазмы (0,1 %/2,0 %) и зуд (0,7 %/1,8 %). Большинство реакций были лёгкой или средней степени тяжести. Менее чем 2 % пациентов прекратили участие в этих исследованиях из-за нежелательных явлений.
Перечень нежелательных реакций (HP) в табличном формате
Все HP, зарегистрированные у пациентов, получавших эренумаб в 12-недельный плацебо-контролируемый период клинических исследований, а также в период пострегистрационного применения препарата приведены в таблице 3. Внутри каждого системно-органного класса HP представлены по категориям частоты встречаемости, причём сначала указаны наиболее частые реакции. Внутри каждой категории частоты HP представлены в порядке уменьшения степени их серьёзности. Кроме того, для каждой HP приведена соответствующая ей категория частоты в соответствии со следующими обозначениями: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10 000, <1/1000); очень редко (<1/10 000).
| Системно-органный класс | HP | Категория частоты |
| Нарушения со стороны иммунной системы | Реакции гиперчувствительностиa, включая анафилаксию, ангионевротический отёк, сыпь, припухлость/отёк и крапивницу | Часто |
| Нарушения со стороны желудочно-кишечного тракта | Запор | Часто |
| Язвенные поражения полости ртаb | Частота не известна | |
| Нарушения со стороны кожи и подкожных тканей | Зудc | Часто |
| Алопеция, сыпьa | Частота не известна | |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Мышечный спазм | Часто |
| Общие расстройства и нарушения в месте введения | Реакции в месте введения3 | Часто |
a См. раздел «Описание отдельных нежелательных реакций».
b Термин «Язвенные поражения полости рта» включает такие предпочтительные термины, как стоматит, язвы во рту, образование пузырей на слизистой оболочке рта.
c Термин «зуд» включает такие предпочтительные термины, как генерализованный зуд, зуд и зудящая сыпь.
d Термин «сыпь» включает такие предпочтительные термины, как папулёзная сыпь, эксфолиативная сыпь, эритематозная сыпь, крапивница, волдырь.
Описание отдельных нежелательных реакций
Реакции в месте введения
В объединённом анализе 12-недельного плацебо-контролируемого периода клинических исследований реакции в месте введения были лёгкие и проходящие. У одного пациента, получившего эренумаб в дозе 70 мг, препарат был отменен в связи с развитием сыпи в месте введения. Наиболее частыми реакциями в месте введения были боль в месте введения, эритема в месте введения и зуд в месте введения. Как правило, боль в месте инъекции проходит в течение 1 часа после инъекции.
Кожные реакции и реакции гиперчувствительности
В объединённом анализе 12-недельного плацебо-контролируемого периода исследований наблюдались несерьёзные случаи сыпи, зуда и припухлости/отёка, которые в большинстве случаев были лёгкими и не привели к прекращению лечения.
Запор
В объединённом анализе 12-недельного плацебо-контролируемого периода зарегистрировано 28 сообщений о случаях запора среди 1400 пациентов, получавших препарат Иринэкс. Все нежелательные явления были лёгкими или умеренными по степени тяжести. В большинстве таких этих случаев (23) симптомы появились в течение одного месяца после первого введения препарата, однако, у некоторых пациентов запор наблюдался позднее на фоне продолжения терапии. В большинстве случаев (18) запор разрешился в течение трёх месяцев. Все пациенты, за исключением одного, продолжили лечение.
Иммуногенность
В клинических исследованиях профилактического лечения мигрени на протяжении двойной слепой фазы исследования частота образования антител к эренумабу у пациентов, получавших эренумаб в дозе 70 мг составила 6,3% (56/884) (у 3 пациентов нейтрализующая активность определялась in vitro) и 2,6% (13/504) у пациентов, получавших эренумаб в дозе 140 мг (in vitro нейтрализующая активность не определялась ни у одного пациента). Образование антител к эренумабу не влияло на его эффективность или безопасность.
Пострегистрационные данные
Нарушения со стороны иммунной системы
В пострегистрационном периоде отмечены реакции гиперчувствительности, включая сыпь, ангионевротический отёк и анафилактоидные реакции (см. раздел «Особые указания»).
Нарушения со стороны желудочно-кишечного тракта
- Зарегистрированы случаи запора с серьёзными осложнениями в пострегистрационном применении. В большинстве этих случаев нежелательные явления наблюдались после введения первой дозы препарата Иринэкс, однако они могли возникать и позднее на фоне продолжения терапии. Многие случаи запора с серьёзными осложнениями были зарегистрированы у пациентов с наличием в анамнезе эпизодов запора, или получавших сопутствующую терапию лекарственными препаратами, уменьшающими моторику желудочно-кишечного тракта. В отдельных тяжёлых случаях потребовалась госпитализация.
- Отмечались язвы полости рта (например, стоматиты, изъязвление слизистой оболочки полости рта, образование пузырей на слизистой оболочке полости рта).
Нарушения со стороны кожи и подкожных тканей
Алопеция, кожная сыпь (например, папулёзная сыпь, эксфолиативная сыпь, эритематозная сыпь, крапивница, образование волдырей).
Нарушения со стороны сосудов
Артериальная гипертензия.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В клинических исследованиях не было выявлено случаев передозировки эренумаба у человека. В клинических исследованиях эренумаб применяли п/к в дозах до 280 мг без каких-либо признаков дозоограничивающей токсичности. В случае передозировки следует проводить поддерживающую и симптоматическую терапию по мере необходимости.
Взаимодействие с другими лекарственными средствами
В открытом исследовании фармакокинетического лекарственного взаимодействия эренумаба и комбинированных пероральных контрацептивов у здоровых женщин эренумаб (однократная п/к инъекция в дозе 140 мг) не влиял на фармакокинетику комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и норгестимат.
В рандомизированном двойном слепом плацебо-контролируемом исследовании у здоровых добровольцев эренумаб (однократное в/в введение в дозе 140 мг), применяемый одновременно с суматриптаном, никак не влиял на показатели артериального давления в покое по сравнению с суматриптаном в качестве монотерапии. Эренумаб не оказывал влияния на фармакокинетику суматриптана.
Эренумаб не метаболизируется изоферментами цитохрома P450; также маловероятно, что он может вызывать заметные изменения концентрации провоспалительных цитокинов, которые способны влиять на экспрессию или активность изоферментов цитохрома P450. По этой причине лекарственные взаимодействия при одновременном применении препаратов, которые являются субстратами, индукторами или ингибиторами изоферментов цитохрома P450, представляются маловероятными.
Влияние на результаты лабораторных и диагностических исследований
Влияние эренумаба на результаты лабораторных и/или диагностических исследований не изучалось.
Особые указания
Реакции гиперчувствительности
В постмаркетинговом опыте применения препарата Иринэкс сообщалось о таких серьёзных нежелательных реакциях гиперчувствительности, как кожная сыпь, ангионевротический отёк и анафилактоидные реакции. Эти реакции могут возникать в течение нескольких минут, хотя некоторые из них могут возникать более чем через неделю после лечения. При возникновении серьёзных или тяжёлых реакций гиперчувствительности применение препарата Иринэкс следует прекратить и начать соответствующую терапию (см. раздел «Противопоказания»).
Пациенты с гиперчувствительностью к латексу
Съёмная крышка предварительно заполненного шприца и автоинжектора (шприц-ручки) содержит сухой натуральный каучуковый латекс, который может вызывать аллергические реакции у лиц, чувствительных к латексу.
Запор
Запор является частым побочным эффектом при применении препарата Иринэкс и обычно характеризуется лёгкой или умеренной интенсивностью. В большинстве случаев о появлении запоров сообщалось сразу после применения первой дозы препарата, однако пациенты испытывали запор и позже в течение курса лечения. В большинстве случаев
запор разрешался в течение трёх месяцев. При пострегистрационном применении эренумаба отмечались запоры, сопровождающиеся серьёзными осложнениями. В некоторых случаях требовалась госпитализация, в том числе обусловленная необходимостью хирургического вмешательства.
Запор в анамнезе или одновременный приём препаратов, связанных со сниженной перистальтикой желудочно-кишечного тракта, может привести к увеличению риска развития более тяжёлых запоров и осложнений, связанных с запорами. Следует предупредить пациентов об опасности развития тяжёлых запоров и рекомендовать обратиться к врачу, в том случае, если запор не проходит или усиливается. При развитии тяжёлых запоров пациентам следует немедленно обратиться за медицинской помощью. Лечение запора следует начать незамедлительно, учитывая наличие медицинских показаний. При развитии тяжёлых запоров необходимо прекратить применение препарата.
Сердечно-сосудистые заболевания
Пациенты с некоторыми основными сердечно-сосудистыми заболеваниями были исключены из клинических исследований, в связи с чем данные по безопасности у этих пациентов отсутствуют.
Артериальная гипертензия
Сообщалось о развитии артериальной гипертензии и утяжелении уже имеющейся артериальной гипертензии после применения препарата Иринэкс. У многих пациентов уже имелась артериальная гипертензия или факторы риска развития этого заболевания. В некоторых случаях требовалась медикаментозная терапия и даже госпитализация.
При применении препарата Иринэкс следует наблюдать за состоянием пациентов на предмет развития артериальной гипертензии или утяжеления уже имеющейся артериальной гипертензии. В соответствующих случаях, если не удалось установить альтернативную этиологию осложнений, следует рассмотреть отмену препарата Иринэкс.
Фертильность
Данных по влиянию эренумаба на репродуктивную функцию человека нет. При системных экспозициях эренумаба у половозрелых обезьян, до 283 или 123 раз превышающих экспозицию (оцениваемую по AUC для сыворотки крови) у человека, достигаемую в случае применения препарата в клинической дозе 70 мг или 140 мг 1 раз в месяц, никаких нежелательных действий в отношении суррогатных маркеров фертильности (патологоанатомических или гистопатологических изменений репродуктивных органов) не наблюдалось.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Иринэкс не оказывает значительного влияния на способность управлять транспортными средствами и/или механизмами.
Форма выпуска
Раствор для подкожного введения, 140 мг/мл.
Первичная упаковка
По 1 мл в предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс, или
по 1 мл в предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс, в автоинжекторе (шприц-ручке).
Вторичная упаковка: один предварительно заполненный шприц или одну предварительно заполненную шприц-ручку вместе с инструкцией по медицинскому применению лекарственного препарата помещают в пачку картонную с контролем первого вскрытия.
Хранение
При температуре от 2 до 8 °C. Не замораживать.
Хранить предварительно заполненные шприцы/шприц-ручки в оригинальной картонной пачке для защиты от воздействия света.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Amgen Manufacturing, Limited, Пуэрто-Рико
Sandoz, GmbH, Австрия
Владелец регистрационного удостоверения
«Сандоз Фармасьютикалс д.д.», Веровшкова 57, 1000 Любляна, Словения / Sandoz Pharmaceuticals d.d., Verovskova 57, 1000 Ljubljana, Slovenia
Производитель
Производство готовой лекарственной формы, первичная упаковка
«Амджен Мэньюфэкчуринг Лимитед», Роуд 31, Км 24.6, Джанкое, Пуэрто-Рико 00777, США / Amgen Manufacturing Limited, Road 31, Km. 24.6, Juncos, PR, 00777, USA
Вторичная (потребительская) упаковка, выпускающий контроль качества
«с.а. Алкон-Куврер н.в.», Рейксвег 14, 2870 Пуурс, Бельгия / s.a. Alcon-Couvreur n.v., Rijksweg 14, Puurs, 2870, Belgium (предварительно заполненные шприцы)
«Сандоз ГмбХ», Биохемиштрассе 10, 6336 Лангкампфен, Австрия / Sandoz GmbH, Biochemiestrasse 10, 6336 Langkampfen, Austria (предварительно заполненные шприц- ручки)
Организация, принимающая претензии потребителей:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, д. 70
тел. (495)967 12 70
факс (495) 967 12 68
www.novartis.ru
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Иринэкс:
