Иринэкс
, растворРегистрационный номер
Торговое наименование
Иринэкс
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
1 мл препарата содержит:
действующее вещество: эренумаб 70 мг;
вспомогательные вещества: сахароза, полисорбат-80, уксусная кислота ледяная, натрия гидроксид, вода для инъекций.
Характеристика препарата
Эренумаб представляет собой человеческое моноклональное антитело класса G2 (IgG2), с высокой аффинностью связывающееся с рецептором кальцитонин-ген-родственного пептида (CGRP). Эренумаб состоит из 2 тяжёлых цепей, в каждой из которых содержится по 456 аминокислот и 2 лёгких цепей подкласса лямбда, состоящих из 216 аминокислот. Приблизительная молекулярная масса составляет 150 кДа. Эренумаб производятся по технологии рекомбинантной ДНК в клетках яичников китайского хомячка (СНО).
Описание
Раствор от бесцветного до светло-жёлтого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Эренумаб — это человеческое моноклональное антитело, являющееся антагонистом рецептора CGRP, и не обладает значимой фармакологической активностью в отношении рецепторов адреномедуллина, кальцитонина и амилина, а также агонистической активностью в отношении рецептора CGRP.
CGRP — это нейропептид, модулирующий передачу ноцицептивных сигналов, и вазодилататор, связанный с патофизиологией мигрени. Показано, что в отличие от других нейропептидов, концентрация CGRP значительно увеличивается во время приступа мигрени и возвращается к норме после его разрешения. Внутривенное (в/в) введение CGRP вызывает у пациентов мигренеподобную головную боль, из чего можно предположить, что CGRP может являться причиной возникновения мигрени.
Рецептор к CGRP локализуется на участках, имеющих отношение к патофизиологии мигрени. Эренумаб является мощным и специфичным конкурентом CGRP за связывание с рецептором и тем самым подавляет его действие на рецептор.
Фармакодинамика
В рандомизированном двойном слепом плацебо-контролируемом исследовании по оценке эффективности однократного в/в введения эренумаба в дозе 140 мг у пациентов со стабильной стенокардией не отмечалось снижения переносимости физической нагрузки при нагрузочной ЭКГ-пробе (на тредмил-тесте) по сравнению с плацебо и усугубления ишемии миокарда.
Клинические данные
Эренумаб оценивался в 3 базовых исследованиях по изучению профилактического лечения эпизодической и хронической мигрени. В исследования были включены пациенты с мигренью с аурой или без ауры в анамнезе в соответствии с диагностическими критериями Международной классификации головной боли (the International Classification of Headache Disorders, ICHD-III).
Эренумаб продемонстрировал статистически и клинически значимые улучшения ключевых показателей эффективности по сравнению с плацебо.
Хроническая мигрень
В клиническом исследовании пациентов с хронической мигренью эффективность применения препарата оценивалась на основании изменения количества дней с мигренью в течение месяца (ДММ) к 3 месяцу по сравнению с таковым показателем до лечения эренумабом (исходный уровень). Вторичными показателями эффективности служили снижение количества ДММ на 50–100 % относительно исходного уровня (ответ ≥50 %), изменение относительно исходного уровня количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени. На рисунке 1 и в таблице 1 приведены ключевые результаты исследования. Анализ ежемесячных изменений показал, что среднемесячное количество дней с мигренью снизилось по сравнению с плацебо уже в первый месяц, а последующий анализ еженедельных изменений показал, что эффект эренумаба развивался уже на первой неделе после инъекции.
Рисунок 1. Динамика изменения количества ДММ относительно исходного уровня у пациентов с хронической мигренью.
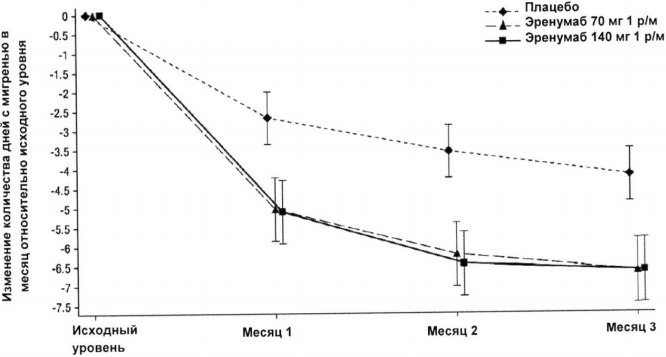
a Представлены среднеквадратичные средние значения и 95%-ные доверительные интервалы. Все p-значения для разницы в среднеквадратичных средних между группами эренумаба и плацебо, которые оценивали в месяц 3 (главный показатель эффективности), составляли <0,001.
| Эренумаб 70 мг (n = 188) | Эренумаб 140 мг (n = 187) | Плацебо (n = 281) | Межгрупповая разница/ Отношение шансов | pa | |
|---|---|---|---|---|---|
| ДММ | |||||
| Среднее изменениеb (95 % ДИ) | -6,64 (-7,47; -5,81) | -6,63 (-7,45; -5,80) | -4,18 (-4,86; -3,50) | 70 мг -2,46 (-3,52; -1,39) 140 мг -2,45 (-3,51; -1,38) | <0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 39,9 | 41,2 | 23,5 | ||
| Отношение шансовc (95 % ДИ) | 70 мг 2,18 (1,46; 3,27) 140 мг 2,34 (1,56; 3,51) | <0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 17,0 | 20,9 | 7,8 | ||
| Отношение шансов (95 % ДИ) | 70 мг 2,43 (1,36; 4,33) 140 мг 3,13 (1,78; 5,48) | Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb (95 % ДИ) | -3,45 (-4,02; -2,87) | -4,13 (-4,70; -3,56) | -1,58 (-2,05;-1,11) | 70 мг -1,86 (-2,60; -1,13) 140 мг -2,55 (-3,28; -1,82) | <0,001 |
| Результаты субъективных ответов пациентов | |||||
| HIT 6 | |||||
| Среднее изменениеb (95 % ДИ) | -5,6 (-6,5; -4,6) | -5,6 (-6,5;-4,6) | -3,1 (-3,9; -2,3) | 70 мг -2,5 (-3,7; -1,2) 140 мг -2,5 (-3,7; -1,2) | Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменениеb (95 % ДИ) | -19,41 (-25,19; -13,62) | -19,76 (-25,56; -13,97) | -7,54 (-12,40; -2,69) | 70 мг -11,86 (-19,34; -4,39) 140 мг -12,22 (-19,64; -4,75) | Не применимо |
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение к месяцу 3 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, среднемесячное значение на исходном уровне, факторы стратификации (регион [Северная Америка или Европа] и злоупотребление лекарственными препаратами [имеется или отсутствует]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % к 3 месяцу основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактической терапии, разница в сокращении ДММ, наблюдаемая между дозой 140 мг и плацебо, составляла -3,3 дня (95 % ДИ: -4,6; -2,1), а между дозой 70 мг и плацебо — -2,5 дня (95 % ДИ: -3,8; -1,2). У пациентов, у которых не было достигнуто клинического ответа на два или более метода профилактической терапии, разница ДММ составляла -4,3 дня (95 % ДИ: -5,8; -2,8) между дозой 140 мг и плацебо и -2,7 дня (95 % ДИ: -4,2; -1,2) между дозой 70 мг и плацебо соответственно. Доля пациентов, получавших эренумаб, которые достигли по меньшей мере 50 % сокращения ДММ, была выше по сравнению с группой плацебо среди пациентов, не достигших клинического ответа на один или несколько методов профилактической терапии (40,8% для дозы 140 мг и 34,7 % для дозы 70 мг против 17,3 % для плацебо), с отношением шансов 3,3 (95% ДИ: 2,0; 5,5) для дозы 140 мг и 2,6 (95 % ДИ: 1,6; 4,5) для дозы 70 мг. У пациентов, не достигших клинического ответа после применения двух или более методов профилактической терапии, доля составила 41,3 % для дозы 140 мг и 35,6 % для дозы 70 мг против 14,2 % для плацебо с отношением шансов 4,2 (95 % ДИ: 2,2; 7,9) и 3,5 (95 % ДИ: 1,8; 6,6) соответственно.
Эпизодическая мигрень
В клиническом исследовании пациентов с эпизодической мигренью эффективность применения препарата оценивалась на основании изменения среднемесячного количества дней с мигренью в течение месяцев 4–6 относительно исходного уровня. Вторичными показателями эффективности служили снижение на 50–100 % относительно исходного уровня среднего количества ДММ (ответ ≥50 %), изменение относительно исходного уровня среднего количества дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрени, и изменение относительно исходного уровня показателей по двум доменам опросника MPFID (Дневник влияния мигрени на физическую активность), связанных с ухудшением физического состояния (УФС) и повседневной активностью (ПА). Опросник MPFID — это инструмент для оценки исходов, сообщаемых пациентами, который позволяет измерить влияние мигрени на физическое функционирование (физическую активность). Он содержит 13 пунктов для оценки влияния мигрени в течение прошедших 24 часов на два аспекта физического функционирования, представляющих интерес — влияние на повседневную активность (ПА: 7 пунктов, например трудности с выполнением действий, требующих концентрации внимания) и ухудшение физического состояния (УФС: 5 пунктов, например трудности с выполнением действий, требующих физических усилий), а также один общий пункт для оценки влияния на повседневную активность в целом. Пациенты ежедневно оценивают время, в течение которого они ощущали влияние мигрени, или уровень затруднений, связанных с мигренью. Показатели по шкале MPFID за месяц усредняются по дням с мигренью и без мигрени; при этом чем выше показатель, тем в большей степени мигрень влияет на домены ПА и УФС.
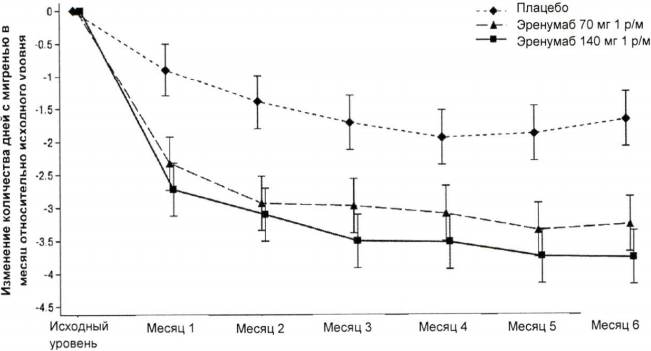
На рисунке 2 и в таблице 2 приведены ключевые результаты исследования.
Рисунок 2. Динамика изменения количества дней с мигренью в течение месяца относительно исходного уровня в исследовании пациентов с эпизодической мигренью.
| Эренумаб 70 мг (n = 312) | Эренумаб 140 мг (n = 318) | Плацебо (n = 316) | Межгрупповая разница/ Отношение шансов | р-значениеa | |
|---|---|---|---|---|---|
| Количество дней с мигренью в течение месяца (ДММ) | |||||
| Среднее изменениеb 95 % ДИ | -3,23 (-3,58; -2,88) | -3,67 (-4,02, -3,33) | -1,83 (-2,18, -1,48) | 70 мг 1,40 (-1,88; -0,92) 140 мг -1,85 (-2,33; -1,37) | <0,001 |
| Пациенты, у которых показатель ДММ изменился на ≥50 % | |||||
| % | 43,3 | 50,0 | 26,6 | ||
| Отношение шансовc 95 % ДИ | 70 мг 2,13 (1,52; 2,98) 140 мг 2,81 (2,01; 3,94) | <0,001 | |||
| Пациенты, у которых показатель ДММ изменился на ≥75 %d | |||||
| % | 20,8 | 22,0 | 7,9 | ||
| Отношение шансов 95 % ДИ | 70 мг 3,14 (1,91; 5,18) 140 мг 3,35 (2,05; 5,49) | Не применимо | |||
| Количество дней в течение месяца, в которые пациенты применяли специфические препараты для купирования приступа мигрениe | |||||
| Среднее изменениеb 95 % ДИ | -1,13 (-1,34; -0,92) | -1,61 (-1,83; -1,40) | -0,20 (-0,41; 0,02) | 70 мг -0,94 (-1,23; -0,64) 140 мг -1,42 (-1,71; -1,12) | <0,001 |
| Показатель по домену ухудшения физического состояния шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -4,24 (-5,02; -3,45) | -4,81 (-5,59; -4,03) | -2,38 (-3,16; -1,59) | 70 мг -2,22 (-3,28; -1,16) 140 мг | <0,001 |
| Влияние на показатель по домену повседневной активности шкалы MPFID | |||||
| Среднее изменениеb 95 % ДИ | -5,52 (-6,28; -4,75) | -5,86 (-6,62; -5,10) | -3,30 (-4,06; -2,53) | -2,22 (-3,28, -1,16) -2,57 (-3,62; -1,51) | <0,001 |
| HIT 6 | |||||
| Среднее изменение 95 % ДИ | -6,7 (-7,4; -6,0) | -6,9 (-7,6; -6,3) | -4,6 (-5,3; -4,0) | 70 мг -2,1 (-3,0; -1,1) 140 мг -2,3 (-3,2; -1,3) | Не применимо |
| Суммарный показатель MIDAS | |||||
| Среднее изменение 95 % ДИ | -6,7 (-7,6; -5,9) | -7,5 (-8,3; -6,6) | -4,6 (-5,5; -3,8) | 70 мг -2,1 (-3,3; -0,9) 140 мг -2,8 (-4,0; -1,7) | Не применимо |
| Ответ по домену ухудшения физического состояния шкалы MPFID | |||||
| %f | 39,1 | 42,5 | 30,1 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,49 (1,07; 2,08) 140 мг 1,73 (1,24; 2,40) | ||||
| Ответ по влиянию на показатель по домену повседневной активности шкалы MPFID | |||||
| %f | 49,0 | 50,3 | 34,5 | ||
| Отношение шансов 95 % ДИ | 70 мг 1,83 (1,33; 2,52) 140 мг 1,93 (1,40; 2,67) | ||||
ДИ — доверительный интервал; ДММ — количество дней с мигренью в течение месяца; MPFID — дневник влияния мигрени на физическую активность.
a Все p-значения представлены в виде нескорректированных значений и после коррекции на множественность сравнений являются статистически значимыми.
b Среднеквадратичное среднее изменение в месяцы 4–6 относительно исходного уровня, межгрупповая разница и p-значение основаны на линейной модели смешанных эффектов, в которую включены исследуемая группа, значение на исходном уровне, факторы стратификации (регион [Северная Америка или другой] и применение в прошлом лекарственных препаратов для профилактики мигрени [применялись, применялись в прошлом, применяются в настоящее время в качестве сопутствующих препаратов]), плановый визит и взаимодействие «исследуемая группа-плановый визит»; вменения отсутствующих данных не проводили.
c Отношение шансов и p-значение для пациентов с ответом ≥50 % в месяцы 4–6 основано на стратифицированном критерии Кохрана-Мэнтела-Ханцеля после вменения отсутствующих данных, которые считались отсутствием ответа.
d Апостериорный анализ; никакой проверки гипотезы не проводили.
e К специфическим препаратам от мигрени относятся триптаны и производные эрготамина.
f Снижение на ≥5 среднего месячного показателя УФС и ПА по сравнению с исходным показателем.
У пациентов, у которых не было достигнуто клинического ответа на один или несколько методов профилактического лечения, разница сокращения ДММ, наблюдаемая между дозой 140 мг и плацебо, составила -2,5 (95 % ДИ: -3,4; -1,7) и между дозой 70 мг и плацебо -2,0 (95 % ДИ: -2,8; -1,2). Также доля пациентов, у которых достигнуто сокращение ДММ на 50 % была больше по сравнению с группой плацебо (39,7 % для 140 мг и 38,6 % для 70 мг, при отношении шансов 3,1 [95 % ДИ: 1,7; 5,5] и 2,9 [95 % ДИ: 1,6; 5,3] соответственно).
Фармакокинетика
Эренумаб характеризуется нелинейной кинетикой, что обусловлено его связыванием с рецептором CGRP. У здоровых добровольцев, которым подкожно (п/к) вводили препарат в дозе 70 мг или 140 мг, среднее значение максимальной концентрации (Cmax) составляло соответственно 6,1 мкг/мл и 15,8 мкг/мл (стандартное отклонение [SD]) 2,1 мкг/мл и 4,8 мкг/мл), а среднее значение площади под кривой «концентрация-время» (AUClast — 159 сут × мкг/мл и 505 сут × мкг/мл (SD 58 сут × мкг/мл и 139 сут × мкг/мл) соответственно.
У пациентов, получавших препарат в дозе 70 мг или 140 мг п/к каждые 4 недели, минимальная концентрация (Cmin) в сыворотке крови со временем увеличивалась менее чем в 2 раза (Cmin [SD] 5,7 [3,1] и 6,2 [2,9] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 70 мг, соответственно, Cmin [SD] 12,8 [6,53] и 14,9 [6,45] мкг/мл для пациентов с эпизодической и хронической мигренью, получавших 140 мг, соответственно) и достигала равновесного состояния через 12 недель после начала лечения. Эффективный период полувыведения эренумаба составляет 28 дней.
Всасывание
У здоровых добровольцев взрослого возраста, получавших однократную п/к инъекцию эренумаба в дозе 70 мг или 140 мг, медиана Cmax в плазме крови достигалась приблизительно через 6 дней, а расчётная абсолютная биодоступность составляла 82 %.
Распределение
После однократного в/в введения в дозе 140 мг средний объём распределения в терминальной фазе выведения (Vz) составлял около 3,86 л (SD = 0,77).
Метаболизм и выведение
Выведение эренумаба описывается двухфазной кривой. При низких концентрациях выведение происходит преимущественно за счёт насыщаемого связывания с мишенью (рецептором CGRP), в то время как при более высоких концентрациях — преимущественно за счёт неспецифического ненасыщаемого протеолиза.
Фармакокинетика у особых групп пациентов
По данным популяционного фармакокинетического анализа у групп пациентов, которым показан эренумаб, его фармакокинетические параметры не зависели от возраста, пола, расы, подтипа мигрени (эпизодическая или хроническая) или клиренса креатинина.
Показания
Препарат применяется для профилактики мигрени у взрослых, которые имеют по крайней мере 4 дня мигрени в течение месяца.
Противопоказания
Повышенная чувствительность к действующему или вспомогательным веществам, входящим в состав препарата.
Опыт медицинского применения у детей отсутствует.
Применение при беременности и в период грудного вскармливания
Беременность
Адекватных и строго контролируемых исследований по применению эренумаба у беременных женщин не проводилось. В исследовании репродуктивной токсичности у яванских макак, в которых животные получали эренумаб во время беременности, а его экспозиция (оцениваемая по AUC) в 40 или 17 раз превышала таковую у пациентов, получающих эренумаб в дозе 70 мг или 140 мг 1 раз в месяц соответственно, не было выявлено никаких эффектов в отношении беременности, эмбриофетального или постнатального развития (до 6-месячного возраста). У только что родившихся обезьян определялись существенные концентрации эренумаба в сыворотке крови, подтверждая, что эренумаб, как и другие антитела IgG класса, проникает через плацентарный барьер.
Повреждающее действие эренумаба на плод в случае его применения у женщин во время беременности неизвестно, так как исследования на животных не всегда позволяют предсказать эффект лекарственного препарата у человека. В качестве меры предосторожности желательно избегать применения препарата во время беременности.
Применение эренумаба во время беременности возможно только в случае, если ожидаемая польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Неизвестно, проникает ли эренумаб в грудное молоко у человека. Отсутствуют данные о влиянии эренумаба на ребёнка, находящегося на грудном вскармливании, или на продукцию грудного молока у матери. Ввиду того, что многие лекарственные препараты проникают в грудное молоко, а также возможного развития нежелательных реакций на препарату младенцев, находящихся на грудном вскармливании, решение о прекращении кормления грудью или об отмене препарата следует принимать с учётом потенциальной пользы от применения эренумаба для матери и потенциальной пользы от грудного вскармливания для ребёнка.
Фертильность
Данных по влиянию эренумаба на репродуктивную функцию человека нет. При системных экспозициях эренумаба у половозрелых обезьян, до 283 или 123 раз превышающих экспозицию (оцениваемую по AUC для сыворотки крови) у человека, достигаемую в случае применения препарата в клинической дозе 70 мг или 140 мг 1 раз в месяц, никаких нежелательных действий в отношении суррогатных маркеров фертильности (патологоанатомических или гистопатологических изменений репродуктивных органов) не наблюдалось.
Способ применения и дозы
Лечение должно начинаться врачами, имеющими опыт диагностики и лечения мигрени. Рекомендуемая доза — 70 мг 1 раз в 4 недели (в месяц). У некоторых пациентов клинический эффект может достигаться при применении дозы 140 мг 1 раз в 4 недели (в месяц).
Клинические исследования показали, что у большинства пациентов, отвечающих на терапию, эффект наступает в течение 3 месяцев. Следует рассмотреть возможность прекращения лечения у пациентов, у которых не получен ответ после 3 месяцев терапии.
Рекомендуется регулярно оценивать необходимость продолжения лечения.
При пропуске очередной дозы рекомендуется возобновить лечение как можно раньше. В дальнейшем препарат применяется 1 раз в 4 недели (в месяц), начиная с последней полученной дозы.
Препарат Иринэкс следует вводить подкожно (п/к).
Препарат Иринэкс предназначен для самостоятельного введения пациентом.
Введение должно осуществляться лицом, обученным технике введения препарата. Для введения дозы 140 мг следует провести две последовательные подкожные инъекции препарата Иринэкс по 70 мг каждая.
Подробные указания по хранению препарата, обращению с ним и технике введения приведены в разделе «Указания по применению препарата Иринэкс».
Особые группы пациентов
Применение у пациентов с нарушением функции почек
Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек лёгкой или средней степеней тяжести. Не выявлены различия в фармакокинетике эренумаба у пациентов с нарушением функции почек лёгкой или средней степеней тяжести и пациентами с нормальной функцией почек по данным популяционного фармакокинетического анализа. У пациентов с нарушением функции почек тяжёлой степени (рСКФ <30 мл/мин/1,73 м2) исследований не проводилось.
Применение у пациентов с нарушением функции печени
Клинических исследований у пациентов с нарушением функции печени не проводилось. Эренумаб, как и другие моноклональные антитела, не метаболизируется изоферманами системы цитохрома P450. Выведение через печень не является основным способом введения эренумаба.
Применение у пациентов в возрасте 65 лет и старше
В клинических исследованиях эренумаба участвовало недостаточное количество пациентов в возрасте 65 лет и старше для выявления различий в ответе на лечение между пожилыми пациентами и пациентами более молодого возраста. Коррекция дозы у пациентов в возрасте 65 лет и старше не требуется.
Применение у пациентов в возрасте младше 18 лет
Безопасность и эффективность препарата Иринэкс у данной категории пациентов не установлена.
Указания по применению препарата Иринэкс
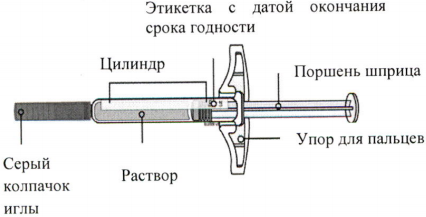
Инструкция по применению препарата Иринэкс, раствор для подкожного введения 70 мг/мл, в предварительно заполненном шприце
Одноразовый предварительно заполненный шприц
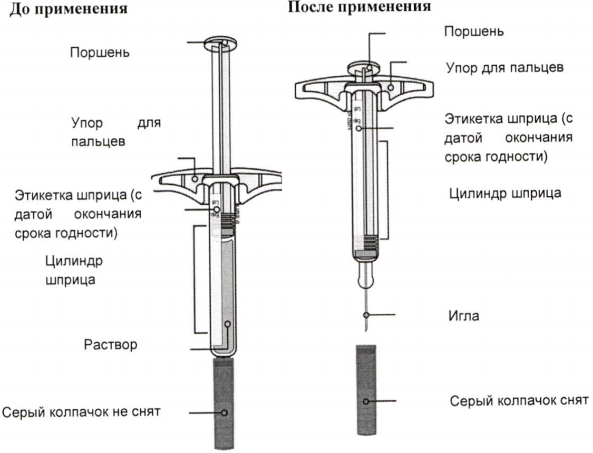
Важно! Внутри находится игла.
Важно
Перед применением препарата Иринэкс (предварительно заполненный шприц) ознакомьтесь с важной информацией:
Хранение
Храните препарат в недоступном и невидном для детей месте.
Храните препарат в оригинальной упаковке для защиты от света или физических повреждений.
Храните препарат в холодильнике при температуре 2–8 °C.
Вне холодильника длительность хранения препарата при комнатной температуре (до 25 °C) не должна превышать 14 дней.
Не убирайте препарат обратно в холодильник, после того как он был из него извлечён.
Не применяйте препарат, если он хранился при комнатной температуре (до 25 °C) в течение более 14 дней.
Препарат следует утилизировать в случае его хранения при более высокой температуре, либо более 14 дней.
Не подвергайте препарат воздействию экстремально низких или высоких температур.
Например, избегайте хранения препарата в машине.
Не замораживайте.
Применение
Не пытайтесь вводить препарат Иринэкс до того, как лечащий врач или медсестра не обучат Вас технике введения препарата.
Не применяйте препарат после истечения срока годности, указанного на упаковке.
Не встряхивайте шприц.
Не снимайте серый колпачок со шприца до тех пор, пока не будете готовы к введению препарата.
Не замораживайте препарат и не применяйте препарат, если он был заморожен.
Не используйте шприц, если он падал на твёрдую поверхность, так как часть шприца может быть повреждена, даже если Вы не видите каких-либо повреждений. В этом случае возьмите новый шприц и сообщите об этом лечащему врачу.
В сером колпачке иглы содержится натуральный латекс, что может вызвать аллергические реакции у лиц, имеющих аллергическую реакцию на латекс. Сообщите лечащему врачу, если у Вас есть аллергическая реакция на латекс.
За более подробной информацией или помощью обратитесь к лечащему врачу.
Шаг 1. Подготовка перед инъекцией
Ознакомьтесь с данной информацией до введения препарата.
Проверьте назначение врача.
Лечащий врач назначил Вам дозу 70 мг или 140 мг.
Для введения дозы 70 мг Вам будет нужно полностью ввести содержимое одного предварительно заполненного шприца. Для введения дозы 140 мг понадобится 2 последовательные инъекции (2 предварительно заполненных шприца) по 70 мг каждая.
Чтобы избежать дискомфорта в месте инъекции, оставьте шприцы при комнатной температуре в течение минимум 30 минут до начала инъекции.
Не пытайтесь нагреть автоинжектор за счёт внешнего источника тепла, например горячей водой или в микроволновой печи.
Не оставляйте автоинжектор на прямом солнечном свете.
А) Достаньте предварительно заполненный шприц с препаратом Иринэкс из картонной пачки.
Возьмитесь за цилиндр шприца, чтобы достать его из упаковки.
Б) Внимательно осмотрите предварительно заполненный шприц с препаратом Иринэкс.
Всегда держите шприц за цилиндр.
Убедитесь, что препарат в шприце является прозрачным бесцветным или светло-жёлтым раствором.
Оставьте шприц при комнатной температуре в течение минимум 30 минут до инъекции.
Не используйте шприц, если препарат в нем мутный или изменил цвет, а также содержит хлопья или частицы.
Не используйте шприц, если любая его часть имеет трещину или сломана.
Не используйте шприц, если его роняли.
Не используйте шприц, если серый колпачок иглы отсутствует или плохо закрыт.
Не используйте шприц, если срок годности, указанный на этикетке, истёк.
Во всех указанных случаях используйте новый шприц, а в случае сомнений обратитесь к лечащему врачу.
В) Приготовьте все материалы необходимые для инъекции. Тщательно вымойте руки с мылом.
На чистую, хорошо освещённую рабочую поверхность положите:
- 1 или 2 новых шприца (в зависимости от назначенной дозы),
- спиртовые салфетки,
- ватные шарики или марлевые тампоны,
- лейкопластырь,
- контейнер для утилизации острых предметов.

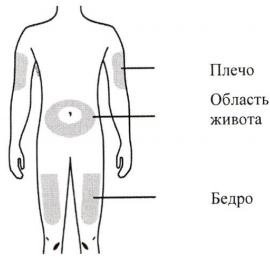
Г) Подготовьте и очистите место инъекции(й).
Инъекцию можно производить в:
- бедро,
- область живота, за исключением 5 см вокруг пупка,
- внешнюю поверхность плеча (только если инъекция проводится с посторонней помощью).
- 1 или 2 новых автоинжектора (в зависимости от назначенной дозы),
- спиртовые салфетки,
- ватные шарики или марлевые тампоны, лейкопластырь,
- контейнер для утилизации острых предметов.
- бедро,
- область живота, за исключением 5 см вокруг пупка,
- внешнюю поверхность плеча (только если инъекция проводится с посторонней помощью).
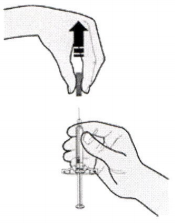
Очистите предполагаемое место инъекции спиртовой салфеткой и подождите, пока поверхность кожи станет сухой.
Не прикасайтесь к этой зоне до инъекции.
Если Вы хотите вводить препарат в ту же самую область, убедитесь, что это не то же самое место предыдущей инъекции.
Не производите инъекцию в область повреждённой кожи (истончение, покраснение, раздражение, уплотнение, шелушение, сыпь, кровоизлияния). Избегайте введения в места с наличием шрамов и растяжек.
Шаг 2. Непосредственно перед введением
Д) Снимите серый колпачок с иглы в направлении от себя, когда будете готовы к инъекции. Не оставляйте серый колпачок снятым более 5 минут. Это может привести к высыханию препарата.
Наличие на конце иглы капли препарата является нормальным.
Не скручивайте и не сгибайте серый колпачок.
Не одевайте серый колпачок обратно на шприц.
Не снимайте серый колпачок с иглы до тех пор, пока Вы не будете готовы к инъекции.
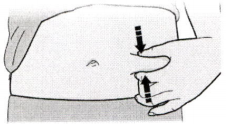
Е) Создайте складку кожи в месте введения, чтобы образовалась плотная поверхность для инъекции. Удерживайте кожу между большим и указательным пальцами, создавая зону около 5 см шириной.
Важно. Во время проведения самой инъекции продолжайте удерживать кожу в этом положении.
Шаг 3. Инъекция
Ж) Удерживая складку кожи, введите иглу шприца со снятым серым колпачком в кожу под углом 45–90 градусов.
Не помещайте палец на поршень, пока вводите иглу.
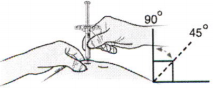
З) Медленно, не останавливаясь, надавите на поршень вниз, пока он не перестанет двигаться.
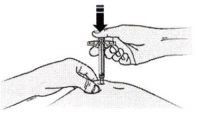
И) После этого уберите палец и плавно удалите шприц из кожи.
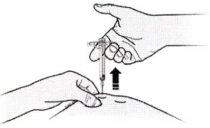
Важно. Если при удалении шприца Вы обнаружите, что в цилиндре остался раствор, значит Вы ввели неполную дозу. Сразу же сообщите об этом лечащему врачу.
Шаг 4. После инъекции
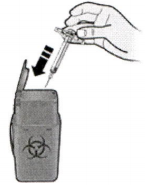
К) Утилизируйте использованный шприц и серый колпачок.
Положите использованный шприц в контейнер для утилизации острых предметов сразу после использования. Не бросайте в бытовой
мусор. Обсудите с лечащим врачом как правильно утилизировать шприц.
Не используйте шприц повторно.
Не следует повторно использовать шприц или контейнер для утилизации острых предметов или выбрасывать их в бытовой мусор.
Важно. Всегда храните контейнер для утилизации острых предметов в недоступном для детей месте.
Л) Осмотрите место введения.
При появлении крови прижмите ватный шарик или марлевый тампон к месту инъекции. Не растирайте место инъекции. При необходимости используйте лейкопластырь.
Если Вам была назначена доза 140 мг, повторите все шаги со вторым шприцем для получения полной дозы.
Инструкция по применению препарата Иринэкс, раствор для подкожного введения 70 мг/мл, в предварительно заполненном шприце в автоинжекторе (шприц-ручке)
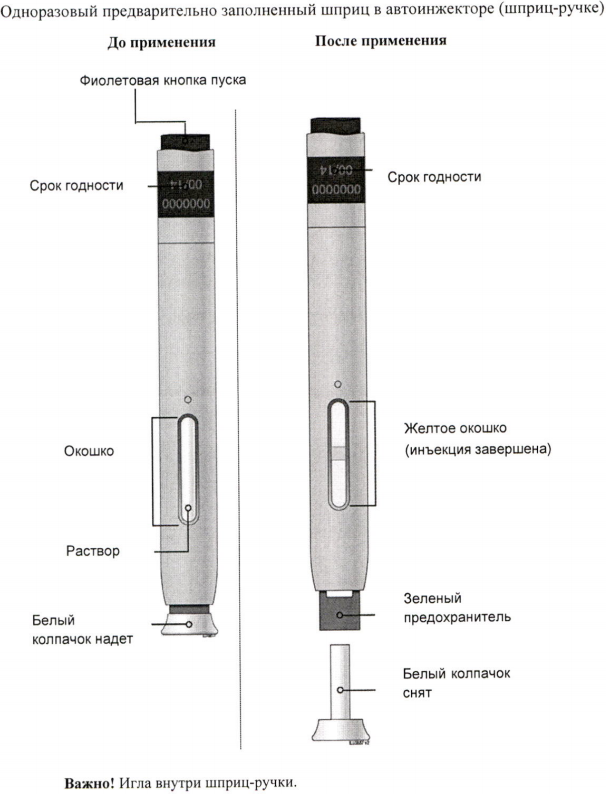
Важно
Перед применением препарата Иринэкс (предварительно заполненный шприц в автоинжекторе (шприц-ручке)) ознакомьтесь с важной информацией:
Хранение
Храните препарат в недоступном и невидном для детей месте.
Храните препарат в оригинальной упаковке для защиты от света или физических повреждений.
Храните препарат в холодильнике при температуре 2–8 °C.
Вне холодильника длительность хранения препарата при комнатной температуре (до 25 °C) не должна превышать 14 дней.
Не убирайте препарат обратно в холодильник, после того как он был из него извлечён. Не применяйте препарат, если он хранился при комнатной температуре (до 25 °C) в течение более 14 дней.
Препарат следует утилизировать в случае его хранения при более высокой температуре, либо более 14 дней.
Не подвергайте препарат воздействию экстремально низких или высоких температур. Например, избегайте хранения препарата в машине.
Не замораживайте.
Применение
Не пытайтесь вводить препарат Иринэкс до того, как лечащий врач или медсестра не обучат Вас технике введения препарата.
Не применяйте препарат после истечения срока годности, указанного на упаковке.
Не встряхивайте автоинжектор.
Не снимайте белый колпачок с автоинжектора до тех пор, пока не будете готовы к введению препарата.
Не замораживайте препарат и не применяйте препарат, если он был заморожен.
Не используйте автоинжектор, если он падал на твёрдую поверхность, так как часть автоинжектора может быть повреждена, даже если Вы не видите каких-либо повреждений. В этом случае возьмите новый автоинжектор и сообщите об этом лечащему врачу.
В белом колпачке иглы содержится натуральный латекс, что может вызвать аллергические реакции у лиц, имеющих аллергическую реакцию на латекс. Сообщите лечащему врачу, если у Вас есть аллергическая реакция на латекс.
За более подробной информацией или помощью обратитесь к лечащему врачу.
Шаг 1. Подготовка перед инъекцией
Ознакомьтесь с данной информацией до введения препарата.
Проверьте назначение врача.
Лечащий врач назначил Вам дозу 70 мг или 140 мг.
Для введения дозы 70 мг Вам будет нужно полностью ввести содержимое одной предварительно заполненной шприц-ручки. Для введения дозы 140 мг понадобится 2 последовательные инъекции (2 предварительно заполненных шприц-ручки) по 70 мг каждая.
Чтобы избежать дискомфорта в месте инъекций, оставьте шприцы при комнатной температуре в течение минимум 30 минут до начала инъекции.
А) Достаньте автоинжектор с препаратом Иринэкс из картонной пачки.
Аккуратно достаньте автоинжектор из картонной пачки в направлении вверх.
Оставьте автоинжектор при комнатной температуре в течение минимум 30 минут до инъекции.
Не убирайте автоинжектор обратно в холодильник после того, как препарат достиг комнатной температуры.
Не пытайтесь нагреть автоинжектор за счёт внешнего источника тепла, например горячей водой или в микроволновой печи.
Не оставляйте автоинжектор на прямом солнечном свете.
Не встряхивайте автоинжектор.
На этом этапе не снимайте с автоинжектора белый колпачок.
Б) Внимательно осмотрите предварительно заполненный шприц с препаратом Иринэкс.
Убедитесь, что препарат в окошке является прозрачным бесцветным или светло-жёлтым раствором.
Не используйте автоинжектор, если препарат в нем мутный или изменил цвет, а также содержит хлопья или частицы.
Не используйте автоинжектор, если любая его часть имеет трещину или сломана.
Не используйте автоинжектор, если его роняли.
Не используйте автоинжектор, если белый колпачок иглы отсутствует или плохо закрыт.
Не используйте автоинжектор, если срок годности, указанный на этикетке, истёк.
Во всех указанных случаях используйте новый автоинжектор, а в случае сомнений обратитесь к лечащему врачу.
В) Приготовьте все материалы необходимые для инъекции. Тщательно вымойте руки с мылом.
На чистую, хорошо освещённую рабочую поверхность положите:

Г) Подготовьте и очистите место инъекции(й).
Инъекцию можно производить в:
Очистите предполагаемое место инъекции спиртовой салфеткой и подождите, пока поверхность кожи станет сухой.
Не прикасайтесь к этой зоне до инъекции.
Если Вы хотите вводить препарат в ту же самую область, убедитесь, что это не то же самое место предыдущей инъекции.
Не производите инъекцию в область повреждённой кожи (истончение, покраснение, раздражение, уплотнение, шелушение, сыпь, кровоизлияния). Избегайте введения в места с наличием шрамов и растяжек.
Шаг 2. Непосредственно перед введением
Д) Снимите белый колпачок с иглы в направлении от себя, когда будете готовы к инъекции. Не оставляйте белый колпачок снятым более 5 минут. Это может привести к высыханию препарата.
Наличие на конце иглы капли препарата является нормальным.
Не скручивайте и не сгибайте белый колпачок.
Не одевайте белый колпачок обратно на автоинжектор.
Не снимайте белый колпачок с иглы до тех пор, пока Вы не будете готовы к инъекции.
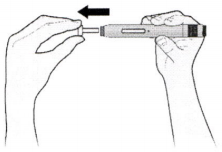
Е) Растяните или оттяните кожу в месте инъекции, чтобы создать твёрдую поверхность.
Метод с растяжением кожи
Уверенным движением растяните кожу, для чего нажмите на неё и разведите большой палец и указательный пальцы в разные стороны, создав область шириной около 5 см.
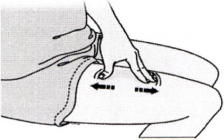
или
Метод с оттягиванием кожи
Оттяните кожу, зажав её большим и указательным пальцами и создав область шириной около 5 см.
Важно! Во время инъекции удерживайте кожу в растянутом или оттянутом состоянии.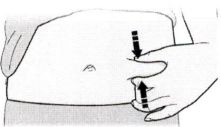
Шаг 3. Инъекция
Ж) Удерживайте кожу в растянутом или оттянутом состоянии. Подведите шприц-ручку со снятым белым колпачком к коже под углом 90 градусов.
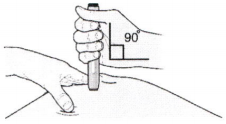
Важно! Пока не прикасайтесь к фиолетовой кнопке пуска.
З) Уверенным движением протолкните шприц ручку вниз, пока она не перестанет двигаться.
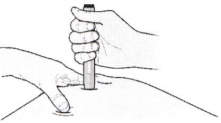

Важно! Необходимо протолкнуть автоинжектор вниз до конца, не касаясь фиолетовой кнопки пуска до тех пор, пока Вы не будете готовы сделать инъекцию.
И) Когда Вы будете готовы к инъекции, нажмите на фиолетовую кнопку пуска. При этом Вы услышите щелчок.
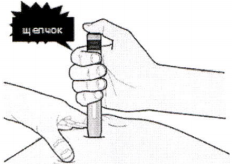
К) Продолжайте давить на кожу. Инъекция может занять около 15 секунд.
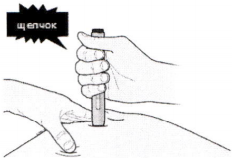
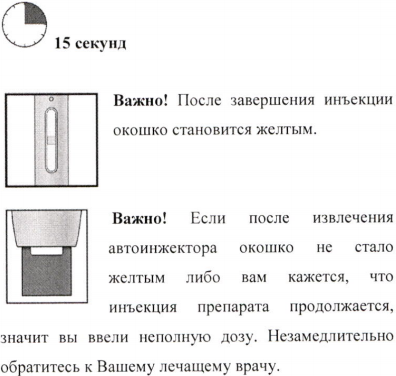
Шаг 4. После инъекции
К) Утилизируйте использованный автоинжектор и белый колпачок.
Положите использованный автоинжектор в контейнер для утилизации острых предметов сразу после использования.
Обсудите с лечащим врачом как правильно утилизировать автоинжектор.
Не используйте автоинжектор повторно.
Не помещайте автоинжектор или контейнер для острых отходов в ёмкости для рециклинга и не выбрасывайте их вместе с бытовым мусором.
Важно. Всегда храните контейнер для утилизации острых предметов в недоступном и невидном для детей месте.
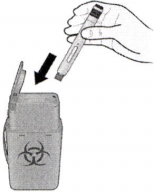
Л) Осмотрите место введения.
При появлении крови прижмите ватный шарик или марлевый тампон к месту инъекции.
Не растирайте место инъекции. При необходимости используйте лейкопластырь.
Если Вам была назначена доза 140 мг, повторите все шаги со вторым автоинжектором для получения полной дозы.
Побочное действие
Для оценки безопасности эренумаба в течение 12 недель после начала лечения по сравнению с плацебо были объединены данные 2 клинических исследований II фазы и 2 клинических исследований III фазы у пациентов с мигренью.
В целом, в эти исследования было включено 2656 пациентов (1613 получали эренумаб, 1043 — плацебо). Из них 893 пациентов получали эренумаб в дозе 70 мг и 507 — в дозе 140 мг.
Общая выборка для оценки безопасности, учитывающая продолжающиеся открытые фазы дополнительных исследований, включает 2537 пациентов (2310,3 пациенто-лет), получивших по крайней мере 1 дозу эренумаба: 2066 пациентов получали препарат по крайней мере 6 месяцев, а 1213 пациентов — по крайней мере 12 месяцев.Сводные данные по нежелательным реакциям (HP)
Все HP, зарегистрированные у пациентов, получавших эренумаб в 12-недельный плацебо-контролируемый период клинических исследований, приведены в таблице 1. Большинство HP были лёгкой или средней степени тяжести.
Ниже HP сгруппированы в соответствии с классификацией органов и систем органов MedDRA, и перечислены в порядке уменьшения частоты встречаемости.
Частота встречаемости оценивалась следующим образом: «очень часто» — ≥10 %, «часто» — ≥1–<10 %, «нечасто» — ≥0,1 %–<1 %, «редко» — ≥0,01–<0,1 %, «очень редко» — <0,01 %, включая отдельные сообщения, «частота неизвестна» — не может быть определена по имеющимся данным. В пределах каждой частотной категории HP распределены в порядке уменьшения частоты встречаемости.
| Системно-органный класс | HP | Категория частоты |
|---|---|---|
| Нарушения со стороны иммунной системы | Реакции гиперчувствительности, включая сыпь, отёк и крапивницу | Часто |
| Общие расстройства и нарушения в месте введения | Реакции в месте введенияa | Часто |
| Нарушения со стороны желудочно-кишечного тракта | Запор | Часто |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Мышечный спазм | Часто |
| Нарушения со стороны кожи и подкожных тканей | Зудb | Часто |
a Термин «реакции в месте введения» включает в себя несколько предпочтительных терминов, в частности боль в месте введения и эритема в месте введения.
b Термин «зуд» включает такие предпочтительные термины, как генерализованный зуд, зуд и зудящая сыпь.
Описание отдельных нежелательных реакций
Реакции в месте введения
В объединённом анализе 12-недельного плацебо-контролируемого периода клинических исследований наиболее частыми реакциями в месте введения у пациентов, получавших эренумаб, были боль в месте введения, эритема в месте введения и зуд в месте введения.
Большинство реакций в месте введения были 1 степени тяжести (лёгкие) и проходящие. Как правило боль в месте инъекции проходит в течение 1 часа после инъекции. У одного пациента, получившего эренумаб в дозе 70 мг п/к, препарат был отменен в связи с развитием сыпи в месте введения. Ни у одного из пациентов, получавших эренумаб в дозе 140 мг п/к, препарат не был отменен по причине реакций в месте введения по данным 12-недельного плацебо-контролируемого периода исследований.
Иммуногенность
Как и все белки, обладающие терапевтическим эффектом, эренумаб может вызывать иммунный ответ. Иммуногенность оценивали с использованием метода иммуноанализа для обнаружения связывающих антител против эренумаба. Для пациентов, в сыворотках которых при скрининговом иммуноанализе были обнаружены антитела к эренумабу, проводили биологический анализ in vitro для обнаружения нейтрализующих антител.
В 4 исследованиях профилактического лечения мигрени на протяжении двойной слепой фазы исследования частота образования антител к эренумабу у пациентов, получавших эренумаб в дозе 70 мг и 140 мг, составила 6,3 % (56/884, при этом у 3 пациентов нейтрализующая активность определялась in vitro) и 2,6 % (13/504, при этом in vitro нейтрализующая активность не определялась ни у одного пациента). Образование антител к эренумабу не влияло на его эффективность или безопасность.
Определяемая частота образования антител к лекарственному препарату в значительной степени зависит от чувствительности и специфичности анализа. Кроме того, частота обнаружения в сыворотке крови антител (в том числе, нейтрализующих) может зависеть от целого ряда факторов, к которым относятся метод анализа, способ и время получения образцов, сопутствующие терапия и заболевания. По этим причинам сравнение частоты образования антител к эренумабу с частотой образования антител к другим препаратам может привести к неверным выводам.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В клинических исследованиях не было выявлено случаев передозировки эренумаба у человека. В клинических исследованиях эренумаб применяли п/к в дозах до 280 мг без каких-либо признаков дозоограничивающей токсичности. В случае передозировки следует проводить поддерживающую и симптоматическую терапию по мере необходимости.
Взаимодействие с другими лекарственными средствами
В открытом исследовании фармакокинетического лекарственного взаимодействия эренумаба и комбинированных пероральных контрацептивов у здоровых женщин эренумаб (однократная п/к инъекция в дозе 140 мг) не влиял на фармакокинетику комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и норгестимат.
В рандомизированном двойном слепом плацебо-контролируемом исследовании у здоровых добровольцев эренумаб (однократное в/в введение в дозе 140 мг), применяемый одновременно с суматриптаном, никак не влиял на показатели артериального давления в покое по сравнению с суматриптаном в качестве монотерапии. Эренумаб не оказывал влияния на фармакокинетику суматриптана.
Эренумаб не метаболизируется изоферментами цитохрома P450; также маловероятно, что он может вызывать заметные изменения концентрации провоспалительных цитокинов, которые способны влиять на экспрессию или активность изоферментов цитохрома P450. По этой причине лекарственные взаимодействия при одновременном применении препаратов, которые являются субстратами, индукторами или ингибиторами изоферментов цитохрома P450, представляются маловероятными.
Влияние на результаты лабораторных и диагностических исследований
Влияние эренумаба на результаты лабораторных и/или диагностических исследований не изучалось.
Особые указания
Пациенты с некоторыми основными сердечно-сосудистыми заболеваниями были исключены из клинических исследований, в связи с чем данные по безопасности у этих пациентов отсутствуют.
Пациенты с гиперчувствительностью к латексу
Съёмная крышка предварительно заполненного шприца и автоинжектора (шприц-ручки) содержит сухой натуральный каучуковый латекс, который может вызывать аллергические реакции у лиц, чувствительных к латексу.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Иринэкс не оказывает значительного влияния на способность управлять транспортными средствами и/или механизмами.
Форма выпуска
Раствор для подкожного введения, 70 мг/мл.
Первичная упаковка
По 1 мл в предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс,
или
по 1 мл предварительно заполненный шприц из стекла I гидролитического класса с иглой из нержавеющей стали и колпачком иглы из резины, содержащей латекс, в автоинжекторе (шприц-ручке).
Вторичная упаковка: один предварительно заполненный шприц или две предварительно заполненные шприц-ручки вместе с инструкцией по медицинскому применению лекарственного препарата помещают в пачку картонную с контролем первичного вскрытия.
Хранение
При температуре от 2 до 8 °C. Не замораживать.
Хранить предварительно заполненные шприцы/ шприц-ручки в оригинальной картонной пачке для защиты от воздействия света.
Хранить в недоступном и невидном для детей месте.
Срок годности
2 года.
Не применять после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Amgen Europe, B.V., Нидерланды
Amgen Manufacturing, Limited, Пуэрто-Рико
Производство готовой лекарственной формы, первичная упаковка
«Амджен Мэньюфэкчуринг Лимитед», Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико 00777, Соединенные Штаты Америки/ Amgen Manufacturing Limited, Carr 31, Km 24.6, Juncos, Puerto Rico (PR), 00777, USA
Вторичная (потребительская) упаковка, выпускающий контроль качества
«Амджен Европа Б.В.», Минервум 7061, 4817 ZK Бреда, Нидерланды/ Amgen Europe B.V., Minervum 7061,4817 ZK, Breda, Netherlands
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
«Сандоз Фармасьютикалс д.д.», Веровшкова 57, 1000 Любляна, Словения/ Sandoz Pharmaceuticals d.d., Verovskova 57, 1000 Ljubljana, Slovenia
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в России:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Иринэкс:
