Кунокс®
Лекарственная форма
лиофилизат для приготовления раствора для внутримышечного введения
Состав
Состав на 1 флакон:
Для дозировки 50 ЕД
Действующее вещество:
Ботулинический токсин типа А — гемагглютинин комплекс 50 ЕД
Вспомогательные вещества:
Альбумин человека сывороточный 0,25 мг;
Натрия хлорид 0,45 мг.
Для дозировки 100 ЕД
Действующее вещество:
Ботулинический токсин типа А — гемагглютинин комплекс 100 ЕД
Вспомогательные вещества:
Альбумин человека сывороточный 0,5 мг;
Натрия хлорид 0,9 мг.
Для дозировки 200 ЕД
Действующее вещество:
Ботулинический токсин типа А — гемагглютинин комплекс 200 ЕД
Вспомогательные вещества:
Альбумин человека сывороточный 1,0 мг;
Натрия хлорид 1,8 мг.
Описание
Белая или почти белая лиофилизированная масса, распределённая по дну флакона
Фармакологическое действие
Фармакодинамика
Ботулинический токсин типа А блокирует периферический выброс ацетилхолина в пресинаптических холинергических нервных окончаниях путём расщепления SNAP-25, белка, принимающего участие в процессе экзоцитоза ацетилхолина из везикул, расположенных в нервных окончаниях. После инъекции происходит первоначальное быстрое высокоаффинное связывание токсина со специфичными клеточными рецепторами. За этим следует трансфер токсина через плазматическую мембрану с помощью рецептор-опосредованного эндоцитоза. Финальный этап — высвобождение токсина в цитозоль.
Этот процесс сопровождается постепенным ингибированием высвобождения ацетилхолина. Первичный фармакодинамический эффект ботулинического токсина типа А обусловлен химической денервацией мышцы, в которую была произведена инъекция, что приводит к измеряемому снижению индуцированного электрического ответа мышцы и. как следствие, к её расслаблению. Клинические признаки появляются в течение 2–3 дней, причём максимальный эффект наблюдается в течение 5–6 недель после инъекции.
Восстановление нервно-мышечной передачи происходит обычно в течение 12 недель после инъекции в результате регенерации нервных терминалей и восстановления связей с концевыми пластинами.
Фармакокинетика
Фармакологический эффект ботулинического токсина типа А развивается в месте инъекции. Используя доступные в настоящее время аналитические методики, невозможно обнаружить ботулинический токсин типа А в периферической крови после внутримышечной инъекции в рекомендуемых дозах.
Антитела к ботулиническому токсину типа А могут формироваться после повторных инъекций в 1–5 % случаев. Продукции антител способствует введение больших доз препарата, а также повторное введение в малых дозах через короткие промежутки времени. При формировании антител к ботулиническому токсину типа А эффект от его дальнейшего применения может быть сниженным.
Показания
Блефароспазм
Цервикальная дистония (спастическая кривошея)
Фокальная спастичность:
- ассоциированная с динамической деформацией стопы по типу «конская стопа» вследствие спастичности у пациентов 2 лет и старше с детским церебральным параличом (ДЦП), находящихся на амбулаторном лечении;
- руки у взрослых пациентов, перенёсших инсульт.
Временная коррекция внешнего вида морщин верхней трети лица (межбровные морщины умеренной или тяжёлой степени выраженности, ассоциирующиеся с активностью мышцы, сморщивающей бровь, и/или мышцы гордецов; боковые периорбитальные морщины умеренной или тяжёлой степени выраженности, ассоциирующиеся с активностью круговой мышцы глаз) у взрослых.
Противопоказания
Общие:
- гиперчувствительность к любому компоненту препарата в анамнезе;
- воспалительный процесс в месте предполагаемой инъекции (инъекций);
- острая фаза инфекционных заболеваний;
- беременность и грудное вскармливание;
Блефароспазм и коррекция морщин верхней трети лица:
- выраженный гравитационный птоз тканей;
- выраженные «грыжи» в области верхних и нижних век;
- миастения гравис или синдром Ламберта-Итона.
С осторожностью
Коррекция морщин верхней трети лица:
- у пожилых пациентов с отягощённым анамнезом и сопутствующей лекарственной терапией;
- у пациентов, имеющих дисфагию и аспирацию в анамнезе;
- у детей с тяжёлыми неврологическими нарушениями, дисфагией, заболеванием лёгких или недавно перенёсших аспирационную пневмонию;
- у пациентов с отягощённым анамнезом;
- в случае выраженной слабости или атрофии мышцы, в которую планируется вводить препарат;
- у пациентов с периферической моторной нейропатией (например, при амиотрофическом боковом склерозе или моторной нейропатии);
- у пациентов, имеющих риск развития закрытоугольной глаукомы, включая анатомическое сужение угла передней камеры.
Беременность и лактация
Беременность
Контролируемые исследования ботулинического токсина типа А с участием беременных женщин не проводили. Результаты исследований у животных выявили наличие репродуктивной токсичности. Потенциальный риск для человека не определен. Препарат не следует применять во время беременности и у женщин детородного возраста, не использующих надёжную контрацепцию, за исключением случаев крайней необходимости.
Период грудного вскармливания
Неизвестно, выделяется ли ботулинический токсин типа А в грудное молоко. Во время грудного вскармливания применение препарата Кунокс® не может быть рекомендовано.
Влияние на репродуктивную функцию
Не получено данных о влиянии ботулинического токсина типа А на репродуктивную функцию женщин. Результаты исследований репродуктивной функции у самцов и самок крыс продемонстрировали снижение фертильности.
Способ применения и дозы
Детальные рекомендации указаны для каждого конкретного показания ниже.
Общие рекомендации
Лечение препаратом Кунокс® должно осуществляться только врачами соответствующей квалификации, прошедшими специальную подготовку для проведения данного вида лечения с использованием требуемых инструментов. При начале терапии необходимо использовать минимальные рекомендуемые дозы. При последующих курсах инъекций эта доза может быть постепенно увеличена до максимальной рекомендованной дозы, если это необходимо. Оптимальные дозы должны подбираться с помощью титрации, но рекомендуемая максимальная доза препарата не должна быть превышена.
Единицы активности препарата Кунокс® для инъекций являются специфическими для данного препарата и используемого метода анализа. Они не являются взаимозаменяемыми с другими препаратами ботулинического токсина, и, следовательно, единицы биологической активности препарата Кунокс® не могут сравниваться или преобразовываться в единицы любых других препаратов ботулинического токсина, оцениваемых любым другим специфическим методом анализа (см. раздел Особые указания: Отсутствие взаимозаменяемости между препаратами ботулинического токсина).
Для каждого показания следует соблюдать указанные специфические режимы дозирования и рекомендации по применению препарата Кунокс®. При лечении взрослых пациентов по одному или нескольким показаниям максимальная кумулятивная доза препарата Кунокс® обычно не должна превышать 360 единиц при условии введения с интервалом в 3 месяца. Безопасность и эффективность препарата Кунокс®, вводимого чаще, чем один раз в 3 месяца, клинически не оценивали.
Безопасное и эффективное применение препарата Кунокс® зависит от надлежащего хранения препарата, выбора точной дозы, строгого следования рекомендациям по восстановлению и введению препарата. Понимание стандартных электромиографических методик также необходимо для лечения спастичности верхних и нижних конечностей у детей. Врачи, практикующие введение препарата Кунокс®, должны понимать особенности нервно-мышечной и структурной анатомии пораженной области, а также принимать во внимание любые изменения в анатомии конкретной области, вызванные предшествующими хирургическими процедурами и заболеванием.
Правила приготовления и разведения раствора для инъекций
Перед введением следует развести каждый флакон с лиофилизированным препаратом Кунокс® только стерильным, без консервантов, 0,9 % раствором натрия хлорида для инъекций. Следует набрать необходимое количество растворителя в шприц соответствующего размера (см. Таблица 1), а затем медленно ввести растворитель во флакон. Флакон следует уничтожить, если не наблюдается втягивания растворителя во флакон под действием вакуума. Аккуратно вращая флакон смешать препарат Кунокс® с растворителем. Препарат Кунокс® следует вводить в течение 24 часов после приготовления. В течение этого периода времени неиспользованный восстановленный препарат Кунокс® следует хранить в холодильнике (при температуре 2–8 °C) не более 24 часов до момента использования. Флаконы с препаратом Кунокс® предназначены только для однократного использования. Следует утилизировать неиспользованную часть раствора.
Таблица 1. Инструкция по разведению препарата Кунокс® во флаконах (50 ЕД, 100 ЕД и 200 ЕД)
Количество растворителя*, добавляемого во флакон 50 единиц | Итоговая доза (единиц на 0,1 мл) | Количество растворителя*, добавляемого во флакон 100 единиц | Итоговая доза (единиц на 0,1 мл) | Количество растворителя*, добавляемого во флакон 200 единиц | Итоговая доза (единиц на 0,1 мл) |
0,5 мл | 10,0 единиц | 1,0 мл | 10,0 единиц | 1,0 мл | 20,0 единиц |
1,0 мл | 5,0 единиц | 2,0 мл | 5,0 единиц | 2,0 мл | 10,0 единиц |
2,0 мл | 2,5 единиц | 4,0 мл | 2,5 единиц | 4,0 мл | 5,0 единиц |
4,0 мл | 1,25 единиц | 8,0 мл | 1,25 единиц | 8,0 мл | 2,5 единиц |
* 0,9 % раствор натрия хлорида для инъекций без консерванта
Примечание: эти разведения рассчитаны для объёма инъекции 0,1 мл. Уменьшение или увеличение дозы препарата Кунокс® также возможно при введении меньшего или большего объёма инъекции — от 0,05 мл (уменьшение дозы на 50 %) до 0,15 мл (увеличение дозы на 50 %).
Инъекцию препарата Кунокс® готовят путём забора стерильным шприцем подходящего размера необходимого количества правильно восстановленного токсина, которое должно немного превышать рекомендуемую дозу. Шприц прикреплён к соответствующей инъекционной игле, а в цилиндре шприца должны отсутствовать пузырьки воздуха. Проходимость иглы должна быть подтверждена. При каждом извлечении препарата Кунокс® из флакона следует использовать новую стерильную иглу и шприц.
Восстановленный препарат Кунокс® должен быть прозрачным, бесцветным, без механических включений. Парентеральные лекарственные препараты необходимо проверять визуально на отсутствие включений и изменение цвета перед введением и каждый раз, когда позволяют раствор и упаковка.
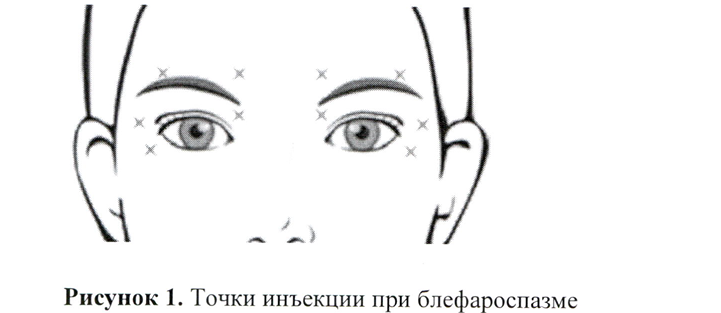
Блефароспазм
Препарат Кунокс® вводится с помощью стерильной иглы калибра 28–30 G. Начальная рекомендованная доза составляет 1,25~2,5 ЕД и вводится в претарзальную область медиальной и латеральной круговой мышцы глаза верхнего века и в претарзальную область латеральной круговой мышцы глаза нижнего века (см. Рисунок 1). Доза может быть увеличена в 2 раза в каждой точке инъекции у пациентов с введением ботулотоксина в анамнезе. Коррекцию дозы можно провести с учётом наличия спазма или симптома. В клинических исследованиях (КИ) пациентам вводили общую дозу в диапазоне 20~60 ЕД.
Для снижения риска развития осложнения в виде птоза, необходимо избегать инъекций в область мышцы, поднимающей верхнее веко. Для снижения риска развития осложнения в виде диплопии необходимо избегать инъекций в медиальную часть нижнего века, уменьшая, таким образом, диффузию препарата в нижнюю косую мышцу глаза. Экхимоз легко возникает в мягких тканях век. Его развитие можно предотвратить путём надавливания на место инъекции сразу после её выполнения.
Безопасность и эффективность препарата Кунокс® для лечения блефароспазма у пациентов младше 18 лет и старше 75 лет не изучали.
Фокальная спастичность
Дозу препарата на начальных и последующих сеансах лечения следует подбирать индивидуально в соответствии с размером, количеством и локализацией вовлечённых в патологический процесс мышц, выраженностью спастичности, наличием локальной мышечной слабости, реакцией пациента на предыдущее лечение или наличием нежелательных явлений (НЯ) при назначении препарата Кунокс® в анамнезе.
Необходимо вводить самую низкую рекомендуемую начальную дозу; иглу подходящего размера можно использовать для поверхностных мышц, а более длинную иглу — для глубоко расположенных мышц. Для определения поражённых мышц можно применять электромиографию или методы стимуляции нервных волокон.
Лечение фокальной спастичности руки у взрослых пациентов, перенёсших инсульт
Препарат вводят с помощью стерильной иглы калибра 24–30 G в зависимости от толщины мышечной ткани выбранной для лечения мышцы. Доза и места инъекции указаны в Таблице 2. В КИ дозы в диапазоне от 100 до 360 единиц распределялись между выбранными мышцами на конкретном сеансе лечения. Безопасность и эффективность препарата Кунокс® для лечения фокальной спастичности руки у пациентов младше 20 лет и старше 80 лет не изучали.
Таблица 2. Режим дозирования препарата Кунокс® для лечения фокальной спастичности руки у взрослых пациентов в зависимости от поражённой мышцы
Мышца, в которую вводится препарат | Доза | Место инъекции |
Согнутое запястье Лучевой сгибатель запястья Локтевой сгибатель запястья | 15–60 ЕД 10–50 ЕД | 1–2 точки 1–2 точки |
Сжатый кулак Поверхностный сгибатель пальцев Глубокий сгибатель пальцев | 15–50 ЕД 15-50 ЕД | 1–2 точки 1–2 точки |
Согнутый локоть Двуглавая мышца | 100–200 ЕД | до 4 точек |
В контролируемых КИ пациентов наблюдали в течение 12 недель после одного курса лечения. Улучшение мышечного тонуса отмечалось в течение 2 недель, максимальный эффект обычно отмечался в течение 4–6 недель. В других КИ ботулинического токсина интервал между начальным введением препарата и его повторными инъекциями у большинства пациентов составлял 12–16 недель, когда действие препарата на мышечный тонус уменьшалось. Максимальная суммарная доза для таких пациентов, получивших 4 курса инъекций в течение 54 недель, составляла 960 единиц.
Лечение фокальной спастичности у детей 2 лет и старше с детским церебральным параличом, находящихся на амбулаторном лечении
С помощью стерильной иглы калибра 26–30 G препарат вводят в медиальную и латеральную головки поражённой икроножной мышцы. Рекомендуемая доза препарата Кунокс® при спастичности и эквино-варусной деформации стопы у детей с детским церебральным параличом определяется в ЕД на килограмм массы тела и составляет 4 ЕД/кг для односторонних инъекций в области нижних конечностей или 6 ЕД/кг — для двусторонних инъекций в области нижних конечностей. Однако общая доза препарата Кунокс® не должна превышать 200 ЕД.
Безопасность и эффективность препарата Кунокс® для лечения фокальной спастичности нижних конечной у детей младше 2 лет не изучали.
Временная коррекция внешнего вида морщин верхней трети лица
Межбровные морщины умеренной или тяжёлой степени выраженности, ассоциирующиеся с активностью мышцы, сморщивающей бровь, и/или мышцы гордецов
Межбровные морщины возникают из-за активности мышц, вызывающих сморщивание бровей, и круговых мышц глаз. Эти мышцы вызывают медиальное движение бровей, а мышца гордецов и опускающая брови мышца оттягивают лоб вниз. Это создаёт нахмурившийся вид или «нахмуренный лоб». Локализация, размер и использование мышц у разных людей заметно различаются. Морщины, вызванные мимикой лица, возникают перпендикулярно направлению действия сокращающихся мышц лица.
Чтобы уменьшить вероятность возникновения осложнения в виде птоза, необходимо предпринять следующие шаги:
- Избегайте вводить препарат вблизи мышцы, поднимающей верхнее веко, особенно у пациентов с более крупными комплексами опускающих бровь мышц.
- Инъекции в боковые мышцы, вызывающие сморщивание кожи, следует выполнять не менее, чем на 1 см выше остеоидной надбровной дуги.
- Убедитесь, что введённый объем/доза препарата являются точными и. по возможности, сведены к минимуму.
- Не вводите токсин ближе, чем на 1 см выше центральной части брови.
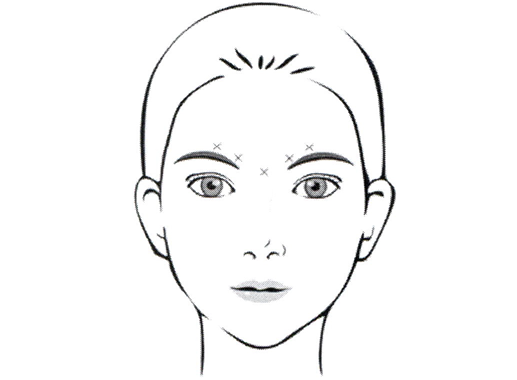
Ввести 4 ЕД препарата Кунокс® внутримышечно в каждую из 5 точек, по 2 в каждую мышцу, сморщивающую бровь, и 1 — в мышцу гордецов с достижением общей дозы 20 ЕД (см. Рисунок 2). Обычно начальные дозы препарата Кунокс® вызывают химическую денервацию мышц через 1–2 дня после инъекции, и сглаживание межбровных морщин происходит, как правило, в течение недели после процедуры. Продолжительность действия препарата Кунокс® на межбровные морщины составляет примерно 3–4 месяца. Безопасность и эффективность препарата Кунокс® для временной коррекции внешнего вида межбровных морщин у пациентов младше 18 лет и старше 65 лет не изучали.
Рисунок 2. Точки введения препарата для коррекции межбровных морщин
Боковые периорбитальные морщины умеренной или тяжёлой степени выраженности, ассоциирующиеся с активностью круговой мышцы глаз (морщины в углах глаз)
Морщины в углах глаз возникают в основном из-за активности круговых мышц глаз, отвечающих за моргание и закрытие века. Сильное сжатие круговых мышц глаза приводит к появлению боковых и радиально ориентированных складок (морщинки "гусиные лапки"), которые берут своё начало во внешнем углу глаза. Распределение этих радиальных морщин у пациентов отличается.
Инъекции следует выполнять кончиком иглы, направленным вверх, и ориентированным от глаз. Введите 4 ЕД препарата Кунокс® в 3 точки на каждой стороне (всего 6 точек) в латеральную круговую мышцу глаза, всего 24 ЕД (по 12 ЕД на каждую сторону). Первая инъекция (точка инъекции А на рисунке ниже) должна быть выполнена в височной области в точке, расположенной примерно на 1,5–2,0 см от внешнего угла глаза и глазничного валика. Если морщины в уголках глаз находятся выше и ниже внешнего угла глаза, следует вводить препарат в соответствии с Рисунком 3. В качестве альтернативы, если морщины в уголках глаз находятся в основном ниже внешнего угла глаза, следует вводить препарат в соответствии с Рисунком 4.
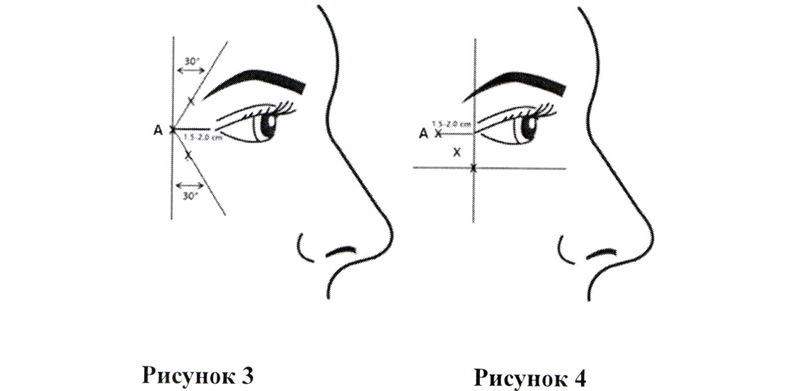
Безопасность и эффективность препарата Кунокс® для временной коррекции внешнего вида боковых периорбитальных морщин у пациентов младше 20 лет и старше 65 лет не изучали.
Цервикальная дистония (спастическая кривошея)
Средняя доза препарата Кунокс®, вводимая пациентам в 2 рандомизированных двойных слепых исследованиях, составляла 168 ЕД (диапазон 25–75 перцентилей составлял от 143 ЕД до 200 ЕД. пациенты получали до 300 ЕД). Дозу препарата Кунокс® распределяли между поражёнными мышцами.
Дозу препарата на начальных и последующих сеансах лечения следует подбирать индивидуально для каждого пациента в зависимости от положения головы и шеи пациента, локализации боли, мышечной гипертрофии, реакции пациента и наличия и профиля НЯ в анамнезе. Начальная доза для пациента, ранее не получавшего препарат Кунокс®, должна быть более низкой, а последующую дозу следует скорректировать согласно индивидуальному ответу. Ограничение общей дозы, вводимой в грудино- ключично-сосцевидную мышцу, до 100 ЕД или менее может уменьшить риск возникновения дисфагии. Для уменьшения риска развития дисфагии не рекомендуется двухстороннее введение препарата в грудино-ключично-сосцевидную мышцу. Рекомендуемое разведение составляет 200 ЕД/2 мл, 200 ЕД/4 мл, 100 ЕД/1 мл или 100 ЕД/2 мл 0,9 % раствором натрия хлорида для инъекций без консервантов, в зависимости от объёма и количества точек инъекций, необходимых для достижения целей терапии. Как правило, с помощью стерильной иглы (например, калибра 25–30 G) подходящей длины следует вводить не более 50 ЕД препарата в одну точку. Для определения поражённых мышц рекомендуется использовать электромиографию.
При лечении спастической кривошеи препарат вводят в грудино-ключично-сосцевидную мышцу на стороне, противоположной ротации.
В случаях, сопровождающихся подъёмом плеча, препарат должен быть введён дополнительно в трапециевидную мышцу и мышцу, поднимающую лопатку на стороне поражения.
При наклоне головы назад препарат вводят в ремённые и трапециевидные мышцы с обеих сторон.
При наклоне головы вперёд препарат вводят в грудино-ключично-сосцевидную мышцу с обеих сторон.
Последующие дозы препарата могут быть скорректированы в зависимости от результатов предыдущего лечения и наличия НЯ.
Клиническое улучшение обычно отмечается в течение первых двух недель после инъекции, а максимальная клиническая эффективность достигается примерно через 6 недель после инъекции. В двойном слепом плацебо-контролируемом исследовании большинство пациентов вернулось к исходному до лечения состоянию через 3 месяца после завершения лечения.
Безопасность и эффективность препарата Кунокс® для лечения спастической кривошеи у пациентов младше 20 лет и старше 75 лет не изучали.
Общие рекомендации для всех показаний к применению
При неэффективности первой процедуры, т.е. отсутствии значительного клинического улучшения по сравнению с исходным состоянием, через 1 месяц после введения препарата, необходимо:
- клиническое подтверждение действия токсина на инъецированную мышцу (мышцы), которое может включать ЭМГ исследование, выполняемое опытным специалистом в специализированном отделении;
- анализ причин неэффективности процедуры, например, неадекватный выбор точек для инъекции, недостаточная доза, неправильная техника инъекции, признаки фиксированной контрактуры, слабость мышц-антагонистов, формирование токсин нейтрализующих антител;
- повторная оценка целесообразности лечения ботулиническим токсином типа А;
- при отсутствии каких-либо НЯ, связанных с первым введением препарата, при повторной процедуре должны быть соблюдены следующие условия: коррекция дозы с учётом анализа причин неэффективности предыдущей процедуры; ЭМГ-контроль; интервал между процедурами должен составлять не менее 3-х месяцев.
При отсутствии эффекта от введения препарата или снижении его выраженности после повторных инъекций, следует рекомендовать другие методы лечения.
Особые группы пациентов
Применение у детей
Блефароспазм
Безопасность и эффективность препарата у детей моложе 18 лет не установлены.
Фокальная спастичность руки у взрослых пациентов, перенёсших инсульт
Безопасность и эффективность препарата у пациентов моложе 20 лет, включая пациентов детского возраста, не установлены.
Фокальная пластичность нижних конечностей у детей с ДЦП
Безопасность и эффективность препарата у детей младше 2 лет с динамической деформацией стопы по типу «конская стопа» вследствие ДЦП, находящихся на амбулаторном лечении, не установлены.
Межбровные морщины умеренной или тяжёлой степени выраженности
Безопасность и эффективность препарата у детей моложе 18 лет не установлены.
Боковые периорбитальные морщины умеренной или тяжёлой степени выраженности
Безопасность и эффективность препарата у пациентов моложе 20 лет не установлены.
Цервикальная дистония
Безопасность и эффективность препарата у пациентов моложе 20 лет, включая пациентов детского возраста, не установлены.
Применение у пожилых
Клинических данных, полученных у пожилых людей, недостаточно.
Применение при почечной и печёночной недостаточности
Данных нет.
Побочные эффекты
Поскольку КП проводятся в самых разных условиях, частоту нежелательных реакций (НЛР), наблюдаемую в КИ препарата, невозможно напрямую сравнить с частотой НЛР в КИ другого лекарственного средства. Кроме того, частота НЛР, отмеченная в КИ, может не отражать частоту, наблюдаемую в клинической практике.
Как правило, НЛР возникают в течение первой недели после инъекции препарата Кунокс®и, обычно, носят транзиторный характер, сохраняясь в течение нескольких месяцев или дольше. Локализованная боль, инфекция, воспаление, болезненность, отёк, эритема и/или кровотечение/кровоподтёки могут быть связаны с инъекцией. Симптомы, ассоциирующиеся с гриппоподобными симптомами (например, тошнота, лихорадка, миалгия), были зарегистрированы после введения другого зарегистрированного препарата ботулинического токсина. Боль и/или беспокойство, вызванные введением иглы, могут привести к вазовагальным реакциям (включая обморок, гипотензию), что может потребовать соответствующей лекарственной терапии.
Ожидаемым фармакологическим действием ботулинического токсина является локальное расслабление мышцы (мышц), в которую был введён препарат Кунокс®. Тем не менее, также может развиться и расслабление соседних мышц из-за распространения токсина (см. раздел Особые указания: Распространение эффекта токсина).
Блефароспазм
В рандомизированном, двойном слепом, с активным контролем КИ 3 фазы, всего 60 пациентов с блефароспазмом из Кореи в возрасте от 18 до 75 лет получали до 60 ЕД препарата Кунокс® или другой препарат ботулинического токсина. Доля пациентов, у которых развилось, по крайней мере, одно НЯ, составила 16,13 % в группе препарата Кунокс® и 27,59 % — в контрольной группе.
В общей сложности, 12 случаев расценивались как возможная НЛР. Частота развития НЛР составила 16,13 % в группе препарата Кунокс® и 24,14 % — в контрольной группе. Наиболее частыми НЛР были птоз век и ощущение инородного тела в глазах в группе препарата Кунокс®.
Фокальная спастичность руки у взрослых пациентов, перенёсших инсульт
Всего 196 пациентов из Кореи в возрасте 20 лет и старше были включены в двойное слепое, с активным контролем, КИ 3 фазы, которым ввели до 360 ЕД препарата Кунокс® или другого ботулинического токсина для лечения спастичности руки после инсульта. Доля пациентов, у которых выявлено, по крайней мере, одно НЯ. составила 39,80% в группе препарата Кунокс® и 41,84 % — в группе другого препарата ботулинического токсина.
НЛР, для которых связь с введением исследуемого препарата не могла быть исключена, развились у 4,08 % пациентов в группе препарата Кунокс® и у 8,16 % пациентов контрольной группы. Наиболее частой НЛР была гематома в месте инъекции в группе препарата Кунокс®.
Фокальная спастичность нижних конечностей у детей с ДЦП
Безопасность препарата Кунокс® для лечения эквиноварусной деформации стопы вследствие спастичности у детей с ДЦП оценивали в КИ 3 фазы, проведённом в Корее. Всего 119 пациентов в возрасте от 2 до 10 лет, включённых в двойное слепое, с активным контролем исследование, получали до 200 ЕД препарата Кунокс® или другого препарата ботулинического токсина. У 9 пациентов в группе препарата Кунокс® (15,00 %) и 9 пациентов в контрольной группе (15,25 %) отмечены НЯ.
В контрольной группе зарегистрирована одна НЛР, мышечная слабость; в группе препарата Кунокс® НЛР зарегистрировано не было.
Межбровные морщины умеренной или тяжёлой степени выраженности
В рандомизированное, двойное слепое, с активным контролем КИ 3 фазы, проведённое в России, было включено всего 136 пациентов в возрасте от 18 до 65 лет, которые получили 20 ЕД препарата Кунокс® или другого препарата ботулинического токсина для разглаживания межбровных морщин. Доля пациентов, у которых развилось, по крайней мере, одно НЯ, составила 27,94 % в группе препарата Кунокс® и 39,71 % — в контрольной группе.
Развитие НЛР, связь которых с введением исследуемого препарата не может быть исключена, отмечены у 7,35 % пациентов в группе препарата Кунокс® и у 19,12 % пациентов в контрольной группе.
Боковые периорбитальные морщины умеренной или тяжёлой степени выраженности (морщины в углах глаз)
В рандомизированном, двойном слепом, с активным контролем КИ 3 фазы всего 220 пациентов из Кореи в возрасте от 20 до 65 лет получали по 12 ЕД препарата Кунокс® или другого препарата ботулинического токсина на каждый глаз для разглаживания морщин в углах глаз. Частота НЯ составила 30,00% в группе препарата Кунокс® и 24,55 % — в контрольной группе.
У 3 пациентов из группы препарата Кунокс® и контрольной группы были отмечены НЛР. Цервикогенная головная боль, мигрень, затылочная невралгия, опущение век, фибромиалгия, мышечно-скелетная боль и миалгия были отмечены как НЛР в группе препарата Кунокс®.
Цервикальная дистония
В двух рандомизированных двойных слепых КИ 3 фазы 152 пациента из Кореи получали препарат Кунокс® для лечения цервикальной дистонии. Частота возникновения НЯ в группе препарата Кунокс® составила 31,58 %, а НЛР — 22,37 %.
Нежелательные лекарственные реакции
Частота НЛР представлена для каждого показания к применению препарата на основе опыта клинического применения, а также с учётом международного опыта применения препаратов ботулинического токсина типа А. Для описания частоты встречаемости приняты следующие критерии: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
Блефароспазм/гемифациальный спазм (для препаратов ботулинического токсина типа А оценка кумулятивной частоты и профиля НЛР в мировой практике проводилась совместно для показаний «блефароспазм» и «гемифациальный спазм»)
Класс системы органов | Предпочтительный термин | Частота |
Нарушения со стороны нервной системы | Головокружения, парез мимической мускулатуры, паралич мимической мускулатуры | Нечасто |
Нарушения со стороны органа зрения | Блефароптоз Точечный кератит, лагофтальм, сухость в глазах, фотофобия и повышенное слезоотделение, раздражение глаз Кератит, эктропион (выворот века), диплопия, энтропион (заворот века), ухудшение и снижение остроты зрения
Отёк века
Язвенный кератит, дефект эпителия роговицы, перфорация роговицы | Очень часто
Часто
Нечасто
Редко
Очень редко |
Нарушения со стороны кожи и подкожных тканей | Экхимозы Сыпь/дерматит | Часто Нечасто |
Общие расстройства и нарушения в месте введения | Раздражение и отёк кожи лица Утомляемость | Часто Нечасто |
Фокальная спастичность руки у взрослых пациентов, перенёсших инсульт
Класс системы органов | Предпочтительный термин | Частота |
Нарушения психики | Депрессия и бессонница | Нечасто |
Нарушения со стороны нервной системы | Гипертонус Гипестезии, головная боль, парестезии, дискоординация и амнезия | Часто Нечасто |
Нарушения со стороны органа слуха и лабиринтные нарушения | Головокружения | Нечасто |
Нарушения со стороны сосудов | Ортостатическая гипотензия | Нечасто |
Нарушения со стороны желудочно-кишечного тракта | Тошнота и парестезии в области рта | Нечасто |
Нарушения со стороны кожи и подкожных тканей | Экхимозы и пурпура Дерматит, кожный зуд, сыпь | Часто Нечасто |
Нарушения со стороны скелетно-мышечной и соединительной ткани | Боли в конечностях и мышечная слабость Артралгия, бурсит | Часто Нечасто |
Общие расстройства и нарушения в месте введения | Боль в месте инъекции, лихорадка, гриппоподобный синдром, кровоизлияние в месте инъекции и раздражение кожи в месте инъекции Астения, боли, повышенная чувствительность в месте инъекции, общее недомогание и периферические отеки | Часто Нечасто |
Фокальная спастичность нижних конечностей у детей с ДЦП
Класс системы органов | Предпочтительный термин | Частота |
Инфекционные и паразитарные заболевания | Вирусные инфекции и инфекционный отит | Очень часто |
Нарушения со стороны нервной системы | Сомноленция, нарушения походки и парестезии | Часто |
Нарушения со стороны кожи и подкожных тканей | Сыпь | Часто |
Нарушения со стороны скелетно-мышечной и соединительной ткани | Миалгия, мышечная слабость и боли в конечностях | Часто |
Нарушения со стороны почек и мочевыводящих путей | Недержание мочи при напряжении | Часто |
Травмы, интоксикации и осложнения манипуляций | Падения | Часто |
Общие расстройства и нарушения в месте введения | Недомогание, боль в месте инъекции и астения | Часто |
Межбровные морщины умеренной или тяжёлой степени выраженности
Класс системы органов | Предпочтительный термин | Частота |
Инфекционные и паразитарные заболевания | Инфекции | Нечасто |
Нарушения психики | Тревожность | Нечасто |
Нарушения со стороны нервной системы | Головная боль, парестезии Головокружение | Часто Нечасто |
Нарушения со стороны органа зрения | Блефароптоз Блефариты, боль в глазах, нарушения зрения (включая снижение его остроты) | Часто Нечасто |
Нарушения со стороны желудочно-кишечного тракта | Тошнота Сухость во рту | Часто Нечасто |
Нарушения со стороны кожи и подкожных тканей | Эритема, ощущение стянутости кожи Отёчность (лица, век, периорбитальной области), фотосенситизация,зуд,сухость кожи | Часто Нечасто |
Нарушения со стороны скелетно-мышечной и соединительной ткани | Локальная мышечная слабость Мышечные подергивания | Часто Нечасто |
Общие расстройства и нарушения в месте введения | Боль в области лица, отёк места инъекции, боль/жжение в месте инъекции Гриппоподобный синдром, астения, лихорадка | Часто Нечасто |
Боковые периорбитальные морщины умеренной или тяжёлой степени выраженности
Класс системы органов | Предпочтительный термин | Частота |
Инфекционные и паразитарные заболевания | Гриппоподобный синдром | Часто |
Нарушения со стороны нервной системы | Головная боль | Часто |
Нарушения со стороны органа зрения | Опущение латеральной части верхнего века, отёк века | Часто |
Общие расстройства и нарушения в месте введения | Геморрагии и гематомы в месте инъекции* Боль в месте инъекции*, парестезии в области инъекции | Часто Нечасто |
* Реакции, связанные с процедурой инъекции
Цервикальная дистония (спастическая кривошея)
Класс системы органов | Предпочтительный термин | Частота |
Инфекционные и паразитарные заболевания | Ринит и инфекции верхних дыхательных путей | Часто |
Нарушения со стороны нервной системы | Головокружение, гипертонус, гипестезия, сомноленция и головная боль | Часто |
Нарушения со стороны органа зрения | Диплопия и птоз | Нечасто |
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Одышка и дисфония | Нечасто |
Нарушения со стороны желудочно-кишечного тракта | Дисфагия Сухость во рту и тошнота | Очень часто Нечасто |
Нарушения со стороны скелетно-мышечной и соединительной ткани | Мышечная слабость Скованность и болезненность движений | Очень часто Часто |
Общие расстройства и нарушения в месте введения | Боль Астения, гриппоподобный синдром, общее недомогание Лихорадка | Очень часто Часто Нечасто |
Иммуногенность
Как и у всех препаратов белковой природы, существует вероятность развития иммуногенности. Выявление продукции антител в значительной степени зависит от чувствительности и специфичности метода. Кроме того, на частоту положительного результата анализа на антитела (включая нейтрализующие антитела) могут влиять несколько факторов, включая процедуру аналитической методики, обработку образцов, сроки сбора образцов, одновременно принимаемые пациентом препараты и основное заболевание пациента. По этим причинам сравнение частоты продукции антител к препарату Кунокс® в исследованиях, описанных выше, с частотой антител в других исследованиях или к другим препаратам может привести к неверным выводам. Применение препаратов ботулинического токсина может привести к образованию нейтрализующих антител, которые могут снизить эффективность последующих введений препарата за счёт ингибирования биологической активности токсина.
В КИ блефароспазма тест на антитела проводили в начале исследования и во время последнего визита пациентов, которые получали препарат Кунокс® или другой препарат ботулинического токсина. Во время скрининга образцы крови забирали у всех 60 пациентов перед началом этого исследования, и, за исключением 2 выбывших пациентов, тест на антитела был выполнен 58 пациентам в конце исследования. Результаты анализа на иммуногенность были отрицательными у всех пациентов, как во время исходной оценки, так и во время визита завершения исследования.
Во время лечения фокальной спастичности нижних конечностей у 119 детей с ДЦП был проведён тест на наличие антитела. Тест выполняли дважды: во время исходного визита (до введения препарата) и во время визита завершения исследования. Результаты теста на антитела были отрицательными у всех пациентов, получавших препарат Кунокс® или другой препарат ботулинического токсина.
В исследовании разглаживания межбровных морщин, проведённом в Корее, на фоне терапии препаратом Кунокс® или другим препаратом ботулинического токсина, тест на иммуногенность был выполнен у 100 пациентов. Тест проводили дважды: во время визита исходной оценки и во время визита завершения исследования. На момент исходной оценки результаты теста у 100 пациентов были отрицательными, и результаты теста у 98 пациентов (за исключением 2 выбывших пациентов) во время визита завершения исследования (Визит 5) также были отрицательными.
Ключевые факторы продукции нейтрализующих антител ещё не до конца изучены. Результаты некоторых исследований показывают, что инъекции ботулинического токсина с более частыми интервалами или в более высоких дозах могут привести к повышению частоты образования антител. Вероятность продукции антител может быть сведена до минимума путём введения препарата в наименьшей эффективной дозе через максимально продолжительные интервалы между инъекциями.
Дополнительная информация
Данные, полученные в пострегистрационном периоде
Блефароспазм
В Корее в течение 6 лет проводили мониторинг пострегистрационного применения препарата, в который был включён 641 пациент с доброкачественным эссенциальным блефароспазмом. Частота НЯ составила 12,5 % (80 из 641; 116 случаев), из них в 7,8 % (50 из 641; 57 случаев) случаев невозможно было исключить причинно-следственную связь с применением препарата. Птоз был зарегистрирован в 3,9 % (25 случаев, 25 из 641 пациента) случаев. Другими НЛР, связанными с применением исследуемого препарата и отмечавшимися у <1 % пациентов, являлись: отёк лица (6 случаев), патологические изменения глаза (4 случая), кожные высыпания (3 случая), зуд, парестезия, опущение век, патологическая секреция слезы, боль в глазах (2 случая), патологическое изменение роговицы, диплопия, аритмия, отёк глаз, паралич глазодвигательного нерва, головная боль, паралич, головокружение и пурпура (1 случай). Серьёзные НЯ отмечали у 3 из 641 пациента (0,5 %, 5 случаев): стеноз спинномозгового канала (2 случая), боли в нижних конечностях (1 случай), инфаркт миокарда (1 случай) и аритмия (1 случай).
Непредвиденные НЛР были зарегистрированы у 11 из 641 пациента (1,7 %), однако непредвиденные серьёзные НЛР среди них отсутствовали. Были зарегистрированы следующие непредвиденные несерьёзные НЛР: отёк лица (6 случаев), патологические изменения глаза (2 случая), головная боль, парестезия, головокружение (по 1 случаю).
Фокальная спастичность руки у взрослых пациентов, перенёсших инсульт
В течение 4 лет в Корее проводилось пострегистрационное исследование 607 пациентов с фокальной спастичностью верхних конечностей. Частота НЯ составила 6,26 % (38/607; 62 случая), из которых в 1,81 % (11/607; 12 случаев) причинно-следственная связь с применением препарата не могла быть исключена. Частыми НЛР были боль в месте инъекции 0,82 % (5/607; 5 случаев), кашель, сыпь в месте инъекции 0,33 % (2/607; 2 случая), судорожный припадок, миалгия и мышечно-скелетная боль 0,16 % (1/607; по одному случаю каждой НЛР). Частота серьёзных НЯ составила 0,66 % (4/607; 5 случаев): астения, аспирационная пневмония, кровохарканье, холангит, ишемический инсульт 0,16 % (1/607; 1 случай). Серьёзных НЛР не зарегистрировано.
Частота непредвиденных НЯ составила 5,11 % (31/607; 41 случай): респираторная инфекция 0,99 % (6/607; 7 случаев), боль в месте инъекции 0,82 % (5/607; 5 случаев), аспирационная пневмония 0,49 % (3/607; 3 случая), сыпь в месте инъекции, зуд 0,33 % (2/607; 2 случая), грибковое поражение ног, цистит, инфекция мочевыводящих путей, гастроэзофагеальная рефлюксная болезнь, гингивит, судорожный припадок, нарушение движения глаз, астения, боль в конечностях, воспаление наружного уха, алопеция, кровохарканье, нарушение дыхания, мышечно-скелетная боль, расстройство сна, депрессия, сонливость, холангит, гипокалиемия, снижение аппетита, ишемический инсульт, ссадины кожи 0,16 % (1/607; по одному случаю каждого НЯ). Частота возникновения НЛР составила 1,65 % (10/607; И случаев): боль в месте инъекции 0.82% (5/607; 5 случаев), кашель, сыпь в месте инъекции 0,33 % (2/607; по 2 случая каждой НЛР), судорожный припадок, мышечно-скелетная боль 0,16 % (1/607; по одному случаю каждой НЛР).
Частота серьёзных непредвиденных НЯ составила 0,66 % (4/607; 5 случаев). Зарегистрированы астения, аспирационная пневмония, кровохарканье, холангит и ишемический инсульт 0,16 % (1/607; по одному случаю каждого вида). Не отмечено случаев подозреваемых непредвиденных серьёзных НЛР.
Данные по безопасности пострегистрационного наблюдения за применением препарата Кунокс®", включая спонтанные сообщения о случаях НЯ. сравнивали с данными по безопасности других препаратов ботулинического токсина типа А, зарегистрированных в Корее. Новых НЯ зарегистрировано не было.
Фокальная спастичность нижних конечностей у детей с ДЦП
В рамках пострегистрационного наблюдательного исследования препарата Кунокс®, проведённого в Корее у 210 детей с фокальной спастичностью и эквино-варусной деформацией стопы вследствие ДЦП. частота НЯ составила 21,4 % (45 из 210; 84 случая). Из них частота НЛР, для которых невозможно было исключить причинно-следственную связь, составила 1,4 % (3 из 210 пациентов; 3 случая): частота воспаления в месте инъекции — 1 % (2 случая) и миалгии — <1% (1 случай). Серьёзные НЯ отмечали у 1,4 % (3 из 210 пациентов; 3 случая) пациентов: 2 случая пневмонии и 1 случай инфекции мочевыводящих путей. При этом, непредвиденных серьёзных НЯ зарегистрировано не было.
Межбровные морщины умеренной или тяжёлой степени выраженности
В течение 4 лет в Корее проводили пострегистрационное наблюдение за 812 пациентами с межбровными морщинами умеренной или тяжёлой степени выраженности. Частота НЯ составила 1,6 % (13/812; 14 случаев), при этом в 0,49 % (4/812; 5 случаев) случаев невозможно исключить причинно-следственную связь явления с введением препарата. Головная боль 0,25 % (2/81; 2 случая), боль в глазах, зуд в месте инъекции и сыпь в месте инъекции 0,12 % (1/812; по одному случаю каждой НЛР) были отмечены как НЛР. Не зарегистрировано серьёзных НЯ или серьёзных НЛР.
Частота непредвиденных НЯ составила 0,74 % (6/812; 6 случаев): псориаз, опоясывающий лишай, респираторная инфекция, сыпь в месте инъекции, флебит, язвенная болезнь 0,12 % (1/812; 1 случай). Частота НЛР составила 0,12 % (1/812; 1 случай): сыпь в месте инъекции 0,12 % (1/812; 1 случай). Не зарегистрировано серьёзных непредвиденных НЯ или подозреваемых непредвиденных серьёзных НЛР.
Данные по безопасности пострегистрационного наблюдения за применением препарата Кунокс®, включая спонтанные сообщения о случаях НЯ. сравнивали с данными по безопасности других препаратов ботулинического токсина типа А. зарегистрированных в Корее. Новых НЯ зарегистрировано не было.
Данные, полученные для других препаратов ботулинического токсина типа А
Последующий перечень включает НЛР и прочие медицинские НЯ, сообщения о которых были получены в пострегистрационный период, независимо от показаний к применению, и которые, возможно, не были перечислены выше.
Нарушения со стороны иммунной системы:
Анафилактический шок, отёк Квинке, сывороточная болезнь и крапивница.
Нарушения со стороны обмена веществ и питания:
Анорексия.
Нарушения со стороны нервной системы:
Плексопатия плечевого сплетения, дисфония, дизартрия, парез лица, гипестезия, мышечная слабость, миастения гравис, периферическая нейропатия, парестезии, радикулопатия, судороги, обмороки и паралич лица.
Нарушения со стороны органа зрения:
Закрытоугольная глаукома (при лечении блефароспазма), страбизм, ослабление чёткости и другие нарушения зрения, сухость глаз (ассоциированная с периорбитальными инъекциями), отёк век.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Тугоухость, шум в ушах и головокружение.
Нарушения со стороны сердца:
Аритмия, инфаркт миокарда.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Аспирационная пневмония (в некоторых случаях с летальным исходом), диспноэ, бронхоспазм, угнетение дыхания и дыхательная недостаточность.
Нарушения со стороны желудочно-кишечного тракта:
Боль в животе, диарея, запор, сухость во рту, дисфагия, тошнота и рвота.
Нарушения со стороны кожи и подкожных тканей:
Алопеция, псориазоформный дерматит, многоформная эритема, гипергидроз, мадароз, зуд и сыпь.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Мышечная атрофия, миалгия, локальные мышечные подергивания/тики.
Общие расстройства и нарушения в месте введения:
Атрофия вследствие денервации, недомогание и лихорадка.
Передозировка
Можно ожидать, что чрезмерные дозы препарата Кунокс® для инъекций вызывают выраженную мышечную слабость и другие различные симптомы.
Симптомы передозировки могут развиваться не сразу после инъекции. В случае непреднамеренной передозировки или перорального приёма пациент должен находиться под наблюдением в течение нескольких недель для выявления клинических проявлений мышечной слабости, которая может быть локальной или распространённой по отношению к месту инъекции (с.м. раздел Особые указания: Распространение эффекта токсина, Повышенный риск клинически значимых эффектов при уже существующих нарушениях со стороны нервно-мышечной системы). Таким пациентам необходимо назначить дополнительное медицинское обследование и немедленно начать соответствующее лечение, а при необходимости — госпитализировать.
При поражении мускулатуры ротоглотки и пищевода возможна аспирация, которая может приводить к развитию аспирационной пневмонии. В случае развития паралича дыхательных мышц или их значительной слабости могут потребоваться интубация трахеи и искусственная вентиляция лёгких до восстановления функции данных мышц. В качестве поддерживающей терапии могут выполняться трахеостомия и/или длительная искусственная вентиляция лёгких, а также прочие общие поддерживающие мероприятия.
В случае передозировки возможно применение противоботулинической сыворотки. Однако введение сыворотки не способно купировать уже развившиеся к моменту её введения клинические эффекты ботулинического токсина.
Взаимодействие
Исследований лекарственного взаимодействия препарата Кунокс® для инъекций не проводили.
Аминогликозиды и другие препараты, влияющие на нервно-мышечную передачу
Следует с осторожностью одновременно вводить препарат Кунокс® и аминогликозиды или другие препараты, влияющие на нервно-мышечную передачу (например, курареподобные препараты), в связи с возможным усилением действия токсина.
Антихолинергические средства
Применение антихолинергических препаратов после введения препарата Кунокс® может усиливать системные антихолинергические эффекты.
Другие препараты ботулинического токсина
Эффект от введения различных препаратов ботулинического нейротоксина одновременно или с интервалом в несколько месяцев неизвестен. Выраженная мышечная слабость может развиваться за счёт введения другого препарата ботулинического токсина до исчезновения эффектов ранее введённого ботулинического токсина.
Миорелаксанты
Мышечная слабость может также усиливаться при применении миорелаксанта до или после введения препарата Кунокс®.
Особые указания
Отсутствие взаимозаменяемости между препаратами ботулинического токсина
Единицы активности препарата Кунокс® являются специфичными для используемого метода приготовления и анализа. Они не взаимозаменяемы с другими препаратами ботулинического токсина, и поэтому единицы биологической активности препарата Кунокс® нельзя сравнивать или конвертировать в единицы активности любых других препаратов ботулинического токсина, оцениваемых любым другим специфическим методом анализа.
Распространение эффекта токсина
Пострегистрационные данные о безопасности других зарегистрированных препаратов ботулинического токсина позволяют предположить, что в некоторых случаях эффекты ботулинического токсина могут наблюдаться за пределами места введения препарата. Симптомы согласуются с механизмом действия ботулинического токсина, и могут включать астению, генерализованную мышечную слабость, диплопию, птоз, дисфагию, дисфонию, дизартрию, недержание мочи и затруднённое дыхание. Эти симптомы регистрировали через несколько часов или педель после инъекции. Трудности с глотанием и дыханием могут угрожать жизни, и получены сообщения о летальных случаях, ассоциированных с распространением токсичных эффектов. Риск развития симптомов, вероятно, является самым большим у детей, получавших препарат для лечения фокальной спастичности, но симптомы могут также возникать у взрослых, которые получали препарат для лечения фокальной спастичности и других нарушений, и особенно у тех пациентов, у которых основное заболевание предрасполагает к развитию этих симптомов. При применении препарата по неодобренным показаниям, включая фокальную спастичность верхних конечностей у детей, а также — по зарегистрированным показаниям, были отмечены симптомы, соответствующие распространению эффекта токсина, при введении препарата в дозах, сопоставимых или меньших, чем дозы, рекомендуемые для лечения цервикальной дистонии и фокальной спастичности. Пациентам или лицам, осуществляющим уход за ними, следует рекомендовать немедленно обратиться за медицинской помощью в случае возникновения нарушений глотания, речи или дыхания.
Серьёзные НЛР при использовании по незарегистрированным показаниям
Серьёзные НЛР. в том числе, чрезмерная слабость, дисфагия и аспирационная пневмония, а также некоторые НЛР, ассоциированные с летальными исходами, были отмечены у пациентов, которые получали другие зарегистрированные препараты ботулинического токсина по неодобренным показаниям. В этих случаях НЛР не обязательно были связаны с отдалённым распространением токсина, но могли возникать в результате действия ботулинического токсина в месте инъекции и/или прилегающих тканей. В некоторых случаях у пациентов ранее наблюдались дисфагия или другие значимые нарушения здоровья. Для выявления факторов, способствующих увеличению риска развития НЛР на фоне применения препарата Кунокс® по неодобренным показаниям, недостаточно информации. Безопасность и эффективность препарата Кунокс® для применения по незарегистрированным показаниям не установлены.
Реакции гиперчувствителъности
Получены сообщения о серьёзных реакциях и/или реакциях гиперчувствительности немедленного типа при введении других зарегистрированных препаратов ботулинического токсина. Эти реакции включали анафилаксию, сывороточную болезнь, крапивницу, отёк мягких тканей и одышку. При возникновении таких реакций дальнейшее введение препарата Кунокс® должно быть прекращено с незамедлительным проведением надлежащего лечения. Один случай летальной анафилаксии был зарегистрирован при введении другого зарегистрированного препарата ботулинического токсина, который был разведён лидокаином. Таким образом, невозможно обоснованно установить являющийся причиной препарат.
Сердечно-сосудистая система
После применения препарата Кунокс® получены сообщения о развитии НЯ со стороны сердечно-сосудистой системы, включая аритмию, инфаркт миокарда и гипертонию. У некоторых из этих пациентов выявлены факторы риска, в том числе, уже существовавшие сердечно-сосудистые заболевания. Следует с осторожностью назначать препарат пациентам с уже существующими сердечно-сосудистыми заболеваниями.
Повышенный риск клинически значимых эффектов при уже существующих нарушениях со стороны нервно-мышечной системы
Необходимо осуществлять наблюдение за пациентами с периферическими двигательными нейропатическими заболеваниями, боковым амиотрофическим склерозом или нарушением нервно-мышечной передачи (например, с тяжёлой миастенией или синдромом Ламберта-Итона) при введении ботулинического токсина. Пациенты с диагностированным или неустановленным нервно-мышечным заболеванием или нарушением нервно-мышечной передачи могут иметь повышенный риск развития клинически выраженных системных эффектов, включая общую мышечную слабость, диплопию, птоз, дисфонию, дизартрию, тяжёлую дисфагию и дыхательную недостаточность в результате введения препарата Кунокс® в терапевтических дозах (см. раздел Особые указания: Распространение эффекта токсина).
Дисфагия и нарушения дыхания
Применение препарата Кунокс® и других препаратов ботулинического токсина может привести к нарушению глотания или дыхания. Пациенты с уже существующими нарушениями глотания или дыхания могут быть более чувствительны к этим осложнениям. В большинстве случаев это является следствием расслабления мышц в области инъекции, которые участвуют в дыхании, или ротоглоточных мышц, которые контролируют глотание или дыхание (см. раздел Особые указания: Распространение эффекта токсина).
Получены сообщения о летальных случаях как осложнениях тяжёлой дисфагии, развившейся после введения другого препарата ботулинического токсина. Дисфагия может сохраняться в течение нескольких месяцев, и необходимо кормить пациента через назогастральный зонд для поддержания адекватного питания и гидратации. Аспирация может быть результатом тяжёлой дисфагии и представляет особый риск при лечении пациентов, у которых уже нарушены глотание или дыхательная функция.
Применение препаратов ботулинического токсина может ослабить мышцы шеи, которые служат вспомогательными мышцами дыхания. Это может привести к значительному снижению дыхательной способности у пациентов с дыхательной недостаточностью, которые могут стать зависимыми от этих вспомогательных мышц. Получены пострегистрационные сообщения о серьёзных нарушениях дыхания, включая дыхательную недостаточность, после введения другого одобренного препарата ботулинического токсина.
Сообщалось, что у пациентов с меньшей массой мышц шеи и у пациентов, которые получают двусторонние инъекции в грудино-ключично-сосцевидную мышцу для лечения цервикальной дистонии, имеется более высокий риск развития дисфагии. Ограничение вводимой дозы в грудино-ключично-сосцевидную мышцу может уменьшить вероятность развития дисфагии. Инъекции в мышцу, поднимающую лопатку, могут способствовать повышению риска развития инфекции верхних дыхательных путей и дисфагии.
Пациентам, получающим лечение ботулиническим токсином, может потребоваться немедленная медицинская помощь в случае возникновения нарушений глотания, речи или дыхания. Эти реакции могут возникнуть в течение нескольких часов или недель после инъекции ботулинического токсина (см. раздел Особые указания: Распространение эффекта токсина).
Эффекты препарата ботулинического токсина со стороны лёгких у пациентов с нарушением дыхания, получающих препарат по поводу фокальной спастичности
Необходимо тщательно контролировать состояние пациентов с дыхательной недостаточностью, получающих препараты ботулинического токсина по поводу фокальной спастичности.
Уже существующие нарушения в месте инъекции
Следует соблюдать осторожность при применении препарата Кунокс® при наличии воспаления в предполагаемом(ых) месте(ах) инъекции, птозе или при наличии выраженной слабости или атрофии в мышцах-мишенях.
Попадание препарата на роговицу у пациентов, получавших другой препарат ботулинического токсина по поводу блефароспазма
Попадание препарата на роговицу отмечали после инъекции другого препарата ботулинического токсина в круговую мышцу глаза. Это также может привести к стойкому дефекту эпителия и изъязвлению роговицы, особенно у пациентов с нарушениями функции лицевого нерва.
Необходима интенсивная терапия всех дефектов эпителия роговицы, например, применение защитных глазных капель, мазей, лечебных мягких контактных линз или глазной повязки либо других соответствующих способов.
Бронхит и инфекции верхних дыхательных путей у пациентов, получавших препарат по поводу фокальной спастичности
Бронхит регистрировали как НЛР более часто у пациентов, получавших препарат по поводу фокальной спастичности верхней конечности, по сравнению с плацебо. У пациентов со снижением функции лёгких, получающих терапию другим зарегистрированным препаратом ботулинического токсина по поводу фокальной спастичности верхней конечности, инфекции верхних дыхательных путей как НЛР также регистрировали чаще, чем у пациентов, получавших плацебо.
Офтальмологические НЛР у пациентов, получавших ботулинический токсин
Получены сообщения о случаях развития сухости глаз, раздражения глаз, фотофобии или нарушений зрения, ассоциированных с введением других зарегистрированных препаратов ботулинического токсина в круговую мышцу глаза или рядом с ней. Если эти офтальмологические признаки и симптомы сохраняются, следует направить пациента на консультацию к офтальмологу (см. раздел Особые указания: Попадание препарата на роговицу у пациентов, получавших другой препарат ботулинического токсина по поводу блефароспазма).
Альбумин человека и передача вирусных заболеваний
Препарат Кунокс® содержит альбумин, вещество, входящее в состав крови человека. Учитывая эффективные процедуры скрининга доноров и производства препарата, существует крайне малый риск передачи вирусных заболеваний и развития атипичного варианта болезни Крейтцфельда-Якоба (vCJD). Существует теоретический риск передачи болезни Крейтцфельда-Якоба (CJD), но даже в этом случае риск передачи также будет считаться крайне маловероятным. Случаев передачи вирусных заболеваний, CJD или vCJD не отмечали при введении зарегистрированного препарата альбумина или альбумина, содержащегося в других зарегистрированных препаратах.
Блефароспазм
Редкое моргание, связанное с введением ботулинического токсина в круговую мышцу глаза, может приводить к оголению роговицы, устойчивому эпителиальному дефекту и к изъязвлению роговицы, особенно у пациентов с нарушениями со стороны VII пары черепно-мозговых нервов. Следует тщательно изучить чувствительность роговицы глаз, которые были ранее оперированы, избегать введения препарата в область нижнего века для профилактики развития выворота века, а также активно лечить любые дефекты эпителиального покрова. Для этого могут применяться капли с защитными свойствами, мази, терапевтические мягкие контактные линзы, закрытие глаза повязкой или другие способы (см. раздел Особые указания: Попадание препарата на роговицу у пациентов, получавших другой препарат ботулинического токсина по поводу блефароспазма).
В мягких тканях век легко возникают экхимозы. Данное явление можно минимизировать, применяя лёгкое давление на место инъекции сразу после введения препарата.
Вследствие антихолинергической активности ботулинического токсина следует соблюдать осторожность при лечении пациентов с риском развития закрытоугольной глаукомы, включая пациентов с анатомическим сужением угла глаза.
Фокальная спастичность
Препарат Кунокс®, применяемый для лечения фокальной спастичности, изучали только в рамках стандартных схем лечения при этих заболеваниях. Поэтому он не предназначен в качестве замены данных методов лечения.
Маловероятно, что Кунокс® будет способствовать увеличению объёма движения в суставах со стойкой контрактурой.
Препарат Кунокс® должен применяться для лечения фокальной спастичности у взрослых пациентов, перенёсших инсульт, только в случае, если ожидается, что снижение мышечного тонуса приведёт к улучшению функции (например, улучшению походки), уменьшению симптоматики (например, уменьшению мышечного спазма или боли) или к облегчению ухода за пациентом. Кроме того, функциональные улучшения могут быть ограничены, если лечение препаратом Кунокс® начинается позже, чем через 2 года после инсульта или у пациентов с наименее тяжёлой спастичностью (балл по модифицированной шкале Ашворт <3).
Как и при любом методе лечения, дающем ранее обездвиженным пациентам вернуться к физической активности, пациента следует предупредить о важности восстанавливать активность постепенно.
Получены редкие спонтанные сообщения о смерти, иногда связанной с аспирационной пневмонией, а также отчёты о возможном системном распространении токсина у детей с сопутствующими заболеваниями, в первую очередь церебральным параличом, на фоне лечения другими препаратами ботулинического токсина А.
Необходимо с осторожностью подходить к лечению детей с выраженной неврологической инвалидностью, дисфагией или имеющих в недавнем анамнезе аспирационную пневмонию или заболевание лёгких. Пациентам с неудовлетворительным состоянием здоровья следует назначать лечение только в том случае, если предполагаемая польза для конкретного пациента превышает потенциальный риск.
Морщины верхней трети лица
Редкое моргание, связанное с введением препарата Кунокс® в круговую мышцу глаза, может приводить к оголению роговицы, устойчивому эпителиальному дефекту и к изъязвлению роговицы, особенно у пациентов с нарушениями со стороны VII пары черепно-мозговых нервов. Препарат Кунокс® необходимо с осторожностью применять при выраженной асимметрии лица, при птозе, дерматохалазисе, глубоких рубцах, у пациентов с плотной кожей или при отсутствии значительного сглаживания мимических морщин при механическом растяжении кожи.
Цервикальная дистония (спастическая кривошея)
Пациенты со спастической кривошеей должны быть проинформированы о возможности развития дисфагии различной степени выраженности: от лёгкой до тяжёлой. Дисфагия может сохраняться от 2 до 3 недель после введения препарата; было сообщено о случае сохранения дисфагии до 5 месяцев. Дисфагия может являться потенциальной причиной аспирации, диспноэ, требующих интубации. В редких случаях возможно развитие аспирационной пневмонии с летальным исходом.
Риск развития дисфагии может быть снижен при сокращении дозы препарата, вводимой в грудино-ключично-сосцевидную мышцу до 100 ЕД и ниже. Показано, что группу повышенного риска развития дисфагии составляют пациенты со сниженной массой мышц шеи, а также пациенты, которым препарат вводится в грудино-ключично-сосцевидные мышцы с обеих сторон. Развитие дисфагии объясняют проникновением токсина в мышечный слой стенки пищевода. Введение препарата в мышцу, поднимающую лопатку, может способствовать повышению риска развития инфекционных заболеваний верхних дыхательных путей и дисфагии.
Дисфагия может быть одной из причин ограничения поступления в организм пищи и воды, что приводит к потере массы тела и дегидратации. Пациенты с субклинической дисфагией могут иметь повышенный риск развития дисфагии более тяжёлой степени после инъекции препарата Кунокс® .
Инструкция по утилизации неиспользованного препарата
Сразу же после проведения инъекций раствор препарата, оставшийся во флаконе или шприце, должен быть инактивирован раствором гипохлорита натрия (0,5 %). В качестве альтернативы, содержимое неиспользованных флаконов следует восстановить небольшим количеством воды, а затем автоклавировать. Все вспомогательные материалы, находившиеся в контакте с препаратом, должны быть утилизированы в соответствии с правилами уничтожения биологических отходов. Пролитый раствор препарата следует вытереть адсорбирующей салфеткой, пропитанной 1 % раствором гипохлорита натрия.
Влияние на способность управлять транспортными средствами или работать с механизмами
После введения препарата Кунокс® может развиться упадок сил, мышечная слабость, помутнение зрения, головокружение или опущения век. В случае появления вышеуказанных симптомов пациентам необходимо избегать управлять автомобилем или заниматься потенциально опасными видами деятельности.
Форма выпуска
Лиофилизат для приготовления раствора для внутримышечного введения, 50 ЕД, 100 ЕД, 200 ЕД.
Хранение
Хранить при температуре от 2 до 8 °C.
Восстановленный раствор хранить при температуре от 2 до 8 °C не более 24 ч.
Срок годности
2 года.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Кунокс:
