Диспорт®
Dysport®Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для инъекций
Состав
| Действующее вещество: | Один флакон содержит |
| 125 ЕД* | |
| Вспомогательные вещества: |
|
| 125 мкг | |
| Лактозы моногидрат | 2,5 мг |
| * ЕД единица активности фирмы. |
|
Описание
Порошок белого цвета без посторонних включений.
Описание восстановленного раствора: прозрачный, бесцветный раствор, без посторонних включений.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Комплекс токсин Clostridium botulinum тип А — гемагглютинин блокирует высвобождение ацетилхолина из пресинаптического нервного окончания, нарушая, таким образом, периферическую холинергическую передачу в нервно-мышечном синапсе. Токсин обладает антагонистическим действием по отношению к процессам, приводящим к высвобождению нейромедиатора, триггером которых является ион Са2+. Это не влияет на постганглионарную холинергическую передачу или постганглионарную симпатическую передачу.
Действие токсина включает первоначальный этап, при котором токсин быстро и интенсивно связывается с мембраной пресинаптического окончания. Вторым является этап интернализации, в ходе которого токсин пересекает пресинаптическую мембрану, не вызывая развитие паралича. Наконец, токсин ингибирует высвобождение ацетилхолина, нарушая механизм Ca2+ опосредованного высвобождения ацетилхолина, тем самым уменьшая потенциал концевой пластинки и вызывая паралич.
Восстановление передачи нервного импульса происходит постепенно по мере образования новых нервных окончаний и восстановления контактов с постсинаптической моторной концевой пластинкой (процесса, который занимает 6–8 недель у экспериментальных животных).
Показания
Препарат Диспорт® показан взрослым пациентам для лечения следующих расстройств:
- блефароспазм;
- гипергидроз подмышечной области;
- временное улучшение внешнего вида гиперкинетических складок (мимических морщин) лица от умеренной до выраженной степени у взрослых пациентов моложе 65 лет, когда выраженность этих морщин оказывает серьёзное психологическое влияние на пациента.
Противопоказания
Диспорт® противопоказан пациентам с повышенной чувствительностью к любому из компонентов препарата.
Детский возраст до 18 лет.
С осторожностью
При нарушениях функций глотания и дыхания; заболеваниях, ведущих к нарушению нервно-мышечной передачи, трудностям глотания или дыхания; субклинических или клинических проявлениях нарушения нервно-мышечной передачи (таких как миастения гравис); хронических респираторных заболеваниях; при введении препарата в случае, когда мышцы-мишени выказывают избыточную слабость или атрофию; при применении препаратов, влияющих напрямую, либо опосредованно, на нервно-мышечную передачу (таких как, аминогликозиды, курареподобные недеполяризующие блокаторы, миорелаксанты); пожилой возраст.
С особой осторожностью следует повторно вводить препарат пациентам, у которых отмечены аллергические реакции на предыдущую инъекцию препарата; у пациентов с замедленным временем свёртываемости крови и при воспалении/инфекции в предполагаемом месте введения.
Применение при беременности и в период грудного вскармливания
Есть ограниченные данные по применению ботулинического токсина типа А — гемагглютинина комплекса у беременных женщин. Исследования на животных не выявили какой-либо прямой или косвенный неблагоприятный эффект относительно беременности, эмбрио-фетального развития, родоразрешения или постнаталтного развития, за исключением высоких доз, вызывающих материнскую токсичность.
Диспорт® может быть использован во время беременности только, если ожидаемая польза от лечения превышает возможный риск для плода. Поэтому должна соблюдаться особая осторожность при применении препарата у беременных.
Неизвестно экскретируется ли токсин Clostridium botulinum тип А — гемагглютинин в женское молоко. Данные исследования не проводились и у животных. Следовательно, не рекомендуется применение препарата Диспорт® в период грудного вскармливания в связи с отсутствием данных.
Отсутствуют клинические данные о влиянии препарата Диспорт® на фертильность. Нет никаких доказательств прямого влияния препарата Диспорт® на фертильность в исследованиях на животных.
Способ применения и дозы
Общие рекомендации
Рекомендованные дозы препарата Диспорт® 125 ЕД являются специфическими для препаратов и не являются взаимозаменяемыми с другими препаратами ботулинического токсина;
Препарат Диспорт® 125 ЕД должен вводиться специалистами, прошедшими подготовку по проведению лечения.
Блефароспазм
При лечении блефароспазма препарат Диспорт® разводят до получения концентрации 200 ЕД/мл (см. Таблицу 1). Препарат применяют в качестве подкожных инъекций.
На основании диапазона доз, использованных в ходе клинических исследований, начальная доза препарата Диспорт® для лечения блефароспазма составляет 40 ЕД на глаз (исходя из соотношения эффективность/переносимость).
Максимальная доза для лечения блефароспазма не должна превышать 120 ЕД на каждый глаз.
Дозы 80 ЕД и 120 ЕД на каждый глаз обладают более продолжительным эффектом. Однако, частота случаев побочных реакций, включая птоз, является дозозависимой.
Инъекции в объёме 0,05 мл (10 ЕД) следует проводить медиально и латерально в соединение между пресептальной и глазничной частями верхней (3 и 4) и нижней (5 и 6) частей круговой мышцы (ш. orbicularis oculi) каждого глаза.
Для проведения инъекций в верхнее веко, с целью уменьшения риска возникновения птоза, иглу следует направлять в сторону от центра, чтобы не задеть мышцу, поднимающую верхнее веко (ш. levator palpebrae superioris). Ниже приведена схема, показывающая места проведения инъекций.
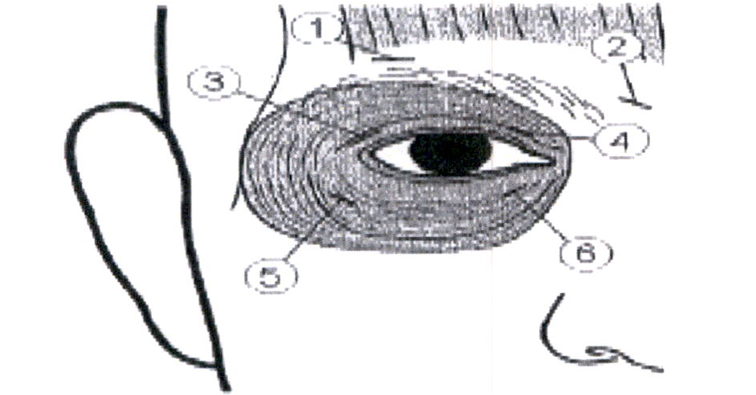
Ожидается, что облегчение симптомов начнётся в течение 2-10 дней после инъекции с максимальным эффектом в течение двух недель.
Инъекции следует повторять приблизительно каждые 12 недель или по показаниям для предупреждения рецидива симптомов (но не чаще, чем раз в 12 недель).
В зависимости от тяжести заболевания, если эффект от предыдущей инъекции не был достигнут, при каждом последующем введении препарата, суммарную дозу следует увеличить до:
- 60 ЕД/глаз (например, 0,05 мл (10 ЕД) медиально и 0,1 мл (20 ЕД) латерально),
- 80 ЕД/глаз: (например. 0,1 мл (20 ЕД) медиально и 0,1 мл (20 ЕД) латерально),
- или до 120 ЕД/глаз: (например, 0,1 мл (20 ЕД) медиально и 0,2 мл (40 ЕД) латерально), над каждым глазом и под ним, по схеме, описанной ранее. Если спазм влияет на остроту зрения, могут быть также использованы дополнительные точки введения во фронтальную мышцу (т. frontalis) над бровью (1 и 2).
Рекомендуемые дозы применяются у взрослых любого возраста, включая пожилых пациентов.
Безопасность и эффективность препарата Диспорт® при лечении блефароспазма у детей до 18 лет не подтверждена.
Гипергидроз подмышечной области
При лечении гипергидроза подмышечной области препарат Диспорт® разводят до получения концентрации 200 ЕД/мл (см. Таблицу 5). Препарат применяют внутрикожно по схемам, приведённым ниже.
Рекомендуемой начальной дозой лечения подмышечного гипергидроза является 100 ЕД на одну подмышечную область. Если желаемый эффект не достигается, то возможно последующее увеличение дозы до 200 ЕД препарата Диспорт®. Максимальная разовая доза не должна превышать 200 ЕД на одну подмышечную область.
Область введения препарата определяют пробой Минора.
Проба проводится до лечения и, при необходимости, в динамике, при комнатной температуре (22-24 °C) после 15 — минутного отдыха пациента.
Для проведения пробы необходимо:
- 5 % спиртовой раствор йода;
- картофельный крахмал;
- маркёр;
- антисептик;
- кисточка;
- марлевые салфетки.
Пациент находится в положении лёжа, руки под головой. Область потоотделения обрабатывают 5 % — ным спиртовым раствором йода и через 1 мин на эту зону салфеткой или кисточкой наносят тонким слоем картофельный крахмал. Результаты теста оценивают через 5 мин. При наличии потоотделения визуально наблюдается окрашивание обработанной поверхности в синий цвет. Интенсивность окраски (от бледно-синего до сине-чёрного) коррелирует с активностью потоотделения. После проведённой пробы площадь гипергидроза отмечают маркёром, затем крахмал смывают спиртом или другим антисептиком.
Внутрикожные инъекции проводят в десять точек в каждой подмышечной области, в каждую точку вводят по 10 ЕД препарата в объёме 0,05 мл, т.е. 100 ЕД на одну область. В большинстве случаев рекомендуемая начальная доза подавляет потоотделение на срок до 48 недель. Периодичность повторных инъекций определяют индивидуально при восстановлении исходного уровня потоотделения, но не чаще, чем раз в 12 недель. Если есть какие-либо доказательства кумулятивного эффекта при повторных инъекциях, сроки проведения повторных инъекций для каждого пациента определяют индивидуально. Безопасность и эффективность препарата Диспорт® при лечении гипергидроза подмышечной области у детей до 18 лет не подтверждена.
Временное улучшение внешнего вида гиперкинетических складок (мимических морщин) лица от умеренной до выраженной степени у взрослых пациентов моложе 65 лет, когда выраженность этих морщин оказывает серьёзное психологическое влияние на пациента
При лечении мимических морщин препарат Диспорт® разводят до получения концентраций, указанных в Таблице 1. Препарат применяют по схемам, приведённым ниже.
При проведении инъекций рекомендуется применять стерильные иглы подходящего калибра.
Интервал между инъекциями не должен быть чаще, чем один раз в три месяца.
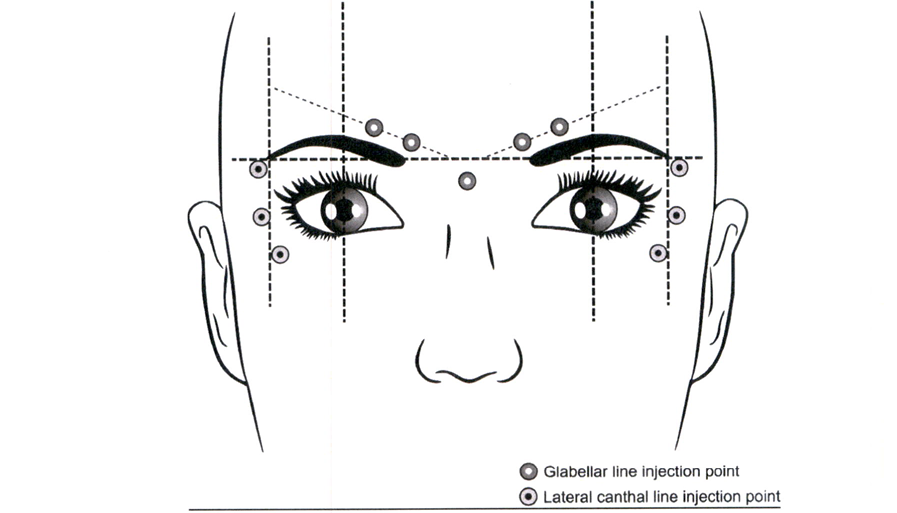
Межбровная область
Рекомендуемая доза составляет 50 ЕД, которую следует разделить на 5 точек введения. 10 ЕД вводят внутримышечно, под прямым углом к коже, в каждую из 5 точек: 2 инъекции в каждую мышцу, сморщивающую бровь (т. corrugator supercilii) и 1 инъекция в мышцу гордецов (т. procerus) около носолобного угла, как показано на схеме ниже.
Анатомические ориентиры могут быть более легко идентифицированы, если их наблюдать и пальпировать при максимальном нахмуривании. Перед инъекцией поместите большой или указательный палец под глазничный валик, чтобы предотвратить образование кровоподтёка ниже глазничного валика. Во время инъекции игла должна быть направлена вверх и медиально. Для того, чтобы уменьшить риск птоза, избегайте инъекций возле мышцы, поднимающей верхнее веко (m. levator palpebrae superioris), особенно у пациентов с более крупной опускающей мышцей брови (т. depressor supercilii). Инъекции в мышцу, сморщивающую бровь (т. corrugator supercilii) должны быть сделаны в центральной части этой мышцы, по крайней мере, на 1 см выше глазничного валика.
Время наступления эффекта составляет от двух до трёх дней после инъекции.
В клинических исследованиях, оптимальный эффект в межбровной области наблюдался до 4-х месяцев после инъекции. У некоторых пациентов эффект все ещё наблюдался спустя 5 месяцев после инъекции.
Область наружного угла глаза
Рекомендуемая доза для каждой стороны составляет 30 ЕД, разделённая на 3 точки введения: 10 ЕД должны вводиться внутримышечно в каждую точку. Введение должно быть латеральным (под углом 20–30 °) к коже и очень поверхностным. Все точки введения должны быть на наружной части круговой мышцы глаза (m. orbicularis oculi) и достаточно далеко от глазничного валика (приблизительно 1- 2 см), как показано на схеме ниже.
Анатомические ориентиры могут быть более легко идентифицированы, если их наблюдать и пальпировать при максимальной улыбке. Необходимо соблюдать осторожность, чтобы не вводить в большую/малую скуловую мышцу, избегая бокового опускания рта и асимметричной улыбки.
Точки введения
Применение у детей
Безопасность и эффективность терапии гиперкинетических морщин ботулиническим токсином типа А у детей младше 18 лет не была подтверждена.
Правила приготовления раствора для инъекций
Удалить с флакона защитную пластмассовую крышку контроля первого вскрытия.
При разведении препарата запрещается открывать флакон, удаляя пробку.
Непосредственно перед разведением содержимого флакона центральная часть пробки должна быть обработана спиртом. Лиофилизат разводят, вводя во флакон регламентированный объём 0,9 % раствора натрия хлорида для инъекций, путём прокола пробки стерильной иглой размером 23 или 25 (в случае коррекции мимических морщин рекомендуется использовать иглы калибра 29-30 G).
Для каждого показания к применению необходимые концентрации специфичны.
| Полученная доза в ЕД/мл | Количество растворителя (0,9 % раствора натрия хлорида для инъекций) |
| 100 ЕД/мл* (или 10 ЕД/0,1 мл) | 1,25 мл* |
| 200 ЕД/мл (или 10 ЕД/0,05 мл) | 0,63 мл |
* Это разведение препарата Диспорт® 125 ЕД является альтернативой только для лечения мимических морщин.
Полученная доза в ЕД/мл Количество растворителя (0,9 % раствора натрия хлорида для инъекций) 100 ЕД/мл* (или 10 ЕД/0,1 мл) 1,25 мл* 200 ЕД/мл (или 10 ЕД/0,05 мл) 0,63 мл
Полученный раствор представляет собой бесцветную прозрачную жидкость. Разведённый препарат может храниться не более 24 ч при температуре от 2 °C до 8 °C.
Побочное действие
Побочные реакции, описанные в данном разделе, имеют следующую классификацию: очень часто (≥1/10), часто (≥1/100 — <1/10), нечасто (≥1/1000 — <1/100), редко (≥1/10000 — <1/1000), очень редко (<1/10000), частота неизвестна (невозможно оценить на основании имеющихся данных).
Общие:
У пациентов с блефароспазмом; гемифациальным спазмом; цервикальной дистонией; спастичностью, связанной с церебральным параличом, инсультом или черепно-мозговой травмой; аксиллярным гипергидрозом и межбровными морщинами, получавших лечение препаратом Диспорт5 в серии клинических исследований, нежелательные явления проявлялись у 25%.
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны нервной системы | Редко | Невралгическая амиотрофия |
| Нарушения со стороны кожи и подкожных тканей | Нечасто | Зуд |
| Редко | Кожная сыпь | |
| Общие расстройства и нарушения в месте введения | Часто | Астения, утомляемость, гриппоподобный синдром, боль /гематома в месте введения |
Частота нежелательных реакций в зависимости от показания к применению
Блефароспазм
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны нервной системы | Часто | Парез лицевого нерва |
| Нечасто | Паралич лицевого нерва | |
| Нарушения со стороны органа зрения | Очень часто | Птоз |
| Часто | Диплопия, сухость глаз, повышенное слезоотделение | |
| Редко | Офтальмоплегия | |
| Нарушения со стороны кожи и подкожных тканей | Часто | Отёк век |
| Редко | Заворот века |
Побочное действие может иметь место при несоблюдении врачом правил выполнения инъекции (разведения, точного расчёта вводимой дозы, правильного выбора точек введения, направления иглы и глубины введения), приводящих к временному параличу близлежащих к месту инъекции групп мышц.
Гипергидроз подмышечной области
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны кожи и подкожных тканей | Часто | Компенсаторное потоотделение, сыпь |
| Общие расстройства и нарушения в месте введения | Неизвестна | Реакции в месте введения* (так как боль, гематома, зуд, отёк) |
* реакции в месте введения при лечении аксиллярного гипергидроза были сообщены в период пост-маркетингового наблюдения.
Временное улучшение внешнего вида гиперкинетических складок (мимических морщин) лица от умеренной до выраженной степени у взрослых пациентов моложе 65 лет, когда выраженность этих морщин оказывает серьёзное психологическое влияние на пациента:
Межбровная область
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны нервной системы | Очень часто | Головная боль |
| Часто | Парез лицевого нерва | |
| Нечасто | Головокружение | |
| Нарушения со стороны органа зрения | Часто | Астенопия (слабость зрения), птоз век, отёк век, повышенное слезоотделение, сухость глаза, подёргивание мышц вокруг глаза |
| Нечасто | Нарушение зрения, размытое зрение, диплопия, | |
| Редко | Глазодвигательные нарушения | |
| Нарушения со стороны кожи и подкожных тканей | Нечасто | Кожная сыпь, зуд |
| Общие расстройства и нарушения в месте введения | Очень часто | Реакции в месте введения (так как эритема, сыпь, зуд, парестезии, боль) |
| Нарушения со стороны иммунной системы | Нечасто | Гиперчувствительность |
Область наружного угла глаза
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны нервной системы | Часто | Головная боль |
| Нарушения со стороны органа зрения | Часто | Отёк век |
| Нечасто | Сухость глаза | |
| Общие расстройства и нарушения в месте введения | Часто | Реакции в месте введения (так как гематома, зуд и отёк) |
Опыт пострегистраиионного применения
Профиль нежелательных реакций, о которых сообщалось компании во время пострегистрационного применения, отражают фармакологию препарата.
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны иммунной системы | Неизвестна | Гиперчувствительность |
| Нарушения со стороны нервной системы | Неизвестна | Гипестезия |
Очень редко сообщается о нежелательных реакциях, возникающих в результате распространения эффектов токсина на участки, удалённые от места инъекции (чрезмерная мышечная слабость, дисфагия, приводящая к аспирационной пневмонии, которая может быть летальной).
Передозировка
Симптомы
Применение больших доз препарата может вызвать дистантный и глубокий нейромышечный паралич. Передозировка может привести к увеличению риска проникновения нейротоксина в кровеносную систему и может стать причиной осложнений, которые ассоциируются с эффектами, возникающими при пищевом отравлении ботулотоксинами (такие как дисфагия и дисфония).
В случае передозировки при инъекции или случайном приёме внутрь пациент должен находиться под медицинским контролем в течение нескольких недель с целью наблюдения возможных симптомов увеличения мышечной слабости или мышечного паралича.
При параличе дыхательных мышц, вызванном передозировкой, может понадобиться проведение искусственной вентиляции лёгких. Рекомендуется общий поддерживающий уход. При необходимости проводится симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Эффект ботулинического токсина может усиливать действие препаратов, влияющих напрямую, либо опосредованно, на нервно-мышечную функцию и такие препараты должны применяться с осторожностью у пациентов, проходящих терапию ботулиническим токсином.
Особые указания
Лечение препаратом должно проводиться специалистами, имеющими опыт в диагностике и лечении подобных состояний, и прошедших подготовку по проведению лечения.
Были зарегистрированы побочные эффекты, связанные с действием токсина на удалённые мышцы, такие как дисфагия, значительное снижение мышечного тонуса, а также пневмония; в очень редких случаях — смерть. Пациенты, получающие Диспорт® в терапевтических дозах, могут испытывать общую мышечную слабость. Риск возникновения подобных побочных реакций может быть уменьшен при соблюдении рекомендаций по дозированию препарата, применении минимально эффективных доз и не превышении максимально рекомендованных доз препарата.
Пациенты с заболеваниями, ведущими к поражению нервно-мышечной передачи, трудностями глотания или дыхания имеют более высокий риск развития данных эффектов. У таких пациентов лечение препаратом Диспорт® должно проводиться под строгим медицинским контролем и только в случае, если ожидаемая польза превышает возможный риск.
Пациенты с субклиническими или клиническими проявлениями поражения нервно-мышечной передачи (так как миастения гравис) должны проходить терапию препаратом только под тщательным контролем медицинских работников. Такие пациенты могут иметь повышенную чувствительность к препаратам ботулинического токсина, которые могут вызвать у них резко выраженную мышечную слабость.
На фоне проводимой терапии ботулиническими токсинами типа A или B были зарегистрированы очень редкие случаи смерти, вызванные дисфагией (нарушение глотания), пневмопатией (включая, но не ограничиваясь диспноэ, респираторную недостаточность, остановку дыхания), и/или у пациентов с выраженной астенией.
С осторожностью следует вводить Диспорт® пациентам с нарушениями функций глотания и дыхания, так как данные нарушения могут быть усугублены вследствие распространённого действия токсина на соответствующие мышцы.
У пациентов с хроническими респираторными заболеваниями в редких случаях имеется риск развития аспирации.
Не рекомендуется превышать рекомендованные дозы и частоту введения препарата Диспорт®.
Пациенты и лица, осуществляющие уход за ними, должны быть предупреждены о необходимости срочного обращения к врачу в случаях возникновений нарушений глотания, речи или респираторных проблем.
Как и для других препаратов для внутримышечного введения, препарат Диспорт® может быть применён у пациентов с замедленным временем свёртываемости крови и при воспалении/инфекции в предполагаемом месте введения только в случаях крайней необходимости.
Остатки препарата после проведения инъекций должны быть утилизированы в соответствии с рекомендациями, изложенными в разделе «Особые указания по утилизации». Во время приготовления препарата, его применения и утилизации остатков должны соблюдаться специфические меры предосторожности.
Образование противоботулинических антител отмечено в редких случаях у пациентов, которым проводили терапию препаратом Диспорт®. Клинически нейтрализация антител проявлялась снижением терапевтического эффекта, что требовало постоянного повышения доз препарата.
В составе препарата Диспорт® содержится малое количество альбумина, соответственно, невозможно полностью исключить риск передачи вирусных инфекций при использовании крови человека или продуктов крови.
Перед применением препарата Диспорт® для коррекции гиперкинетических складок лица необходимо учитывать индивидуальные особенности анатомии лица: асимметрию, птоз, чрезмерная дерматохалазия, наличие рубцов и любые другие изменения анатомии лица, возникшие в результате предыдущих хирургических вмешательств.
Осторожность должна соблюдаться при введении препарата в случае, когда мышцы- мишени выказывают избыточную слабость или атрофию.
С особой осторожностью следует повторно вводить препарат пациентам, у которых отмечены аллергические реакции на предыдущую инъекцию препарата. В случае развития аллергических реакций дальнейшее применение препарата должно осуществляться после оценки соотношения польза/риск от лечения для пациента.
Примечание: при назначении препарата Диспорт® следует учитывать, что единицы действия препарата являются специфическими и не могут сравниваться с таковыми других препаратов, содержащих ботулинический токсин.
Особые указания при утилизации
Сразу же после проведения инъекций оставшийся во флаконе или в шприце раствор следует инактивировать раствором гипохлорита натрия, содержащим 1 % активного хлора. Все вспомогательные материалы, находившиеся в контакте с препаратом, должны быть утилизированы в соответствии со стандартной больничной практикой.
Пролитый препарат должен быть вытерт абсорбирующей салфеткой, смоченной в 1 % растворе гипохлорита натрия. Данный препарат/раствор также может быть инактивирован при помощи автоклавирования; минимальная температура 121 °C.
Влияние на способность управлять транспортными средствами, механизмами
Необходимо соблюдать осторожность при вождении автотранспорта и работе с механизмами. При появлении нежелательных явлений, таких как мышечная слабость и зрительные расстройства, необходимо воздержаться от управления транспортными средствами и работы с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для инъекций, 125 ЕД.
По 125 ЕД в стеклянном флаконе, укупоренном резиновой пробкой под алюминиевой обкаткой с отверстием для иглы в центре и закрытом защитной пластмассовой крышкой контроля первого вскрытия.
1 флакон, зафиксированный в держателе из картона вместе с инструкцией по применению, помещают в пачку картонную.
Хранение
Транспортировать при температуре от -22 до 8 °C.
Хранить при температуре от 2 до 8 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Ipsen Biopharm, Ltd., Великобритания
Производитель
Ипсен Биофарм Лимитед
Эш Роуд, Рексхэм Индастриал Эстейт, Рексхэм LL13 9UF, Великобритания.
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей.
Владелец регистрационного удостоверения: Ипсен Фарма, Франция.
Организация, принимающая претензии потребителей: ООО «ИПСЕН», 109147, Москва, ул. Таганская, 17-23 тел. (495) 258-54-00 факс (495)258-54-01
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Диспорт:
