Элонва®
Elonva®Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Каждый флакон содержит:
Активное вещество: корифоллитропин альфа 100 мкг или 150 мкг.
Вспомогательные вещества: натрия цитрата дигидрат 3,68 мг, сахароза 35,0 мг, L-метионин 0,25 мг, полисорбат 20 0,10 мг. хлористоводородная кислота 0,1 М или натрия гидроксид 0,1 М до pH 7,0, вода для инъекций (извлекаемый объём) до 0,50 мл.
Описание
Прозрачный раствор от бесцветного до светло-жёлтого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Корифоллитропин альфа — это гликопротеин, который продуцируется клетками яичников китайских хомячков с помощью рекомбинантной ДНК технологии.
Корифоллитропин альфа — это стимулятор роста фолликулов пролонгированного действия, который по фармакодинамическим свойствам сопоставим с рекомбинантным фолликулостимулирующим гормоном (рФСГ), но обладает значительно более.длительным действием. Препарат вызывает и поддерживает рост фолликулов в течение недели, поэтому одна подкожная инъекция рекомендуемой дозы препарата Элонва® (может заменить первые 7 ежедневных инъекций любых препаратов рФСГ при проведении (контролируемой стимуляции яичников. Увеличение длительности фолликулостимулирующей активности было достигнуто за счёт присоединения карбокситерминального пептида бета-субъединицы хорионического гонадотропина человека (ХГЧ) к бета-цепи человеческого ФСГ. Корифоллитролин альфа не обладает активностью ХГЧ и лютеинизирующего гормона (ЛГ).
Кардиоэлектрофизиология
В рандомизированном двойном слепом плацебо-контролируемом и контролируемом с применением другого лекарственного средства клиническом исследовании с 4 периодами смены терапии, 70 здоровых женщин в постменопаузном периоде получили разовую терапевтическую дозу 150 мкг корифоллитропина альфа подкожно, разовую дозу, превышающую терапевтическую — 240 мкг корифоллитропина альфа подкожно, 400 мг моксифлоксацина внутрь и плацебо. При применении обеих доз корифоллитропина альфа продолжительность интервала QTc не увеличивалась на протяжении 216 ч после введения препарата. При внесении поправки на исходное значение показателя и его значение при применении плацебо максимальное значение среднего изменения продолжительности интервала QTc после введения 150 мкг корифоллитропина альфа составило 1,4мсек (односторонний 95 % верхний доверительный интервал составил 3.4 мсек). После введения дозы корифоллитропина альфа, превышающей терапевтическую (240 мкг), максимальное значение среднего изменения продолжительности интервала QTc составило 1,2 мсек (односторонний 95 % верхний доверительный интервал 3,6 мсек).
Фармакокинетика
Показатели фармакокинетики корифоллитропина альфа не зависели от дозы в широком диапазоне доз (7,5-240 мкг). Распределение, метаболизм и выведение корифоллитропина альфа сходны с таковыми других гонадотропинов, таких как ФСГ, ХГЧ и Л Г.
Всасывание
После однократного подкожного введения корифоллитропина альфа максимальная концентрация в плазме достигалась через 44 ч (34-57 ч1). Абсолютная биодоступность, составила 58 % (48-70% 1 ).
Экспозиция корифоллитропина альфа зависит от массы тела. В клинических, исследованиях концентрации корифоллитропина альфа в плазме были сходными после введения корифоллитропина альфа в дозах 100 мкг и 150 мкг женщинам с массой тела, <=60 кг и >60 кг соответственно.
Распределение
После всасывания в кровь корифоллитропин альфа распределяется в основном в яичники и почки.
В равновесном состоянии объём распределения и клиренс составляют 9,2 л (6,5-13,1 л1) и 0,13 л/ч (0,10-0,18 л/ч 1 ) соответственно.
Метаболизм
В метаболизме корифоллитропина альфа, преимущественно, участвуют почки. В результате метаболизма образуются фармакологически неактивные альфа и бета субъединицы (включая карбокси-терминальный пептид), которые, преимущественно, выводятся почками.
Выведение
Период полувыведения корифоллитропина альфа составляет 69 ч (59-79 ч1). Корифоллитропин альфа выводится, преимущественно, почками. Выведение может быть снижено у пациентов с почечной недостаточностью. Микросомальные ферменты печени Незначительно участвуют в метаболизме и выведении корифоллитропина альфа. Хотя [данные о применении корифоллитропина альфа пациентами с печёночной недостаточностью отсутствуют, влияние печёночной недостаточности на [фармакокинетический профиль корифоллитропина альфа маловероятно.
1 Предполагаемый диапазон у 90% пациенток.Показания
Контролируемая стимуляция яичников в комбинации с антагонистами гонадотропин рилизинг-гормона (ГнРГ) с целью образования множественных фолликулов у женщин, участвующих в программе вспомогательной репродукции.
Противопоказания
- Гиперчувствительность к корифоллитропину альфа или какому-либо вспомогательному веществу препарата.
- Опухоли яичников, молочной железы, матки, гипофиза или гипоталамуса.
- Кровотечения и кровянистые выделения из половых путей (не связанные с менструацией) неустановленной этиологии.
- Первичная недостаточность яичников.
- Кисты яичников или увеличение яичников.
- Синдром гиперстимуляции яичников (СГЯ) в анамнезе.
- В случае, если предыдущий цикл контролируемой стимуляции яичников привел к росту более чем 30 фолликулов до размера не менее 11 мм, выявленных при ультразвуковом исследовании.
- Количество базальных антральных фолликулов более 20.
- Фиброидные опухоли матки, при которых наступление и дальнейшее вынашивание беременности затруднено.
- Пороки развития репродуктивных органов, при которых беременность невозможна.
- Беременность и период грудного вскармливания.
- Синдром поликистозных яичников (СПКЯ).
- Почечная недостаточность.
Применение при беременности и в период грудного вскармливания
Беременность
Применение препарата Элонва® во время беременности противопоказано.
После контролируемой стимуляции яичников гонадотропинами в клинической практике, тератогенного эффекта не выявлено. Клинические данные не позволяют исключить тератогенный эффект корифоллитропина альфа, в случае его непреднамеренного введения во время беременности. В доклинических исследованиях тератогенного эффекта, связанного с использованием лекарственного препарата не наблюдали.
Период грудного вскармливания
Применение препарата Элонва® в период грудного вскармливания противопоказано.
Способ применения и дозы
Применение препарата Элонва® должно проводиться под контролем врача, имеющего опыт лечения бесплодия.
Препарат можно применять, только если раствор в шприце прозрачный. Доза препарата Элонва® зависит от массы тела и возраста женщины.
Однократное введение препарата в дозе 100 мкг рекомендуется у женщин с массой тела ≤60 кг в возрасте ≤36 лет.
Однократное введение препарата в дозе 150 мкг рекомендуется у женщин:
- с массой тела >60 кг независимо от возраста;
- с массой тела ≥50 кг и старше 36 лет.
Сведения о применении препарата у женщин старше 36 лет и с массой тела менее 50 кг отсутствуют.
| Масса тела | ||||
| Менее 50 кг | 50 — 60 кг | Более 60 кг | ||
| Возраст | ≤36 лет | 100 мкг | 100 мкг | 150 мкг |
| >36 лет | Нет данных | 150 мкг | 150 мкг | |
Рекомендуемые дозы были установлены только при комбинированном использовании с антагонистом ГнРГ.
В 1-й день стимуляции препарат Элонва® вводят однократно подкожно (предпочтительно под кожу живота) в раннюю фолликулярную фазу менструального никла. На 5-й или 6-й день стимуляции, в зависимости от количества и размера растущих фолликулов, должно быть начато использование антагониста ГнРГ. Также необходимо параллельное определение концентрации эстрадиола в плазме крови. Антагонист ГнРГ применяется для предотвращения преждевременного повышения концентрации ЛГ.
На 8-й день стимуляции (через 7 дней после инъекции препарата Элонва® ) лечение может быть продолжено ежедневным введением рФСГ до тех пор. пока не будет достигнут критерий индукции финального созревания ооцита (3 фолликула >17 мм). Суточная доза рФСГ зависит от ответа яичников, который регулярно мониторируется при ультразвуковом исследовании, начиная с 5-го или 6-го дня стимуляции. Если ответ нормальный, то рекомендуемая суточная доза составляет 150 МЕ рФСГ. В случае чрезмерного ответа яичников инъекция рФСГ в день введения ХГЧ может быть пропущена, следует использовать рекомендации по уменьшению риска развития СГЯ (см. раздел «Особые указания»). Обычно достаточное созревание фолликулов достигается на 9-й день лечения (диапазон длительности лечения составляет от 6 до 18 дней). При созревании 3-х фолликулов до размера ≥17 мм производится однократное введение от 5000 МЕ до 10000 МЕ ХГЧ, выделенного из мочи, в этот же или следующий день для индукции финального созревания ооцитов.
Применение у особых групп пациентов
Почечная недостаточность
Клинических исследований препарата у пациенток с почечной недостаточностью не проводилось. Так как скорость выведения корифоллитропина альфа у таких пациенток может быть снижена, применение препарата Элонва® у женщин с почечной недостаточностью противопоказано. Печёночная недостаточность
Хотя данные по применению препарата у пациенток с печёночной недостаточностью отсутствуют, влияние печёночной недостаточности на выведение корифоллитропина альфа маловероятно.
Дети
Применение препарата Элонва® у детей не соотносится с показанием.
Способ введения
Подкожная инъекция препарата может быть произведена самой женщиной или другим лицом, если врач предоставил соответствующие рекомендации.
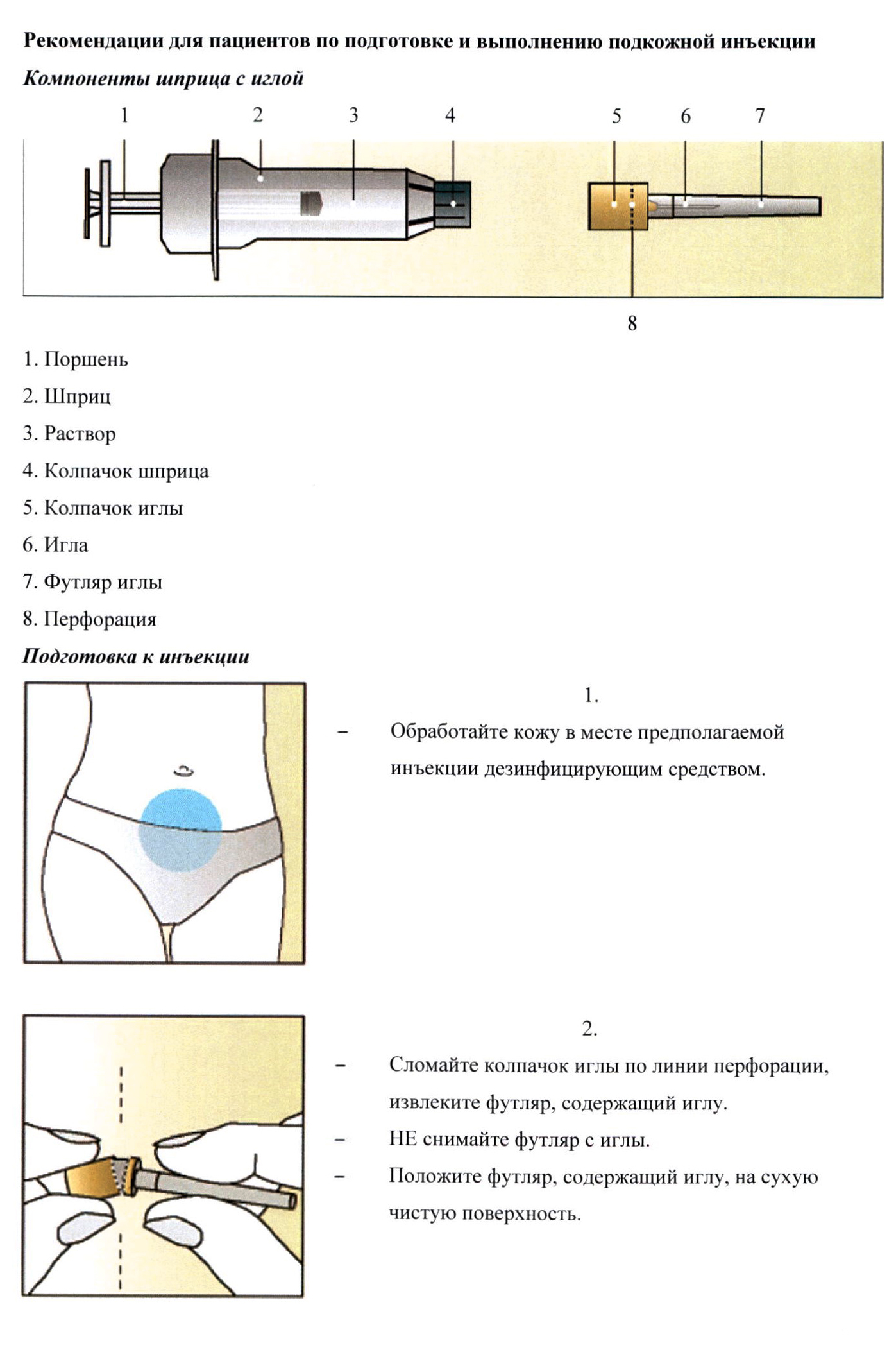
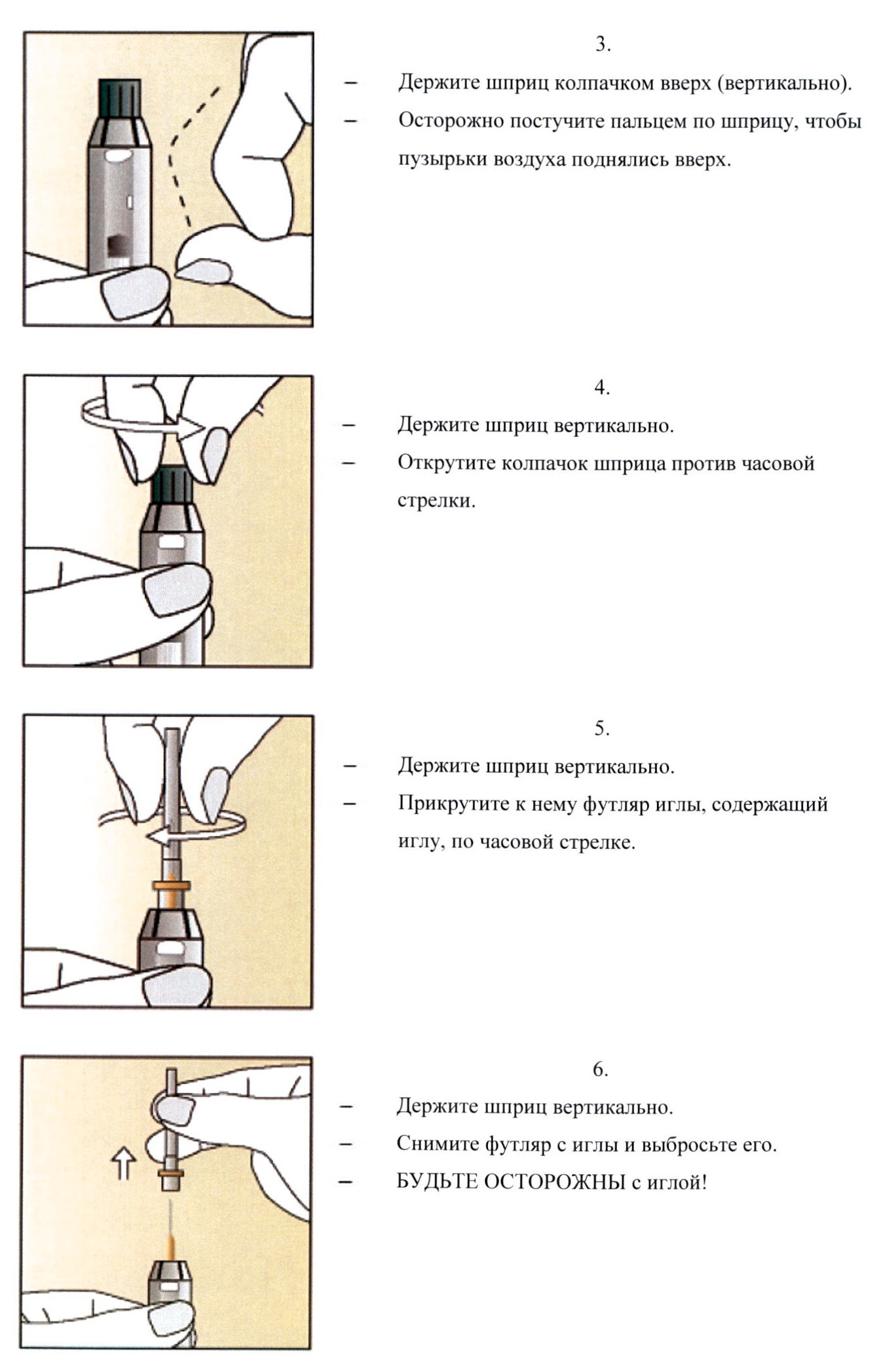
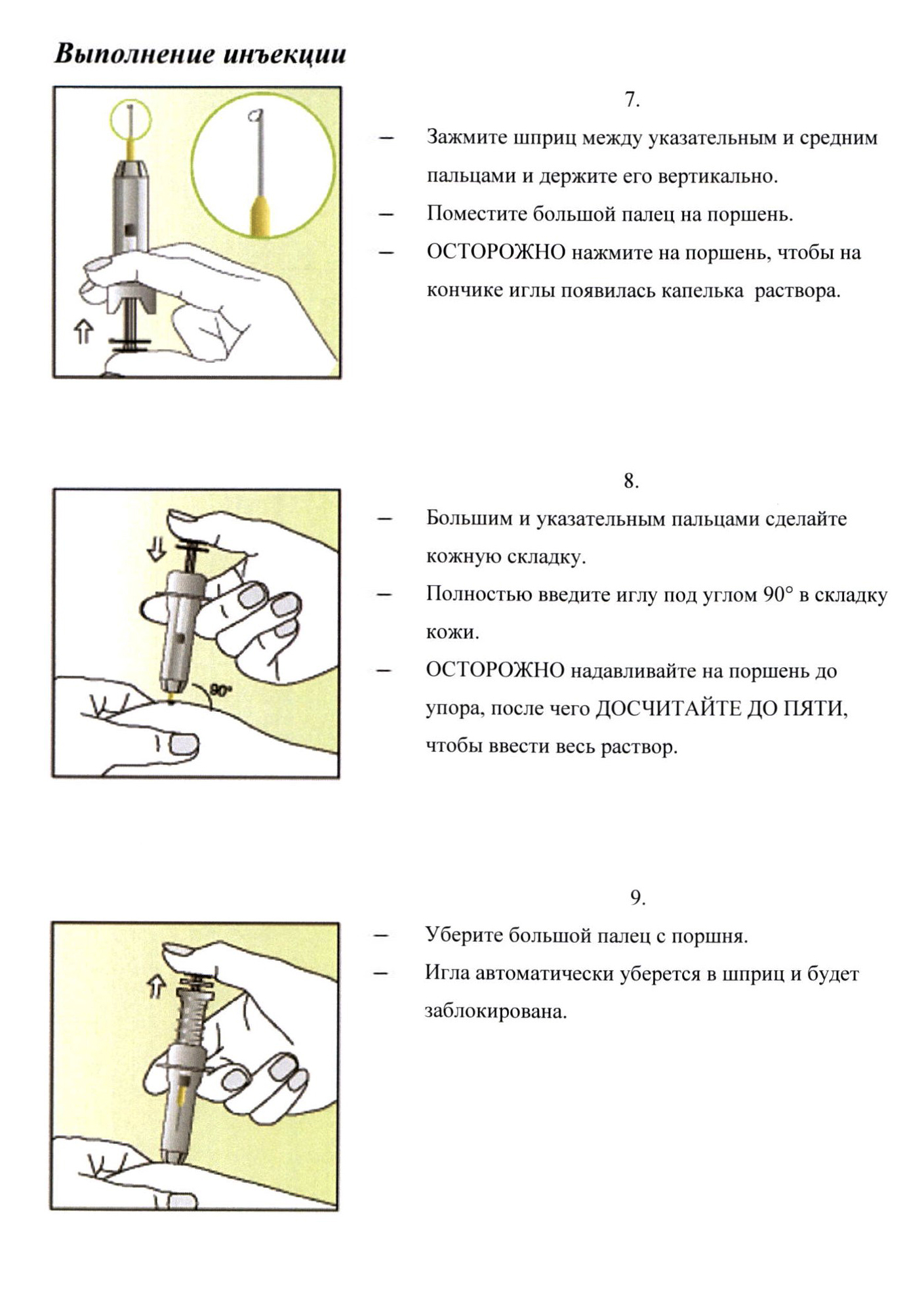
Побочное действие
Основными нежелательными реакциями в клинических исследованиях при лечении препаратом Элонва® были СГЯ (5,2 %), боль и дискомфорт в области малого таза (4.1 % и 5,5% соответственно), головная боль (3,2 %), тошнота (1,7%), утомляемость (1,4 %) и жалобы со стороны молочных желёз (включая болезненные ощущения) (1,2 %). В таблице приведены основные нежелательные реакции (по системам органов и частоте),
которые наблюдались при применении препарата в клинических исследованиях (часто (≥1 %, <10%), нечасто (≥0,1 %, <1%).
| Класс система/орган | Частота | Нежелательные эффекты |
| Нарушения со | Нечасто | Перепады настроения |
| стороны психики | ||
| Нарушения со | Часто | Головная боль |
| стороны нервной | ||
| системы | Нечасто | Головокружение |
| Нарушения со | Нечасто | «Приливы » |
| стороны сосудов | ||
| Нарушения со | Часто | Тошнота |
| стороны желудочно- | ||
| кишечного тракта | Нечасто | Боль в животе, рвота, диарея, запор, вздутие живота |
| Нарушения со | Нечасто | Боль в спине |
| стороны скелетно- | ||
| мышечнои и | ||
| соединительной | ||
| ткани | ||
| Нарушения со | Часто | СГЯ, боль и дискомфорт в области |
| стороны половых | малого таза, болезненность молочных | |
| органов и молочной | желёз | |
| железы | ||
| Нечасто | Перекрут яичника, преждевременная овуляция, боль в груди | |
| Общие расстройства | Часто | Утомляемость |
| и нарушения в месте | ||
| введения | Нечасто | Гематома, боль в месте инъекции, болезненность при введении препарата, раздражительность |
| Лабораторные и | Нечасто | Повышение содержания АЛТ |
| инструментальные данные | (аланинаминотрансферазы), ACT (аспартатаминотрансферазы) |
Кроме того, описаны эктопическая беременность, невынашивание беременности и многоплодная беременность, которые рассматриваются как осложнения ВРТ. В редких случаях при применении препарата Элонва®, как и при применении других гонадотропинов, наблюдались тромбоэмболические осложнения.
Передозировка
Введение более одной рекомендованной дозы препарата Элонва® во время одного никла контролируемой стимуляции яичников и/или применение рФСГ в слишком высоких дозах может привести к увеличению риска развития СГЯ. После введения препарата Элонва® вплоть до 8-го дня стимуляции не следует дополнительно применять препараты, содержащие ФСГ, поскольку это также может повысить риск развития СГЯ. Меры по уменьшению риска развития и лечение СГЯ описаны в разделе «Особые указания».
Взаимодействие с другими лекарственными средствами
Взаимодействие с другими препаратами не изучалось. Корифоллитропин альфа не является субстратом для изоферментов цитохрома P450, поэтому не ожидается взаимодействия с другими препаратами.
Особые указания
Диагностика бесплодия до начала лечении
- Перед началом лечения пара должна быть обследована должным образом, в частности, следует обследовать пациентку на наличие гипотиреоза, надпочечниковой недостаточности, гиперпролактинемии и опухолей гипофиза или гипоталамуса. В случае их выявления следует назначить соответствующее лечение. До начала лечения препаратом Элонва® следует также учесть заболевания, являющиеся противопоказаниями к беременности.
Режим дозировании во время никла стимуляции
- Препарат Элонва® предназначен только для однократного подкожного введения. Во время этого цикла не следует назначать дополнительные инъекции препарата Элонва® (см. раздел «Способ применения и дозы»).
- После введения препарата Элонва® не следует дополнительно вводить препараты, содержащие ФСГ, вплоть до 8-го дня стимуляции (см. раздел «Способ применения и дозы»).
Почечная недостаточность
- У пациенток с почечной недостаточностью скорость выведения корифоллитропина альфа может быть снижена. Применение препарата у таких пациенток противопоказано.
Применение с агонистом ГнРГ не рекомендовано
Опыт применения препарата Элонва® в комбинации с агонистом ГнРГ ограничен. В связи с этим применять препарат Элонва® в сочетании с агонистом ГнРГ не рекомендуется.
Синдром гиперстимуляции яичников (СГЯ)
- СГЯ представляет собой состояние, отличающееся от неосложнённого увеличения яичников. К клиническим проявлениям СГЯ лёгкой или средней степени тяжести относятся боли в животе, тошнота, диарея, небольшое или умеренное увеличение яичников и кисты яичников. При тяжёлом течении СГЯ возможна угроза жизни. К клиническим проявлениям тяжёлого течения СГЯ относятся большие кисты яичников, острая боль в животе, аспит, плевральный выпот, гидроторакс, одышка, олигурия. изменения со стороны крови и увеличение массы тела. В редких случаях могут развиться венозные или артериальные тромбоэмболии. У пациенток с СГЯ наблюдались также случаи гранзиторного изменения показателей функции печени, свидетельствующие о её нарушении, которые не сопровождались или сопровождались морфологическими изменениями, выявленными при биопсии печени. Развитие СГЯ может быть следствием применения ХГЧ или беременности (эндогенный ХГЧ). Ранний СГЯ обычно развивается в течение 10 дней после введения ХГЧ и может быть связан с избыточным ответом яичников на стимуляцию гонадотропином. Поздний СГЯ развивается спустя более 10 дней после введения ХГЧ вследствие гормональных изменений при беременности. Учитывая риск развития СГЯ. пациенток следует наблюдать в течение по крайней мере 2 недель после введения ХГЧ. Женщины с известными факторами риска повышенного ответа яичников особенно склонны к развитию СГЯ во время либо после применения гонадотропинов, в том числе препарата Элонва®. Во время первого цикла стимуляции яичников, когда факторы риска известны лишь частично, требуется тщательный мониторинг ранней симптоматики СГЯ.
Чтобы уменьшить риск развития СГЯ, до лечения и регулярно во время лечения необходимо проводить ультразвуковой мониторинг растущих фолликулов. Также необходимо параллельное определение концентрации эстрадиола в плазме крови. В программах ВРТ риск развития СГЯ повышен при наличии 18 и более фолликулов диаметром ≥11 мм. Если общее число фолликулов составляет 30 и более, вводить ХГЧ не следует.
Меры по уменьшению риска развитии СГЯ в зависимости от выраженности ответа
яичников
- Воздержаться от дальнейшей стимуляции гонадотропином с максимальным сроком до 3 дней.
- Отмена ХГЧ и прекращение терапевтического цикла.
- Для индукции финального созревания ооцита применять ХГЧ, выделенный из мочи, в дозе ниже 10000 МЕ (например, 5000 МЕ ХГЧ, выделенного из мочи) или 250 мкг рекомбинантного хориогонадотропина альфа, что эквивалентно примерно 6500 МЕ ХГЧ, выделенного из мочи.
- Отмена переноса эмбриона с последующей его криоконсервацией.
- Отмена ХГЧ для поддержки лютеиновой фазы.
Чтобы уменьшить риск развития СГЯ, необходимо использовать рекомендуемые дозы и
схемы применения препарата Элонва® и тщательно контролировать ответ яичников. При
развитии СГЯ следует придерживаться стандартных подходов и назначить надлежащее
лечение.
Перекрут яичника
- После лечения с применением гонадотропинов. в том числе препарата Элонва®, наблюдались случаи перекрута яичника. Перекрут яичника может быть связан с другими состояниями, такими как СГЯ, беременность, перенесённые оперативные вмешательства на органах брюшной полости, перекрут яичника в прошлом и кисты яичников в настоящее время или в анамнезе. Ранняя диагностика и незамедлительное устранение перекрута могут снизить повреждение яичника, связанное со снижением его кровоснабжения.
Многоплодная беременность
- При применении всех препаратов гонадотропинов, включая препарат Элонва®, наблюдались случаи наступления многоплодной беременности и рождения близнецов. Перед началом лечения следует информировать женщину и её партнера о возможном риске для матери (осложнения беременности и родов) и новорождённых (низкая масса тела). При лечении с применением методов ВРТ риск многоплодной беременности в основном зависит от числа перенесённых эмбрионов.
Эктопическая беременность
- У женщин с бесплодием, которым проводится лечение методами ВРТ, повышен риск эктопической беременности. В связи с этим, на ранних сроках беременности следует провести ультразвуковое исследование, чтобы подтвердить наличие маточной беременности и исключить внематочную беременность.
Врождённые пороки развития
- Частота врождённых пороков развития после применения ВРТ несколько выше, чем после естественного оплодотворения. Это связывают с индивидуальными особенностями родителей (например, возраст женщины, характеристики спермы) и повышенной частотой многоплодной беременности.
Опухоли яичников и других органов репродуктивной системы
- У женщин, получавших различные схемы лечения по поводу бесплодия, описаны случаи развития как доброкачественных, так и злокачественных опухолей яичников и других органов репродуктивной системы. Не установлено, может ли лечение гонадотропинами привести к увеличению риска развития этих опухолей у женщин с бесплодием.
Сосудистые осложнения
Тромбоэмболические осложнения, связанные или не связанные с СГЯ. наблюдались при лечении гонадотропинами, включая препарат Элонва®. Внутрисосудистый тромбоз, который может развиться в венах или артериях, может привести к снижению кровоснабжения конечностей или жизненно важных органов. У женщин с факторами риска тромбоэмболических осложнений (тромбоэмболия в анамнезе, отягощённый семейный анамнез, ожирение или тромбофилия) лечение гонадотропинами может способствовать дальнейшему увеличению этого риска. В таких случаях необходимо оценить риск и пользу применения гонадотропинов. Следует отметить, что сама беременность повышает риск развития тромбоза.
Влияние на способность управлять транспортными средствами, механизмами
Не проводилось исследований для оценки влияния на способность управлять транспортными средствами и работать с механизмами.
Препарат Элонва® может вызвать головокружение. Пациенток следует предупредить, что при головокружении не следует управлять транспортными средствами и работать с механизмами.
Форма выпуска
Раствор для подкожного введения, 100 мкг/0,5 мл, 150 мкг/0,5 мл.
Хранение
При температуре от 2 до 8 °C, в защищённом от света месте. Не замораживать. Хранить в недоступном для детей месте.
Срок годности
3 года. Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Vetter Pharma-Fertigung, GmbH & Co. KG, Германия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Элонва:
