Элонва®
Elonva®Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Каждый флакон содержит:
Активное вещество: корифоллитропин альфа 100 мкг или 150 мкг.
Вспомогательные вещества: натрия цитрата дигидрат 3,68 мг, сахароза 35,0 мг, L-метионин 0,25 мг, полисорбат 20 0,10 мг. хлористоводородная кислота 0,1 М или натрия гидроксид 0,1 М до pH 7,0, вода для инъекций (извлекаемый объём) до 0,50 мл.
Описание
Прозрачный раствор от бесцветного до светло-жёлтого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Корифоллитропин альфа представляет собой гликопротеин, полученный с помощью рекомбинантной ДНК-технологии из клеток яичников китайских хомячков (СНО).
Корифоллитропин альфа является стимулятором роста фолликулов пролонгированного действия, который по фармакодинамическим свойствам сопоставим с рекомбинантным фолликулостимулирующим гормоном (рФСГ), но обладает значительно более длительным действием.
Корифоллитропин альфа вызывает и поддерживает множественный рост фолликулов в течение недели, поэтому 1 подкожная (п/к) инъекция рекомендуемой дозы препарата Элонва® может заменить первые 7 ежедневных инъекций любых препаратов рФСГ при проведении контролируемой стимуляции яичников.
Увеличение длительности фолликулостимулирующей активности было достигнуто за счёт присоединения карбокси-терминального пептида бета-субъединицы хорионического гонадотропина человека (ХГЧ) к бета-цепи человеческого ФСГ. Корифоллитропин альфа не обладает активностью ХГЧ и лютеинизирующего гормона (ЛГ).
Влияние на электрофизиологию сердца
В рандомизированном двойном слепом плацебо-контролируемом и контролируемом с применением другого лекарственного средства клиническом исследовании с 4 периодами смены терапии, 70 здоровых женщин в постменопаузном периоде получили разовую терапевтическую дозу 150 мкг корифоллитропина альфа п/к, разовую дозу, превышающую терапевтическую — 240 мкг корифоллитропина альфа п/к, 400 мг моксифлоксацина внутрь и плацебо. При применении обеих доз корифоллитропина альфа продолжительность интервала QTc не увеличивалась на протяжении 216 ч после введения препарата.
При внесении поправки на исходное значение показателя и его значение при применении плацебо максимальное значение среднего изменения продолжительности интервала QTc после введения 150 мкг корифоллитропина альфа составило 1,4 мсек (односторонний 95% верхний доверительный интервал составил 3,4 мсек). После введения дозы корифоллитропина альфа, превышающей терапевтическую (240 мкг), максимальное значение среднего изменения продолжительности интервала QTc составило 1,2 мсек (односторонний 95% верхний доверительный интервал 3,6 мсек).
Фармакокинетика
Показатели фармакокинетики корифоллитропина альфа оценивались после п/к введения у женщин, которым проводились циклы контролируемой стимуляции яичников. Распределение, метаболизм и выведение корифоллитропина альфа сходны с таковыми других гонадотропинов, таких как ФСГ, ХГЧ и ЛГ.
Всасывание
После однократного п/к введения препарата Элонва® средняя максимальная концентрация корифоллитропина альфа в плазме (Сmах) составила 4,24 нг/мл (2,49–7,21 нг/мл1) и достигалась при среднем Тmах равном 44 ч (35–57 ч1) после приёма. Абсолютная биодоступность составила 58 % (48–70 %1).
Экспозиция корифоллитропина альфа зависит от массы тела. Среднее значение AUC (площадь под кривой “концентрация-время”) корифоллитропина альфа после однократного п/к введения составляет 665 ч × нг/мл (426–1037 ч × нг/мл1) и является сходным после введения корифоллитропина альфа в дозах 100 мкг женщинам с массой тела ≤60 кг и 150 мкг женщинам с массой тела >60 кг.
Распределение
После всасывания в кровь корифоллитропин альфа распределяется в основном в яичники и почки. В равновесном состоянии объём распределения составляет 9,2 л (6,5–13,1 л1). Экспозиция корифоллитропина альфа возрастает пропорционально дозе в диапазоне от 60 мкг до 240 мкг.
Метаболизм
В метаболизме корифоллитропина альфа в основном участвуют почки. В результате метаболизма образуются фармакологически неактивные альфа- и бета-субъединицы (включая карбокси-терминальный пептид), которые преимущественно выводятся почками.
Выведение
Среднее значение периода полувыведения (T½) корифоллитропина альфа составляет 70 ч (59–82 ч1), клиренс составляет 0,13 л/ч (0,10–0,18 л/ч1).
Корифоллитропин альфа выводится преимущественно почками. Скорость выведения может быть снижена у пациенток с почечной недостаточностью (см. разделы «Способ применения и дозы» и «Особые указания»). Печёночный метаболизм в незначительной степени влияет на выведение корифоллитропина альфа.
Фармакокинетика в особых клинических группах пациенток
У пациенток с нарушением функции печени
Хотя данные о применении препарата у пациенток с печёночной недостаточностью отсутствуют, влияние печёночной недостаточности на фармакокинетический профиль корифоллитропина альфа маловероятно.
Прогнозируемый диапазон у 90 % пациенток.
Показания
Контролируемая стимуляция яичников в комбинации с антагонистами гонадотропин рилизинг-гормона (ГнРГ) с целью образования множественных фолликулов у женщин, участвующих в программе вспомогательных репродуктивных технологий (ВРТ).
Противопоказания
- Гиперчувствительность к корифоллитропину альфа или какому-либо вспомогательному веществу препарата.
- Опухоли яичников, молочной железы, матки, гипофиза или гипоталамуса.
- Кровотечения и кровянистые выделения из половых путей (не связанные с менструацией) неустановленной этиологии.
- Первичная недостаточность яичников.
- Кисты яичников или увеличение яичников.
- Фибромиома матки, несовместимая с беременностью
- Аномалии развития половых органов, несовместимые с нормальным развитием беременности.
- Беременность и период грудного вскармливания.
- Почечная недостаточность.
Факторы риска развития синдрома гиперстимуляции яичников (СГЯ)
◦ СГЯ в анамнезе.
◦ В случае, если предыдущий цикл контролируемой стимуляции яичников привёл к росту более чем 30 фолликулов до размера ≥11 мм, выявленных при ультразвуковом исследовании.
◦ Количество базальных антральных фолликулов более 20.
◦ Синдром поликистозных яичников (СПКЯ).
Способ применения и дозы
Применение препарата Элонва® должно проводиться под контролем врача, имеющего опыт лечения бесплодия.
Препарат можно применять, только если раствор в шприце прозрачный.
Доза препарата Элонва® зависит от массы тела и возраста женщины.
Однократное введение препарата в дозе 100 мкг рекомендуется у женщин с массой тела ≤60 кг в возрасте ≤36 лет.
Однократное введение препарата в дозе 150 мкг рекомендуется у женщин:
- с массой тела ≥60 кг независимо от возраста;
- с массой тела ≥50 кг и старше 36 лет.
Сведения о применении препарата у женщин старше 36 лет и с массой тела менее 50 кг отсутствуют.
Масса тела | ||||
Менее 50 кг | 50–60 кг | Более 60 кг | ||
Возраст | ≤36 лет | 100 мкг | 100 мкг | 150 мкг |
>36 лет | Нет данных | 150 мкг | 150 мкг | |
Рекомендуемые дозы корифоллитропина альфа были установлены только при его применении в комбинации с антагонистом ГнРГ, вводимом с 5–6 дня стимуляции.
В 1-й день стимуляции препарат Элонва® вводят однократно подкожно (предпочтительно под кожу живота) в раннюю фолликулярную фазу менструального цикла.
На 5–6 день стимуляции, в зависимости от количества и размера растущих фолликулов, следует начинать введение антагониста ГнРГ. Антагонист ГнРГ применяется для предотвращения преждевременного повышения концентрации ЛГ. Также необходимо параллельно проводить определение концентрации эстрадиола в плазме крови.
На 8-й день стимуляции (через 7 дней после инъекции препарата Элонва®) терапия может быть продолжена ежедневным введением рФСГ, до тех пор пока не будет достигнут критерий индукции финального созревания ооцитов (наличие 3 фолликулов размерами ≥17 мм).
Суточная доза рФСГ зависит от ответа яичников, регулярно мониторирующегося во время трансвагинального ультразвукового обследования, начиная с 5–6 дня стимуляции. Если ответ нормальный, то рекомендуемая суточная доза составляет 150 ME рФСГ. В случае чрезмерного ответа яичников, инъекция рФСГ в день введения ХГЧ может быть пропущена, следует придерживаться рекомендаций по уменьшению риска развития синдрома гиперстимуляции яичников (СГЯ) (см. раздел «Особые указания»).
Обычно достаточное созревание фолликулов достигается на 9-й день введения рФСГ (в диапазоне от 6 до 18 дней).
При достижении 3 фолликулов размеров ≥17 мм в этот же или следующий день однократно вводится от 5000 ME до 10000 ME ХГЧ для индукции финального созревания ооцитов.
Применение в особых клинических группах пациенток
У пациенток с почечной недостаточностью
Клинических исследований препарата у пациенток с почечной недостаточностью не проводилось. Так как скорость выведения корифоллитропина альфа у таких пациенток может быть снижена, применение препарата Элонва® у женщин с почечной недостаточностью противопоказано.
У пациенток с печёночной недостаточностью
Хотя данные по применению препарата у пациенток с печёночной недостаточностью отсутствуют, влияние печёночной недостаточности на выведение корифоллитропина альфа маловероятно.
У детей и подростков до 18 лет
Показания к применению препарата Элонва® у детей и подростков в возрасте до 18 лет отсутствуют.
Способ применения
Препарат Элонва® предназначен только для подкожного введения.
Инъекции препарата Элонва® могут проводиться женщиной или её партнёром, если они обучены технике введения препарата. Самостоятельное введение препарата может выполняться только хорошо мотивированными женщинами, имеющими достаточную подготовку и возможность проконсультироваться с врачом в случае необходимости. Препарат можно вводить только, если раствор в шприце прозрачный.
Рекомендации для пациентов по подготовке и выполнению п/к инъекции
Компоненты шприца с иглой
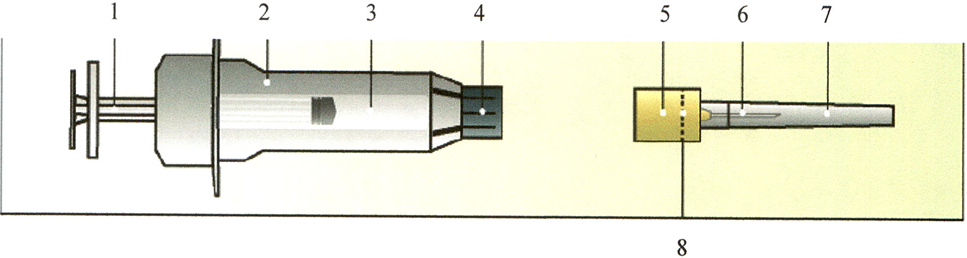
- Поршень
- Шприц
- Раствор
- Колпачок шприца
- Колпачок иглы
- Игла
- Футляр иглы
- Перфорация
Подготовка к инъекции
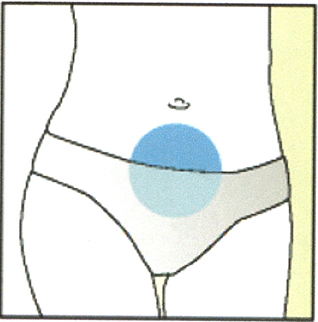
1. Обработайте кожу в месте предполагаемой инъекции дезинфицирующим средством.
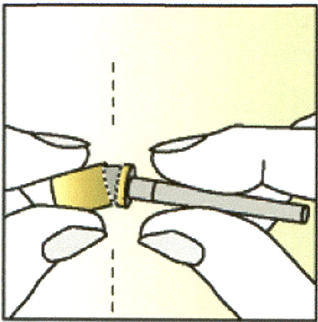
2. Сломайте колпачок иглы по линии перфорации, извлеките футляр, содержащий иглу.
НЕ снимайте футляр с иглы.
Положите футляр, содержащий иглу, на сухую чистую поверхность.
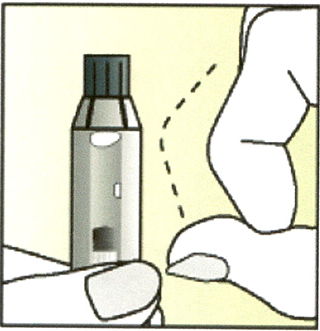
3. Держите шприц колпачком вверх (вертикально).
Осторожно постучите пальцем по шприцу, чтобы пузырьки воздуха поднялись вверх.
4. Держите шприц вертикально.
Открутите колпачок шприца против часовой стрелки.
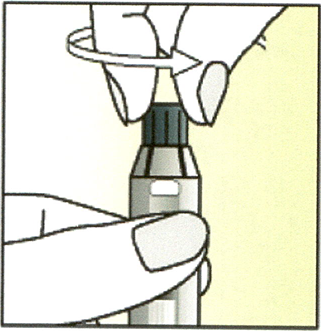
5. Держите шприц вертикально.
Прикрутите к нему футляр иглы, содержащий иглу, по часовой стрелке.
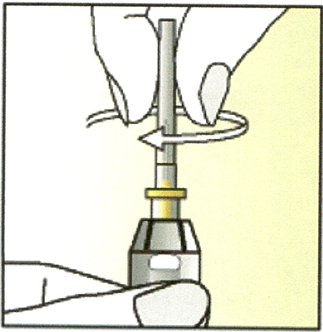
6. Держите шприц вертикально.
Снимите футляр с иглы и выбросьте его.
БУДЬТЕ ОСТОРОЖНЫ с иглой!
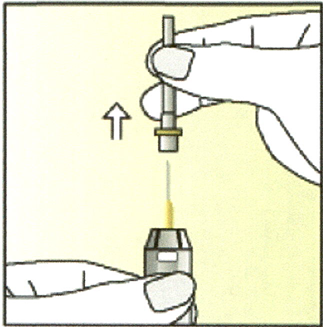
Выполнение инъекции
7. Зажмите шприц между указательным и средним пальцами и держите его вертикально.
Поместите большой палец на поршень.
ОСТОРОЖНО нажмите на поршень, чтобы на кончике иглы появилась капелька раствора.
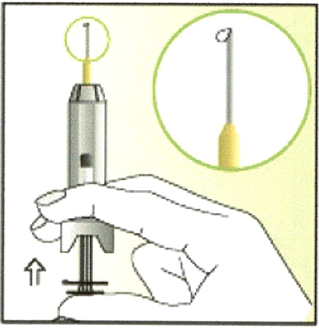
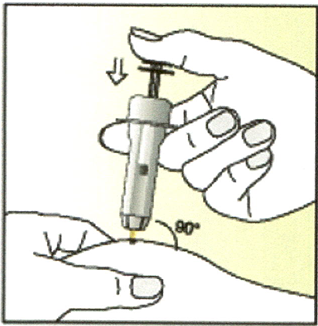
8. Большим и указательным пальцами сделайте кожную складку.
Полностью введите иглу под углом 90° в складку кожи.
ОСТОРОЖНО надавливайте на поршень до упора, после чего ДОСЧИТАЙТЕ ДО ПЯТИ, чтобы ввести весь раствор.
9. Уберите большой палец с поршня.
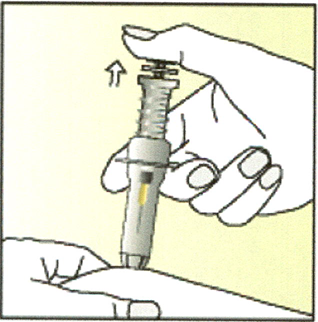
Игла автоматически уберётся в шприц и будет заблокирована.
Побочное действие
Основными нежелательными реакциями в клинических исследованиях (N=2397) при лечении препаратом Элонва® были дискомфорт в области малого таза (6,0 %), СГЯ (4,3 %), головная боль (4,0 %), боль в области малого таза (2,9 %), тошнота (2,3 %), утомляемость (1,5 %) и болезненность молочных желёз (1,3 %).
В таблице приведены основные нежелательные реакции (по системам органов и частоте), которые наблюдались при применении препарата в клинических исследованиях (часто (≥1 %, <10 %), нечасто (≥0,1 %, <1 %).
Класс система/орган | Частота | Нежелательные реакции |
Нарушения со стороны психики | Нечасто | Перепады настроения |
Нарушения со стороны нервной системы | Часто | Головная боль |
Нечасто | Головокружение | |
Нарушения со стороны сосудов | Нечасто | «Приливы» |
Нарушения со стороны желудочно-кишечного тракта | Часто | Тошнота |
Нечасто | Вздутие живота, рвота, диарея, запор | |
Нарушения со стороны скелетно-мышечной и соединительной ткани | Нечасто | Боль в спине |
Беременность, послеродовые и перинатальные состояния | Нечасто | Спонтанный выкидыш |
Нарушения со стороны половых органов и молочной железы | Часто | СГЯ, боль в области малого таза, дискомфорт в области малого таза, болезненность молочных желёз |
Нечасто | Перекрут яичника, болезненность в области придатков матки, преждевременная овуляция, боль в молочных железах | |
Общие расстройства и нарушения в месте введения | Часто | Утомляемость |
Нечасто | Гематома, боль в месте инъекции, болезненность при введении препарата, раздражение | |
Лабораторные и инструментальные данные | Нечасто | Повышение содержания АЛТ (аланинаминотрансферазы), ACT (аспартатаминотрансферазы) |
При пострегистрационном применении препарата были получены сообщения о реакциях гиперчувствительности, как локальных, так и генерализованных, включая сыпь.
Кроме того, описаны эктопическая беременность и многоплодная беременность, которые рассматриваются как осложнения ВРТ.
В редких случаях при применении препарата Элонва®, как и при применении других гонадотропинов, наблюдались тромбоэмболические осложнения.
Передозировка
Введение более одной рекомендованной дозы препарата Элонва® во время одного цикла контролируемой стимуляции яичников и/или применение рФСГ в слишком высоких дозах может привести к увеличению риска развития СГЯ. После введения препарата Элонва® вплоть до 8-го дня стимуляции не следует дополнительно применять препараты, содержащие ФСГ, поскольку это также может повысить риск развития СГЯ (см. раздел «Особые указания»).
Взаимодействие с другими лекарственными средствами
Взаимодействие с другими препаратами не изучалось. Корифоллитропин альфа не является субстратом для изоферментов цитохрома Р450, поэтому не ожидается взаимодействия с другими препаратами.
Препарат Элонва® может быть причиной ложноположительных тестов для определения беременности на основании оценки ХГЧ, если такие тесты проводятся во время стимуляции яичников в цикле ВРТ, Это может быть связано с перекрёстной реактивностью некоторых тестов на ХГЧ с карбокси-терминальным пептидом бета-субъединицы препарата Элонва®.
Особые указания
Оценка возможных причин бесплодия перед началом терапии
Перед началом применения препарата Элонва® следует провести диагностику причин бесплодия, как у женщины, так и у ее партнера, с выявлением возможных противопоказаний к беременности. Также необходимо проведение обследования женщины на наличие гипотиреоза, надпочечниковой недостаточности, гиперпролактинемии и опухолей гипоталамо-гипофизарной области, с последующим назначением соответствующей терапии при необходимости.
Рекомендации по применению препарата во время цикла стимуляции овуляции
Препарат Элонва® предназначен только для однократного п/к введения. Во время этого цикла не следует назначать дополнительные инъекции препарата Элонва® (см. раздел «Способ применения и дозы»).
После введения препарата Элонва® не следует дополнительно вводить препараты, содержащие ФСГ, вплоть до 8-го дня стимуляции (см. раздел «Способ применения и дозы»).
Почечная недостаточность
У пациенток с почечной недостаточностью скорость выведения корифоллитропина альфа может быть снижена. Применение препарата у таких пациенток противопоказано.
Применение с агонистом ГнРГ
Опыт применения препарата Элонва® в комбинации с агонистом ГнРГ ограничен. В связи с этим применять препарат Элонва® в сочетании с агонистом ГнРГ не рекомендуется.
Синдром гиперстимуляции яичников
СГЯ представляет собой состояние, отличающееся от неосложнённого увеличения яичников. К клиническим проявлениям СГЯ лёгкой или средней степени тяжести относятся боли в животе, тошнота, диарея, небольшое или умеренное увеличение яичников и кисты яичников. При тяжёлом течении СГЯ возможна угроза жизни. К клиническим проявлениям тяжёлого течения СГЯ относятся большие кисты яичников, острая боль в животе, асцит, плевральный выпот, гидроторакс, одышка, олигурия, изменения со стороны крови и увеличение массы тела. В редких случаях могут развиться венозные или артериальные тромбоэмболии. У пациенток с СГЯ наблюдались также случаи транзиторного изменения показателей функции печени, свидетельствующие о ее нарушении, которые не сопровождались или сопровождались морфологическими изменениями, выявленными при биопсии печени.
Развитие СГЯ может быть следствием применения ХГЧ или беременности (эндогенный ХГЧ). Ранний СГЯ обычно развивается в течение 10 дней после введения ХГЧ и может быть связан с избыточным ответом яичников на стимуляцию гонадотропином. Поздний СГЯ развивается спустя более 10 дней после введения ХГЧ вследствие гормональных изменений при беременности. Учитывая риск развития СГЯ, пациенток следует наблюдать в течение, по крайней мере, 2 недель после введения ХГЧ.
Женщины с известными факторами риска повышенного ответа яичников особенно склонны к развитию СГЯ во время либо после применения гонадотропинов, в том числе препарата Элонва®. Во время первого цикла стимуляции яичников, когда факторы риска известны лишь частично, требуется тщательный мониторинг ранней симптоматики СГЯ.
Необходимо следовать текущей клинической практике для уменьшения риска развития СГЯ во время применения ВРТ. Для уменьшения риска развития СГЯ важно придерживаться рекомендованных доз и схем применения препарата Элонва® и тщательно контролировать ответ яичников.
Для контроля риска развития СГЯ до начала и регулярно во время применения корифоллитропина альфа необходимо проводить ультразвуковой мониторинг растущих фолликулов, также необходимо параллельное определение концентрации эстрадиола в плазме крови. В программах ВРТ риск развития СГЯ повышен при наличии 18 и более фолликулов диаметром ≥11 мм.
В случае развития СГЯ необходимо следовать рекомендациям текущей клинической практики и проводить соответствующее наблюдение и лечение.
Перекрут яичника
После стимуляции овуляции с применением гонадотропинов, в том числе препарата Элонва®, наблюдались случаи перекрута яичника. Перекрут яичника может быть связан с другими состояниями, такими как СГЯ, беременность, перенесённые оперативные вмешательства на органах брюшной полости, перекрут яичника в прошлом и кисты яичников в настоящее время или в анамнезе. Ранняя диагностика и незамедлительное устранение перекрутя могут снизить повреждение яичника, связанное со снижением его кровоснабжения.
Многоплодная беременность
При применении всех препаратов гонадотропинов, включая препарат Элонва®, наблюдались случаи наступления многоплодной беременности и рождения близнецов. Перед началом лечения следует информировать женщину и её партнёра о возможном риске для матери (осложнения беременности и родов) и новорождённых (низкая масса тела при рождении), связанных с многоплодной беременностью. Риск многоплодной беременности у женщин, участвующих в процедурах ВРТ, в основном связан с количеством пересаженных эмбрионов.
Эктопическая беременность
У женщин с бесплодием, которым проводятся процедуры ВРТ, повышен риск эктопической беременности. В связи с этим, на ранних сроках беременности следует провести ультразвуковое исследование, чтобы подтвердить наличие маточной беременности и исключить внематочную беременность.
Врождённые пороки развития
Частота врождённых пороков развития после применения ВРТ несколько выше, чем после естественного оплодотворения. Это связывают с индивидуальными особенностями родителей (например, возраст женщины, характеристики спермы) и повышенной частотой многоплодной беременности.
Новообразования яичников и других органов репродуктивной системы
У женщин, получавших различные схемы лечения по поводу бесплодия, описаны случаи развития как доброкачественных, так и злокачественных опухолей яичников и других органов репродуктивной системы. Однако точно не установлена взаимосвязь лечения бесплодия гонадотропинами с повышенным риском развития таких опухолей.
Результаты небольшого неконтролируемого исследования показали, что в этом случае отмечается более сильный ответ со стороны яичников, чем при комбинации с антагонистом ГнРГ.
Сосудистые осложнения
Тромбоэмболические осложнения, связанные или не связанные с СГЯ, наблюдались при лечении гонадотропинами, включая препарат Элонва®. Внутрисосудистый тромбоз, который может развиться в венах или артериях, может привести к снижению кровоснабжения конечностей или жизненно важных органов. У женщин с факторами риска тромбоэмболических осложнений (тромбоэмболия в анамнезе, отягощённый семейный анамнез, ожирение или тромбофилия) лечение гонадотропинами может способствовать дальнейшему увеличению этого риска. В таких случаях необходимо оценить риск и пользу применения гонадотропинов. Следует отметить, что сама беременность повышает риск развития тромбоза.
Влияние на способность управлять транспортными средствами, механизмами
Не проводилось исследований для оценки влияния на способность управлять транспортными средствами и работать с механизмами. Препарат Элонва® может вызвать головокружение. Женщину следует предупредить, что при головокружении не следует управлять транспортными средствами и работать с механизмами.
Форма выпуска
Раствор для подкожного введения, 100 мкг/0,5 мл, 150 мкг/0,5 мл.
По 100 или 150 мкг активного вещества в растворе для подкожного введения по 0,5 мл, в одноразовом шприце объёмом 1 мл из бесцветного стекла типа I (Евр. Фарм.) с автоматической системой блокировки иглы.
Одноразовый шприц с одной стороны закупорен навинчивающимся пластиковым колпачком с резиновой прокладкой (Евр. Фарм.), а с другой стороны пластиковым поршнем с накрученной на нем резиновой поршневой пробкой (Евр. Фарм.).
1 одноразовый стерильный предварительно заполненный шприц с автоматической системой блокировки иглы в комплекте с 1 стерильной иглой в индивидуальной упаковке помещают в прозрачный пластиковый контейнер.
1 прозрачный пластиковый контейнер и инструкцию по применению помещают в картонную пачку, на пачке имеется контроль вскрытия упаковки.
Хранение
При температуре от 2 до 8 °С, в защищённом от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Vetter Pharma-Fertigung, GmbH & Co. KG, Германия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Элонва:
