Эйтоплазм
Лекарственная форма
лиофилизат для приготовления раствора для инфузий
Листок-вкладыш — информация для пациента
Эйтоплазм, 500 ME, лиофилизат для приготовления раствора для внутривенного введения.
Эйтоплазм, 1000 ME, лиофилизат для приготовления раствора для внутривенного введения.
Действующее вещество: фактор свёртывания крови Ⅷ
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Это позволит в короткий срок выявить новую информацию о безопасности. Обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях. Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нём содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его ещё раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу.
- Препарат назначен именно Вам. Не передавайте его другим людям. Он может навредить им, даже если симптомы их заболевания совпадают с Вашими.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Эйтоплазм, и для чего его применяют.
- О чём следует знать перед применением препарата Эйтоплазм.
- Применение препарата Эйтоплазм.
- Возможные нежелательные реакции.
- Хранение препарата Эйтоплазм.
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат Эйтоплазм, и для чего его применяют.
Препарат Эйтоплазм содержит действующее вещество — фактор свёртывания крови Ⅷ, который относится к группе лекарств, останавливающих кровотечение.
Показания к применению
Лечение и профилактика кровотечений у пациентов в возрасте от 12 лет и старше с врождённой гемофилией A или приобретённым дефицитом фактора свёртывания крови Ⅷ.
Способ действия препарата Эйтоплазм
Препарат Эйтоплазм содержит фактор свёртывания крови Ⅷ, полученный из плазмы крови человека. Попадая в кровь, фактор свёртывания крови Ⅷ вступает в реакции с другими факторами свёртывания крови. В результате образуется кровяной сгусток и происходит свёртывание крови.
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к врачу.
2. О чём следует знать перед применением препарата Эйтоплазм.
Противопоказания
Не применяйте препарат Эйтоплазм:
- если у Вас аллергия на человеческий фактор Ⅷ или какие-либо другие компоненты препарата, перечисленные в разделе 6 листка-вкладыша.
Если Вы считаете, что любое из перечисленного относится к Вам, сообщите об этом Вашему лечащему врачу.
Особые указания и меры предосторожности
Перед применением препарата Эйтоплазм проконсультируйтесь с лечащим врачом или работником аптеки или медицинской сестрой.
Обязательно предупредите Вашего лечащего врача, если что-либо из нижеуказанных пунктов относится к Вам:
- если у Вас аллергия на белок (например, молоко или яйца);
- если у Вас ранее определялся высокий уровень нейтрализующих антител (ингибиторов) к фактору Ⅷ;
- если у Вас есть факторы риска сердечно-сосудистых заболеваний (высокий уровень холестерина в крови, курение, низкая физическая активность, сахарный диабет, высокий уровень артериального давления).
Немедленно обратитесь за медицинской помощью, если во время лечения у Вас:
возникнут пятна или волдыри на коже (признаки крапивницы);
- возникнет чувство стеснения в грудной клетке, одышка, снижение артериального давления, обморок (признаки анафилаксии);
- возникнет отёк лица (губы, веки, щеки) и слизистой рта, затруднение дыхания, охриплость голоса, лающий кашель (признаки ангионевротического отёка);
- не получится контролировать кровотечение (признаки высокого уровня ингибиторов к фактору Ⅷ);
- боль, отёк, покраснение кожи в месте установки катетера, озноб, повышение температуры тела до 38 °C и выше (признаки инфекции в месте введения катетера, тромбоза катетера).
Если лекарственные препараты изготавливаются из крови или плазмы крови человека, принимаются специальные меры для предотвращения передачи возбудителей инфекционных заболеваний пациентам.
К ним относятся:
- тщательный отбор доноров крови или плазмы, чтобы не допустить к донорству носителей вирусных инфекций;
- испытание каждого образца крови или плазмы на наличие вирусов иммунологическими и молекулярно-генетическими методами;
- включение в обработку крови или плазмы стадий, способных инактивировать или удалять вирусы.
Несмотря на это, при введении лекарственных препаратов, изготовленных из крови или плазмы крови человека, нельзя исключить возможность передачи возбудителей инфекций, особенно в отношении неизвестных и новых вирусов, а также других патогенов.
Принятые меры считаются эффективными против таких оболочечных вирусов, как вирус иммунодефицита человека (ВИЧ), вирус гепатита B (ВГВ) и вируса гепатита C (ВГС). А также в отношении безоболочечного вируса гепатита А (ВГА). Принятые меры не считаются достаточными в отношении такого безоболочечного вируса, как парвовирус В19.
Инфицирование парвовирусом В19 опасно для беременных женщин (инфицирование плода) и для лиц с угнетением иммунной системы или некоторыми видами анемий (например, при серповидно-клеточной болезни или гемолитической анемии).
При каждом введении препарата Эйтоплазм, необходимо записывать название и номер серии препарата в целях сохранения истории использованных серий.
Если Вы регулярно (повторно) получаете препараты фактора Ⅷ, полученные из плазмы крови человека, врач может рекомендовать Вам пройти вакцинацию от гепатитов А и В.
Дети и подростки
Не вводите препарат детям от 0 до 12 лет, поскольку безопасность и эффективность применения лекарственного препарата Эйтоплазм у детей и подростков в возрасте до 12 лет не установлены. Данные отсутствуют.
Другие препараты и препарат Эйтоплазм
Сообщите лечащему врачу или работнику аптеки о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Беременность и грудное вскармливание
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом или работником аптеки.
Не применяйте препарат во время беременности и в период грудного вскармливания.
Управление транспортными средствами и работа с механизмами
Препарат Эйтоплазм не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
Препарат Эйтоплазм содержит натрий
Препарат Эйтоплазм, 500 ME содержит от 1,13 ммоль до 1,65 ммоль (от 26 мг до 38 мг) натрия на флакон.
Препарат Эйтоплазм, 1000 ME содержит от 1,13 ммоль до 1,65 ммоль (от 26 мг до 38 мг) натрия на флакон.
Необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия.
3. Применение препарата Эйтоплазм.
Лечение следует начинать под наблюдением врача, имеющего опыт в лечении гемофилии. Всегда применяйте препарат в полном соответствии с листком-вкладышем или с рекомендациями лечащего врача или работника аптеки. При появлении сомнений посоветуйтесь с лечащим врачом или работником аптеки.
Путь и (или) способ введения
Препарат следует вводить внутривенно, путём инъекции.
Рекомендуется соблюдать время введения от 2 до 5 минут, проверяя частоту пульса и прерывая введение или уменьшая скорость инъекции, если частота пульса увеличивается.
Для обучения технике внутривенной инъекции, необходимо обратиться к врачу или медицинской сестре.
Следует использовать только предоставленные наборы для инъекций / инфузий.
Если Вы применили препарата Эйтоплазм больше, чем следовало
Случаев передозировки не сообщалось.
Если Вы считаете, что применили препарата Эйтоплазм больше, чем следовало, немедленно обратитесь к врачу.
Если Вы забыли применить препарат Эйтоплазм
Если Вы забыли применить дозу в обычное время, примите пропущенную дозу, как только вспомните об этом. Если пришло время принять следующую дозу, не принимайте двойную дозу, чтобы компенсировать пропущенную.
Для определения продолжительности лечения необходимо проконсультироваться с врачом.
Не прекращайте применение препарата без консультации с врачом, так как симптомы заболевания могут вернуться.
При наличии вопросов по применению препарата обратитесь к лечащему врачу или работнику аптеки.
4. Возможные нежелательные реакции.
Подобно всем лекарственным препаратам препарат Эйтоплазм может вызывать нежелательные реакции, однако они возникают не у всех.
Прекратите применение препарата Эйтоплазм и немедленно обратитесь за медицинской помощью, если заметите следующие симптомы:
Редко - могут возникать не более чему 1 человека из 1 000:
- отёк лица (губы, веки, щеки) и слизистой рта, затруднение дыхания, свистящее дыхание, охриплость голоса, лающий кашель — признаки ангионевротического отёка;
- пятна или волдыри на коже — признаки крапивницы.
Очень редко — могут возникать не более чем у 1 человека из 10 000:
- чувство стеснения в грудной клетке, одышка, снижение артериального давления, обморок
- признаки анафилактического шока.
Другие возможные нежелательные реакции, которые могут наблюдаться при применении препарата Эйто плазм
Редко - могут возникать не более чему 1 человека из 1 000:
- повышение температуры тела.
Неизвестно — исходя из имеющихся данных частоту возникновения определить невозможно
- головная боль.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом или работником аптеки. К ним также относятся любые нежелательные реакции, не указанные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1
Тел.: +7 (499) 578-06-70, +7 (499) 578-02-20, +7 (800)-550-99-03
Факс: +7 (495)698-15-73
Электронная почта: pharm@roszdravnadzor. gov.ru
www.roszdravnadzor.gov.ru
5. Хранение препарата Эйтоплазм.
Храните препарат в недоступном для ребёнка месте так, чтобы ребёнок не мог увидеть его.
Не применяйте препарат после истечения срока годности (срока хранения), указанного упаковке после «Годен до:».
Датой истечения срока годности является последний день месяца.
Храните и перевозите препарат в холодильнике (2–8 °C), в оригинальной упаковке (флакон в пачке).
Не выбрасывайте лекарственные препараты в канализацию. Уточните у работника аптеки, как избавиться от препаратов, которые больше не потребуются. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведение.
Препарат Эйтоплазм содержит
Эйтоплазм, 500 ME, лиофилизат для приготовления раствора для внутривенного введения Действующим веществом является фактор свёртывания крови Ⅷ.
Каждый флакон содержит 500 международных единиц (ME) фактора свёртывания крови Ⅷ.
Прочими ингредиентами (вспомогательными веществами) являются: натрия хлорид, натрия цитрат дигидрат, глицин, кальция хлорид дигидрат.
Эйтоплазм, 1000 ME, лиофилизат для приготовления раствора для внутривенного введения Действующим веществом является фактор свёртывания крови Ⅷ.
Каждый флакон содержит 1000 международных единиц (ME) фактора свёртывания крови Ⅷ.
Прочими ингредиентами (вспомогательными веществами) являются: натрия хлорид, натрия цитрат дигидрат, глицин, кальция хлорид дигидрат.
Растворитель (вода для инъекций).
Внешний вид препарата Эйтоплазм и содержимое упаковки
Лиофилизат для приготовления раствора для внутривенного введения.
Препарат представляет собой белый или бледно-жёлтый порошок или рыхлое твёрдое вещество.
После растворения — прозрачный или слегка опалесцирующий бесцветный или светло- жёлтый раствор.
Эйтоплазм, 500 ME, лиофилизат для приготовления раствора для внутривенного введения
По 500 ME во флаконы нейтрального стекла, укупоренные пробками хлорбутиловыми с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия. На каждый флакон наклеивают этикетку самоклеящуюся.
Растворитель (вода для инъекций)
По 10 мл во флаконы нейтрального стекла, укупоренные колпачками комбинированными из алюминия и пластмассы с элементом эластомерным. На каждый флакон наклеивают этикетку самоклеящуюся.
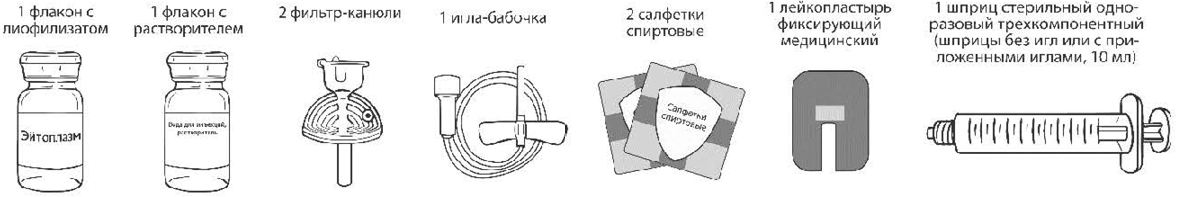
Комплект для растворения и внутривенного введения:
- 1 шприц стерильный одноразовый трёхкомпонентный (шприцы без игл или с приложенными иглами, 10 мл);
- 2 фильтр-канюли 0,45 мкм;
- 1 игла-бабочка, 0,65x20 мм с удлинителем;
- 1 лейкопластырь фиксирующий медицинский;
- 2 салфетки спиртовые.
Все компоненты комплекта для растворения и внутривенного введения стерильные, в индивидуальных герметичных упаковках.
1 флакон с препаратом, 1 флакон с растворителем и комплект для растворения и внутривенного введения вместе с листком-вкладышем помещают в пачку картонную.
Эйтоплазм, 1000 ME, лиофилизат для приготовления раствора для внутривенного введения
По 1000 ME во флаконы нейтрального стекла, укупоренные пробками хлорбутиловыми с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия. На каждый флакон наклеивают этикетку самоклеящуюся.
Растворитель (вода для инъекций)
По 10 мл во флаконы нейтрального стекла, укупоренные колпачками комбинированными из алюминия и пластмассы с элементом эластомерным. На каждый флакон наклеивают этикетку самоклеящуюся.
Комплект для растворения и внутривенного введения:
- 1 шприц стерильный одноразовый трёхкомпонентный (шприцы без игл или с приложенными иглами, 10 мл);
- 2 фильтр-канюли 0,45 мкм;
- 1 игла-бабочка, 0,65x20 мм с удлинителем;
- 1 лейкопластырь фиксирующий медицинский;
- 2 салфетки спиртовые.
Все компоненты комплекта для растворения и внутривенного введения стерильные, в индивидуальных герметичных упаковках.
1 флакон с препаратом, 1 флакон с растворителем и комплект для растворения и внутривенного введения вместе с листком-вкладышем помещают в пачку картонную.
Держатель регистрационного удостоверения и производитель
Российская Федерация
Открытое акционерное общество «Фармстандарт-Уфимский витаминный завод»
(ОАО «Фармстандарт-УфаВИТА»)
Адрес: 450077, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Тел./факс: (347) 272-92-85
Адрес электронной почты: info@pharmstd.ru
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к держателю регистрационного удостоверения.
Представитель держателя регистрационного удостоверения
Российская Федерация
Открытое акционерное общество «Фармстандарт-Уфимский витаминный завод»
(ОАО «Фармстандарт-УфаВИТА»)
Адрес: 450077, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Тел./факс: (347) 272-92-85
Адрес электронной почты: info@pharmstd.ru
Листок-вкладыш пересмотрен
Представленные данные о лекарственном препарате в течение 1 года будут проверяться и дополняться новыми сведениями, и по мере необходимости листок-вкладыш будет обновляться.
Прочие источники информации
Подробные сведения о препарате содержатся на веб-сайте Союза: https://eec.eaeunion.org
(линия отрыва или отреза)
Следующие сведения предназначены исключительно для медицинских работников
Приготовление и работа с препаратом
Общие положения
- Тщательно вымойте руки перед проведением нижеописанных процедур и выполняйте правила асептики в процессе приготовления и введения раствора препарата.
- Открытые медицинские материалы используйте, по возможности, быстро, чтобы сократить до минимума время их контакта с атмосферным воздухом.
- Достаньте флакон с препаратом и растворителем (вода для инъекций) из холодильника и слегка нагрейте, например, подержав их в руках. Не допускается нагревание препарата выше 37 °C.
- Поставьте оба флакона на чистую ровную поверхность.
- Снимите защитную пластиковую накладку с каждого флакона.
- Обработайте пробки флаконов салфеткой спиртовой. Дайте им высохнуть перед использованием. Не прикасайтесь руками или другими предметами к обработанным поверхностям.
Откройте блистерную упаковку фильтр-канюли. Снимите защитный колпачок е иглы фильтр-канюли (рис.1).
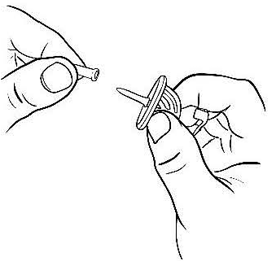
Рисунок 1.
Введите пластиковую иглу фильтр-канюли вертикально в центр пробки флакона с растворителем до упора (рис. 2).
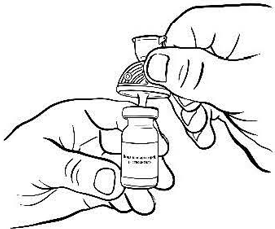
Рисунок 2.
Откройте блистерную упаковку шприца, отогнув до середины бумажное покрытие, и вставьте шприц с резьбой в отверстие фильтр-канюли, открыв защитную крышечку (рис. 3). Поворачивайте шприц по часовой стрелке, пока не почувствуете лёгкое сопротивление. Убедитесь в плотности соединения.
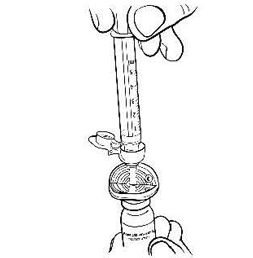
Рисунок 3.
Переверните флакон вверх дном и отберите в шприц 10 мл растворителя, плавно оттягивая поршень (рис. 4). Убедитесь, что объём растворителя, перемещённого в шприц, составляет 10 мл.
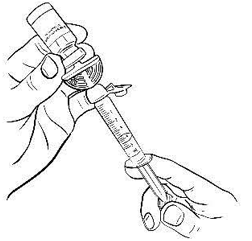
Рисунок 4.
- Отсоедините заполненный шприц из фильтр-канюли, поворачивая против часовой стрелки.
Откройте блистерную упаковку второй фильтр-канюли, затем откройте защитную крышечку фильтр-канюли и вставьте в отверстие фильтр-канюли шприц с набранным растворителем, поворачивая шприц по часовой стрелке. Введите пластиковую иглу фильтр- канюли вертикально в центр пробки флакона с препаратом до упора. Растворитель автоматически переместиться во флакон. Нажмите до упора на поршень шприца чтобы убедиться, что растворитель полностью переместился во флакон с препаратом (рис. 5).
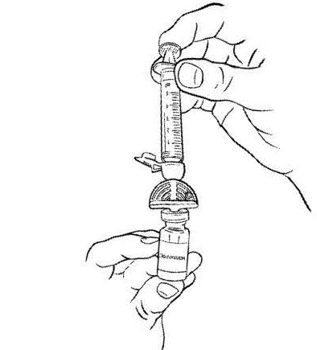
Рисунок 5.
Осторожно покачивайте флакон круговыми движениями, пока всё вещество не растворится (рис. 6). Не встряхивайте флакон. Убедитесь в том, что порошок полностью растворился. При наличии любых включений или мутности не используйте раствор.
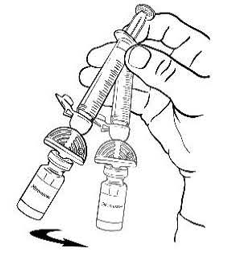
Рисунок 6.
Держа флакон в слегка наклонённом положении, отберите из него весь раствор в шприц через фильтр-канюлю, медленно и плавно оттягивая поршень. Убедитесь в том, что весь приготовленный раствор перешёл в шприц. Удалите воздух из шприца, перевернув флакон вверх дном (рис. 7).
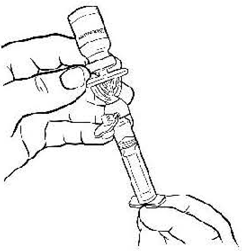
Рисунок 7.
- Не меняя положения поршня (см. п. 14), удалите наполненный шприц из фильтр-канюли, поворачивая против часовой стрелки.
- Откройте блистерную упаковку иглы-бабочки для периферических вен.
Снимите защитную заглушку с трубки иглы-бабочки. Присоедините шприц к игле- бабочки поворачивая по часовой стрелке (рис.8). Убедитесь в плотности соединения.
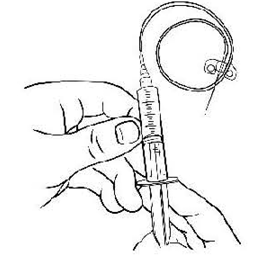
Рисунок 8.
- Снимите защитный колпачок с иглы-бабочки. Удалите воздух из присоединенной системы.
- Обработайте место инъекции прилагаемой салфеткой спиртовой и введите раствор внутривенно струйно, медленно (в течение 2–5 минут), закрепив иглу лейкопластырем фиксирующим медицинским.
- По окончанию введения раствора обеспечьте безопасную утилизацию всех использованных материалов.
Если необходимо ввести несколько флаконов препарата Эйтоплазм, аналогичным образом приготовьте раствор во флаконе из другой упаковки, используя прилагаемые растворитель, фильтр-канюли и шприц, а затем введите препарат в обычном порядке, последовательно меняя предварительно наполненные шприцы.
Комплект расходных медицинских материалов
Приготовленный раствор должен использоваться сразу после разведения. Если инъекция по какой-либо причине откладывается, флакон с раствором препарата следует хранить при температуре от 2 до 8 °C не более 3 часов без замораживания. Неиспользованный за это время раствор не должен применяться, он подлежит утилизации.
Несовместимость
В связи с отсутствием исследований совместимости, данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Режим дозирования
Терапия «по требованию»
Расчёт требуемой дозы основывается на эмпирически выявленной закономерности, согласно которой 1 ME фактора свёртывания крови Ⅷ на килограмм массы тела повышает активность фактора Ⅷ в плазме крови на 1,5–2 % от исходной активности.
Необходимая доза рассчитывается по следующей формуле:
Необходимая доза = масса тела (кг) × желаемое повышение уровня ФⅧ (%) (МЕ/дл) × 0,5
При расчёте количества вводимого препарата и определения частоты введений следует всегда ориентироваться на клиническую эффективность в каждом конкретном случае.
При развитии перечисленных ниже кровотечений активность фактора Ⅷ за соответствующий период не должна опускаться ниже указанного уровня активности в плазме крови (в % от нормального уровня или МЕ/дл). Представленная таблица может быть использована для расчёта дозы препарата при эпизодах кровотечений и хирургических вмешательствах:
| Тяжесть кровотечения или тип хирургического вмешательства | Необходимый уровень ФⅧ в плазме (% от нормы или МЕ/дл) | Частота введения и длительность терапии |
| Кровотечения | ||
| Ранние гемартрозы, внутримышечные кровотечения, кровотечения в ротовой полости | 20–40 | Повторяют каждые 12–24 ч. Не менее 1 дня, до купирования боли или заживления |
| Более обширные гемартрозы, внутримышечные кровотечения или гематомы | 30–60 | Повторяют введения каждые 12–24 ч в течение 3–4 дней или более до купирования боли и восстановления трудоспособности |
| Кровоизлияния, представляющие угрозу для жизни | 60–100 | Повторяют введения каждые 8–24 ч до устранения угрозы жизни |
| Хирургические вмешательства | ||
| Малые, включая удаление зубов | 30–60 | Каждые 24 ч, не менее 1 дня, до заживления |
| Обширные | 80–100 (до и после операции) | Повторяют введения каждые 8–24 ч, до адекватного заживления раны, затем не менее 7 дней для поддержания активности ФⅧ на уровне 30–60 % (МЕ/дл) |
Профилактика
При проведении длительной профилактики кровотечений у пациентов с тяжёлой формой гемофилии А препарат обычно назначают в дозе 20–40 МЕ/кг массы тела с интервалами 2–3 дня. В отдельных случаях, особенно у молодых пациентов, может потребоваться сокращение интервалов между введениями или введение более высоких доз.
Передозировка
О симптомах передозировки фактора Ⅷ свёртывания плазмы крови человека не сообщалось.
Контроль проведения лечения
При проведении курса лечения необходимо контролировать уровень фактора Ⅷ для расчёта вводимой дозы и частоты повторного введения препарата. Пациенты могут индивидуально реагировать на введение фактора Ⅷ, при этом может наблюдаться различный период полувыведения и восстановления. Доза, рассчитанная с учётом массы тела, может потребовать корректировки у пациентов с недостаточной или избыточной массой тела. Проведение точного контроля заместительной терапии при помощи анализа на свёртываемость крови (активность фактора Ⅷ в плазме) является обязательным, особенно при обширных хирургических вмешательствах.
При использовании одноэтапного in vitro анализа для определения активности фактора Ⅷ в образцах крови пациентов клоттинговым методом на основе активированного частичного тромбопластинового времени (АЧТВ) полученные результаты активности фактора Ⅷ в значительной степени зависят как от типа АЧТВ-реагента, так и от стандарта, используемого в проведении анализа. Также возможно значительное расхождение между результатами, полученными с использованием одноэтапного анализа клоттинговым методом на основе АЧТВ и полученными с использованием анализа хромогенным методом. Это важно учитывать, особенно при смене лаборатории и/или реагентов, используемых в анализе.
Ингибиторы
Выработка нейтрализующих антител (ингибиторов) к фактору Ⅷ является известным осложнением при лечении пациентов с гемофилией А. Эти ингибиторы обычно представляют собой иммуноглобулины класса G (IgG), направленные против прокоагулянтной активности фактора Ⅷ, содержание которых определяется в единицах Бетезда (BU) на миллилитр плазмы с использованием модифицированного метода определения. Риск выработки ингибиторов коррелирует со степенью тяжести заболевания, а также с воздействием фактора Ⅷ, этот риск является наибольшим в течение первых 50 дней применения, но сохраняется в течение всей жизни, хотя встречается нечасто.
Клиническая значимость выработки ингибитора будет зависеть от титра ингибитора, при этом низкий титр определяет меньший риск недостаточного клинического ответа, чем высокий титр ингибиторов.
В целом все пациенты, получающие лечение препаратами фактора свёртывания крови Ⅷ, должны тщательно контролироваться на предмет появления ингибиторов с помощью соответствующих клинических наблюдений и лабораторных испытаний.
Если ожидаемый уровень активности фактора Ⅷ в плазме не достигнут, или если кровотечение не удаётся контролировать при применении адекватной дозы препарата, следует провести исследование на наличие ингибитора фактора Ⅷ. У пациентов с высокими уровнями ингибитора лечение фактором Ⅷ может быть неэффективным, и следует рассмотреть вопрос о применении других методов лечения.
Лечение таких пациентов должно проводиться под наблюдением врачей с опытом лечения гемофилии при наличии ингибиторов к фактору Ⅷ.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий, 500 МЕ, 1000 МЕ.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Эйтоплазм:
