Фактор VII
Factor VIIРегистрационный номер
Торговое наименование
Фактор VII
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
Один флакон с лиофилизатом содержит:
|
Компонент |
Количество |
|
Действующее вещество: |
|
|
600 ME** |
|
|
Вспомогательные вещества: |
|
|
Натрия цитрата дигидрат |
40 мг |
|
80 мг |
|
|
не более 0,5 МЕ/МЕ фактора VII |
Один флакон с растворителем содержит:
|
Компонент |
Количество |
|
10 мл |
* Активность FVII определяли относительно международного стандартного образца концентрата FVII Всемирной организации здравоохранения (ВОЗ).
**По общему содержанию белка 50–200 мг/флакон.
Описание
Лиофилизат: порошок или ломкая твёрдая масса белого или светло-жёлтого цвета.
Растворитель: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Фактор Ⅶ — один из витамин К-зависимых факторов нормальной человеческой плазмы, компонент внешнего пути системы свёртывания крови. Он представляет собой одноцепочечный гликопротеин с молекулярной массой около 50 000 Дальтон. Фактор Ⅶ является зимогеном сериновой протеазы фактора VIIa (активной сериновой протеазы), который запускает внешний путь системы свёртывания крови. Комплекс тканевой фактор-фактор VIIa активирует факторы свёртывания крови IX и X, в результате чего образуются факторы IXa и Xa. При дальнейшем развёртывании коагуляционного каскада образуется тромбин, фибриноген превращается в фибрин, и формируется сгусток. Нормальное образование тромбина является также исключительно важным для тромбоцитарной функции, как части системы гемостаза. Врождённый дефицит фактора Ⅶ является заболеванием, которое наследуется по аутосомно-рецессивному типу. Применение фактора Ⅶ человека обеспечивает повышение концентрации фактора Ⅶ в плазме и может временно устранить дефект свёртывания крови у пациентов с дефицитом фактора Ⅶ.
Фармакокинетика
При внутривенном введении фактора Ⅶ его концентрация в плазме крови пациента повышается до 60-100 % со средним периодом полувыведения примерно 3–5 часов. В таблице ниже приведены результаты фармакокинетического исследования «Восстановление и период
полувыведения нагретого паром концентрата фактора Ⅶ» с предоставлением следующих фармакокинетических данных: увеличение концентрации препарата в плазме после введения (IR), площадь под кривой (AUC), среднее время удержания (MRT), клиренс (С1), объём распределения в равновесном состоянии (Vss), период полувыведения (HL) в начальной фазе (HL1) и в конечной фазе (HL2).
Результаты:
|
|
IR |
AUC |
MRT |
С1 |
Vss |
HL |
HL1 |
HL2 |
|
Мин |
1,6 |
1,9 |
3,8 |
100 |
503 |
2,7 |
0,21 |
2,5 |
|
Q1 |
1,7 |
3,9 |
5,5 |
206 |
1345 |
3,8 |
0,68 |
2,7 |
|
Медиана |
1,9 |
4,3 |
6,9 |
326 |
1893 |
4,8 |
1,19 |
3,1 |
|
Q3 |
3,0 |
7,2 |
7,4 |
396 |
3377 |
5,1 |
1,87 |
5,3 |
|
Макс |
3,4 |
9,8 |
15,1 |
531 |
6410 |
10,5 |
2,79 |
10,8 |
Данные доклинической безопасности
Фактор свёртывания крови Ⅶ человека, входящий в состав препарата Фактор VII, является естественным компонентом плазмы крови человека и действует подобно эндогенному фактору VII.
Исследования токсичности при однократном введении не релевантны в связи с возникновением у животных перегрузки объёмом при введении высоких доз. Исследования токсичности при повторном (многократном) введении на животных не представляются возможным в связи с образованием антител к гетерологичным белкам, затрудняющих проведение последующих исследований.
В связи с отсутствием клинических данных канцерогенного или мутагенного действия, проведение экспериментальных исследований, особенно на гетерологичных видах, не считается необходимым.
Показания
Лекарственный препарат Фактор Ⅶ показан:
- при лечении нарушений свёртывания крови, вызванных изолированной наследственной недостаточностью фактора VII;
- для профилактики нарушений свёртывания крови, вызванных изолированной наследственной недостаточностью фактора VII, при кровотечениях в анамнезе и остаточной концентрации фактора Ⅶ ниже 25 % (0,25 МЕ/мл).
Препарат не содержит значительного количества фактора VIIa и не должен применяться у пациентов с гемофилией с ингибиторами.
Противопоказания
- гиперчувствительность к фактору свёртывания крови Ⅶ или к любому из действующих веществ;
- высокий риск тромбоза или диссеминированного внутрисосудистого свёртывания (ДВС);
- известная аллергия на гепарин или гепарин-индуцированная тромбоцитопения в анамнезе.
Применение при беременности и в период грудного вскармливания
Беременность
Безопасность человеческого фактора свёртывания Ⅶ при использовании во время беременности не подтверждена контролируемыми клиническими исследованиями. Данные отсутствуют.
Исследований репродуктивной токсичности на животных недостаточно (см. раздел «Данные доклинической безопасности»). Необходим индивидуальный подход к ведению беременности и контролю состояния пациентки, а также к оценке эффективности лечения. Применение препарата Фактор Ⅶ у беременных требует соблюдения мер предосторожности. Информация о рисках, связанных с потенциальной опасностью инфицирования беременных женщин парвовирусом B19, приведена в разделе «Особые указания».
Фертильность
Влияние препарата Фактор Ⅶ на фертильность не изучалось в контролируемых клинических исследованиях. Данные отсутствуют.
Способ применения и дозы
Режим дозирования
Лечение препаратом Фактор Ⅶ должен проводить только врач, имеющий опыт применения заместительной терапии факторами свёртывания.
Поскольку заболевание является редким, то доступны лишь ограниченные данные о клиническом применении препаратов фактора VII. По этой причине можно дать только общие рекомендации по дозированию, в то время как индивидуальную потребность в дозе препарата можно определить только основываясь на регулярном определении уровня фактора Ⅶ в плазме и постоянном мониторинге клинического состояния пациента.
Дозы и продолжительность заместительной терапии зависят от тяжести дефицита фактора VII, локализации и степени тяжести эпизодов кровотечения, а также клинического состояния больного. Связь между остаточной концентрацией фактора Ⅶ и склонностью к кровотечениям у некоторых пациентов менее однозначна, чем при классической гемофилии. Количество вводимых единиц препарата Фактор Ⅶ выражается в Международных Единицах (ME), соответствующих существующему стандарту ВОЗ для препаратов фактора VII. Активность фактора Ⅶ в плазме выражается либо в процентах (относительно нормальной плазмы), либо в Международных Единицах (относительно Международного стандарта фактора Ⅶ плазмы).
Одна ME активности фактора Ⅶ эквивалентна величине активности фактора Ⅶ в 1 мл нормальной человеческой плазмы.
Расчёт требуемой дозы основан на эмпирическом наблюдении, согласно которому 1 ME фактора Ⅶ на килограмм массы тела увеличивает активность фактора Ⅶ в плазме крови примерно на 1,9 % (0,019 МЕ/мл) относительно нормального уровня активности.
Требуемая доза определяется с помощью следующей формулы:
Требуемая доза (ME) = масса тела (кг) × желаемое повышение активности фактора Ⅶ (МЕ/мл) х 53* {единица, поделённая на наблюдаемое восстановление (мл/кг)}
*(поскольку 1: 0,019 = 52,6)
Если известно восстановление в конкретном случае, то для расчёта следует использовать это значение.
В каждом отдельном случае количество препарата, которое необходимо ввести, и частота применения всегда должны соотноситься с клинической эффективностью. Это особенно важно при лечении недостаточности фактора VII, поскольку индивидуальная склонность к кровотечениям не зависит строгим образом от активности фактора Ⅶ в плазме, измеренной с помощью лабораторных проб. Интервалы между дозами должны учитывать короткий период полувыведения фактора Ⅶ из циркуляторного русла, составляющий от 3 до 5 часов. При применении препарата Фактор Ⅶ в виде интермиттирующих инъекций/инфузий целесообразно делать интервалы между дозами от 6 до 8 часов. Обычно при лечении дефицита фактора Ⅶ требуются (в зависимости от активности в нормальной плазме) более низкие дозы недостающего фактора по сравнению с классической гемофилией (гемофилия А и В). Ниже в таблице представлены примерные рекомендации по применению интермиттирующих инъекций/инфузий, выработанные исходя из имеющегося ограниченного клинического опыта.
|
Степень кровотечения / Тип хирургического вмешательства |
Требуемая концентрация фактора Ⅶ МЕ/мл* |
Частота введения (часы) /Длительность терапии (дни) |
|
Лёгкое кровотечение |
0,10–0,20 |
Однократное введение |
|
Тяжёлое кровотечение |
0,25–0,40 (низшая-высшая концентрация) |
В течение 8–10 дней или до полного прекращения кровотечения** |
|
Малые хирургические вмешательства |
0,20–0,30 |
Однократная доза перед хирургической операцией или, если предполагаемый риск кровотечения более очевиден, — до заживления раны* |
|
Обширные хирургические вмешательства |
Перед операцией >0,50, затем 0,25–0,45 (низшая-высшая концентрации) |
В течение 8–10 дней или до полного заживления раны** |
* 1 МЕ/мл =100 МЕ/дл =100 % нормальной плазмы. Активность фактора Ⅶ в плазме выражается либо в процентах (относительно содержания в нормальной плазме, принятого за 100 %), либо в Международных Единицах (относительно международного стандарта для фактора Ⅶ в плазме).
** Исходя из клинической оценки в каждом случае, ближе к концу лечения могут быть достаточными более низкие дозы при условии достижения адекватного гемостаза.
Интервалы между введениями должны быть адаптированы к короткому периоду полувыведения фактора Ⅶ из кровотока, который равен приблизительно 3–5 часам.
Когда необходимо поддерживать высокий уровень фактора Ⅶ в течение продолжительного времени, необходимо введение доз с интервалом 8–12 часов.
Дети
Безопасность и эффективность Фактора Ⅶ у детей в возрасте до 6 лет на данный момент не установлены.
Способ применения
Препарат Фактор Ⅶ вводится внутривенно в виде интермиттирующих инъекций или инфузий. При применении в виде инфузии следует использовать только прилагаемую инфузионную систему. Раствор вводят медленно (не более 2 мл/мин).
Восстановление препарата Фактор Ⅶ необходимо проводить непосредственно перед использованием. После восстановления препарат Фактор Ⅶ следует использовать немедленно, поскольку он не содержит консервантов.
Для восстановления и введения препарата необходимо использовать набор для растворения и введения, содержащийся в упаковке с препаратом, так как использование некоторых видов изделий для инъекций/инфузий может привести к неэффективности лечения за счёт адсорбции фактора свёртывания Ⅶ на их внутренней поверхности.
Восстановленный препарат следует визуально проверить на наличие взвешенных частиц и изменение цвета перед введением. Раствор должен быть от бесцветного до слегка желтоватого и от прозрачного до слегка опалесцирующего. В случае обнаружения посторонних частиц, изменения цвета или помутнения, препарат не должен использоваться.
Восстановление лиофилизата
- Подогреть неоткрытый флакон с растворителем до комнатной температуры, но не более чем до 37 °C.
- Удалить пластмассовые крышки с флаконов с лиофилизатом и с растворителем (рис. А) и протереть пробки обоих флаконов.
- Удалить, вращая и снимая, защитное покрытие с одного конца прилагаемой иглы для переноса (рис. Б). Ввести открытую иглу через резиновую пробку во флакон с растворителем (рис. В).
- Удалить защитное покрытие с другого конца иглы для переноса, не касаясь поверхности иглы.
- Перевернуть флакон с растворителем вертикально над флаконом с лиофилизатом и ввести свободный конец иглы для переноса через резиновую пробку флакона с концентратом (рис. Г). Растворитель будет поступать во флакон с лиофилизатом под действием вакуума.
- Разъединить два флакона, вынув иглу из пробки флакона с лиофилизатом (рис. Д). Аккуратно встряхивать и вращать флакон с лиофилизатом для ускорения растворения.
- По завершении восстановления препарата ввести прилагаемую аэрационную иглу (рис. Е) и дать пене полностью осесть. Извлечь аэрационную иглу.
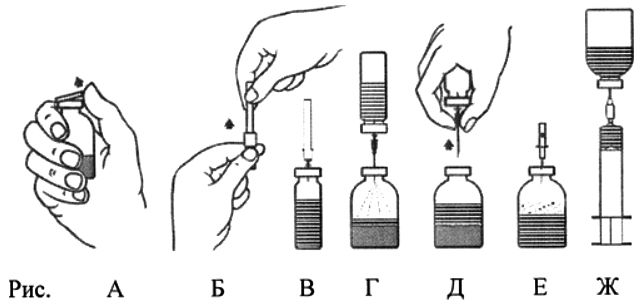
Способ введения
- Удалить, вращая и снимая, защитное покрытие с одного конца прилагаемой фильтрующей иглы, и насадить её на стерильный одноразовый шприц. Набрать раствор в шприц (рис. Ж).
- Отсоединить фильтрующую иглу от шприца и выполнить медленное внутривенное введение раствора (максимальная скорость введения: 2 мл/мин) с помощью системы для трансфузии (или прилагаемой одноразовой иглы).
Неиспользованный препарат и отработанный материал должен быть уничтожен в соответствии с локальными требованиями.
Побочное действие
Нежелательные реакции, наблюдавшиеся в клинических исследованиях
Нежелательные реакции, встречавшиеся в ходе проведения клинических исследований, перечислены в соответствии со следующей градацией: очень часто (≥1/10); часто (≥1/100-<1/10); нечасто (≥1/1000-<1/100); редко (≥1/10 000-<1/1000); очень редко (<1/10 000, включая единичные сообщения).
В таблице ниже представлены нежелательные реакции, отмечавшиеся в ходе клинического исследования, включающего 57 взрослых пациентов и детей с наследственной недостаточностью фактора VII, которым вводился препарат Фактор Ⅶ для контроля острых случаев кровотечений, в рамках хирургического вмешательства и для долговременной профилактики кровотечений. В ходе данного исследования препарат Фактор Ⅶ вводился в течение 8234 дней.
|
Системно-органный класс |
Нежелательная реакция (Предпочтительный термин MedDRA) |
Частота на пациента |
|
Нарушения со стороны крови и лимфатической системы |
Ингибирование фактора Ⅶ (наличие антител к фактору VII) |
Частота неизвестна |
|
Нарушения со стороны иммунной системы |
Реакция гиперчувствительности |
Частота неизвестна |
|
Психические расстройства |
Состояние спутанности сознания |
Частота неизвестна |
|
Бессонница |
Частота неизвестна |
|
|
Беспокойство |
Частота неизвестна |
|
|
Нарушения со стороны нервной системы |
Тромбоз мозговых вен |
Частота неизвестна |
|
Головокружение |
Частота неизвестна |
|
|
Дизестезия |
Частота неизвестна |
|
|
Головная боль |
Частота неизвестна |
|
|
Нарушения со стороны сердца |
Аритмия |
Частота неизвестна |
|
Артериальная гипотензия |
Частота неизвестна |
|
|
Сосудистые нарушения |
Гиперемия |
Частоа |
|
Тромбоз глубоких вен |
Частота неизвестна |
|
|
Поверхностный тромбофлебит |
Частота неизвестна |
|
|
Прилив жара |
Частота неизвестна |
|
|
Тромбоз глубоких вен |
Частота неизвестна |
|
|
Приливы |
Частота неизвестна |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Бронхоспазм |
Частота неизвестна |
|
Одышка |
Частота неизвестна |
|
|
Нарушения со стороны желудочно-кишечного тракта |
Диарея |
Частота неизвестна |
|
Тошнота |
Частота неизвестна |
|
|
Нарушения со стороны кожи и подкожных тканей |
Кожная сыпь |
Частоа |
|
Кожный зуд |
Частота неизвестна |
|
|
Общие нарушения и реакции в месте введения |
Гипертермия |
Частоа |
|
Боль в грудной клетке |
Частоа |
|
|
Нарушение самочувствия6 |
Частоа |
|
|
Дискомфорт в грудной клетке |
Частота неизвестна |
а Показатель «частота» определялся исходя из количества пациентов, у которых наблюдалось данное нежелательное явление, оценённое исследователем как, по крайней мере, возможно связанное с введением препарата, и оценённое таким же образом компанией-производителем.
б Под необычными ощущениями понимается дословный термин, который сообщался участниками, описывающий затуманенность сознания.
Нежелательные реакции, наблюдавшиеся при пострегистрационном применении
В ходе постмаркетингового применения отмечались следующие нежелательные реакции, перечисленные в соответствии с классификацией систем органов MedDRA в порядке нарастания тяжести проявления, где применимо.
- Реакции аллергического или анафилактического типа:
Такие реакции наблюдаются редко.
- Общие нарушения и реакции в месте введения:
Повышение температуры тела наблюдается редко. Сообщалось о крапивнице и рвоте.
- Нарушения со стороны сосудов:
Возможно редкое развитие тромбоэмболических осложнений после введения человеческого фактора свёртывания Ⅶ (см. раздел «Особые указания»).
Сообщалось о развитии инсульта, инфаркта миокарда, артериального тромбоза, тромбоэмболии лёгочной артерии и синдрома диссеминированного внутрисосудистого свёртывания.
Передозировка
Симптомы
При применении больших доз препаратов фактора Ⅶ и препаратов протромбинового комплекса, содержащих фактор VII, отмечались следующие нежелательные явления: инфаркт миокарда, диссеминированное внутрисосудистое свёртывание, венозный тромбоз, лёгочная эмболия (см. раздел «Побочное действие»).
Таким образом, в случае передозировки препарата Фактор Ⅶ повышается риск развития тромбоэмболических осложнений.
Взаимодействие с другими лекарственными средствами
Какие-либо взаимодействия препарата Фактор Ⅶ с другими лекарственными средствами неизвестны. Фактор Ⅶ не следует смешивать с другими лекарственными препаратами, включая гепарин.
Контроль лабораторных показателей
При проведении у пациентов, получающих высокие дозы препарата Фактор VII, чувствительных к гепарину тестов на свёртывание, следует учитывать наличие гепарина в препарате
Особые указания
Прослеживаемость
Чтобы улучшить прослеживаемость биологических лекарственных препаратов, следует чётко записывать название и номер серии вводимого препарата.
Меры предосторожности
При применении препаратов, содержащих фактор VII, отмечалось развитие реакций гиперчувствительности, включая анафилактические реакции. Следует проинформировать пациентов и их близких о ранних признаках реакций гиперчувствительности. При возникновении таких симптомов необходимо рекомендовать пациентам немедленно прервать применение препарата и обратиться к своему лечащему врачу.
При возникновении аллергических и/или анафилактических реакций введение необходимо немедленно прекратить. В случае шока следует провести стандартные медицинские мероприятия. Пациента и/или лицо, осуществляющее уход за пациентом, необходимо проинформировать о первых признаках реакций гиперчувствительности. При возникновении таких симптомов пациентам следует рекомендовать немедленно прекратить применение препарата и обратиться к врачу.
Поскольку концентрат фактора Ⅶ получают из плазмы, он также содержит другие человеческие белки.
Вирусная безопасность
Стандартные мероприятия по предотвращению инфекций, являющихся следствием применения лекарственных препаратов, получаемых из человеческой крови или плазмы, включают отбор доноров, скрининг материала, сданного отдельными донорами, и пулов плазмы в отношении специфических маркеров инфекции, а также внедрение в производство этапов эффективной инактивации/удаления вирусов. Несмотря на это, при использовании лекарственных препаратов, приготовленных из человеческой крови или плазмы, невозможно полностью исключить риск передачи инфекционных заболеваний, в том числе вызванных неизвестными вирусами или другими возбудителями.
Принимаемые меры считаются эффективными для вирусов в оболочке, таких как вирус иммунодефицита человека , вирус гепатита B, вирус гепатита C, а также для безоболочечного вируса гепатита A.
Применяемые технологии по удалению и инактивации возбудителей могут быть ограниченно эффективны в отношении некоторых безоболочечных вирусов, в частности, парвовируса В19. Инфекция парвовирусом В19 может быть опасна для беременных женщин (инфицирование плода) и пациентов с иммунодефицитом или повышенным распадом эритроцитов (в частности, при гемолитической анемии).
Соответствующая вакцинация (против гепатита А и В) может быть рекомендована пациентам, регулярно получающим терапию с применением препарата Фактор VII, произведённого из плазмы крови.
Тромбоэмболия, ДВС-синдром
При терапии препаратами, содержащими фактор VII, существует риск развития тромбоэмболических осложнений и ДВС. При лечении препаратом Фактор Ⅶ наблюдались тромбозы, в том числе тромбозы глубоких вен, и тромбофлебиты. Пациенты, получающие терапию препаратом Фактор VII, должны находиться под внимательным наблюдением из-за возможности развития признаков и симптомов тромбоэмболических осложнений и ДВС-синдрома.
Особые группы пациентов
Вследствие риска развития тромбоэмболических осложнений и ДВС особенно строгий мониторинг должен осуществляться при введении человеческого фактора свёртывания Ⅶ пациентам с ишемической болезнью сердца, с заболеваниями печени, перед проведением
хирургического вмешательства, новорождённым в неонатальном периоде или пациентов с риском развития тромбоэмболии или синдрома две.
Заместительная терапия человеческим фактором свёртывания Ⅶ может приводить к формированию циркулирующих антител, ингибирующих фактор VII. Если подобные ингибиторы появляются, это состояние проявляется как недостаточный клинический ответ.
Натрий
Фактор Ⅶ содержит примерно 40 мг натрия на флакон, что эквивалентно 2 % от рекомендованной ВОЗ максимальной суточной дозы для взрослого — 2 г натрия.
Влияние на способность управлять транспортными средствами, механизмами
Влияния препарата Фактор Ⅶ на способность управлять транспортным средством и работать с механизмами не наблюдалось.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения 600 ME.
По 600 ME лиофилизата в стеклянном флаконе вместимостью 20 мл, укупоренном резиновой пробкой с алюминиевой обкаткой и пластмассовой крышкой типа flip-off, и по 10 мл растворителя (вода для инъекций) в стеклянном флаконе вместимостью 10 мл, укупоренном резиновой пробкой с алюминиевой обкаткой и пластмассовой крышкой типа flip-off.
Один флакон с лиофилизатом, один флакон с растворителем, одноразовый шприц, одноразовая игла, игла для переноса, фильтрующая игла, аэрационная игла, система для трансфузии и инструкция по медицинскому применению в картонной пачке.
Хранение
При температуре от 2 до 8 °C в оригинальной упаковке (пачке картонной).
Не замораживать!
Хранить в недоступном дня детей месте.
Срок годности
Лиофилизат: 3 года.
Растворитель: 5 лет.
Срок годности набора определяется наименьшим сроком годности одного из его компонентов.
Не применять после окончания срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Takeda Manufacturing Austria AG, Австрия
Siegfried Hameln, GmbH, Германия
Владелец регистрационного удостоверения
Такеда Мануфекчуринг Австрия АГ, Австрия
Индустриештрассе 67, 1221 Вена, Австрия
Производитель
Такеда Мануфекчуринг Австрия АГ, Австрия (лиофилизат)
Ланге Аллее 24, 1221 Вена, Австрия
Зигфрид Хамельн ГмбХ, Германия (растворитель)
Лангес Фельд 13, 31789, Хамельн, Германия
Выпускающий контроль качества
Такеда Мануфекчуринг Австрия АГ, Австрия
Индустриештрассе 67, 1221 Вена, Австрия
Организация, принимающая претензии потребителей
ООО «Такеда Фармасьютикалс», Российская Федерация
119048, г. Москва, ул. Усачёва, д. 2, стр. 1.
Телефон: + 7 495 933 55 11
Факс: + 7 495 502 16 25
Электронная почта: russia@takeda.com
Адрес в интернете:
https://www.takeda.com/ru-ru
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Фактор VII:
