Фанди®
, лиофилизатРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для инфузий
Состав
Фанди® 250 МЕ | Фанди® 500 МЕ | Фанди® 1 000 МЕ | |
|---|---|---|---|
Активное вещество: | |||
Фактор свёртывания крови Ⅷ Активность | 250 МЕ | 500 МЕ | 1 000 МЕ |
Вспомогательные вещества: | |||
40 мг | 40 мг | 40 мг | |
50 мг | 50 мг | 50 мг | |
175 мг | 175 мг | 175 мг |
Описание
Лиофилизат: белый или бледно-жёлтый, гигроскопический лиофилизат или хрупкое твёрдое вещество.
Растворитель: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Характеристика
Фанди® получен из человеческой плазмы в результате процесса непрерывной очистки, состоящего из преципитации полиэтиленгликолем (макрогол) с последующей аффинной хроматографией и осаждением хлористым натрием и глицином.
Производственный процесс получения Фанди® валидирован дляинактивации/удаления вирусов, с использованием ВИЧ и модельных вирусов как с липидной оболочкой, так и вирусов, не имеющих липидной оболочки. Два специфических этапа, разработанных для инактивации любых инфицирующих вирусов (обработка три-(н-бутил)-фосфатом/полисорбатом 80 и последующая термообработка в течение 72–74 ч при температуре 81 ± 1 °C), а также две стадии апробированного процесса по инактивации и удалению вирусов (преципитация полиэтиленгликолем (макрогол) и аффинная хроматография) совместно привели к высокой степени инактивации и удаления вирусов.
Фармакодинамика
Фанди® — лиофилизированный концентрат высокоочищенного и стабильного фактора свёртывания крови VIII (фVIII), дважды вирусинактивированный.
В препарате Фанди® фVIII (FVIII: C) представлен в виде комплекса с фактором Виллебранда.
Комплекс фVIII/фактора Виллебранда состоит из двух молекул (фVIII и фактора Виллебранда), которые оказывают различное физиологическое действие.
При введении фVIII связывается с фактором Виллебранда в кровотоке больного гемофилией.
Активированный фVIII выступает как ко-фактор активированного фактора IX, ускоряя преобразование фактора X в активированный фактор X; активированный фактор X содействует переходу протромбина в тромбин. Тромбин, в свою очередь, преобразовывает фибриноген в фибрин и, таким образом, формируется сгусток. Гемофилия А — наследственная болезнь (передаётся по рецессивному сцепленному с полом типу), обусловленная недостаточностью фактора свёртывания крови VIII, проявляется симптомами кровоизлияния в суставы, мягкие ткани или во внутренние органы, что может происходить спонтанно или в результате случайных травм или хирургических вмешательств. В результате заместительной терапии происходит повышение содержания фактора свёртывания крови VIII в плазме крови, что временно корригирует дефицит фактора свёртывания в плазме крови и препятствует кровоточивости.
Фармакокинетика
Активность фVIII в плазме крови снижается по двухфазному экспоненциальному механизму выведения.
Период полувыведения Фанди® определённый в клиническом исследовании препарата, составляет примерно 14,18 ± 2,55 ч и уровень восстановления in vivo — 105,5 ± 18,5 %, что эквивалентно примерно 0,021 ± 0,004 МЕ/мл на МЕ/кг введённого препарата (определение проводили с использованием хромогенного метода). Среднее время удержания (MRT): 20,6 ± 4,8 ч, площадь под кинетической кривой изменения концентрации в крови (AUC): 19,3 ± 3,7 МЕ ч/мл и клиренс: 2,6 ± 0,5 мл/ч/кг.
Показания
Лечение и профилактика кровотечений у больных гемофилией А (врождённый дефицит фактора VIII) и приобретённой недостаточности фактора VIII.
Противопоказания
Повышенная чувствительность к компонентам препарата.
Применение при беременности и в период грудного вскармливания
Клинический опыт использования фактора VIII у беременных и кормящих женщин отсутствует, так как гемофилия А у женщин встречается редко; в связи с этим фактор свёртывания крови VIII можно применять во время беременности и грудного вскармливания только при чётких показаниях.
Способ применения и дозы
Лечение должно проводиться под наблюдением врача, имеющего опыт ведения больных гемофилией.
Дозировка и длительность заместительной терапии зависят от степени дефицита фVIII, локализации и интенсивности кровотечения, а также от тяжести клинического состояния больного.
Количество вводимого фVIII выражается в Международных Единицах (ME), что соответствует общепринятому стандарту Всемирной Организации Здравоохранения (ВОЗ) для препаратов фактора VIII. Активность фVIII в плазме выражается либо в процентах (соответствует нормальной человеческой плазме), либо в Международным Единицах (соответствует Международному Стандарту для фVIII в плазме).
Одна Международная Единица (ME) активности фVIII равна количеству фVIII в 1 мл нормальной плазмы человека.
Расчёт необходимой дозы фVIII основывается на эмпирических данных, что одна Международная Единица (ME) фVIII на кг массы тела повышает активность фVIII в плазме на 2,1 ± 0,4 %.
Дозу препарата рассчитывают по формуле:
Необходимая доза Фанди® = масса тела (кг) х желаемое повышение фVIII (%) (МЕ/дл) х 0,5
В каждом конкретном случае общая доза и частота введения препарата должны всегда соотноситься с клинической эффективностью.
В следующих случаях кровотечений активность фVIII не должна падать ниже указанного уровня активности плазмы (в % от нормы или в МЕ/дл) в соответствующий период. Нижеприводимая таблица может быть использована для рекомендуемой дозировки при кровотечениях и хирургических вмешательствах:
Тяжесть кровотечения/ Тип хирургического вмешательства | Необходимый уровень активности фVIII в крови (%) (МЕ/дл) | Частота введения (ч) / Продолжительность терапии (дни) |
|---|---|---|
| Кровотечения | ||
| Начинающийся гемартроз, кровоизлияние в мягкие ткани или кровоточивость слизистой полости рта | 20–40 | Каждые 12–24 ч (минимум 1 день до остановки кровотечения (или его болевое проявления) или до заживления раны. |
| Более выраженный гемартроз кровотечение или гематома мягких тканей | 30–60 | Повторять каждые 12–24 ч в течение 3–4 и более дней пока боль или нарушение трудоспособности не прекратятся. |
| Угрожающие жизни кровотечения и кровоизлияния | 60–100 | Повторять каждые 8–24 ч до устранения угрозы. |
| Хирургические вмешательства | ||
| Малые хирургические вмешательства, включая удаление зубов | 30–60 | Каждые 24 ч (минимум 1 день) до полного заживления раны. |
| Большие хирургические вмешательства | 80–100 (пред- и постоперационный) | Повторять каждые 8–24 ч до заживления раны, после чего продолжить терапию в течение минимум 7 дней, поддерживая фVIII на уровне 30–60 % (МЕ/дл). |
В течение курса лечения рекомендуется определять активность фVIII для коррекции дозы препарата и частоты его введения. В случае больших хирургических вмешательств особенно необходим точный мониторинг заместительной терапии, что подразумевает исследование коагулограммы и активности фVIII. Отдельные пациенты могут отличаться по клиническому ответу на введение фVIII и демонстрировать различный уровень подъёма фактора VIII в условиях in vivo и периода его полувыведения.
Для долгосрочной профилактики кровотечений у больных с тяжёлой формой гемофилии А обычные дозы составляют от 20 до 40 МЕ фактора VIII на кг массы тела каждые 2–3 дня. В некоторых случаях, особенно у молодых пациентов, могут потребоваться меньшие интервалы между введениями или большие дозы.
Нет достаточных клинических данных по применению Фанди®у детей младше 6 лет.
Больных необходимо регулярно обследовать для выявления ингибиторов к фVIII. Если ожидаемое повышение активности фVIII в плазме крови не достигается или кровотечение не контролируется соответствующей дозой, необходимо провести обследование на наличие ингибиторов к фVIII. У пациентов с высоким уровнем ингибитора заместительная терапия фVIII может быть неэффективной и тогда должны быть рассмотрены другие терапевтические возможности. Помощь таким пациентам должна оказываться врачами с опытом лечения больных гемофилией.
Способ приготовления раствора для инфузий
Химическая и физическая стабильность препарата в процессе его применения сохраняется в течение 12 ч при температуре 25 °C. С микробиологической точки зрения препарат необходимо использовать немедленно. Если препарат не используется сразу, то период и условия его хранения перед применением (если восстановление не проводится в контролируемых и апробированных асептических условиях) определяется пользователем и обычно не превышает 24 ч при температуре от 2 до 8 °C. Неиспользованные остатки препарата нельзя сохранять для последующего использования и хранить в холодильнике.
Приготовление раствора:
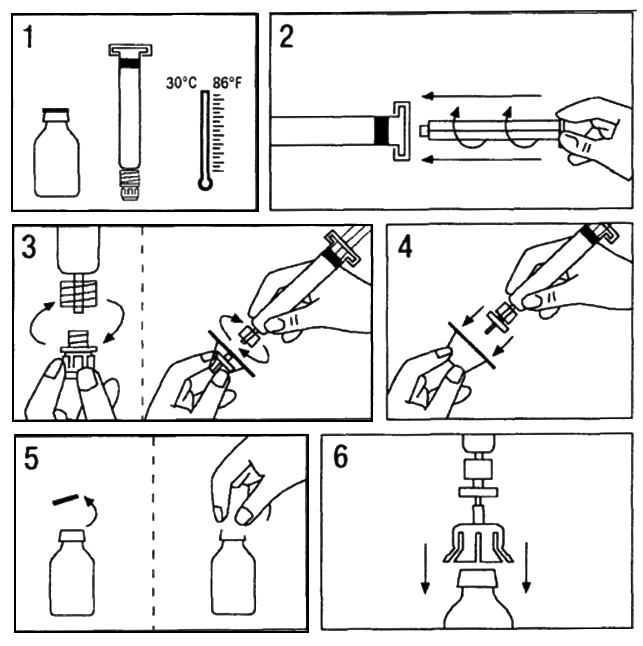
- Нагрейте флакон с лиофилизатом и шприц с растворителем до температуры не выше 30 °C (Рис.1).
- Вставьте поршень в шприц, содержащий растворитель (Рис.2).
- Достаньте фильтр из упаковки. Удалите колпачок с конца шприца и зафиксируйте фильтр на шприце (Рис. 3).
- Достаньте из упаковки адаптер к флакону и зафиксируйте его на шприце с фильтром (Рис. 4).
- Удалите крышку флакона с препаратом и обработайте пробку асептическим тампоном (Рис.5).
- Проткните пробку иглой адаптера (Рис.6).
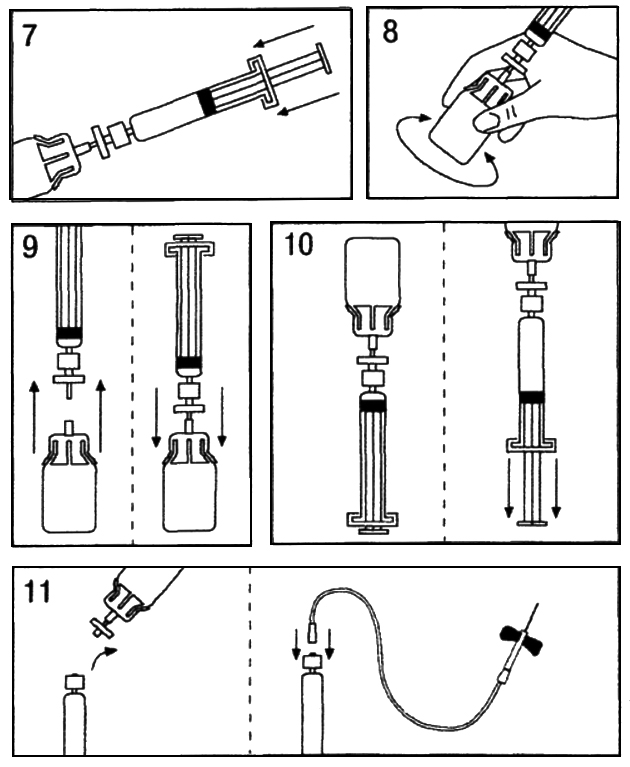
- Перелейте растворитель полностью из шприца во флакон (Рис.7).
- Осторожно вращайте флакон до полного растворения препарата. Не используйте препарат, пока препарат не растворится полностью или пока видны механические частицы (Рис.8).
- Быстро отделите шприц с фильтром от флакона с адаптером, во избежание попадания воздуха (Рис.9).
- Переверните флакон и переместите приготовленный раствор в шприц (Рис. 10).
- Приготовьте место для инъекции, отделите шприц и введите препарат с помощью прилагаемой стерильной иглы-«бабочки» или другой стерильной иглы. Скорость инфузии в вену должна быть 3 мл/мин и не превышать 10 мл/мин (Рис. 11).
Восстановленный раствор должен быть прозрачным или слегка опалесцирующим, бесцветным или светло-жёлтым, без видимых посторонних включений.
Не используйте раствор при наличии в нем хлопьевидного осадка или механических включений.
Перед применением восстановленный в жидком виде препарат необходимо визуально обследовать на наличие в нем твёрдых частиц и на изменение цвета.
Не используйте повторно инфузионные наборы.
Любой неиспользованный препарат или другие использованные материалы подлежат утилизации в соответствии с местными требованиями.
Побочное действие
Гиперчувствительность или аллергические реакции (могут включать ангионевротический отёк, зуд в месте введения, озноб, прилив крови к лицу, генерализованную крапивницу, головную боль, сыпь, гипотензию, вялость, тошноту, чувство беспокойства, тахикардию, сдавленность в груди, пощипывание в онемевшей части тела, рвоту, одышку), которые могут прогрессировать в отдельных случаях до тяжёлой анафилаксии (до развития шока); в редких случаях наблюдается гипертермия (появление жара).
У больных с гемофилией А возможно развитие нейтрализующих антител (ингибиторов) к фактору VIII. Если это происходит, то выражается в виде неэффективного клинического ответа. В таких случаях рекомендуется обратиться в специализированный центр гемофилии.
Передозировка
Симптомы передозировки человеческим фактором свёртывания крови VIII неизвестны.
Взаимодействие с другими лекарственными средствами
Взаимодействие человеческого фактора свёртывания крови VIII с другими лекарственными средствами неизвестно.
Несовместимость
Не следует смешивать Фанди® с другими лекарственными средствами. Следует использовать только прилагаемые к препарату инфузионные наборы, поскольку на внутренних поверхностях других наборов для инфузий может возникнуть адсорбция человеческого фактора свёртывания крови VIII и в результате уменьшается эффективность препарата.
Особые указания
Кроме Фактора VIII препарат содержит следы других белков человека. Пациенты должны быть информированы о возможных ранних симптомах реакции гиперчувствительности, которые включают сыпь, генерализованную крапивницу, стеснение в грудной клетке, одышку, гипотензию и анафилаксию. При таких симптомах рекомендуется немедленно прекратить введение препарата и обратиться к врачу.
При шоке необходимо применять противошоковую терапию в соответствии с общепринятыми правилами.
При использовании препаратов из крови или плазмы крови человека нельзя полностью исключить возможное возникновение инфекционных заболеваний вследствие передачи возбудителя через кровь. Вышесказанное относится также к патогенным микроорганизмам, природа которых ещё не изучена.
Тем не менее риск передачи инфекционных возбудителей снижается путём:
- контроля отбора доноров при медицинском осмотре, скрининга индивидуальных порций и пулов плазмы на наличие поверхностного антигена гепатита B (HBsAg) и антител к вирусам иммунодефицита человека и гепатита С;
- тестирования пулов плазмы на наличие геномного материала вируса гепатита С;
- процедуры по инактивации/удалению вирусов в производственном процессе, которые были валидированы с использованием модельных вирусов. Доказана эффективность данных процедур для вирусов иммунодефицита человека (ВИЧ), гепатита С (ВГС), гепатита А (ВГА) и гепатита B (ВГВ).
Процедуры по инактивации и удалению вирусов могут оказывать ограниченное действие на безоболочечные вирусы, такие как парвовирус В19 и другие инфекционные агенты.
Рекомендуется проводить соответствующую вакцинацию (гепатиты A и B) пациентам, которые проходят лечение концентратами фVIII из плазмы крови человека.
Инфицирование парвовирусом B19 может быть опасным для беременных женщин (внутриутробная инфекция) и для пациентов с иммунодефицитом или с усиленным эритропоэзом (например, гемолитическая анемия).
Образование нейтрализующих антител (ингибиторов) к фактору VIII является известным осложнением, встречающимся при лечении гемофилии А. Как правило, ингибиторами являются иммуноглобулины G, направленные против прокоагулянтной активности фактора VIII, которые определяются в Бетезда Единицах (БЕ) в мл плазмы, при использовании модифицированного метода Ниймегена. Риск появления ингибиторов взаимосвязан с экспозицией антигемофильного фактора VIII; это более вероятно в течение первых 20 дней экспозиции. Редко ингибиторы могут появляться по истечении первых 100 дней экспозиции. Больные, которые проходят терапию человеческим фактором свёртывания крови VIII, должны тщательно обследоваться на наличие ингибиторов с учётом результатов клинических наблюдений и лабораторных тестов (см. также «Побочные реакции»).
В интересах пациентов, когда это возможно, каждый раз при введении им препарата Фанди® рекомендуется регистрировать название и номер серии препарата.
Влияние на способность управлять транспортными средствами, механизмами
Препарат не оказывает влияния на способность управления автомобильным транспортом и механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий, 250, 500 или 1 000 МЕ.
По 250, 500 или 1000 МЕ лиофилизата в стеклянном флаконе, укупоренном пробкой из хлорбутилового каучука с алюминиевым колпачком, закрытым пластиковой крышкой.
Растворитель (вода для инъекций) — по 10 мл в стеклянном шприце, укупоренном пробкой из бромбутилового каучука с колпачком из синтетического полиизопрена, в индивидуальном прозрачном контейнере.
Инфузионный набор: адаптер для флакона в индивидуальном прозрачном контейнере, микрофильтр в индивидуальном прозрачном контейнере, 2 асептических тампона в отдельных пакетах и игла-«бабочка» в индивидуальном прозрачном контейнере.
1 флакон с препаратом, прозрачный контейнер со шприцем и поршнем, инфузионный набор вместе с инструкцией по применению в картонной пачке.
Хранение
При температуре не выше 30 °C.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Instituto GRIFOLS, S.A., Испания
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Фанди:
