Фазенра
FasenraРегистрационный номер
Торговое наименование
Фазенра
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Один шприц содержит:
Действующее вещество: бенрализумаб 30 мг
Вспомогательные вещества: L-гистидин 1,4 мг, L-гистидина гидрохлорида моногидрат 2,3 мг, α,α-трегалозы дигидрат 95 мг, полисорбат 20 (растительного происхождения) 0,06 мг, вода для инъекций приблизительно 910 мг.
Описание
От прозрачной до опалесцирующей, от бесцветной до жёлтого цвета жидкость.
Фармакотерапевтическая группа
Фармакологические свойства
Фармакодинамика
Механизм действия
Бенрализумаб представляет собой антиэозинофильное гуманизированное, афукозилированное, моноклональное антитело (IgGl/каппа). Бенрализумаб связывается с альфа-субъединицей рецептора к человеческому интерлейкину-5 (IL-5Ra), обладая высоким сродством (16 пМ) и специфичностью. Рецептор к IL-5 находится на поверхности эозинофилов и базофилов. Отсутствие фукозы в Fc домене бенрализумаба облегчает процесс связывания (45,5 нМ) с FcyRHI-рецепторами на поверхности иммунных эффекторных клеток, таких как натуральные киллеры, что приводит к апоптозу эозинофилов и базофилов посредством антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ).
Эозинофильное воспаление является важным компонентом патогенеза бронхиальной астмы. В эозинофилах содержатся медиаторы воспаления (такие как эйкозаноиды, лейкотриены, цитокины) и белковые гранулы (такие как эозинофильный катионный белок, эозинофильная пероксидаза, эозинофильный нейротоксин и главный основной белок). Бенрализумаб, посредством АЗКЦ, уменьшает эозинофильное воспаление.
Фармакодинамические свойства
Фармакодинамический ответ (уменьшение количества эозинофилов в крови) после подкожного введения препарата пациентам с бронхиальной астмой изучалось в 12- недельном исследовании фазы II. Пациенты получали в виде подкожных инъекций бенрализумаб в одной из трёх доз (25 мг (n = 7), 100 мг (n = 6) и 200 мг (n = 6)) или плацебо (n = 6) однократно каждые 4 недели (всего 3 дозы). Исходная медиана количества эозинофилов до начала лечения составляла 400, 200, 120 и 200 клеток/мкл для групп бенрализумаба 25 мг, 100 мг, 200 мг и плацебо, соответственно.
Снижение количества эозинофилов в крови после подкожного введения бенрализумаба было отмечено для всех доз и не наблюдалось в группе плацебо. Через 24 ч после введения препарата отмечалось полное или практически полное снижение медианы количества эозинофилов в крови (0, 0 и 5 клеток/мкл, соответственно). В группе плацебо медиана количества эозинофилов в крови не изменилась. Эффект в отношении количества эозинофилов сохранялся на протяжении терапии.
В клиническом исследовании фазы I изучалось влияние бенрализумаба на эозинофилы в слизистой оболочке дыхательных путей у пациентов с бронхиальной астмой, с содержанием эозинофилов в мокроте 2,5 % и более. Пациенты получали бенрализумаб 100 мг или 200 мг подкожно однократно каждые четыре недели в течение 8 недель (общее количество пациентов в общей группе бенрализумаба n = 9) или плацебо (n = 5). По окончании 12-недельного периода лечения медиана снижения количества эозинофилов в слизистой оболочке дыхательных путей в общей группе бенрализумаба составила 96 % по сравнению с 47 % в группе плацебо (статистически значимое различие, p = 0,039).
В клиническом исследовании фазы I лечение бенрализумабом также сопровождалось снижением уровня базофилов крови, и в исследованиях фазы I и фазы II — снижением сывороточной концентрации веществ, содержащихся в гранулах эозинофилов, таких как эозинофильный нейротоксин и эозинофильный катионный белок.
В исследованиях фазы I и II после введения бенрализумаба в рекомендованной дозе
медиана абсолютного количества эозинофилов в крови составила 0 клеток/мкл, что соответствует медиане снижения на 100 %. Это снижение было отмечено уже при первом измерении, после 4 недель терапии, и сохранялось на протяжении терапии.
Иммуногенность
В целом, антитела к исследуемому препарату были обнаружены у 107 из 809 (13 %) пациентов, получавших препарат Фазенра по рекомендованной схеме в течение 48 и 56 недель. У большинства пациентов с наличием антител были выявлены нейтрализующие антитела. Наличие антител к бенрализумабу ассоциировалось с повышением клиренса бенрализумаба и повышенным уровнем эозинофилов в крови у пациентов с высокими титрами антител к препарату в сравнении с пациентами без антител. Данных о наличии связи между образованием антител к препарату и эффективностью и безопасностью препарата не получено.
Представленные данные были получены у пациентов с наличием антител к бенрализумабу по результатам специфических методов определения. Наблюдаемая частота образования антител (в том числе, нейтрализующих) может зависеть от нескольких факторов, включая анализ чувствительности и специфичности, метод определения антител, хранение проб, время сбора проб, применение сопутствующих препаратов и основное заболевание. По этим причинам сравнение частоты случаев образования антител к бенрализумабу с таковой к другим препаратам в других исследованиях может давать недостоверные результаты.
Фармакокинетика
Фармакокинетика бенрализумаба у пациентов с бронхиальной астмой изменялась пропорционально дозе подкожно вводимого бенрализумаба (от 2 мг до 200 мг).
Всасывание
После подкожного введения пациентам с бронхиальной астмой период полуабсорбции составлял 3,5 дня. На основании результатов популяционного анализа фармакокинетики расчётная абсолютная биодоступность составила приблизительно 59 %, клинически значимые различия в биодоступности при введении в область живота, бедра или плеча не наблюдались.
Распределение
На основании результатов популяционного анализа фармакокинетики центральный и периферический объём распределения бенрализумаба составил 3,1 л и 2,5 л, соответственно, у пациента с массой тела 70 кг.
Метаболизм
Бенрализумаб представляет собой гуманизированное моноклональное антитело класса IgGl. Бенрализумаб расщепляется с участием протеолитических ферментов, которые широко распределены по всему организму человека и не локализованы только в печени.
Выведение
Популяционный анализ фармакокинетики бенрализумаба продемонстрировал, что фармакокинетика препарата носит линейный характер, и его выведение из организма не зависит от связывания с каким-либо рецептором. Рассчитанный системный клиренс бенрализумаба составляет 0,29 л/день у пациента с массой тела 70 кг. После подкожного введения период полувыведения составляет приблизительно 15,5 дней.
Фармакокинетика у особых групп пациентов
Пожилой возраст (≥ 65 лет)
Популяционный анализ фармакокинетики показал, что возраст пациента не влиял на фармакокинетику бенрализумаба.
Пол, раса
Популяционный анализ фармакокинетики показал, что пол и расовая принадлежность существенно не влияли на клиренс бенрализумаба.
Нарушение функции почек
Клинических исследований для изучения влияния нарушения функции почек на фармакокинетические параметры бенрализумаба не проводилось. Популяционный анализ фармакокинетики показал, что клиренс бенрализумаба у пациентов с клиренсом креатинина от 30 до 80 мл/мин сопоставим с клиренсом бенрализумаба у пациентов с нормальной функцией почек. Данные о пациентах с клиренсом креатинина менее 30 мл/мин ограничены; тем не менее, бенрализумаб не выводится почками.
Нарушение функции печени
Клинических исследований бенрализумаба у пациентов с нарушением функции печени не проводилось. Метаболизм в печени не является основным способом выведения моноклональных антител класса IgG; изменение функции печени не должно сопровождаться изменением клиренса бенрализумаба. Согласно результатам
популяционного анализа фармакокинетики, исходные параметры биомаркеров функции печени (АЛТ, ACT и билирубин) не оказывают клинически значимого эффекта на клиренс бенрализумаба.
Детский возраст
Популяционный анализ фармакокинетики показал, что фармакокинетика бенрализумаба у подростков в возрасте 12–17 лет соответствовала таковой у взрослых. Бенрализумаб не изучался у детей в возрасте 5–11 лет (см. раздел «Способ применения и дозы»).
Лекарственные взаимодействия
Клинических исследований для изучения лекарственных взаимодействий не проводилось. Ожидается, что применение бенрализумаба не будет оказывать какого-либо влияния на фармакокинетику одновременно применяемых препаратов. Согласно результатам популяционного анализа, часто применяемые одновременно с бенрализумабом препараты у пациентов с бронхиальной астмой не оказывают никакого влияния на клиренс бенрализумаба.
Показания
Тяжёлая бронхиальная астма с эозинофильным фенотипом у взрослых пациентов в качестве дополнительной поддерживающей терапии.
Противопоказания
- Повышенная чувствительность к бенрализумабу или вспомогательным веществам, входящим в состав препарата.
- Детский возраст до 18 лет.
С осторожностью
Беременность и период грудного вскармливания, пациенты с повышенным риском развития гельминтных инвазий.
Применение при беременности и в период грудного вскармливания
Беременность
Данных о применении препарата у беременных в клинических исследованиях недостаточно для информирования о рисках, связанных с применением препарата.
Моноклональные антитела, такие как бенрализумаб, проникают через плацентарный барьер, и по мере прогрессирования беременности проницаемость плаценты для бенрализумаба увеличивается. Следовательно, потенциальное воздействие на плод наиболее вероятно во втором и третьем триместрах беременности.
В исследовании влияния препарата на развитие плода в пренатальный и постнатальный периоды беременные яванские макаки получали бенрализумаб с 20 по 22 день гестации (в зависимости от срока определения беременности), на 35 день гестации, один раз в 14 дней в течение всего периода гестации и затем спустя 1 месяц после родов в дозах 10 мг/кг и 30 мг/кг внутривенно болюсно. Применение бенрализумаба не сопровождалось развитием нежелательных реакций у матери, плода или новорождённого, а также нарушением постнатального развития.
Рекомендуется избегать применения препарата Фазенра при беременности. Назначение препарата Фазенра беременным женщинам возможно только в случае, если ожидаемая польза для матери превышает любые возможные риски для плода.
Грудное вскармливание
Неизвестно, проникает ли бенрализумаб в молоко животных или грудное молоко человека, поэтому нельзя исключить риск для ребёнка, получающего грудное вскармливание. Следует оценить пользу грудного вскармливания для здоровья и развития новорождённого, пользу от терапии бенрализумабом для матери и принять решение либо о прекращении грудного вскармливания, либо о приостановлении/прекращении терапии бенрализумабом.
Фертильность
Исследований по изучению влияния препарата на фертильность у людей не проводились. Влияние бенрализумаба на фертильность изучалось в исследовании с повторным введением препарата на протяжении 9 месяцев яванским макакам внутривенно в дозах до 25 мг/кг или подкожно в дозах до 30 мг/кг однократно каждые 2 недели (что приблизительно в 409 и 275 раз выше максимальной рекомендованной дозы у человека на основании AUC, и в 396 и 193 раза выше максимальной рекомендованной дозы у человека на основании Cmax). Влияния бенрализумаба на репродуктивную функцию у самцов и самок отмечено не было.
Способ применения и дозы
Для подкожного введения. В соответствии с требованиями клинической практики рекомендуется проводить наблюдение за пациентами после инъекции биологических препаратов (см. раздел «Побочное действие», Реакции гиперчувствительности). Препарат вводят в область плеча, бедра или живота. Не следует вводить препарат в чувствительную область, в область ушиба, гематомы или уплотнения.
Перед введением препарат Фазенра в оригинальной упаковке необходимо оставить в помещении при комнатной температуре в течение 30 минут. Препарат Фазенра необходимо ввести в течение 24 часов или утилизировать в соответствии с локальными инструкциями. Не следует встряхивать препарат. Препарат Фазенра не следует применять, если он был заморожен.
Дозы
Рекомендуемая доза препарата Фазенра составляет 30 мг. Препарат необходимо вводить один раз в 4 недели (первые 3 инъекции) и затем один раз в 8 недель. Если инъекция препарата пропущена в запланированное время, следует её выполнить как можно быстрее; двойная доза в связи с пропуском препарата не может быть назначена.
Применение у особых групп пациентов
Дети
Безопасность и эффективность бенрализумаба у пациентов младше 18 лет не были установлены.
Пациенты пожилого возраста
Пациентам пожилого возраста коррекция дозы не требуется (см. раздел «Фармакокинетика»).
Нарушение функции почек и печени
Пациентам с нарушением функции почек и печени коррекция дозы не требуется (см. раздел «Фармакокинетика»).
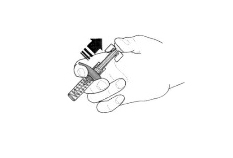
Инструкция по использованию препарата Фазенра в шприце с безопасной системой введения
Рисунок 1.
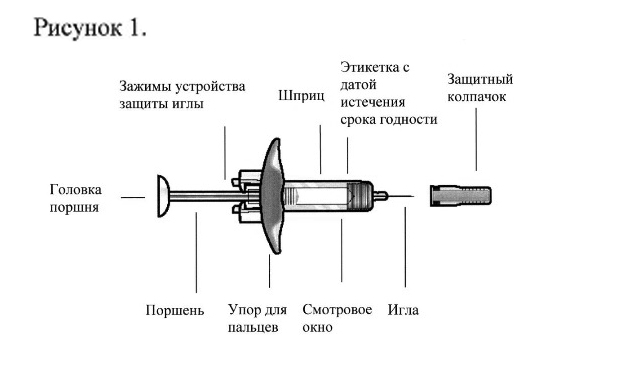
В целях предотвращения преждевременной активации устройства защиты иглы не касайтесь зажимов устройства защиты иглы.
- Возьмите шприц, не касаясь поршня, и извлеките из упаковки. Проверьте этикетку с датой истечения срока годности. Перед введением препарата Фазенра осмотрите его на наличие частиц и изменение цвета. Препарат Фазенра должен быть от прозрачного до опалесцирующего, от бесцветного до жёлтого цвета и может содержать несколько прозрачных или от белого до почти белого цвета частиц. Не используйте препарат Фазенра, если раствор мутный, имеет другой цвет или при наличии крупных частиц или инородных тел. В шприце может быть небольшой пузырёк воздуха; это нормально. Не пытайтесь удалить пузырёк перед введением препарата.
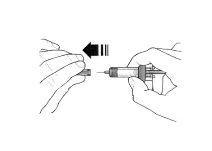
- Не снимайте колпачок иглы до момента непосредственного введения. Держите шприц одной рукой и снимите колпачок, потянув за него. В процессе снятия колпачка не держитесь за поршень или головку поршня; в противном случае поршень может переместиться. Если шприц повреждён или нестерилен (например, упал на пол без колпачка), его необходимо утилизировать и использовать новый.
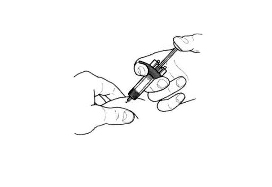
- Аккуратно возьмите кожную складку и введите иглу (например, в область плеча, бедра или живота).
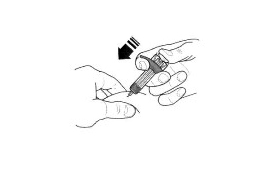
- Введите весь препарат, нажимая на поршень до упора, пока головка поршня не окажется целиком за фиксаторами устройства защиты иглы. Это необходимо для активации устройства защиты иглы.
- После введения препарата извлеките иглу из кожи, продолжая нажимать на поршень большим пальцем. Прекратите оказывать давление на поршень для активации устройства защиты иглы. Не надевайте колпачок на шприц.
- Утилизируйте шприц в соответствии с локальными требованиями.
Побочное действие
Профиль безопасности
В клинических исследованиях с участием пациентов с тяжёлой бронхиальной астмой и эозинофильным фенотипом наиболее часто отмечаемыми побочными реакциями были головная боль и фарингит.
Побочные реакции в клинических исследованиях
В двух плацебо-контролируемых исследованиях фазы III продолжительностью от 48 до 56 недель лечения 1 663 пациента с тяжёлой неконтролируемой бронхиальной астмой получали бенрализумаб. В Таблице 1 представлены побочные реакции, отмеченные в двух плацебо-контролируемых исследованиях у пациентов, получавших бенрализумаб 30 мг однократно каждые 4 недели (первые 3 дозы), а затем каждые 8 недель. Частота возникновения побочных реакций представлена в следующей градации: очень часто (> 1/10), часто (≥1/100, <1/10), нечасто (≥1/1 000, <1/100), редко (≥1/10 000, <1/1 000), очень редко (<1/10 000), неуточнённой частоты (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты реакции представлены в порядке убывания серьёзности.
| Класс системы органов | Побочные реакции | Частота |
|---|---|---|
| Нервная система | Головная боль | часто |
| Инфекции и инвазии | Фарингит1 | часто |
| Общие нарушения и нарушения в месте введения | Лихорадка Реакции в месте введения | часто |
| Нарушения иммунной системы | Реакции гиперчувствительности2 | часто |
1 Фарингит включал в себя следующие термины: «фарингит», «бактериальный фарингит», «вирусный фарингит», «стрептококковый фарингит».
2 Реакции гиперчувствительности включали в себя следующие термины: «крапивница», «папулёзная крапивница» и «кожная сыпь» (см. раздел «Особые указания»).
Описания отдельных побочных реакций
Реакции в месте введения
В плацебо-контролируемых исследованиях реакции в месте введения (такие как боль, эритема, кожный зуд, папула) имели место у 2,2 % пациентов, получавших бенрализумаб в рекомендованной дозе, и у 1,9 % пациентов в группе плацебо.
Постмаркетинговые данные
Как правило, достоверная оценка частоты побочных реакций не представляется возможной, поскольку информацию получают в виде спонтанных сообщений от популяции неустановленного размера. Следовательно, такие побочные реакции являются реакциями неуточнённой частоты (частота не может быть определена на основании имеющихся данных).
Со стороны иммунной системы: анафилаксия (определяемая групповыми терминами предпочтительного употребления: «анафилактическая реакция», «ангионевротический отёк»).
Передозировка
В клинических исследованиях пациенты с эозинофилией получали препарат подкожно в дозах до 200 мг, при этом каких-либо дозозависимых токсических реакций не наблюдалось. Специфическое лечение передозировки бенрализумабом отсутствует. В случае передозировки необходимо проводить поддерживающую терапию и вести наблюдение за состоянием пациента.
Взаимодействие с другими лекарственными средствами
Клинических исследований по изучению лекарственных взаимодействий не проводилось. Ферменты семейства цитохрома P450, эффлюксные насосы и механизмы связывания с белками не вовлечены в клиренс бенрализумаба. Экспрессия IL-5Rα на гепатоцитах не была установлена. Снижение количества эозинофилов не сопровождается системным изменением уровня провоспалительных цитокинов.
Особые указания
Препарат Фазенра не предназначен для лечения обострения бронхиальной астмы. Следует информировать пациентов о необходимости обратиться к врачу, если после начала терапии добиться контроля заболевания не удалось, или имеет место ухудшение течения заболевания.
После начала применения препарата Фазенра не следует резко отменять пероральные глюкокортикостероиды. При необходимости, снижение дозы пероральных глюкокортикостероидов следует производить поэтапно и под наблюдением врача. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии препаратом.
Реакции гиперчувствительности
После введения препарата Фазенра отмечались реакции гиперчувствительности (такие как анафилаксия, ангионевротический отёк, крапивница, папулёзная крапивница, кожная сыпь). Эти реакции могут развиваться в течение нескольких часов после введения препарата Фазенра, однако, в некоторых случаях реакции развиваются позже (спустя несколько дней). При симптомах реакции гиперчувствительности пациенту следует прекратить применение препарата Фазенра.
Паразитарные инвазии (гельминтозы)
Эозинофилы могут принимать непосредственное участие в развитии иммунологической реакции организма в ответ на паразитарную инвазию. Пациенты с гельминтозами были исключены из клинических исследований. Вероятность изменения реакции организма на гельминтоз при введении препарата Фазенра не установлена.
Перед началом применения препарата Фазенра необходимо провести лечение ранее выявленного гельминтоза. Если паразитарная инвазия развилась на фоне применения препарата Фазенра, и пациент не отвечает на применение противогельминтных средств, необходимо прекратить лечение препаратом Фазенра до разрешения паразитарной инвазии.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Фазенра не влияет или оказывает незначительное влияние на способность к управлению транспортными средствами и механизмами.
Форма выпуска
Раствор для подкожного введения, 30 мг/мл.
По 1,0 мл в стеклянный шприц (тип I Евр. Ф.) с иглой, защитным колпачком для иглы, безопасной системой введения и вытянутым упором для пальцев. По 1 шприцу в запечатанной контурной ячейковой упаковке. По 1 контурной ячейковой упаковке с инструкцией по применению препарата в картонной пачке с контролем первого вскрытия.
Хранение
При температуре от 2 до 8 °C.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Cook Pharmika LLC, США
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Фазенра:
