Фиразир
, растворРегистрационный номер
Торговое наименование
Фиразир
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
1 мл раствора содержит:
Активное вещество: икатибант (свободное основание) 10,0 мг (соответствует содержанию икатибанта ацетата около 12,5 мг);
Вспомогательные вещества: натрия гидроксид 0,64 мг, уксусная кислота ледяная 1,32 мг, натрия хлорид 7,45 мг, вода для инъекций до 1,0 мл.
Описание
Прозрачный от бесцветного до слегка желтоватого цвета раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Наследственный ангионевротический отёк (НАО) — аутосомно-доминантное заболевание, которое возникает в связи с отсутствием или дисфункцией ингибитора СI-эстеразы. Приступы наследственного ангионевротического отёка сопровождаются повышенным высвобождением брадикинина, который является основным медиатором воспаления, что лежит в основе развития клинических проявлений синдрома.
НАО проявляется в виде рецидивирующих отёков кожных покровов и слизистых оболочек органов дыхания и желудочно-кишечного тракта. Продолжительность приступа обычно составляет от 2 до 5 дней. Икатибант является синтетическим селективным антагонистом рецепторов брадикинина типа 2 (B2). Представляет собой синтетический декапептид, по химической структуре близкий брадикинину, имеющий в составе 5 аминокислот. Повышение уровня брадикинина является ключевым медиатором в развитии клинических симптомов острого приступа НАО.
Икатибант вводили молодым здоровым добровольцам в дозах 0,8 мг/кг в течение более 4 часов; 1,5 мг/кг/сут или 0,15 мг/кг/сут в течение 3 суток, что сопровождалось предотвращением развития брадикинин-индуцированной гипотензии, вазодилатации и рефлекторной брадикардии. Установлено, что икатибант проявляет свойства конкурентного антагониста даже в случае увеличения концентрации брадикинина в раза.
Как показано в проведённых контролируемых исследованиях, большинстве случаев, необходимо однократное введение икатибанта. Время начала купирования приступа НАО среднем составляет от 0,6 до 1,0 часа.
Фармакокинетика
Фармакокинетика икатибанта изучалась в исследованиях с внутривенным и подкожным введением препарата здоровым лицам и больным с острыми эпизодами НАО. Фармакокинетические параметры икатибанта в группе пациентов с НАО не отличались от соответствующих показателей группы здоровых лиц.
Абсорбция
При подкожном введении абсолютная биодоступность икатибанта составляет 97 %. Время достижения максимальной концентрации в плазме крови приблизительно 30 минут.
Распределение
Объём распределения (Vss) препарата в организме человека составляет около 20–25 л. Связь с белками плазмы крови — 44 %.
Выведение
Препарат в основном подвергается процессу метаболизма, и около 10 % его выводился через почки в неизменном виде. Клиренс составляет 15–20 л/ч, независимо от дозы препарата. Период полувыведения (T½) составляет 1–2 часа.
Метаболизм
В процессе метаболизма икатибанта под действием протеолитических ферментов образуются неактивные метаболиты, которые полностью выводятся через почки. В исследованиях in vitro подтверждено, что икатибант не подвергается метаболизму путём окисления, не является ингибитором основных ферментов (CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2G19; 2D6, 2E1 и 3A4) цитохрома P450 (CYP) и не индуцирует CYP 1A2 и 3A4.
Особые группы больных
Имеются данные о том, что экскреция икатибанта уменьшается с возрастом на 50–60 % у пожилых больных (75–80 лет) по сравнению с пациентами в возрасте 40 лет. Пол и масса тела не оказывают влияния на параметры фармакокинетики.
Ограниченные данные позволяют предположить, что эти показатели также не изменяются при снижении функции печени и почек. Влияние расовой принадлежности на фармакокинетику икатибанта не изучалось. Отсутствуют данные исследований фармакокинетики препарата у детей.
Показания
Симптоматическое лечение острых приступов наследственного ангионевротического отёка (обусловленного дефицитом ингибитора С1-эстеразы) у взрослых.
Противопоказания
Повышенная чувствительность к компонентам препарата (активному веществу и вспомогательным веществам), одновременный приём ингибиторов ангиотензин-превращающего фермента, детский возраст до 18 лет (эффективность и безопасность применения не установлены).
С осторожностью
Следует применять препарат самостоятельно в амбулаторных условиях
Введение препарата Фиразир больным, которым препарат назначается впервые, следует проводить в стационаре или в амбулаторных условиях под руководством врача.
В случае недостаточного эффекта препарата при самостоятельном его введении, а также при возобновлении или продолжении нарастания отёка, пациенту следует обратиться к врачу, дальнейшее введение препарата проводится в стационаре (см. «Способ применения и дозы»).
Обязательна госпитализация больных с симптомами отёка гортани, в том числе в случаях, когда приступ купируется после самостоятельного введения препарата в амбулаторных условиях.
При ишемической болезни сердца
При сопутствующей ишемической болезни сердца, учитывая свойства антагониста рецепторов брадикинина типа 2, нельзя исключить возможность ухудшения функции миокарда и снижения коронарного кровообращения. Поэтому с осторожностью следует назначать Фиразир пациентам с острым коронарным синдромом.
При инсульте
Икатибант может снижать положительный нейропротективный эффект брадикинина поздней фазы, хотя очевиден факт положительного влияния блокады рецепторов В2 в острый период нарушения мозгового кровообращения. Следовательно, необходимо с осторожностью назначать икатибант пациентам в первые недели инсульта.
Применение при беременности и в период грудного вскармливания
Беременность
В связи с отсутствием клинических данных применение Фиразира в период беременности и у женщин, планирующих беременность, не рекомендуется. Данные доклинических исследований указывают на неблагоприятное влияние препарата на процесс имплантации плодного яйца и на родоразрешение.
Тем не менее, Фиразир может применяться при беременности при тщательном сопоставлении соотношения польза/риск для матери и плода, например, для лечения угрожающего жизни острого приступа НАО, сопровождающегося отёком гортани.
Грудное вскармливание
Фиразир проникает в грудное молоко, поэтому после применения препарата следует исключить кормление грудью на 12 часов.
Способ применения и дозы
Препарат Фиразир предназначен для подкожного введения, наиболее часто препарат вводится в область передней брюшной стенки.
Применение препарата проводят под контролем квалифицированного медицинского сотрудника.
После обучения технике выполнения подкожных инъекций под контролем медицинского сотрудника пациент (или лицо, осуществляющее за ним уход) может вводить препарат самостоятельно.
Решение о возможности самостоятельного введения препарата Фиразир пациентом принимает врач, имеющий опыт диагностики и лечения НАО.
Пациенты с клиническими проявлениями отёка гортани должны быть экстренно госпитализированы, им следует находится под наблюдением врача до полного купирования приступа НАО.
Шприц, содержащий препарат Фиразир, предназначен только для однократного применения.
Подбор дозы
Рекомендуемая доза однократного введения препарата Фиразир составляет 30 мг.
Фиразир следует вводить медленно, в полном объёме (3 мл).
В большинстве случаев однократного введения препарата достаточно для купирования симптомов НАО. В случае недостаточной эффективности или рецидивирующего приступа НАО, повторно препарат Фиразир в дозе 30 мг можно ввести через 6 часов. Если после повторного введения препарата симптомы НАО сохраняются или приступ НАО рецидивирует, третья доза препарата может быть введена ещё через 6 часов. Не рекомендуется превышать максимальную суточную дозу препарата — 90 мг (3 инъекции препарата). Имеются данные о проведении не более 8 инъекций препарата Фиразир в течение месяца.
Особые группы
Пожилые больные
Данные об использовании препарата Фиразир в группе больных старше 65 лет ограничены. Установлено, что у пожилых больных может повышаться концентрация икатибанта в плазме крови, однако, клиническая значимость данного наблюдения в отношении безопасности препарата Фиразир не определена.
Нарушения функции печени
При заболеваниях печени не требуется снижения дозы препарата Фиразир.
Нарушения функции почек
При заболеваниях почек не требуется снижения дозы препарата Фиразир.
Дети и подростки
Эффективность и безопасность применения препарата Фиразир у детей до 18 лет не установлена.
Отсутствуют данные применения препарата Фиразир у детей.
Информация, необходимая при самостоятельном применении препарата
Инструкция по введению препарата включает следующие основные этапы:
1) Общая значимая информация
2) Подготовка шприца и иглы для инъекции
3) Подготовка места инъекции
4) Введение препарата
5) Уничтожение инъекционных материалов
Пошаговая инструкция по технике проведения инъекции
1) Общая значимая информация
-Вымойте руки водой и мылом перед началом манипуляций
-Вскройте блистер, потянув место печати
-Достаньте предварительно наполненный шприц из блистерной упаковки
-Снимите наконечник колпачка со шприца, свернув колпачок
-Отложите предварительно наполненный шприц после того, как отвернете колпачок
2) Подготовка шприца и иглы к инъекции
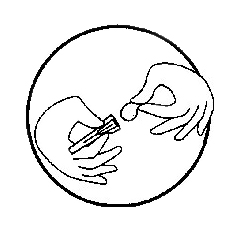
-Достаньте колпачок с иглой из блистера
-Вскройте контейнер, содержащий иглу (игла должна оставаться в нем)
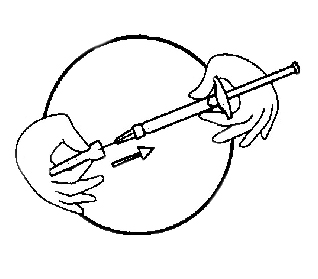
-Крепко держите шприц. Аккуратно наденьте иглу на предварительно заполненный шприц, содержащий бесцветный раствор
-Зафиксируйте шприц и иглу винтовым движением шприца, иглу не вынимайте из контейнера
-Достаньте иглу из контейнера, потянув за шприц. Не нажимайте на поршень
-Шприц подготовлен к инъекции
3) Подготовка места инъекции
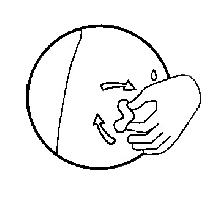
-Выберите место для инъекции. Наметьте кожную складку в области передней брюшной стенки на расстоянии 5–10 см ниже пупка, слева или справа от средней линии живота. Необходимо отступить на 2 см от участка изменённой кожи. Препарат не следует вводить в участки кожи с рубцовыми изменениями, отёком тканей или локальной болезненностью
-Обработайте кожу тампоном со спиртовым раствором, немного подождите, чтобы кожа высохла
4) Введение препарата

-Возьмите шприц в руку между 2 пальцами, расположив большой палец на поршне
-Проверьте, чтобы воздушных пузырьков не было в шприце, нажимая на поршень до появления первой капли раствора на кончике иглы
4) Введение препарата (продолжение)
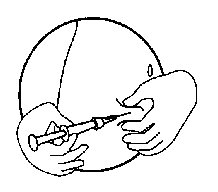
-Держите шприц под углом 45–90 к поверхности кожи с иглой, обращенной в сторону места инъекции
-Держа шприц в одной руке, другой рукой, между большим и указательным пальцами, возьмите осторожно кожную складку в месте, где кожа предварительно была обработана
-Продолжая держать кожную складку, поднесите шприц к месту инъекции быстро введите иглу в кожную складку
-Медленно нажимайте на поршень шприца с постоянным усилием до тех пор, пока препарат будет полностью введен в кожу
-Вводите препарат медленно в течение 30 секунд
-Отпустите кожную складку и осторожно удалите иглу
5) Уничтожение инъекционных материалов
-Поместите использованные шприц и иглу в контейнер, предназначенный для утилизации потенциально опасных материалов.
Побочное действие
Наиболее частыми побочными реакциями в клинических исследованиях у больных были местные признаки воспаления (характеризующиеся раздражением кожи, ощущением зуда, жжения, боли, появлением отёка, эритематозных высыпаний). В целом реакции были слабо выраженными, кратковременными, не требовали дополнительной терапии.
Частота побочных эффектов (ПЭ), представленных в таблице 1, оценивалась
следующим образом: очень часто: ≥1/ 0, часто: ≥1/100, <1/10; нечасто: ≥1/1000.
В связи с ограниченным количеством наблюдений каждое из нечасто встречающихся явлений отмечено у одного пациента.
Таблица 1:
Побочные эффекты, зарегистрированные в ходе клинических исследований икатибанта
| Побочные эффекты | |||
| Классификация по заболеваниям, органам и системам | очень часто | часто | нечасто |
| Наследственные, семейные и генетические заболевания | наследственный ангионевротический отек* | ||
| Со стороны желудочно-кишечного тракта | тошнота, рвота | ||
| Местные и системные реакции | Местные признаки воспаления (характеризующиеся раздражением кожи, ощущением зуда, жжения, боли, появлением отёка, эритематозных высыпаний) | астения, утомляемость, гипертермия * | |
| инфекционные заболевания | Опоясывающий лишай, фарингит | ||
| Травмы, интоксикации и осложнения, связанные с введением препарата | Закрытая травма | ||
| Нарушения со стороны обмена веществ и питания | Гиперурикемия, гипергликемия | ||
| Со стороны инструментальных и лабораторных показателей | повышение активности креатинфосфокиназы, увеличение протромбинового времени | повышение массы тела, глюкозы в крови, изменения функциональных тестов печени | |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Мышечные спазмы | ||
| Со стороны нервной системы | головокружение, головная боль | ||
| Нарушения со стороны почек и мочевыводящих путей | протеиурия | ||
| Со стороны органов дыхания, органов средостения | приступ удушья, кашель, заложенность коса | ||
| Со стороны кожи и подкожно-жировой клетчатки | сыпь, зуд, покраснение | генерализованная крапивница | |
| Со стороны сердечно-сосудистой системы | приливы (внезапные покраснения лица, шеи, груди, затылка, сопровождающиеся чувством жара, заканчивающиеся обильным потоотделением) | ||
* Приступы НАО регистрировали как побочные реакции однако, учитывая особенности возникновения эпизодов, в большинстве случаев приступы НАО носили рецидивирующий характер, они не имели связи с применением препарата Фиразир.
Самостоятельное применение препарата
Профиль безопасности препарата Фиразир при его применении специалистами здравоохранения и самостоятельном введении пациентами не отличается.
Передозировка
Не отмечено случаев передозировки препарата Фиразир.
В клиническом исследовании препарат применялся у здоровых добровольцев в дозе 3,2 мг/кг внутривенно (что приблизительно в 8 раз превышало терапевтическую дозу), введение препарата Фиразир сопровождалось кратковременной артериальной гипотензией и/или местной реакцией (покраснением, зудом в месте инъекции).
Специального лечения не проводится.
Взаимодействие с другими лекарственными средствами
Фармакокинетическое взаимодействие препарата Фиразир с изоферментами (CYP) цитохрома P450 не установлено.
Одновременное применение препарата Фиразир и ингибиторов ангиотензин-превращающего фермента (АПФ) не изучалось.
Особые указания
В связи с повышением брадикинина в плазме крови у больных с НАО, совместное применение препарата Фиразир с ингибиторами ангиотензин-превращающего фермента (АПФ) противопоказано.
Влияние на способность управлять транспортными средствами, механизмами
Фиразир обладает незначительным или умеренным влиянием на способность к управлению транспортными средствами и механизмами. Пациентам в период лечения следует воздержаться от вождения автотранспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Раствор для подкожного введения 10 мг/мл.
3,0 мл препарата в предварительно заполненном шприце из прозрачного стекла типа Ⅰ, снабжённым ограничителем хода поршня серого цвета из бромбутила, покрытого фторполимером, адаптером с насадкой Люэра из поликарбоната, закрытым навинчивающейся крышечкой, и упором для пальцев белого цвета из полипропилена. По 1 шприцу вместе с 1 иглой (25G, 16 мм) в блистерной упаковке. По 1 блистерной упаковке вместе с инструкцией по применению в пачке картонной с контролем первого вскрытия.
Хранение
При температуре не выше 25 °C. Не замораживать.
ХРАНИТЬ В НЕДОСТУПНОМ ДЛЯ ДЕТЕЙ МЕСТЕ.
Срок годности
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
RENTSCHLER BIOTECHNOLOGIE, GmbH, Германия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Фиразир:
