Глацетат
GlacetatРегистрационный номер
Торговое наименование
Глацетат
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Состав на 1 мл:
Действующее вещество:
Глатирамера ацетат — 20 мг/ 40 мг.
Вспомогательные вещества:
Маннитол — 40 мг, вода для инъекций — до 1 мл.
Описание
Cлегка опалесцирующий раствор от бесцветного до светло-жёлтого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Глатирамера ацетат представляет собой ацетатную соль синтетических полипептидов, полученных из 4 активированных производных аминокислот; L-глутаминовой кислоты, L-аланина, L-тирозина, L-лизина. Точный механизм, с помощью которого глатирамера ацетат оказывает своё влияние на пациентов с рассеянным склерозом (PC), полностью не выяснен, но может включать иммуномодуляцию. Исследования на животных и с участием пациентов с PC позволяют предположить, что глатирамера ацетат действует как антиген, индуцируя на периферии регуляторный фенотип антигенпрезентирующих клеток, включая дендритные клетки, моноциты и В-клетки, которые, в свою очередь, модулируют адаптивные функции B- и T-клеток, индуцируя противовоспалительную и регуляторную секрецию цитокинов. Является ли терапевтический эффект опосредованным клеточными эффектами, описанными выше, неизвестно, потому что патофизиология PC изучена лишь частично.
Рецидивирующе-ремиттирующий рассеянный склероз (РРРС)
В трёх контролируемых исследованиях 269 пациентов получали лечение глатирамера ацетатом. Первое двухлетнее исследование включало 50 пациентов (глатирамера ацетат — 25 пациентов, плацебо — 25 пациентов) с определенным РРРС в соответствии с действовавшими на тот момент времени критериями постановки диагноза и имевших, по крайней мере, 2 обострения заболевания за предыдущие два года. Второе исследование включало 251 пациента, получавших лечение в течение 35 месяцев (глатирамера ацетат — 125 пациентов, плацебо — 126 пациентов), третье исследование проводилось в течение 9 месяцев и включало 239 пациентов (глатирамера ацетат — 119 пациентов, плацебо — 120 пациентов), в этом исследовании были те же критерии включения, что и в первых двух исследованиях, и один дополнительный критерий — наличие у пациента по меньшей мере одного очага, накапливающего контраст (Gd+), визуализируемого на Т1-взвешенных МРТ изображениях.
В клинических исследованиях было отмечено значимое уменьшение количества обострений у пациентов с PC, получавших лечение глатирамера ацетатом, по сравнению с группой плацебо.
В самом крупном контролируемом исследовании частота обострений в группе глатирамера ацетата (ГА) по сравнению с группой плацебо снизилась на 32 % (1,98 в группе плацебо и 1,34 в группе ГА).
В настоящее время имеются данные о 103 пациентах, получающих лечение глатирамера ацетатом в течение 12 лет.
Глатирамера ацетат также продемонстрировал превосходство над плацебо во влиянии на МРТ, характерные для рецидивирующе-ремиттирующего PC.
Нет доказательств того, что лечение глатирамера ацетатом влияет на прогрессирование инвалидизации, продолжительность и тяжесть рецидивов.
В настоящее время нет данных относительно применения препарата у пациентов с первично- или вторично-прогрессирующим рассеянным склерозом.
Клинически изолированный синдром (КИС)
Было проведено одно плацебо-контролируемое клиническое исследование (КИ), включавшее 481 пациента (глатирамера ацетат — 243 пациента, плацебо — 238 пациентов), с достоверным единичным монофокальным неврологическим проявлением и МРТ признаками, более вероятными для PC (по крайней мере 2 очага в головном мозге, более 6 мм в диаметре на Т2-взвешенных МРТ изображениях) (КИС). Пациенты исключались из исследования, если симптом(ы) можно было объяснить любыми другими заболеваниями, нежели PC. После плацебо-контролируемой фазы исследования пациенты продолжали лечение в открытой фазе (без плацебо): после перехода в клинически достоверный рассеянный склероз (КДРС) или после трёх лет лечения, в зависимости от того, что наступит раньше. Открытая фаза лечения продолжалась 2 года, при этом общая продолжительность лечения не должна была превышать 5 лет. Из 243 пациентов, изначально распределённых в группу лечения глатирамера ацетатом, 198 пациентов продолжили терапию в открытой фазе исследования. Из 238 пациентов, изначально распределённых в группу плацебо, 211 пациентов перешли в группу лечения глатирамера ацетатом во время открытой фазы исследования.
Во время плацебо-контролируемой фазы КИ продолжительностью 3 года, глатирамера ацетат статистически достоверно замедлял переход от КИС в клинически диагностируемый PC (в соответствии с критериями Позера), снижая риск трансформации на 45 % (Hazard Ratio/отношение рисков = 0,55; 95 % ДИ [0,40; 0,77], p = 0.0005). Доля пациентов, у которых КИС переходил в КДРС, составила 43 % в группе плацебо и 25 % в группе пациентов, получавших глатирамера ацетат.
Положительный лечебный эффект по сравнению с плацебо был также продемонстрирован во влиянии на количество новых очагов в головном мозге, визуализируемых на Т2-взвешенных изображениях и объём очагов на Т2-взвешенных изображениях по данным МРТ.
Фармакокинетика
Исследований фармакокинетики у пациентов не проводилось. Данные in vitro, а также ограниченные данные, полученные при участии здоровых добровольцев, показывают, что при подкожном введении активное вещество быстро абсорбируется, при этом большая часть его распадается на мелкие фрагменты в подкожной клетчатке.
Данные доклинических исследований
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности при многократном введении, репродуктивной токсичности, генотоксичности или канцерогенности, не указывают на наличие вредных факторов для человека, кроме данных, уже включённых в разделы данной инструкции по медицинскому применению препарата. Ввиду отсутствия данных по фармакокинетике, невозможно определить допустимые пределы концентрации у человека в сравнении с животным.
У небольшого количества крыс и обезьян, которым вводили препарат по меньшей мере в течение 6 месяцев, отмечалось отложение иммунных комплексов в почечных клубочках. В 2-летнем исследовании на крысах не наблюдалось отложения иммунных комплексов в почечных клубочках.
У сенсибилизированных животных (морских свинок и мышей) после введения препарата отмечалась анафилаксия. Актуальность этих данных для человека неизвестна.
Токсическое действие в месте инъекции после повторного введения препарата животным относится к распространённым реакциям.
Показания
Рецидивирующе-ремиттирующий рассеянный склероз.
Противопоказания
Гиперчувствительность к глатирамера ацетату или маннитолу, детский возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью
Предрасположенность к развитию аллергических реакций, сердечно-сосудистые заболевания, нарушение функции почек, беременность, период грудного вскармливания.
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных не показали репродуктивной токсичности.
В доклинических исследованиях у крыс и кроликов, получавших глатирамера ацетат путём подкожной инъекции в течение периода органогенеза, никаких неблагоприятных эффектов на развитие эмбриона-плода не наблюдалось при дозах до 37,5 мг/кг/день. У крыс, получавших подкожно глатирамера ацетат в дозах до 36 мг/кг с 15 дня беременности и во время лактации, существенного влияния на роды или на рост и развитие потомства не установлено.
Большинство данных о применении глатирамера ацетата у беременных женщин касались препарата в дозировке 20 мг/мл, который вводили подкожно один раз в день. Опыт применения препарата у беременных женщин указывает на отсутствие мальформативной или фетальной/неонатальной токсичности. На сегодняшний день отсутствуют соответствующие эпидемиологические данные. Отсутствуют адекватные и хорошо контролируемые исследования у беременных женщин. Поскольку исследования на животных не всегда могут предсказать реакции у человека, препарат не следует использовать во время беременности, за исключением случаев, когда ожидаемая польза для матери превосходит потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, выделяются ли глатирамера ацетата или его метаболиты в материнское молоко. Однако у крыс, получавших ежедневно подкожно глатирамера ацетат в дозах до 36 мг/кг начиная с 15-го дня беременности на протяжении всего периода кормления грудью, не установлено существенного влияния на рост и развитие потомства. Риск для новорождённых/младенцев не может быть исключён. Необходимо принять решение либо о прекращении грудного вскармливания, либо о прекращении терапии глатирамера ацетатом с учётом пользы грудного вскармливания для ребёнка и пользы терапии для женщины.
Способ применения и дозы
Глатирамера ацетат, 20 мг
В виде подкожных инъекций по 20 мг препарата Глацетат (один заполненный раствором препарата шприц для инъекций) один раз в сутки ежедневно предпочтительно в одно и то же время дня, минимальный интервал между инъекциями — 24 часа. Препарат не предназначен для внутривенного или внутримышечного введения.
Глатирамера ацетат, 40 мг
В виде подкожных инъекций по 40 мг препарата Глацетат (один заполненный раствором препарата шприц для инъекций) 3 раза в неделю, минимальный интервал между инъекциями — 48 часов. Препарат не предназначен для внутривенного или внутримышечного введения.
В настоящее время данные о длительности курса лечения отсутствуют. Решение о назначении длительного курса лечения должен принимать лечащий врач в каждом конкретном случае.
Пациентам рекомендуется пройти обучение по технике самостоятельного проведения инъекций. Первая инъекция (а также 30 минут после неё) должна проходить под наблюдением квалифицированного специалиста. Для снижения риска появления раздражения или боли в области инъекции каждый раз необходимо менять зону для введения инъекции.
Каждый шприц с препаратом Глацетат предназначен только для однократного применения. Препарат Глацетат в дозировке 20 мг/мл и препарат Глацетат 40 мг/мл применяются только в заявленном соответствующей дозировке режиме дозирования.
Рекомендации для пациентов по применению препарата
- Убедитесь в том, что у Вас есть все необходимое для инъекции: одноразовый шприц, заполненный раствором препарата Глацетат, контейнер для использованных шприцов, ватный тампон, смоченный спиртом.
- Возьмите один заполненный шприц из общей упаковки, которая должна храниться в холодильнике.
- Выдержите шприц с раствором при комнатной температуре не менее 20 минут.
- Перед введением препарата Глацетат тщательно вымойте руки с мылом.
- Внимательно осмотрите раствор в шприце. При наличии взвешенных частиц или изменений цвета раствора его не следует применять.
- Выберите место для инъекции. Возможные зоны для инъекций обозначены на рис.1: руки, бедра, ягодицы, живот (следует избегать зоны примерно 5 см вокруг пупка). Не следует проводить инъекцию в болезненные места, обесцвеченные, покрасневшие участки кожи или области с уплотнениями и узелками. Выбирая новое место, Вы сможете уменьшить неприятные ощущения и боль во время инъекции. Внутри каждой инъекционной зоны достаточно места для нескольких инъекций. Рекомендуется составить схему мест инъекций и иметь её при себе. Для инъекций на ягодицах и руках Вам потребуется помощь другого человека.
- Снимите защитный колпачок с иглы.
- Предварительно обработав место инъекции ватной салфеткой, смоченной спиртовым раствором, слегка соберите кожу в складку большим и указательным пальцами (рис. 2).
- Располагая иглу шприца перпендикулярно месту инъекции (рис. 3), проколите кожу и, равномерно надавливая на поршень шприца, введите его содержимое в место инъекции.
- Удалите иглу движением шприца перпендикулярно месту инъекции.
- Поместите шприц в контейнер для использованных шприцов.
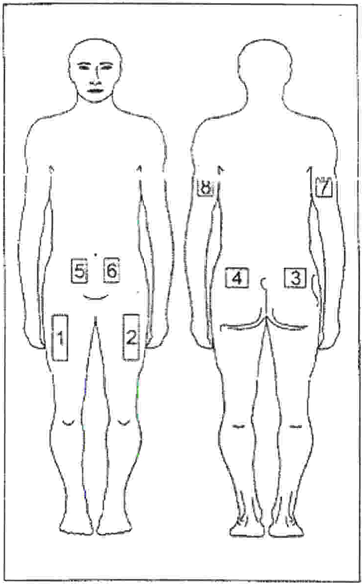
Рис. 1 Схема расположения мест инъекций
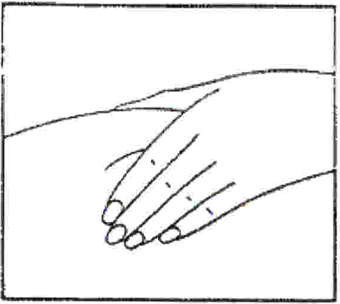
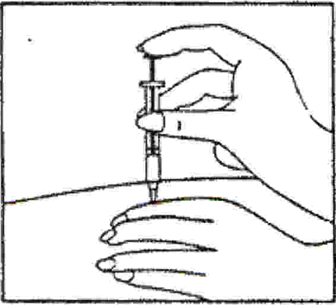
Если Вы забыли ввести препарат Глацетат, сделайте инъекцию немедленно, как только вспомнили об этом. Нельзя вводить двойную дозу препарата
Дети
Проспективные, рандомизированные, клинически контролируемые исследования среди детей и подростков не проводились Тем не менее, немногочисленные опубликованные данные свидетельствуют о том, что профиль безопасности у подростков в возрасте от 12 до 18 лет, ежедневно получавших глатирамера ацетат в дозировке 20 мг/мл подкожно, аналогичен профилю, наблюдаемому у взрослых. Нет достоверной информации о возможности применения препарата глатирамера ацетат в дозировке 20 мг/мл у детей младше 12 лет для того, чтобы рекомендовать лечение. Препарат глатирамера ацетат в дозировке 40 мг/мл, противопоказан для применения у пациентов до 18 лет, поскольку клинические исследования у этих возрастных групп не проводились. Таким образом, препарат Глацетат не должен применяться в данной возрастной группе.
Пациенты пожилого возраста
Эффективность и безопасность препарата у пожилых людей не изучались.
Пациенты с нарушением функции почек
Эффективность и безопасность препарата у пациентов с почечной недостаточностью не изучались.
Побочное действие
Большинство данных по безопасности применения глатирамера ацетата были накоплены на основании применения глатирамера ацетата в дозировке 20 мг/мл в виде ежедневных инъекций. В этом разделе представлены данные, накопленные за время проведения 4-х плацебо-контролируемых клинических исследований по применению глатирамера ацетата в виде п/к инъекций в дозе 20 мг/мл 1 раз в день и 1 плацебо-контролируемого исследования применения глатирамера ацетата в виде п/к инъекций в дозе 40 мг/мл 3 раза в неделю.
Глатирамера ацетат 20 мг/мл (применяется ежедневно)
Наиболее часто в ходе клинических исследований глатирамера ацетата отмечались реакции в месте инъекции. Проведённые плацебо-контролируемые исследования показали, что доля пациентов, сообщивших о данных нежелательных явлениях минимум один раз, составляла 70 % для глатирамера ацетата и 37 % — для плацебо. Чаще всего в клинических и пострегистрационных исследованиях наблюдались реакции в месте введения: покраснение, боль, уплотнение, зуд, отёк, воспаление и гиперчувствительность; и редко: липоатрофии и некроз кожи.
Реакция, ассоциированная, по крайне мере, с одним или более симптомов (вазодилатация, боль в груди, одышка, учащённое сердцебиение или тахикардия), которая проявляется через несколько минут после инъекции, называется немедленной постинъекционной реакцией. По крайне мере один из симптомов указанной реакции наблюдался минимум один раз у 31 % пациентов, получавших глатирамера ацетат, по сравнению с 13 % пациентов с плацебо.
Все нежелательные реакции, наиболее часто наблюдаемые у пациентов, получавших глатирамера ацетат по сравнению с группой плацебо, представлены ниже.
Частота развития нежелательных реакций классифицирована следующим образом: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (>1/10000, но <1/1000).
Инфекции и инвазии: очень часто — инфекции, грипп; часто — бронхит, гастроэнтерит, средний отит, Herpessimplex, ринит, периодонтальный абсцесс, вагинальный кандидоз*; нечасто — абсцесс, воспаление подкожно-жировой клетчатки, фурункулёз, пиелонефрит, Herpeszoster.
Новообразования, включая полипы и кисты: часто — доброкачественные новообразования кожи, новообразования; нечасто — рак кожи.
Со стороны кроветворной и лимфатической систем: часто — лимфаденопатия*, нечасто — лейкоцитоз, лейкопения, спленомегалия, тромбоцитопения, изменение морфологии лимфоцитов.
Со стороны иммунной системы: часто — реакции гиперчувствительности.
Со стороны эндокринной системы: нечасто — зоб, гипертиреоз.
Со стороны обмена веществ: часто — анорексия, увеличение массы тела*; нечасто — непереносимость алкоголя, подагра, гиперлипидемия, гипернатриемия, снижение концентрации ферритина в сыворотке крови.
Со стороны психики: очень часто — тревога*, депрессия; часто — нервозность; нечасто — необычные сновидения, спутанность сознания, эйфория, галлюцинации, агрессивность, мания, расстройство личности, суицидальные попытки.
Со стороны нервной системы: очень часто — головная боль; часто — извращение вкуса, гипертонус мышц, мигрень, нарушения речи, обмороки, тремор*; нечасто — туннельный синдром запястья, когнитивные расстройства, судороги, дисграфия, дислексия, дистония, нарушения моторных функций, миоклонус. неврит, нейромышечная блокада, нистагм, паралич, паралич малоберцового нерва, ступор, дефект полей зрения.
Со стороны органа зрения: часто — диплопия, нарушение зрения*; нечасто — катаракта, повреждение роговицы, сухость склеры и роговицы, кровоизлияние в глаз, птоз век, мидриаз, атрофия зрительного нерва.
Со стороны органа слуха и равновесия: часто — нарушение слуха.
Со стороны сердечно-сосудистой системы: очень часто — вазодилатация*; часто — ощущение сердцебиения*, тахикардия*; нечасто — экстрасистолия, синусовая брадикардия, пароксизмальная тахикардия, варикозное расширение вен.
Со стороны дыхательной системы: очень часто — одышка*; часто — кашель, сезонный ринит; нечасто — апноэ, ощущение удушья, носовое кровотечение, гипервентиляция лёгких, ларингоспазм, лёгочные нарушения.
Со стороны желудочно-кишечного тракта: очень часто — тошнота*; часто — аноректальные нарушения, запор, кариес, диспепсия, дисфагия, недержание каловых масс, рвота*; нечасто — колит, энтероколит, полипоз толстой кишки, отрыжка, язвенная болезнь пищевода, периодонтит, ректальное кровотечение, увеличение слюнных желёз.
Со стороны печени и желчевыводящих путей: часто — отклонение показателей печёночных проб; нечасто — желчнокаменная болезнь, гепатомегалия.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — кожная сыпь*; часто — экхимоз, гипергидроз, кожный зуд, заболевания кожи*, крапивница; нечасто — ангионевротический отёк, контактный дерматит, узловая эритема, кожные узелки.
Со стороны скелетно-мышечной системы и соединительной ткани: очень часто — артралгия, боль в спине*; часто — боль в шее; нечасто — артрит, бурсит, боль в боку, мышечная атрофия, остеоартрит.
Со стороны почек и мочевыделительной системы: часто — императивные позывы, поллакиурия, задержка мочи; нечасто — гематурия, нефролитиаз, заболевания мочевыделительного тракта, отклонения от лабораторных норм анализа мочи.
Беременность, послеродовое и перинатальное состояния: нечасто — самопроизвольный аборт.
Со стороны репродуктивной системы: нечасто — нагрубание молочных желез, эректильная дисфункция, пролапс тазовых органов, приапизм, заболевания простаты, отклонение в результатах цитологического исследования шейки матки, нарушение функции яичек, вагинальное кровотечение, вульвовагинальные нарушения.
Общие расстройства и нарушения в месте введения: очень часто — астения, боль в груди*, реакции в месте инъекции* и **, боль*; часто — озноб*, отёк лица*, атрофия в месте инъекции***, местные реакции*, периферический отёк, отёк, лихорадка; нечасто — гипотермия, немедленная постинъекционная реакция, воспаление, киста, похмельный синдром, заболевания слизистых оболочек, поствакцинальный синдром, некроз в месте инъекции.
* Вероятность возникновения таких случаев у пациентов, принимавших глатирамера ацетат составляет более 2% (>2/100) по сравнению с группой плацебо. Нежелательная реакция без знака «*» указывает на разницу, меньшую или равную 2 %.
** «Реакции в месте инъекции» (различные виды) включает любые нежелательные явления, возникающие в месте инъекции, за исключением атрофии и некроза, которые приведены отдельно.
*** Относится к локализованной липоатрофии в месте инъекции.
У пациентов с рассеянным склерозом, получавших глатирамера ацетат при проведении неконтролируемых клинических исследований, а также в период постмаркетингового применения, были зафиксированы редкие (≥1/10 000, но <1/1000) случаи анафилактоидных реакций.
В период постмаркетингового применения глатирамера ацетата были зафиксированы редкие случаи тяжёлых повреждений печени (включая печёночную недостаточность и гепатит с желтухой). Большинство случаев тяжёлой травмы печени разрешается с прекращением лечения. Повреждения печени происходили от нескольких дней до нескольких лет после начала лечения глатирамера ацетатом.
Глатирамера ацетат а дозировке 40 мг/мл (применяется три раза в неделю)
В двойном слепом, плацебо контролируемом клиническом исследовании, которое продолжалось 12 месяцев, оценивалась безопасность глатирамера ацетата в дозировке 40 мг/мл у 943 пациентов с диагнозом ремиттирующе-рецидивирующий-рассеянный склероз в сравнении с группой плацебо, включавшей 461 пациента.
В целом у пациентов, которые принимали глатирамера ацетат в дозировке 40 мг/мл три раза в неделю, нежелательные реакции в месте инъекции совпадали с теми, которые были отмечены при ежедневном введении глатирамера ацетата в дозировке 20 мг/мл.
В частности, реакции в месте инъекции (РМИ) и немедленные постинъекционные реакции (НПИР) при введении глатирамера ацетата в дозировке 40 мг/мл три раза в неделю наблюдались реже, чем при ежедневных инъекциях глатирамера ацетата в дозировке 20 мг/мл (35,5 % по сравнению с 70 % для РМИ и 7,8 % по сравнению с 31 % для НПИР соответственно).
У 36 % пациентов при применении глатирамера ацетата в дозировке 40 мг/мл по сравнению с 5 % пациентов на фоне приёма плацебо наблюдались РМИ. У 8% пациентов, получавших глатирамера ацетат в дозировке 40 мг/мл, по сравнению с 2% пациентов, принимавших плацебо, были выявлены НПИР.
При этом были отмечены несколько специфических нежелательных реакций:
- у пациентов с рассеянным склерозом, получавших глатирамера ацетат в дозировке 20 мг/мл, при проведении неконтролируемых клинических исследований, а также по результатам постмаркетингового опыта применения в редких случаях (≥1/10 000, но <1/1000) наблюдалась анафилактическая реакция. У пациентов, принимавших глатирамера ацетат в дозировке 40 мг/мл, таких случаев было 0,3% (нечасто: ≥1/1000, но <1/100);
- ни одного случая некроза в месте инъекции выявлено не было;
- у 2,1 % пациентов, получавших глатирамера ацетат в дозировке 40 мг/мл (часто: ≥1/100, но <1/10), наблюдались случаи покраснения кожи и боли в конечностях, которые не выявлялись в случае применения глатирамера ацетат в дозировке 20 мг/мл;
- у одного пациента (0,1%), получавшего глатирамера ацетат в дозировке 40 мг/мл (нечасто: ≥1/1000, но <1/100), наблюдалось лекарственно-индуцированное поражение печени и токсический гепатит, которые также редко встречались у пациентов с рассеянным склерозом, принимавших глатирамера ацетат в дозировке 20 мг/мл в период постмаркетингового наблюдения.
В период постмаркетингового применения глатирамера ацетата в дозировке 40 мг/мл зафиксированы редкие случаи тяжёлых поражений печени (включая печёночную недостаточность и гепатит с желтухой). Большинство случаев тяжёлых поражений печени разрешались с прекращением лечения. Поражения печени происходили в период от нескольких дней до нескольких лет после начала лечения глатирамера ацетатом в дозировке 40 мг/мл.
Передозировка
Получено несколько сообщений о передозировке (до 300 мг глатирамера ацетата). Никаких побочных реакций, кроме перечисленных в разделе «Побочное действие», при этом не наблюдалось.
В случае передозировки показано тщательное наблюдение, симптоматическое и поддерживающее лечение.
Взаимодействие с другими лекарственными средствами
Взаимодействие между глатирамера ацетатом и другими лекарственными препаратами отдельно не оценивалось. Нет данных о взаимодействии с интерфероном бета.
При одновременном применении глатирамера ацетата в дозировке 20 мг/мл с препаратами, применяющимися для лечения рассеянного склероза, включая применение глюкокортикостероидов до 28 дней, клинически значимых взаимодействий не наблюдалось.
Выявлено увеличение случаев реакций в месте инъекций при одновременном введении глатирамера ацетата в дозировке 40 мг/мл с глюкокортикостероидами.
В исследовании in vitro было сделано предположение, что глатирамера ацетат имеет высокий уровень связи с белками плазмы крови и не вытесняется из связи с белком плазмы крови самостоятельно, а также фенитоином или карбамазепином. Тем не менее, поскольку глатирамера ацетат обладает потенциальным воздействием на протеин-связывающие вещества, необходимо контролировать его одновременное применение с другими лекарственными препаратами.
Особые указания
Начало лечения глатирамера ацетатом должно проводиться под контролем невролога и врача, имеющего опыт лечения рассеянного склероза. Препарат не показан для лечения первично- или вторично- прогрессирующего рассеянного склероза.
Пациенты должны быть проинформированы о возможности появления нежелательных реакций, в том числе немедленных постинъекционных реакций (приливы, боль в груди, одышка, учащённое сердцебиение), возникающих непосредственно после инъекции глатирамера ацетата (см. раздел «Побочное действие»). Большинство этих симптомов непродолжительны, спонтанно разрешаются без последствий.
При развитии серьёзных нежелательных реакций следует немедленно прекратить терапию и обратиться к лечащему врачу или вызвать скорую медицинскую помощь. Решение о применении симптоматической терапии принимает врач.
Нет доказательств того, что определённые группы пациентов в большей степени подвержены риску возникновения таких реакций. Тем не менее, пациенты с сердечно-сосудистыми заболеваниями должны находиться под наблюдением врача на протяжении всего периода лечения.
Было выявлено несколько случаев судорог и/или анафилактоидных или аллергических реакций. Также могут редко встречаться серьёзные реакции гиперчувствительности (бронхоспазм, анафилактическая реакция или крапивница). В случае тяжёлых реакций необходимо назначить соответствующее лечение и отменить приём препарата.
В сыворотке крови пациентов были обнаружены антитела к глатирамера ацетату. После курса лечения средней продолжительностью 3–4 месяца была зафиксирована их максимальная концентрация, которая впоследствии снижалась и стабилизировалась на уровне, чуть выше базового.
Нет данных, что антитела к глатирамера ацетату обладают нейтрализующим действием или оказывают влияние на клиническую эффективность препарата.
У пациентов с почечной недостаточностью следует контролировать функцию почек.
хотя нет убедительных доказательств, что отложение иммунных комплексов оказывает воздействие на клубочковую фильтрацию.
В период постмаркетингового применения глатирамера ацетата в дозировке 20 мг/мл и в дозировке 40 мг/мл зафиксированы редкие случаи тяжёлых повреждений печени (включая печёночную недостаточность и гепатит с желтухой) (см. раздел «Побочное действие»).
Влияние на способность управлять транспортными средствами, механизмами
Исследований по изучению влияния глатирамера ацетата на способность управлять транспортными средствами и механизмами не проводилось.
Форма выпуска
Раствор для подкожного введения, 20 мг, 40 мг.
Первичная упаковка лекарственного препарата.
По 1 мл раствора препарата в одноразовый шприц из бесцветного стекла типа I (Евр. Ф. или Ф. США) с пластиковым поршнем и резиновым уплотнителем поршня, с фиксированной иглой, защищённой двойным колпачком, состоящим из внутренней резиновой и внешней твёрдой пластиковой частей. На каждый шприц наклеивают самоклеящуюся этикетку.
Вторичная упаковка лекарственного препарата.
Для дозировки 20 мг/мл:
По 1 шприцу помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной.
По 1 контурной пластиковой подложке помещают в пачку из картона. По 28 или 30 пачек с одним шприцем вместе с инструкцией по применению помещают в коробку из картона. По 5 шприцев помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной. По 6 контурных пластиковых подложек (по 5 шприцев) вместе с инструкцией по применению помещают в пачку из картона.
По 7 шприцев помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной. По 4 контурных пластиковых подложек (по 7 шприцев) вместе с инструкцией по применению помещают в пачку из картона.
Для дозировки 40 мг/мл:
По 1 шприцу помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной.
По 1 контурной пластиковой подложке помещают в пачку из картона. По 6 или 12 пачек с одним шприцем вместе с инструкцией по применению помещают в коробку из картона.
По 3 шприца помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной. По 4 контурных пластиковых подложек (по 3 шприца) вместе с инструкцией по применению помещают в пачку из картона.
По 7 шприцев помещают в немаркированную контурную пластиковую подложку из плёнки поливинилхлоридной/ полиэтилентерефталатной. По 2 контурных пластиковых подложек (по 7 шприцев) вместе с инструкцией по применению помещают в пачку из картона.
Хранение
При температуре от 2 до 8°С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Фармасинтез, АО, Российская Федерация
Владелец регистрационного удостоверения
АО «Фармасинтез», Россия
664007, Иркутская обл., г. Иркутск, ул. Красногвардейская, д. 23, офис 3
Производитель
АО «Фармасинтез», Россия,
Юридический адрес:
664007, Иркутская обл., г. Иркутск, ул. Красногвардейская, д. 23, офис 3
Адрес производственной площадки:
г. Иркутск, ул. Р. Люксембург, д. 184
Организация, принимающая претензии потребителей
АО «Фармасинтез», Россия,
г. Иркутск, ул. Р. Люксембург, д. 184
Тел.: 8-800-100-15-50,
www.pharmasyntez.com
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Глацетат:
