Идельвион®
IdelvionРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
| 1 флакон с лиофилизатом содержит: | |||||
| Компонент | Количество | ||||
|---|---|---|---|---|---|
| Действующее вещество | |||||
| 250 ME | 500 ME | 1000 ME | 2000 ME | ||
| Вспомогательные вещества | |||||
| Натрия цитрата дигидрат | 18,4 мг | 18,4 мг | 18,4 мг | 36,8 мг | |
| 45 мг | 72,5 мг | 72,5 мг | 145 мг | ||
| 0,15 мг | 0,3 мг | 0,6 мг | 1,2 мг | ||
| 17,5 мг | 30 мг | 30 мг | 60 мг | ||
| Кислота хлористоводородная | q.s. для доведения pH до 6,8 | ||||
| 1 флакон с растворителем содержит: | |||||
| Вода для инъекций | 2,5 мл | 2,5 мл | 2,5 мл | 5 мл | |
Описание
Лиофилизат: цельная или растрескавшаяся плотная масса, от белого до светло-жёлтого цвета.
Восстановленный раствор: прозрачная или слегка опалесцирующая жидкость от бесцветного до жёлтого цвета.
Растворитель: бесцветная прозрачная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Дозировка 250 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 100 МЕ/мл албутрепенонакога альфа.
Дозировка 500 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 200 МЕ/мл албутрепенонакога альфа.
Дозировка 1000 ME: после восстановления 2,5 мл воды для инъекций раствор содержит 400 МЕ/мл албутрепенонакога альфа.
Дозировка 2000 ME: после восстановления 5 мл воды для инъекций раствор содержит 400 МЕ/мл албутрепенонакога альфа.
Албутрепенонаког альфа представляет собой очищенный белок, получаемый с помощью технологии рекомбинантной ДНК посредством гибридного слияния рекомбинантного альбумина с рекомбинантным фактором свёртывания крови Ⅸ. Гибридное слияние кДНК альбумина человека с кДНК факторфактор свёртывания крови Ⅸ свёртывания крови Ⅸ человека позволяет получать белок в виде отдельного рекомбинантного белка с гарантированной однородностью продукта, избегая химической конъюгации. Фрагмент рекомбинантного фактора Ⅸ идентичен аллельной форме Thr148 фактора Ⅸ, полученного из плазмы. Расщепляемый линкёр между рекомбинантным фактором Ⅸ и молекулами альбумина получают из эндогенного нативного «активационного пептида» в факторе Ⅸ.
Фармакодинамика
Препарат Идельвион® является рекомбинантным фактором свёртывания крови Ⅸ, соединённым с рекомбинантным альбумином, применяемым для лечения гемофилии B у взрослых и детей. Удлинение периода полувыведения албутрепенонаког альфа и усиление системного воздействия достигаются за счёт его гибридного слияния с рекомбинантным альбумином. Структурные и функциональные свойства рекомбинантного фактора свёртывания крови Ⅸ сходны с эндогенным фактором свёртывания крови Ⅸ. Альбумин — естественный, инертный белок-переносчик в плазме крови с периодом полувыведения около 20 дней. Гибридное слияние рекомбинантного фактора свёртывания крови Ⅸ с альбумином увеличивает период полувыведения фактора Ⅸ. При попадании в сосудистое русло препарат Идельвион® остаётся интактным до активации фактора Ⅸ. альбумин расщепляется, высвобождая активированный фактор Ⅸ (фактор Ⅸa), необходимый для нормального свёртывания крови.
Гемофилия B — сцепленное с полом наследственное нарушение свёртывания крови в связи с пониженным уровнем активности фактора Ⅸ, приводящее массивным кровоизлияниям в суставы, мышцы и внутренние органы, как спонтанно, так и в результате травм и оперативных вмешательств. При заместительной терапии уровни фактора Ⅸ в плазме крови повышаются, обеспечивая временную коррекцию дефицита фактора и уменьшает эпизоды кровотечений.
Фактор Ⅸ активируется под влиянием комплекса фактора Ⅶ/тканевого фактора во внешнем пути активации свёртывания крови, также, как и фактор Ⅺa во внутреннем пути коагуляции. Активированный фактор Ⅸ совместно с активированным фактором Ⅷ активирует фактор Ⅹ. Это, в конечном итоге, способствует превращению протромбина в тромбин. Затем тромбин превращает фибриноген в фибрин и формируется тромб. Активность фактора Ⅸ отсутствует или значительно снижена у пациентов с гемофилией В. поэтому таким пациентам может потребоваться заместительная терапия.
Общая информация о клинической эффективности и безопасности
С целью оценки эффективности лечения и профилактики эпизодов кровотечения было проведено исследование фазы 1/2 препарата Идельвион® у 17 пациентов (в возрасте от 13 до 46 лет). 13 пациентов в группе профилактики получали препарат Идельвион® еженедельно с целью профилактики приблизительно в течение 11 месяцев, 4 пациента в группе лечения по требованию получали препарат Идельвион® при возникновении эпизодов кровотечения. Все 85 случаев кровотечения были успешно устранены с помощью 1–2 доз препарата Идельвион®.
Эффективность препарата Идельвион® оценивали в открытой, неконтролируемой части исследования фазы 2/3, в которой 63 пациента мужского пола, ранее получавших лечение, в возрасте от 12 до 61 лет, получали препарат Идельвион® в качестве профилактики каждые 7, 10 и/или 14 дней и/или для лечения эпизодов кровотечений по требованию. У всех пациентов была гемофилия В тяжёлой (уровень фактора Ⅸ <1 %) или умеренной степени (уровень фактора Ⅸ ≤2 %). Сорок пациентов, ранее получавших лечение, получали препарат Идельвион® в качестве профилактики.
Пациенты, получавшие профилактическое лечение, начинали терапию с дозы 35–50 МЕ/кг один раз в неделю. Подгруппа пациентов была переведена на удлинённые интервалы между введениями препарата (каждые 10 или 14 дней) в рекомендованной дозе 75 МЕ/кг, либо дозу корректировали индивидуально. 21 пациентов, ранее получавших лечение, продолжали получать профилактическое лечение с удлинёнными 14-дневными интервалами между введениями препарата дополнительно в течение 98–575 дней (медиана: 386 дней). Из числа данных пациентов 8 (38 %) имели, как минимум, один эпизод кровотечения за 14-дневный период профилактики, тогда как при введении препарата с недельными интервалами случаев кровотечений не отмечалось. Медиана среднегодовой частоты кровотечений при 7-дневном профилактическом режиме применения препарата Идельвон® в отношении всех кровотечений составила 0,0 (диапазон 0–6), и при 14-дневном режиме профилактики — 1,08 (диапазон 0–9,1).
Долгосрочная эффективность и безопасность стандартного профилактического лечения была подтверждена в открытом продлённом исследовании продолжительностью до 5 лет. В данном исследовании 59 пациентов, ранее получавших лечение в возрасте ≥12 лет (54 взрослых и 5 подростков) получали препарат Идельвион® с целью профилактики и/или для лечения эпизодов кровотечений по требованию.
Пациенты, получавшие профилактическое лечение, начинали с дозы 35–50 МЕ/кг один раз в неделю или продолжали приём такой дозы. Подгруппа пациентов, переведённых на режим с продлённым интервалом терапии (каждые 10, 14 дней или 21 день) в рекомендованной дозе 75 МЕ/кг (10 или 14 дней) или 100 МЕ/кг (21 день). В конце исследования 14 (24%) пациентов, ранее получавших лечение, получали профилактическое лечение с 7-дневным интервалом, 11 (19 %), 25 (42 %) и 9 (15 %) пациентов, ранее получавших лечение, продолжали получать режим с продлённым интервалом в 10, 14 дней и 21 день, соответственно. В ходе исследования 2 (18 %) пациента, ранее получавших лечение, получавших терапию с 21-дневным режимом, были переведены обратно на режим с более частым применением препарата в связи с увеличением частоты геморрагических осложнений. Расчётная медиана среднегодовой частоты кровотечений при профилактическом лечении препаратом Идельвион® с 7-, 14- и 21-дневным интервалом (все кровотечения) составляла 1,3 случая (диапазон: 0–8 случаев), 0,9 случаев (диапазон: 0–13 случаев) и 0,3 случая (диапазон: 0–5 случаев), соответственно.
Имеющаяся в настоящее время информация поддерживает удлинение интервала между введениями препарата у некоторых пациентов, хотя это может быть связано с повышением риска кровотечений по сравнению с применением препарата с недельными интервалами. Следует отметить, что среднегодовая частота кровотечений не сопоставима между различными концентратами фактора и в различных клинических исследованиях.
Профилактика и контроль кровотечений у пациентов младше 12 лет, ранее получавших лечение
Эффективность препарата Идельвион® изучали в исследовании фазы 3, в котором 27 пациентов, ранее получавших лечение — мальчиков в возрасте 1–10 лет (медиана возраста 6,0 лет), 12 из них в возрасте <6 лет, получали препарат Идельвион® для профилактики и контроля эпизодов кровотечений. Все 27 пациентов получали еженедельное профилактическое лечение препаратом Идельвион®, в среднем, в течение 13,1 месяцев (9, 18 месяцев).
Из 106 эпизодов кровотечений большинство (94; 88,7 %) были купированы с помощью одной инъекции, 103; 97,2 % были купированы с помощью 1–2 инъекций. Гемостатическую эффективность при разрешении кровотечения оценивали, как «отличную» или «хорошую» в 96 % от всех эпизодов кровотечений.
Долгосрочная эффективность и безопасность стандартного профилактического лечения была подтверждена в открытом продлённом исследовании продолжительностью до 5 лет. В исследовании 24 пациента, ранее получавших лечение в возрасте <12 лет, получали препарат Идельвион® с целью профилактики и/или для лечения эпизодов кровотечений по требованию.
Пациенты, получавшие профилактическое лечение, продолжали получать дозу 35–50 МЕ/кг один раз в неделю. Подгруппа пациентов была переведена на режим с продлённым интервалом введения (каждые 10 или 14 дней) в рекомендованной дозе 75 МЕ/кг. В конце исследования 17 (71 %) ранее леченных пациентов, получали профилактическое лечение с 7-дневным интервалом, 3 (12 %) и 4 (17 %) ранее леченных пациентов продолжали получать режим с интервалом, продлённым до 10 и 14 дней, соответственно. В ходе исследования 4 (50 %) пациента, ранее леченных пациента, получавшие терапию с 14-дневным режимом, были переведены обратно на режим с более частым применением препарата в связи с увеличением частоты геморрагических осложнений. Расчётная медиана среднегодовой частоты кровотечений при профилактическом применении препарата Идельвион® с 7- и 14-дневным интервалом (все кровотечения) составила 2,0 случая (диапазон: 0–14 случаев) и 5,6 случая (диапазон: 0–8 случаев), соответственно.
Периоперационное лечение
Безопасность и эффективность препарата Идельвион® в периоперационных условиях оценивали в двух базовых исследованиях фазы 3 и в долгосрочном расширенном исследовании. Анализ эффективности в соответствии с протоколом включает 30 операций, проведённых у 21 пациента в возрасте от 5 до 58 лет, которым проводили обширные и малые хирургические вмешательства, стоматологические и другие инвазивные хирургические процедуры. Дозу подбирали индивидуально в зависимости от фармакокинетики у пациента и клинического ответа на лечение. При 96,7 % (n = 29) хирургических вмешательствах препарат вводили однократно болюсно в дозе от 14 до 163 МЕ/кг. Гемостатическую эффективность оценивали, как «отличную» или «хорошую» при всех исследуемых процедурах. В течение 14-дневного послеоперационного периода пациенты получали от 0 до 11 инфузий, общие дозы варьировали от 0 до 444 МЕ/кг.
Фармакокинетика
Взрослые пациенты
Фармакокинетику препарата Идельвион® оценивали после внутривенного введения однократной дозы 50 МЕ/кг. Фармакокинетические (ФК) параметры были основаны на активности фактора Ⅸ в плазме, измеренной с помощью одностадийного анализа коагулирующей активности (см. таблицу 1). Средняя величина активности фактора Ⅸ после однократной дозы 50 МЕ/кг препарата Идельвион® на 7 и 14 день составила 13,76 % и 6,10 % соответственно. Повторная оценка ФК параметров на протяжении до 30 недель показала стабильный профиль фармакокинетики, а постепенное восстановление активности в динамике было стабильным.
Минимальные уровни от 5–10 % были проанализированы в клинических исследованиях с целью обеспечения контроля кровотечений в период профилактики. Исходя из результатов ФК-имитации, время до достижения 5 % активности фактора Ⅸ в плазме крови после однократной инъекции 50 МЕ/кг препарата Идельвион® составляет 12,5 дней у взрослых пациентов.
| Параметр | Доза 50 МЕ/кг (n = 22) |
|---|---|
| ППАа (МЕ/дл)/(МЕ/кг) | 1,18 (0,86; 1.86) |
| Cmaxа(МЕ/дл) | 62,7 (40,5; 87,0) |
| AUC0–inf (ч × МЕ/дл) | 6638 (2810; 9921) |
| t½ (4) | 95,3 (51,5; 135,7) |
| КЛ (мл/ч/кг) | 0,875 (0,748; 1,294) |
а = скорректировано с учётом исходных уровней.
ППА = показатель повышения активности фактора Ⅸ; AUC = площадь под кривой зависимости активности фактора Ⅸ от времени; КЛ = клиренс, скорректированный с учётом массы тела; ½ = период полувыведения.
Пациенты детского возраста
Фармакокинетику препарата Идельвион® у детей и подростков (в возрасте от 1 года до 18 лет) оценивали после внутривенного введения однократной дозы 50 МЕ/кг. Фармакокинетические параметры основаны на активности фактора Ⅸ в плазме, измеренной с помощью одностадийного анализа коагулирующей активности (см. таблицу 2).
| Параметр | Возраст от 1 до 6 лет (n = 12) | Возраст от 6 до 12 лет (n = 15) | Возраст от 12 до 18 лет (n = 5) |
|---|---|---|---|
| ППАа (МЕ/дл)/(МЕ/кг) | 0,968 (0,660; 1,280) | 1,07(0,70; 1,47) | 1,11 (0.84; 1,61) |
| Cmaxа (МЕ/дл) | 48.2 (33,0; 64,0) | 50,5 (34,9; 73,6) | 55,3 (40,5; 80,3) |
| AUC0–inf (ч × МЕ/дл) | 4301 (2900; 8263) | 4718 (3212; 7720) | 4804 (2810; 9595) |
| t½ (ч) | 86,2 (72,6; 105,8) | 89,0 (62,1; 123,0) | 88,8 (51,5; 130,0) |
| КЛ (мл/ч/кг) | 1,16 (0,61; 1,72) | 1,06 (0.65; 1,56) | 1,04 (0,52; 1,67) |
а = скорректировано с учётом исходных уровней.
ППА = показатель повышения активности фактора Ⅸ; AUC = площадь под кривой зависимости активности фактора Ⅸ от времени; КЛ = клиренс, скорректированный с учётом массы тела; t½ = период полувыведения.
Минимальные уровни клинически значимой активности фактора Ⅸ от 5–10 % были проанализированы в клинических исследованиях с целью обеспечения контроля кровотечений в период профилактики. Исходя из результатов ФК-имитации, время до достижения 5 % активности фактора Ⅸ в плазме крови после однократной инъекции 50 МЕ/кг препарата Идельвион® составляет 7 дней у детей в возрасте от 1 до <6 лет, 9 дней от 6 до <12 лет и 11 дней от 12 до <18 лет.
Показания
Лечение и профилактика кровотечений у пациентов с гемофилией B (врождённый дефицит фактора свёртывания крови Ⅸ).
Препарат Идельвион® показан к применению во всех возрастных группах.
Противопоказания
Гиперчувствительность к действующему веществу, белкам хомяка или непереносимость любого из компонентов, входящих в состав препарата.
С осторожностью
- Заболевания печени
- послеоперационный период
- пациенты с риском развития тромбозов или диссеминированного внутрисосудистого свёртывания крови (ДВС-синдром)
- возраст до 1 года и более 65 лет (отсутствие данных об эффективности и безопасности).
Применение при беременности и в период грудного вскармливания
Доклинических исследований репродуктивной токсичности фактор свёртывания крови Ⅸ не проводилось. Учитывая, что гемофилия типа В очень редко наблюдается у женщин, отсутствуют данные об опыте применения препаратов фактора Ⅸ во время беременности и в период грудного вскармливания. В связи с этим во время беременности и в период грудного вскармливания препарат Идельвион® рекомендуется применять при наличии чётких клинических показаний.
Отсутствуют данные о влиянии препаратов фактора свёртывания крови Ⅸ на фертильность.
Способ применения и дозы
Только для внутривенного введения! Терапия препаратом Идельвион® должна проводиться врачами, имеющими опыт лечения пациентов с гемофилией B.
Пациенты, ранее не получавшие лечение
Безопасность и эффективность препарата Идельвион® у пациентов, ранее не получавших лечения, на сегодняшний день не установлены.
Контроль лечения
В ходе лечения рекомендуется определять уровень фактора Ⅸ для регулирования дозы и частоты повторных инфузий. У разных пациентов могут варьировать реакции на введение фактора Ⅸ с различными периодами полувыведения и восстановлением. Доза, рассчитанная, исходя из массы тела, может потребовать корректировки у пациентов с недостаточной или избыточной массой тела. В случае обширных хирургических вмешательств, в частности, тщательный контроль заместительной терапии посредством анализа свёртываемости крови (активность фактора Ⅸ в плазме крови) является обязательным.
При использовании активированного частичного тромбопластинового времени (АЧТВ) на основе in vitro одностадийного анализа коагулирующей активности для определения активности фактора Ⅸ в образцах крови пациентов результаты активности фактора свёртывания Ⅸ в плазме могут в значительной степени изменяться под влиянием типа АЧТВ-реагента и стандартного образца, используемых при количественном определении. Измерение с помощью одностадийного анализа коагулирующей активности с использованием АЧТВ-реагента на основе каолина или АЧТВ-реагента на основе Актина FS, скорее всего, приведёт к заниженному результату уровня активности. Это имеет особое значение при смене лаборатории и/или реагентов, используемых при количественном определении.
Режим дозирования
Дозы и продолжительность заместительной терапии препаратом Идельвион® зависят от степени тяжести дефицита фактора Ⅸ, локализации и выраженности кровотечения и клинического состояния пациента.
Количество вводимых единиц фактора Ⅸ измеряется в международных единицах (ME), что соответствует действующему стандарту Всемирной Организации Здравоохранения (ВОЗ) для препаратов, содержащих фактор свёртывания крови Ⅸ. Активность фактора Ⅸ в плазме выражается в процентах (относительно нормальной плазмы человека) или в ME (относительно международного стандарта содержания фактора Ⅸ в плазме).
1 ME активности фактора свёртывания крови Ⅸ эквивалентна количеству фактора Ⅸ в 1 мл нормальной плазмы человека.
Лечение по требованию
Расчёт необходимой дозы фактора Ⅸ основывается на эмпирически определённой закономерности, согласно которой 1 ME фактора свёртывания крови Ⅸ на килограмм массы тела повышает активность фактора Ⅸ в крови в среднем примерно на 1,3 МЕ/дл (1,3 % от исходной активности) у пациентов >12 лет и на 1,0 МЕ/дл (1,0 % от исходной активности) у пациентов <12 лет.
Необходимую дозу рассчитывают с использованием следующей формулы:
Необходимая доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (% от нормальной активности или МЕ/дл) × (обратная величина наблюдаемого восстановления (МЕ/кг на МЕ/дл)).
Ожидаемый уровень повышения фактора Ⅸ (МЕ/дл или % от нормальной активности) = Доза (ME) × Восстановление (МЕ/дл на МЕ/кг)/масса тела (кг)
При выборе дозы и частоты введения препарата следует всегда ориентироваться на клиническую эффективность в каждом индивидуальном случае.
Для пациентов <12 лет
Для постепенного восстановления 1 МЕ/дл на 1 МЕ/кг дозу рассчитывают следующим образом:
Доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (МЕ/дл) × 1 дл/кг.
Пример:
1. Максимальный уровень 50 % от нормальной активности требуется пациенту с массой тела 20 кг и тяжёлой гемофилией В.
Соответствующая доза составит 20 кг × 50 МЕ/дл × 1 дл/кг = 1000 ME.
2. Доза 1000 ME препарата Идельвион®, вводимая пациенту с массой тела 25 кг, должна обеспечить максимальное повышение уровня фактора свёртывания крови Ⅸ после инъекции 1000 МЕ/25 кг × 1,0 (МЕ/дл на МЕ/кг) = 40 МЕ/дл (40 % от нормальной активности).
Для пациентов ≥12 лет
Для постепенного восстановления 1,3 МЕ/дл на 1 МЕ/кг дозу рассчитывают следующим образом:
Доза (ME) = масса тела (кг) × желаемый уровень повышения фактора Ⅸ (МЕ/дл) × 0,77 дл/кг.
Пример:
3. Максимальный уровень 50 % от нормальной активности требуется пациенту с массой тела 80 кг и тяжёлой гемофилией B.
Соответствующая доза составит 80 кг × 50 МЕ/дл × 0,77 дл/кг = 3080 ME.
4. Доза 2000 ME препарата Идельвион®, вводимая пациенту с массой тела 80 кг, должна обеспечить максимальное повышение уровня фактора свёртывания крови Ⅸ после инъекции 2000 ME × 1,3 (МЕ/дл на МЕ/кг)/80 кг = 32,5 МЕ/дл (32,5 % от нормальной активности).
Доза и частота введения должна рассчитываться с учётом клинической эффективности в каждом индивидуальном случае.
В случаях кровотечений, приведённых в таблице 3, активность фактора Ⅸ за соответствующий период времени не должна быть ниже указанного в таблице уровня активности плазмы (в % от нормального уровня или МЕ/дл). Таблица 3 может быть использована для расчёта доз препарата при кровотечениях и в хирургической практике.
| Тяжесть кровотечения / тип хирургического вмешательства | Требуемый уровень фактора Ⅸ (% или МЕ/дл) | Частота введения доз (часы) / продолжительность терапии (дни) |
|---|---|---|
| Кровотечение Слабовыраженный или умеренный гемартроз, внутримышечное кровотечение (кроме подвздошно-поясничной мышцы) или кровотечение в полости рта | 30–60 | Однократной дозы должно быть достаточно для большинства кровотечений. Повторное введение через 24–72 часа при наличии признаков продолжающегося кровотечения. |
| Массивные кровотечения Кровотечения, представляющие угрозу для жизни, кровотечения в глубоких мышцах, включая подвздошно-поясничную мышцу | 60–100 | Повторные инфузии каждые 24–72 часа в течение первой недели, затем поддерживающая доза еженедельно до прекращения кровотечения или заживления. |
| Малые хирургические вмешательства Включая неосложнённое удаление зубов | 50–80 (начальный уровень) | Однократной дозы может быть достаточно для большинства кровотечений. При необходимости повторную дозу можно вводить через 24–72 часа до прекращения кровотечения или заживления. |
| Большие хирургические вмешательства | 60–100 (начальный уровень) | Повторные инфузии каждые 24–72 часа в течение первой недели, затем поддерживающая доза 1–2 раза в неделю до прекращения кровотечения или заживления. |
Профилактическое лечение
После эпизода кровотечения следует строго соблюдать профилактический режим путём введения 2 доз препарата Идельвион® с интервалом не менее 24 часов между ними, возможен более длительный интервал, исходя из состояния пациента.
При долгосрочной профилактике кровотечений у пациентов с тяжёлой формой гемофилии B препарат Идельвион® обычно применяется в дозе от 35 до 50 МЕ/кг один раз в неделю. Некоторым пациентам, находящимся на контроле при введении препарата один раз в неделю, можно назначать до 75 МЕ/кг с интервалом от 10 или 14 дней. У пациентов старше 18 лет возможно увеличение интервала терапии (см. раздел «Фармакологические свойства. Фармакодинамика»).
В некоторых случаях, особенно у молодых пациентов, могут потребоваться более короткие интервалы или более высокие дозы.
Пациенты детского возраста
Для стандартной профилактики кровотечений рекомендованный режим дозирования составляет от 35 до 50 МЕ/кг один раз в неделю (см. раздел «Фармакологические свойства. Фармакодинамика» и раздел «Фармакологические свойства. Фармакокинетика»).
Способ введения
Восстановленный раствор вводят внутривенно медленно. Рекомендуемая скорость введения должна быть не более 5 мл/минуту.
Приготовление восстановленного раствора
Приготовление восстановленного раствора препарата следует проводить в асептических условиях. Для приготовления и введения препарата Идельвион® следует использовать только прилагаемые в комплекте растворитель и устройство для добавления растворителя Mix2Vial, так как в связи с адсорбцией фактора Ⅸ на внутренней поверхности некоторых устройств для введения лечение может оказаться неэффективным. Довести растворитель до комнатной температуры (около 25 °C). Убедиться, что крышки с флаконов с растворителем и препаратом удалены, пробки обработаны антисептическим раствором и высушены до открытия устройства для добавления растворителя Mix2Vial.
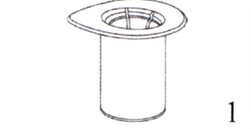
1. Снимите крышку с упаковки устройства для добавления растворителя со встроенным фильтром Mix2Vial. Не вынимайте устройство для добавления растворителя со встроенным фильтром Mix2Vial из блистерной упаковки!
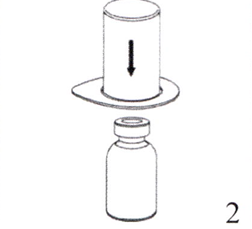
2. Поместите флакон с растворителем на ровную чистую поверхность, крепко удерживая его. Возьмите устройство Mix2Vial вместе с блистерной упаковкой и острым стержнем синей части устройства проткните пробку флакона с растворителем, надавливая вертикально вниз.
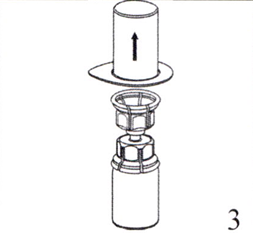
3. Аккуратно придерживая за край блистерной упаковки устройства Mix2Vial, снимите блистерную упаковку по направлению вертикально вверх. Убедитесь, что вы удалили только блистерную упаковку, а не само устройство Mix2Vial.
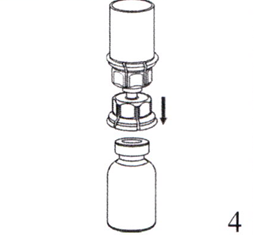
4. Поместите на ровную поверхность флакон с препаратом, и переверните над ним флакон с растворителем вместе с прикреплённым к нему устройством Mix2Vial, затем стержнем прозрачной части устройства для добавления растворителя проткните пробку флакона с препаратом, надавливая вертикально вниз. Растворитель автоматически переместится во флакон с препаратом.
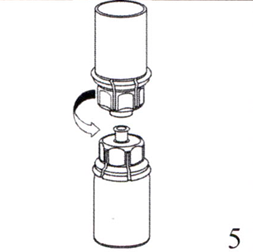
5. Одной рукой обхватите устройство для добавления растворителя Mix2Vial со стороны флакона с препаратом, другой — со стороны флакона с растворителем и, аккуратно развинтите устройство на две части, избегая сильного пенообразования при растворении лиофилизата. Флакон из под растворителя с синей частью присоединённого устройства для добавления растворителя Mix2Vial следует выбросить.
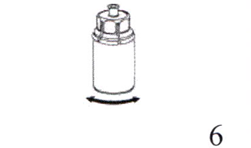
6. Аккуратно покрутите флакон с препаратом с присоединённым прозрачным устройством до полного растворения препарата. Не встряхивайте флакон.
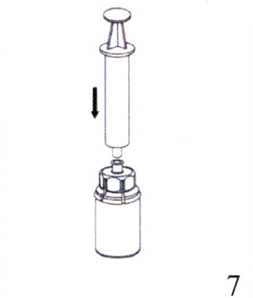
7. Наберите воздух в пустой стерильный шприц и, удерживая флакон с препаратом в вертикальном положении, присоедините шприц к наконечнику Люэра на устройстве Mix2Vial. Введите воздух во флакон с препаратом.
Набор и введение препарата
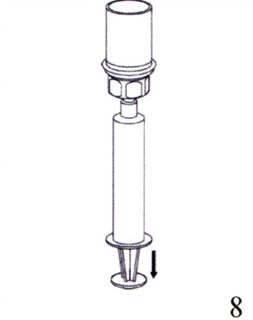
8. Нажимая на поршень шприца, переверните флакон вместе со шприцем. Плавно оттягивая поршень шприца, наберите в него восстановленный раствор.
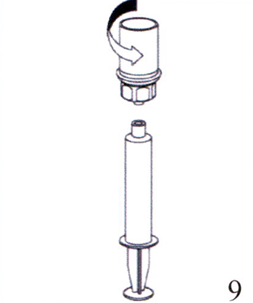
9. После того, как восстановленный раствор набран в шприц, обхватите цилиндр шприца (удерживая шприц вниз поршнем) и отсоедините прозрачное устройство Mix2Vial от шприца.
Восстановленный раствор должен быть прозрачным или слегка опалесцирующим, бесцветным или желтоватым. После фильтрования/извлечения (см. выше) и перед введением восстановленный раствор препарата следует проверить визуально на наличие механических включений и изменение цвета. Не использовать восстановленный раствор, если раствор помутнел или изменил цвет, а также, если в растворе наблюдаются механические включения! Восстановленный раствор готовят непосредственно перед применением. Неиспользованный раствор подлежит уничтожению.
При проведении инъекции не допускать попадания крови в шприц с препаратом, так как это может вызвать коагуляцию крови в шприце и попадания сгустков в кровоток пациента! Восстановленный раствор препарата Идельвион® дальнейшему разведению не подлежит. После восстановления химическая и физическая стабильность раствора во время использования сохраняется в течение 8 часов при температуре от 20 до 25 °C, однако форма выпуска не содержит консерванты, поэтому с микробиологической точки зрения препарат следует применять немедленно. Если его не использовали сразу, время и условия хранения до использования не должны превышать 4 часов при температуре не выше 25 °C.
Побочное действие
Гиперчувствительность или аллергические реакции (включая ангионевротический отёк, ощущение жжения и покалывания в месте введения, озноб, гиперемию, генерализованную крапивницу, головную боль, кожную сыпь, артериальную гипотензию, заторможенность, тошноту, беспокойство, тахикардию, ощущение сдавления в грудной клетке, звон в ушах, рвоту, свистящее дыхание) наблюдаются редко и могут прогрессировать вплоть до развития тяжёлой анафилаксии (включая шок). В некоторых случаях данные реакции прогрессировали до тяжёлой анафилаксии и возникали в тесной временной взаимосвязи с образованием ингибиторов фактора Ⅸ (см. также раздел «Особые указания»). Сообщалось о развитии нефротического синдрома после попытки индукции иммунной толерантности у пациентов с гемофилией типа В, наличием ингибиторов к фактору Ⅸ и случаев аллергических реакций в анамнезе.
Очень редко сообщалось об образовании антител к белкам хомяков.
У пациентов с гемофилией B могут образовываться нейтрализующие антитела (ингибиторы) к фактору свёртывания крови Ⅸ. При появлении таких ингибиторов состояние проявляется в виде недостаточного клинического ответа. В таких случаях рекомендуется связаться со специализированным центром по лечению гемофилии. Образование ингибиторов отмечалось, как и в продолжающемся клиническом исследовании с участием ранее не леченных пациентов, так и у ранее леченных пациентов в пострегистрационном периоде применения препарата Идельвион®.
Существует потенциальный риск развития эпизодов тромбоэмболии после введения препаратов, содержащих фактор Ⅸ, особенно высокий при применении препаратов низкой степени очистки. Применение препаратов фактора Ⅸ низкой степени очистки приводило к случаям инфаркта миокарда, диссеминированного внутрисосудистого свёртывания, венозного тромбоза и тромбоэмболии лёгочной артерии. Применение препаратов фактора Ⅸ с высокой степенью очистки редко приводило к подобным нежелательным реакциям.
Тип, частота и тяжесть нежелательных реакций у детей сопоставимы с таковыми у взрослых пациентов.
Табличный перечень нежелательных реакций
В ходе пяти открытых клинических исследований с участием 114 пациентов, получивших как минимум одну дозу препарата Идельвион®, в общем было выявлено 14 нежелательных реакций у 8 пациентов.
Ниже представлены нежелательные реакции с частотой возникновения согласно классификации MedDRA. Частота указана по следующим категориям: очень часто (≥1/10), часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000) очень редко (<1/10000), неизвестно (частота не может быть оценена на основании имеющихся данных).
| Классификация в соответствии с поражением органов и систем органов (MedDRA) | Нежелательные реакции | Частота встречаемости на пациента |
| Нарушения со стороны крови и лимфатической системы | Ингибирование фактора Ⅸ/образование ингибиторов | Частота неизвестна |
| Общие нарушения и реакции в месте введения | Реакции в месте введения | Часто |
| Нарушения со стороны иммунной системы | Гиперчувствительность | Нечасто |
| Нарушения со стороны нервной системы | Головная боль | Часто |
| Головокружение | Часто | |
| Нарушения со стороны кожи и подкожной клетчатки | Кожная сыпь | Нечасто |
| Экзема | Нечасто |
Описание отдельных нежелательных реакций
У одного пациента, ранее не получавшего лечения, в продолжающемся клиническом исследовании были выявлены высокие титры ингибиторов к фактору Ⅸ. Данных о частоте образования ингибиторов у пациентов, ранее не получавших лечение, недостаточно.
Применение у детей
Ожидается, что частота встречаемости, тип и степень тяжести нежелательных реакций у детей будут такими же, как у взрослых.
Передозировка
О случаях передозировки препаратом Идельвион® не сообщалось.
Взаимодействие с другими лекарственными средствами
Исследования лекарственного взаимодействия препарата Идельвион® с другими лекарственными препаратами не проводилось. Для приготовления и введения препарата Идельвион® следует использовать только прилагаемые в комплекте растворитель и устройство для добавления растворителя Mix2Vial. Не следует смешивать препарат с другими лекарственными средствами в одном шприце.
Особые указания
Прослеживаемость
С целью улучшения прослеживаемости биологических лекарственных препаратов необходимо отчётливо указывать наименование и номер серии вводимого препарата.
Гиперчувствительность
Как и в случае внутривенного введения любого препарата, содержащего белок, при применении препарата Идельвион® возможно развитие аллергических реакций гиперчувствительности немедленного типа. Пациентов необходимо информировать о ранних симптомах реакций гиперчувствительности, таких как кожная сыпь, генерализованная крапивница, ощущение сдавления в грудной клетке, свистящее дыхание, артериальная гипотензияи анафилаксия. Рекомендуется, чтобы первоначальное введение препарата Идельвион® проводилось под медицинским наблюдением, при котором может быть оказана надлежащая медицинская помощь при аллергических реакциях. В случае возникновения симптомов аллергической реакции (в том числе анафилаксии) введение препарата следует немедленно прекратить и обеспечить соответствующие меры по оказанию медицинской помощи.
Ингибиторы фактора Ⅸ
У пациентов, получающих терапию препаратом Идельвион®, необходимо проводить мониторинг образования ингибиторов к фактору свёртывания крови Ⅸ, используя лабораторные и клинические методы. В литературе были отмечены случаи, демонстрирующие корреляцию между возникновением ингибиторов к фактору Ⅸ и аллергическими реакциями. Пациенты с аллергическими реакциями должны быть обследованы на наличие ингибиторов. Следует отметить, что пациенты с ингибиторами к фактору Ⅸ могут подвергаться повышенному риску развития анафилаксии при последующем введении фактора Ⅸ.
В связи с риском развития аллергических реакций после введения препарата, содержащего фактор Ⅸ, первоначальное введение фактора Ⅸ должно осуществляться под медицинским наблюдением с обеспечением соответствующих мер в случае развития аллергических реакций.
У пациентов с гемофилией B могут образовываться нейтрализующие антитела (ингибиторы) к фактору свёртывания крови Ⅸ. У пациентов с высоким содержанием ингибиторов к фактору Ⅸ применение препарата Идельвион® может оказаться неэффективным.
Тромбоэмболия
В связи с потенциальным риском развития тромботических осложнений при применении препарата необходимо проводить клиническое наблюдение за ранними симптомами возникновения тромбоэмболии и коагулопатии потребления и необходимую лабораторную диагностику у пациентов подверженных риску возникновения тромбоза или ДВС, включая пациентов с заболеванием печени, пациентов после оперативных вмешательств и новорождённых. В каждой из этих ситуаций пользу лечения препаратом Идельвион® необходимо сопоставлять с риском данных осложнений.
Сердечно-сосудистые заболевания
У пациентов из группы риска по развитию сердечно-сосудистых заболеваний применение препаратов фактора Ⅸ может повышать риск развития сердечно-сосудистых осложнений.
Осложнения, связанные с катетеризацией
При необходимости центрального венозного доступа (ЦВД) следует учитывать риск развития осложнений, связанных с ЦВД, включая местные инфекции, бактериемию и тромбоз в месте катетеризации.
Пациенты детского возраста
Перечисленные особые указания и меры предосторожности применимы как у взрослых, так и у детей.
Индукция иммунной толерантности
Безопасность и эффективность применения препарата Идельвион® для индукции иммунной толерантности не установлены.
Натрий
Следует учитывать, что препарат Идельвион® содержит около 25,8 мг (1,13 ммоль) натрия на дозу (масса тела 70 кг) при применении максимальной дозы (15 мл = 6000 ME). Это соответствует 1,29 % от максимальной суточной дозы, рекомендованной ВОЗ 2 г натрия в день у взрослых.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Идельвион® не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения, 250 МЕ, 500 МЕ, 1000 МЕ, 2000 МЕ.
По 250 ME, 500 ME, 1000 ME во флакон вместимостью 6 мл или 2000 ME во флакон вместимостью 10 мл из прозрачного бесцветного стекла типа Ⅰ, укупоренный пробкой из бромбутилового каучука и обкатанный алюминиевым колпачком с пластиковой крышкой типа «флип-офф».
По 2,5 или 5,0 мл воды для инъекций во флакон прозрачного бесцветного стекла типа Ⅰ, укупоренный пробкой из хлорбутилового каучука и обкатанный алюминиевым колпачком с пластиковой крышкой типа «флип-офф».
Устройство для добавления растворителя со встроенным фильтром 15 мкм (Mix-2Vial™ 20/20) в блистер из полиэтилентерефталат/бумага, ламинированная полиэтиленом.
По 1 флакону с лиофилизатом, 1 флакону с растворителем, 1 устройству для добавления растворителя со встроенным фильтром (Mix-2Vial™ 20/20) и 1 картонной пачке с комплектом для внутривенного введения препарата (1 одноразовый шприц объёмом 5 или 10 мл, 1 игла-бабочка, 2 дезинфицирующие салфетками в индивидуальных герметичных упаковках и 1 нестерильный лейкопластырь) и инструкцией по медицинскому применению в картонную пачку с контролем первого вскрытия.
Хранение
Хранить при температуре от 2 до 25 °C в защищённом от света месте.
Хранить в недоступном для детей месте.
Срок годности
3 года (лиофилизат).
5 лет (растворитель «Вода для инъекций»).
Примечание: срок годности комплекта определяется по наименьшему сроку годности одного из компонентов.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
CSL Behring, GmbH, Германия
Производитель
Производитель готовой лекарственной формы /фасовщик (первичная упаковка)
СиЭсЭл Беринг ГмбХ / CSL Behring GmbH
Гёрцхаузер Хоф 1, 35041 Марбург (район Михельбах), Германия (лиофилизат)
Эмиль-фон-Беринг-Штрассе 76, 35041 Марбург, Германия (растворитель)
Упаковщик (вторичная (потребительская) упаковка) / выпускающий контроль качества
СиЭсЭл Беринг ГмбХ / CSL Behring GmbH
Эмиль-фон-Беринг-Штрассе 76, 35041 Марбург, Германия
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
СиЭсЭл Беринг ГмбХ, Эмиль-фон-Беринг-Штрассе, 35041, Марбург, Германия
CSL Behring GmbH, Emil-von-Behring-Strasse 76, 35041 Marburg, Germany
Наименование и(или) адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата на принятие претензий от потребителя:
Филиал Общества с ограниченной ответственностью «Си Эс Эл Беринг Биотэрапис ГмбХ»
125167, г. Москва, Ленинградский проспект, д. 39, стр. 80
Тел.: 8 (495) 788-52-89
inforussia@cslbehring.com
