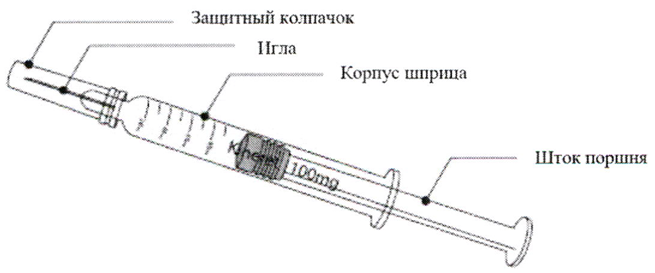
Кинерет®
KineretРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
В 0,67 мл раствора в одном предварительно заполненном шприце содержится:
Действующее вещество: Анакинра — 100 мг
Вспомогательные вещества: лимонная кислота, натрия хлорид, динатрия эдетата дигидрат, полисорбат-80, вода для инъекций.
Описание
Прозрачный или опалесцирующий от бесцветного до беловатого цвета раствор, который может содержать аморфные полупрозрачные или белые частицы, относящиеся к препарату.
Характеристики
Анакинра представляет собой рекомбинантную версию антагониста рецептора интерлейкина-1 (IL-lra) человека, продуцированного штаммом Е. coli с использованием технологии рекомбинантной ДНК.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Анакинра блокирует биологическую активность интерлейкина-1α (ИЛ-1α) и интерлейкина-1β (ИЛ-1β) путём конкурентного ингибирования их связей с рецептором интерлейкина-1 типа I. Интерлейкин-1 (ИЛ-1) является ключевым провоспалительным цитокином, медиатором многих клеточных ответов, включая те, которые имеют важное значение при синовиальном воспалении.
Анакинра ингибирует реакции, индуцированные ИЛ-1 in vitro, в том числе, индукцию оксида азота и простагландина E2 и/или синтез коллагеназы синовиальными клетками, фибробластами и хондроцитами.
Спонтанные мутации в гене C1AS1/NLRP3 были обнаружены у большинства пациентов с криопирин-ассоциированными периодическими синдромами (CAPS). CIAS1/NLRP3 кодирует криопирин, компонент инфламмасомы. Активация инфламмасомы приводит к протеолитической матурации и секреции ИЛ-β, который вызывает широкий спектр реакций, включая системное воспаление. У пациентов с CAPS, не получавших лечение, отмечают повышенный уровень C-реактивного белка (СРВ), амилоида А (САА) и ИЛ-6 в сыворотке крови по сравнению с нормальными уровнями. Было отмечено, что назначение препарата Кинерет® приводит к снижению уровней острофазных белков и уменьшению экспрессии ИЛ-6. Снижение уровней острофазных белков было зарегистрировано в течение первых недель лечения.
Фармакокинетика
Абсолютная биодоступность анакинры после подкожной болюсной инъекции в дозе 70 мг у здоровых субъектов (n = 11) составляет 95 %. Процесс абсорбции является фактором, ограничивающим скорость выведения анакинры из плазмы после подкожной инъекции.
У пациентов на фоне лечения препаратом Кинерет® максимальные концентрации анакинры в плазме обнаруживали спустя 3–7 час после подкожного введения анакинры в клинически значимых дозах (от 1 до 2 мг/кг; n = 18). Концентрация в плазме уменьшалась без очевидной фазы распределения, а период полувыведения составлял от 4 до 6 час. У пациентов, получавших препарат Кинерет®, не наблюдали непредвиденного накопления анакинры после ежедневного подкожного введения в течение до 24 недель. Средние (SD) показатели клиренса (CL/F) и объёма распределения (Vd/F) по результатам популяционного фармакокинетического анализа данных 35 пациентов составили 105 (27) мл/мин и 18,5 (11) л, соответственно. Данные, полученные в исследованиях на людях и животных, показали, что почки являются основным органом, ответственным за выведение анакинры. Клиренс анакинры у пациентов, получавших препарат Кинерет®, возрастал с увеличением клиренса креатинина (КК).
Влияние демографических параметров на фармакокинетику анакинры оценивали с помощью популяционного фармакокинетического анализа данных 341 пациента, получавшего ежедневно подкожно анакинру в дозах 30, 75 и 150 мг в течение до 24 недель. Оцениваемый клиренс анакинры увеличивался с увеличением КК и массы тела. Результаты популяционного фармакокинетического анализа показали, что среднее значение плазменного клиренса после подкожной болюсной инъекции приблизительно на 14 % выше у мужчин, чем у женщин, и приблизительно на 10 % выше у лиц в возрасте <65 лет, чем у испытуемых лиц в возрасте 65 лет. Тем не менее, после коррекции по КК, массе тела, полу и возрасту существенных факторов, влияющих на показатель среднего плазменного клиренса, выявлено не было. Коррекция дозы препарата не требуется с учётом возраста или пола.
У пациентов с CAPS была отмечена приблизительная линейность дозы с незначительной тенденцией к более высокому, чем пропорциональному её увеличению.
Фармакокинетические данные у детей <4 лет недостаточны, но имеется клинический опыт применения у детей в возрасте от 8 месяцев. При инициации лечения в рекомендуемой суточной дозе 1–2 мг/кг проблем с безопасностью применения препарата выявлено не было.
Фармакокинетические данные отсутствуют в пожилой возрастной группе пациентов с CAPS.
Было продемонстрировано распределение препарата в спинномозговой жидкости.
Печёночная недостаточность
Исследование было проведено у 12 пациентов с дисфункцией печени (класс B по классификации Чайлд-Пью), получивших однократную дозу 1 мг/кг внутривенно.
Фармакокинетические параметры пациентов и здоровых добровольцев значительно не различались, за исключением показателя клиренса, который у пациентов был ниже примерно на 30 %. Соответствующее снижение КК было отмечено у пациентов с печёночной недостаточностью. Таким образом, снижение клиренса, наиболее вероятно, объясняется снижением функции почек у данной популяции пациентов. Эти данные подтверждают, что для пациентов с печёночной недостаточностью класса В по классификации Чайлд-Пью коррекция дозы не требуется. Для пациентов с умеренной печёночной недостаточностью коррекция дозы не требуется (класс B по классификации Чайлд-Пью). Пациентам с тяжёлой печёночной недостаточностью следует проводить терапию препаратом Кинерет® с осторожностью.
Почечная недостаточность
Среднее значение плазменного клиренса на фоне лечения препаратом Кинерет® пациентов с почечной недостаточностью лёгкой (КК 50–80 мл/мин) и средней (КК 30–49 мл/мин) степени тяжести было снижено на 16 % и 50 %, соответственно. У пациентов с почечной недостаточностью тяжёлой степени тяжести и терминальной стадией (КК <30 мл/мин) среднее значение клиренса плазмы было снижено на 70 % и 75 %, соответственно. Менее 2,5 % от введённой дозы препарата Кинерет® было выведено с использованием гемодиализа или постоянного амбулаторного перитонеального диализа. Эти данные подтверждают, что для пациентов с почечной недостаточностью лёгкой степени тяжести (КК 50–80 мл/мин) коррекция дозы не требуется.
Показания
Препарат Кинерет® показан взрослым, подросткам и детям в возрасте от 8 месяцев и старше с массой тела от 10 кг и выше для лечения криопирин-ассоциированных периодических синдромов (CAPS), включая:
- мультисистемное воспалительное заболевание неонатального возраста (NOMID) / хронический младенческий неврологический кожно-артикулярный синдром (CINCA)
- Синдром Макла-Уэллса (MWS)
- Семейный холодовой аутовоспалительный синдром (FCAS)
Противопоказания
Повышенная чувствительность к действующему веществу или любым вспомогательным веществам или производным белка E. coli.
Препарат Кинерет® не следует назначать пациентам с нейтропенией (абсолютное число нейтрофилов, ANC <1,5 × 109/л).
С осторожностью
- У пациентов, имеющих в анамнезе рецидивирующие инфекции или предрасполагающие факторы, которые могут привести к развитию инфекции; повышение активности печёночных ферментов в анамнезе или печёночную недостаточность тяжёлой степени тяжести; почечную недостаточность средней степени тяжести (КК 30–59 мл/мин); бронхиальную астму; злокачественные новообразования, в том числе, в анамнезе (см. раздел «Особые указания»);
- У пациентов, которым требуется вакцинация (см. раздел «Особые указания»);
- У пожилых пациентов (см. раздел «Особые указания»);
- У пациентов, принимающих одновременно варфарин или фенитоин (см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение при беременности и в период грудного вскармливания
Данные о применении анакинры у беременных женщин ограничены. Результаты исследований на животных не указывают на наличие прямой или косвенной репродуктивной токсичности.
В качестве меры предосторожности рекомендуется избегать применения анакинры во время беременности, а также женщинам детородного возраста, не использующих контрацепцию.
Неизвестно, проникает ли анакинра/метаболиты в грудное молоко. Риск для новорождённого ребёнка/младенца не может быть исключён. Во время лечения препаратом Кинерет® грудное вскармливание следует прекратить.
Способ применения и дозы
Раствор для подкожного введения.
Лечение препаратом Кинерет® должно быть назначено врачами-специалистами, имеющими опыт в диагностике и лечении CAPS, и проводиться под их контролем.
Препарат Кинерет® вводится путём подкожной инъекции. Препарат Кинерет® поставляется готовым к применению в градуированном предварительно заполненном шприце.
Градуированный предварительно заполненный шприц предназначен для дозирования от 20 до 100 мг анакинры. Поскольку минимальная доза в шприце составляет 20 мг, он не подходит для лечения детей с массой тела менее 10 кг.
Во избежание чувства дискомфорта в месте инъекции рекомендуется чередовать места инъекции. Для облегчения симптомов реакций в месте инъекции рекомендуется охлаждение места инъекции, нагревание раствора препарата до комнатной температуры, наложение на место инъекции холодных пакетов (до её проведения и после), применение кортикостероидов и антигистаминных препаратов для местного применения.
Взрослые, подростки и дети в возрасте от 8 месяцев и старше и массой тела от 10 кг и выше
Начальная доза:
Рекомендуемая начальная доза при всех подтипах CAPS составляет 1–2 мг/кг/день в виде подкожной инъекции. Терапевтический ответ проявляется, главным образом, в виде уменьшения клинических симптомов, таких как лихорадка, сыпь, боли в суставах и головная боль, а также снижением уровней острофазных белков (СРБ/САА) или частоты обострений.
Поддерживающая доза при CAPS лёгкой степени тяжести (FCAS, MWS лёгкой степени тяжести):
Как правило, клинические и лабораторные симптомы успешно контролируются путём строгого соблюдения рекомендуемой начальной дозы (1–2 мг/кг/день).
Поддерживающая доза при CAPS тяжёлой степени тяжести (MWS и NOMID/CINCA):
В течение 1–2 месяцев может потребоваться увеличение дозы с учётом терапевтического ответа. Обычная поддерживающая доза при CAPS тяжёлого течения составляет 3–4 мг/кг/день, и она может быть увеличена до максимальной дозы 8 мг/кг/день.
В дополнение к оценке клинических симптомов и воспалительных маркеров при CAPS тяжёлого течения, рекомендуется проводить оценку воспаления центральной нервной системы (ЦНС), в том числе внутреннего уха (с помощью магниторезонансной томографии (MPT) или компьютерной томографии (КТ), люмбальной пункции и аудиологического исследования) и органов зрения (офтальмологическая оценка) после первоначального 3-месячного курса лечения, а затем каждые 6 месяцев, до тех пор, пока не будет определён эффективный режим терапии. Когда контроль состояния пациента успешно достигнут, мониторинг клинических, офтальмологических показателей и параметров ЦНС можно проводить ежегодно.
Применение у пожилых пациентов (>65 лет)
Данные о применении препарата у пожилых пациентов с CAPS ограничены.
Предположительно, коррекция дозы препарата не требуется.
Применение у детей (в возрасте <18 лет)
Данные о применении препарата у детей в возрасте до восьми месяцев отсутствуют.
Режим дозирования и способ применения у детей в возрасте 8 месяцев и старше с массой тела 10 кг и выше соответствует режиму применения у взрослых пациентов с CAPS и зависит от массы тела.
Применение у пациентов с нарушением функции печени
Для пациентов с умеренной печёночной недостаточностью (класс B по классификации Чайлд-Пью) коррекция дозы не требуется. Пациентам с тяжёлой печёночной недостаточностью (класс C по классификации Чайлд-Пью) следует проводить терапию препаратом Кинерет® с осторожностью.
Применение у пациентов с нарушением функции почек
Для пациентов с почечной недостаточностью лёгкой степени тяжести (КК 60–89 мл/мин) коррекция дозы не требуется. Препарат Кинерет® следует применять с осторожностью у пациентов с почечной недостаточностью средней степени тяжести (КК 30–59 мл/мин).
У пациентов с почечной недостаточностью тяжёлой степени тяжести (КК <30 мл/мин) и терминальной стадией почечной недостаточности, включая пациентов на диализе, следует предусмотреть введение назначенной дозы препарата Кинерет® через день.
Если препарат Кинерет® введён в большей дозе, чем это было необходимо При случайном введении препарата Кинерет® в дозе, превышающей необходимую, не должно возникнуть серьёзных проблем. Тем не менее, в подобном случае пациенту следует обратиться к врачу. В любом случае, если пациент почувствовал себя нехорошо, он/она должен/должна незамедлительно обратиться к врачу.
Если пропущено введение дозы препарата Кинерет®
Если пропущено введение дозы препарата Кинерет®, пациенту следует обратиться к врачу, чтобы обсудить, когда следует вводить следующую дозу.
Инструкция по подготовке и выполнению инъекции препарата Кинерет®
Данный раздел содержит информацию о том, как сделать себе или своему ребёнку инъекцию препарата Кинерет®. Не следует вводить препарат Кинерет® себе или своему ребёнку, если Вы не прошли инструктаж у врача или медицинской сестры. Если у вас есть вопросы о том, как вводить препарат, пожалуйста, обратитесь за помощью к врачу или медицинской сестре.
Препарат Кинерет® представляет собой стерильный раствор, не содержащий консервантов.
Только для однократного применения.
Шприц не следует встряхивать. Перед инъекцией необходимо дать нагреться шприцу до комнатной температуры.
Перед введением нужно проверить внешний вид раствор на наличие механических включений и изменения цвета. Вводить можно только прозрачный или слабо опалесцирующий от бесцветного до белёсого цвета раствор, который может содержать аморфные полупрозрачные или белые частицы, относящиеся к препарату.
Присутствие таких частиц не влияет на качество препарата.
Шприц предназначен только для одноразового применения. Любые неиспользованные остатки препарата следует утилизировать.
Как сделать инъекцию самостоятельно или с помощью другого лица с использованием препарата Кинерет® в градуированном предварительно заполненном шприце
Вводить препарат себе или своему ребёнку необходимо в одно и то же время каждый день.
Поскольку препарат Кинерет® предназначен для подкожных инъекций, его вводят только под кожу.
Для выполнения подкожной инъекции препарата себе или своему ребёнку вам понадобятся:
- Препарат Кинерет® в градуированном предварительно заполненном шприце;
- Спиртовые салфетки или аналоги;
- Стерильная марля или ткань.
Что вам следует сделать перед подкожным введением препарата Кинерет® себе или своему ребёнку?
- Достаньте препарат Кинерет® в градуированном предварительно заполненном шприце из холодильника.
- Не встряхивайте шприц.
- Проверьте дату истечения срока годности на этикетке предварительно заполненного шприца (в редакции «До:»). Не используйте препарат Кинерет® после истечения срока годности, указанного на упаковке.
- Проверьте внешний вид раствора препарата Кинерет® в шприце. Раствор должен быть прозрачным или слабо опалесцирующим, от бесцветного до белого цвета. Раствор может содержать аморфные полупрозрачные или белые частицы, относящиеся к препарату. Присутствие этих частиц не влияет на качество препарата. Раствор не следует вводить, если он изменил цвет или стал непрозрачным, или если имеются какие-либо другие частицы, отличные от прозрачно-белых частиц.
- Для облегчения симптомов реакций в месте инъекции препарата оставьте шприц при комнатной температуре в течение приблизительно 30 минут или осторожно подержите его в руке в течение нескольких минут. Не нагревайте Кинерет® каким-либо иным способом (например, не нагревайте его в микроволновой печи или при помощи горячей воды).
- Не снимайте защитный колпачок со шприца, если Вы не готовы вводить препарат.
- Тщательно вымойте руки.
- Найдите удобную, хорошо освещённую и чистую поверхность и поместите все необходимое оборудование перед собой.
- Убедитесь, что Вы знаете, какую дозу препарата Кинерет® назначил ваш врач; от 20 до 90 мг, 100 мг или выше.
- Если врач назначил дозу 100 мг, смотрите раздел «Как приготовить дозу 100 мг».
- Если врач назначил более низкую дозу, смотрите раздел «Как приготовить дозу от 20 до 90 мг».
Как приготовить дозу 100 мг
Перед введением препарата Кинерет® вам следует выполнить следующее:
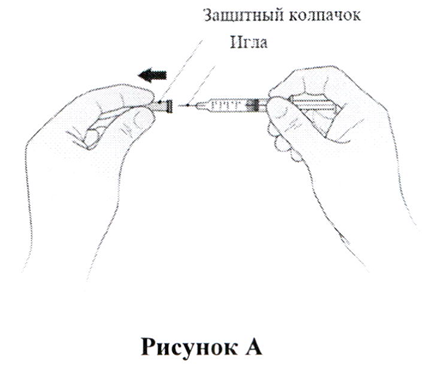
- Возьмите шприц и осторожно снимите с иглы защитный колпачок, не вращая его. Потяните колпачок прямо, как показано на Рис. А. Не прикасайтесь к игле и не нажимайте на поршень. Сразу выбросьте колпачок от иглы.
- Вы можете заметить наличие небольшого пузырька воздуха в шприце. Вам не следует удалять пузырьки воздуха перед инъекцией. Введение раствора с пузырьком воздуха безопасно.
- Теперь Вы можете использовать предварительно заполненный шприц согласно описания в следующих разделах «Куда следует делать себе инъекцию?» и «Как сделать себе инъекцию?».
Как приготовить дозу от 20 до 90 мг
Перед введением препарата Кинерет® вам следует выполнить следующее:
- Возьмите шприц и осторожно снимите с иглы колпачок, не вращая его. Потяните колпачок прямо, как показано на Рис. А. Не прикасайтесь к игле и не нажимайте на поршень. Сразу выбросьте колпачок от иглы.
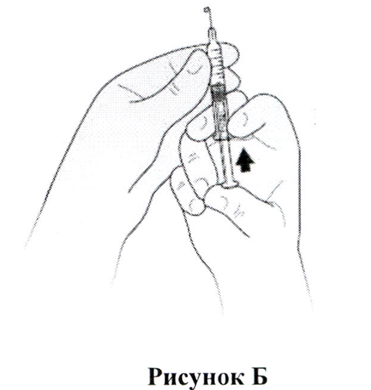
- Вам следует держать шприц в одной руке, направляя иглу прямо вверх, как показано на Рис. Б. Поместите и держите большой палец на штоке поршня до тех пор, пока на кончике иглы не появится крошечная капля жидкости.
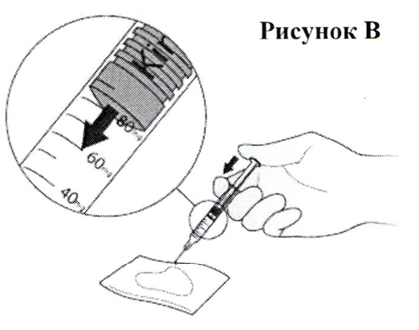
- Переверните шприц таким образом, чтобы игла теперь была направлена вниз. Поместите стерильную марлю или ткань на плоскую поверхность и держите над ней шприц с иглой, направленной в сторону марли или ткани, как показано на Рис. В. Убедитесь в том, что игла не касается марли или ткани.
- Поместите большой палец на шток поршня и нажимайте на него до тех пор, пока передняя часть поршня не дойдёт до метки на шкале, указывающей на необходимую вам дозу препарата Кинерет® (ваш врач проинформирует вас о назначенной дозе препарата). Выпущенная струя жидкости впитается марлей или тканью, как показано на Рис. В.
- Если вы не смогли установить правильную дозу, утилизируйте шприц и используйте новый.
- Теперь, вы можете использовать предварительно заполненный шприц согласно описанию в следующих разделах «Куда следует делать себе инъекцию?» и Как сделать себе инъекцию?».
Куда следует делать себе инъекцию?
Наиболее подходящие участки для выполнения инъекции себе или своему ребёнку (смотрите Рис. Г):
- живот (за исключением области вокруг пупка);
- верхняя часть бедра;
- верхние наружные области ягодиц;
- наружная область плеча.
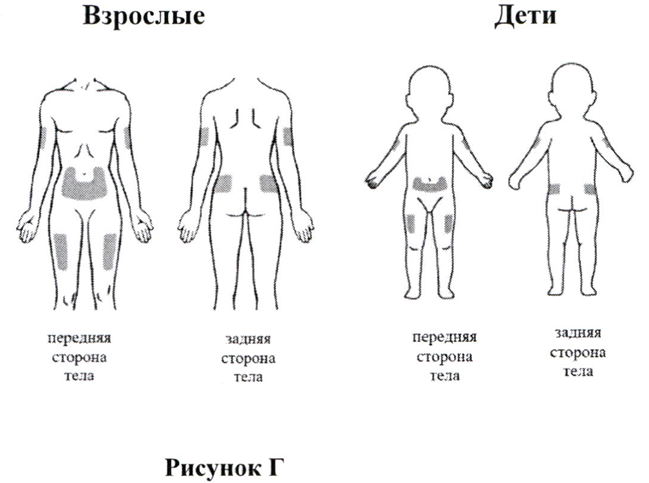
Каждый раз меняйте место инъекции, чтобы избежать развития болезненности в одной области. При введении препарата с посторонней помощью может быть задействована задняя поверхность вашего плеча.
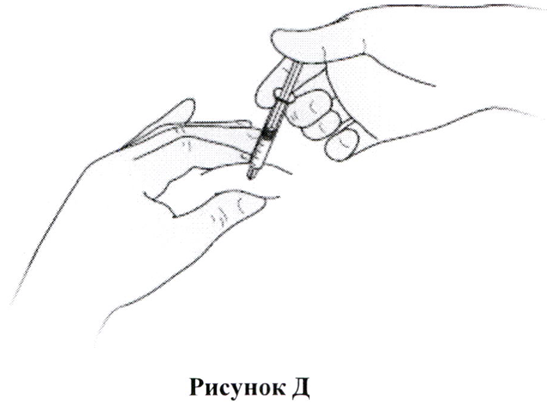
Как сделать себе инъекцию?
- Продезинфицируйте кожу с помощью спиртовых салфеток и зажмите кожу между большим и указательным пальцами, не сдавливая её.
- Введите иглу в кожу полностью, как было вам показано медицинской сестрой или врачом.
- Вводите раствор препарата медленно и равномерно в образовавшуюся кожную складку, как показано на Рис. Д.
- После введения препарата, извлеките иглу и отпустите кожу.
- Любые неиспользованные остатки препарата должны быть утилизированы. Используйте один шприц только для одной инъекции. Не используйте шприц повторно, поскольку это может стать причиной развития инфекции.
Запомните
Если у вас есть какие-либо проблемы, пожалуйста, незамедлительно обращайтесь к своему врачу или медицинской сестре за помощью и советом.
Утилизация использованных шприцев и материалов
- Не надевайте колпачок на использованные иглы
- Держите использованные шприцы в недоступном для детей месте
- Никогда не кладите использованный шприцы в обычное мусорное ведро с бытовыми отходами
- Если вам нужна доза препарата менее 100 мг, как было сказано выше, следует удалить избыток препарата из шприца на марлю или ткань. После инъекции утилизируйте мокрую марлю или ткань с вашим шприцем и очистите поверхность чистой тканью
- Использованные шприцы и марлю или ткань следует утилизировать согласно местным законодательным актам. Данные меры помогут защитить окружающую среду.
Побочное действие
Краткая характеристика профиля безопасности
Данные о нежелательных лекарственных реакциях (НЛР) у пациентов с CAPS получены в открытом КИ у 43 пациентов с NOM1D/CINCA на фоне терапии препаратом Кинерет®, длительностью до 5 лет и показателем общей экспозиции 159,8 пациенто-лет. В ходе 5-летнего КИ у 14 пациентов (32,6 %) было зарегистрировано 24 серьёзных нежелательных явления (СНЯ). Одиннадцать СНЯ у 4 пациентов (9,3 %) были расценены как связанные с применением препарата Кинерет®. Ни у одного пациента лечение препаратом Кинерет® не было прекращено из-за НЛР.
Ниже представлены НЛР, которые классифицированы в соответствии с поражением органов и систем органов (медицинский словарь для нормативно-правовой деятельности MedDRA) и частотой возникновения.
Класс системы органов | Частота | Нежелательная лекарственная реакция |
Инфекционные и паразитарные заболевания | Часто (от ≥1/100 до <1/10) | Тяжёлые инфекции |
Нарушения со стороны кровеносной и лимфатической систем | Часто (от ≥1/100 до <1/10) | Нейтропения Тромбоцитопения |
Нарушения со стороны иммунной системы | Нечасто (от ≥1/1 000 до <1/100) | Аллергические реакции, включая анафилактическую реакцию, ангионевротический отёк, крапивницу и зуд |
Нарушения со стороны нервной системы | Очень часто (≥1/10) | Головная боль |
Нарушения со стороны печени и желчевыводящих путей | Нечасто (от ≥1/1 000 до <1/100) | Повышение печёночных трансаминаз |
Частота неизвестна (не может быть идентифицирована по имеющимся данным) | Неинфекционный гепатит | |
Нарушения со стороны кожи и подкожных тканей | Очень часто (≥1/10) | Реакции в месте инъекции |
Нечасто (от ≥1/1000 до <1/100) | Сыпь | |
Лабораторные и инструментальные данные | Очень часто (≥1/10) | Повышение холестерина в крови |
Если любые из указанных в инструкции побочных эффектов усугубляются, или пациент заметил любые другие побочные эффекты, не указанные в инструкции, следует сообщить об этом врачу.
Тяжёлые инфекции
У 43 пациентов с CAPS за 5-летний период наблюдения частота тяжёлых инфекций составляла 0,1/год, из которых чаще всего встречалась пневмония и гастроэнтерит.
Применение препарата Кинерет® было временно прекращено у одного пациента; остальные пациенты продолжили лечение препаратом Кинерет® во время течения инфекций.
В ходе КИ и пострегистрационного применения препарата были отмечены редкие случаи инфекций условно-патогенными организмами, которые включали грибковые, микобактериальные, бактериальные и вирусные патогены. Инфекции были отмечены во всех системах органов и были зарегистрированы у пациентов, получавших препарат Кинерет® отдельно или в сочетании с иммунодепрессантами.
Нейтропения
В плацебо-контролируемых КИ препарата Кинерет® для отличного от CAPS состояния в ходе лечения было отмечено незначительное уменьшение средних значений общего числа лейкоцитов и абсолютного числа нейтрофилов. Нейтропения (ANC <1,5 × 109/л) была зарегистрирована у 2,4 % пациентов, получавших препарат Кинерет® по сравнению с 0,4 % пациентов, получавших плацебо. Ни у одного из этих пациентов не было диагностировано острых инфекций, связанных с нейтропенией. Из 43 пациентов с CAPS, наблюдавшихся в течение пяти лет, нейтропения была отмечена у 2 пациентов. В обоих случаях нейтропения разрешилась в ходе продолжения лечения препаратом Кинерет®.
Тромбоцитопения
В ходе КИ препарата Кинерет®, назначаемого по показаниям, не включающим CAPS, тромбоцитопения была зарегистрирована у 1,9 % пациентов в группе препарата Кинерет® по сравнению с 0,3 % пациентов в группе плацебо. Тромбоцитопения была лёгкой (количество тромбоцитов >75 × 109/л). У пациентов с CAPS также наблюдали лёгкую тромбоцитопению.
В ходе пострегистрационного применения препарата Кинерет® была зарегистрирована тромбоцитопения, в том числе, эпизодически отмечали случаи тяжёлой тромбоцитопении (количество тромбоцитов <10 × 109/л).
Злокачественные опухоли
В рамках КИ препарата Кинерет®, назначаемого по показаниям, не включающим CAPS, общая частота случаев злокачественных опухолей была одинаковой в группе пациентов, принимавших препарат Кинерет®, и в группе, принимавшей плацебо, и не отличалась от частоты случаев, зарегистрированных в целом в исследуемых популяциях. Кроме того, общая частота случаев злокачественных опухолей не увеличивалась на протяжении трёх лет применения препарата Кинерет®.
Аллергические реакции
Аллергические реакции на препарат Кинерет®, включая анафилактические реакции, ангионевротический отёк, крапивницу, сыпь и зуд, встречались нечасто. Большинство из этих реакций были представлены макулопапулезной или уртикарной сыпью.
У 43 пациентов с CAPS, наблюдавшихся в течение пяти лет, не было серьёзных аллергических реакций и случаев, требующих досрочного прекращения лечения препаратом Кинерет®.
Иммуногенность
В ходе КИ у большинства пациентов с CAPS были обнаружены антитела к анакинре. Не было отмечено клинически значимого влияния наличия антител к анакинре на фармакокинетику, эффективность и безопасность препарата Кинерет®.
Изменения функции печени
В ходе КИ наблюдали случаи транзиторного повышения активности печёночных ферментов.
Это повышение не было связано с признаками или симптомами повреждения клеток печени.
В ходе пострегистрационного применения препарата Кинерет® были получены сообщения о единичных случаях неинфекционного гепатита.
В пострегистрационном периоде изменения функции печени были отмечены преимущественно у пациентов с предрасполагающими факторами в анамнезе, например, имевших повышенную активность трансаминаз до назначения препарата Кинерет®.
Реакции в месте инъекции
В ходе КИ препарата Кинерет®, назначаемого по показаниям, отличным от CAPS, наиболее частыми НДР являлись реакции в месте инъекции. Большинство (95 %) реакций в месте инъекций были от лёгкой до умеренной степени тяжести. Реакции в месте инъекции обычно характеризовались одним или несколькими признаками, такими как: эритема, экхимоз, воспаление и боль. Из 43 пациентов с CAPS, наблюдавшихся в течение пяти лет, ни один пациент не прекратил лечение препаратом Кинерет® и не приостановил его временно в связи с реакциями в месте инъекции. Реакции в месте инъекции обычно возникают в течение двух недель с момента введения препарата, и исчезают в течение 4–6 недель. У пациентов, у которых ранее не регистрировали реакций в месте инъекции, эти реакции редко развивались после первого месяца терапии.
Повышение холестерина в крови
У 775 пациентов, которые в рамках КИ по отличным от CAPS показаниям получали препарат Кинерет® в суточных дозах 30 мг, 75 мг, 150 мг, 1 мг/кг или 2 мг/кг, наблюдали увеличение общего содержания холестерина от 2,4 % до 5,3 % через 2 недели после начала лечения препаратом Кинерет® вне зависимости от дозы препарата. Подобные изменения показателей общего холестерина отмечали и через 24 недели лечения препаратом Кинерет®. Лечение плацебо (n = 213) сопровождалось уменьшением общего содержания холестерина приблизительно на 2,2 % на неделе 2 и на 2,3 % на неделе 24. Данных о липопротеинах низкой плотности и липопротеинах высокой плотности не имеется.
Применение у детей
Препарат Кинерет® изучали у пациентов в возрасте от 8 месяцев до <18 лет (36 пациентов с CAPS и 86 пациентов с другими состояниями) в течение пяти лет. За исключением инфекций и связанных с ними симптомов, которые чаще отмечались у пациентов в возрасте <2 лет, профиль безопасности был сходным у детей всех возрастных групп. Педиатрическая и взрослая популяции пациентов имели сходный профиль безопасности; новых клинически значимых НЛР отмечено не было.
Передозировка
В ходе КИ не было отмечено ограничивающей дозу токсичности. В рамках КИ по отличным от CAPS показаниям 1015 пациентов получали препарат Кинерет® внутривенно в дозах до 2 мг/кг/час на протяжении 72 часов. Профиль нежелательных явлений в этих КИ не отличался от профиля безопасности в КИ, где применяли более низкие дозы препарата Кинерет®.
Взаимодействие с другими лекарственными средствами
Взаимодействие между препаратом Кинерет® и другими лекарственными средствами направленно не изучали. В рамках КИ не было отмечено взаимодействия между препаратом Кинерет® и другими лекарственными средствами (в том числе нестероидными противовоспалительными препаратами, глюкокортикостероидами и базисными противоревматическими препаратами (БПРП)).
В ходе КИ у пациентов (отличных от CAPS) на фоне основной терапии метотрексатом, которые одновременно получали препарат Кинерет® и этанерцепт, частота развития острых инфекций (7 %) и нейтропении была выше, чем у пациентов, получавших только этанерцепт или только препарат Кинерет®. Одновременный приём препарата Кинерет® и этанерцепта или другого антагониста фактора некроза опухоли-альфа (ФНО-α) не рекомендуется.
При хроническом воспалении образование ферментов CYP450 подавляется вследствие повышения уровня цитокинов (например, ИЛ-1). Таким образом, можно ожидать, что для антагониста рецептора ИЛ-1, такого как анакинра, образование ферментов CYP450 может быть нормализовано в ходе лечения. Это может иметь клиническое значение для субстратов CYP450 с узким терапевтическим индексом (например, варфарина и фенитоина).
У пациентов, применяющих препараты данного типа, в начале или конце лечения препаратом Кинерет® целесообразно проведение оценки их терапевтического эффекта, а также лабораторных показателей или концентрации этих препаратов с последующей возможной коррекцией их дозы.
Особые указания
Аллергические реакции
Аллергические реакции, включая анафилактические реакции и ангионевротический отёк, встречались нечасто. Чаще всего отмечали макулопапулёзную или уртикарную сыпь. При появлении признаков тяжёлой аллергической реакции введение препарата Кинерет® следует прекратить и назначить надлежащее лечение.
Нежелательные явления со стороны печени
В ходе КИ были отмечены случаи временного повышения активности печёночных ферментов. Эти повышения не были связаны с признаками или симптомами повреждения клеток печени. В ходе пострегистрационного применения препарата сообщалось о нежелательных явлениях со стороны печени, не оказывавших влияния на её функцию.
У большинства пациентов были выявлены предрасполагающие факторы, например, случаи повышения активности печёночных трансаминаз в анамнезе. Оценку эффективности и безопасности применения препарата Кинерет® у пациентов с активностью аспартатаминотрансферазы/аланинаминотрансферазы ≥1,5 верхнего уровня нормы не проводили.
Тяжёлые инфекции
В ходе КИ препарата Кинерет® при показаниях, отличных от CAPS, была отмечена взаимосвязь применения препарата Кинерет® с увеличением заболеваемости тяжёлыми инфекциями (1,8 %) по сравнению с плацебо (0,7 %). Для небольшого числа пациентов с бронхиальной астмой, заболеваемость острыми инфекциями была выше у пациентов, получавших препарат Кинерет® (4,5 %), по сравнению с пациентами, получавшими плацебо (0 %); в основном были диагностированы инфекции респираторного тракта. Оценку безопасности и эффективности применения препарата Кинерет® у пациентов с хроническими и острыми инфекциями не проводили.
Препарат Кинерет® не следует назначать пациентам с активными инфекциями. Для пациентов с CAPS существует риск обострения заболевания после прекращения терапии препаратом Кинерет®. При условии тщательного контроля лечение препаратом Кинерет® может быть продолжено и во время тяжёлой инфекции.
Врачи должны соблюдать осторожность при введении препарата Кинерет® пациентам, имеющим в анамнезе рецидивирующие инфекции или предрасполагающие факторы, которые могут привести к развитию инфекции.
Безопасность применения препарата Кинерет® у пациентов с латентным туберкулёзом неизвестна. Имеются сообщения о туберкулёзе у пациентов, получивших несколько курсов лечения биологическими противовоспалительными препаратами. Перед назначением препарата Кинерет® пациентов необходимо проверять на наличие латентного туберкулёза.
Имеющиеся медицинские рекомендации также должны быть приняты во внимание.
Другие виды противоревматической терапии ассоциировались с реактивацией гепатита B.
Скрининг на вирусный гепатит должен быть выполнен в соответствии с опубликованными руководствами перед началом терапии препаратом Кинерет®.
Почечная недостаточность
Препарат Кинерет® выводится путём клубочковой фильтрации и последующего метаболизма в почечных канальцах. Соответственно, плазменный клиренс препарата Кинерет® снижается при ухудшении функции почек.
Для пациентов с почечной недостаточностью лёгкой степени тяжести (КК 60–89 мл/мин) коррекция дозы не требуется. У пациентов с почечной недостаточностью средней степени тяжести (КК 30–59 мл/мин) препарат Кинерет® следует применять с осторожностью.
У пациентов с тяжёлой почечной недостаточностью (КК <30 мл/мин) или терминальной почечной недостаточностью, включая пациентов на диализе, следует предусмотреть введение назначенной дозы препарата Кинерет® через день.
Нейтропения
Применение препарата Кинерет® было, как правило, связано с нейтропенией (ANC <1,5 × 109/л) в плацебо-контролируемых КИ при другом показании, но случаи нейтропении также были отмечены у пациентов с CAPS. Терапию препаратом Кинерет® не следует начинать у пациентов с нейтропенией (ANC <1,5 × 109/л). Рекомендуется проводить оценку количества нейтрофилов до начала лечения и во время применения препарата Кинерет® ежемесячно в течение первых 6 месяцев лечения и далее — каждые 3 месяца. Пациентам, у которых развивается нейтропения (ANC <1,5 × 109/л), следует проводить тщательный контроль количества нейтрофилов, и лечение препаратом Кинерет® у них должно быть прекращено. Оценку безопасности и эффективности применения препарата Кинерет® у пациентов с нейтропенией не проводили.
Иммуносупрессия
Влияние лечения препаратом Кинерет® на уже имеющуюся злокачественную опухоль не изучали. Поэтому, не рекомендуется назначать препарат Кинерет® пациентам с уже имеющимися злокачественными опухолями.
Вакцинация
Данные плацебо-контролируемого КИ (n = 126) не показали различий в выработке антител к столбняку в ответ на введение дифтерийно-столбнячной вакцины пациентам, получавшим препарат Кинерет® и плацебо. Данные о результатах вакцинации при введении других инактивированных антигенов пациентам на фоне лечения препаратом Кинерет® отсутствуют.
Нет данных и о реакциях на применение живых вакцин или о вторичной передаче инфекции с живыми вакцинами пациентам, получающим Кинерет®. Таким образом, живые вакцины не следует назначать пациентам на фоне лечения препаратом Кинерет®.
Применение у пожилых пациентов (≥65 лет)
В рамках КИ по показаниям, отличным от CAPS, препарат Кинерет® изучали у 752 пациентов в возрасте ≥65 лет, в том числе, у 163 пациентов в возрасте ≥75 лет. В целом, не было обнаружено различий в безопасности и эффективности препарата у пациентов пожилого и более молодого возраста. Опыт лечения пожилых пациентов с CAPS ограничен.
Поскольку у пожилых заболеваемость инфекциями более высокая, во время лечения этих пациентов следует соблюдать осторожность.
Вспомогательные вещества
Данный препарат содержит менее 1 ммоль натрия (23 мг) на каждые 100 мг воды, что практически означает отсутствие натрия в препарате.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Кинерет® не оказывает влияния на способность управлять транспортными средствами и работу с механизмами, требующими повышенной концентрации внимания.
Форма выпуска
Раствор для подкожного введения, 150 мг/мл.
0,67 мл раствора (100 мг) в градуированном предварительно заполненном шприце, состоящем из стеклянного цилиндра (боросиликатное стекло I типа USP) со встроенной нержавеющей стальной иглой для подкожного введения (размер 29G), закрытой эластомерным колпачком с дополнительным внешним жёстким полипропиленовым колпачком, поршня и плунжера.
7 градуированных предварительно заполненных шприцев помещают в ПВХ блистер (поддон). 1 блистер (поддон) с вместе с инструкцией по применению помещают в картонную коробку (вторичную упаковку). 4 картонные коробки, содержащие по 7 шприцев, упакованы в картонную пачку (третичную упаковку) (всего в картонной пачке 28 градуированных предварительно заполненных шприцев).
На каждую картонную пачку наклеивают прозрачную защитную этикетку для контроля первого вскрытия.
Хранение
Хранить при температуре от 2 до 8 °C в картонной пачке для защиты от воздействия света.
Не замораживать.
Храните в местах, недоступных для детей.
Препарат Кинерет® допустимо хранить в течение 12 часов при температуре не выше 25 °C.
По истечению этого периода препарат необходимо выбросить.
Срок годности
3 года.
Не использовать после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Patheon Italia, S.p.A., Италия
Swedish orphan biovitrum ab (publ), Швеция
Владелец регистрационного удостоверения и выпускающий контроль качества:
Сведиш Орфан Биовитрум АБ (пабл) / Swedish Orphan Biovitrum АВ (publ)
SE 112 76 Стокгольм, Швеция / SE 11276 Stockholm, Sweden
Производитель и первичный упаковщик:
Патеон Италия С.П.А. / Patheon Italia S.P.A.
Виале Дж.Б. Стукки, 110 20900 Монца (Монца-Брианца), Италия / Viale G. В. Stukki, 110 20900 Monza (Monza-Brianza), Italy
Адрес для направления претензий потребителей:
ООО «Сведиш Орфан Биовитрум»
С/О Шведский Торговый Совет
119034, Москва, ул. Пречистенка 40/2, дом 1, 4 подъезд, 2 этаж
Тел.: +7 (495) 641 37 30, +7 (495) 748 84 79
