Луверис®
, 75 МЕРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для подкожного введения
Состав
Один флакон с лиофилизатом содержит:
Действующее вещество: лутропин альфа 75 МЕ (3,4 мкг);
вспомогательные вещества: полисорбат 20 0,05 мг, метионин 0,1 мг, натрия гидрофосфата дигидрат 0,825 мг, натрия дигидрофосфата моногидрат 0,052 мг, сахароза 47,75 мг, фосфорная кислота q.s., натрия гидроксид q.s.
Один флакон с растворителем содержит: вода для инъекций — 1,0 мл.
Описание
Лиофилизат: лиофилизированный порошок или пористая масса белого цвета.
Растворитель: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Луверис® (лутропин альфа), рекомбинантный человеческий лютеинизирующий гормон (р-чЛГ), идентичный натуральному гормону человека, создан при помощи биотехнологических методов. Он принадлежит к семейству гормонов, называемых гонадотропинами, которые участвуют в физиологической регуляции репродуктивной функции.
Луверис® компенсирует недостаток лютеинизирующего гормона в организме. Под воздействием препарата Луверис® происходит стимуляция образования эстрадиола фолликулами. Введение препарата Луверис® в середине менструального цикла запускает процесс образования жёлтого тела и овуляцию.
Введение препарата Луверис® в постовуляторный период поддерживает функционирование жёлтого тела.
В рамках клинического исследования, в которое включались женщины с гипогонадотропным гипогонадизмом, имевшие концентрацию эндогенного ЛГ в плазме крови менее 1,2 МЕ/л, оценивалось применение р-чЛГ в соответствующих дозах. Было показано, что применение р-чЛГ в дозе 75 МЕ/сутки (в комбинации с рекомбинантным человеческим фолликулостимулирующим гормоном (р-чФСГ) в дозе 150 МЕ) обеспечивает наиболее адекватное развитие фолликула у 80 % пациенток.
Фармакокинетика
Фармакокинетический профиль лутропина альфа аналогичен лютеинизирующему гормону человека, выделяемому из мочи.
Всасывание
После подкожного введения лутропина альфа максимальная концентрация в плазме крови (Cmax) достигается приблизительно через 4 — 16 часов. Средняя абсолютная биодоступность лутропина альфа, определённая иммунологическим методом, после однократного подкожного введения (в дозе, значительно большей, чем позволяющая адекватное количественное определение, т. е. 10000 МЕ) здоровым добровольцам женского пола составляет 56 % ± 23 %.
Не отмечалось достоверного различия Cmax, tmax (время достижения максимальной концентрации) или биодоступности при внутримышечном и подкожном введении препарата.
Распределение
После внутривенного введения лутропина альфа в дозе 300 МЕ фаза быстрого распределения длится приблизительно 1 час; терминальный период полувыведения (t1/2) р-чЛГ составляет приблизительно 11 часов. Объём распределения (Vss) в равновесном состоянии составляет приблизительно 10- 14 л. Среднее время удерживания (MRT) соответствует приблизительно 6 часам.
Лутропин альфа обладает линейной фармакокинетикой — значение AUC (площадь под фармакокинетической кривой концентрация-время) прямо пропорционально введённой дозе. Фармакокинетика лутропина альфа после одно- и многократного введения препарата Луверис® сравнима, и кумулирование лутропина альфа является минимальным. Не было отмечено фармакокинетического взаимодействия препарата с фоллитропином альфа при их одновременном введении.
Выведение
После подкожного введения препарата Луверис®, лутропин альфа выводится из организма при среднем терминальном периоде полувыведения, составляющем приблизительно 18 часов. Общий клиренс составляет приблизительно 2-3 л/ч; менее 5 % введённой дозы препарата выводится почками в неизменённом виде.
Фармакокинетика в особых популяциях
Фармакокинетика лутропина альфа у лиц пожилого возраста, детей, а также у пациенток с почечной или печёночной недостаточностью не исследовалась.
Показания
Лечение бесплодия, обусловленное гипоталамо-гипофизарными нарушениями, приводящими к снижению уровня лютеинизирующего и фолликулостимулирующего гормонов в организме.
Противопоказания
- Повышенная чувствительность к лутропину альфа или к любому из вспомогательных веществ;
- рак яичников, рак матки, рак молочной железы;
- опухоли гипоталамуса или гипофиза;
- увеличение яичников, поликистоз яичников, кисты яичников неясной этиологии, не обусловленные поликистозом яичников;
- кровянистые выделения или кровотечения из влагалища неясной этиологии;
- беременность, период лактации.
Препарат Луверис® противопоказан в случаях, когда нормальное течение беременности невозможно:
- первичная недостаточность яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- фибромиома матки, несовместимая с беременностью.
Применение при беременности и в период грудного вскармливания
Препарат Луверис® противопоказан в период беременности или в период грудного вскармливания.
Способ применения и дозы
Лечение препаратом Луверис® следует начинать под наблюдением врача, имеющего опыт лечения бесплодия. Луверис® вводится подкожно. Раствор готовится непосредственно перед инъекцией с использованием прилагаемого растворителя. Каждый флакон предназначен для однократного применения.
У женщин с дефицитом лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов Луверис® применяется в виде курсов ежедневных инъекций в комбинации с фоллитропином альфа (р-чФСГ). Поскольку данные пациентки страдают аменореей и характеризуются низкой секрецией эндогенных эстрогенов, терапия ими может быть начата в любое время. Рекомендуемая доза для начального режима терапии составляет 75 МЕ лутропина альфа (то есть один флакон препарата Луверис® ) в сутки в комбинации с р-чФСГ в дозе 75 МЕ -150 МЕ. В клинических исследованиях Луверис® продемонстрировал способность повышать чувствительность яичников к фоллитропину альфа. Если повышение дозы р-чФСГ все-таки требуется, его следует проводить с интервалом в 7–14 дней на 37,5 — 75 МЕ. Допустимо проведение лечения в рамках одного цикла терапии до 5 недель.
При достижении желаемого результата через 24–48 часов после последней инъекции препарата Луверис® и р-чФСГ проводится однократная инъекция рекомбинантного человеческого хориогонадотропина (р-чХЕ) в дозе 250 мкг или человеческого хорионического гонадотропина (чХЕ) в дозе 5000-10 000 МЕ. Рекомендуется половой контакт в день введения человеческого хорионического гонадотропина и на следующий день.
В качестве альтернативы могут быть использованы вспомогательные репродуктивные технологии.
При чрезмерном/избыточном ответе нужно прекратить лечение и отменить введение чХЕ (см. «Побочное действие»). Лечение можно возобновить в течение следующего цикла с использованием более низкой дозы ФСГ, чем во время предыдущего цикла.
Рекомендации при самостоятельном введении препарата.
Самостоятельное введение препарата Луверис® может выполняться только высокомотивированными пациентками, прошедшими соответствующее обучение, при наличии постоянной возможности получения консультации специалиста. Луверис® вводится подкожно. Место инъекции следует менять ежедневно.
Если пациентка вводит Луверис® самостоятельно, ей следует внимательно прочитать и строго следовать нижеприведенной инструкции по введению препарата:
- Вымойте руки. Инъекцию следует проводить с соблюдением правил асептики и антисептики.
- Подготовьте чистую поверхность и разложите все на ней:
· тонкую иглу для подкожного введения;
· один флакон препарата Луверис® ;
· один флакон с растворителем,
· два тампона, смоченных спиртом;
· один шприц;
· одну иглу для растворения порошка в растворителе;
· контейнер для острых предметов для безопасной утилизации стеклянных деталей и игл.
- Удалите защитную крышку с флакона с растворителем. Соедините иглу для смешивания со шприцем и наберите в него немного воздуха, потянув поршень примерно до отметки 1 мл. Затем вставьте иглу во флакон, утопите поршень, чтобы выпустить воздух, и плавно наберите весь растворитель.
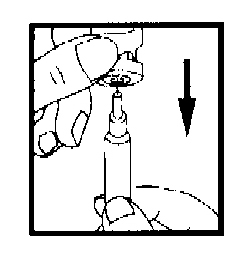
Осторожно положите шприц на рабочую поверхность, стараясь не трогать иглу.
- Приготовьте раствор для инъекции: удалите защитную крышку флакона с препаратом, возьмите шприц, проткните иглой резиновую пробку и медленно введите растворитель во флакон с препаратом. Плавно покачайте флакон, не вынимая иглы. Не трясите флакон.
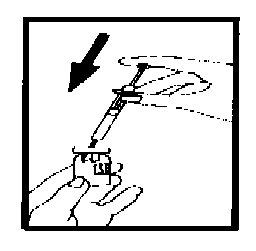
После того, как порошок растворится (обычно происходит сразу), убедитесь, что полученный раствор прозрачен и не содержит твёрдых частиц. Переверните флакон и плавно наберите раствор обратно в шприц.
Можно также смешивать Луверис® и фоллитропин альфа в качестве альтернативы раздельному введению каждого препарата. После растворения препарата Луверис® наберите раствор обратно в шприц и повторно введите его в контейнер с препаратом фоллитропина альфа. Как только препарат растворится, наберите раствор обратно в шприц. Осмотрите его на предмет наличия твёрдых частиц. Не используйте раствор, если он не прозрачен.
В 1 мл растворителя можно растворить до 3 флаконов с препаратом.
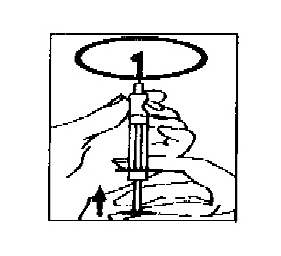
- Замените иглу на тонкую и выпустите пузырьки воздуха: если в шприце видны пузырьки воздуха, направьте шприц иглой вверх и осторожно постучите по нему, пока весь воздух не скопится вверху. Плавно надавите на поршень, чтобы удалить воздух.
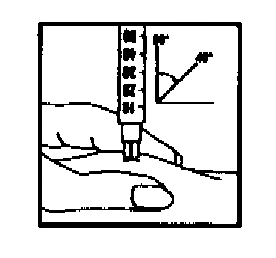
- Введите раствор сразу: Ваш лечащий врач или медсестра посоветуют, куда производить инъекцию (например, предплечье, передняя поверхность бедра).
Протрите выбранную область тампоном, смоченным спиртом. Соберите кожу в складку и быстрым движением введите иглу под углом 45–90°. Введите препарат под кожу, как Вас обучали.
Не вводите содержимое непосредственно в вену. Вводите раствор путём плавного надавливания на поршень. Используйте столько времени, сколько Вам потребуется, чтобы ввести весь раствор. Сразу после этого выньте иглу и круговыми движениями протрите кожу тампоном, смоченным спиртом.
- Утилизируйте все использованные предметы: как только Вы закончили введение препарата, немедленно поместите все иглы и пустые стеклянные ёмкости в контейнер для острых предметов. Неиспользованный раствор должен быть выброшен.
В том случае, когда пациентка забыла ввести очередную дозу препарата Луверис®, нельзя вводить двойную дозу, а следует обратиться к врачу.
Не использовать флакон при наличии признаков повреждения препарата, таких как изменение цвета порошка или повреждение флакона.
Побочное действие
Препарат Луверис® применяется совместно с фоллитропином альфа, поэтому трудно дифференцировать какой-либо побочный эффект к действию конкретно одного из этих двух препаратов.
В клинических исследованиях наблюдались лёгкие и средней тяжести реакции в месте инъекции (боль, покраснение, зуд, припухлость, кровоподтек) соответственно 7,4 % или 0,9% случаев.
Синдром гиперстимуляции яичников (СГЯ) наблюдался менее чем у 6 % пациенток. Случаи тяжёлой формы СГЯ не отмечены.
Не описано случаев перекрута кисты яичника и кровотечения в брюшную полость при применении препарата Луверис®, однако, редко при применении человеческого менопаузального гонадотропина (чМГ), выделенного из мочи и содержащего лютеинизирующий гормон, эти случаи описаны, поэтому их нельзя исключить.
Может развиться эктопическая беременность, особенно у женщин с заболеванием маточных труб в анамнезе, многоплодная беременность.
В случае обнаружения пациенткой каких-либо не упомянутых выше побочных эффектов, ей следует обратиться к врачу. Ниже используются следующие категории частоты нежелательных явлений:
Очень часто (≥1/10);
Часто (≥1/100, но <1/10);
Нечасто (≥1/1000, но <1/100);
Редко (≥1/10000, но <1/1000);
Очень редко (<1/10000);
Частота неизвестна (не может быть определена на основании имеющихся данных).
После введения препарата Луверис® могут наблюдаться следующие нежелательные реакции:
Нарушения со стороны иммунной системы
Очень редко: реакции гиперчувствительности (от лёгкой до тяжёлой степени выраженности), в том числе анафилактические реакции и шок.
Нарушения со стороны нервной системы
Часто: головная боль.
Нарушения со стороны сосудов
Очень редко: тромбоэмболии, обычно связанные с тяжёлой формой СГЯ (см. раздел «Особые указания»);
Нарушения со стороны желудочно-кишечного тракта
Часто: боль в животе, дискомфорт в животе, тошнота, рвота, диарея.
Нарушения со стороны половых органов и молочной железы
Часто: СГЯ лёгкой или средней степени тяжести с сопутствующей симптоматикой (см. раздел «Особые указания»), кисты яичников, боль в молочной железе, боль в области малого таза.
Общие расстройства и нарушения в месте введения
Часто: реакции в месте введения (например, боль, эритема, гематома, отёк и/или раздражение тканей в месте введения).
Передозировка
Симптомы передозировки препаратом Луверис® неизвестны. Однократное введение до 40000 МЕ лутропина альфа хорошо переносилось и не сопровождалось тяжёлыми побочными эффектами. Тем не менее, при передозировке существует вероятность возникновения синдрома гиперстимуляции яичников.
Лечение СГЯ симптоматическое.
Взаимодействие с другими лекарственными средствами
Не следует смешивать Луверис® с другими лекарственными веществами в одном шприце, за исключением фоллитропина альфа. Исследования показали, что эти два препарата можно смешивать и вводить одновременно, это не влияет на их терапевтическую активность.
Клинически значимого лекарственного взаимодействия препарата Луверис® с другими лекарственными препаратами не описано.
Особые указания
Перед началом терапии необходимо соответствующее обследование пациентки и её партнера на предмет причины бесплодия. Не рекомендуется применение препарата Луверис®, когда его эффекта не ожидается, в частности, при первичной яичниковой недостаточности, аномалиях развития половых органов или фибромиоме матки, несовместимых с беременностью. Перед началом лечения необходимо обследование на наличие гипотиреоза, недостаточности коры надпочечников и гиперпролактинемии и, при необходимости, назначение соответствующей терапии.
У пациенток с порфирией или её наличием в семейном анамнезе препарат Луверис® может повышать риск обострения заболевания. При ухудшении состояния или появлении первых признаков порфирии может потребоваться прекращение терапии.
Синдром гиперстимуляции яичников (СГЯ)
Увеличение яичников является ожидаемым эффектом контролируемой стимуляции яичников. Оно чаще отмечается у женщин с синдромом поликистозных яичников и обычно регрессирует на фоне лечения.
В противоположность неосложненному увеличению яичников, СГЯ представляет собой более тяжёлое состояние, соответствующее значительному увеличению яичников, сопровождающемуся созданием высоких концентраций половых стероидных гормонов в плазме крови и повышением сосудистой проницаемости, что может приводить к накоплению жидкости в полости брюшины, плевральной полости и, в редких случаях, в полости перикарда. Проявлениями СГЯ лёгкой степени могут являться боль или дискомфорт в животе, увеличение его размеров, или увеличение размеров яичников. При СГЯ средней степени тяжести могут дополнительно отмечаться тошнота, рвота, а также значительное увеличение размеров яичников по данным ультразвукового исследования.
При тяжёлой форме СГЯ, помимо этого, наблюдается выраженное увеличение яичников, увеличение массы тела, диспноэ или олигурия. Могут отмечаться гиповолемия, гемоконцентрация, электролитные нарушения, асцит, плевральный выпот или острый респираторный дистресс-синдром. Очень редко тяжёлая форма СГЯ может осложняться перекрутом кисты яичника или тромбоэмболическими явлениями, такими как тромбоэмболия лёгочной артерии, ишемический инсульт или инфаркт миокарда.
Независимыми факторами риска развития СГЯ являются молодой возраст, низкая масса тела, синдром поликистозных яичников, высокие дозы экзогенных гонадотропинов, высокая абсолютная или быстро нарастающая концентрация эстрадиола в плазме крови, наличие эпизодов СГЯ в анамнезе, большое количество созревающих фолликулов и большое количество ооцитов, забранных в течение цикла репродуктивной технологии. Соблюдение рекомендуемых доз и режимов терапии препарата Луверис® и ФСГ может обеспечить минимизацию риска гиперстимуляции яичников. Для выявления факторов риска рекомендуется осуществлять мониторинг стимуляции роста фолликула посредством ультразвукового исследования, также рекомендуется определение концентрации эстрадиола.
Имеются доказательства того, что чХГ играет определённую роль в индукции СГЯ, и данный синдром может приобретать более тяжёлое течение в случае наступления беременности. Поэтому, при развитии гиперстимуляции яичников рекомендуется отложить введение чХГ и рекомендовать пациентке воздерживаться от половых контактов или использовать барьерные контрацептивы в течение не менее 4 дней. Поскольку СГЯ может прогрессировать быстро (в течение 24 часов) или может приобретать тяжёлое течение в течение нескольких дней, необходимо наблюдение пациенток в течение не менее 2 недель после введения чХГ.
СГЯ лёгкой или умеренной степени выраженности обычно разрешается спонтанно. В случае развития тяжёлого СГЯ рекомендуется прекратить введение гонадотропина и госпитализировать пациентку с назначением ей соответствующего лечения.
Многоплодная беременность
После индукции овуляции повышается частота многоплодной беременности по сравнению с таковой при естественном зачатии. Большинство таких плодов являются близнецами. При многоплодной беременности, особенно с большим количеством плодов, возрастает риск неблагоприятных исходов для матери, плода и новорождённого.
С целью минимизации риска развития многоплодной беременности с большим количеством плодов рекомендуется тщательный мониторинг ответа яичников на стимуляцию.
У пациенток, получающих вспомогательные репродуктивные технологии (ВРТ), риск многоплодной беременности преимущественно обусловлен количеством перемещённых эмбрионов, их качеством и возрастом пациентки.
Невынашивание беременности
Частота невынашивания и самопроизвольных абортов выше у пациенток, перенёсших стимуляцию роста фолликула с целью индукции овуляции, чем при естественном зачатии.
Эктопическая беременность
Женщины, имеющие в анамнезе эктопическую беременность, характеризуются повышением риска данного состояния в последующем, вне зависимости от факта получения вспомогательных репродуктивных технологий. Однако, распространённость эктопической беременности, как было показано, выше при применении ВРТ, чем в общей популяции.
Врождённые аномалии
Распространённость врождённых аномалий после ВРТ может быть несколько выше, чем после естественного зачатия, хотя не ясно, связано ли это с факторами, обусловливающими бесплодие у пары или процедурами ВРТ. Согласно результатам клинических и маркетингового исследований, не получено данных о том, что применение гонадотропинов повышает риск развития врождённых аномалий у детей пациенток, получающих терапию по поводу бесплодия.
Тромбоэмболии
У женщин, перенёсших тромбоэмболии недавно или страдающих ими в настоящее время, а также у женщин, имеющих известные факторы риска тромбоэмболий в личном или семейном анамнезе, гонадотропины могут дополнительно повышать риск усугубления или развития данных нарушений. В таких случаях следует соотносить пользу и риск применения гонадотропинов. Следует отметить, однако, что беременность сама по себе, а также СГЯ повышают риск развития тромбоэмболий.
Новообразования половых органов
Описаны случаи развития новообразований (как доброкачественных, так и злокачественных) яичников и других половых органов у женщин, получавших комбинированную терапию по поводу бесплодия. В настоящее время не ясно, способствует ли терапия гонадотропинами повышению риска этих новообразований у женщин, страдающих бесплодием.
Особые популяции
Применение у детей
Показания к применению препарата Луверис® у детей отсутствуют.
Применение у пожилых пациенток
Показания к применению препарата Луверис® у лиц пожилого возраста отсутствуют.
Пациентки с нарушением функции почек или печени
Безопасность, эффективность и фармакокинетика препарата Луверис® у пациенток с почечной или печёночной недостаточностью не известны.
Влияние на способность управлять транспортными средствами, механизмами
Исследований влияния препарата на способность к управлению транспортными средствами и другими механизмами не проводилось.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения 75 МЕ.
По 75 МЕ лутропина альфа во флаконы бесцветного прозрачного стекла тип Ⅰ (Евр. Ф.) вместимостью 3 мл, укупоренные резиновой пробкой, уплотнённой сверху алюминиевым колпачком с отрывающейся пластмассовой крышечкой типа "Flip off".
По 1 мл растворителя (вода для инъекций) во флаконы из бесцветного прозрачного стекла тип Ⅰ (Евр. Ф.) вместимостью 2 мл, укупоренные резиновой пробкой, уплотнённой сверху алюминиевым колпачком с отрывающейся пластмассовой крышечкой типа "Flip off". По 1, 3 или 10 флаконов лиофилизата в комплекте с растворителем (1, 3 или 10 флаконов) в пластиковом контейнере вместе с инструкцией по применению в картонной пачке.
Хранение
В оригинальной упаковке в защищённом от света месте при температуре не выше 25 °C. Хранить в недоступном для детей месте.
Срок годности
Лиофилизат — 3 года.
Растворитель — 3 года.
Не использовать после срока годности, указанного на упаковке.Условия отпуска из аптек
Отпускают по рецепту
Производитель
MERCK SERONO, S.p.A., Италия
