Новакутан-БТА
Лекарственная форма
лиофилизат для приготовления раствора для внутримышечного введения
Состав
Состав на 1 флакон:
действующее вещество: ботулинический токсин типа А — гемагглютинин комплекс — 100 ЕД.
вспомогательные вещества: альбумин человека — 0,5 мг, натрия хлорид — 0,9 мг.
Описание
Лиофилизат: лиофилизированный порошок белого цвета.
Восстановленный раствор: бесцветный прозрачный раствор, без посторонних частиц и механических включений.
Фармакологическое действие
Фармакодинамика
Препарат Новакутан-БТА представляет собой ботулинический токсин, продуцируемый штаммом бактерии Clostridium botulinum типа А, очищенный от комплексообразующих белков. Оказывает местные фармакологические эффекты и почти не обладает системным действием.
Ботулинический токсин типа А блокирует периферический выброс ацетилхолина в пресинаптических холинергических нервных окончаниях путём расщепления SNAP-25, белка, принимающего участие в процессе экзоцитоза ацетилхолина из везикул, расположенных в нервных окончаниях. После инъекции происходит первоначальное быстрое высокоаффинное связывание токсина со специфичными клеточными рецепторами. За этим следует трансфер токсина через плазматическую мембрану с помощью рецептор-опосредованного эндоцитоза. Финальный этап — высвобождение токсина в цитозоль.
Этот процесс сопровождается постепенным ингибированием высвобождения ацетилхолина. Первичный фармакодинамический эффект ботулинического токсина типа А обусловлен химической денервацией мышцы, в которую была произведена инъекция, что приводит к измеряемому снижению индуцированного электрического ответа мышцы, и, как следствие, к её расслаблению. Клинические признаки появляются в течение 2–3 дней, причём максимальный эффект наблюдается в течение 5–6 недель после инъекции.
Восстановление нервно-мышечной передачи происходи обычно в течение 12 недель после инъекции в результате регенерации нервных терминалей и восстановления связей с концевыми пластинами.
Фармакокинетика
Отдельных фармакокинетических исследований препарата Новакутан-БТА не проводилось. Известно, что при внутримышечном введении период полувыведения ботулинического токсина составляет около 10 часов, в течение 24 часов 60 введённой дозы выводится с мочой. Пресинаптический захват и ретроградный транспорт из места введения ботулинического токсина незначительны.
Метаболизируется обычным путём с участием протеаз.
Фармакологический эффект проявляется в течение 2–3 дней после введения препарата и достигает максимума в течение 5–6 недель. Восстановление нервно-мышечной передачи происходит обычно в течение 12 недель после введения ботулинического токсина в результате регенерации нервных терминалей и восстановления связей с концевыми пластинами.
При повторном введении в 1,5 случаев к ботулиническому токсину могут формироваться антитела. Продукции антител способствует введение высоких доз ботулинического токсина или небольшой интервал (менее 14 дней) между повторными введениями малых доз. При формировании антител терапевтический эффект ботулинического токсина А может снижаться.
В терапевтических дозах ботулинический токсин не проникает через гематоэнцефалический барьер.
Показания
- Временная коррекция гиперкинетических складок верхней трети лица (межбровных, лобных морщин и периорбитальных морщин типа «гусиные лапки») у взрослых.
Противопоказания
- Повышенная чувствительность к любому компоненту препарата;
- воспалительный процесс в месте введения;
- острая фаза инфекционных заболеваний;
- беременность и период грудного вскармливания;
- выраженный гравитационный птоз тканей верхней трети лица;
- выраженные «грыжи» в области верхних и нижних век;
- нарушения нервно-мышечной передачи (миастения гравис или синдром Ламберта-Итона);
- детский возраст до 18 лет.
С осторожностью
- У пожилых пациентов с отягощённым анамнезом и сопутствующей лекарственной терапией;
- у пациентов, имеющих дисфагию и аспирацию в анамнезе;
- у пациентов с отягощённым анамнезом;
- при наличии воспаления в местах предполагаемых инъекций или в случае выраженной слабости или атрофии в мышце, в которую планируется вводить препарат;
- у пациентов с периферической моторной нейропатией (например, при амиотрофическом боковом склерозе или моторной нейропатии);
- у пациентов с субклиническими или клиническими признаками нарушения нервно-мышечной передачи (например, при миастении гравис или синдроме Ламберта-Итона);
- при выраженной мышечной слабости или атрофии мышцы в месте введения;
- при нарушении свёртываемости крови (включая приём антикоагулянтов);
- у больных, имеющих высокий риск развития закрытоугольной глаукомы, включая анатомическое сужение угла передней камеры.
Беременность и лактация
Беременность
Известно, что ботулинический токсин А обладает репродуктивной токсичностью у животных. Контролируемых клинических исследований репродуктивной токсичности препарата Новакутан-БТА у человека не проводилось. Поэтому применение препарата Новакутан-БТА во время беременности и у женщин детородного возраста, не использующих надёжную контрацепцию противопоказано.
Период грудного вскармливания
Неизвестно, выделяется ли ботулинический токсин А в грудное молоко. Поэтому применение препарата Новакутан-БТА в период грудного вскармливания противопоказано.
Влияние на фертильность
Известно, что ботулинический токсин А снижает фертильную способность у животных.
Контролируемых клинических исследований влияния препарата Новакутан-БТА на фертильность человека не проводилось.
Способ применения и дозы
Только для внутримышечного введения.
Не допускать попадания препарата в кровеносный сосуд
Лечение препаратом Новакутан-БТА должно проводиться врачом соответствующей квалификации, прошедшим специальную подготовку по применению препаратов ботулинического токсина.
Перед применением содержимое флакона растворяют в соответствующем количестве стерильного 0,9 раствора хлорида натрия, не содержащего консервантов. Полученный раствор аккуратно перемешивают, не допуская резкого встряхивания.
Не использовать препарат, если не наблюдается втягивания растворителя во флакон под действием вакуума.
Приготовленный раствор может быть использован в течение 24 часов после приготовления при условии хранения при температуре от 2 до 8 °C. Неиспользованный раствор подлежит утилизации (см. раздел «Меры предосторожности при утилизации»).
Различные препараты ботулинического токсина А не являются взаимозаменяемыми. Единицы действия препарата Новакутан-БТА являются специфическими и не могут использоваться для пересчёта доз других препаратов ботулинического токсина.
Для коррекции мимических морщин содержимое одного флакона растворяют в 2,5 мл растворителя для получения раствора концентрацией 4 ЕД/0,1 мл (рекомендуемая доза). Так как эффективность препарата является специфической, для достижения терапевтического эффекта у конкретного пациента может потребоваться как увеличение, так и снижение рекомендованной дозы. Также возможно уменьшение или увеличение дозы путём изменения вводимого объёма — от 0,05 мл (50 снижение дозы) до 0,15 мл (50 увеличение дозы). Разведение препарата проводят согласно таблице:
| Объём растворителя | Полученная доза (ЕД/0,1 мл) |
| 1,0 мл | 10,0 ЕД/0,1 мл |
| 2,0 мл | 5,0 ЕД/0,1 мл |
| 4,0 мл | 2,5 ЕД/0,1 мл |
| 8,0 мл | 1,25 ЕД/0,1 мл |
- Межбровные морщины:
Вводят иглой размером 27–30G/0,40–0,3 мм по 0,1 мл раствора в каждую из пяти точек: по 2 точки в каждую мышцу, сморщивающую бровь, 1 точка в мышцу гордецов.
Общая доза вводимого препарата составляет 20 ЕД.
Для профилактики птоза необходимо избегать введения препарата вблизи мышцы, поднимающей верхнее веко, особенно у пациентов с хорошо выраженной мышцей, опускающей верхнее веко. При введении препарата в мышцу, сморщивающую бровь (m.corrugators), следует выбирать точку инъекции в центральной части мышцы, отступив не менее I см выше дуги брови. Перед проведением инъекции необходимо плотно прижать большой или указательный пальцы к коже ниже края глазницы, чтобы препятствовать распространению лекарственного препарата ниже этого уровня. Во время выполнения инъекции иглу следует направлять вверх и медиально.
Терапевтический эффект продолжается в течение 3–4 месяцев, после чего процедуру можно повторить. Интервал между процедурами должен составлять не менее 3 месяцев. При отсутствии эффекта от введения препарата или снижения ею выраженности после повторных инъекций следует рекомендовать другие методы лечения. При неэффективности первой процедуры, т.е. отсутствии значительного клинического улучшения, по сравнению с исходным состоянием, через 1 месяц после введения препарата, необходимо:
- клиническое подтверждение действия токсина на инъецированную мышцу (мышцы), которое может включать ЭМГ исследование, выполняемое опытным специалистом в специализированном отделении;
- анализ причин неэффективности процедуры, например, неадекватный выбор точек для инъекции, недостаточная доза, неправильная техника инъекции, признаки фиксированной контрактуры, слабость мышц-антагонистов, формирование токсин нейтрализующих антител;
- повторная оценка целесообразности лечения ботулиническим токсином типа А;
- при отсутствии каких-либо нежелательных эффектов, связанных с первым введением препарата, при повторной процедуре должны быть соблюдены следующие условия: коррекция дозы с учётом анализа причин неэффективности предыдущей процедуры: ЭМГ-контроль; интервал между процедурами должен составлять не менее 3-х месяцев. При отсутствии эффекта от введения препарата или снижения его выраженности после повторных инъекций следует рекомендовать другие методы лечения.
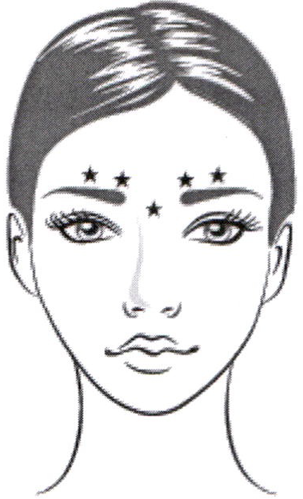
- Периорбитальные морщины («гусиные лапки»):
Препарат Новакутан-БТА вводят билатерально в 3 точки круговой мышцы глаза с наибольшей выраженностью морщин при улыбке (всего 6 точек). Обычно рекомендуется вводить по 2–6 ЕД в каждую точку, на глубину 2–3 мм, общая доза составляет 6–18 ЕД с каждой стороны.
Инъекции производятся на расстоянии не менее 1 см от края орбиты, кнаружи от вертикальной линии, проведённой через латеральный кантус и не приближаясь к нижнему краю скуловой дуги.

- Лобные морщины:
Новакутан-БТА вводят внутримышечно в каждую из 4 точек инъекций в лобные мышцы. Рекомендуется вводить по 2–6 ЕД в точки, располагающиеся с каждой стороны вдоль лобных складок с интервалом 1–2 см так, что общая доза составляет 8–24 ЕД. Для уменьшения риска птоза бровей инъекции должны осуществляться на расстоянии не менее 2–3 см от края брови.
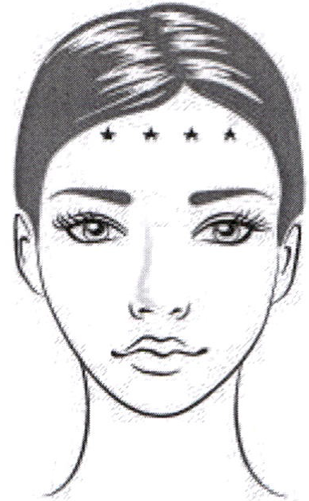
Эффективность и безопасность препарата у детей и подростков до 18 лет и у лиц старше 65 лет не изучена.
Побочные эффекты
Частота развития нежелательных реакций при применении препарата Новакутан-БТА носит дозозависимый характер и при корректировке периорбитальных морщин типа «гусиные лапки» составляет 18,3 , при корректировке межбровных и лобных морщин 53–55 .
Как правило, нежелательные реакции проявляются в течение первых дней после инъекции и являются преходящими. В редких случаях длительность нежелательных реакций может составлять несколько месяцев или более.
Локальная мышечная слабость отражает ожидаемое фармакологическое действие ботулинического токсина на мышцу. Однако большие дозы могут вызвать слабость мышц помимо непосредственно тех, что локализованы в месте инъекции.
Как и при любой инъекционной процедуре в месте введения препарата может отмечаться локальная болезненность, воспаление, парестезия, гипестезия, уплотнение кожи, отёчность, эритема, локализованная инфекция, кровотечение и/или гематомы.
Связанная с процедурой боль и/или тревога могут приводить к вазовагальным реакциям, включая транзиторную гипотензию и обмороки.
Описано повышение температуры и возникновение гриппоподобного синдрома.
Нежелательные реакции (частота для каждой нозологии)
Частота встречаемости нежелательных реакций представлена для каждого показания к применению препарата на основе опыта клинического применение на имя. Для описания частоты встречаемости приняты следующие критерии: очень часто (≥1/10); часто (1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
Межбровные морщины
| Инфекционные и паразитарные заболевания: | |
| Нечасто | Инфекции |
| Нарушения | психики: |
| Нечасто | Тревожность |
| Нарушения со стороны нервной системы: | |
| Часто | Головная боль, парестезии |
| Нечасто | Головокружение |
| Нарушения со стороны органа зрения: | |
| Часто | Блефароптоз |
| Нечасто | Блефариты, боль в глазах, нарушения зрения (включая снижение его остроты) |
| Нарушения со стороны желудочно-кишечного тракта: | |
| Часто | Тошнота |
| Нечасто | Сухость во рту |
| Нарушения | со стороны кожи и подкожных тканей: |
| Часто | Эритема, ощущение стянутости кожи |
| Нечасто | Отёчность (лица, век, периорбитальной области), фотосенситизация, зуд, сухость кожи |
| Нарушения со стороны скелетно-мышечной и соединительной ткани: | |
| Часто | Локальная мышечная слабость |
| Нечасто | Мышечные подёргивания |
| Общие расстройства и нарушения в месте | |
| введения: |
|
| Часто | Боль в области лица, отёк места инъекции, боль/жжение в месте инъекции |
| Нечасто | Гриппоподобный синдром, астения, лихорадка |
Периорбитальные морщины
| Инфекционные и паразитарные заболевания: | |
| Часто | Гриппоподобный синдром |
| Нарушения со стороны нервной системы: | |
| Часто | Головная боль |
| Нарушения со стороны органа зрения: | |
| Часто | Опущение латеральной части верхнего века, отёк века |
|
|
|
| Общие расстройств за и нарушения в месте введения: | |
| Часто | Геморрагии и гематомы в месте инъекции*, |
| Нечасто | Боль в месте инъекции*, парестезии в области инъекции |
| * Реакции, связанные с процедурой инъекции | |
Лобные морщины
| Инфекционные и паразитарные заболевания: | |
| Часто | ОРВИ |
| Нарушения психики: | |
| Часто | Чувство напряжённости |
| Нарушения со стороны нервной системы: | |
| Очень часто | Птоз брови, головная боль |
| Нарушения со стороны органа зрения: | |
| Очень часто | Отёк век |
| Нарушения со стороны желудочно-кишечного тракта: | |
| Часто | Тошнота |
| Нарушения со стороны кожи и подкожных тканей: | |
| Часто | Зуд лба |
| Общие расстройства и нарушения в месте введения: | |
| Часто | Боль области лба, гриппоподобный синдром |
| Травмы, интоксикации и осложнения манипуляций: | |
| Очень часто | Синячки/кровоизлияния |
Дополнительная информация
Последующий перечень включает побочные реакции и прочие медицинские нежелательные явления о которых были получены сообщения в постмаркетинговый период, независимо от показаний к применению, и которые, возможно, не были перечислены выше.
Нарушения со стороны иммунной системы:
Анафилактический шок, отёк Квинке, сывороточная болезнь и крапивница
Нарушения со стороны обмена веществ и питания: Анорексия
Нарушения со стороны нервной системы:
Плексопатия плечевого сплетения, дисфония, дизартрия, парез лица, гипестезия, мышечная слабость, миастения гравис, периферическая нейропатия, парестезии, радикулопатия, судороги, обмороки и паралич лица.
Нарушения со стороны органа зрения:
Закрытоугольная глаукома (при лечении блефароспазма), страбизм, ослабление чёткости и другие нарушения зрения, сухость глаз (ассоциированная с периорбитальными инъекциями), отёк век.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Тугоухость, шум в ушах и головокружение
Нарушения со стороны сердца:
Аритмия, инфаркт миокарда
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Аспирационная пневмония (в некоторых случаях с летальным исходом), диспноэ, бронхоспазм, угнетение дыхания дыхательная недостаточность
Нарушения со стороны желудочно-кишечного тракта:
Боль в животе, диарея, запор, сухость во рту, дисфагия, тошнота и рвота
Нарушения со стороны кожи и подкожных тканей:
Алопеция, псориазоформный дерматит, многофорамная эритема, гипергидроз, мадароз, зуд и сыпь
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Мышечная атрофия, миалгия, локальные мышечные подёргивания/тики
Общие расстройства и нарушения в месте введения:
Атрофия вследствие денервации, недомогание и лихорадка.
Передозировка
Ни одного случая системной токсичности вследствие случайной инъекции Новакутан-БТА не наблюдалось. Чрезмерные дозы могут вызывать локальный, удалённый или генерализованный нервно-мышечный паралич (см. раздел «Особые указания»).
Симптомы передозировки, как правило, не проявляются сразу же после инъекции.
При случайном введении избыточной дозы или проглатывании препарата Новакутан-БТА больной должен находиться под медицинским наблюдением в течение нескольких недель для выявления клинических проявлений и симптомов мышечной слабости, локальной или удалённой от места инъекции, и которые могут включать: птоз, диплопию, дисфагию, расстройство речи, общую слабость или дыхательную недостаточность. Необходимо предусмотреть возможность оказания немедленной медицинской помощи, в том числе, в условиях стационара.
В случае поражения мышц глотки и пищевода может произойти аспирация с последующим развитием аспирационной пневмонии. Пациентам с параличом дыхательной мускулатуры может потребоваться интубация и перевод на искусственную вентиляцию лёгких до улучшения состояния больного. В дополнение к другим мерам общего поддерживающего лечения может потребоваться проведение трахеостомии и продолжительная искусственная вентиляция.
В случае передозировки возможно применение противоботулинической сыворотки. Однако введение сыворотки не способно купировать уже развившиеся к моменту его введения клинические эффекты ботулинического токсина.
Взаимодействие
Теоретически, эффект ботулинического токсина может усиливаться при одновременном применении с антибиотиками группы аминогликозидов или спектиномицином, а также с другими лекарственными средствами, влияющими на нейромышечную передачу (например, миорелаксантами).
Эффект введения различных серотипов ботулинического нейротоксина одновременно или с интервалом в несколько месяцев неизвестен. Возможно усугубление нейромышечной слабости при введении другого ботулинического токсина до исчезновения эффектов ранее введённого ботулинического токсина. Исследования по лекарственному взаимодействию не проводились. Клинически значимых случаев лекарственного взаимодействия не описано.
Особые указания
Не следует превышать рекомендуемые дозы и частоту введения препарата в связи с потенциальным риском передозировки, чрезмерной мышечной слабости, дистантного распространения токсина и формирования нейтрализующих антител (см. раздел «Передозировка»). При первичном курсе лечение необходимо начинать с самой низкой рекомендуемой дозы для конкретного показания к применению.
Врачи и пациенты должны быть осведомлены, что побочные эффекты могут возникнуть, несмотря на хорошую переносимость предыдущих инъекций. Необходимо соблюдать осторожность и внимательность при каждой процедуре.
Были зарегистрированы побочные эффекты, связанные с распространением токсина от места введения, иногда с летальным исходом, связанным в некоторых случаях с дисфагией, пневмонией и/или выраженной мышечной слабостью. Данные симптомы согласуются с механизмом действия ботулинического токсина и появляются в период от нескольких часов до нескольких недель после инъекции. Риск возникновения этих побочных эффектов наиболее высок у пациентов с сопутствующими заболеваниями и состояниями, предрасполагающими к развитию данных симптомов, а также у пациентов, получающих лечение по поводу спастичности в высоких дозах.
Пациенты, получающие препарат в терапевтических дозах, могут также испытывать выраженную мышечную слабость.
К пожилым и ослабленным пациентам следует относиться с осторожностью. Следует оценить соотношение риска и пользы для конкретного пациента, прежде чем приступать к лечению препаратом Новакутан-БТА.
Было сообщено о дисфагии, последовавшей за инъекциями в участки помимо мышц шеи. Новакутан-БТА следует применять с крайней осторожностью и под постоянным контролем у пациентов, имеющих субклинические или клинические признаки нарушения нервно-мышечной передачи, например, при миастении гравис или синдроме Ламберта-Итона, у больных периферическими моторными нейропатическими заболеваниями (например, боковым амиотрофическим склерозом или моторной нейропатией), а также у пациентов с сопутствующей неврологической патологией.
Эти пациенты могут иметь повышенную чувствительность к данной группе препаратов даже в терапевтических дозах, что может приводить к развитию выраженной мышечной слабости и высокому риску возникновения клинически значимых системных эффектов, включая тяжёлую дисфагию и нарушения дыхания. В таких случаях ботулинический токсин должен быть использован под контролем специалиста и только тогда, когда польза от лечения превышает риск. Больные с дисфагией и аспирацией в анамнезе должны лечиться с особой осторожностью.
Пациентам и лицам, осуществляющим уход, следует рекомендовать немедленно обратиться за медицинской помощью в случае возникновения нарушений глотания, речи или дыхания.
Перед инъекцией препарата Новакутан-БТА необходимо уточнить анатомию соответствующих областей и любые изменения анатомии в результате предшествовавших операций; следует избегать инъекций в легко повреждаемые анатомические структуры.
Серьёзные побочные реакции, в том числе со смертельным исходом, отмечались у пациентов, которым препарат вводился по неутверждённым показаниям — инъекции препарата непосредственно в слюнные железы, оро-лингво-фарингеальную область, пищевод и желудок. У некоторых пациентов была предшествующая дисфагия или выраженная слабость.
О развитии серьёзных и/или немедленных реакций гиперчувствительности на фоне применения препарата Новакутан-БТА, таких как анафилаксия, сывороточная болезнь, крапивница, отёк мягких тканей или диспноэ сообщалось нечасто. Реакции были зарегистрированы как в случаях монотерапии препаратом Новакутан-БТА, так и при применении его в сочетании с другими препаратами, способными вызвать подобные симптомы. В случае развития таких реакций дальнейшее введение препарата Новакутан-БТА должно быть прекращено и немедленно начата соответствующая медикаментозная терапия, в частности эпинефрином. Описывался один случай анафилаксии с летальным исходом после инъекции препарата, разведённого ненадлежащим образом с использованием 5 мл 1% лидокаина.
Как и при любых инъекциях могут наблюдаться осложнения, связанные с процедурой. Инъекции могут приводить к локальным инфекциям, болезненности, воспалению, парестезии, гипестезии, повышенной чувствительности, отеку, эритеме, кровотечениям/гематомам. Связанная с инъекцией боль и/или тревога могут приводить к вазовагальным реакциям, например, обморокам, артериальной гипотензии и др.
Необходимо соблюдать осторожность при слабости или атрофии мышц, в которые планируется введение препарата.
Описаны редкие нежелательные реакции со стороны сердечно-сосудистой системы, включая аритмии и инфаркт миокарда, в некоторых случаях с летальным исходом. У части этих пациентов изначально присутствовали факторы риска, в том числе заболевания сердечно-сосудистой системы.
Отмечались впервые появившиеся или повторные пароксизмы, как правило, у предрасположенных к этим состояниям больных. Точная связь между этими явлениями и введением токсина не установлена. Припадки отмечали преимущественно среди больных ДЦП.
Формирование нейтрализующих антител к ботулиническому токсину может снижать эффективность препарата Новакутан-БТА, за счёт инактивации биологической активности токсина. По данным клинических исследований, введение препарата с большей частотой и в больших дозах может приводить к росту случаев формирования антител. Потенциальное формирование антител может быть минимизировано путём введения наименьших эффективных доз с максимальными клинически допустимыми интервалами между инъекциями. Клинические флюктуации при повторном применении препарата Новакутан- БТА (как и для всех ботулинических токсинов) могут быть результатом различий в технике разведения препарата, интервалах между инъекциями и инъецируемых мышцах, а также небольших колебаний значений активности препарата, определяемой биологическим методом.
Морщины верхней трети лица (межбровные, лобные морщины, «гусиные лапки)
Редкое моргание, связанное с введением ботулинического токсина в круговую мышцу глаза, может приводить к повреждению роговицы, персистирующим дефектам эпителия и эрозиям роговицы, особенно у пациентов с патологией VII пары черепно-мозговых нервов.
Новакутан-БТА необходимо с осторожностью применять в следующих случаях:
- при выраженной асимметрии лица.
- при птозе, дерматохалазисе, глубоких рубцах,
- у пациентов с плотной кожей или при отсутствии значительного сглаживания мимических морщин при механическом растяжении кожи.
Важная информация
Оставшийся после проведения инъекций неиспользованный раствор препарата, а также вспомогательные инструменты и материалы, находившиеся в контакте с препаратом (шприцы, иглы и т.д.), должны быть утилизированы в соответствии с действующими правилами уничтожения биологических отходов.
Влияние на способность управлять транспортными средствами или работать с механизмами
Исследование по изучению влияния препарата на способность управлять транспортными средствами и работать с механизмами не проводились. Новакутан-БТА может вызывать астению, мышечную слабость, головокружение и расстройства зрения. В случаях развития таких симптомов может создаваться опасность при управлении автомобилем или работе с движущимися механизмами.
Меры предосторожности при утилизации
Неиспользованный раствор автоклавируют при температуре 120 ± 2 °C и давлении пара 0,11 МПа в течение 45 мин. или дезактивируют в течение не менее 18 часов одним из растворов: 70 этанол, 50 изопропанол, 0,1 М раствор гидроксида натрия, 0,1 раствор гипохлорита натрия.
Пролитый препарат вытирают адсорбирующей салфеткой, смоченной в растворе гидроксида натрия. В случае попадания раствора на повреждённую поверхность кожи (порез, царапина), на неповреждённую кожу или в глаза — тщательно промыть большим количеством воды.
Форма выпуска
Лиофилизат для приготовления раствора для внутримышечного введения, 100 ЕД.
Хранение
Хранить при температуре от 2 до 8 °C
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Без рецепта
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Новакутан-БТА:
