Войксакт
Лекарственная форма
раствор для подкожного введения
Листок вкладыш: информация для пациента
Данная сводка не включает всю информацию, необходимую для безопасного и эффективного применения препарата ВОЙКСАКТ. См. полную инструкцию по применению ВОЙКСАКТ.
ВОЙКСАКТ (сибепрелимаб-szsi) раствор для подкожного введения
Первое одобрение в США: 2025
Показания к применению
ВОЙКСАКТ является блокатором лиганда, индуцирующего пролиферацию (APRIL), показан для снижения протеинурии у взрослых с первичной нефропатией иммуноглобулина A (IgAN), подверженных риску прогрессирования заболевания. (1)
Данное показание одобрено в рамках ускоренного одобрения на основании снижения протеинурии. Не установлено, замедляет ли ВОЙКСАКТ снижение функции почек в долгосрочной перспективе у пациентов с IgAN. Продолжение одобрения для данного показания может быть обусловлено подтверждением и описанием клинической пользы в подтверждающем клиническом исследовании. (1)
Дозировка и применение
Рекомендуемая дозировка: 400 мг, вводится подкожно один раз в 4 недели. (2.1)
Лекарственная форма и дозы
Раствор для инъекций: 400 мг/2 мл (200 мг/мл) в одноразовом шприце с готовой дозой. (3)
Противопоказания
Тяжёлая гиперчувствительность к сибепрелимабу-szsi или любому из вспомогательных веществ в ВОЙКСАКТ. (4)
Предупреждения и меры предосторожности
- Иммуносупрессия и повышенный риск инфекций: Перед началом применения ВОЙКСАКТ оцените наличие активных инфекций. Во время лечения контролируйте наличие признаков и симптомов инфекции. (5.1)
- Иммуносупрессия и риски иммунизации: Живые вакцины не рекомендуются в течение 30 дней до начала применения ВОЙКСАКТ или во время лечения. (5.2)
Нежелательные реакции
Наиболее частые нежелательные реакции — инфекции верхних дыхательных путей и эритема в месте инъекции. (6.1)
Для сообщения о ПОДОЗРЕВАЕМЫХ НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ обращайтесь в Otsuka America Pharmaceutical, Inc. по телефону 1-800-438-9927 или в FDA по телефону 1-800-FDA-1088 или на сайт www.fda.gov/medwatch.
См. раздел 17 для ИНФОРМАЦИИ ДЛЯ ПАЦИЕНТОВ и одобренную FDA маркировку для пациентов.
Выпущено: 11/2025
Полная инструкция по применению: Содержание*
1 ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
2 ДОЗИРОВКА И ПРИМЕНЕНИЕ
2.1 Рекомендуемая дозировка
2.2 Пропущенная доза
2.3 Приготовление и введение
3 ЛЕКАРСТВЕННАЯ ФОРМА И ДОЗЫ
4 ПРОТИВОПОКАЗАНИЯ
5 ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
5.1 Иммуносупрессия и повышенный риск инфекций
5.2 Иммуносупрессия и риски иммунизации
6 НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
6.1 Опыт клинических исследований
8 ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ НАСЕЛЕНИЯ
8.1 Беременность
8.2 Лактация
8.4 Применение в педиатрии
8.5 Применение у пожилых пациентов
11 ОПИСАНИЕ
12 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
12.1 Механизм действия
12.2 Фармакодинамика
12.3 Фармакокинетика
12.6 Иммуногенность
13 ДОКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ
13.1 Канцерогенез, мутагенез, нарушение фертильности
14 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
16 КАК ПОСТАВЛЯЕТСЯ/ХРАНЕНИЕ И ОБРАЩЕНИЕ
17 ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
* Разделы или подразделы, отсутствующие в полной инструкции по применению, не указаны.
ПОЛНАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
1 ПОКАЗАНИЯ И ПРИМЕНЕНИЕ
ВОЙКСАКТ показан для снижения протеинурии у взрослых с первичной нефропатией иммуноглобулина A (IgAN), подверженных риску прогрессирования заболевания.
Данное показание одобрено в рамках ускоренного одобрения на основании снижения протеинурии. Не установлено, замедляет ли ВОЙКСАКТ снижение функции почек в долгосрочной перспективе у пациентов с IgAN. Продолжение одобрения для данного показания может быть обусловлено подтверждением и описанием клинической пользы в подтверждающем клиническом исследовании.
2 ДОЗИРОВКА И ПРИМЕНЕНИЕ
2.1 Рекомендуемая дозировка
Рекомендуемая дозировка ВОЙКСАКТ составляет 400 мг, вводимая путём подкожной инъекции один раз в 4 недели.
2.2 Пропущенная доза
Если запланированная доза ВОЙКСАКТ пропущена, введите пропущенную дозу как можно скорее, а затем возобновите введение доз каждые 4 недели.
2.3 Приготовление и введение
ВОЙКСАКТ предназначен для самостоятельного введения пациентом или для введения лицом, осуществляющим уход. Обеспечьте надлежащее обучение пациентов и/или лиц, осуществляющих уход, по вопросам введения ВОЙКСАКТ перед использованием в соответствии с «Инструкцией по применению».
Визуально проверьте шприц с готовой дозой на наличие частиц и изменение цвета. Раствор должен быть от прозрачного до опалесцирующего и от бесцветного до жёлтого. Не используйте шприц с готовой дозой, если раствор содержит видимые частицы, мутный или обесцвеченный (кроме как от прозрачного до опалесцирующего, от бесцветного до жёлтого).
Позвольте шприцу с готовой дозой ВОЙКСАКТ достичь комнатной температуры до 77°F (25°C) в течение 15–30 минут перед инъекцией. Храните шприц с готовой дозой ВОЙКСАКТ в оригинальной картонной коробке для защиты от света. После того как шприц с готовой дозой ВОЙКСАКТ достиг комнатной температуры, не возвращайте его в холодильник. Не используйте ВОЙКСАКТ, если он находился при комнатной температуре в течение 7 дней или дольше.
Вводите ВОЙКСАКТ только путём подкожной инъекции. Вводите в переднюю часть бедра или живот. Задняя часть верхней части руки также может использоваться в качестве места инъекции, если введение осуществляется подкожно лицом, осуществляющим уход. Не вводите в то же место, которое использовалось для предыдущей инъекции, или в родинки, шрамы, синяки или участки, где кожа нежная, повреждённая, красная, шелушащаяся или уплотнённая.
3 ЛЕКАРСТВЕННАЯ ФОРМА И ДОЗЫ
Раствор для инъекций: 400 мг/2 мл (200 мг/мл) прозрачный до опалесцирующего, бесцветный до жёлтого, раствор в одноразовом шприце с готовой дозой.
4 ПРОТИВОПОКАЗАНИЯ
ВОЙКСАКТ противопоказан пациентам с тяжёлой гиперчувствительностью к сибепрелимабу-szsi или любому из вспомогательных веществ ВОЙКСАКТ.
5 ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
5.1 Иммуносупрессия и повышенный риск инфекций
ВОЙКСАКТ подавляет иммунную систему, снижая выработку антител, что может увеличить риск инфекций. У пациентов с хроническими или рецидивирующими инфекциями может быть повышен риск серьёзных инфекций. В клинических исследованиях инфекции возникали у 49% пациентов, получавших ВОЙКСАКТ, по сравнению с 45% пациентов, получавших плацебо.
Перед началом применения ВОЙКСАКТ оцените наличие активных инфекций у пациентов. Во время лечения контролируйте пациентов на предмет признаков и симптомов инфекции. Если развивается серьёзная инфекция, рассмотрите возможность прерывания приёма ВОЙКСАКТ до тех пор, пока инфекция не будет взята под контроль.
Имеются ограниченные данные клинических исследований по сопутствующему применению ВОЙКСАКТ и системных иммунодепрессантов. Учитывайте возможность повышенной иммуносупрессии при совместном назначении ВОЙКСАКТ и иммунодепрессантов или при начале применения ВОЙКСАКТ до или после иммуносупрессивной терапии.
5.2 Иммуносупрессия и риски иммунизации
В связи со своим механизмом действия ВОЙКСАКТ может вмешиваться с иммунными ответами на вакцины и увеличивать риск инфекции от живых вакцин. Живые вакцины не рекомендуются в течение 30 дней до начала применения ВОЙКСАКТ или во время лечения ВОЙКСАКТ, поскольку безопасность не установлена. Нет данных о вторичной передаче инфекции от лиц, получающих живые вакцины, пациентам, получающим ВОЙКСАКТ, или об эффективности иммунизации, проведённой во время приёма ВОЙКСАКТ.
6 НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Следующие клинически значимые нежелательные реакции описаны в других разделах маркировки:
- Иммуносупрессия и повышенный риск инфекций [см. Предупреждения и меры предосторожности (5.1)]
- Иммуносупрессия и риски иммунизации [см. Предупреждения и меры предосторожности (5.2)]
6.1 Опыт клинических исследований
Поскольку клинические исследования проводятся в широко варьирующихся условиях, частоты нежелательных реакций, наблюдаемые в клинических исследованиях одного препарата, нельзя напрямую сравнивать с частотами в клинических исследованиях другого препарата, и они могут не отражать частоты, наблюдаемые на практике.
Безопасность ВОЙКСАКТ оценивалась в рандомизированном, двойном слепом, плацебо-контролируемом клиническом исследовании у пациентов с IgAN (VISIONARY). Медиана продолжительности воздействия составила 44 недели у 259 пациентов, получавших ВОЙКСАКТ, и 48 недель у 251 пациента, получавшего плацебо. Наиболее частыми нежелательными реакциями (сообщалось у ≥10% пациентов, получавших ВОЙКСАКТ, и с более высокой частотой, чем плацебо) у пациентов, получавших ВОЙКСАКТ и плацебо, соответственно, были инфекции (49% против 45%) и реакции в месте инъекции (24% против 23%). Наиболее частой инфекцией была инфекция верхних дыхательных путей (15% против 14%), а наиболее частой реакцией в месте инъекции была эритема в месте инъекции (13% против 12%). Большинство нежелательных реакций были охарактеризованы как лёгкие или умеренные по степени тяжести и разрешились без прерывания лечения или его прекращения.
8 ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ НАСЕЛЕНИЯ
8.1 Беременность
Резюме риска
Нет доступных данных по применению ВОЙКСАКТ у беременных женщин для оценки связанного с препаратом риска основных врождённых пороков развития, выкидыша или других неблагоприятных исходов для матери или плода. Моноклональные антитела, такие как сибепрелимаб-szsi, могут активно транспортироваться через плаценту по мере прогрессирования беременности; следовательно, потенциальные воздействия на плод, вероятно, будут больше во втором и третьем триместрах беременности (см. Клинические соображения). В исследовании токсичности с улучшенным пренатальным и постнатальным развитием (ePPND) подкожное введение сибепрелимаба-szsi беременным обезьянам не привело к каким-либо неблагоприятным эффектам на эмбриофетальное или постнатальное развитие при воздействии, примерно в 10 раз превышающем клиническое воздействие при максимальной рекомендуемой дозе для человека (МРЧД) на основе площади под кривой (AUC) (см. Данные).
Фоновый риск основных врождённых пороков развития и выкидыша для указанной популяции неизвестен. Все беременности имеют фоновый риск врождённых пороков, потери или других неблагоприятных исходов. В общей популяции США расчётный фоновый риск основных врождённых пороков развития и выкидыша при клинически распознанных беременностях составляет от 2% до 4% и от 15% до 20% соответственно.
Беременные женщины, подвергшиеся воздействию ВОЙКСАКТ, или их медицинские работники должны сообщать о воздействии ВОЙКСАКТ, позвонив по телефону 1-833-869-9228 или посетив сайт www.VOYXACT.com.
Клинические соображения
Риск, связанный с заболеванием, для матери и/или эмбриона/плода
Нефропатия IgA ассоциирована с неблагоприятными исходами для матери, включая повышенные частоты кесарева сечения, гипертензии, индуцированной беременностью, преэклампсии и преждевременных родов, и неблагоприятными исходами для плода/новорождённого, включая мертворождение и низкий вес при рождении.
Нежелательные реакции у плода/новорождённого
Транспорт эндогенных антител IgG через плаценту увеличивается по мере прогрессирования беременности и достигает пика в третьем триместре. Следовательно, ВОЙКСАКТ может присутствовать у младенцев, подвергшихся воздействию in utero. Рассмотрите потенциальное клиническое воздействие воздействия ВОЙКСАКТ на младенцев, которые были подвержены воздействию ВОЙКСАКТ in utero.
Данные
Данные по животным
В исследовании токсичности ePPND подкожное введение сибепрелимаба-szsi один раз каждые две недели беременным яванским макакам с 20-го дня беременности до родов (включая период органогенеза) не привело к каким-либо неблагоприятным эффектам на эмбриофетальное или постнатальное развитие при единственной тестируемой дозе 101 мг/кг, которая обеспечила приблизительно 10-кратный запас экспозиции по сравнению с клинической экспозицией при MRHD на основе AUC.
8.2 Лактация
Резюме риска
Нет данных о наличии сибепрелимаба-szsi в грудном молоке человека, о влиянии сибепрелимаба-szsi на грудного ребёнка или о влиянии сибепрелимаба-szsi на выработку молока. Эндогенный материнский IgG и моноклональные антитела переносятся в грудное молоко человека. Влияние местного желудочно-кишечного воздействия сибепрелимаба-szsi на грудного ребёнка неизвестно. Следует учитывать преимущества развития и здоровья грудного вскармливания наряду с клинической потребностью матери в ВОЙКСАКТ и любыми потенциальными неблагоприятными эффектами на грудного ребёнка от ВОЙКСАКТ или от основного заболевания матери.
8.4 Применение в педиатрии
Безопасность и эффективность ВОЙКСАКТ у пациентов детского возраста не установлены.
8.5 Применение у пожилых пациентов
Клинические исследования ВОЙКСАКТ не включали достаточного количества пациентов в возрасте 65 лет и старше, чтобы определить, отличаются ли их реакции от реакций пациентов более молодого возраста.
Не наблюдалось клинически значимых различий в фармакокинетике ВОЙКСАКТ у пациентов в возрасте 65 лет и старше по сравнению с пациентами более молодого возраста [см. Клиническая фармакология (12.3)].
11 ОПИСАНИЕ
ВОЙКСАКТ содержит сибепрелимаб-szsi, блокатор лиганда, индуцирующего пролиферацию (APRIL), и гуманизированное моноклональное антитело иммуноглобулина G2 (IgG2), продуцируемое клетками яичников китайского хомячка (CHO).
Приблизительная молекулярная масса сибепрелимаба-szsi составляет 146 кДа.
ВОЙКСАКТ (сибепрелимаб-szsi) раствор для инъекций представляет собой стерильный, не содержащий консервантов, от прозрачного до опалесцирующего, от бесцветного до жёлтого раствор в одноразовом шприце с готовой дозой для подкожного введения.
Каждый шприц с готовой дозой объёмом 2 мл содержит 400 мг сибепрелимаба-szsi и вспомогательные вещества: аргинин (17,6 мг), глутаминовую кислоту (14,8 мг), гистидин (4,34 мг), L-гистидина гидрохлорид моногидрат (4,62 мг), полисорбат 80 (0,40 мг), сорбитол (36,4 мг) и воду для инъекций, USP. Уровень pH составляет 6,2.
12 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
12.1 Механизм действия
ВОЙКСАКТ связывается с APRIL с константой диссоциации (KD) 0,95 пМ, что блокирует сигнализацию на рецепторе антигена созревания В-клеток (BCMA) и рецепторе трансмембранного активатора и кальциевого модулятора и интерактора лиганда циклопорина (TACI). Ингибирование APRIL приводит к снижению уровней сывороточного галактозодефицитного иммуноглобулина A1 (Gd-IgA1), который участвует в патогенезе IgAN.
12.2 Фармакодинамика
У здоровых субъектов, получивших однократную подкожную дозу ВОЙКСАКТ 400 мг, уровни APRIL в сыворотке снизились >90% к 3-му дню, и снижение поддерживалось до 42-го дня.
У пациентов с IgAN, получавших ВОЙКСАКТ каждые четыре недели в исследовании VISIONARY, подавление APRIL >90% наблюдалось к 4-й неделе и сохранялось на протяжении всего лечения. Уровни Gd-IgA1, IgA, IgG и IgM в сыворотке снизились в течение 4 недель, достигли плато к 24-й неделе, и к 48-й неделе средние уровни в сыворотке снизились от исходного уровня на 67% для Gd-IgA1, на 69% для IgA, на 35% для IgG и на 75% для IgM.
12.3 Фармакокинетика
После введения доз ВОЙКСАКТ 400 мг подкожно каждые 4 недели пациентам с IgAN, стационарное состояние достигается к 20 неделям дозирования.
Всасывание
После однократной подкожной дозы ВОЙКСАКТ 400 мг у здоровых субъектов медиана времени достижения максимальной концентрации составляет 8 дней.
Абсолютная биодоступность сибепрелимаба-szsi составляет приблизительно 92%, и нет разницы в относительной биодоступности после введения в живот, бедро или руку.
Распределение
Объём распределения составляет 4 л.
Элиминация
После однократной дозы ВОЙКСАКТ 400 мг средний терминальный период полувыведения составляет 9,3 дня. Средний кажущийся клиренс сибепрелимаба-szsi после доз 400 мг каждые 4 недели составляет 206 мл/день.
Метаболизм
Как моноклональное антитело IgG2, ожидается, что сибепрелимаб-szsi будет расщепляться протеолитическими ферментами через катаболические пути таким же образом, как и эндогенный IgG.
Конкретные популяции
Специальные исследования для оценки влияния почечной недостаточности и печёночной недостаточности на фармакокинетику сибепрелимаба-szsi не проводились.
Популяционный фармакокинетический анализ не выявил каких-либо клинически значимых различий в фармакокинетике сибепрелимаба-szsi в зависимости от пола, возраста, веса, расы и лёгкой до умеренной почечной недостаточности (рСКФ: от 30 до 89 мл/мин).
12.6 Иммуногенность
Наблюдаемая частота появления антител к препарату (ADA) в значительной степени зависит от чувствительности и специфичности анализа. Различия в методах анализа исключают значимые сравнения частоты ADA в исследовании, описанном ниже, с частотой ADA в других исследованиях, включая исследования сибепрелимаба-szsi.
В течение периода лечения в исследовании VISIONARY у 88 из 256 (34%) оцениваемых пациентов, получавших ВОЙКСАКТ, развились ADA. Среди 88 пациентов, у которых был положительный тест на ADA, у 21 пациента (23,9%) развились ADA, которые имели нейтрализующую активность. Экспозиция сибепрелимаба-szsi у пациентов с IgAN, у которых развились ADA, была ~ на 40% ниже, чем у пациентов с необнаруживаемыми ADA в течение периода лечения. Снижение отношения белок/креатинин в моче на основе 24-часовых сборов мочи (uPCR-24h) от исходного уровня до 9-го месяца было численно ниже у пациентов, у которых развились ADA (41,6%), по сравнению с теми, у кого их не было (52,7%). Клиническая значимость различий в снижении uPCR в зависимости от наличия или отсутствия ADA не ясна. Наличие ADA не оказало клинически значимого влияния на частоту или тяжесть нежелательных реакций.
13 ДОКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ
13.1 Канцерогенез, мутагенез, нарушение фертильности
Исследования канцерогенности или мутагенности с сибепрелимабом-szsi не проводились.
Нарушение фертильности
У яванских макак, которым внутривенно вводили сибепрелимаб-szsi в дозах 25, 50 или 100 мг/кг один раз каждые две недели в течение 26 недель, не наблюдалось связанных с сибепрелимабом неблагоприятных эффектов на частоту и продолжительность менструального цикла у самок, анализ подвижности, концентрации и количества сперматозоидов у самцов или на репродуктивные органы самцов и самок при дозах до 100 мг/кг, что обеспечивает приблизительно 13-кратный запас экспозиции по сравнению с клинической экспозицией при MRHD на основе AUC.
14 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Влияние ВОЙКСАКТ на протеинурию оценивалось в рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом, глобальном исследовании (VISIONARY, NCT05248646) у взрослых с подтверждённой биопсией IgAN, рСКФ ≥30 мл/мин/1,73 м², протеинурией (определяемой как отношение белок/креатинин в моче на основе 24-часовых сборов мочи [uPCR-24h] ≥0,75 г/г или белок мочи ≥1,0 г/день) и на стабильной и максимально переносимой дозе ингибитора ангиотензин-превращающего фермента (АПФ) и/или блокатора рецепторов ангиотензина (БРА) с ингибитором натрий-глюкозного котранспортёра 2 (SGLT2i) или без него. Пациенты с другими гломерулопатиями или те, кто получал системные иммунодепрессанты в течение 16 недель до скрининга, были исключены. Пациенты были рандомизированы в соотношении 1:1 для получения либо ВОЙКСАКТ, либо плацебо, вводимых подкожно один раз в 4 недели.
В исследование было включено в общей сложности 510 пациентов. Промежуточный анализ эффективности был проведён на первых 320 (63%) рандомизированных пациентах, у которых была возможность достичь визита на 9-й месяц, 152 из которых были рандомизированы для получения ВОЙКСАКТ, а 168 были рандомизированы для получения плацебо. Исходные демографические и клинические характеристики в целом были сбалансированы между группами лечения. На исходном уровне медиана возраста составляла 42 года (диапазон от 18 до 83 лет); 63% были мужчинами, 59% были азиатами, 38% были белыми и 3% были других рас.
На исходном уровне средний uPCR-24h составлял 1,5 г/г, средняя расчётная скорость клубочковой фильтрации (рСКФ) составляла 63 мл/мин/1,73 м², и у 74% была гематурия (на основе тест-полоски мочи). Примерно у 67% пациентов в анамнезе была гипертензия, а у 7% в анамнезе был сахарный диабет 2 типа. На исходном уровне 98% получали лечение АПФ и/или БРА, и 40% пациентов также получали SGLT2i.
Первичной конечной точкой было относительное изменение от исходного уровня в uPCR-24h на 9-й месяц. Оценочное среднее процентное изменение от исходного уровня в uPCR-24h показано на Рисунке 1. Наблюдаемое среднее геометрическое процентное изменение от исходного уровня с течением времени для uPCR из образцов утренней мочи показано на Рисунке 2.
Рисунок 1: Оценочное процентное изменение по сравнению с исходным уровнем в uPCR-24h на 9-й месяц у пациентов с IgAN в исследовании VISIONARY
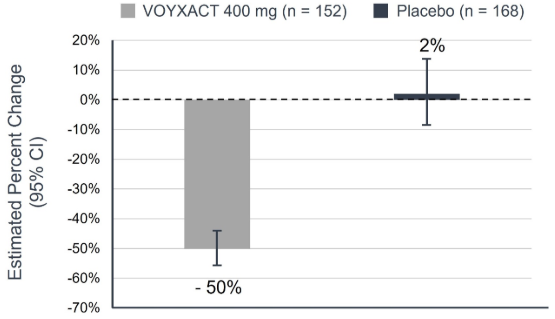
| VOYXACT | -50% |
| Placebo | 2% |
| VOYXACT vs. Placebo (96.5% CI)* | 51% (43%, 58%) |
| p-value | <0.0001 |
CI = доверительный интервал
24-часовое повышение CCR на 9-м месяце по сравнению с исходным уровнем определяется как повышение CCR за 24 часа 9 месяцев/повышение CCR за 24 часа.
Столбик показывает среднее геометрическое процентное изменение за 9 месяцев по сравнению с исходным уровнем, а квадратики указывают на 95%-ный ДИ.
*96,5%-ный ДИ соответствует двустороннему уровню значимости 0,035 для промежуточного анализа (IA).
Данные были включены в анализ независимо от раннего прекращения лечения и начала комбинированной терапии (стратегия лечения). Недостающие данные были получены с использованием метода множественного вычисления.
Рисунок 2: Процентное изменение по сравнению с исходным уровнем в Spot uPCR с течением времени у пациентов с IgAN в исследовании VISIONARY
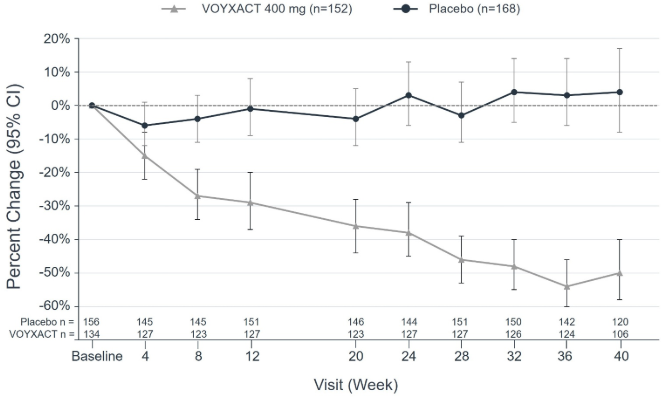
CI = доверительный интервал
Точечный прирост на определённой неделе определяется как точечный прирост/базовый уровень точечного прироста
Точки указывают на среднее геометрическое процентное изменение за определённые недели по сравнению с исходным уровнем, а квадратики указывают на соответствующие 95%-ные отклонения, основанные на наблюдаемом и нерасчленённом точечном приросте.
Эффект лечения (процентное снижение показателя uPCR-за 24 часа между ВОЙКСАКТ и плацебо) был одинаковым в следующих подгруппах и с учётом заранее определённых факторов стратификации: пол, возраст, раса, этническая принадлежность и географический регион, исходная протеинурия (uPCR- за 24 часа), исходная рСКФ и использование SGLT2i.
16 КАК ПОСТАВЛЯЕТСЯ/ХРАНЕНИЕ И ОБРАЩЕНИЕ
Как поставляется
ВОЙКСАКТ (сибепрелимаб-szsi) инъекционный раствор поставляется в виде стерильного, не содержащего консервантов, прозрачного до опалесцирующего, бесцветного до желтого раствора в предварительно заполненном одноразовом шприце с иглой 27 калибра, длиной ½ дюйма и предохранительным устройством для иглы.
Шприц с готовой дозой ВОЙКСАКТ не изготовлен из натурального каучукового латекса.
Шприц с готовой дозой ВОЙКСАКТ 400 мг/2 мл (200 мг/мл) упакован в индивидуальную картонную коробку (NDC 59148-400-75).
Хранение и обращение
Храните ВОЙКСАКТ в холодильнике при температуре от 36°F до 46°F (от 2°C до 8°C). Храните шприц с готовой дозой в оригинальной коробке для защиты от света.
Не замораживайте. Не встряхивайте. Не подвергайте воздействию тепла или прямого солнечного света.
После того как шприц с готовой дозой ВОЙКСАКТ достиг комнатной температуры, не возвращайте его в холодильник.
Не используйте ВОЙКСАКТ, если он находился при комнатной температуре в течение 7 дней или дольше.
17 ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендуйте пациенту и/или лицу, осуществляющему уход, прочитать одобренную FDA маркировку для пациентов (Информация для пациентов и Инструкция по применению).
Инфекции
Проинформируйте пациентов, что у них может быть более высокая вероятность развития инфекций при приёме ВОЙКСАКТ. Инструктируйте пациентов сообщать своему врачу, если у них появятся признаки или симптомы инфекции [см. Предупреждения и меры предосторожности (5.1)].
Гиперчувствительность
Проинформируйте пациентов о признаках и симптомах реакций гиперчувствительности. Посоветуйте пациентам прекратить приём ВОЙКСАКТ и немедленно обратиться за медицинской помощью при появлении признаков или симптомов реакций гиперчувствительности [см. Противопоказания (4)].
Беременность
Посоветуйте пациентам, которые подверглись воздействию ВОЙКСАКТ во время беременности, связаться с Otsuka Pharmaceutical Development and Commercialization, Inc. по телефону 1-833-869-9228 или на сайте www.VOYXACT.com.
Произведено:
Otsuka Pharmaceutical Company, Ltd., Tokyo, 101-8535 Japan
Лицензия США № XXXX
Распространяется:
Otsuka America Pharmaceutical, Inc.
Rockville, MD 20850, USA
©2025, Otsuka Pharmaceutical Co., Ltd., Tokyo, 101-8535 Japan
Информация для пациентов
ВОЙКСАКТ® (VOY-ZAKT)
раствор для подкожного введения
Что такое ВОЙКСАКТ?
ВОЙКСАКТ — это лекарственный препарат, отпускаемый по рецепту, используемый для снижения белка в моче (протеинурии) у взрослых с заболеванием почек, называемым первичной нефропатией иммуноглобулина A (IgAN), которые подвержены риску ухудшения своего заболевания.
Не известно, является ли ВОЙКСАКТ безопасным и эффективным у детей.
Не принимайте ВОЙКСАКТ, если у вас:
у вас аллергия на любой из компонентов ВОЙКСАКТ. См. конец данной Информации для пациентов для полного списка ингредиентов ВОЙКСАКТ. Прекратите использование ВОЙКСАКТ и обратитесь за неотложной помощью, если у вас появятся признаки и симптомы аллергической реакции, включая:
◦ проблемы с дыханием
◦ отёк лица, губ, рта, языка или горла
◦ головокружение или ощущение лёгкости в голове
◦ зуд
◦ крапивница
◦ кожная сыпь
Перед приёмом ВОЙКСАКТ сообщите своему врачу обо всех своих медицинских состояниях, включая:
- наличие инфекции.
- получали или планируете получить терапию, которая может снизить способность вашей иммунной системы бороться с инфекциями (иммуносупрессивная терапия).
- недавно получали или запланированы для получения иммунизации (вакцины). ВОЙКСАКТ может повлиять на реакцию вашей иммунной системы на вакцины и увеличить риск инфекции от живых вакцин.
- беременны или планируете беременность. Не известно, навредит ли ВОЙКСАКТ вашему будущему ребёнку.
- кормите грудью или планируете грудное вскармливание. Не известно, проникает ли ВОЙКСАКТ в ваше грудное молоко или повлияет ли он на вашего ребёнка. Поговорите со своим врачом о наилучшем способе кормления вашего ребёнка во время лечения ВОЙКСАКТ.
Сообщите своему врачу обо всех принимаемых вами лекарствах, включая рецептурные и безрецептурные лекарства, витамины и растительные добавки.
Как мне принимать ВОЙКСАКТ?
- Прочитайте подробную «Инструкцию по применению», прилагаемую к ВОЙКСАКТ, для получения информации о том, как приготовить и ввести ВОЙКСАКТ, а также как правильно хранить и выбрасывать использованные шприцы с готовой дозой ВОЙКСАКТ.
- Используйте ВОЙКСАКТ точно так, как вам говорит ваш врач.
- ВОЙКСАКТ вводится в виде инъекции под кожу (подкожная инъекция).
- Вводите ВОЙКСАКТ под кожу (подкожная инъекция) в переднюю часть верхней части ног (бедер) или область живота, избегая области в 2 дюймах вокруг пупка. Задняя часть верхней части рук также может использоваться, если инъекцию делает лицо, осуществляющее уход.
- Если вы пропустили дозу ВОЙКСАКТ, введите пропущенную дозу как можно скорее. Затем примите следующую дозу через 4 недели.
Каковы возможные побочные эффекты ВОЙКСАКТ?
ВОЙКСАКТ может вызывать серьёзные побочные эффекты, включая:
иммуносупрессию и повышенный риск инфекций. ВОЙКСАКТ ослабляет вашу иммунную систему, что может увеличить риск инфекций. Ваш врач будет проверять вас на наличие признаков и симптомов инфекций перед началом и во время лечения ВОЙКСАКТ. Немедленно сообщите своему врачу, если у вас появятся какие-либо признаки и симптомы инфекции во время лечения ВОЙКСАКТ, включая:
◦ лихорадка
◦ озноб
◦ чувство усталости
◦ кашель
Наиболее частые побочные эффекты ВОЙКСАКТ включают: инфекцию верхних дыхательных путей и покраснение кожи в месте инъекции.
Это не все возможные побочные эффекты ВОЙКСАКТ.
Обратитесь к своему врачу за медицинской консультацией о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Как мне хранить ВОЙКСАКТ?
- Храните ВОЙКСАКТ в холодильнике при температуре от 36°F до 46°F (от 2°C до 8°C).
- Храните шприц с готовой дозой ВОЙКСАКТ в оригинальной коробке для защиты от света.
- Позвольте шприцу с готовой дозой ВОЙКСАКТ достичь комнатной температуры до 77°F (25°C) в течение 15–30 минут перед инъекцией.
- Когда шприц с готовой дозой ВОЙКСАКТ достиг комнатной температуры, не возвращайте его в холодильник.
- Не используйте ВОЙКСАКТ, если он находился при комнатной температуре в течение 7 дней или дольше.
- Не замораживайте шприц с готовой дозой ВОЙКСАКТ.
- Не встряхивайте шприц с готовой дозой ВОЙКСАКТ.
- Держите шприц с готовой дозой ВОЙКСАКТ подальше от тепла и прямого солнечного света.
- Не используйте по истечении срока годности, указанного на коробке.
Храните ВОЙКСАКТ и все лекарства в недоступном для детей месте.
Общая информация о безопасном и эффективном использовании ВОЙКСАКТ.
Лекарства иногда назначаются для целей, не указанных в листке Информации для пациентов. Не используйте
ВОЙКСАКТ для состояния, для которого он не был назначен. Не давайте ВОЙКСАКТ другим людям, даже если у них те же симптомы, что и у вас. Это может навредить им. Вы можете попросить вашего фармацевта или врача предоставить информацию о ВОЙКСАКТ, предназначенную для медицинских работников.
Какие компоненты ВОЙКСАКТ?
Действующее вещество: сибепрелимаб-szsi
Вспомогательные вещества: аргинин, глутаминовая кислота, гистидин, L-гистидина гидрохлорид моногидрат, полисорбат 80, сорбитол и вода для инъекций.
Шприц с готовой дозой ВОЙКСАКТ не изготовлен из натурального каучукового латекса.
Произведено:
Otsuka Pharmaceutical Company, Ltd., Tokyo, 101-8535 Japan
Лицензия США № XXXX
Распространяется:
Otsuka America Pharmaceutical, Inc.
Rockville, MD 20850, USA
Для получения дополнительной информации звоните 1-833-869-9228 или посетите www.VOYXACT.com.
Данная Информация для пациентов была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Выпущено: 11/2025
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
ВОЙКСАКТ® (VOY-ZAKT)
раствор для подкожного введения
Одноразовый шприц с готовой дозой
Данная Инструкция по применению содержит информацию о том, как вводить ВОЙКСАКТ. Прочтите и следуйте данной Инструкции по применению перед тем, как вводить шприц с готовой дозой ВОЙКСАКТ в первый раз и при каждом пополнении запаса. Эта информация не заменяет разговор с вашим врачом о вашем состоянии здоровья или лечении. Ваш врач должен показать вам или лицу, осуществляющему уход, как правильно приготовить и ввести ВОЙКСАКТ перед тем, как вы используете или введёте его в первый раз.
Важная информация, которую вам необходимо знать перед инъекцией шприца с готовой дозой ВОЙКСАКТ
- Шприц с готовой дозой ВОЙКСАКТ предназначен только для инъекций под кожу (подкожное введение).
- Не снимайте серый колпачок с иглы со шприца с готовой дозой до тех пор, пока не будете готовы к инъекции.
- Каждый шприц с готовой дозой имеет защиту иглы. Она автоматически закроет иглу после завершения инъекции.
- Никогда не тяните назад поршень.
- Не используйте, если шприц с готовой дозой ВОЙКСАКТ был повреждён.
- Не используйте, если шприц с готовой дозой ВОЙКСАКТ был уронен после снятия колпачка иглы.
Хранение шприца с готовой дозой ВОЙКСАКТ
- Храните ваш шприц с готовой дозой ВОЙКСАКТ в холодильнике при температуре от 36°F до 46°F (от 2°C до 8°C). Храните шприц с готовой дозой в оригинальной коробке для защиты от света.
- Позвольте шприцу с готовой дозой ВОЙКСАКТ достичь комнатной температуры до 77°F (25°C) в течение 15–30 минут перед инъекцией.
- Когда шприц с готовой дозой ВОЙКСАКТ достиг комнатной температуры, не возвращайте его в холодильник.
- Не используйте шприц с готовой дозой ВОЙКСАКТ, если он находился при комнатной температуре в течение 7 дней или дольше.
- Не замораживайте шприц с готовой дозой ВОЙКСАКТ.
- Не встряхивайте шприц с готовой дозой ВОЙКСАКТ.
- Держите шприц с готовой дозой ВОЙКСАКТ подальше от тепла и прямого солнечного света.
- Выбросьте любой шприц с готовой дозой ВОЙКСАКТ, если срок его годности истек. См. Шаг 11 для инструкций о том, как выбросить шприц с готовой дозой ВОЙКСАКТ.
- Храните шприц с готовой дозой ВОЙКСАКТ и все лекарства в недоступном для детей месте.
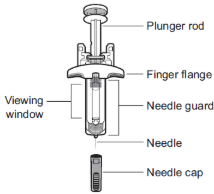
Ваш одноразовый шприц с готовой дозой ВОЙКСАКТ
Перед использованием
После использования
Подготовка ваших принадлежностей
Шаг 1: Достаньте коробку со шприцем с готовой дозой ВОЙКСАКТ из холодильника
Достаньте коробку, содержащую шприц с готовой дозой ВОЙКСАКТ, из холодильника и проверьте срок годности (EXP) на боковой стороне коробки.
- Не используйте шприц с готовой дозой, если пломбы на коробке были нарушены.
- Не используйте шприц с готовой дозой, если срок годности (EXP), напечатанный на коробке, истёк.
Шаг 2: Подождите 15–30 минут перед использованием
Подождите 15–30 минут, чтобы позволить шприцу с готовой дозой естественным образом достичь комнатной температуры (см. Рисунок A).
- Не согревайте шприц с готовой дозой каким-либо другим способом.
- Не оставляйте шприц с готовой дозой под прямыми солнечными лучами.
ЖДИТЕ ~ 15–30 минут
Рисунок A
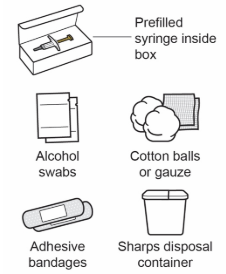
Шаг 3: Соберите принадлежности
Соберите принадлежности, которые не входят в коробку со шприцем с готовой дозой ВОЙКСАКТ:
- Спиртовые салфетки
- Ватные шарики или марля
- Лейкопластыри
- Контейнер для утилизации острых предметов (см. Шаг 11)
Подготовка к инъекции шприца с готовой дозой ВОЙКСАКТ
Шаг 4: Достаньте шприц с готовой дозой ВОЙКСАКТ из коробки
Держите середину шприца с готовой дозой (рядом со смотровым окном), чтобы аккуратно поднять шприц с готовой дозой из коробки (см. Рисунок B).
- Не поднимайте шприц с готовой дозой за поршень.
- Не встряхивайте и не перекатывайте шприц с готовой дозой.
- Не снимайте серый колпачок с иглы со шприца с готовой дозой до Шага 8 и пока вы не будете готовы к инъекции.
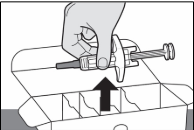
Рисунок B
Шаг 5: Осмотрите шприц с готовой дозой ВОЙКСАКТ
- Убедитесь, что на этикетках указано ВОЙКСАКТ.
- Проверьте срок годности (EXP), напечатанный на шприце с готовой дозой (см. Рисунок C).
- Проверьте лекарство в шприце с готовой дозой через смотровое окно. Нормально видеть пузырьки воздуха. Лекарство внутри должно быть от прозрачного до слегка перламутрового и от бесцветного до жёлтого (см. Рисунок C).
Не используйте шприц с готовой дозой ВОЙКСАКТ, если:
◦ срок годности, напечатанный на этикетке шприца с готовой дозой, истёк.
◦ лекарство мутное, обесцвеченный или в нём плавают частицы.
◦ какая-либо часть шприца с готовой дозой повреждена, сломана или защита иглы была активирована.
- Не пытайтесь удалить пузырьки воздуха из шприца с готовой дозой.
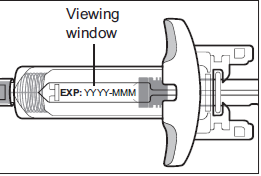
Рисунок C
Шаг 6: Выберите место инъекции
Выберите место инъекции на вашей обнажённой коже из 1 из следующих областей (см. Рисунок D):
- передняя часть верхней части бедра
- область живота, избегая области в 2 дюймах вокруг пупка.
Только для лица, осуществляющего уход: также может использоваться задняя часть верхней части руки.
Не вводите в то же самое место, которое вы использовали для последней инъекции.
- Не вводите в родинки, шрамы или синяки, или кожу, которая нежная, повреждённая, уплотнённая или красная.
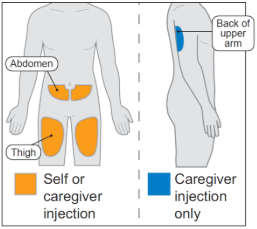
Рисунок D
Шаг 7: Очистите место инъекции
Вымойте руки с мылом и чистой водой (см. Рисунок E).
Рисунок E
- Очистите место инъекции спиртовой салфеткой и дайте коже высохнуть (см. Рисунок F).
- Не прикасайтесь к области снова перед инъекцией.
- Не обмахивайте и не дуйте на место инъекции после того, как вы его очистили.
Рисунок F
Введение ВОЙКСАКТ
Шаг 8: Снимите колпачок иглы
Когда вы будете готовы к инъекции, держите шприц с готовой дозой одной рукой, потяните колпачок иглы прямо другой рукой (см. Рисунок G).
- Вы можете увидеть каплю жидкости на конце иглы. Это нормально.
- Не прикасайтесь к игле и не надевайте колпачок обратно, и не позволяйте ей касаться любой поверхности.
- Не прикасайтесь к поршню и не оттягивайте его назад.
- Не используйте шприц с готовой дозой с погнутой или сломанной иглой.
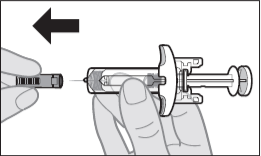
Рисунок G
Шаг 9: Зажмите кожу и введите иглу
Сняв колпачок с иглы, держите шприц с готовой дозой одной рукой. Другой рукой аккуратно зажмите кожу в месте инъекции (см. Рисунок H).
- Важно зажать достаточно кожи, чтобы ввести под кожу, а не в мышцу.
Введите всю иглу под углом 45 градусов в зажатую кожу, используя движение, подобное метанию дротика (см. Рисунок H).
- Избегайте касания поршня до тех пор, пока игла не введена.
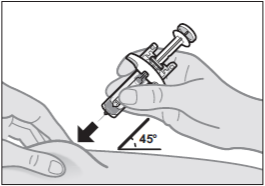
Рисунок H
Шаг 10: Завершите инъекцию
Нажмите на поршень до упора, пока он не остановится, и все лекарство не будет введено (см. Рисунок I).
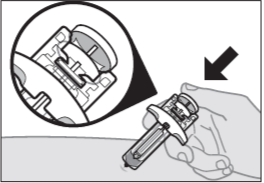
Рисунок I
Снимите большой палец с поршня, чтобы позволить защите иглы автоматически закрыть exposed иглу (см. Рисунок J).
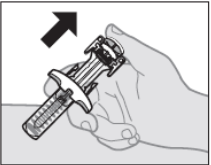
Рисунок J
Аккуратно поднимите шприц от места инъекции (см. Рисунок K).
- Может быть небольшое количество крови или жидкости в месте инъекции. Подержите давление на вашей коже ватным шариком или марлей, пока любое кровотечение не остановится.
- Наклейте лейкопластырь, если это необходимо.
- Не трите и не массируйте место инъекции.
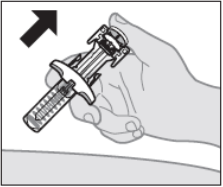
Рисунок K
Утилизация шприца с готовой дозой ВОЙКСАКТ
Шаг 11: Выбросьте шприц с готовой дозой ВОЙКСАКТ
Выбросьте использованный шприц с готовой дозой в контейнер для утилизации острых предметов, одобренный FDA, сразу после использования (см. Рисунок L). Не перерабатывайте и не выбрасывайте шприц с готовой дозой в бытовой мусор.
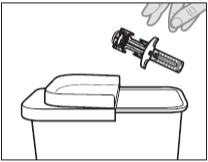
Рисунок L
- Выбросьте оставшиеся принадлежности в бытовой мусор или контейнер для острых предметов.
- Если у вас нет контейнера для утилизации острых предметов, одобренного FDA, вы можете использовать бытовой контейнер, который:
- изготовлен из прочного пластика,
- может быть закрыт плотно прилегающей, устойчивой к проколам крышкой, без возможности выпадения острых предметов,
- находится в вертикальном положении и устойчив во время использования,
- противопроточный, и
- правильно маркирован для предупреждения об опасных отходах внутри контейнера.
- Когда ваш контейнер для утилизации острых предметов почти заполнен, вам нужно будет следовать рекомендациям вашего сообщества по правильному способу утилизации вашего контейнера для утилизации острых предметов. Могут существовать местные или государственные законы о том, как выбрасывать иглы и шприцы.
- Для получения дополнительной информации о безопасной утилизации острых предметов и конкретной информации об утилизации острых предметов в штате, в котором вы живете, перейдите на веб-сайт FDA по адресу: http://www.fda.gov/safesharpsdisposal.
- Не перерабатывайте ваш использованный контейнер для утилизации острых предметов.
Если у вас есть вопросы или опасения по поводу вашего шприца с готовой дозой ВОЙКСАКТ, пожалуйста, позвоните своему врачу.
Вы также можете позвонить по телефону 1-800-441-6763 или посетить www.VOYXACT.com для получения дополнительной информации.
Произведено:
Otsuka Pharmaceutical Company, Ltd.
Tokyo 101-8535 Japan
Лицензия США № XXXX
Распространяется:
Otsuka America Pharmaceutical, Inc.
Rockville, MD 20850 USA
Данная Инструкция по применению была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Выпущено: Ноябрь 2025
▼ Лекарственный препарат в настоящий момент не зарегистрирован в Российской Федерации. |
Форма выпуска
Раствор для подкожного введения 400 мг/2 мл (200 мг/мл).
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
АТХ
-
Действующее вещество
Синонимы
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Войксакт:
