Фактор VII
Factor VIIРегистрационный номер
Торговое наименование
Фактор VII
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
1 флакон содержит:
Активный ингредиент: | |
Фактор VII 600 МЕ | |
В виде белка, содержащегося в плазме | 50-200 мг/флакон |
Вспомогательные ингредиенты: | |
Натрия цитрата дигидрат | 40 мг |
80 мг | |
250 МЕ | |
Растворитель: | |
10 мл |
Описание
Лиофилизат: белый или слегка окрашенный порошок или рыхлая твёрдая масса.
Растворитель: бесцветная прозрачная жидкость.
Восстановленный раствор: прозрачный или слегка опалесцирующий, от бесцветного до желтоватого цвета раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Фактор VII — один из витамин K-зависимых факторов нормальной человеческой плазмы, компонент внешнего пути системы свёртывания крови. Он представляет собой одноцепочечный гликопротеин с молекулярной массой около 50 000 Дальтон. Фактор VII является зимогеном сериновой протеазы фактора VIIa (активной сериновой протеазы), который запускает внешний путь системы свёртывания крови. Комплекс тканевой фактор-фактор VIIa активирует факторы свёртывания крови IX и X, в результате чего образуются факторы IХа и Ха. При дальнейшем развертывании коагуляционного каскада образуется тромбин, фибриноген превращается в фибрин и формируется сгусток. Нормальное образование тромбина также является исключительно важным для тромбоцитарной функции, как части системы гемостаза. Наследственный дефицит Фактора VII относится к аутосомно-рецессивному нарушению. Применение Фактора VII человека обеспечивает повышение плазменных уровней Фактора VII и может временно устранить дефект свёртывания крови у больных с дефицитом Фактора VII.
Фармакокинетика
При внутривенном введении Фактора VII повышение его концентрации в плазме крови пациента составляет от 60 до 100 %; период полувыведения в среднем равен 3–5 часов.
Доклинические данные по безопасности
Фактор свёртывания крови VII человека является нормальным компонентом крови человека и по действию идентичен эндогенному Фактору VII.
Испытания токсичности однократных доз не представляются обоснованными, поскольку более высокие дозы приводят к чрезмерному превышению нормальной нагрузки. Испытания токсичности повторных доз у животных бесполезны из-за выработки антител к гетерологичным белкам, которые препятствуют дальнейшим введениям испытуемых доз.
Поскольку опыт клинического применения не даёт каких-либо доказательств наличия онкогенности и мутагенности, экспериментальные исследования, особенно на гетерологичных видах животных, не рассматриваются как обязательные.
Показания
Фактор VII показан при:
- лечении нарушений свёртывания крови, вызванных изолированной наследственной недостаточностью Фактора VII;
- профилактике нарушений свёртывания крови, вызванных изолированной наследственной недостаточностью Фактора VII, при кровотечениях в анамнезе и остаточном уровне Фактора VII ниже, чем 25 % от нормального содержания (0,25 МЕ/мл).
Препарат не содержит значительных количеств Фактора VIIa и не должен применяться у больных гемофилией в случае присутствия у них ингибитора.
Противопоказания
- Повышенная чувствительность к действующему веществу или любому из вспомогательных веществ;
- высокий риск тромбоза или диссеминированного внутрисосудистого свёртывания;
- известная аллергия на гепарин или гепарин-индуцированная тромбоцитопения в анамнезе.
- детский возраст до 6 лет (данных, имеющихся в настоящее время, недостаточно, чтобы рекомендовать применение Фактор VII детям младше 6 лет).
Применение при беременности и в период грудного вскармливания
Безопасность Фактора VII при использовании во время беременности не подтверждалась контролируемыми клиническими исследованиями. Поэтому Фактор VII может назначаться во время беременности и лактации только по строгим показаниям.
Способ применения и дозы
Восстановление Фактора VII необходимо проводить непосредственно перед применением. При применении в виде инфузии следует использовать только прилагаемую инфузионную систему.
Восстановление лиофилизата
- Подогреть неоткрытый флакон, содержащий растворитель, до комнатной температуры (макс. 37 °C).
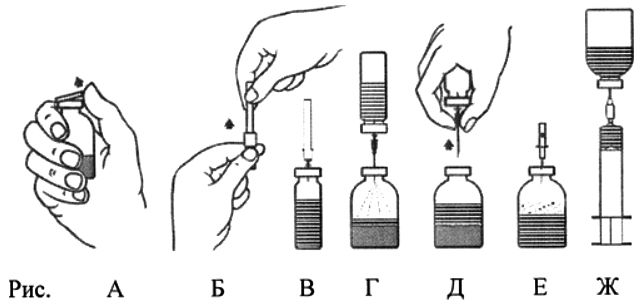
- Удалить защитные диски с флаконов с лиофилизатом и с растворителем (рис. А) и очистить пробки обоих флаконов.
- Удалить, вращая и снимая, защитное покрытие с одного конца прилагаемой иглы для переноса (рис. Б). Ввести открытую иглу через резиновую пробку во флакон с растворителем (рис. В).
- Удалить защитное покрытие с другого конца иглы для переноса, избегая касания открытого конца.
- Перевернуть флакон с растворителем вертикально над флаконом с концентратом и ввести свободный конец иглы для переноса через резиновую пробку флакона с концентратом (рис. Г). Под действием вакуума растворитель будет поступать во флакон с концентратом.
- Разъединить два флакона, вынув иглу из пробки флакона с концентратом (рис. Д). Встряхивать и вращать флакон с концентратом для ускорения растворения.
- По завершении восстановления концентрата ввести прилагаемую аэрационную иглу (рис. Е) и дать пене полностью осесть. Извлечь аэрационную иглу.
Способ введения
- Удалить, вращая и снимая, защитное покрытие с одного конца прилагаемой фильтрующей иглы, и насадить её на стерильный одноразовый шприц. Набрать раствор в шприц (рис. Ж).
- Отсоединить фильтрующую иглу от шприца и выполнить медленное внутривенное введение раствора (максимальная скорость инъекции: 2 мл/мин) с помощью системы для трансфузии (или прилагаемой одноразовой иглы).
- Для проведения лечения в домашних условиях следует убедиться, что использованные иглы и шприцы были сложены обратно в коробку комплекта для восстановления, и вернуть эту коробку в ваш центр гемофилии.
Дозы и продолжительность заместительной терапии зависят от тяжести дефицита Фактора VII, локализации и степени эпизодов кровотечения, а также клинического состояния больного. Связь между остаточным уровнем Фактора VII и склонностью к кровотечениям менее однозначная у отдельных пациентов, чем при классической гемофилии.
Количество вводимых единиц Фактора VII выражается в Международных Единицах (ME), соответствующих существующему стандарту ВОЗ для препаратов фактора VII. Активность Фактора VII в плазме выражается либо в виде процента (относительно нормальной плазмы), либо в Международных Единицах (относительно Международного стандарта для фактора VII в плазме).
Одна Международная Единица (ME) активности Фактора VII эквивалентна величине активности фактора VII в одном мл нормальной человеческой плазмы. Расчёт требуемой дозы основан на эмпирическом наблюдении, согласно которому, 1 Международная Единица (ME) фактора VII на кг массы тела повышает активность Фактора VII в плазме примерно на 1,9 % (1,9 МЕ/дл) от активности в норме.
Требуемая доза определяется с помощью следующей формулы:
Необходимая доза (ME) = масса тела (кг) × желаемое повышение активности Фактора VII (МЕ/мл) × 0,5 (величина, обратная эмпирически наблюдаемому восстановлению (мл/кг))
Если индивидуальное восстановление известно, для расчёта следует использовать обратную этому значению величину, вместо 0,5.
В каждом отдельном случае количество, которое необходимо ввести, и частота применения всегда должны быть соотнесены с клинической эффективностью. Это особенно важно при лечении недостаточности Фактора VII, поскольку индивидуальная склонность к кровотечениям не зависит строгим образом от измеренной с помощью
лабораторных проб активности Фактора VII в плазме. Интервалы между дозами должны учитывать короткий период полувыведения Фактора VII из циркуляторного русла, составляющий примерно от 3 до 5 часов. При применении Фактора VII в виде интермиттирующих инъекций/инфузий адекватными часто являются 6–8 часовые интервалы между дозами. Обычно при лечении дефицита Фактора VII требуются, в зависимости от активности в нормальной плазме, более низкие дозы недостающего фактора по сравнению с классической гемофилией (гемофилия А и В). Ниже в таблице представлены примерные рекомендации по применению интермиттирующих инъекций/инфузий, выработанные исходя из имеющегося ограниченного клинического опыта. Медицинские данные, основанные на клинических исследованиях эффективности, отсутствуют.
Степень кровотечения/ Тип хирургического вмешательства | Требуемый уровень фактора VII МЕ/мл* | Частота введения (часы) / Длительность терапии (дни) |
|---|---|---|
| Лёгкое кровотечение | 0,10–0,20 | Однократная доза |
| Тяжёлое кровотечение | 0,25–0,40 (низший — высший уровни) | В течение 8–10 дней или до полного заживления** |
| Малые хирургические вмешательства | 0,20–0,30 | Однократная доза перед хирургической операцией или, если предполагаемый риск кровотечения более очевиден, до заживления раны* |
| Большие хирургические вмешательства | Перед операцией > 0,50 Затем 0,25–0,45 (низший — высший уровни) | В течение 8–10 дней или до полного заживления раны* |
*1 МЕ/мл = 100 МЕ/дл = 100 % нормальной плазмы. Активность фактора VII в плазме выражается либо в виде процента (относительно нормальной плазмы), либо в Международных Единицах (относительно международного стандарта для фактора VII в плазме)
**Исходя из клинической оценки в отдельном случае, ближе к концу лечения могли быть достаточными более низкие дозы при условии достижения адекватного гемостаза. Интервалы между дозами должны учитывать короткий период полувыведения Фактора VII из циркуляторного русла, составляющий примерно от 3 до 5 часов. При необходимости поддерживать высокие уровни Фактора VII в течение длительных периодов времени, дозы следует вводить с интервалом 8–12 часов.
Любой неиспользованный препарат и отработанный материал должен быть уничтожен в соответствии с локальными требованиями.
Цвет раствора может варьировать от бесцветного до бледно-жёлтого или светло-коричневого. Не использовать растворы, являющиеся мутными или содержащие осадок. Восстановленные препараты перед применением должны проверяться визуально на наличие механических включений и изменение цвета.
Препарат необходимо использовать сразу после восстановления.
Побочное действие
Расстройства иммунной системы: гиперчувствительность. Заместительная терапия фактором VII (человека) в редких случаях может приводить к выработке циркулирующих антител, которые ингибируют фактор VII. Присутствие таких ингибиторов проявит себя в виде недостаточного клинического ответа.
Аллергические или анафилактические реакции: наблюдаются в редких случаях.
Местные реакции: в редких случаях наблюдается повышение температуры тела.
Расстройства сердечно-сосудистой системы: аритмия. В редких случаях может вызывать тромбоэмболию. Также имеются сведения о тромбозе глубоких вен.
Расстройства со стороны системы крови и кроветворения: серопозитивность к фактору VII.
Желудочно-кишечные расстройства: тошнота, диарея.
Расстройства психики: спутанность сознания, бессонница, беспокойное состояние.
Взаимодействие с другими лекарственными средствами
Какие-либо взаимодействия фактора VII с другими лекарственными средствами не известны.
Особые указания
При возникновении аллергических и анафилактических реакций применение необходимо немедленно прекратить. В случае шока следует провести стандартные медицинские мероприятия. Следует проинформировать пациентов о ранних признаках реакций гиперчувствительности. При возникновении таких симптомов необходимо рекомендовать пациентам немедленно прервать применение препарата и обратиться к своему лечащему врачу.
Стандартные мероприятия по предотвращению инфекций, являющихся следствием применения лекарственных препаратов, получаемых из человеческой крови или плазмы, включают отбор доноров, скрининг материала, сданного отдельными донорами, и пулов плазмы в отношении специфических маркеров инфекции, а также внедрение в производство этапов эффективной инактивации/удаления вирусов. Несмотря на это, возможность передачи инфекционных агентов при применении лекарственных препаратов, получаемых из человеческой крови или плазмы, полностью исключить нельзя.
Предпринимаемые меры считаются эффективными в отношении таких оболочечных вирусов, как ВИЧ, вирус гепатита B, вирус гепатита C, а также таких безоболочечных вирусов, как вирус гепатита A и парвовирус В19.
Следует предусмотреть адекватную вакцинацию пациентов, которым регулярно или повторно назначаются препараты Фактора VII, получаемые из плазмы человека. Настоятельно рекомендуется регистрировать номер и серию введённого препарата для контроля.
При лечении больных препаратами, содержащими Фактор VII, существует риск возникновения тромбоза или диссеминированного внутрисосудистого свёртывания. Пациенты, которым назначают Фактор VII, должны тщательно наблюдаться на предмет признаков или симптомов внутрисосудистого свёртывания или тромбоза. Из-за риска тромбоэмболических осложнений следует соблюдать осторожность при применении более высоких доз концентратов Фактора VII у пациентов с ишемической болезнью сердца в анамнезе, у лиц с заболеваниями печени, у пациентов в послеоперационный период, у новорождённых, у пациентов с риском тромбоэмболических явлений или диссеминированного внутрисосудистого свёртывания. В любой из этих ситуаций потенциальную пользу от лечения препаратом Фактор VII следует сопоставить с риском данных осложнений.
Влияние на способность управлять транспортными средствами, механизмами
Не выявлено.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения, 600 МЕ.
По 600 МЕ препарата в стеклянном флаконе (тип II, ЕР) и по 10 мл растворителя в стеклянном флаконе (тип I, ЕР) в картонной коробке вместе с набором для растворения и введения (одноразовый шприц, одноразовая игла, игла для переноса, фильтрующая игла, аэрационная игла, система для трансфузии) и инструкцией по применению.
Хранение
При температуре от 2 до 8 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после окончания срока годности, указанного на этикетке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Baxter, S.A., Бельгия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Фактор VII:
