ИЛСИРА
Лекарственная форма
раствор для подкожного введения
Состав
| Ингредиент: | В 1,0 мл | В предварительно наполненном шприце 0,9 мл |
| Действующее вещество: | ||
| Левилимаб | 180,0 мг | 162,0 мг |
| Вспомогательные вещества: | ||
| Натрия ацетата тригидрат | 0,436 мг | 0,392 мг |
| Глицин | 7,5 мг | 6,8 мг |
| Маннитол | 23,0 мг | 20,7 мг |
| Уксусная кислота ледяная | до pH 5,0 | до pH 5,0 |
| Вода для инъекций | до 1,0 мл | до 0,9 мл |
Описание
Прозрачный, жёлто-коричневого цвета раствор. Возможно наличие лёгкой опалесценции.
Фармакологическое действие
Фармакодинамика
Левилимаб — рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, B- и T-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 — единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка A — SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген- индуцированного артрита у яванских макак (Macaca fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам T- и B-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжёлых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2–24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Cmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0–168) составляли 1866231 [1297632–3719014] (нг/мл) × ч, для группы пациентов с еженедельным введением препарата и 2152996,5 [1323711–3081436] (нг/мл) × ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация — время рассчитанной в период 0–2016 ч после введения (AUC(0–2016)) составили 189580779 [134794695; 230680771] (нг/мл) × ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл) × ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax–mult) нарастал и достигал значений 201024 [151563–246408] нг/мл при еженедельном введении препарата и 51570 [37201–71740] нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Tmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объём распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5–14,2 раза при еженедельном введении и в 1,9–4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Выведение
Значения показателей, характеризующих период элиминации (Kel, Cl и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печёночной недостаточностью: фармакокинетические данные у больных с почечной и печёночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
- Гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые бактериальные инфекции в острой фазе, включая туберкулёз.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
- Печёночная недостаточность тяжёлой степени тяжести (класс C по классификации Чайлд-Пью. Почечная недостаточность тяжёлой и терминальной степени тяжести (СКФ <30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжёлых и среднетяжёлых инфекционных заболеваний; после недавно проведённой вакцинации живыми вакцинами; при назначении пациентам с печёночной недостаточностью лёгкой и средней степени тяжести (класс A и B по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и >30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целю раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Беременность и лактация
Применение при беременности
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат ИЛСИРА® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнёры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА® противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата ИЛСИРА® должно осуществляться под наблюдением врачей.
Рекомендуемая доза препарат ИЛСИРА® составляет 324 мг однократно в виде двух подкожных инъекций по 162 мг каждая.
Указания по применению
Подготовка к проведению подкожной инъекции
- Тщательно вымойте руки.
Извлеките упаковку со шприцем из холодильника. Затем извлеките шприц с лекарственным препаратом из картонной пачки. Осмотрите шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае:
⁃ помутнения раствора, наличия в препарате посторонних видимых частиц;
⁃ изменения цвета;
⁃ повреждения любых частей шприца;
⁃ истечения срока годности (годен до...), указанного на картонной пачке, а также на этикетке шприца.
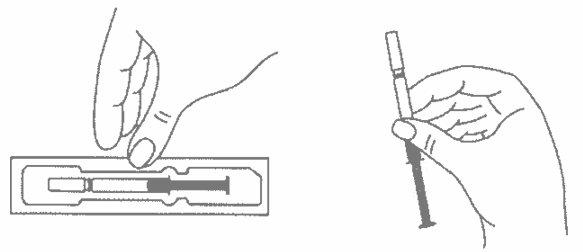
Оставьте шприц при комнатной температуре приблизительно на 25–30 минут. Не следует согревать шприц с препаратом каким-либо другим способом.
- Подготовьте спиртовую салфетку/ватный тампон.
Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
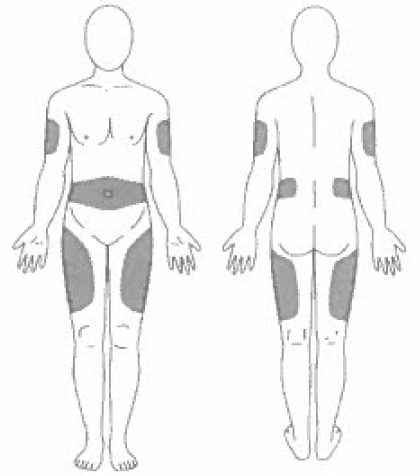
- Места инъекций и стороны следует менять с каждой последующей процедурой инъекции.
- Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции.
Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
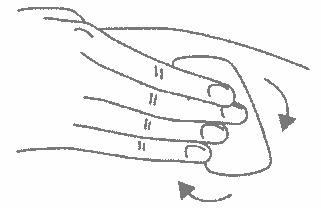
- Шприц не встряхивать.
Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям;
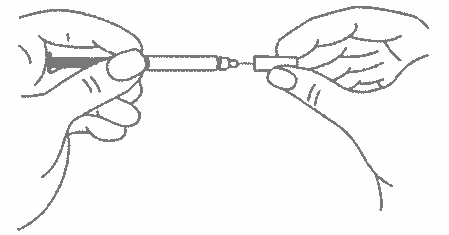
Одной рукой возьмите в складку обработанную кожу.
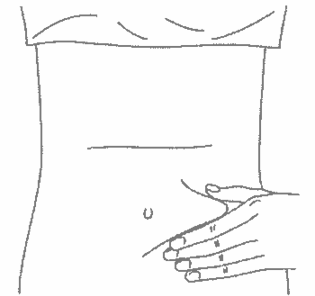
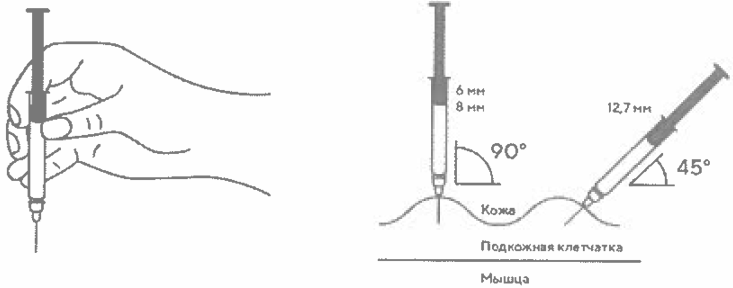
В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90 градусов).
Одним быстрым движением полностью введите иглу в кожную складку.
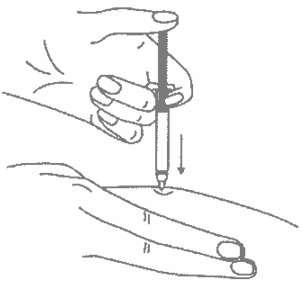
После введения иглы отпустите складку кожи.
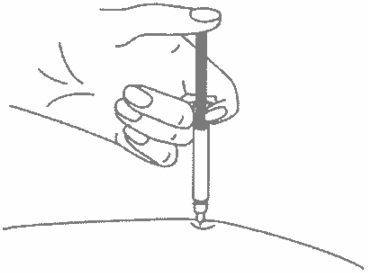
Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2–5 секунд.
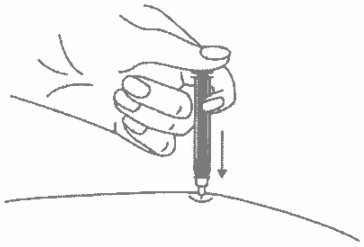
- Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
Кусочком марли слегка прижмите область инъекции в течение 10 секунд, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
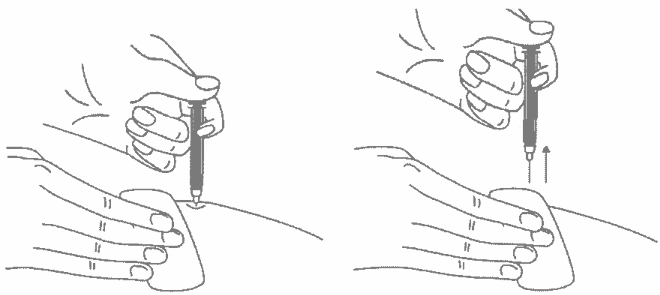
- После инъекции шприц повторно не использовать.
На данном этапе не следует снимать колпачок шприца
Техника выполнения подкожной инъекции препарата ИЛСИРА® в преднаполненном шприце
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускайте хранения использованных шприцев в местах, доступных для детей.
Побочные эффекты
В рамках проведённых клинических исследований у пациентов с ревматоидным артритом препарат ИЛСИРА® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведённых клинических исследованиях были нейтропения, повышение активности АЛТ и повышение уровня холестерина крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата ИЛСИРА®, был ожидаемым для класса ингибиторов ИЛ6Р. Летальных исходов, связанных с терапией препаратом ИЛСИРА®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарём нежелательных реакций MedDRA. Ниже приведён перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определённую, вероятную или возможную степень связи с приёмом препарата. Частота указана с учётом следующих критериев: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000), очень редко (<10 000).
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулёз. |
| Нарушения со стороны крови и лимфатической системы | Очень часто | нейтропения |
| Часто | лейкопения, лимфопения | |
| Нечасто | тромбоцитопения | |
| Нарушения со стороны сосудов | Нечасто | повышение артериального давления |
| Общие нарушения и реакции в месте введения | Часто | реакции в месте введения* |
| Лабораторные и инструментальные данные | Часто | повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), повышение уровня холестерина и триглицеридов крови, повышение уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулёз. |
| * В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда. | ||
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы крови, отклонение от нормы процедуры визуализации лёгких.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при подкожном введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 килограммов) явлений дозолимитирующей токсичности не зарегистрировано.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи. При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору. До начала приёма препарата ИЛСИРА® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьёзные инфекции
Наличие таких потенциально тяжёлых инфекций как ВИЧ, активный гепатит B и(или) C, сифилис, туберкулёз, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита B терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулёз
Пациентам с активным туберкулёзом терапия препаратом ИЛСИРА® противопоказана. Перед назначением препарата ИЛСИРА® и в ходе терапии необходимо проводить стандартный скрининг на туберкулёз. Пациентам с латентным туберкулёзом рекомендуется пройти стандартный курс противотуберкулёзной терапии перед началом терапии препаратом ИЛСИРА®.
Лабораторные показатели
Нейтропения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьёзных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА® пациентов с АЧН <2 × 109/л. При снижении АЧН <0,5 × 109/л терапию препаратом ИЛСИРА® следует отменить. Следует оценивать число нейтрофилов через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® при числе тромбоцитов ниже 100 × 103/мкл. Лечение не рекомендуется при числе тромбоцитов <50 × 103/мкл. Следует оценивать число тромбоцитов через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение активности «печёночных» трансаминаз без признаков печёночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печёночных трансаминаз (АЛТ и ACT) через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведённых клинических исследований препарата ИЛСИРА® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата ИЛСИРА® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА® при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом ИЛСИРА® так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом ИЛСИРА®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
| ▼ Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объёма клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи. |
Влияние на способность управлять транспортными средствами или работать с механизмами
Отсутствуют данные о влиянии препарата ИЛСИРА® на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата ИЛСИРА®, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Раствор для подкожного введения 180 мг/мл.
Хранение
При температуре от 2 до 8 °C в защищённом от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате ИЛСИРА:
