Нувик
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
В 1 флаконе содержится действующее вещество симоктоког альфа (фактор свёртывания крови Ⅷ человеческий рекомбинантный) 250 МЕ или 500 МЕ, или 1000 МЕ, или 2000 МЕ. Вспомогательные вещества: натрия хлорид 45 мг, сахароза 13,5 мг, аргинина гидрохлорид 13,5 мг, кальция хлорида дигидрат 0,75 мг, полоксамер 188 3,0 мг, натрия цитрата дигидрат 3,0 мг. В 1 шприце содержится вода для инъекций 2,5 мл.
Описание
Масса белого цвета, возможно наличие небольшого количества порошка белого цвета. Восстановленный раствор — прозрачный или слегка опалесцирующий бесцветный раствор.
Фармакологическое действие
Фармакодинамика
Симоктоког альфа, фактор свёртывания крови VIII человеческий (рДНК), представляет собой высокоочищенный протеин, состоящий из 1440 аминокислот. Последовательность аминокислот сравнима с таковой фактора свёртывания VIII (фактор VIII) из плазмы человека, состоящего их двух цепей с молекулярной массой 90 кДа и 80 кДа и не содержащего В-домен. Препарат получают при помощи технологии рекомбинантной ДНК из клеточных линий эмбриональной почки человека (НЕК 293F клетки). Никакие вещества человеческого или животного происхождения в процессе производства и в готовый препарат не добавляются.
Посттрансляционные модификации препарата Нувик аналогичны таковым в эндогенном факторе VIII у здоровых людей, и в отличие от препарата из клеточных линий хомячка препарат рекомбинантного фактора VIII из клеточных линий человека не имеет карбогидратных эпитопов, обладающих антигенными свойствами.
Комплекс фактор VIII/фактор Виллебранда состоит из двух молекул (фактор VIII и фактор Виллебранда) с различными физиологическими функциями. При введении пациентам с гемофилией фактор VIII связывается с фактором Виллебранда в кровеносном русле. Активированный фактор VIII действует как кофактор для активированного фактора IX, ускоряя превращение фактора X в активированный фактор X. Активированный фактор X превращает протромбин в тромбин. Затем тромбин превращает фибриноген в фибрин, при этом может сформироваться тромб. Гемофилия А — это связанное с полом наследственное нарушение свёртывания крови, связанное со снижением уровня фактора VIII и приводящее к профузным кровотечениям в суставы, мышцы или внутренние органы, как спонтанным, так и в результате случайных травм или хирургических вмешательств. При проведении заместительной терапии достигается временная коррекция дефицита фактора VIII в плазме и коррекция кровотечений.
Иммуногенность препарата Нувик изучалась в клинических исследованиях, в которых приняли участие 135 пациентов с тяжёлой гемофилией А, ранее получавших лечение (74 взрослых и 61 ребёнок). Ни у одного из пациентов появление ингибиторов не наблюдалось.
В клиническом исследовании на 32 взрослых пациентах с тяжёлой гемофилией А среднее потребление препарата Нувик в целях профилактики составило 468,7 МЕ/кг в месяц. Средняя доза для лечения острых кровотечений была 33,0 МЕ/кг для пациентов, получавших Нувик в профилактических целях. В другом клиническом исследовании 22 взрослых пациента получали лечение при необходимости. Всего 986 случаев кровотечений потребовали лечения со средней дозой 30,9 МЕ/кг. В целом малые кровотечения требуют применения несколько меньших доз препарата, а более тяжёлые кровотечения требуют введения препарата в дозах, вплоть до трёх раз превышающих средние дозы препарата.
Фармакодинамика у детей
Данные были получены от 29 ранее получавших лечение детей в возрасте от 2 до 5 лет, 31 в возрасте от 6 до 12 лет и одного старше 14 лет. Средняя доза профилактических инфузий составила 37,8 МЕ/кг. Двадцать пациентов получали среднюю дозу более 45 МЕ/кг. Среднее потребление препарата Нувик в целях профилактики составило 521,9 МЕ/кг в месяц. Исследования показали, что для лечения кровотечений у детей средняя дозировка Нувик (43,9 МЕ/кг) выше, чем у взрослых (33,0 МЕ/кг), а также что средняя дозировка, необходимая для остановки от средних до сильных кровотечений, выше чем для слабых кровотечений (78,2 МЕ/кг против 41,7 МЕ/кг). Для детей младшего возраста в основном требуется большая средняя доза (6–12 лет: 43,9 МЕ/кг, 2–5 лет: 52,6 МЕ/кг).
Фармакокинетика
Таблица 1. Фармакокинетика препарата Нувик (50 МЕ/кг) у взрослых в возрасте от 18 до 65 лет с тяжёлой формой гемофилии А, ранее получавших лечение (n = 20)
Фармакокинетический параметр | Хромогенный анализ | |
Среднее ± СО | Медиана (интервал) | |
AUC (ч*МЕ/мл) | 22,6 ± 8,0 | 22,3 (8,4-38,1) |
T ½ (ч) | 14,7 ± 10,4 | 12,5 (5,4-55,6) |
IVR (%/МЕ/кг) | 2,5 ± 0,4 | 2,50,7-3,2) |
CL (мл/ч/кг) | 3,0 ± 1,2 | 2,70,5-6,4) |
Таблица 2. Фармакокинетика препарата Нувик (50 МЕ/кг) у детей в возрасте от 6 до 12 лет с тяжёлой формой гемофилии А, ранее получавших лечение (n = 12)
Фармакокинетический параметр | Хромогенный анализ | |
Среднее ± СО | Медиана (интервал) | |
AUC (ч*МЕ/мл) | 13,2 ±3,4 | 12,8 (7,8-19,1) |
T½ (ч) | 10,0 ± 1,9 | 9,9 (7,6-14,1) |
IVR (%/МЕ/кг) | 1,9 ±0,4 | 1,90,2-2,6) |
CL (мл/ч/кг) | 4,3 ± 1,2 | 4,2 (2,8 — 6,9) |
Таблица 3. Фармакокинетика препарата Нувик (50 МЕ/кг) у детей в возрасте от 2 до 5 лет с тяжёлой формой гемофилии А, ранее получавших лечение (n = 13)
Фармакокинетический параметр | Хромогенный анализ | |
Среднее ± СО | Медиана (интервал) | |
AUC (ч*МЕ/мл) | 11,7 ±5,3 | 10,5 (4,9-23,8) |
T½ (ч) | 9,5 ± 3,3 | 8,2 (4,3-17,3) |
IVR (%/МЕ/кг) | 1,9 ±0,3 | 1,8 0,5-2,4) |
CL (мл/ч/кг) | 5,4 ± 2,4 | 5,1 (2,3-10,9) |
AUC = площадь под кривой (FVIII : С), Т½ — период полувыведения, IVR= восстановление фактора in vivo, CL = клиренс, СО = стандартное отклонение
Фармакокинетика у детей
В соответствии с литературными данными время восстановления и период полувыведения несколько меньше у детей, чем у взрослых, в то же время клиренс препарата у детей выше, что может быть связано с известным фактом, что у детей объём плазмы на килограмм массы тела выше, чем у взрослых.
Разделение на подгруппы по весу
Таблица 4. Фармакокинетика препарата Нувик (50 МЕ/кг) в зависимости от веса у взрослых в возрасте от 18 до 65 лет с тяжёлой формой гемофилии А, ранее получавших лечение (n = 20)
Нормальный вес: индекс массы тела(ИМТ) 18,5-25 кг/м2 Предожирение: ИМТ 25-30 кг/м2 Ожирение: ИМТ > 30 кг/м2
Показания
Лечение и профилактика кровотечений у детей старше 3-х лет и взрослых с гемофилией А (врождённый дефицит фактора свёртывания крови VIII).
Противопоказания
Повышенная чувствительность к действующему веществу или любому из компонентов препарата.
Беременность и лактация
Поскольку гемофилия А редко наблюдается у женщин, опыт лечения фактором VIII во время беременности и кормления грудью отсутствует. Поэтому Нувик следует применять при беременности и в период грудного вскармливания только при наличии абсолютных показаний.
Способ применения и дозы
Лечение должно проводиться врачом, имеющим опыт лечения пациентов с гемофилией. Препарат вводят внутривенно после растворения в прилагаемом растворителе (вода для инъекций). Следует использовать только прилагаемые приспособления для растворения и введения, так как вследствие адсорбции фактора VIII на внутренней поверхности любых других контейнеров и устройств для проведения инъекции лечение может быть неэффективным. Скорость введения раствора не должна превышать 4 мл/мин. Доза и длительность проведения заместительной терапии зависят от степени дефицита фактора VIII, локализации и тяжести кровотечения, а также от объективного состояния пациента.
Количество единиц фактора VIII в препарате выражается в Международных Единицах (МЕ), установленных действующим стандартом ВОЗ для препаратов фактора VIII. Активность фактора VIII в плазме выражается в процентах (относительно содержания фактора VIII в нормальной человеческой плазме) или в МЕ (относительно Международного Стандарта фактора VIII).1 МЕ активности фактора VIII эквивалентна содержанию фактора VIII в 1 мл нормальной человеческой плазмы.
Режим терапии «по требованию»
Расчёт требуемой дозы основан на эмпирически полученных результатах, согласно которым 1 МЕ фактора VIII/кг массы тела повышает уровень активности фактора VIII в плазме примерно на 2 % от нормальной активности (или 2 МЕ/дл). Расчёт требуемой дозы проводят по формуле:
- Необходимая доза = масса тела (кг) × желаемое повышение уровня фактора VIII (%) (МЕ/дл) × 0,5 (МЕ/кг на МЕ/дл)
Ожидаемое повышение уровня фактора VIII (% от нормы):
2 × количество введённого фактора VIII (МЕ)
масса тела (кг)
Дозы и частота применения препарата всегда должны быть ориентированы на достижение клинического эффекта в каждом индивидуальном случае.
В случае последующих кровотечений уровень активности фактора VIII не должен уменьшаться ниже заданного уровня активности в плазме (% от нормального содержания ) в соответствующий период времени. Таблица ниже может быть использована в качестве ориентира для выбора доз при различных кровотечениях и хирургических вмешательствах.
Таблица 5. Рекомендуемые дозы препарата Нувик при различных видах кровотечений и хирургических вмешательствах
| Тяжесть кровотечения/тип хирургического вмешательства | Необходимый уровень фактора VIII (%) | Частота введения (часы)/ Длительность лечения (дни) |
| Кровотечение | ||
| Ранние гемартрозы, внутримышечные кровотечения, кровотечения ротовой полости | 20–40 | Каждые 12–24 ч не менее 1 суток, пока эпизод кровотечения (определяется по наличию боли) не разрешится или до заживления источника кровотечения. |
| Более обширные гемартрозы, внутримышечные кровотечения или гематомы | 30–60 | Каждые 12–24 ч в течение не менее 3–4 дней до исчезновения боли и острых функциональных нарушений. |
| Угрожающие жизни кровотечения. | 60–100 | Каждые 8-24 ч до полного исчезновения угрозы кровотечения. |
| Хирургические вмешательства | ||
| Малые вмешательства, включая удаление зубов | 30–60 | Каждые 24 ч не менее 1 суток до достижения заживления. |
| Крупные вмешательства | 80-100 (до- и постоперационный) | Каждые 8-24 ч до адекватного заживления источника кровотечения, затем не менее 7 дней для поддержания активности фактора VIII на уровне 30- 60 % |
Режим терапии «профилактика»
Для длительной профилактики кровотечений у пациентов с тяжёлой формой гемофилии А средняя доза фактора VIII составляет 20–40 МЕ/кг массы тела с интервалами в 2–3 дня.
В некоторых случаях, особенно у более молодых пациентов, может возникнуть необходимость сокращения промежутка между введениями или же повышения дозы.
Во время курса лечения рекомендуется определять уровень фактора VIII с целью коррекции дозы и частоты повторных введений. В случае больших хирургических вмешательств необходим тщательный мониторинг заместительной терапии путём контроля свёртываемости крови (активность фактора VIII в плазме). Ответ на лечение может быть разным у отдельных пациентов, что свидетельствует о различиях в периоде полувыведения и восстановления.
Пациенты, ранее не получавшие лечения
Информация о безопасности и эффективности препарата Нувик у пациентов, ранее не получавших лечение, на данный момент отсутствует.
Применение у детей
Применение препарата у детей соответствует таковому у взрослых, однако для детей могут потребоваться более короткие интервалы введения или более высокие дозы.
Подготовка препарата к введению
Лиофилизат разводят с помощью прилагаемого растворителя (2,5 мл воды для инъекций) и приспособлений для растворения и введения. Раствор после восстановления должен быть бесцветным, прозрачным или слегка опалесцирующим, pH от 6,5 до 7,5. Восстановленный препарат используют немедленно.
Инструкция по приготовлению и введению
1. Доведите шприц с растворителем (вода для инъекций) и закрытый флакон с лиофилизатом до комнатной температуры. Вы можете согреть их в руке. Не используйте никаких других способов нагревания. Следует поддерживать комнатную температуру препарата в процессе восстановления.
2. Удалите пластиковую flip-off крышку с флакона с лиофилизатом. Не снимайте алюминиевый колпачок и не извлекайте резиновую пробку.
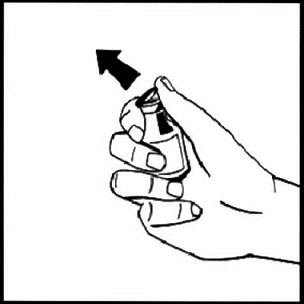
3. Протрите верх флакона дезинфицирующей спиртовой салфеткой. Дайте спирту высохнуть.
4. Удалите бумажное покрытие с упаковки адаптера для флакона. Не вынимайте адаптер из упаковки.
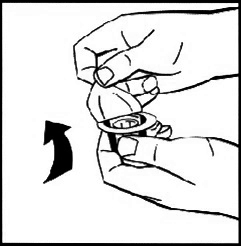
5. Поставьте флакон с лиофилизатом на ровную поверхность и удерживайте его. Поместите упаковку с адаптером острием вниз по центру резиновой пробки. Надавите на адаптер с усилием, чтобы игла проткнула пробку. Когда адаптер займет нужное положение, раздастся щелчок.
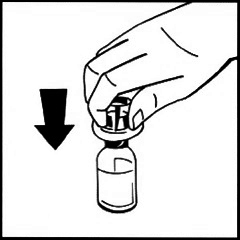
6. Снимите бумажное покрытие с упаковки шприца. Держите шток поршня за конец и не трогайте штифт. Вставьте шток поршня концом с резьбой в поршень шприца с растворителем. Поворачивайте шток поршня по часовой стрелке, пока не почувствуете лёгкое сопротивление.
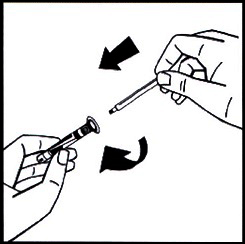
7. Отломите пластиковый колпачок с индикацией вскрытия от шприца с растворителем по перфорации колпачка. Не дотрагивайтесь до внутренней части колпачка или открывшегося конца шприца. Если раствор не будет сразу же использован, закройте шприц пластиковым колпачком на время хранения.
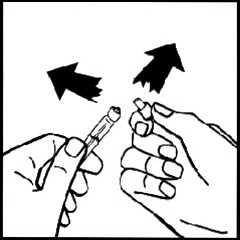
8. Снимите упаковку с адаптера для флакона и поместите в контейнер для отходов.
9. Надёжно соедините шприц с растворителем с адаптером для флакона, поворачивая по часовой стрелке, пока не почувствуете сопротивление.
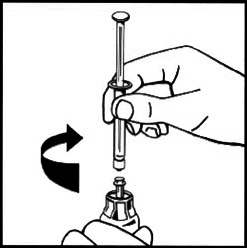
10. Нажимая на шток поршня, осторожно введите растворитель во флакон с лиофилизатом.
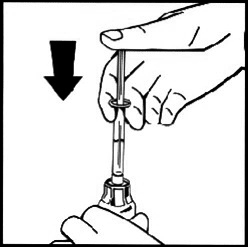
11. Не извлекая шприц, осторожно вращайте флакон или двигайте по кругу до полного растворения лиофилизата. Не встряхивайте флакон.
12. Перед введением обязательно осмотрите раствор на предмет наличия частиц и изменения цвета. Раствор должен быть прозрачным и бесцветным. Не используйте мутный раствор или раствор, в котором есть частицы.
13. Переверните флакон с присоединенным шприцом вверх дном и медленно введите раствор обратно в шприц. Убедитесь, что всё содержимое флакона перенесено в шприц.
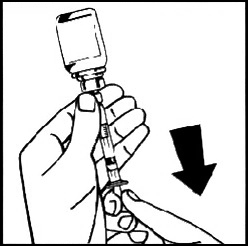
14. Отсоедините заполненный шприц от адаптера флакона, поворачивая его против часовой стрелки, пустой флакон поместите в контейнер для отходов.
15. Раствор в шприце готов для введения. Не хранить в холодильнике после разведения. Приготовленный раствор после разведения следует использовать немедленно.
16. Очистите место введения одной из прилагающихся дезинфицирующих салфеток.
17. Подсоедините к шприцу прилагающуюся систему для введения ("иглу-бабочку"). Введите "иглу-бабочку" в выбраную вену. При использовании жгута для облегчения введения в вену иглы перед введением раствора необходимо снять жгут. Следует следить за тем, чтобы кровь не попала внутрь шприца, чтобы исключить риск образования фибриновых сгустков.
18. Медленно введите раствор в вену (со скоростью не более 4 мл/мин).
Если планируется использовать несколько флаконов с препаратом для одной процедуры введения, можно использовать ту же иглу для введения восстановленного препарата из других флаконов. Адаптер флакона и шприц предназначены только для одноразового использования. Неиспользованный препарат или отходы следует утилизировать в соответствии с существующими правилами.
Побочные эффекты
Общая характеристика профиля безопасности
Гиперчувствительность или аллергические реакции (которые могут включать ангионевротический отёк, жжение и зуд в месте введения препарата, озноб, покраснение лица, генерализованную крапивницу, головную боль, местную крапивницу, гипотензию, заторможенность, тошноту, беспокойство, тахикардию, чувство стеснения в груди, звон в ушах, рвоту, свистящее дыхание) при применении препаратов фактора VIII наблюдались редко, но в некоторых случаях прогрессировали с развитием тяжёлой анафилаксии (включая шок).
В ходе клинических исследований применения препарата Нувик у получавших предшествующее лечение детей (от 2 до 11 лет, n = 58), подростков (от 12 до 17 лет, n = 3) и взрослых пациентов (n = 74) с тяжёлой формой гемофилии А в общей сложности было зарегистрировано 8 нежелательных реакций (НЛР) (6 у взрослых и 2 у детей) у 5 пациентов (3 взрослых и 2 ребёнка). У подростков НЛР не наблюдались. Общее число пациентов в исследованиях составляло 135.
Таблица 6. Сведения о частоте нежелательных реакций в клинических исследованиях у пациентов с тяжёлой формой гемофилии А, получавших предшествующее лечение
| Нежелательные реакции | Частота* у детей от 2 до 11 лет (n = 58) | Частота* у пациентов старше 18 лет (n = 74) | |
| Со стороны нервной системы | Парестезия | - 1,72 % | 1,35 % - |
| Со стороны органов слуха и равновесия | Системное головокружение (вертиго) | — | 1,35 % |
| Со стороны желудочно-кишечного тракта | Сухость во рту | — | 1,35 % |
| Со стороны скелетно-мышечной системы и соединительной ткани | Боль в спине | 1,72 % | — |
| Местные реакции | Воспаление в месте введения препарата | — | 1,35 % |
| Боль в месте введения препарата | — | 1,35 % | |
| Со стороны лабораторных показателей | Положительный результат определения ненейтрализующих антител к фактору VIII | — | 1,35 % |
* Все перечисленные нежелательные реакции возникали однократно.
Описание отдельных нежелательных реакций
Не-нейтрализующие антитела к фактору VIII определялись у одного взрослого пациента. Тест выполнялся в центральной лаборатории при восьми разведениях. Результат был положительным только при коэффициенте разбавления 1, при этом титр антител был очень низким. Ингибирующая активность по данным модифицированного Бетезда-теста не определялась. Клиническая эффективность и восстановление активности препарата Нувик invivo у данного пациента не изменялись.
Применение у детей
Предполагается, что частота, тип и степень тяжести нежелательных реакций у детей сходны с данными показателями у взрослых.
Передозировка
О случаях передозировки не сообщалось.
Взаимодействие
Исследования взаимодействий препарата Нувик с другими лекарственными средствами не проводились. Ввиду отсутствия исследований совместимости данный препарат не следует смешивать с другими препаратами.
Особые указания
Гиперчувствительность
Как и при применении любого белкового препарата для внутривенного введения, возможно развитие аллергических реакций гиперчувствительности. Нувик содержит следы человеческих белков хозяина, отличных от фактора VIII. При появлении симптомов реакции гиперчувствительности пациенту следует немедленно прекратить применение препарата и обратиться к врачу. Пациенты должны быть проинформированы о ранних признаках реакций гиперчувствительности, включая аллергическую сыпь, генерализованную крапивницу, чувство стеснения в груди, свистящее дыхание, гипотензию и анафилаксию. В случае развития шока следует проводить стандартное лечение.
Ингибиторы
Образование нейтрализующих антител (ингибиторов) к фактору VIII является известным осложнением при лечении пациентов с гемофилией А. Обычно этими ингибиторами являются направленные против прокоагулянтной активности фактора VIII иммуноглобулины IgG, содержание которых определяется в модифицированных единицах Бетезда (BU) на мл плазмы с использованием модифицированного метода. Риск появления ингибиторов коррелирует с количеством раз (дней) введения фактора VIII и наиболее высок в течение первых 20 дней введения. В редких случаях ингибиторы могут появиться после первых 100 дней введения.
Случаи рецидивирующего появления ингибиторов (с низким титром) наблюдались после перехода с лечения одним препаратом фактора VIII на лечение другим препаратом фактора VIII у пациентов, ранее получавших препарат (введение более 100 дней), у которых отмечалось появление ингибиторов в анамнезе. Поэтому рекомендуется проводить тщательное наблюдение за пациентами на предмет появления ингибиторов после перехода с одного препарата фактора VIII на другой.
В целом состояние пациентов, получающих лечение препаратами фактора VIII, следует тщательно мониторировать на предмет появления ингибиторов путём соответствующего клинического наблюдения и проведения лабораторных тестов (необходимо периодически определять уровень активности фактора VIII). Если ожидаемый уровень активности фактора VIII в плазме не достигнут, или если при применении адекватной дозы не удаётся контролировать кровотечение, необходимо выполнить соответствующий анализ для выявления ингибиторов фактора VIII. У пациентов с высоким уровнем ингибиторов лечение фактором VIII может быть неэффективным, при этом необходимо рассмотреть вопрос о применении альтернативных методов лечения (например, индукция иммунной толерантности). Лечение таких пациентов должен проводить врач, имеющий опыт лечения гемофилии при наличии ингибиторов к фактору VIII.
Осложнения, связанные с применением катетера
При необходимости применения устройства для центрального венозного доступа следует учитывать риск осложнений, связанных с его применением, в том числе местные инфекции, бактериемию и тромбоз в месте введения катетера. При каждом введении препарата Нувик пациенту настоятельно рекомендуется регистрировать название препарата и номер серии для того, чтобы можно было проследить связь состояния пациента с введением препарата конкретной серии.
Применение у детей
Выше приведённые указания в одинаковой степени относятся как к взрослым, так и к детям. Ограничения, связанные с вспомогательными веществами В одном флаконе препарата содержится < 1 ммоль (23 мг) натрия. Однако в зависимости от массы тела и показаний пациент может применять более одного флакона препарата. Это следует учитывать пациентам, придерживающимся диеты с ограничением содержания натрия.
Влияние на способность управлять транспортными средствами или работать с механизмами
Нувик не оказывает влияния на способность к управлению автотранспортом и выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения 250 МЕ, 500 МЕ, 1000 МЕ и 2000 МЕ.
Хранение
Хранить при температуре от 2 до 8 °C в защищённом от света месте. Не замораживать. Хранить в недоступном для детей месте.
Срок годности
2 года. Не использовать после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Нувик:
