Аимафикс
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
| Наименование компонента | Содержание в 1 флаконе | |
|---|---|---|
| Активное вещество: | ||
| Фактор свёртывания крови Ⅸ | 500 МЕ | 1000 МЕ |
| Вспомогательные вещества: | ||
| Натрия хлорид | 76,0 мг | 76,0 мг |
| Глицин | 92,6 мг | 92,6 мг |
| Натрия цитрат | 29,4 мг | 29,4 мг |
| Натрия гепарин | не более 100 МЕ | не более 100 МЕ |
| Антитромбин Ⅲ | не более 1,25 МЕ | не более 1,25 МЕ |
| Растворитель: | ||
| Вода для инъекций | 10 мл | 10 мл |
Описание
Лиофилизат белого или светло-жёлтого цвета. После растворения — прозрачный или слегка опалесцирующий бесцветный или светло-жёлтый раствор.
Растворитель (вода для инъекций) — прозрачная бесцветная жидкость.
Фармакологические свойства
Аимафикс является высокоочищенным вирусинактивированным фактором свёртывания крови Ⅸ, полученным из плазмы крови человека.
Фактор свёртывания крови Ⅸ представляет собой одноцепочечный гликопротеин с молекулярной массой около 68 кДа, синтезируемый в печени.
Фактор свёртывания крови Ⅸ — это витамин-K-зависимый фактор, активируемый фактором свёртывания крови Ⅸa в последовательной цепи реакций внутреннего механизма свёртывания крови или комплексом «фактор свёртывания крови VII/тканевый фактор свёртывания крови» во внешнем механизме свёртывания крови.
Активированный фактор свёртывания крови Ⅸ в комбинации с активированным фактором свёртывания крови VIII активирует фактор свёртывания крови X, способствующий превращению протромбина в тромбин. Тромбин, в свою очередь, участвует в превращении фибриногена в фибрин и образовании сгустка.
Активность фактора свёртывания крови Ⅸ значительно снижена у пациентов с гемофилией B, что приводит к сильным кровоизлияниям в суставы, мышцы и внутренние органы в результате случайных травм или хирургических вмешательств. Для увеличения содержания фактора свёртывания крови Ⅸ в крови необходима заместительная терапия, позволяющая временно восстановить дефицит фактора свёртывания крови IX и уменьшить риск кровотечений.
Введение концентрата фактора свёртывания крови Ⅸ человека пациентам с гемофилией B приводит к восстановлению 30–60 % активности фактора свёртывания крови Ⅸ в крови.
Период полувыведения фактора свёртывания крови Ⅸ длится от 16 до 30 часов, в среднем — 24 часа.
Показания
Лечение и профилактика кровотечений при наследственном (гемофилия B) и приобретённом дефиците фактора свёртывания крови Ⅸ.
Противопоказания
Повышенная чувствительность к любому из компонентов препарата.
С осторожностью
Применение в педиатрии
Поскольку в клинической практике недостаточно данных о применении препарата фактора свёртывания крови Ⅸ у детей младше 6 лет, для данной возрастной группы пациентов препарат следует применять с осторожностью, только при наличии абсолютных показаний.
Беременность и лактация
В связи с редкими случаями проявления гемофилии B у женщин, нет данных о практике применения препаратов фактора свёртывания крови Ⅸ в период беременности и грудного вскармливая. Поэтому препарат фактора свёртывания крови Ⅸ рекомендуют применять при беременности и грудном вскармливании, если польза для матери превышает потенциальный риск для плода или ребёнка.
Способ применения и дозы
Препарат восстановить в соответствии с инструкцией, указанной в разделе «Приготовление и введение восстановленного раствора препарата». Восстановленный раствор препарата вводить внутривенно инъекцией или медленной инфузией. Рекомендуется вводить не более 100 МЕ/кг массы тела в сутки. Скорость введения препарата устанавливают индивидуально для каждого пациента.
Приготовление и введение восстановленного раствора препарата
Восстановление лиофилизата растворителем
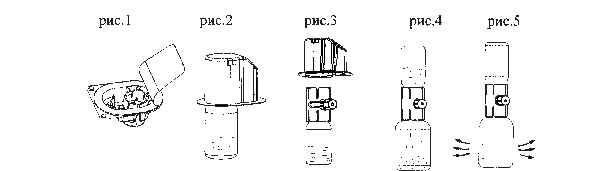
- Нагреть лиофилизат и растворитель до комнатной температуры.
- Удалить защитные крышки с флаконов лиофилизата и растворителя.
- Протереть поверхности крышек обоих флаконов спиртом.
- Для открытия упаковки с безыгольным передаточным устройством осторожно удалить верхнюю часть, не касаясь внутренней части (рис. 1).
- Не извлекать безыгольное передаточное устройство из упаковки.
- Перевернуть коробку и ввести пластиковый наконечник сквозь крышку флакона с растворителем (рис. 2).
- Взять за край упаковки и снять её, освобождая безыгольное передаточное устройство (рис. 3).
- Не снимая флакон с растворителем, перевернуть безыгольное передаточное устройство так, чтобы флакон с растворителем оказался над устройством.
- Вставить второй пластиковый наконечник устройства сквозь пробку флакона с лиофилизатом. Поскольку порошок во флаконе находится под вакуумом, растворитель проникнет во флакон с лиофилизатом (рис. 4).
- Встряхивать систему до полного растворения порошка (рис. 5), иначе нерастворенный препарат не пройдет через фильтр устройства.
Среднее время полного восстановления препарата менее 3 минут.
Введение раствора
Раствор должен быть прозрачным или слегка опалесцирующим. Перед применением препарата проверить, что внешний вид раствора соответствует описанию, не содержит видимые механические включения и не изменил окраску.
Не использовать, если раствор мутный или содержит осадок.
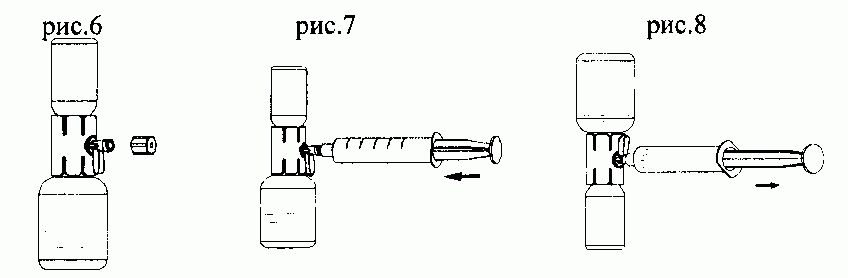
- Повернуть клапан безыгольного передаточного устройства вниз по направлению к флакону лиофилизата и удалить покрывающую его крышку (рис. 6).
- Заполнить шприц воздухом, оттянув поршень назад, присоединить его к клапану устройства и ввести воздух во флакон лиофилизата (рис. 7).
- Не двигая поршнем, перевернуть систему таким образом, чтобы флакон лиофилизата оказался над устройством, и медленно втянуть раствор в шприц, оттягивая поршень назад (рис. 8).
- Осторожно повернуть клапан в первоначальное положение и вытянуть шприц из устройства.
- Присоединить иглу-бабочку к шприцу и ввести препарат внутривенно инфузией или медленной инъекцией.
Остатки препарата и использованные материалы необходимо уничтожить в установленном порядке.
Лечение препаратом проводят под наблюдением врача. Доза и продолжительность замещающей терапии зависят от тяжести нарушения гемостатической функции, локализации и интенсивности кровотечения и клинических проявлений заболевания.
Активность фактора свёртывания крови Ⅸ выражается или в процентах по отношению к нормальной плазме человека, или в Международных Единицах (ME) по отношению к международному стандарту фактора свёртывания крови Ⅸ, принятому Всемирной организацией здравоохранения (ВОЗ). Одна единица активности фактора свёртывания крови Ⅸ, выраженная в ME, эквивалентна количеству фактора свёртывания крови Ⅸ в 1 мл нормальной плазмы человека. Расчёт необходимой дозы фактора свёртывания крови Ⅸ основан на эмпирически установленном факте, что 1 МЕ фактора свёртывания крови Ⅸ на 1 кг массы тела увеличивает активность фактора свёртывания крови Ⅸ в плазме на 0,8 % от нормальной активности.
Требуемую дозу препарата (ME) рассчитывают по следующей формуле:
доза (ME) = масса тела (кг) × требуемое увеличение активности фактора свёртывания крови IX (%) × величина обратная наблюдаемому увеличению активности фактора свёртывания крови Ⅸ
Количество вводимого препарата и частота применения должны быть установлены, исходя из клинической эффективности применения препарата в каждом индивидуальном случае. Препараты фактора свёртывания крови Ⅸ в редких случаях вводят более одной инъекции в день.
В случае приведённых ниже геморрагических кровотечений активность фактора свёртывания крови Ⅸ не должна быть ниже указанной активности в плазме крови, выраженной в % от нормы, в соответствующий период. В данной таблице приведены рекомендуемые дозы препарата в случае кровотечений и хирургическом вмешательстве:
| Вид кровотечения | Терапевтически необходимое содержание фактора свёртывания крови Ⅸ в плазме крови | Период времени, в течение которого необходимо поддерживать терапевтический уровень активности фактора свёртывания крови Ⅸ в плазме |
|---|---|---|
| Геморрагические кровотечения | ||
| Ранний гемартроз, слабое внутримышечное кровотечение и кровотечение из слизистых оболочек ротовой полости | 20–40 % | Каждые 24 часа. По крайней мере 1 день до снятия боли или полного восстановления |
| Более интенсивный гемартроз, внутримышечное кровотечение или гематома | 30–60 % | Каждые 24 часа в течение 3–4 дней и более до снятия боли и полной остановки кровотечения |
| Кровотечения, угрожающие жизни | 60–100 % | Каждые 8–24 часа до снятия угрозы жизни |
| Кровотечения при хирургическом вмешательстве | ||
| Средней тяжести, включая экстракцию зубов | 30–60 % | Каждые 24 часа. По крайней мере 1 день до прекращения кровотечения |
| Тяжёлые кровотечения | 80–100 % (до и после операции) | Каждые 8–24 часа до адекватного заживления раны, затем в течение 7 дней до поддержания активности фактора свёртывания крови Ⅸ в пределах 30–60 % |
В течение курса терапии рекомендуется вести наблюдение за активностью фактора свёртывания крови Ⅸ в плазме крови для установления рекомендуемой дозы и частоты введения препарата. В частности, при обширном хирургическом вмешательстве в обязательном порядке проводят тщательный мониторинг заместительной терапии путём исследования свёртывания крови (активности фактора свёртывания крови Ⅸ в плазме крови пациента). У отдельных пациентов, способных проявлять различную восприимчивость к фактору свёртывания крови Ⅸ, могут достигаться различные уровни восстановления активности in vivo и период полураспада фактора свёртывания крови Ⅸ в плазме.
В случаях длительной профилактики кровотечений у пациентов с тяжёлой формой гемофилии B препарат вводят в дозе 20–40 МЕ фактора свёртывания крови Ⅸ на 1 кг массы тела пациента с интервалами в 3–4 дня.
В некоторых случаях, особенно у молодых пациентов, возможно введение препарата через более короткие временные интервалы или в более высокой дозе. При введении препарата необходимо контролировать появление в крови ингибиторов фактора свёртывания крови IX. Если ожидаемый уровень активности фактора свёртывания крови Ⅸ в плазме крови пациента не был достигнут, или если для кровотечения не установлена эффективная доза препарата, необходимо вести контроль образования ингибитора фактора свёртывания крови Ⅸ в плазме крови пациента.
Для пациентов с высоким содержанием ингибитора фактора свёртывания крови Ⅸ, терапия фактором свёртывания крови Ⅸ может быть малоэффективной, в этом случае возможно применение альтернативной терапии. Ведение таких пациентов должно проводиться специалистом, имеющим опыт лечения пациентов с гемофилией.
Побочные эффекты
Как и все лекарственные средства, препарат Аимафикс может оказывать побочные действия, однако они наблюдаются не у каждого пациента.
Гиперчувствительность или аллергические реакции (которые могут включать ангионевротический отёк, жжение в месте инъекции, озноб, гиперемию, крапивницу (в том числе генерализованную), головную боль, понижение артериального давления, сонливость, тошноту, беспокойство, тахикардию, стеснение и покалывание в груди, рвоту, свистящее дыхание) редко наблюдались у пациентов, получавших препараты фактора свёртывания крови Ⅸ человека. В некоторых случаях эти реакции развивались в тяжёлые анафилактические проявления, вызванные ингибированием фактора свёртывания крови Ⅸ.
Нефротический синдром отмечался у пациентов с гемофилией B, перенёсших проявления иммунной толерантности и аллергические реакции в анамнезе, в крови которых обнаружены ингибиторы фактора свёртывания крови Ⅸ. В редких случаях наблюдалась лихорадка.
У пациентов с гемофилией B могут образовываться нейтрализующие антитела (ингибиторы) к фактору свёртывания крови Ⅸ. Наличие таких антител в крови пациента приводит к малой эффективности гемостатической терапии. В таких случаях необходима консультация специалиста по гемофилии. Случаи выявления ингибиторов у пациентов, принимающих Аимафикс, не установлены.
Существует потенциальный риск тромбоэмболических осложнений после назначения препаратов фактора свёртывания крови Ⅸ низкой степени чистоты, применение которых сопровождалось такими реакциями, как инфаркт миокарда, диссеминированное внутрисосудистое свёртывание (генерализованный тромбогеморрагический синдром), венозный тромбоз и эмболия лёгочной артерии. Применение высокоочищенного фактора свёртывания крови Ⅸ редко приводит к данным побочным эффектам.
Обо всех не описанных выше эффектах сообщайте лечащему врачу.
Передозировка
Симптомы передозировки препаратом фактора свёртывания крови Ⅸ человека не зарегистрированы.
При случайной передозировке препаратом Аимафикс необходимо немедленно вызвать врача.
Взаимодействие
О взаимодействии фактора свёртывания крови Ⅸ человека с другими лекарственными средствами неизвестно.
Аимафикс нельзя смешивать с другими лекарственными препаратами. Для введения препарата необходимо использовать прилагаемое оборудование или другое оборудование, предназначенное для приготовления и внутривенного введения раствора препарата, в связи с тем, что использование некачественного оборудования может приводить к адсорбции фактора свёртывания крови Ⅸ на его внутренней поверхности и, как следствие, низкой эффективности терапии.
Особые указания
Как и в случае некоторых внутривенных белковых препаратов, возможны реакции гиперчувствительности.
Препарат содержит следовые количества белков человеческой плазмы отличные от фактора свёртывания крови Ⅸ. Пациенты должны быть предупреждены о ранних симптомах реакций гиперчувствительности, включая крапивницу (в том числе генерализованную), затруднение дыхания, одышку, понижение артериального давления, и анафилактический шок.
В случае проявления данных реакций, необходимо немедленно прекратить введение препарата и обратиться к лечащему врачу. При возникновении шока необходимо следовать действующим требованиям противошоковой терапии.
После повторной терапии препаратом фактора свёртывания крови Ⅸ необходим контроль образования нейтрализующих антител (ингибиторов) в крови пациента, количество которых определяют с помощью соответствующего биологического теста.
В литературных данных описана взаимосвязь между наличием ингибитора фактора свёртывания крови IX и аллергическими реакциями. Поэтому, пациенты, ранее проявлявшие аллергические реакции, должны быть обследованы на наличие ингибиторов фактора свёртывания крови Ⅸ. Следует отметить, что для пациентов, имеющих ингибиторы фактора свёртывания крови Ⅸ, существует высокий риск развития анафилактического шока в результате последующей терапии фактором свёртывания крови IX.
В связи с возможным риском аллергических реакций, начальное введение фактора свёртывания крови Ⅸ в соответствии с предписанием врача должно проводиться под тщательным наблюдением для своевременного оказания надлежащей медицинской помощи.
Поскольку применение препаратов фактора свёртывания крови Ⅸ низкой чистоты может привести к развитию тромбоэмболических осложнений, использование препаратов фактора свёртывания крови IX может быть потенциально опасным для пациентов с признаками фибринолиза и диссеминированного внутрисосудистого свёртывания (ДВС-синдрома). Из-за потенциального риска тромбоэмболических осложнений, клинические наблюдения ранних признаков тромбоза должны проводиться с помощью подходящего биологического теста при введении препарата пациентам с болезнями печени, постоперационно и пациентам с риском тромботических осложнений или ДВС-синдромом. Эффективность применения препарата Аимафикс в каждом из указанных случаев должна оцениваться с учётом риска возможных осложнений.
При каждом введении препарата Аимафикс рекомендуется записывать номер серии препарата.
Вирусная безопасность
При изготовлении лекарственных препаратов из крови или плазмы человека применяют комплекс мер, необходимый для предотвращения возможной передачи инфекции пациентам. Данные меры включают тщательный отбор здоровых доноров, гарантирующий исключение риска инфекционного заражения доноров, а также контроль крови каждого донора и общего пула плазмы на отсутствие вирусов и инфекций. Производство препаратов крови человека также включает стадии производственной обработки крови или плазмы человека, позволяющие инактивировать или удалять вирусы. Несмотря на это, при применении лекарственных препаратов, изготовленных из крови или плазмы человека, нельзя полностью исключать вероятность передачи инфекции, в том числе, неизвестных или новых вирусов и других инфекционных агентов.
Указанные меры эффективны для таких оболочечных вирусов, как вирус иммунодефицита человека (ВИЧ-1, ВИЧ-2), вирус гепатита B, вирус гепатита C, для безоболочечного вируса гепатита A, а также оказывают ограниченное действие на безоболочечный парвовирус B19.
Парвовирус B19 является опасным вирусом для беременных женщин (риск развития внутриутробной инфекции), отдельных пациентов со слабой иммунной системой или с анемией (серповидно-клеточной или гемолитической).
Для всех пациентов, применяющих препараты фактора свёртывания крови Ⅸ человека, рекомендуется адекватная вакцинация против гепатита A и B.
Влияние на способность управлять транспортными средствами или работать с механизмами
Не оказывает влияние на способность к управлению транспортным средством, механизмами и другой деятельности, требующей высокой концентрации внимания.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения, 500 МЕ и 1000 МЕ.
Хранение
В защищённом от света месте при температуре от 2 до 8 °C. Не замораживать.
Хранить препарат в недоступном для детей месте.
Срок годности
3 года.
Не использовать препарат по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Аимафикс:
