Эксэмптия
ExemptiaРегистрационный номер
Торговое наименование
Эксэмптия
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Действующее вещество: адалимумаб — 40,000 мг.
Вспомогательные вещества: сорбитол — 8,000 мг, натрия хлорид — 4,672 мг, L-аргинина гидрохлорид — 4,000 мг, янтарная кислота — 0,944 мг, полисорбат 80 — 0,080 мг, натрия гидроксид до pH 5,2, вода для инъекций до 0,8 мл.
Описание
Прозрачный или опалесцирующий, бесцветный или слегка жёлтый раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Адалимумаб селективно связывается с фактором некроза опухоли альфа (ФНО) и нейтрализует биологическую функцию ФНО за счёт блокады взаимодействия с поверхностными клеточными р55 и р75 рецепторами к ФНО.
Также адалимумаб модулирует биологические ответные реакции, которые индуцируются или регулируются ФНО, включая изменения уровней молекул адгезии, вызывающих миграцию лейкоцитов (ELAM-1, VCAM-1 и ICAM-1 при значении IC50 0,1–0,2 нМ).
Фармакодинамика
После лечения адалимумабом наблюдалось быстрое снижение уровня острофазных показателей воспаления (С-реактивного белка (СРБ) и скорости оседания эритроцитов (СОЭ)) и уровня цитокинов (ИЛ-6) в сыворотке крови в сравнении с исходными значениями у пациентов с ревматоидным артритом (РА). Уровень матриксных металлопротеиназ (ММР-1 ММР-3) в сыворотке крови, вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща, также снизился после введения адалимумаба. У пациентов, получавших лечение адалимумабом, отмечалось, как правило, улучшение гематологических признаков хронического воспаления.
Также быстрое снижение уровня СРБ наблюдалось у пациентов с полиартикулярным ювенильным идиопатическим артритом, болезнью Крона, язвенным колитом и гнойным гидраденитом после лечения адалимумабом. У пациентов с болезнью Крона отмечалось уменьшение числа клеток, экспрессирующих маркёры воспаления толстой кишки, в том числе значительное снижение экспрессии ФНО-α. Эндоскопические исследования слизистой оболочки кишечника показали признаки заживления слизистой оболочки у пациентов, получавших лечение адалимумабом.
Фармакокинетика
Всасывание и распределение
После подкожного введения однократной дозы 40 мг адалимумаба наблюдалось медленное всасывание и распределение с достижением максимальной концентрации в сыворотке крови примерно через 5 дней после введения. Средняя абсолютная биодоступность адалимумаба после подкожного введения однократной дозы 40 мг, рассчитанная на основании данных трёх исследований, составила 64 %. После внутривенного введения однократных доз в диапазоне от 0,25 до 10 мг/кг концентрации были пропорциональны дозе. После введения дозы 0,5 мг/кг (~40 мг) клиренс находился в пределах от 11 до 15 мл/ч, объём распределения (Vss) находился в пределах от 5 до 6 л, а средняя терминальная фаза полувыведения составила около 2 недель. Концентрация адалимумаба в синовиальной жидкости у нескольких пациентов с ревматоидным артритом колебалась в пределах от 31 до 96 % относительно концентрации в сыворотке крови.
После подкожного введения дозы 40 мг адалимумаба один раз в две недели у взрослых пациентов с ревматоидным артритом (РА) средняя минимальная равновесная концентрация составила около 5 мкг/мл (без сопутствующего лечения метотрексатом) и от 8 до 9 мкг/мл (при сопутствующем лечении метотрексатом) соответственно. Минимальный равновесный уровень адалимумаба увеличивался почти пропорционально дозе после подкожного введения доз 20, 40 и 80 мг один раз в две недели и один раз в неделю.
После подкожного введения дозы 24 мг/м2 (до максимальной дозы 40 мг) один раз в две недели у пациентов с ювенильным идиопатическим артритом (ЮНА) в возрасте от 4 до 17 лет средняя минимальная равновесная концентрация (значения, измеренные с 20 по 48 неделю) адалимумаба в сыворотке крови составила 5,6±5,6 мкг/мл (102 % коэффициент вариации (КВ)) при применении адалимумаба без сопутствующего лечения метотрексатом и 10,9 ± 5,2 мкг/мл (47,7 % коэффициент вариации) при сопутствующем лечении метотрексатом.
У пациентов с ЮИА в возрасте от 2 до 4 лет или от 4 лет и старше с массой тела <15 кг, получивших адалимумаб в дозе 24 мг/м2, средняя минимальная равновесная концентрация адалимумаба в сыворотке крови составила 6,0 ± 6,1 мкг/мл (101 % КВ) при применении адалимумаба без сопутствующего лечения метотрексатом и 7,9 ± 5,6 мкг/мл (71,2 % КВ) при сопутствующем лечении метотрексатом.
После подкожного введения дозы 24 мг/м2 (до максимальной дозы 40 мг) один раз в две недели у пациентов с энтезит-ассоциированным артритом, в возрасте от 6 до 17 лет средняя минимальная равновесная концентрация (значения, измеренные на 24-й неделе) адалимумаба в сыворотке крови составила 8,8 ± 6,6 мкг/мл при применении адалимумаба без сопутствующего лечения метотрексатом и 11,8 ± 4,3 мкг/мл при сопутствующем лечении метотрексатом.
После подкожного введения 40 мг адалимумаба один раз в две недели взрослым пациентам с аксиальным спондилоартритом без рентгенологически подтверждённого анкилозирующего спондилита средняя (±SD) равновесная концентрация на 68 неделе составила 8,0 ± 4,6 мкг/мл.
У взрослых пациентов с псориазом средняя минимальная равновесная концентрация составила 5 мкг/мл при монотерапии адалимумабом 40 мг один раз в две недели. После подкожного введения 0,8 мг/кг (максимум до 40 мг) адалимумаба один раз в две недели детям с хроническим бляшечным псориазом (средняя равновесная концентрация (±SD) составила приблизительно 7,4 ± 5,8 мкг/мл (79 % КВ).
У взрослых пациентов с гнойным гидраденитом при введении дозы 160 мг адалимумаба на 0-й неделе и затем 80 мг на 2-й неделе была достигнута минимальная концентрация адалимумаба в сыворотке крови приблизительно от 7 до 8 мкг/мл на 2 и 4 неделе. Средняя минимальная равновесная концентрация с 12 по 36 неделю составила около 8–10 мкг/мл при лечении адалимумабом 40 мг один раз в неделю.
Изучение воздействия адалимумаба у детей с гнойным гидраденитом проводилось с использованием метода фармакокинетического моделирования и моделирования на основе фармакокинетических исследований у детей с другими заболеваниями, которые получали лечение адалимумабом (хронический бляшечный псориаз, ювенильный идиопатический артрит, болезнь Крона и энтезит-ассоциированный артрит). Полученные данные оказались сопоставимы среди указанных групп пациентов. Рекомендованная доза у детей с гнойным гидраденитом 40 мг один раз в 2 недели. Ввиду того, что воздействие адалимумаба зависит от массы тела, дети с большой массой тела и недостаточным ответом на терапию адалимумабом могут получать взрослую дозу 40 мг 1 раз в неделю. У пациентов с болезнью Крона, при введении индукционной дозы 80 мг адалимумаба на 0 неделе, далее 40 мг адалимумаба на 2 неделе, концентрация адалимумаба в сыворотке крови составляет приблизительно 5,5 мкг/мл во время индукционного периода.
При введении индукционной дозы 160 мг адалимумаба на 0 неделе и затем 80 мг адалимумаба на 2 неделе была достигнута минимальная концентрация адалимумаба в сыворотке крови около 12 мкг/мл в течение индукционного периода. Средний минимальный равновесный уровень около 7 мкг/мл наблюдался у пациентов с болезнью Крона (БК), получавших поддерживающую дозу 40 мг адалимумаба один раз в две недели. У пациентов детского возраста с БК средней или тяжёлой степени тяжести открыто введённая индукционная доза адалимумаба составляла 160/80 мг или 80/40 мг на 0 и 2 неделе, соответственно, в зависимости от массы тела >40 кг или <40 кг. На 4 неделе пациенты были рандомизированы 1:1 либо в группу поддерживающего лечения стандартными дозами (40/20 мг один раз в две недели), либо низкими дозами (20/10 мг) один раз в две недели в зависимости от их массы тела. Средний уровень (±SD) минимальной остаточной концентрации адалимумаба в сыворотке крови, достигнутый на 4 неделе, составил 15,7 ± 6,6 мкг/мл у пациентов с массой тела >40 кг (160/80 мг) и 10,6 ± 6,1 мкг/мл у пациентов с массой тела <40 кг (80/40 мг).
У пациентов, продолживших свою терапию после рандомизации, на 52 неделе среднее значение (±SD) минимальной остаточной концентрации адалимумаба составило 9,5 ± 5,6 мкг/мл в группе стандартных доз и 3,5 ± 2,2 мкг/мл в группе низких доз. Среднее значение минимальной остаточной концентрации стабильно поддерживалось у пациентов, продолживших лечение адалимумабом один раз в две недели в течение 52 недель. У пациентов, которым увеличили кратность приёма дозы от одного раза в две недели до одного раза в неделю, средняя (±SD) концентрация адалимумаба в сыворотке крови на 52 неделе составила 15,3 ± 11,4 мкг/мл (40/20 мг, один раз в неделю) и 6,7 ± 3,5 мкг/мл (20/10 мг, один раз в неделю).
У взрослых пациентов с язвенным колитом при применении индукционной дозы 160 мг адалимумаба на 0 неделе и затем 80 мг адалимумаба на 2 неделе была достигнута минимальная концентрация адалимумаба в сыворотке крови около 12 мкг/мл в течение индукционного периода. Среднее равновесное значение минимальной остаточной концентрации составило около 8 мкг/мл наблюдался у пациентов с язвенным колитом, получавших поддерживающую дозу 40 мг адалимумаба один раз в две недели. После подкожного введения дозы, с учётом массы тела, 0,6 мг/кг (но не более 40 мг), 1 раз в 2 недели у детей с язвенным колитом средняя (±SD) равновесная концентрация адалимумаба в сыворотке составляла 5,0 ± 3,3 мкг/мл на 52 неделе. Для пациентов, которые получали дозу 0,6 мг/кг (не более 40 мг) каждую неделю, средняя (±SD) равновесная концентрация адалимумаба в сыворотке составляла 15,7 ± 5,6 мкг/мл на 52 неделе.
У взрослых пациентов с увеитом, при применении индукционной дозы 80 мг адалимумаба на 0 неделе затем по 40 мг адалимумаба 1 раз в 2 недели, начиная через 1 неделю после начала терапии, средняя равновесная концентрация составляет приблизительно от 8 до 10 мкг/мл.
У детей с увеитом проводилось популяционное фармакокинетическое моделирование и моделирование на основе фармакокинетических данных у других пациентов детского возраста (псориаз, ювенильный идиопатический артрит, болезнь Крона и активный энтезит- ассоциированный артрит). Данные о клиническом применении индукционной дозы у детей в возрасте до 6 лет отсутствуют. На основании прогнозируемой экспозиции адалимумаба при применении без метотрексата, предполагается, что индукционная доза может привести к увеличению системного воздействия.
Фармакокинетические данные, полученные в клинических исследованиях и при фармакокинетическом/фармакодинамическом моделировании позволяют предположить сопоставимые результаты экспозиции адалимумаба и эффективности у пациентов, получавших 80 мг адалимумаба 1 раз в 2 недели в сравнении с 40 мг 1 раз в неделю (включая взрослых пациентов с РА. гнойным гидраденитом, язвенным колитом, болезнью Крона или псориазом, детей с гнойным гидраденитом, и детей с массой тела >40 кг с болезнью Крона и язвенным колитом).
У японских пациентов с интестинальной формой болезни Бехчета приём индукционной дозы адалимумаба 160 мг на неделе 0, далее 80 мг на неделе 2 позволяет достичь минимальных концентраций адалимумаба в сыворотке крови — около 13 мкг/мл в течение периода индукции. Средние минимальные равновесные остаточные концентрации, равные приблизительно 9 мкг/мл, наблюдались у японских пациентов с интестинальной формой болезни Бехчета, которые получали поддерживающую дозу адалимумаба 40 мг 1 раз в 2 недели.
Зависимость фармакологического эффекта от экспозиции у детей
На основании клинических данных, полученных у детей с ЮНА и активным энтезит- ассоциированным артритом, зависимость фармакологического эффекта от экспозиции устанавливалась между концентрацией в плазме крови и ответом RedACR 50. Эффективная концентрация адалимумаба, которая даёт половину максимальной вероятности ответа RedACR 50 (ЕС50), составила 3 мкг/мл (95 % ДИ: 1–6 мкг/мл).
Зависимость фармакологического эффекта от экспозиции адалимумаба между концентрацией адалимумаба и эффективостью у детей с тяжелым хроническим бляшечным псориазом были установлены для достижения PASI 75 и PGA (Physician Global Assessment, общая оценка врачом) чистая или почти чистая кожа. Достижение показателей PAST 75 и PGA чистая или почти чистая кожа повышается с увеличением концентрации адалимумаба в плазме крови, ЕС50 для обоих показателей составляет приблизительно 4,5 мкг/мл (95 % ДИ 0,4–47,6 и 1,9–10,5, соответственно).
Выведение
В ходе популяционного фармакокинетического анализа данных, полученных для более чем 1300 пациентов с РА, была выявлена тенденция к более высокому кажущемуся клиренсу при увеличении массы тела. После учёта весовых различий, пол и возраст оказывали минимальный эффект на клиренс адалимумаба. Более низкий уровень свободного адалимумаба в сыворотке крови (не связанного с антителами к адалимумабу) отмечался у пациентов с обнаруживаемыми антителами к адалимумабу.
Особые группы пациентов
Нарушение функции печени или почек
Исследования адалимумаба у пациентов с нарушением функции печени или почек не проводились.
Показания
Взрослые
- Среднетяжёлый и тяжёлый активный ревматоидный артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами). В комбинации с метотрексатом адалимумаб снижает скорость прогрессирования повреждения суставов (по данным рентгенографического исследования) и улучшает функциональную активность.
- Активный анкилозирующий спондилит.
- Тяжёлый аксиальный спондилоартрит без рентгенологически подтверждённого анкилозирующего спондилита, но при наличии объективных признаков воспаления по повышенному уровню СРБ и/или данным МРТ, при отсутствии адекватного ответа на лечение нестероидными противовоспалительными препаратами или их непереносимости.
- Активный псориатический артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами).
- Хронический бляшечный псориаз (среднетяжёлой и тяжёлой степени), псориаз ногтей, когда показана системная терапия.
- Активный гнойный гидраденит (acne inversa) средней или тяжёлой степени тяжести у взрослых пациентов при отсутствии адекватного ответа на стандартную системную терапию.
Болезнь Крона (среднетяжёлой или тяжёлой степени):
⁃ при неадекватном ответе на традиционную терапию, а также непереносимости или противопоказаниях к традиционной терапии;
⁃ при неэффективности (или снижении эффективности) или непереносимости инфликсимаба.
- Язвенный колит среднетяжёлой и тяжёлой степени при неадекватном ответе на традиционную терапию, включая кортикостероиды и/или 6-меркаптопурин или азатиоприн, а также при непереносимости или противопоказаниях к традиционной терапии.
- Неинфекционный увеит (промежуточный, задний и панувеит) у взрослых при неадекватном ответе на терапию глюкокортикостероидами, в ситуациях, когда необходимо ограничение дозы или отмена глюкокортикостероидов, а также когда терапия глюкокортикостероидами противопоказана.
- Болезнь Бехчета (интестинальная форма) у пациентов при отсутствии адекватного ответа на стандартную терапию.
Дети
- Ювенильный идиопатический артрит у пациентов от 2 лет в режиме монотерапии или в комбинации с метотрексатом.
- Активный энтезит-ассоциированный артрит у пациентов в возрасте от 6 лети старше при отсутствии адекватного ответа на терапию стандартными препаратами или их непереносимости.
- Хронический бляшечный псориаз (тяжёлой степени) у детей с 4 лет при неадекватном ответе на местную терапию или фототерапию, а также у пациентов, которым местная терапия и фототерапия противопоказаны.
- Болезнь Крона (среднетяжёлой или тяжёлой степени) у пациентов от 6 лет и старше при неадекватном ответе на традиционную терапию (включая полное энтеральное питание и глюкокортикостероиды и/или иммуносупрессоры), а также непереносимости или противопоказаниях к традиционной терапии.
- Неинфекционный передний увеит у детей от 2 лет при неадекватном ответе на стандартную терапию или когда стандартная терапия не подходит таким пациентам.
- Активный гнойный гидраденит (acne inversa) средней или тяжёлой степени тяжести у детей от 12 лет при отсутствии адекватного ответа на стандартную системную терапию.
- Язвенный колит среднетяжёлой и тяжёлой степени у детей от 5 лет при неадекватном ответе на традиционную терапию, включая кортикостероиды и/или 6-меркаптопурин или азатиоприн, а также при непереносимости или противопоказаниях к традиционной терапии.
Противопоказания
- Гиперчувствительность к адалимумабу или любым вспомогательным компонентам.
- Детский возраст до 18 лет (кроме пациентов от 2 лет с ювенильным идиопатическим артритом, пациентов от 6 лет и старше с болезнью Крона (среднетяжёлой и тяжёлой степени), пациентов от 6 лет с активным энтезит-ассоциированным артритом, пациентов от 4 лет с хроническим бляшечным псориазом, пациентов от 12 лет с активным гнойным гидраденитом, пациентов от 2 лет с неинфекционным передним увеитом, пациентов от 5 лет с язвенным колитом среднетяжёлой и тяжёлой степени).
- Инфекционные заболевания, в том числе туберкулёз.
- Совместный приём с антагонистами ФИО или другими генно-инженерными биологическими противоревматическими препаратами (например, анакинра или абатацепт).
- Сердечная недостаточность средней тяжести или тяжёлой степени (III/IV функциональный класс NYHA).
С осторожностью
- Рецидивирующие инфекции в анамнезе.
- Носительство вируса гепатита B.
- Злокачественные новообразования, в том числе в анамнезе.
- Сердечная недостаточность лёгкой степени тяжести (Ⅰ/Ⅱ функциональный класс по классификации NYHA).
- Демиелинизирующие заболевания нервной системы, в том числе в анамнезе.
- Пациенты старше 65 лет.
Применение при беременности и в период грудного вскармливания
Женщины, способные к деторождению
Женщинам, способным к деторождению, необходимо использовать адекватные методы контрацепции для предотвращения беременности и продолжать их применение в течение по крайней мере 5 месяцев после последнего введения адалимумаба.
Беременность
В исследовании эмбрио- и фетотоксического действия, проведённом на яванских макаках с использованием адалимумаба в дозах до 100 мг/кг (в 373 раза выше экспозиции (AUC) у человека при подкожном введении 40 мг), признаков негативного воздействия препарата на плод не выявлено.
В проспективное когортное исследование действия адалимумаба во время беременности было включено 257 женщин с ревматоидным артритом (РА) или болезнью Крона, получавших лечение адалимумабом, по крайней мере, в течение первого триместра беременности, а также 120 женщин с РА или болезнью Крона, не проходивших терапию адалимумабом.
Не было выявлено (стандартизированное отношение шансов 0,84, 95 % ДИ от 0,34 до 2,05) статистически значимых различий в общей частоте тяжёлых врождённых пороков развития, включённых в основной критерий оценки безопасности, а также по показателям дополнительного критерия оценки безопасности, которые включают слабовыраженные врождённые пороки развития, самопроизвольный аборт, преждевременные роды, низкую массу тела у новорождённых и тяжёлые или оппортунистические инфекции. О случаях мертворождения или злокачественных новообразованиях не сообщалось.
Несмотря на то, что в регистрационном исследовании отмечают недостатки методики, включая небольшой размер выборки и отсутствие рандомизации, полученные данные не демонстрируют повышенного риска развития неблагоприятных исходов беременности у женщин с РА или болезнью Крона, получавших лечение адалимумабом, по сравнению с женщинами с РА или болезнью Крона, не получавшими лечения адалимумабом. При этом данные пострегистрационного наблюдения не указывают на наличие риска, связанного с приёмом препарата.
Адалимумаб является ингибитором ФНО-α. Применение адалимумаба во время беременности может повлиять на иммунный ответ у новорождённых. Применять Адалимумаб во время беременности следует только при очевидной необходимости.
Адалимумаб может проникать через плаценту в сыворотку крови новорождённых детей от женщин, которые получали препарат во время беременности. Следовательно, у этих детей может быть повышен риск развития инфекции. Младенцам, которые подвергались воздействию адалимумаба внутриутробно, не рекомендуется введение живых вакцин в течение 5 месяцев после последней инъекции адалимумаба у матери во время беременности.
Роды и родоразрешенне
На сегодняшний день данные о влиянии адалимумаба на роды и родоразрешение отсутствуют.
Грудное вскармливание
Ограниченные данные из публикаций указывают на то, что адалимумаб выводится с грудным молоком в очень низких концентрациях: от 0,1 до 1 % от соответствующего уровня в сыворотке крови матери. Иммуноглобулины G, принимаемые перорально, подвергаются протеолитическому расщеплению в кишечнике и обладают низкой биодоступностью; это позволяет предположить, что системное воздействие адалимумаба на новорождённого при грудном вскармливании маловероятно. Поэтому пользу грудного вскармливания для развития и здоровья ребёнка следует рассматривать с учётом клинической необходимости лечения адалимумабом у матери и вероятности развития побочных эффектов вследствие воздействия адалимумаба на ребёнка, находящегося на грудном вскармливании, или по причине сопутствующего заболевания матери.
Способ применения и дозы
Подкожно.
Лечение препаратом Эксэмптия® проводится под контролем врача. Если врач считает это возможным, то после соответствующего обучения технике подкожных инъекций, пациенты могут самостоятельно вводить себе препарат.
Препарат Эксэмптия® вводят подкожно в область бедра или живота. Места инъекций следует чередовать. Недопустимо вводить новые инъекции на участках с чувствительной, повреждённой, покрасневшей или уплотнённой кожей.
Раствор следует осмотреть перед введением на предмет наличия посторонних частиц и изменения цвета.
Препарат Эксэмптия® не следует смешивать в одном шприце или флаконе с любыми другими лекарственными препаратами. Оставшийся раствор и использованные материалы следует утилизировать.
Если очередная инъекция препарата Эксэмптия® была случайно пропущена, необходимо провести инъекцию сразу, как только это будет обнаружено. Следующая инъекция должна быть проведена в соответствии с запланированным ранее графиком.
Может возникнуть необходимость во временном прекращении применения препарата, например, перед хирургическим вмешательством или в случае развития серьёзного инфекционного заболевания. Согласно имеющимся данным, возобновление лечения препаратом Эксэмптия® после его отмены в течение 70 дней или более вызвало клинический ответ такой же интенсивности, как до прекращения приёма препарата, с аналогичным профилем безопасности.
Взрослые
Ревматоидный артрит (РА), псориатический артрит (ПсА), анкилозирующий спондилит (АС), тяжёлый аксиальный спондилоартрит без рентгенологически подтверждённого анкилозирующего спондилита (аксиал СпА)
Рекомендуемая доза препарата Эксэмптия® у взрослых с ревматоидным артритом (РА), псориатическим артритом (ПсА) и анкилозирующим спондилитом (АС) и тяжёлым аксиальным спондилоартритом без рентгенологически подтверждённого анкилозирующего спондилита (аксиал СпА) составляет 40 мг подкожно 1 раз в 2 недели. При назначении препарата Эксэмптия® терапия глюкокортикостероидами (ГКС), нестероидными противовоспалительными препаратами (НПВП) (в том числе салицилатами), анальгетиками (наркотическими и ненаркотическими), метотрексатом и другими базисными противоревматическими препаратами может быть продолжена.
У некоторых пациентов с ревматоидным артритом, не получающих метотрексат, дополнительный эффект может быть достигнут при увеличении кратности применения препарата Эксэмптия® до 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели.
По всем указанным выше показаниям, согласно имеющимся данным, клинический ответ, как правило, достигается в течение 12 недель лечения. Следует тщательно пересмотреть продолжение терапии у пациента, не достигающего ответа на лечение в течение данного периода времени.
Болезнь Крона
Рекомендуемый режим дозирования препарата Эксэмптия® для взрослых с болезнью Крона — 160 мг в 1-й день (применяется по четыре инъекции по 40 мг в день или по две инъекции по 40 мг в день последовательно в течение двух дней), через 2 недели (на 15-й день) — 80 мг, ещё через 2 недели (29-й день) начинают применять поддерживающую дозу — 40 мг 1 раз в 2 недели. При назначении препарата Эксэмптия® терапия аминосалицилатами, ГКС и/или иммуномодуляторами (например, 6-меркаптопурин и азатиоприн) может быть продолжена.
Пациенты, наблюдающие уменьшение ответа на лечение препаратом, могут получить дополнительный эффект от увеличения частоты введения препарата Эксэмптия® до 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели.
Некоторые пациенты могут не отвечать на терапию препаратом Эксэмптия® в течение первых 4 недель, однако лечение следует продолжить, так как положительный эффект может быть достигнут в течение 12 недель. Решение о прекращении терапии может быть принято в случае, если не получает эффекта от лечения в течение этого периода.
Во время поддерживающей терапии препаратом Эксэмптия® дозу глюкокортикостероидов можно постепенно уменьшать в соответствии с имеющимися клиническими руководствами по лечению болезни Крона.
Язвенный колит
Начальная (индукционная) доза для взрослых со среднетяжёлой и тяжёлой степенью язвенного колита составляет 160 мг исходно (доза может быть введена в виде четырёх инъекций в один день или в виде двух инъекций в сутки в течение двух дней подряд) и 80 мг через 2 недели. После индукционной дозы рекомендуемая поддерживающая доза составляет 40 мг, которая вводится в виде регулярных подкожных инъекций с интервалом в 2 недели. Во время лечения препаратом Эксэмптия® терапия аминосалицилатами, глюкокортикостероидами и/или иммуномодуляторами (например, 6-меркаптопурином и азатиоприном) может быть продолжена.
Во время поддерживающей терапии препаратом Эксэмптия® дозу глюкокортикостероидов можно постепенно снижать в соответствии с имеющимися клиническими руководствами по лечению язвенного колита.
Пациенты, у которых наблюдается уменьшение ответа на лечение препаратом, могут получить дополнительный эффект от увеличения частоты введения препарата Эксэмптия® до 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели.
Имеющиеся данные свидетельствуют о том, что клинический эффект обычно достигается в течение 2–8 недель лечения. Лечение препаратом Эксэмптия® следует продолжать только у пациентов, у которых наблюдается терапевтический эффект в течение первых 8 недель терапии.
Хронический бляшечный псориаз и псориаз ногтей
Начальная доза для взрослых пациентов составляет 80 мг.
Поддерживающая доза — по 40 мг 1 раз в 2 недели, начиная через неделю после начальной дозы.
Следует тщательно пересмотреть продолжение терапии в период свыше 16 недель у пациента, не достигающего ответа в течение данного периода времени.
Если через 16 недель терапии у пациента не наблюдается адекватный ответ на терапию, то частота применения препарата может быть увеличена (40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели). В течение данного периода следует проводить оценку пользы применения и риска нежелательных явлений. Если адекватный ответ достигнут при частоте применения препарата 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели, то далее можно вернуться к обычной поддерживающей дозе (40 мг 1 раз в 2 недели).
Активный гнойный гидраденит (acne inversa)
Рекомендуемый режим дозирования для препарата Эксэмптия® у взрослых пациентов с гнойным гидраденитом (ГГ) включает начальную дозу 160 мг в 1 день (возможно введение четырёх инъекций по 40 мг в течение одних суток или двух инъекций по 40 мг в сутки в течение двух дней подряд) и затем на 15 день (через две недели) — 80 мг (введении двух инъекций по 40 мг в течение одних суток). Через две недели (29 день) продолжают введение дозы 40 мг один раз в неделю или 80 мг 1 раз в 2 недели (введение 2х инъекций по 40 мг в течение одних суток). При необходимости, приём антибиотиков во время лечения препаратом Эксэмптия® может быть продолжен.
Во всех исследованиях пациенты применяли ежедневно наружные антисептики. Во время лечения препаратом Эксэмптия® пациентам рекомендуется ежедневно промывать места поражений ГГ местным антисептическим средством.
Следует тщательно пересмотреть продолжение терапии в период свыше 12 недель у пациентов, не достигающих улучшений в течение данного периода времени.
При необходимости временного прекращения лечения, приём препарата Эксэмптия" в дозе 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели может быть возобновлён.
Следует периодически выполнять оценку соотношения пользы и риска продолжения длительного лечения.
Увеит
Рекомендуемый режим дозирования для препарата Эксэмптия® у взрослых пациентов с увеитом включает начальную дозу 80 мг, затем по 40 мг 1 раз в две недели, начиная через неделю после применения начальной дозы. Существует ограниченный опыт начала терапии препаратом Эксэмптия® в режиме монотерапии. Лечение препаратом Эксэмптия® может быть начато в комбинации с глюкокортикостероидами и/или с другими небиологическими иммуномодулирующими средствами. Доза глюкокортикостероидов может быть постепенно снижена до полной отмены в соответствии с устоявшейся клинической практикой, начало снижения дозы глюкокортикостероидов — через 2 недели после начала лечения препаратом Эксэмптия®. Рекомендуется ежегодно оценивать пользу и риск продолжения длительного лечения.
Болезнь Бехчета (интестинальная форма)
Начальная доза у взрослых составляет 160 мг. Далее через 2 недели следует снизить дозу до 80 мг. Через 4 недели после начала терапии следует перейти на поддерживающую терапию 40мг 1 раз в 2 недели.
Дети
Объём для инъекции выбирается исходя из массы тела Пациента.
Для пациентов, которым необходимо введение менее 40 мг препарата, на этикетке шприца предусмотрена риска 20 мг.
Ювенильный идиопатический артрит
Дозы препарата Эксэмптия® для пациентов с ювенильным идиопатическим артритом в возрасте от 2 лет и старше представлены в таблице 1. Доза подбирается в зависимости от массы тела пациента.
При назначении препарата Эксэмптия® терапия метотрексатом, глюкокортикостероидами, нестероидными противовоспалительными препаратами и/или анальгетиками может быть продолжена.
Препарат Эксэмптия® при ювенильном идиопатическом артрите назначают 1 раз в 2 недели.
Таблица 1. Дозы препарата Эксэмптия® при ювенильном идиопатическом артрите:
| Масса тела | Рекомендованная доза |
| От 10 до 30 кг | 20 мг 1 раз в 2 недели |
| ≥30 кг | 40 мг 1 раз в 2 недели |
Клинический ответ обычно достигается в течение 12 недель лечения. Решение о прекращении терапии может быть принято в случае, если пациент не получает эффекта от лечения в течение этого периода.
Применение препарата Эксэмптия® у детей младше 2 лет с ювенильным идиопатическим артритом или у детей с массой тела менее 10 кг не изучалось.
Энтезит-ассоциированный артрит
Доза препарата Эксэмптия® для пациентов с энтезит-ассоциированным артритом, в возрасте от 6 лег и старше представлена в таблице 2. Доза подбирается в зависимости от массы тела пациента.
Таблица 2. Дозы препарата Эксэмптия® при энтезит-ассоциированном артрите у детей:
| Масса тела | Рекомендованная доза |
| От 15 до 30 кг | 20 мг 1 раз в 2 недели |
| ≥30 кг | 40 мг 1 раз в 2 недели |
Применение препарата Эксэмптия® у пациентов с энтезит-ассоциированным артритом, в возрасте до 6 лет не изучалось.
Болезнь Крона
Дозы препарата Эксэмптия® для пациентов с болезнью Крона в возрасте от 6 лет до 17 лет представлены в таблице 3. Доза подбирается в зависимости от массы тела пациента.
Таблица 3. Дозы препарата Эксэмптия® при болезни Крона у детей:
| Масса тела |
| Начальная доза | Поддерживающая доза, начиная с 4 недели |
| <40 кг |
| 80 мг в первый день 40 мг через 2 недели | 20 мг 1 раз в 2 недели |
| ≥40 кг |
| 160 мг в первый день 80 мг через 2 недели | 40 мг 1 раз в 2 недели |
Пациенты, у которых наблюдается уменьшение ответа на лечение препаратом, могут получить дополнительный эффект от увеличения дозы препарата Эксэмптия®:
- пациенты с массой тела менее 40 кг: 20 мг 1 раз в неделю;
- пациенты с массой тела 40 кг и более: 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели. Применение препарата Эксэмптия® у детей младше 6 лет с болезнью Крона не изучалось.
Активный гнойный гидраденит (acne inversa) у детей с 12 лет, массой тела не менее 30 кг
Рекомендуемая доза составляет 80 мг (стартовая доза), далее назначается поддерживающая доза — 40 мг 1 раз в 2 недели, начиная через одну неделю после стартовой дозы.
В случае отсутствия адекватного ответа на терапию при применении поддерживающей дозы 40 мг 1 раз в 2 недели, следует рассмотреть увеличение дозы препарата — 40 мг 1 раз в неделю или 80 мг 1 раз в 2 недели.
При необходимости, во время применения препарат Эксэмптия® может быть продолжена терапия антибиотиками.
Во время лечения препаратом Эксэмптия® рекомендуется ежедневное применение наружных антисептических средства на участках воспалительных кожных элементов.
Следует тщательно оценить необходимость продолжения лечения препаратом Эксэмптия®, в случае отсутствия ответа на терапию в течение 12 недель. В случае прерывания терапии препаратом Эксэмптия® возможно возобновить лечение по схеме, указанной выше.
В случае продолжительного лечения препаратом Эксэмптия® следует периодически оценивать пользу применения препарата в соотношении к возможному риску.
Клинические исследования препарата Эксэмптия® у детей с гнойным гидраденитом не проводились. Дозирование препарата Эксэмптия® у данных пациентов было определено на основании фармакокинетического моделирования и симуляции.
Данные о применении препарата Эксэмптия® у детей младше 12 лет с активным гнойным гидраденитом отсутствуют.
Хронический бляшечный псориаз
Рекомендованный режим дозирования препарата Эксэмптия® у детей от 4 до 17 лет представлен в таблице 4 ниже.
Доза подбирается в зависимости от массы тела.
Таблица 4. Дозы препарата Эксэмптия® при бляшечном псориазе у детей:
| Масса тела | Рекомендованная доза |
| От 15 до 30 кг | Начальная доза и доза, вводимая через 1 неделю после первой инъекции, составляет 20 мг. Через 2 недели после второй инъекции следует перейти на поддерживающую терапию в дозе 20 мг 1 раз в 2 недели. |
| ≥30 кг | Начальная доза и доза, вводимая через 1 неделю после первой инъекции, составляет 40 мг. Через 2 недели после второй инъекции следует перейти на поддерживающую терапию в дозе 40 мг 1 раз в 2 недели. |
Если пациент не отвечает на терапию в течение 16 недель терапии, то необходимо тщательно рассмотреть вопрос о необходимости продолжения лечения.
При повторной терапии хронического бляшечного псориаза у детей препаратом Эксэмптия® необходимо следовать такому же режиму дозирования.
Данные о применении препарата Эксэмптия1' у детей младше 4 лет с хроническим бляшечным псориазом отсутствуют.
Увеит
Данные о применении препарата у детей младше 2 лет с увеитом отсутствуют. Перед началом лечения рекомендуется оценить пользу и возможные риски длительной терапии. Опыта применения препарата Эксэмптия® у детей для лечения увеита без метотрексата нет.
Доза подбирается в зависимости от массы тела.
Дети с массой тела <30 кг:
рекомендованная доза препарата Эксэмптия® составляет 20 мг 1 раз в 2 недели в комбинации с метотрексатом. Возможно применение начальной дозы 40 мг за 1 неделю до начала поддерживающей терапии. Нет данных о применении начальной дозы 40 мг у детей младше 6 лет.
Дети с массой тела ≥30 кг:
рекомендованная доза препарата Эксэмптия® составляет 40 мг 1 раз в 2 недели в комбинации с метотрексатом. Возможно применение начальной дозы 80 мг за 1 неделю до начала поддерживающей терапии.
Язвенный колит
Рекомендованный режим дозирования препарата Эксэмптия® у детей с язвенным колитом от 5 до 17 лет представлен в таблице 5 ниже.
Доза подбирается в зависимости от массы тела пациента.
Таблица 5. Дозы препарата Эксэмптия® у детей с язвенных колитом:
| Масса тела |
| Начальная доза | Поддерживающая доза, начиная с 4 недели |
| <40 кг |
| 80 мг в первый день 40 мг через 2 недели | 40 мг 1 раз в 2 недели или 20 мг 1 раз в неделю |
| ≥40 кг |
| 160 мг в первый день 80 мг через 2 недели | 80 мг 1 раз в 2 недели или 40 мг 1 раз в неделю |
Пациентам, которым исполнилось 18 лет во время терапии препаратом Эксэмптия®, следует продолжать приём назначенной поддерживающей дозы.
Если пациент не отвечает на терапию в течение 8 недель терапии, то необходимо тщательно рассмотреть вопрос о необходимости продолжения лечения.
В случае рецидива заболевания на фоне поддерживающей терапии может быть оправданным назначение повторной индукционной дозы: 80 мг однократно (для пациентов <40 кг) или 160 мг однократно (для пациентов ≥40 кг) с последующей поддерживающей дозой, как указано в таблице 5.
Данные о применении препарата Эксэмптия® у детей младше 5 лет с язвенным колитом отсутствуют.
Особые группы пациентов
Пациенты в возрасте 65 лет и старше
В клинических исследованиях 9,4 % пациентов были в возрасте 65 лет и старше, и приблизительно 2,0 % в возрасте 75 лет и старше. Отличий в эффективности не наблюдалось между данными группами пациентов. Коррекция дозы для данной категории пациентов не требуется.
Инструкция по подготовке и проведению инъекции препарата Эксэмптия® в однодозовом шприце
1) Подготовка.
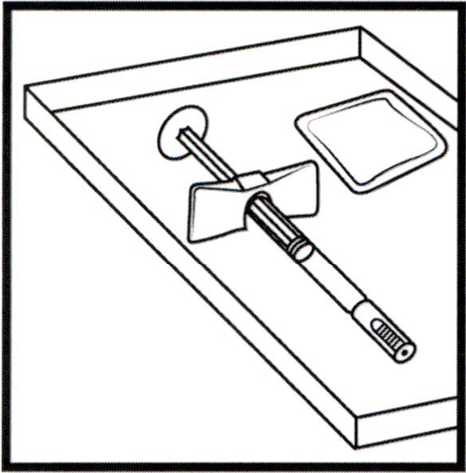
- Тщательно вымойте руки.
- Достаньте из упаковки и положите на чистую поверхность один шприц с препаратом Эксэмптия® и одну пропитанную спиртом салфетку.
- Убедитесь, что срок хранения препарата Эксэмптия®, указанный на шприце, не истёк.
- Препарат Эксэмптия® представляет собой прозрачный, бесцветный раствор. Не используйте препарат, если жидкость мутная, содержит хлопья или частицы или изменила свой цвет.
2) Выбор и подготовка места для инъекции.
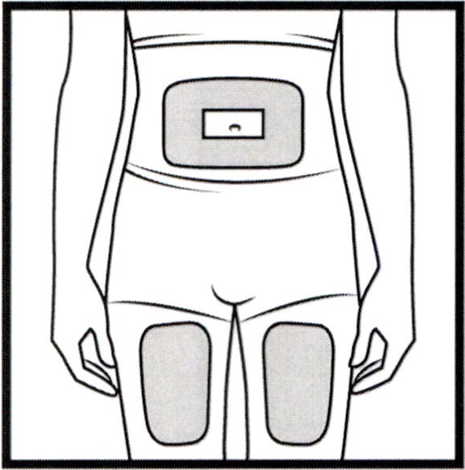
- Выберете место на животе или передней поверхности бедра.
- Места инъекций и стороны следует менять. Каждое следующее место введения должно отступать от предыдущего как минимум на 3 см.
- Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтёк. Эти признаки могут указывать на наличие инфекции.
- Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
3) Введение препарата Эксэмптия®.
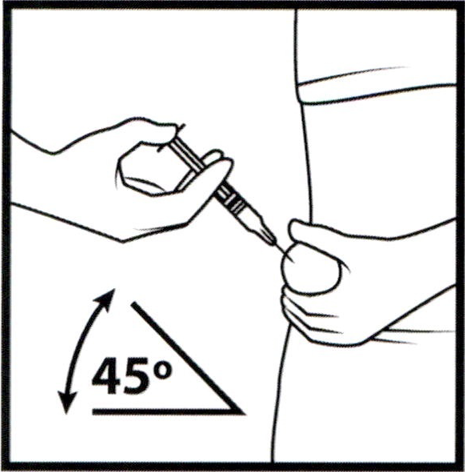
- Не встряхивайте шприц.
- Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям. Одной рукой возьмите в складку обработанную кожу.
- В другую руку возьмите шприц, держа его под углом 45° к поверхности кожи, градуированной поверхностью вверх.
- Одним быстрым движением полностью введите иглу в кожную складку.
- После введения иглы отпустите складку кожи.
- Введите весь раствор в течение 2–5 секунд.
- После введения раствора (когда шприц будет пустым) извлеките иглу из кожи под тем же углом.
- Кусочком марли слегка прижмите область инъекции в течение 10 секунд, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
- После инъекции шприц повторно не использовать.
Побочное действие
Краткий обзор профиля безопасности
Наиболее часто сообщалось о таких нежелательных реакциях, как инфекции (например, назофарингит, инфекции верхних дыхательных путей и синусит), реакции в месте инъекции (эритема, зуд, кровотечение, боль или отёк), головная боль и костно-мышечные боли. Сообщалось о серьёзных нежелательных реакциях при применении адалимумаба. Такие антагонисты ФНО, как препарат Эксэмптия®, влияют на иммунную систему, и их применение может повлиять на защиту организма от инфекций и рака. Также при применении адалимумаба сообщалось о смертельных и угрожающих жизни инфекциях (в том числе сепсисе, оппортунистических инфекциях и туберкулёзе), реактивации вируса гепатита B (ВГВ) и различных злокачественных опухолях (в том числе лейкемии, лимфоме и Т-клеточной лимфоме печени и селезёнки).
Сообщалось о случаях серьёзных гематологических, неврологических и аутоиммунных реакций. Они включают редкие случаи панцитопении, апластической анемии, центральных и периферических демиелинизирующих явлений, а также сообщения о волчанке, волчаночно-подобных заболеваниях и синдроме Стивенса-Джонсона.
Перечень нежелательных реакций основан на данных клинических исследований и пострегистрационного опыта применения, сведённых по классу систем органов и частоте ниже: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1 000 до <1/100), редко (от ≥1/10 000 до <1/1 000), неизвестно (невозможно оценить на основании имеющихся данных). В каждой группе явлений, распределённых по частоте, побочные эффекты представлены в порядке убывания серьёзности. Также включена наибольшая частота, наблюдавшаяся при различных показаниях.
Инфекции и инвазии*:
Очень часто — инфекции дыхательных путей (в том числе инфекции нижних и верхних дыхательных путей, пневмония, синусит, фарингит, назофарингит и вирусная пневмония, вызванная герпесом);
Часто — системные инфекции (в том числе сепсис, кандидоз и грипп), кишечные инфекции (в том числе вирусный гастроэнтерит), инфекции кожи и мягких тканей (в том числе паронихия, целлюлит, импетиго, некротизирующий фасциит и опоясывающий лишай), ушные инфекции, инфекции полости рта (в том числе простой герпес, герпетическое поражение слизистой оболочки полости рта и зубные инфекции), инфекции половых путей (в том числе вульвовагинальная грибковая инфекция), инфекции мочевыводящих путей (в том числе пиелонефрит), грибковые инфекции, инфекции суставов;
Нечасто — неврологические инфекции (в том числе вирусный менингит), оппортунистические инфекции и туберкулёз (в том числе кокцидиоидомикор, гистоплазмоз и микобактериальные инфекции, вызванные Mycobacterium avium complex), бактериальные инфекции, глазные инфекции, дивертикулит***.
Новообразования доброкачественные, злокачественные и неуточнённые (включая кисты и полипы)*:
Часто — рак кожи, за исключением меланомы (в том числе базальноклеточная карцинома и плоскоклеточный рак), доброкачественные новообразования;
Нечасто - лимфома**, солидные опухоли (в том числе рак молочной железы, новообразование в лёгких и щитовидной железе), меланома**;
Редко — лейкемия***;
Неизвестно — Т-клеточная лимфома печени и селезёнки***, карцинома из клеток Меркеля (нейроэндокринная карцинома кожи)***.
Нарушения со стороны крови и лимфатической системы*:
Очень часто — лейкопения (включая нейтропению и агранулоцитоз), анемия;
Часто — лейкоцитоз, тромбоцитопения;
Нечасто — идиопатическая тромбоцитопеническая пурпура;
Редко — панцитопения.
Нарушения со стороны иммунной системы*:
Часто — реакции гиперчувствительности, аллергические реакции (включая сезонную аллергию);
Нечасто — саркоидоз***, васкулит;
Редко — анафилаксия***.
Нарушения метаболизма и питания:
Очень часто — повышение концентрации липидов;
Часто — гипокалиемия, повышенный уровень мочевой кислоты, отклонение уровня натрия крови от нормы, гипокальциемия, гипергликемия, гипофосфатемия, обезвоживание.
Нарушения психики:
Часто — изменения настроения (включая депрессию), беспокойство, бессонница.
Нарушения со стороны нервной системы*:
Очень часто — головная боль;
Часто — парестезии (включая гипестезии), мигрень, компрессия корешка нерва;
Нечасто — нарушение мозгового кровообращения***, тремор, невропатия;
Редко — рассеянный склероз, демиелинизирующие (например, нарушения зрительного нерва, синдром Гийена-Барре)***.
Нарушения со стороны органа зрения:
Часто — нарушения зрения, конъюнктивит, блефарит, отёк глаз;
Нечасто — диплопия.
Нарушения со стороны органов слуха и равновесия:
Часто — вертиго;
Нечасто — глухота, шум в ушах.
Кардиологические нарушения *:
Часто — тахикардия;
Нечасто — аневризма аорты, окклюзия сосудов и артерий, тромбофлебит.
Нарушения со стороны сосудистой системы:
Часто — гипертония, покраснение кожи, гематома;
Нечасто — инфаркт миокарда***, аритмия, хроническая сердечная недостаточность;
Редко — остановка сердца.
Респираторные, торакальные и медиастинальные нарушения*:
Часто — астма, одышка, кашель;
Нечасто — лёгочная эмболия***, интерстициальная болезнь лёгких, хроническая лёгких, пневмонит, плевральный выпот***;
Редко — фиброз лёгких***.
Нарушения со стороны пищеварительной системы:
Очень часто — боль в животе, тошнота, рвота;
Часто — кровотечение ЖКТ, диспепсия, гастроэзофагеальная рефлюксная болезнь, синдром Шегрена;
Нечасто — панкреатит, дисфагия, отёк лица;
Редко — прободение кишечника***.
Гепатобилиарные нарушения *:
Очень часто — повышенный уровень печёночных ферментов;
Нечасто — холецистит и желчнокаменная болезнь, стеатоз печени, повышенный билирубин;
Редко — гепатит, реактивация гепатита B***, аутоиммунный гепатит***;
Неизвестно — печёночная недостаточность***.
Нарушения со стороны кожи и подкожных тканей:
Очень часто — сыпь (в том числе эксфолиативная сыпь);
Часто — ухудшение или впервые выявленный псориаз (в том числе — ладонноподошвенный пустулёзный псориаз) ***, крапивница, кровоподтёки (в том числе пурпура), дерматит (в том числе экзема), ломкость ногтевых пластинок, гипергидроз, алопеция***, зуд;
Нечасто — ночная потливость, шрамы;
Редко — экссудативная эритема***, синдром Стивенса-Джонсона, ангионевротический отёк***, кожный васкулит***, лихеноидная реакция кожи***;
Неизвестно — ухудшение симптомов дерматомиозита***.
Нарушения со стороны костно-мышечной системы и соединительной ткани:
Очень часто — костно-мышечные боли;
Часто — мышечные спазмы (в том числе повышенный уровень креатинфосфокиназы в крови);
Нечасто — рабдомиолиз, системная красная волчанка;
Редко — волчаночно-подобный синдром***.
Нарушения со стороны мочевыделительной системы:
Часто — почечная недостаточность, гематурия;
Нечасто — никтурия.
Нарушения со стороны репродуктивной системы и молочных желёз:
Нечасто — эректильная дисфункция.
Системные нарушения и осложнения в месте введения*:
Очень часто — реакции в месте инъекции (включая эритему в месте инъекции);
Часто — боль в груди, отёк, пирексия***;
Нечасто — воспаление.
Лабораторные показатели*:
Часто — нарушения коагуляции и геморрагические нарушения (в том числе повышенное активированное частичное тромбопластиновое время), положительный результат теста на аутоантитела (в том числе антитела к двухцепочечной ДНК), повышенный уровень лактатдегидрогеназы в крови.
Травмы, отравления и осложнения процедур*:
Часто — ухудшение заживления.
Примечания
* Дополнительная информация представлена в других разделах «Противопоказания», «Особые указания» и в других подразделах раздела «Побочное действие».
** Включая открытые, расширенные исследования.
*** Включая данные спонтанных сообщений.
Болезнь Бехчета (интестинальная форма)
Профиль безопасности в исследовании с участием японских пациентов с интестинальной формой болезни Бехчета был таким же, как общий профиль безопасности адалимумаба.
Увеит
Профиль безопасности у пациентов с неинфекционным увеитом был таким же, как общий профиль безопасности адалимумаба.
Активный гнойный гидраденит
Профиль безопасности у пациентов с ГГ, получавших лечение адалимумабом один раз в неделю, был сопоставим с известным профилем безопасности адалимумаба.
Побочные эффекты у пациентов детского возраста
В целом, нежелательные явления у пациентов детского возраста были схожи с явлениями, наблюдавшимися у взрослых пациентов, по частоте и виду.
Описание отдельных нежелательных реакций
Реакции в месте инъекции
У 12,9 % пациентов (взрослых и детей), получавших лечение адалимумабом, возникали реакции в месте инъекции (эритема и/или зуд, кровотечение, боль или отёк) по сравнению с 7,2 % пациентов, получающих плацебо или контрольный препарат. В основном реакции в месте инъекции не требовали отмены лекарственного препарата.
Инфекции
В исследованиях у взрослых и детей частота возникновения инфекций составила 1,51 на 1 пациенто-год в группе пациентов, получавших адалимумаб, и 1,46 на 1 пациенто-год в контрольной группе.
Инфекции, главным образом, включали назофарингит, инфекции верхних дыхательных путей и синусит. Большинство пациентов продолжили приём адалимумаба после разрешения инфекции.
Частота возникновения серьёзных инфекций была сопоставима в группе лечения адалимумабом и в контрольной группе: 0,04 и 0,03 на 1 пациенто-год, соответственно, составила 0,04/пациенто-год среди пациентов, получавших лечение адалимумабом, и 0,03/пациенто-год среди пациентов, получавших плацебо и активный препарат контроля.
У взрослых и детей сообщалось о серьёзных инфекциях (в том числе смертельных инфекциях, которые возникали редко), включающих сообщения о туберкулёзе (в том числе милиарном и внелегочном) и инвазивных оппортунистических инфекциях (например, диссеминированном или внелегочном гистоплазмозе, бластомикозе, кокцидиоидомикозе, пневмоцистозе, кандидозе, аспергиллезе и листериозе). В большинстве случаев туберкулёз возникал в течение первых восьми месяцев после начала терапии, что может указывать на рецидив латентной болезни.
Злокачественные новообразования и лимфопролиферативные нарушения
В ходе исследований адалимумаба у детей с ювенильным идиопатическим артритом (полиартикулярным ювенильным идиопатическим артритом и энтезит-ассоциированным артритом), болезнью Крона, бляшечным псориазом, увеитом и язвенным колитом злокачественных опухолей не наблюдалось. В исследованиях у взрослых частота всех злокачественных опухолей, за исключением лимфомы и немеланомного рака кожи, составила 6,8 (95 % ДИ 4,4–10,5) на 1000 пациенто-лет. Частота немеланомного рака кожи составила 8.8 (95 % ДИ 6,0–13,0) на 1000 пациенто-лет. Среди данных видов рака кожи частота репортирования плоскоклеточного рака (95 % ДИ) составила 2,7 (1,4–5,4) на 1000 пациенто-лет среди пациентов. Частота лимфомы составила 0,7 (95 % ДИ 0,2–2,7) на 1000 пациенто-лет. В продлённых исследованиях частота репортирования опухолей не увеличивалась: всех злокачественных опухолей, за исключением лимфомы и немеланомного рака кожи — 8,5 на 1000 пациенто-лет, немеланомного рака кожи — 9,6 на 1000 пациенто-лет, лимфомы — 1,3 на 1000 пациенто-лет. В ходе пострегистрационного периода редко сообщались случаи, развития Т-клеточной лимфомы печени и селезёнки у пациентов, получавших лечение адалимумабом.
Аутоантитела
В ходе клинических исследований у 11,9 % пациентов с РА, получавших лечение адалимумабом и у 8,1 %, получавших плацебо и активный препарат контроля, регистрировалось появление аутоантител на 24-й неделе терапии. У пациентов с ревматоидным артритом и псориатическим артритом, редко наблюдались клинические признаки, указывающие на впервые возникший волчаночно-подобный синдром. Состояние пациентов улучшилось после прекращения терапии. Ни у одного из пациентов не наблюдалось развитие волчаночного нефрита или симптомов со стороны центральной нервной системы.
Гепатобилиарные нарушения
У пациентов с различными заболеваниями (РА, псориатический артрит, полиартикулярный ювенильный идиопатический артрит, энтезит-ассоциированный артрит, БК, язвенный колит, БК у детей, бляшечный псориаз, гнойный гидраденит, увеит) наблюдалось повышение уровня АЛТ до 6,1 % случаев.
По всем показаниям в клинических исследованиях у пациентов с повышенным уровнем АЛТ не наблюдались симптомы и в большинстве случаев повышения были преходящими и разрешались на фоне продолжающегося лечения. Однако в ходе пострегистрационного периода сообщалось о случаях печёночной недостаточности, а также менее тяжёлых нарушениях печени, которые могли предшествовать печёночной недостаточности, таких как гепатит, в том числе аутоиммунный гепатит, у пациентов, получавших адалимумаб.
Сопутствующее лечение азатиоприном/6-меркаптопурином
В ходе исследований у взрослых с болезнью Крона наблюдалась более высокая частота нежелательных явлений, в частности репортирование злокачественных опухолей и нежелательных явлений, ассоциированных с серьёзными инфекциями, при применении адалимумаба в комбинации с азатиоприном/6-меркаптопурином по сравнению с монотерапией адалимумабом.
Передозировка
В ходе клинических исследований какие-либо явления дозоограничивающей токсичности не наблюдались. Самой высокой оцениваемой дозой являлась многократная внутривенная доза 10 мг/кг, примерно в 15 раз превышающая рекомендуемую дозу.
Взаимодействие с другими лекарственными средствами
Были проведены исследования адалимумаба у пациентов с ревматоидным артритом, полиартикулярным ювенильным идиопатическим артритом и псориатическим артритом, принимавших препарат как в качестве монотерапии, так и в сочетании с метотрексатом. Образование антител было ниже при одновременном назначении адалимумаба с метотрексатом в сравнении с монотерапией. Введение адалимумаба без метотрексата приводило к повышению образования антител, ускорению клиренса и снижению эффективности адалимумаба (см. раздел «Фармакодинамика»).
Противопоказано применять адалимумаб в комбинации с анакинрой (см. раздел «Противопоказания» и «Особые указания»). Противопоказано применять адалимумаб в комбинации с абатацептом (см. раздел «Противопоказания» и «Особые указания»).
Особые указания
Инфекции
Пациенты, принимающие антагонисты ФИО, более подвержены развитию серьёзных инфекций. Нарушение функции лёгких может повысить риск развития инфекций. В связи с этим, следует тщательно наблюдать пациентов на предмет появления инфекций, в том числе туберкулёза, до начала лечения, во время лечения и после окончания лечения адалимумабом. Поскольку полное выведение адалимумаба может занимать до четырёх месяцев, необходимо продолжить наблюдение в течение данного периода после введения последней дозы препарата.
Не следует начинать лечение адалимумабом у пациентов с активной инфекцией, в том числе хронической или локализованной, пока она не будет вылечена. У пациентов, которые были подвержены туберкулёзу, и у пациентов, которые путешествовали в районы высокого риска туберкулёза или эндемического микоза, например, гистоплазмоза, кокцидиоидомикоза или бластомикоза, следует оценить риск и пользу лечения адалимумабом до начала терапии (см. подраздел «Другие оппортунистические инфекции»). Пациентов, у которых развилась новая инфекция во время лечения адалимумабом, следует тщательно наблюдать и провести полное диагностическое обследование. Следует прекратить введение адалимумаба, если у пациента развилась новая серьезная инфекция или сепсис, и следует начать соответствующую противомикробную или противогрибковую терапию пока инфекция не будет пролечена. Врачи должны проявлять осторожность при рассмотрении возможности применения адалимумаба у пациентов с рецидивирующей инфекцией в анамнезе или при наличии состояний, предрасполагающих к развитию инфекций, в том числе применение сопутствующих иммунодепрессантов.
Серьёзные инфекции
Сообщалось о случаях серьёзных инфекций, в том числе сепсиса, вызванных бактериальной, микобактериальной, инвазивной грибковой, паразитарной, вирусной или другой оппортунистической инфекцией, например, листериозом, легионеллезом и пневмоцистозом у пациентов, получающих адалимумаб.
Другие серьёзные инфекции, наблюдавшиеся в ходе клинических исследований, включают пневмонию, пиелонефрит, септический артрит и септицемию. Сообщалось о случаях госпитализации или смертельного исхода, связанных с развитием инфекций.
Туберкулёз
Сообщалось о случаях туберкулёза, в том числе реактивации и нового развития туберкулёза, у пациентов, получавших адалимумаб. Сообщения включали случаи лёгочного и внелёгочного т.е. диссеминированного туберкулёза.
До начала терапии адалимумабом следует провести оценку на наличие активного или неактивного («латентного») туберкулёза у всех пациентов. Данная оценка должна включать подробную медицинскую оценку туберкулёза в анамнезе пациента или возможного предыдущего контакта с людьми с активной формой туберкулёза и предыдущей и/или текущей терапией иммунодепрессантами. Необходимо выполнение соответствующих скрининговых тестов (а именно, туберкулиновой кожной пробы и рентгена грудной клетки) у всех пациентов (возможно применение местных рекомендаций). Рекомендуется регистрация процедуры проведения и результатов этих тестов в личной карточке пациента. Врачи, назначающие лечение, должны помнить о риске ложноотрицательных результатов туберкулиновой кожной пробы, особенно у пациентов с тяжёлой формой заболевания или ослабленным иммунитетом.
Если диагностирован активный туберкулёз, то не следует начинать терапию препаратом Эксэмптия® (см. раздел «Противопоказания»),
Во всех описанных выше ситуациях следует очень тщательно оценивать соотношение польза/риск терапии.
При подозрении на латентный туберкулёз, следует проконсультироваться у врача, имеющего большой опыт в лечении туберкулёза.
При диагностировании латентного туберкулёза, необходимо провести соответствующее противотуберкулёзное профилактическое лечение до начала применения препарата Эксэмптия® и в соответствии с местными рекомендациями.
Также следует провести противотуберкулёзное профилактическое лечение до начала применения препарата Эксэмптия® у пациентов с несколькими или значимыми факторами риска развития туберкулёза, несмотря на отрицательный результат теста на туберкулёз, а также у пациентов с прошлым латентным или активным туберкулёзом в анамнезе, для которых невозможно подтвердить проведение адекватного курса лечения.
Несмотря на профилактическое лечение туберкулёза, отмечались случаи реактивации туберкулёза у пациентов, получавших лечение адалимумабом. У некоторых пациентов, успешно прошедших лечение активного туберкулёза, наблюдалось повторное развитие туберкулёза во время лечения адалимумабом.
Пациентам должны быть даны указания по обращению за медицинской помощью в случае появления признаков/симптомов, указывающих на туберкулёзную инфекцию (например, непрекращающийся кашель, истощение/снижение массы тела, субфебрильная температура тела, вялость), во время или после терапии препаратом Эксэмптия®.
Другие оппортунистические инфекции
Оппортунистические инфекции, в том числе инвазивные грибковые инфекции, наблюдались у пациентов, получавших адалимумаб. Эти инфекции не всегда выявлялись должным образом у пациентов, принимавших антагонисты ФИО, что приводило к задержке в назначении соответствующего лечения, а иногда и к смертельному исходу. У пациентов с такими признаками и симптомами, как лихорадка, недомогание, снижение массы тела, потливость, кашель, одышка и/или инфильтраты лёгких, либо другими серьёзными системными заболеваниями с сопутствующим шоком и без него, следует подозревать развитие инвазивной грибковой инфекции и введение препарата Эксэмптия® должно быть незамедлительно прекращено. Диагностику и применение эмпирической противогрибковой терапии у данных пациентов необходимо проводить после консультации с врачом, имеющим опыт в лечении пациентов с инвазивной грибковой инфекцией.
Реактивация гепатита B
Реактивация гепатита B наблюдалась у пациентов, получавших антагонисты ФИО, в том числе адалимумаб, и являвшихся хроническими носителями этого вируса (т.е., положительный результат на поверхностный антиген). Некоторые случаи были со смертельным исходом. Перед началом лечения препаратом Эксэмптия" пациентам необходимо выполнить тест на инфекцию ВГВ. Пациентам с положительным результатом теста на инфекцию гепатита B рекомендуется консультация врача, имеющего опыт в лечении гепатита B.
Носителей ВГВ, нуждающихся в лечении препаратом Эксэмптия®, необходимо тщательно наблюдать на наличие признаков и симптомов активной инфекции ВГВ на протяжении всего периода терапии и в течение нескольких месяцев после ее прекращения. Достаточные данные по лечению пациентов, являющихся носителями ВГВ с применением противовирусной терапии в сочетании с антагонистами ФИО для профилактики реактивации ВГВ отсутствуют.
При реактивации ВГВ у пациентов, применение препарата Эксэмптия® следует прекратить и начать эффективную противовирусную терапию с соответствующим поддерживающим лечением.
Неврологические осложнения
В редких случаях применение антагонистов ФИО, в том числе препарата Эксэмптия®, было связано с новым развитием или обострением клинических симптомов и/или радиографических признаков демиелинизирующего заболевания центральной нервной системы, в том числе рассеянного склероза и неврита зрительного нерва, а также периферических демиелинизирующих заболеваний, в том числе синдрома Гийена-Барре. Врачам, назначающим лечение, следует проявлять осторожность при рассмотрении возможности применения адалимумаба у пациентов с уже существующими или недавно возникшими демиелинизирующими нарушениями центральной или периферической нервной системы. В случае развития описанных выше явлений, следует рассмотреть возможность отмены препарата Эксэмптия®. Показана ассоциация промежуточного увеита с демиелинизирующими заболеваниями центральной нервной системы. До начала терапии препаратом Эксэмптия" у пациентов с неинфекционным промежуточным увеитом необходимо проведение обследования на предмет наличия демиелинизирующих заболеваний центральной нервной системы.
Аллергические реакции
В ходе клинических исследований серьёзные аллергические .реакции, связанные с применением адалимумаба, наблюдались редко. В ходе клинических исследований случаи несерьёзных аллергические реакций, связанных с применением адалимумаба, наблюдались нечасто. Были получены сообщения о случаях серьёзных аллергических реакций, в том числе анафилаксии, после введения ададимумаба. В случае возникновения анафилактической реакции или другой серьёзной аллергической реакции, введение препарата Эксэмптия® следует незамедлительно прекратить и начать соответствующую терапию.
Подавление иммунитета
В ходе исследования у 64 пациентов с ревматоидным артритом, получавших лечение адалимумабом, какие-либо признаки подавления гиперчувствительности замедленного типа и уровня иммуноглобулинов, или изменения в числе T-, B-, NK-клеток-эффекторов, моноцитов/макрофагов и нейтрофилов отмечены не были.
Злокачественные новообразования и лимфопролиферативные нарушения
В ходе контролируемой части клинических исследований антагонистов ФНО наблюдалось больше случаев злокачественных опухолей, в том числе лимфомы, среди пациентов, получавших антагонист ФНО, в сравнении с пациентами контрольной группы. Однако они случались редко. В пострегистрационный период сообщалось о случаях лейкемии у пациентов, получавших лечение антагонистом ФНО. Пациенты с ревматоидным артритом с продолжительным, очень активным воспалительным заболеванием, затрудняющим оценку риска, подвержены наибольшему основному риску развития лимфомы и лейкемии. Согласно имеющимся данным, нельзя исключать возможный риск образования лимфомы, лейкемии и других злокачественных опухолей у пациентов, получающих лечение антагонистом ФНО.
В пострегистрационный период сообщалось о случаях злокачественной опухоли, некоторых со смертельным исходом, среди детей, подростков и молодежи (в возрасте до 22 лет), получавших лечение антагонистами ФНО (начало терапии в возрасте <18 лет), в том числе адалимумабом. Примерно в половине случаев это была лимфома. В остальных случаях это были различные злокачественные опухоли и в том числе редкие злокачественные опухоли, как правило связанные с подавлением иммунитета. Нельзя исключать риск образования злокачественных опухолей у детей и подростков, получающих лечение антагонистами ФНО.
В пострегистрационный период были отмечены редкие случаи Т-клеточной лимфомы печени и селезёнки у пациентов, получавших лечение адалимумабом. Эта редкая форма Т- клеточной лимфомы имеет очень агрессивное течение заболевания и, как правило, является смертельной. При применении адалимумаба наблюдались некоторые случаи возникновения такой Т-клеточной лимфомы печени и селезёнки у молодых пациентов при сопутствующем лечении азатиоприном или 6-меркаптопурином по поводу воспалительного заболевания кишечника.
Следует тщательно учитывать потенциальный риск применения азатиоприна или 6- меркаптопурина в комбинации с препаратом Эксэмптия®. Нельзя исключать риск развития Т-клеточной лимфомы печени и селезёнки у пациентов, получающих лечение адалимумабом (см. раздел «Побочное действие»).
Исследования с включением пациентов со злокачественной опухолью в анамнезе или продолживших лечение адалимумабом после образования злокачественной опухоли не проводились. Таким образом, следует проявлять крайнюю осторожность при назначении лечения препаратом Эксэмптия® у таких пациентов (см. раздел «Побочное действие»). Все пациенты, в частности, пациенты с расширенной терапией иммунодепрессантами в медицинском анамнезе или пациенты с псориазом с ПУВА-терапией в анамнезе должны проходить обследование на наличие немеланомного рака кожи до начала и во время лечения препаратом Эксэмптия®. Также сообщалось о случаях меланомы и карциномы из клеток Меркеля у пациентов, получавших лечение антагонистами ФИО, в том числе адалимумабом (см. раздел «Побочное действие»).
В ходе поискового клинического исследования по оценке применения другого антагониста ФИО, инфликсимаба, у пациентов с хронической обструктивной болезнью лёгких (ХОБЛ) средней или тяжёлой степени тяжести сообщалось больше случаев образования злокачественных опухолей, в основном в лёгком, либо в голове и шее, у пациентов, получавших лечение инфликсимабом в сравнении с пациентами контрольной группы. Все пациенты имели анамнез заядлого курения. В связи с этим, следует соблюдать осторожность при применении какого-либо антагониста ФИО у пациентов с ХОБЛ, а также у пациентов с повышенным риском образования злокачественной опухоли по причине заядлого курения. Согласно имеющимся данным неизвестно, влияет ли лечение адалимумабом на риск развития дисплазии или рака толстой кишки. Все пациенты с язвенным колитом, находящиеся в группе повышенного риска развития дисплазии или рака толстой кишки (например, пациенты с продолжительным язвенным колитом или первичным склерозирующим холангитом), или с предыдущей дисплазией или раком толстой кишки в анамнезе должны регулярно проходить обследование по поводу дисплазии до начала терапии и на протяжении всего периода заболевания. Данная оценка должна включать колоноскопию и биопсию в соответствии с местными рекомендациями.
Гематологические реакции
Сообщалось о редких случаях панцитопении, в том числе апластической анемии, при применении антагонистов ФИО. Сообщалось о нежелательных явлениях со стороны системы крови, в том числе клинически значимой цитопении (например, тромбоцитопении, лейкопении) при применении адалимумаба. Всем пациентам во время лечения препаратом Эксэмптия® должно быть рекомендовано немедленное обращение к врачу, если у них наблюдаются следующие признаки и симптомы: постоянная лихорадка, кровоподтеки, кровотечение или бледность. У пациентов с подтверждёнными значительными отклонениями гематологических показателей от нормы следует рассмотреть возможность прекращения терапии препаратом Эксэмптия®.
Вакцинация
В ходе исследования у 226 взрослых пациентов с ревматоидным артритом, получавших лечение адалимумабом или плацебо, наблюдались аналогичные ответы антител на стандартную 23-валентную пневмококковую вакцину и трехвалентную вакцину против вируса гриппа. Данные по вторичной передаче инфекции через живые вакцины у пациентов, получающих адалимумаб, отсутствуют. Пациентам детского возраста рекомендуется, если это возможно, пройти все современные вакцинации в соответствии с действительными руководствами по вакцинации до начала терапии препаратом Эксэмптия®. Пациенты, принимающие препарат Эксэмптия8, могут пройти сопутствующую вакцинацию, за исключением живых вакцин. Не рекомендуется введение живых вакцин младенцам, подвергнутым воздействию адалимумаба в утробе матери, в течение 5 месяцев после последней инъекции адалимумаба матери во время беременности.
Хроническая сердечная недостаточность
В ходе клинического исследования с применением другого антагониста ФИО наблюдалось ухудшение хронической сердечной недостаточности и повышенный уровень смертности в результате хронической сердечной недостаточности. Также сообщалось о случаях ухудшения хронической сердечной недостаточности у пациентов, получавших адалимумаб. Следует с осторожностью применять препарат Эксэмптия® у пациентов с легкой сердечной недостаточностью (класс ИП по МУНА). Препарат Эксэмптия® противопоказан при сердечной недостаточности средней или тяжелой степени тяжести. При развитии новых или ухудшении симптомов сердечной недостаточности, лечение пациентов препаратом Эксэмптия® должно быть прекращено.
Аутоиммунные процессы
Лечение адалимумабом может привести к образованию аутоиммунных антител. Влияние длительного лечения препаратом Эксэмптия® на развитие аутоиммунных заболеваний неизвестно. Если у пациента наблюдаются симптомы, указывающие на развитие волчаночно-подобного синдрома, при лечении препаратом Эксэмптия® и положительном результате теста на антитела к двухцепочечной ДНК, то не следует проводить дальнейшее лечение препаратом Эксэмптия® (см. раздел «Побочное действие»).
Одновременное применение биологических базисных препаратов для лечения ревматоидного артрита (БИВИП) или антагонистов ФИО
В ходе клинических исследований наблюдались случаи серьёзных инфекций при одновременном применении анакинры с другим антагонистом ФИО, этанерцептом, без дополнительного клинического эффекта в сравнении с монотерапией этанерцептом. Из-за характера нежелательных явлений, наблюдавшихся при терапии этанерцептом в комбинации с анакинрой, аналогичная токсичность также может наблюдаться при применении анакинры в комбинации с другим антагонистом ФИО. Таким образом, противопоказано применение адалимумаба в комбинации с анакинрой. Одновременное введение адалимумаба с другими биологическими БИВИП (например, анакинрой и абатацептом) или другими антагонистами ФИО не рекомендуется, с учётом возможного повышенного риска развития инфекций, в том числе серьезных инфекций и других потенциальных фармакологических взаимодействий (см. раздел «Взаимодействие с другими лекарственными средствами»).
Хирургическое вмешательство
Опыт безопасного проведения хирургических процедур у пациентов, получающих лечение адалимумабом, ограничен. При планировании проведения хирургической процедуры, следует учитывать длительность периода полувыведения адалимумаба. Пациента, нуждающегося в хирургическом вмешательстве, во время лечения препаратом Эксэмптия^ необходимо тщательно наблюдать на предмет развития инфекций и принимать соответствующие меры. Опыт безопасного применения адалимумаба у пациентов, проходящих артропластику ограничен.
Непроходимость тонкой кишки
Отсутствие ответа на лечение болезни Крона может указывать на наличие фиксированного фиброзного стеноза, нуждающегося в хирургическом вмешательстве. Имеющиеся данные указывают на то, что применение адалимумаба не ухудшает и не вызывает стенозы.
Пациенты пожилого возраста
Частота серьёзных инфекций среди пациентов старше 65 лет, получающих лечение адалимумабом, была выше, чем у пациентов в возрасте до 65 лет. Из общего числа участников клинических исследований адалимумаба 9,4 % были в возрасте 65 лет и старше, а примерно 2,0 % — в возрасте 75 лет и старше. Поскольку в целом среди пациентов пожилого возраста чаще встречаются инфекции, следует соблюдать осторожность при назначении препарата Эксэмптия1* данной категории пациентов.
Дети
См. выше подраздел «Вакцинация».
Возможность хранения препарата Эксэмптия® в шприцах при комнатной температуре
При необходимости (например, во время путешествия) препарат Эксэмптия® допускается хранить при комнатной температуре (до 25 °C) в защищённом от света месте не более 14 дней. С момента извлечения из холодильника шприц должен быть использован в течение 14 дней, если шприц после извлечения из холодильника не будет использован в течение этого срока, он должен быть уничтожен. Для удобства рекомендуется записать дату извлечения шприца из холодильника и срок, в течение которого следует использовать препарат.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Эксэмптия® может оказывать незначительное влияние на способность управлять транспортными средствами и другими механизмами, так как на фоне применения препарата могут наблюдаться головокружение и нарушение зрения (см. раздел «Побочное действие»).
Форма выпуска
Раствор для подкожного введения, 40 мг/0,8 мл.
По 0,8 мл в трёхкомпонентные стерильные шприцы бесцветного нейтрального стекла I гидролитического класса вместимостью 1 мл с системой защиты иглы или без неё. На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу в контурную ячейковую упаковку из плёнки ПВХ с покрытием бумагой или без покрытия.
По 1 или 2 контурных ячейковых упаковок вместе с инструкцией по медицинскому применению и 1 или 2 салфетками спиртовыми помещают в картонную пачку.
На пачку может быть нанесена этикетка контрольного вскрытия.
Хранение
При температуре от 2 до 8 °C в защищённом от света месте.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
ПСК Фарма, ООО, Российская Федерация
Производитель
ООО «ПСК Фарма».
Юридический адрес: 141983, Московская область, г.о.Дубна, г. Дубна, ул. Программистов, д. 5, стр. 1.
Адрес места производства: Московская обл., г.о. Дубна, г. Дубна, ул. Программистов, д. 5, стр. 2.
Юридическое лицо, на имя которого выдано регистрационное удостоверение/Организация, принимающая претензии потребителей
ООО «ПСК Фарма», 141983, Московская обл., г. Дубна, ул. Программистов, д. 5, стр. 1.
Тел./факс: 8 (800) 234-16-99
Email: pv@rusbiopharm.ru
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Эксэмптия:
