Гэттестив
, лиофилизатРегистрационный номер
Торговое наименование
Гэттестив
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для подкожного введения
Состав
1 флакон с лиофилизатом содержит:
действующее вещество: тедуглутид — 5 мг;
вспомогательные вещества: L-гистидин — 3,88 мг, маннитол — 15 мг, натрия дигидрофосфата моногидрат — 0,645 мг, натрия гидрофосфата гептагидрат — 3,435 мг; 1Н раствор хлористоводородной кислоты — q.s. до pH 7,4; 1М раствор натрия гидроксида — q.s. до pH 7,4.
1 предварительно заполненный шприц с растворителем содержит:
Вода для инъекций — 0,5 мл.
Описание
Лиофилизат: белый порошок или уплотнённая в таблетку белая пористая масса (цельная или раскрошенная).
Растворитель: прозрачная бесцветная жидкость.
Восстановленный раствор препарата: прозрачный либо со слабой опалесценцией, бесцветный раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Тедуглутид представляет собой аналог глюкагоноподобного пептида-2 (ГПП-2), производимый в клетках Escherichia coli с помощью рекомбинантной ДНК-технологии.
Механизм действия
Природный ГПП-2 человека, секретируемый L клетками кишечника, усиливает кишечный и портальный кровоток, подавляет секрецию соляной кислоты в желудке и снижает перистальтику кишечника. В доклинических исследованиях показано, что тедуглутид сохраняет целостность слизистой оболочки, стимулируя восстановление и нормальный рост кишечника путём увеличения размера кишечных ворсинок и глубины крипт.
Фармакодинамика
Подобно ГПП-2, тедуглутид представляет собой полипептидную цепь из 33 аминокислот, в которой аланин заменён на глицин во втором положении позиции N-конца. Замена единственной аминокислоты по сравнению с естественно вырабатываемым ГПП-2 приводит к возникновению устойчивости к расщеплению in vivo под действием фермента дипептидилпептидазы-4 (ДПП-4), что удлиняет период полувыведения тедуглутида.
Тедуглутид увеличивает размер ворсинок и глубину крипт эпителия кишечника.
В соответствии с данными доклинических исследований (см. раздел «Особые указания») и предполагаемым механизмом действия, одновременно с трофическими эффектами в отношении слизистой оболочки кишечника, существует риск стимулирования роста новообразований тонкой и/или толстой кишки. Проведённые клинические исследования (КП) не смогли ни исключить, ни подтвердить наличие этого повышенного риска. В ходе КИ отмечено несколько случаев образования доброкачественных колоректальных полипов, однако частота их образования не увеличивалась в сравнении с пациентами, получавшими плацебо. Помимо необходимости в проведении колоноскопии для удаления полипов к моменту начала терапии (см. раздел «Особые указания»), за каждым пациентом необходимо вести постоянное наблюдение с учётом его характеристик (например, возраста, основного заболевания, наличия полипов в анамнезе и др.).
Фармакокинетика
Всасывание
Тедуглутид быстро всасывается из места подкожной (п/к) инъекции; максимальная концентрация в плазме крови (Cmax) достигается примерно через 3–5 часов после введения препарата во всех дозах. Абсолютная биодоступность тедуглутида для п/к введения высокая (88 %). Не наблюдалось кумуляции тедуглутида после повторного п/к введения.
Распределение
После п/к введения кажущийся объём распределения тедуглутида составляет 26 литров у пациентов с синдромом короткой кишки.
Метаболизм
Метаболизм тедуглутида изучен не полностью. Так как тедуглутид является пептидом, его метаболизм, вероятно, соответствует основному механизму метаболизма пептидов.
Выведение
Терминальный период полувыведения тедуглутида составляет примерно 2 часа. После внутривенного введения плазменный клиренс тедуглутида составил примерно 127 мл/час/кг, что эквивалентно скорости клубочковой фильтрации. В ходе исследования фармакокинетики препарата было подтверждено выведение тедуглутида почками у пациентов с почечной недостаточностью.
Дозовая линейность
Скорость и степень абсорбции тедуглутида пропорциональны дозе при однократном и повторном п/к введении в дозах до 20 мг.
Фармакокинетика в особых клинических группах
Дети
После п/к введения тедуглутида сходные значения Cmax продемонстрированы во всех возрастных группах с помощью метода популяционного фармакокинетического моделирования. Однако более низкая экспозиция (AUC) и более короткий период полувыведения отмечены у пациентов в возрасте от 1 года и до 17 лет по сравнению со взрослыми пациентами. Фармакокинетический профиль тедуглутида у этой популяции детей (согласно значениям клиренса и объёма распределения) отличался от такового у взрослых пациентов после коррекции на массу тела. В частности, клиренс снижается с увеличением возраста от 1 года и по мере взросления. Отсутствуют данные пациентов детского возраста с почечной недостаточностью средней тяжести или тяжёлой степени, или терминальной стадией почечной недостаточности.
Пол
В КИ не наблюдалось значимых различий в зависимости от пола пациентов.
Пожилые пациенты
В КИ 1 фазы не выявлены различия в параметрах фармакокинетики тедуглутида у здоровых добровольцев моложе 65 лет в сравнении с добровольцами старше 65 лет. Опыт применения тедуглутида у добровольцев в возрасте от 75 лет и старше ограничен.
Нарушение функции печени
В КИ 1 фазы оценивали влияние печёночной недостаточности на параметры фармакокинетики тедуглутида после его п/к введения в дозе 20 мг. Максимальная экспозиция и общая величина экспозиции тедуглутида после однократного п/к введения дозы 20 мг были ниже (10–15 %) у добровольцев с печёночной недостаточностью средней степени тяжести, чем у здоровых добровольцев.
Нарушение функции почек
В КИ 1 фазы оценивали влияние почечной недостаточности на параметры фармакокинетики тедуглутида после его п/к введения в Aдозе 10 мг. По мере прогрессирования почечной недостаточности до терминальной стадии значения основных параметров фармакокинетики тедуглутида увеличивались в 2,6 (AUCinf) и 2,1 (Cmax) раза по сравнению со значениями у здоровых добровольцев.
Показания
Препарат Гэттестив показан для лечения пациентов в возрасте от 1 года и старше с синдромом короткой кишки (СКК). Пациенты должны быть в стабильном состоянии после периода адаптации кишечника после перенесённой операции.
Противопоказания
- Гиперчувствительность к тедуглутиду и/или любому вспомогательному веществу в составе препарата.
- Диагностированное или подозреваемое злокачественное новообразование.
- Пациенты с наличием в анамнезе (в течение последних 5 лет) злокачественных новообразований желудочно-кишечного тракта, в том числе гепатобилиарной системы и поджелудочной железы.
- Детский возраст до 1 года (в связи с отсутствием клинических данных по эффективности и безопасности).
С осторожностью
Следует соблюдать осторожность при назначении препарата Гэттестив: пациентам с сердечно-сосудистыми заболеваниями, например, сердечно-сосудистой недостаточностью или артериальной гипертензией (см. раздел «Особые указания»); пациентам, принимающим одновременно препараты, требующие титрации дозы или имеющие узкий терапевтический индекс (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»); пациентам с тяжёлыми, клинически нестабильными сопутствующими заболеваниями (например, заболеваниями сердца и сосудов, лёгких, почек, печени, центральной нервной или эндокринной системы, а также инфекционными заболеваниями) в связи с недостаточными клиническими данными.
Применение при беременности и в период грудного вскармливания
Беременность
Нет данных о применении препарата Гэттестив у беременных женщин. В исследованиях на животных не выявлено прямой или косвенной репродуктивной токсичности препарата Гэттестив (см. раздел «Особые указания»), В качестве меры предосторожности рекомендуется избегать применения препарата Гэттестив у беременных женщин.
Период грудного вскармливания
Данных об экскреции тедуглутида с грудным молоком нет. У крыс среднее значение концентрации тедуглутида в молоке составило менее 3 % от значения их плазменной концентрации после однократного п/к введения препарата в дозе 25 мг/кг. Нельзя исключать риск для новорождённых детей/младенцев, находящихся на грудном вскармливании. В качестве меры предосторожности рекомендуется избегать применения препарата Гэттестив у женщин в период грудного вскармливания.
Способ применения и дозы
Препарат Гэттестив предназначен только для подкожного введения.
Лечение необходимо начинать под контролем врача, который имеет опыт лечения пациентов с СКК.
Терапию не следует начинать до тех пор, пока пациент не достигнет стабильного состояния после периода адаптации кишечника. До начала терапии следует провести оптимизацию и стабилизацию внутривенно вводимой жидкости и парентерального питания.
По результатам оценки клинического состояния пациента врач должен определить индивидуальные задачи терапии и предпочтения пациента. Терапию следует прекратить, если не достигнуто общее улучшение состояния пациента. Эффективность и безопасность терапии у всех пациентов следует непрерывно контролировать в соответствии с клиническими рекомендациями.
Режим дозирования
Взрослые пациенты
Рекомендуемая доза препарата Гэттестив составляет 0,05 мг/кг массы тела 1 раз в сутки ежедневно. Ниже в Таблице 1 указан объём вводимого раствора препарата с учётом массы тела пациента. В связи с гетерогенностью популяции пациентов с СКК, некоторым пациентам может потребоваться тщательно контролируемое снижение суточной дозы препарата для улучшения переносимости лечения. В случае пропуска дозы препарата необходимо ввести её как можно раньше в этот же день.
Эффективность терапии следует оценивать через 6 месяцев лечения. Ограниченные данные КИ показали, что некоторые пациенты могут отреагировать на терапию спустя более длительный период времени (т.е. те, у кого ещё сохраняется толстая кишка или дистальный/терминальный отдел подвздошной кишки); если через 12 месяцев терапии не достигнуто общее улучшение, то необходимо повторно оценить потребность в продолжении лечения.
Продолжение терапии рекомендуется и для пациентов, которые отказались от парентерального питания.
Таблица 1
| Масса тела | Дозировка 5 мг Вводимый объём раствора препарата |
| 38–41 кг | 0,20 мл |
| 42–45 кг | 0,22 мл |
| 46–49 кг | 0,24 мл |
| 50–53 кг | 0,26 мл |
| 54–57 кг | 0,28 мл |
| 58–61 кг | 0,30 мл |
| 62–65 кг | 0,32 мл |
| 66–69 кг | 0,34 мл |
| 70–73 кг | 0,36 мл |
| 74–77 кг | 0,38 мл |
| 78–81 кг | 0,40 мл |
| 82–85 кг | 0,42 мл |
| 86–89 кг | 0,44 мл |
| 90–93 кг | 0,46 мл |
Дети (≥1 года)
Терапию должен начинать врач, имеющий опыт лечения СКК у детей.
Рекомендуемая доза препарата Гэттестив у детей и подростков (в возрасте от 1 года до 17 лет) такая же, как у взрослых пациентов (0,05 мг/кг массы тела 1 раз в сутки ежедневно).
Ниже в Таблице 2 указан рекомендуемый объём препарата с учётом массы тела ребёнка.
В случае пропуска дозы препарата необходимо ввести её как можно раньше в этот же день.
Рекомендуемый период терапии составляет 6 месяцев, после которого следует оценить эффективность терапии. У детей младше 2 лет эффективность терапии рекомендуется оценивать через 12 недель терапии. Отсутствуют данные о применении препарата более 6 месяцев у детей.
Таблица 2
| Масса тела | Дозировка 5 мг Вводимый объём раствора препарата |
| 10–11 кг | 0,05 мл |
| 12–13 кг | 0,06 мл |
| 14–17 кг | 0,08 мл |
| 18–21 кг | 0,10 мл |
| 22–25 кг | 0,12 мл |
| 26-29 кг | 0,14 мл |
| 30–33 кг | 0,16 мл |
| 34–37 кг | 0,18 мл |
| 38–41 кг | 0,20 мл |
| 42–45 кг | 0,22 мл |
| 46–49 кг | 0,24 мл |
| ≥50 кг | Смотрите Таблицу 1 раздел «Взрослые пациенты». |
- Объём шприца для инъекций для применения у детей должен быть 0,5 мл или меньше, с ценой деления 0,01 мл.
Применение в особых клинических группах пациентов
Пожилые пациенты
Коррекции дозы препарата у пациентов старше 65 лет не требуется.
Пациенты с почечной недостаточностью
Коррекции дозы не требуется у взрослых пациентов или детей с почечной недостаточностью лёгкой степени тяжести. Суточная доза препарата должна быть снижена на 50% у взрослых пациентов или детей с почечной недостаточностью средней степени тяжести и тяжёлой степени (с клиренсом креатинина менее 50 мл/мин) и терминальной стадией почечной недостаточности (см. раздел «Фармакокинетика»),
Пациенты с печёночной недостаточностью
Коррекции дозы не требуется у взрослых пациентов или детей с печёночной недостаточностью лёгкой или средней степени тяжести, учитывая результаты КИ тедуглутида у пациентов с печёночной недостаточностью класса B по классификации Чайлд-Пью. КИ у пациентов с печёночной недостаточностью тяжёлой степени не проводилось (см. разделы «Фармакокинетика» и «Особые указания»).
Дети
Безопасность и эффективность препарата Гэттестив у детей младше 1 года не установлены, данные отсутствуют.
Способ применения
Раствор препарата следует вводить подкожно 1 раз в сутки, ежедневно, чередуя участки инъекции в четырёх квадрантах брюшной стенки. Если введение препарата в живот осложняется болевыми ощущениями, формированием рубцов или уплотнением ткани, то для инъекции можно использовать область бедра. Не следует вводить препарат Гэттестив внутривенно или внутримышечно.
Инструкция по приготовлению раствора лекарственного препарата Гэттестив
Количество флаконов, необходимых для введения одной дозы препарата, следует определять в зависимости от массы тела пациента и рекомендуемой дозы 0,05 мг/кг/сутки. Во время каждого визита врач должен взвесить пациента, определить суточную дозу, которую следует вводить до следующего визита, проинструктировав соответствующим образом пациента.
Таблицы с рекомендуемыми для инъекции объёмами раствора препарата с учётом рекомендуемой дозы на кг массы тела и для детей, и для взрослых представлены выше в этом разделе.
Если требуются 2 флакона препарата, то необходимо повторить процедуру растворения порошка для второго флакона, а затем забрать дополнительный объём раствора препарата из второго флакона в шприц, уже содержащий раствор из первого флакона. Объём раствора, оставшийся после введения назначенной дозы препарата, необходимо удалить и утилизировать.
Только для однократного применения.
Инструкция по подготовке и введению препарата Гэттестив
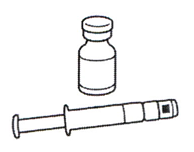
В упаковке препарата Гэттестив содержится:
1 или 28 флаконов с 5 мг тедуглутида в виде порошка (лиофилизата)
1 или 28 предварительно заполненных шприцев с растворителем Необходимые материалы, не включённые в упаковку:
- Иглы для приготовления раствора препарата (размером 22G, ½; 0,7 × 40 мм)
- 0,5 или 1 мл шприцы для инъекций (с интервалами шкалы 0,02 мл и меньше). Для детей следует использовать 0,5 мл шприц или меньше (с интервалами шкалы 0,01 мл и меньше) для инъекций
- Тонкие иглы для п/к инъекций (например, размером 26G, 5/8 (0,45 × 16 мм) или меньшие иглы для детей, если потребуется)
- Салфетки, смоченные спиртом
- Тампоны, пропитанные спиртом
- Плотно закрывающийся контейнер для безопасной утилизации использованных шприцев и игл
ПРИМЕЧАНИЕ: До начала процедуры убедитесь в наличии чистой рабочей поверхности и вымойте руки.
1. Сборка предварительно заполненного шприца
После подготовки всех необходимых материалов, следует выполнить сборку предварительно заполненного шприца следующим образом:
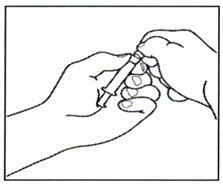
1.1 Возьмите предварительно заполненный шприц с растворителем и откиньте верхнюю часть пластикового колпачка таким образом, чтобы он был готов к присоединению иглы для приготовления раствора препарата.
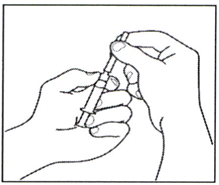
1.2 Присоедините иглу для раствора препарата (22G ½; 0,7 × 40 мм) к предварительно заполненному шприцу, завинтив её по часовой стрелке.
2. Растворение препарата
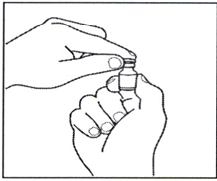
2.1 Удалите пластиковый диск типа «flip-off» с флакона с порошком, протрите верхнюю часть флакона спиртовой салфеткой и дайте высохнуть. Не прикасайтесь к верхней части флакона.
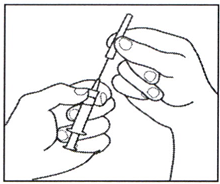
2.2 Снимите колпачок с иглы на собранном, предварительно заполненном шприце с растворителем, не прикасаясь к кончику иглы.
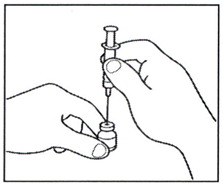
2.3 Проткните иглой предварительно заполненного шприца центр резиновой пробки флакона с порошком и мягко надавите на поршень шприца, вводя весь растворитель во флакон.
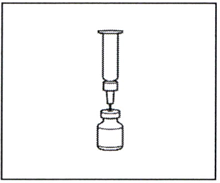
2.4 Оставьте иглу с пустым шприцем, присоединёнными к флакону, примерно на 30 секунд.
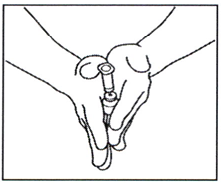
2.5 Осторожно вращайте флакон между ладонями в течение 15 секунд. Затем, осторожно один раз поверните флакон вверх- вниз, не вынимая иглу и пустой шприц из флакона.
ПРИМЕЧАНИЕ: Не трясите флакон. Встряхивание флакона может вызвать образование пены, которая затрудняет извлечение раствора препарата из флакона.
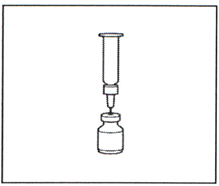
2.6 Оставьте флакон с присоединённым пустым шприцем на две минуты.
2.7 Проверьте флакон на наличие нерастворившегося порошка. Если порошок остался, повторите этапы 2.5 и 2.6. Не трясите флакон. Если во флаконе по-прежнему остался нерастворившийся порошок, выбросьте флакон и начните подготовку раствора препарата с новым флаконом порошка.
ПРИМЕЧАНИЕ: Приготовленный раствор должен быть прозрачным либо со слабой опалесценцией и бесцветным. Если раствор помутнел или содержит посторонние частицы, не используйте его.
ПРИМЕЧАНИЕ: После приготовления следует немедленно ввести раствор. Приготовленный раствор, если он не был введён сразу после восстановления, следует хранить при температуре ниже 25°C не более 3 часов.
3. Подготовка шприца для инъекций
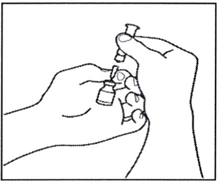
3.1 Удалите из флакона с раствором препарата пустой шприц для растворения порошка, оставив иглу во флаконе, и выбросьте шприц.
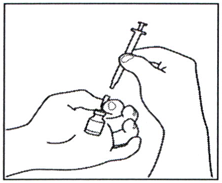
3.2 Возьмите шприц для инъекций и присоедините его к игле, которая ещё находится во флаконе.
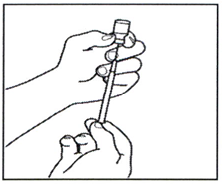
3.3 Переверните флакон вверх дном, сдвиньте кончик иглы поближе к пробке и введите весь раствор препарата в шприц, осторожно потянув за поршень.
ПРИМЕЧАНИЕ: Если Ваш врач или врач Вашего ребёнка определил для введения 2 флакона с препаратом, подготовьте второй предварительно заполненный шприц с растворителем и второй флакон с порошком, как описано на этапах 1 и 2. Введите раствор из второго флакона в тот же шприц для инъекций, повторив этап 3.
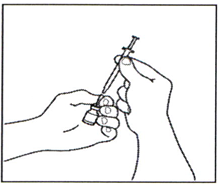
3.4 Отсоедините шприц для инъекций от иглы, оставив её во флаконе. Выбросьте флакон с иглой в контейнер для утилизации острых предметов.
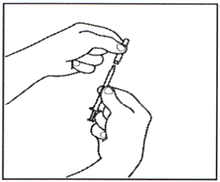
3.5 Возьмите иглу для п/к инъекций, но не снимайте с неё пластикового колпачка. Присоедините иглу к шприцу для инъекций, в котором содержится раствор препарата.
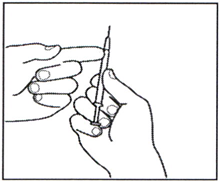
3.6 Проверьте раствор в шприце на наличие пузырьков воздуха. При наличии пузырьков воздуха, осторожно постучите по шприцу, пока они не поднимутся вверх. Затем осторожно вдавите поршень, чтобы выпустить воздух.
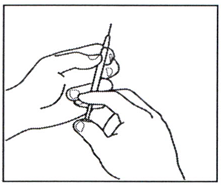
3.7 Доза/объём раствора препарата должна быть рассчитана лечащим врачом. Удалите избыточный объём раствора препарата из шприца, не снимая колпачка с иглы, пока в шприце не останется требуемая доза препарата.
4. Выполнение инъекции
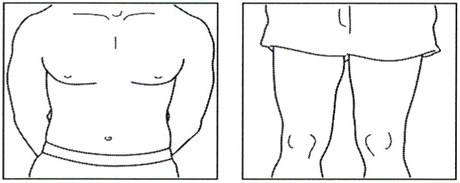
4.1 Определите участок на животе или на бедре, если инъекции на животе болезненны или имеются уплотнения (см. рисунок).
ПРИМЕЧАНИЕ: Не следует использовать для выполнения инъекций одно и то же место каждый день — меняйте участки (используйте верхний, нижний, левый и правый квадрант живота), чтобы избежать дискомфорта. Следует избегать введения раствора препарата в воспалённые, припухлые участки, участки с рубцами или родинками, родимыми пятнами или другими поражениями кожи.
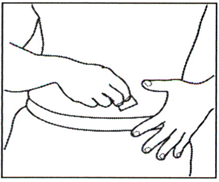
4.2 Круговыми движениями протрите намеченный участок кожи тампоном, пропитанным спиртом. Дайте ему высохнуть.
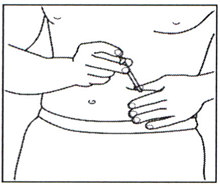
4.3 Удалите пластиковый колпачок с иглы шприца для инъекций. Одной рукой осторожно возьмите очищенную кожу в месте инъекции. Другой рукой держите шприц, как карандаш. Отведите запястье назад и быстро введите иглу под углом 45°.
4.4 Немного оттяните поршень. Если Вы заметили кровь в шприце, извлеките иглу и замените на чистую иглу того же размера. Вы все ещё можете использовать препарат, который уже находится в шприце. Попробуйте ввести в другое место на обработанном участке кожи.
4.5 Вводите препарат медленно, постоянно надавливая на поршень, пока весь раствор препарата не будет введён, а шприц пуст.
4.6 Потяните иглу, вынимая её из кожи, выбросьте иглу и шприц в контейнер для утилизации острых предметов. Может возникнуть небольшое кровотечение. Если потребуется, осторожно прижмите место инъекции ватным тампоном или марлевой салфеткой, пока не прекратится кровотечение.
Побочное действие
Обзор профиля безопасности
Наиболее частыми нежелательными реакциями (HP), зарегистрированными в КИ тедуглутида, были: боль в животе, вздутие живота, инфекции дыхательных путей (включая назофарингит, грипп, инфекции верхних и нижних дыхательных путей), тошнота, реакции в месте инъекции, головная боль и рвота. Примерно у 38 % пациентов со стомой, получавших терапию тедуглутидом, развились осложнения со стороны стомы. Большинство HP были лёгкой или средней степени тяжести.
Не получено новых сигналов по безопасности у пациентов, получавших тедуглутид в дозе 0,05 мг/кг/сутки до 30 месяцев в ходе продлённого, открытого исследования.
Перечень HP в виде таблицы
Представленные ниже HP распределены по системно-органным классам с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1,000 до <1/100); редко (≥1/10,000 до <1/1,000); очень редко (<1/10,000); частота неизвестна (частота не может быть определена на основании имеющихся данных). Все HP, зарегистрированные в рамках пострегистрационного периода применения препарата, выделены курсивом.
| Частота Класс систем и органов | Очень часто | Часто | Нечасто | Частота неизвестна |
| Инфекции и инвазии | инфекции дыхательных путей* | гриппоподобное заболевание | ||
| Нарушения со стороны иммунной системы | гиперчувствительность | |||
| Нарушение со стороны обмена веществ и питания | снижение аппетита, гиперволемия | |||
| Нарушения психики | тревога, бессонница | |||
| Нарушения со стороны нервной системы | головная боль | |||
| Нарушения со стороны сердца | хроническая сердечная недостаточность | |||
| Нарушения со стороны сосудов | обморок | |||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | кашель, одышка | |||
| Нарушения со стороны желудочно-кишечного тракта | вздутие живота, боль в животе, тошнота, рвота | колоректальный полип, стеноз толстой кишки, метеоризм, непроходимость кишечника, стеноз протока поджелудочной железы, панкреатит+, стеноз тонкой кишки | полип двенадцати-перстной кишки | желудочный полип |
| Нарушения со стороны печени и желчевыводящих путей | холецистит, острый холецистит | |||
| Общие расстройства и нарушения в месте введения | реакция в месте инъекции‡ | периферические отёки | задержка жидкости | |
| Травмы, интоксикации и осложнения манипуляций | осложнения со стороны желудочно-кишечной стомы | |||
* включает следующие предпочтительные термины: назофарингит, грипп, инфекции верхних дыхательных путей и инфекции нижних дыхательных путей. + включает следующие предпочтительные термины: панкреатит, острый панкреатит и хронический панкреатит. ‡ включает следующие предпочтительные термины: гематома в месте инъекции, эритема в месте инъекции, боль в месте инъекции, припухлость в месте инъекции и кровотечение в месте инъекции. | ||||
Описание отдельных нежелательных реакций
Иммунногенностъ
В соответствии с потенциально иммуногенными свойствами лекарственных препаратов, содержащих пептиды, применение препарата Гэттестив может инициировать выработку антител. Согласно объединённым данным 2 КИ, проведённых у взрослых пациентов с СКК (6-месячное рандомизированное, плацебо-контролируемое КИ с последующим 24-месячным открытым КИ), которые получали п/к инъекции тедуглутида в дозе 0,05 мг/кг 1 раз в сутки, антитела к тедуглутиду были обнаружены у 3 % (2/60) пациентов через 3 месяца, у 17 % (13/77) пациентов через 6 месяцев, у 24 % (16/67) пациентов через 12 месяцев, у 33 % (11/33) пациентов через 24 месяца, и у 48 % (14/29) пациентов через 30 месяцев лечения. В ходе КИ 3 фазы у 28 % пациентов с СКК, которые получали тедуглутид в течение >2 лет, были обнаружены антитела к белку Е. coli (остаточные белки штамма-продуцента). Продукция антител не ассоциировалась с клинически значимыми данными по безопасности, снижением эффективности или изменением фармакокинетики тедуглутида.
Реакции в месте инъекций
Реакции в месте инъекции развивались у 26 % пациентов с СКК, получавших лечение тедуглутидом, по сравнению с 5 % пациентов в группе плацебо. Реакции включали гематому, эритему, боль, припухлость и кровотечение в месте инъекции (см. также раздел «Особые указания»). Большинство реакций были умеренными по своей тяжести и не приводили к отмене препарата.
С-реактивный белок
В течение первых 7 дней терапии тедуглутидом наблюдали умеренное повышение концентрации С-реактивного белка примерно до 25 мг/л, которое непрерывно уменьшалось по мере продолжения ежедневного введения препарата. Через 24 недели применения тедуглутида у пациентов отмечалось небольшое общее повышение концентрации С-реактивного белка, в среднем на 1,5 мг/л. Эти изменения не сопровождались изменениями других лабораторных показателей или клиническими симптомами. Не наблюдалось клинически значимого среднего увеличения концентрации С-реактивного белка от исходного значения после продлённой терапии тедуглутидом в течение до 30 месяцев.
Дети
В 2 завершённых КИ 87 детей (в возрасте от 1 года до 17 лет) получали тедуглутид в течение периода до 6 месяцев. Ни один пациент не завершил преждевременно исследование из-за развития нежелательного явления. В целом, профиль безопасности тедуглутида (включая тип и частоту HP, а также иммуногенность) у детей и подростков (в возрасте 1–17 лет) был схожим с таковым у взрослых пациентов.
Длительные данные по безопасности ещё отсутствуют для детской популяции. Отсутствуют данные и для детей младше 1 года.
Передозировка
Максимальная доза тедуглутида, которую изучали во время программы клинической разработки препарата, составляла 86 мг/сутки в течение 8 дней. Неожидаемых системных HP не наблюдалось (см. раздел «Побочное действие»).
В случае передозировки врач должен тщательно контролировать состояние пациента.
Взаимодействие с другими лекарственными средствами
Исследований лекарственного взаимодействия тедуглутида не проводилось. Результаты исследования in vitro показали, что тедуглутид не ингибирует изоферменты системы цитохрома P450, участвующие в метаболизме лекарственных средств. Учитывая фармакодинамический эффект тедуглутида существует возможность повышения абсорбции одновременно принимаемых лекарственных препаратов (см. раздел «Особые указания»).
Особые указания
Следует регистрировать каждый случай введения препарата Гэттестив пациенту, записывая ФИО пациента и номер серии препарата, чтобы сохранить связь между пациентом и введённым препаратом.
Взрослые пациенты
Колоректальные полипы
До начала терапии препаратом Гэттестив необходимо выполнить колоноскопию с удалением полипов. В течение первых 2 лет терапии препаратом Гэттестив рекомендуется ежегодно выполнять колоноскопию (или альтернативный метод визуализации). Далее колоноскопию рекомендуется выполнять не реже, чем 1 раз в 5 лет. Потребность в увеличении частоты наблюдения определяется по данным индивидуальной оценки пациентов (например, возраст, основное заболевание). При обнаружении полипа, следует придерживаться текущих рекомендаций по наблюдению за полипами. В случае развития злокачественной опухоли терапию препаратом Гэттестив следует прекратить.
Желудочно-кишечная неоплазия, включая печень и желчевыводящие протоки
В исследовании канцерогенности препарата на крысах, доброкачественные опухоли были обнаружены в тонкой кишке и внепечёночных желчных протоках. Эти результаты не были подтверждены в КИ длительностью более одного года. При обнаружении неоплазии, её следует удалить. В случае развития злокачественной опухоли терапию препаратом Гэттестив следует прекратить.
Желчный пузырь и желчевыводящие протоки
В ходе КИ зарегистрированы случаи развития холецистита, холангита и желчекаменной болезни. При появлении симптомов заболевания желчного пузыря или желчных протоков необходимо повторно оценить необходимость продолжения терапии препаратом Гэттестив.
Заболевания поджелудочной железы
В ходе КИ зарегистрированы нежелательные явления со стороны поджелудочной железы, такие как хронический и острый панкреатит, стеноз протока поджелудочной железы, инфекция поджелудочной железы и повышение активности амилазы и липазы в крови. При развитии нежелательных реакций со стороны поджелудочной железы, необходимо повторно оценить необходимость продолжения терапии препаратом Гэттестив.
Мониторинг тонкого кишечника, желчного пузыря и желчных протоков, поджелудочной железы
В соответствии с руководствами по терапии необходимо вести тщательное наблюдение за пациентами с СКК. Как правило, это мониторинг признаков и симптомов нарушения функции тонкой кишки, желчного пузыря и желчных протоков, поджелудочной железы, и, если потребуется, проведение дополнительных лабораторных исследований и соответствующих методов визуализации.
Непроходимость кишечника
В КИ зафиксированы случаи непроходимости кишечника. В случае рецидива непроходимости кишечника, необходимо повторно оценить необходимость продолжения терапии препаратом Гэттестив.
Гиперволемия и электролитный баланс
Чтобы избежать гиперволемии или обезвоживания, у пациентов, получающих терапию препаратом Гэттестив. требуется тщательная корректировка парентеральной поддержки. Электролитный баланс и водный баланс следует тщательно контролировать на протяжении всего лечения, особенно во время первоначального терапевтического ответа и прекращения лечения.
Гиперволемия:
В КИ наблюдались случаи гиперволемии. Гиперволемия наиболее часто развивалась в первые 4 недели терапии и уменьшалась со временем.
В связи с повышенным всасыванием жидкости необходимо контролировать пациентов с заболеваниями сердечно-сосудистой системы, такими как сердечная недостаточность и артериальная гипертензия, в отношении развития гиперволемии, особенно в начале терапии. Пациенты должны сообщать своему врачу о внезапной прибавке массы тела, отёке лица и области голеностопных суставов и/или одышке. В целом, гиперволемию можно предотвратить, своевременно выполнив соответствующую оценку потребности в парентеральном питании. Эту оценку необходимо проводить чаще в первые месяцы терапии.
В КИ зарегистрированы случаи хронической сердечной недостаточности. При выраженном ухудшении заболевания сердечно-сосудистой системы, необходимо повторно оценить необходимость продолжения терапии препаратом Гэттестив.
Обезвоживание:
Пациенты с СКК подвержены обезвоживанию, которое может привести к острой почечной недостаточности.
Пациентам, получающим препарат Гэттестив, следует осторожно уменьшать парентеральное питание и не прекращать его применение резко. После уменьшения парентерального питания необходимо оценить объём жидкости у пациента и, если потребуется, провести соответствующую коррекцию.
Сопутствующая терапия
Необходимо осуществлять тщательный контроль за пациентами, получающими сопутствующую терапию пероральными лекарственными препаратами, требующими титрования дозы или с узким терапевтическим индексом, из-за возможного увеличения абсорбции.
Особые клинические состояния
Препарат Гэттестив не изучали у пациентов с тяжёлыми, клинически нестабильными сопутствующими заболеваниями (например, заболеваниями сердечно-сосудистой, дыхательной, почечной, эндокринной, печёночной систем, ЦНС или инфекционными заболеваниями). Следует соблюдать осторожность при назначении препарата Гэттестив этим пациентам.
Препарат Гэттестив не изучали у пациентов со злокачественными новообразованиями за последние 5 лет.
Печёночная недостаточность
Исследований препарата Гэттестив у пациентов с тяжёлой степенью печёночной недостаточности не проводилось. Согласно полученным данным не требуется ограничивать применение препарата у пациентов с печёночной недостаточностью средней тяжести.
Прекращение терапии
Из-за риска развития дегидратации необходимо осторожно прекращать терапию препаратом Гэттестив.
Дети
Смотрите также общие предостережения, указанные для взрослых пациентов в этом разделе.
Колоректальные полипы/Неоплазия
До начала применения препарата Гэттестив всем детям и подросткам необходимо выполнить анализ кала на скрытую кровь. При наличии крови в стуле неясной этиологии следует провести колоноскопию/сигмоидоскопию. Последующее исследование кала на скрытую кровь следует выполнять ежегодно у всех детей и подростков на фоне применения препарата Гэттестив.
Проведение колоноскопии/сигмоидоскопии рекомендуется всем детям и подросткам после 1 года лечения, а затем не реже, чем 1 раз в 5 лет по мере продолжения терапии препаратом Гэттестив, а также в случае нового или необъяснимого желудочно-кишечного кровотечения.
Доклинические данные по безопасности
В исследованиях субхронической и хронической токсичности отмечали гиперплазию желчного пузыря, желчных протоков и протоков поджелудочной железы. Эти наблюдения потенциально ассоциировались с ожидаемыми фармакологическими свойствами тедуглутида и были обратимыми в разной степени в течение 8–13 недель после длительного применения.
Канцерогенность /мутагенность
Результаты стандартного набора тестов на генотоксичность тедуглутида были отри дательными.
В исследовании канцерогенности у крыс доброкачественные опухоли, связанные с терапией, включали опухоли эпителия желчного протока у самцов, у которых плазменные концентрации тедуглутида были примерно в 32 и 155 раз выше, чем у пациентов, получавших препарат ежедневно в рекомендуемой дозе (частота: у 1 из 44 и у 4 из 48, соответственно). Аденому слизистой оболочки тощей кишки наблюдали у 1 из 50 самцов и у 5 из 50 самцов, у которых плазменные концентрации тедуглутида были примерно в 10 и 155 раз выше, чем у пациентов, получавших препарат ежедневно в рекомендуемой дозе. Кроме того, аденокарцинома тощей кишки отмечена у самца крысы, получавшего препарат в наименьшей из исследуемых доз (величина плазменной экспозиции животного: человека различалась примерно в 10 раз).
Токсичное влияние на репродуктивную систему и развитие плода
Исследования токсичного влияния тедуглутида на репродуктивную систему и развитие плода проводили на крысах и кроликах, которым препарат вводили в дозах 0; 2; 10 и 50 мг/кг/сутки. Тедуглутид не оказывал влияния на репродуктивную функцию или параметры развития плода, определяемые в исследованиях фертильности, эмбриофетального развития, пре- и постнатального развития. Данные исследования фармакокинетики показали, что экспозиция тедуглутида у плода кролика и крыс-сосунков очень низкая.
Фертильность
Данных о влиянии тедуглутида на фертильность человека нет. Результаты исследований на животных не выявили нарушения фертильности.
Реакции в месте инъекций
В ходе доклинических исследований выявлены очаги выраженного гранулематозного воспаления в местах инъекций.
Вспомогательные вещества
Препарат Гэттестив содержит менее 1 ммоль натрия (23 мг) в одном флаконе, что практически означает отсутствие натрия в препарате.
Влияние на способность управлять транспортными средствами, механизмами
Терапия препаратом Гэттестив оказывает незначительное влияние на способность управлять транспортными средствами и механизмами. Однако в КИ препарата наблюдались обморочные состояния (см. раздел «Побочное действие»). Данные HP могут влиять на способность к управлению транспортными средствами и механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения, 5 мг (в комплекте с растворителем).
Лиофилизат: количество препарата, содержащее 5 мг тедуглутида, помещают во флакон (3 мл) из боросиликатного стекла (тип I), укупоренный бромбутилкаучуковой пробкой (13 мм), уплотнённой алюминиевым колпачком, снабжённым отрывным пластиковым диском типа «flip-off».
Растворитель: 0,5 мл растворителя в предварительно заполненном шприце (1,5 мл) из боросиликатного стекла (тип I), с бороздкой и насадкой Люэра, запечатанной пробкой из бромобутилового каучука, покрытой плёнкой FluroTec®.
По 1 флакону с лиофилизатом и по 1 предварительно заполненному шприцу с растворителем с инструкцией по медицинскому применению помещают в пачку картонную.
По 28 флаконов с лиофилизатом и по 28 предварительно заполненных шприцев с растворителем с инструкцией по медицинскому применению помещают в картонную пачку.
Для контроля первого вскрытия пачки предусмотрено наличие двух специальных стикеров.
Хранение
При температуре не выше 25 °C.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
Лиофилизат — 4 года.
Растворитель — 4 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Shire Pharmaceuticals Ireland, Limited, Ирландия
Patheon Italia, S.p.A., Италия
Almaс Pharma Services, Limited, Великобритания
Vetter Pharma-Fertigung, GmbH & Co. KG, Германия
Владелец регистрационного удостоверения
Шайер Фармасьютикалс Айерленд Лимитед, Ирландия
Shire Pharmaceuticals Ireland Limited
Block 2&3 Miesian Plaza, 50-58 Baggot Street Lower, Dublin 2, D02 Y754, Ireland
Производитель
Лиофилизат (производитель и первичный упаковщик)
Патеон Италия С.И.А., Италия
Patheon Italia S.P.A.
Viale G.B. Stucchi, 110, 20900 Monza (MB), Italia
Растворитель (производитель и первичный упаковщик)
Веттер Фарма-Фертигунг ГмбХ и Ко. КГ, Германия
Vetter Pharma-Fertigung GmbH & Со. KG
Eisenbahnstrasse 2-4, 88085, Langenargen, Germany
Выпускающий контроль качества
Шайер Фармасьютикалс Айерленд Лимитед, Ирландия
Shire Pharmaceuticals Ireland Limited
Block 2&3 Miesian Plaza, 50-58 Baggot Street Lower, Dublin 2, D02 Y754, Ireland
Организация, принимающая претензии от потребителей:
ООО «Такеда Фармасьютикалс»
119048 Москва, ул. Усачёва, д. 2, стр. 1;
Телефон: +7 (495) 933 55 11;
Факс: +7 (495) 502 16 25
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Гэттестив:
