ИКАТИБАНТ-ХИМРАР
, растворРегистрационный номер
Торговое наименование
ИКАТИБАНТ-ХИМРАР
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
1 мл раствора содержит:
Действующее вещество: Икатибант 10,00 мг (в виде Икатибанта ацетата 12,50 мг)
Вспомогательные вещества: натрия гидроксид, уксусная кислота ледяная, натрия хлорид, вода для инъекций.
Описание
Прозрачная бесцветная или со слегка желтоватым оттенком жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Наследственный ангионевротический отёк (НАО) — аутосомно-доминантное заболевание, которое возникает в связи с отсутствием или дисфункцией ингибитора C1-эстеразы.
Приступы НАО сопровождаются повышенным высвобождением брадикинина, который является основным медиатором развития клинических симптомов.
НАО проявляется в виде рецидивирующих отёков кожных покровов и/или слизистых оболочек органов дыхания и желудочно-кишечного тракта. Продолжительность приступа обычно составляет от 2 до 5 дней.
Икатибант является селективным конкурентным антагонистом рецепторов брадикинина типа 2 (В2). Представляет собой синтетический декапептид по химической структуре близкий брадикинину, но имеющий в составе 5 непротеиногенных аминокислот.
Повышение концентрации брадикинина является ключевым медиатором развития клинических симптомов острого приступа НАО.
У молодых здоровых добровольцев икатибант в дозах 0,8 мг/кг в течение более 4 ч, 1,5 мг/кг/сут или 0,15 мг/кг/сут в течение 3 суток, предотвращал развитие брадикинин-индуцированной гипотензии, вазодилатации и рефлекторной тахикардии.
Установлено, что икатибант проявляет свойства конкурентного антагониста даже в случае увеличения разрешающей дозы брадикинина в 4 раза.
Клиническая эффективность и безопасность
Эффективность была изучена в клинических исследованиях (КИ). Медиана времени до начала купирования симптомов у пациентов, получавших икатибант, была меньше (2,0; 2,5 и 2,0 ч, соответственно), чем на фоне применения транексамовой кислоты (12 ч) или плацебо (4,6 и 19,8 ч). Терапевтическое действие икатибанта было подтверждено и вторичными конечными точками эффективности. По результатам обобщённого анализа этих контролируемых КИ фазы III время до начала купирования симптомов и время до начала купирования основных симптомов было сопоставимо и не зависело от возраста, пола, расовой принадлежности, массы тела, а также сопутствующего приёма андрогенов или антифибринолитиков. При лечении икатибантом первых 15 приступов (1114 доз для лечения 1030 приступов) медиана времени до начала купирования симптомов была сопоставима (2,0-2,5 ч). Для лечения 92,4 % приступов НАО было достаточно одной дозы икатибанта. Всего в этих исследованиях получили лечение 66 пациентов с приступами НАО, проявляющимися отёком гортани. Полученные результаты были сопоставимы с результатами лечения пациентов с НАО другой локализации по времени начала регрессии симптомов.
Применение у детей
Открытое нерандомизированное в одной группе КИ включало 32 пациента. Все пациенты получили, по крайней мере, одну дозу икатибанта (0,4 мг/кг массы тела, но не более максимальной дозы 30 мг). В целом медиана времени до начала купирования симптомов составляла 1,0 ч. Через 1 ч и 2 ч после начала терапии, соответственно, у 50 % и 90 % пациентов отмечалось уменьшение выраженности симптомов. В общем, медиана времени до минимизации симптомов (самый короткий промежуток времени от начала терапии до момента, когда все симптомы либо стали слабыми, либо полностью исчезли) составляла 1,1 ч.
Фармакокинетика
Фармакокинетику икатибанта изучали при внутривенном и подкожном введении препарата здоровым добровольцам и пациентам. Фармакокинетические параметры икатибанта у пациентов с НАО не отличались от соответствующих показателей у здоровых добровольцев.
Абсорбция
При подкожном введении абсолютная биодоступность икатибанта составляет 97 %. Время достижения максимальной концентрации в плазме крови — приблизительно 30 мин.
Распределение
Объём распределения (Vss) икатибанта в организме человека составляет 20-25 л. Связь с белками плазмы крови — 44 %.
Выведений
Большая часть икатибанта метаболизируется и меньше 10 % его выводится почками в неизменённом виде. Клиренс составляет 15–20 л/ч независимо от дозы препарата. Период полувыведения (T½) составляет 1–2 ч.
Биотрансформация
В процессе метаболизма икатибанта под действием протеолитических ферментов образуются неактивные метаболиты, которые полностью выводятся почками. В исследованиях in vitro подтверждено, что икатибант не подвергается метаболизму путём окисления, не является ингибитором основных изоферментов цитохрома (CYP) Р450 (CYP1A2, 2А6, 2В6, 2С8, 2С9, 2С19, 2D6, 2Е1 и ЗА4) и не индуцирует CYP1A2 и ЗА4.
Особые группы пациентов
Пожилые
Известно, что снижающаяся с возрастом экскреция способствует повышению экспозиции икатибанта примерно на 50–60 % у пожилых пациентов (75–80 лет) по сравнению с пациентами в возрасте 40 лет.
Половая принадлежность
Полученные данные указывают на отсутствие различий клиренса, скорректированного по массе тела, у женщин и мужчин.
Печёночная и почечная недостаточность
Ограниченные данные позволяют предположить, что на экспозицию икатибанта не оказывает влияние печёночная или почечная недостаточность.
Расовая принадлежность
Информация о возможном эффекте расовой принадлежности ограничена. Полученные результаты определения экспозиции не предполагают различий клиренса у белого населения (n = 132) и представителей других рас (n = 40).
Дети
После однократного подкожного введения икатибанта (в дозах от 0,4 мг/кг до максимальной дозы 30 мг) время достижения его максимальной концентрации в плазме крови составляло приблизительно 30 мин, а T½ — около 2 ч. Не было отмечено различий в экспозиции икатибанта у пациентов во время приступа НАО и в период между приступами.
Популяционное фармакокинетическое моделирование с использованием данных как взрослых пациентов, так и детей, показало, что клиренс икатибанта зависит от массы тела: у детей с приступами НАО более низкие значения клиренса соответствовали более низким значениям массы тела. Рассчитанная на основе данных моделирования экспозиция икатибанта у детей с НАО при определении дозы препарата с учётом массы тела оказывается ниже, чем экспозиция, определённая в КИ у взрослых пациентов с НАО.
Показания
Препарат ИКАТИБАНТ-ХИМРАР показан для симптоматического лечения острых приступов наследственного ангионевротического отёка (обусловленного дефицитом ингибитора C1-эстеразы) у взрослых, подростков и детей в возрасте от 2 лет и старше.
Противопоказания
Повышенная чувствительность к компонентам препарата (действующему веществу и вспомогательным веществам).
Одновременный приём ингибиторов ангиотензин-превращающего фермента.
Детский возраст до 2 лет или масса тела пациента менее 12 кг (эффективность и безопасность применения не установлены).
С осторожностью
У пациентов:
- при обострении ишемической болезни сердца или нестабильной стенокардии;
- в первые; недели после инсульта (см. «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Клинические данные о применении икатибанта в период беременности отсутствуют.
Данные доклинических исследований указывают на неблагоприятное влияние препарата на процесс имплантации плодного яйца и на родоразрешение, но потенциальный риск для человека не определён.
Препарат ИКАТИБАНТ-ХИМРАР может применяться при беременности только после тщательной оценки соотношения польза/риск для матери и плода, например, для лечения угрожающего жизни приступа НАО, сопровождающегося отёком гортани.
Грудное вскармливание
Икатибант проникает в молоко лактирующих крыс в концентрациях, аналогичных крови матери. Не обнаружено влияние на постнатальное развитие крысят. Неизвестно, проникает ли икатибант в грудное молоко человека, поэтому после применения препарата ИКАТИБАНТ-ХИМРАР у кормящей пациентки следует исключить кормление грудью на последующие 12 ч.
Фертильность
Не отмечено клинически значимых изменений базальной и гормон-стимулированной концентрации половых гормонов как у женщин, так и у мужчин. Икатибант не оказывал значимое влияние на концентрацию прогестерона в период лютеиновой фазы и функцию жёлтого тела или на продолжительность менструального цикла у женщин. Икатибант не влияет на качественный и количественный состав спермы, подвижность и морфологию сперматозоидов у мужчин.
Способ применения и дозы
Препарат ИКАТИБАНТ-ХИМРАР предназначен для подкожного введения, предпочтительно в область передней брюшной стенки.
Применение препарата ИКАТИБАНТ-ХИМРАР проводят под контролем квалифицированного медицинского сотрудника.
Решение о возможности самостоятельного введения препарата ИКАТИБАНТ-ХИМРАР пациентом или лицом, осуществляющим уход за ним, принимает врач, имеющий опыт диагностики и лечения НАО.
Пациенты с клиническими проявлениями отёка гортани должны быть экстренно госпитализированы, им следует находиться под наблюдением врача до полного купирования приступа НАО.
Препарат ИКАТИБАНТ-ХИМРАР в лекарственной форме раствор для подкожного введения следует вводить медленно с учётом объёма, подлежащего введению.
Шприц, содержащий препарат ИКАТИБАНТ-ХИМРАР, предназначен только для однократного применения.
Подбор дозы
Взрослые
Рекомендуемая доза для взрослых — однократная подкожная инъекция 30 мг препарата ИКАТИБАНТ-ХИМРАР.
В большинстве случаев однократного введения препарата ИКАТИБАНТ-ХИМРАР достаточно для купирования симптомов НАО. В случае недостаточной эффективности или рецидива приступа НАО можно ввести препарат ИКАТИБАНТ-ХИМРАР повторно через 6 ч. Если после повторного введения препарата симптомы НАО сохраняются или приступ ЙАО рецидивирует, третья инъекция препарата может быть выполнена ещё через 6 ч. Не рекомендуется превышать максимальную суточную дозу препарата — 90 мг (3 инъекции препарата ИКАТИБАНТ-ХИМРАР).
Имеются данные КИ о проведении не более 8 инъекций икатибанта в течение месяца.
Педиатрическая популяция
Рекомендуемая доза препарата ИКАТИБАНТ-ХИМРАР, рассчитанная с учётом массы тела ребёнка и подростка (в возрасте 2–17 лет), указана в Таблице 1. Если остаются сомнения в отношении извлекаемого объёма препарата, нужно обратиться к врачу.
Таблица 1
| Масса тела | Доза (Объём инъекции) |
| 12–25 кг | 10 мг (1,0 мл) |
| 26–40 кг | 15 мг (1,5 мл) |
| 41–50 кг | 20 мг (2,0 мл) |
| 51–65 кг | 25 мг (2,5 мл) |
| >65 кг | 30 мг (3,0 мл) |
В рамках КИ применяли не более 1 инъекции икатибанта для лечения приступа НАО.
Нет рекомендаций в отношении режима дозирования для детей младше 2 лет или с массой тела менее 12 кг, так как безопасность и эффективность применения икатибанта у этой группы пациентов не установлена.
Пожилые
Данные о применении икатибанта в группе пациентов старше 65 лет ограничены.
Установлено, что у пожилых пациентов системная экспозиция икатибанта повышена, однако, клиническая значимость данного наблюдения в отношении безопасности икатибанта не определена.
Нарушения функции печени
При печёночной недостаточности не требуется изменения дозы препарата ИКАТИБАНТ-
ХИМРАР.
Нарушения функции почек
При почечной недостаточности не требуется изменения дозы препарата ИКАТИБАНТ-ХИМРАР.
Способ применения
Взрослые
Препарат ИКАТИБАНТ-ХИМРАР может быть введён самостоятельно пациентом или лицом, осуществляющим уход за ним, только после обучения технике выполнения подкожных инъекций под контролем медицинского сотрудника.
Дети и подростки в возрасте 2–17 лет
Препарат ИКАТИБАНТ-ХИМРАР может быть введён лицом, осуществляющим уход за пациентом, только после обучения технике выполнения подкожных инъекций под контролем медицинского сотрудника.
Пошаговая инструкция
- для самостоятельного введения (взрослые пациенты);
- для введения препарата лицом, осуществляющим уход за пациентом, или
- медицинским сотрудником взрослому пациенту, подростку или ребёнку в возрасте старше 2 лет (с массой тела не менее 12 кг)
Инструкция по введению препарата включает следующие основные шаги:
- Общая важная информация.
- а) Подготовка шприца для детей и подростков (2–17 лет) с массой тела 65 кг или меньше.
- б) Подготовка шприца и иглы для инъекции (все пациенты).
- Подготовка места инъекции.
- Введение препарата.
- Уничтожение материалов, использованных для проведения инъекции.
Пошаговая инструкция по технике проведения инъекции
1. Общая важная информация
- Протрите рабочую поверхность и вымойте руки водой и мылом перед началом манипуляций.
- Вскройте блистер.
- Достаньте предварительно заполненный шприц из блистерной упаковки. Раствор должен быть прозрачным, бесцветным или слегка желтоватого цвета и не содержать видимых частиц.
- Отверните навинчивающуюся крышечку с предварительно заполненного шприца.
- Положите предварительно заполненный шприц на рабочую поверхность после того, как отвернёте крышечку.
2. а) Подготовка шприца для детей и подростков (2–17 лет) с массой тела 65 кг или меньше
⚠ Важная информация для медицинских работников и лиц, осуществляющих уход за пациентами
Если доза меньше 30 мг (3 мл), потребуются следующие принадлежности для извлечения необходимого количества препарата (см. ниже):
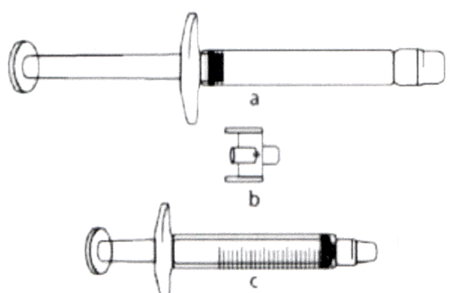
а) Препарат ИКАТИБАНТ-ХИМРАР в предварительно заполненном шприце (содержит раствор икатибанта).
б) Соединительное устройство (коннектор для насадки Люэра, необходимо приобрести отдельно).
с) Градуированный шприц на 3 мл (подходящий к коннектору, необходимо приобрести отдельно).
Необходимый объём раствора для инъекции, выраженный в миллилитрах (мл), следует перенести в пустой 3 мл градуированный шприц (см. Таблицу 1).
⚠ Избегайте прикосновения к обоим концам коннектора и/или кончику шприца для предупреждения их загрязнения
- Удалите колпачки с обоих концов соединительного устройства (коннектора).
- Отверните навинчивающуюся крышечку с предварительно заполненного шприца.
- Присоедините коннектор на конец предварительно заполненного шприца.
- Отверните навинчивающуюся крышечку с пустого градуированного шприца.
- Круговым движением присоедините градуированный шприц к другому концу коннектора и убедитесь, что оба его соединения надёжные.
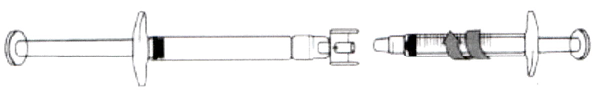
Перенос раствора икатибанта в градуированный шприц
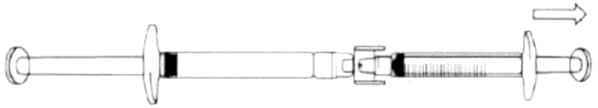
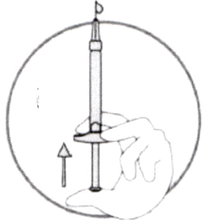
- Для того чтобы начать перенос раствора икатибанта, надавите на поршень предварительно заполненного шприца (слева на рис. ниже).
- Если раствор икатибанта не поступает в градуированный шприц, слегка потяните за поршень градуированного шприца до тех пор, пока раствор икатибанта не начнёт поступать в него (см. рис. ниже).
Продолжайте давить на поршень предварительно заполненного шприца до тех пор, пока необходимый для инъекции объём (доза) не будет перенесён в градуированный шприц. Проверьте по Таблице 1 необходимое количество миллилитров и требуемую дозу препарата.
Если в градуированный шприц попал воздух
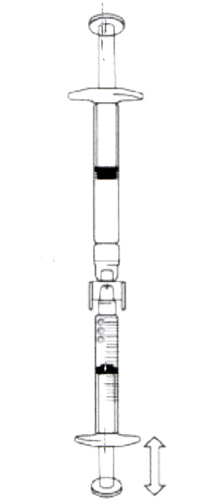
а) Поверните соединённые шприцы таким образом, чтобы предварительно заполненный шприц оказался сверху. Надавите на поршень градуированного шприца для того, чтобы пузырьки воздуха вернулись обратно в предварительно заполненный шприц (этот шаг, возможно, придётся повторить несколько раз).
б) Отберите требуемый объём раствора икатибанта.
- Отсоедините предварительно заполненный шприц и коннектор от градуированного шприца.
- Выбросите предварительно заполненный шприц и коннектор в контейнер для использованных острых медицинских предметов.
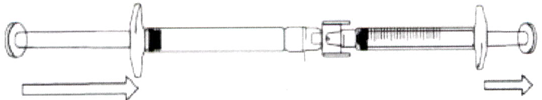
2. б) Подготовка шприца и иглы для инъекции (все пациенты, независимо от возраста)
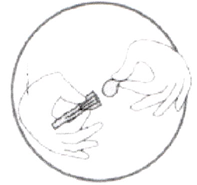
- Достаньте контейнер с иглой из блистера.
- Удалите защитную плёнку с контейнера, как показано на рисунке (игла должна оставаться в контейнере).
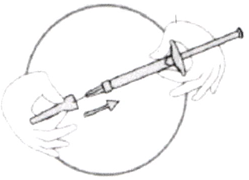
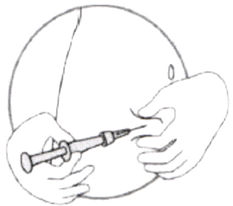
- Крепко взяв шприц, содержащий прозрачный бесцветный или слегка желтоватого цвета раствор препарата без видимых частиц, аккуратно наденьте на него иглу, не вынимая её из контейнера (см. рис. ниже).
- Не вынимая иглу из контейнера, зафиксируйте шприц и иглу винтовым движением шприца.
- Достаньте иглу из контейнера, потянув за шприц. Не нажимайте на поршень!
- Шприц подготовлен к проведению инъекции.
3. Подготовка места инъекции
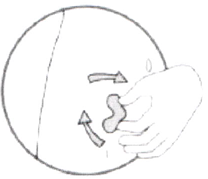
- Выберите место для инъекции. Это должна быть кожная складка в области передней брюшной стенки, с левой или с правой стороны, на расстоянии 5–10 см ниже пупка. Необходимо отступить не меньше, чем на 5 см от любых шрамов. Препарат не следует вводить в отечные или болезненные участки кожи, а также с кровоизлияниями или гематомами.
- Обработайте кожу тампоном со спиртовым раствором и немного подождите, чтобы кожа высохла.
4. Введение препарата
- Держите шприц в одной руке между 2 пальцами, расположив большой палец на основании поршня.
- Проверьте, что в шприце нет воздушных пузырьков, нажимая на поршень до появления первой капли раствора на кончике иглы.
- Держите шприц под углом 45–90° к поверхности кожи с иглой, обращённой в сторону места инъекции.
- Держа шприц в одной руке, другой рукой аккуратно держите кожную складку между большим и указательным пальцами в месте, где кожа была предварительно продезинфицирована.
- Продолжая держать кожную складку, поднесите шприц к месту инъекции, быстро введите иглу в кожную складку.
- Медленно нажимая на поршень шприца и сохраняя твёрдость руки, введите весь раствор в кожную складку. В шприце не должно остаться жидкости.
- Вводите препарат медленно, чтобы продолжительность инъекции была примерно в течение 30 с.
- Отпустите кожную складку и осторожно выньте иглу.
5. Уничтожение материалов, использованных при инъекции
Для безопасного и надёжного обращения с отходами, использованные шприцы, контейнер от иглы и саму иглу поместите в контейнер для использованных острых медицинских предметов и отходов.
Побочное действие
Резюме Профиля безопасности
Практически у всех пациентов, принимавших участие в КИ икатибанта, были отмечены нежелательные реакции в месте подкожного введения препарата, характеризующиеся раздражением кожи, её отёком, покраснением, ощущением боли, зуда и жжения. В целом реакции были от лёгкой до средней степени тяжести, кратковременными, не требовали дополнительной терапии.
Для оценки частоты нежелательных лекарственных реакций (НЛР) использованы следующие критерии (согласно классификации Всемирной организации здравоохранения (ВОЗ)): очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (установить частоту по имеющимся данным не представляется возможным).
Таблица 2
| Классификация по заболеваниям, органам и системам | НЛР (предпочтительный термин) |
| Нарушения со стороны нервной системы | часто: головокружение, головная боль |
| Нарушения со стороны желудочно-кишечного тракта | часто: тошнота |
| Нарушения со стороны кожи и подкожных тканей | часто: сыпь, покраснение, зуд частота неизвестна: крапивница* |
| Общие расстройства и нарушения в месте введения | очень часто: реакции в месте введения (кровоподтёки, гематома, ощущение жжения, покраснение кожи, снижение и отсутствие чувствительности кожи, раздражение кожи, припухлость, боль, ощущение распирания, зуд, отёк, крапивница и ощущение тепла) часто: повышение температуры тела (пирексия) |
| Лабораторные и инструментальные данные | часто: повышение активности «печёночных» трансаминаз |
* НЛР, отмеченные в пострегистрационном периоде
Педиатрическая популяция
У большинства детей и подростков, которых лечили с помощью подкожных инъекций икатибанта, были отмечены нежелательные реакции в месте введения препарата, такие как покраснение и отёк кожи, зуд, боль и ощущение жжения. Эти НЛР были от лёгкой до средней степени тяжести и были схожими с НЛР, зарегистрированными у взрослых.
У 2 пациентов НЛР были расценены как тяжёлые, они полностью разрешились в течение 6 ч. Эти реакции проявлялись покраснением, отёком, ощущением жжения и тепла.
Результаты КИ не выявили клинически значимых изменений уровня репродуктивных гормонов.
Описание отдельных побочных эффектов
Иммуногенность
В контролируемых КИ фазы III при повторных курсах лечения в редких случаях в плазме крови пациентов выявляли кратковременное присутствие антител к икатибанту. При этом ни у одного из пациентов не было отмечено снижения активности икатибанта. У одного пациента антитела к икатибанту определялись до лечения икатибантом и после завершения лечения. Результаты последующих исследований (в течение 5 мес.) антител к икатибанту были отрицательными.
Реакций повышенной чувствительности или анафилактических реакций при применении икатибанта отмечено не было.
Передозировка
Не отмечено случаев передозировки икатибанта.
Внутривенное введение икатибанта в дозе 3,2 мг/кг (приблизительно в 8 раз выше терапевтической дозы) здоровым добровольцам в рамках КИ сопровождалось покраснением, зудом, «приливами» крови к коже или артериальной гипотензией.
Специального лечения не требовалось.
Взаимодействие с другими лекарственными средствами
Фармакокинетические взаимодействия икатибанта с изоферментами (СУР) цитохрома P450 не предполагаются.
Одновременное применение икатибанта и ингибиторов ангиотензин-превращающего фермента (АПФ) не было изучено. В связи с повышением брадикинина в плазме крови у пациентов с НАО, совместное применение препарата ИКАТИБАНТ-ХИМРАР и ингибиторов АПФ противопоказано.
Особые указания
Препарат ИКАТИБАНТ-ХИМРАР следует применять с осторожностью при самостоятельном введении в амбулаторных условиях.
Пациентам, которые прежде не получали препарат ИКАТИБАНТ-ХИМРАР, первое введение следует проводить в медицинском учреждении или под руководством врача.
В случае недостаточного эффекта препарата ИКАТИБАНТ-ХИМРАР или рецидиве приступа после введения препарата ИКАТИБАНТ-ХИМРАР пациентом или лицом, осуществляющим уход за ним, рекомендуется обратиться к врачу. При неэффективности первой инъекции для лечения приступа повторные введения препарата ИКАТИБАНТ- ХИМРАР взрослым пациентам должны проводиться в медицинском учреждении.
Данных о повторном введении икатибанта при неэффективности первой инъекции для лечения приступа у детей и подростков нет.
Обязательна госпитализация пациентов с симптомами отёка гортани, в том числе в случаях, когда приступ купировался после самостоятельного введения препарата ИКАТИБАНТ-ХИМРАР в амбулаторных условиях.
Отёк гортани
После введения препарата ИКАТИБАНТ-ХИМРАР пациенты с симптомами отёка гортани должны наблюдаться в соответствующем стационаре до того момента, пока врач не примет решение о выписке.
Ишемическая болезнь сердца
При сопутствующей ишемической болезни сердца нельзя исключить возможность ухудшения функции миокарда и снижения коронарного кровотока, учитывая свойства антагониста рецепторов брадикинина типа 2. Поэтому препарат ИКАТИБАНТ-ХИМРАР следует с осторожностью назначать пациентам с нестабильной стенокардией или при обострении ишемической болезни сердца.
Инсульт
Несмотря на очевидный факт положительного влияния блокады B2-рецепторов в острый период нарушения мозгового кровообращения, теоретически существует возможность того, что икатибант может снижать нейропротективные эффекты поздней фазы брадикинина. Следовательно, пациентам в первые недели после инсульта следует назначать препарат ИКАТИБАНТ-ХИМРАР с осторожностью.
Педиатрическая популяция
Имеется ограниченный опыт применения икатибанта при лечении более чем одного приступа НАО у детей и подростков.
Неиспользованный препарат ИКАТИБАНТ-ХИМРАР или использованные материалы должны быть утилизированы в соответствии с местными требованиями.
Влияние на способность управлять транспортными средствами, механизмами
Икатибант обладает незначительным влиянием на способность к управлению транспортными средствами и механизмами. В период применения препарата ИКАТИБАНТ-ХИМРАР возможно появление таких симптомов, как повышенная слабость, заторможенность, утомляемость, сонливость и головокружение. Нельзя исключить связь указанных симптомов с клиническими проявлениями НАО. Пациентам в период лечения следует воздержаться от вождения автотранспорта и управления механизмами, если они чувствуют усталость или головокружение.
Форма выпуска
Раствор для подкожного введения, 10 мг/мл.
3,0 мл препарата в предварительно заполненном шприце из прозрачного стекла типа I, снабжённым ограничителем хода поршня из бромбутила, насадкой Люэра из поликарбоната, закрытым навинчивающейся крышкой и упором для пальцев. По 1 шприцу в комплекте с инъекционной иглой (25G, 16 мм) в блистерной упаковке. Блистер покрыт нетканным материалом из синтетических волокон марки Tyvek®. По 1 блистерной упаковке вместе с инструкцией по применению помещают в пачку картонную.
Хранение
При температуре не выше 25 °C. Хранить в оригинальной упаковке. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года. Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
ИИХР, АО, Российская Федерация
Московская обл., г.о. Химки, г. Химки, ул. Рабочая, д. 2А, стр. 1
Держатель РУ и Организация, принимающая претензии от потребителя
АО «ИИХР», Россия 141401, Московская обл., г.о. Химки, г. Химки, ул. Рабочая, д. 2А, стр. 1
тел.: + 7 (495) 995-49-41
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате ИКАТИБАНТ-ХИМРАР:
