Адвейт
AdvateРегистрационный номер
Торговое наименование
Адвейт
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
1 флакон с лиофилизатом содержит:
действующее вещество: октоког альфа 250 МЕ, 500 МЕ, 1000 МЕ или 1500 МЕ;
вспомогательные вещества (на 1 мл восстановленного раствора): трегалозы дигидрат 8,0 мг/мл, гистидин 1,6 мг /мл, трометамол 1,2 мг/мл, натрия хлорид 5,3 мг/мл, кальция хлорида дигидрат 0,2 мг/мл, глутатион (восстановленный) 0,08 мг/мл, полисорбат-80 0,1 мг/мл, маннитол 32 мг/мл.
1 флакон с растворителем содержит:
вода для инъекций 5 мл.
Специфическая активность препарата АДВЕЙТ составляет от 4000 до 10000 МЕ на миллиграмм белка.
Препарат АДВЕЙТ произведён методом рекомбинантной технологии в культуре овариальных клеток китайского хомячка, без добавления протеинов человеческого или животного происхождения в процессе производства.
Препарат АДВЕЙТ приблизительно содержит (после восстановления с помощью 5 мл воды для инъекций):
- 50 МЕ/мл октоког альфа для дозировки 250 МЕ;
- 100 МЕ/мл октоког альфа для дозировки 500 МЕ;
- 200 МЕ/мл октоког альфа для дозировки 1000 МЕ;
- 300 МЕ/мл октоког альфа для дозировки 1500 МЕ;
Препарат не содержит консервантов.
Описание
Лиофилизат: порошок или ломкая масса белого или белого е желтоватым оттенком цвета.
Растворитель: прозрачная, бесцветная жидкость.
Восстановленный раствор: прозрачный бесцветный раствор без механических включений.Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Комплекс фактор VIII/фактор Виллебранда состоит из двух молекул (фактора VIII и фактора Виллебранда), имеющих разные физиологические функции.
Препарат АДВЕЙТ содержит рекомбинантный фактор свёртывания крови VIII (октоког альфа), который является гликопротеином с аминокислотной последовательностью, аналогичной человеческому фактору VIII.
Октоког альфа представляет собой гликопротеин, состоящий из 2332 аминокислот с приблизительной молекулярной массой 280 кДа. При введении пациентам, октоког альфа связывается е эндогенным фактором Виллебранда. Активированный фактор VIII действует как кофактор для активированного фактора IX, ускоряя преобразование фактора X в активированный фактор X. Активированный фактор X способствует переходу протромбина в тромбин. Тромбин, в свою очередь, способствует переходу фибриногена в фибрин, что приводит к образованию тромба (сгустка крови).
Гемофилия A является наследственным, связанным с полом, нарушением свёртывающей системы кроки со снижением уровня активности фактора VIII. Клинически проявляется профузными кровотечениями в суставы, мышцы или внутренние органы, как спонтанными, так и возникающими в результате травм или хирургических вмешательств. При проведении заместительной терапии уровень фактора VIII в плазме повышается, в результате чего происходит временная коррекция дефицита фактора в плазме крови и снижается тенденция к повышенной кровоточивости.
Фармакокинетика
Все фармакокинетические исследования препарата АДВЕЙТ проведены с участием пациентов, предварительно получавших лечение по поводу тяжёлой или умеренно тяжёлой гемофилии А (исходный уровень фактора VIII ≤2). В целом, сводные фармакокинетические данные были получены и проанализированы у 195 ранее леченных пациентов, страдающих тяжёлой гемофилией А (исходный уровень фактора VIII ≤1 %).
Таблица 1. Фармакокинетические параметры препарата АДВЕЙТ у пациентов различных возрастных групп с тяжёлой гемофилией А (исходный уровень фактора VIII <1 %).
| Параметр | Младенцы 1 мес–2 года (n = 5) | Дети 2–5 лет (n = 30) | Дети 5–12 лет (n = 18) | Подростки 12–18 лет (n = 33) | Взрослые
(n = 109) |
|---|---|---|---|---|---|
| AUC0–∞ (МЕ × ч/дл) | 1362,1 ± 311,8 | 1180,0 ± 432,7 | 1506,6 ± 530,0 | 1317,1 ± 438,6 | 1538,5 ± 529,1 |
| Скорректированное нарастание восстановления по Cmax (МЕ/дл на МЕ/кг)* | 2,2 ± 0,6 | 1,8 ± 0,4 | 2,0 ± 0,5 | 2,1 ± 0,6 | 2,2 ± 0,6 |
| Период полувыведения (ч) | 9,0 ± 1,5 | 9,6 ± 1,7 | 11,8 ± 3.8 | 12,1 ± 3,2 | 12,9 ± 4,3 |
| Максимальная концентрация в плазме после инфузии (МЕ/дл) | 110,5 ± 30,2 | 90,8 ± 19,1 | 100,5 ± 25,6 | 107,6 ± 27,6 | 111,3 ± 27,1 |
| Среднее время циркуляции в плазме (ч) | 11,0 ± 2,8 | 12,0 ± 2,7 | 15,1 ± 4,7 | 15,0 ± 5,0 | 16,2 ± 6,1 |
| Объём распределения в равновесном состоянии (дл/кг) | 0,4 ± 0,1 | 0,5 ± 0,1 | 0,5 ± 0,2 | 0,6 ± 0,2 | 0,5 ± 0,2 |
| Клиренс (дл/(кг × ч)) | 3,9 ± 0,9 | 4,8 ± 1,5 | 3,8 ± 1,5 | 4,1 ± 1,0 | 3,6 ± 1,2 |
* Рассчитывается как (Cmaxминус базовый уровень фактора VIII) разделить на лозу (МЕ/кг), где Cmax — максимальный уровень фактора VIII, определённый после введения.
Безопасность и гемостатическая эффективность препарата АДВЕЙТ у детей аналогичны безопасности и гемостатической эффективности у взрослых пациентов.
Показатель скорректированного восстановления и период полувыведения в конечной фазе (T½) у пациентов младше 6 лет были на 20 % меньше, чем у взрослых, что частично может объясняться большим объёмом плазмы на кг массы тела у детей.
В настоящее время отсутствуют данные в отношении параметров фармакокинетики препарата АДВЕЙТ у пациентов, ранее не получавших лечение.
Показания
Лечение и профилактика кровотечений у взрослых и детей, страдающих гемофилией А (наследственный дефицит фактора VIII).
Препарат АДВЕЙТ не содержит фактор Виллебранда в количестве, необходимом для достижения фармакологического эффекта, поэтому не показан для лечения болезни Виллебранда.
Противопоказания
Известная гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, а также к белкам мышей/хомячков.
Применение при беременности и в период грудного вскармливания
Влияние препарата АДВЕЙТ на репродуктивную функцию животных не изучалось. В связи с тем, что гемофилией А женщины страдают крайне редко, безопасность применения препарата АДВЕЙТ у беременных женщин и у женщин в период лактации не установлена. Перед назначением препарата АДВЕЙТ во время беременности и в периоде лактации врач должен тщательно взвесить потенциальные риски и ожидаемую пользу для каждого конкретного пациента.
Способ применения и дозы
Лечение препаратом должно быть начато под наблюдением врача, имеющего опыт в лечении гемофилии, и при наличии возможности немедленного проведения реанимационных мероприятий в случае возникновения анафилаксии.
Дозы и продолжительность лечения зависят от степени дефицита фактора VIII, локализации и интенсивности кровотечения, а также от клинического состояния пациента. Тщательный лабораторный контроль заместительной терапии особенно важен в случаях больших хирургических вмешательств и жизнеугрожающих кровотечений.
Одна Международная Единица (ME) активности фактора VIII эквивалентна количеству фактора VIII, которое содержится в 1 мл нормальной человеческой плазмы.
Лечение «по требованию»
Расчёт необходимой дозы фактора VIII основан на эмпирических данных, согласно которым препарат фактора VIII, введённый в дозе 1 МЕ на 1 кг массы тела, повышает активность фактора VIII в плазме на 2 МЕ/дл.
Необходимая доза препарата АДВЕЙТ определяется по формуле:
Требуемая доза (ME) = масса тела (кг) × необходимый % увеличения фактора VIII × 0,5
При кровотечениях и клинических ситуациях, указанных в Таблицах 2 и 3, активность фактора VIII не должна опускаться ниже заданного уровня (выраженного в % от нормальной активности или в МЕ/дл) в соответствующий период. При выборе дозы и частоты введения при эпизодах кровотечений и хирургических вмешательствах можно руководствоваться Таблицами 2 и 3.
Таблица 2. Применение препарата АДВЕЙТ при различных видах кровотечений
| Степень кровотечения | Требуемая активность фактора VIII после введения (в % от нормы или МЕ/дл) | Частота введения (интервал между введениями в часах) / Продолжительность лечения (в днях) |
|---|---|---|
| Начальные признаки гемартроза, кровоизлияние и мышцы или кровотечение и полости рта | 20–40 | Инъекции повторяют каждые 12–24 ч (каждые 8–24 ч для пациентов младше 6 лет) в течение как минимум 1 дня до купирования кровотечения, о чем свидетельствует отсутствие боли, или до полного выздоровления |
| Более выраженный гемартроз, кровоизлияние в мышцы или гематома | 30–60 | Инъекции повторяют каждые 12–24 ч (каждые 8–24 ч для пациентов младше 6 лет) в течение 3–4 дней или более до купирования боли и восстановления двигательной активности |
| Жизнеугрожающие кровотечения | 60–100 | Инъекции повторяют каждые 8–24 ч (каждые 6–12 ч для пациентов младше 6 лет) до полного купирования кровотечения и устранения угрозы жизни |
Таблица 3. Применение препарата АДВЕЙТ при хирургических вмешательствах
| Тип хирургического вмешательства | Требуемая активность фактора VIII после введения (в % от нормы или МЕ/дл) | Частота ведения (интервал между введениями в часах) / длительность лечения (в днях) |
|---|---|---|
| Малые хирургические вмешательства, включая удаление зуба | 30–60 | Вводить каждые 24 часа (каждые 12–24 ч для пациентов младше 6 лет) в течение не менее 1 дня до достижения выздоровления. |
| Большие хирургические вмешательства | 80–100 (до и после операции) | Инъекции повторяют каждые 8–24 часа (каждые 6–24 ч для пациентов младше 6 лет) до адекватного заживления раны, затем продолжать лечение ещё в течение не менее чем 7 дней, поддерживая активность фактора VIII в пределах от 30 % до 60 % (МЕ/дл). |
Дозу и частоту введения следует адаптировать индивидуально с учётом клинического ответа. При определённых обстоятельствах (например, при наличии ингибиторов в низком титре) могут потребоваться дозы препарата, превышающие расчётные.
В течение курса лечения следует определять уровень фактора свёртывания VIII в плазме с тем, чтобы при необходимости проводить коррекцию дозы или частоты введения.
При проведении больших хирургических вмешательств обязательным является мониторинг заместительной терапии путём определения активности фактора VIII в плазме.
Разные пациенты могут различаться по клиническому ответу на лечение препаратом фактора VIII, достигая различных значений фармакокинетических параметров, в частности, периода полувыведения и показателя восстановления in vivo.
Профилактика кровотечений
Для длительной профилактики кровотечений у пациентов с тяжёлой гемофилией А дозы обычно составляют от 20 до 40 МЕ фактора VIII на кг массы тела с интервалом между введениями от 2 до 3 дней.
Применение препарата у детей
При применении препарата в режиме «по требованию» рекомендуемые дозы и частота введения препарата АДВЕЙТ у детей в возрасте от 0 до 18 лет такие же, как у взрослых пациентов. Для длительной профилактики кровотечений у пациентов младше 6 лет рекомендуется применение препарата в дозе от 20 до 50 МЕ фактора VIII на кг массы тела 3–4 раза в неделю.
Способ применения
Если препарат вводится лицом, которое не имеет специализированного медицинского образования, то данное лицо должно пройти соответствующее обучение по введению препарата АДВЕЙТ,
Скорость введения препарата должна подбираться так, чтобы обеспечить пациенту максимальный комфорт. Скорость введения не должна превышать 10 мл/мин. Рекомендуется, в интересах пациента, каждый раз при введении препарата записывать название препарата и номер серии.
Препарат АДВЕЙТ должен вводиться внутривенно после восстановления лиофилизата стерильной водой для инъекций. Восстановленный раствор должен быть прозрачным, бесцветным и свободным от механических включений. Нельзя использовать помутневший раствор или раствор, содержащий видимые частицы.
- Для восстановления препарата используйте только стерильную воду для инъекций и устройство для разведения, содержащиеся в упаковке.
- Для введения препарата необходимо использовать шприц с наконечником Люэр.
- Используйте препарат в течение трёх часов после восстановления.
- Не помещайте в холодильник восстановленный препарат.
- Любой неиспользованный препарат или остаток необходимо утилизировать в соответствии с установленными требованиями.
- Не используйте устройство БАКСЖЕКТ II, если его стерильная барьерная система или упаковка повреждены, или если Вы заметили любые признаки порчи
Разведение с использованием устройства БАКСЖЕКТ II
Соблюдайте правила асептики!
- Если до момента разведения препарат хранился в холодильнике, доведите температуру препарата АДВЕЙТ (лиофилизат) и стерильной воды для инъекций (растворитель) до комнатной температуры (от 15 до 25 °C).
- Вымойте руки, используя мыло и горячую воду.
- Удалите крышки с флаконов с лиофилизатом и растворителем.
- Протрите пробки спиртовыми салфетками. Установите флаконы на плоскую чистую поверхность.
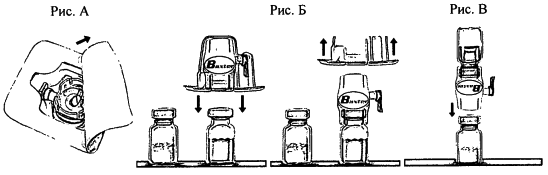
- Вскройте упаковку устройства БАКСЖЕКТ II путём удаления бумажной мембраны, не дотрагиваясь до внутреннего содержимого упаковки (см. рис. А). Не вынимайте устройство из упаковки. Не используйте, если устройство БАКСЖЕКТ II, его стерильная барьерная система или упаковка повреждены.
- Переверните упаковку и введите прозрачное пластиковое острие в пробку флакона с растворителем. Взявшись за края упаковки, потяните вверх и снимите её е устройства БАКСЖЕКТ II (см. рис. Б). Не снимайте голубой колпачок с устройства БАКСЖЕКТ II.
- Для разведения препарата используйте только стерильную воду для инъекций, содержащуюся в упаковке. Присоединив БАКСЖЕКТ II к флакону с растворителем, переверните систему таким образом, чтобы флакон с растворителем находился сверху устройства. Введите белое пластиковое острие в пробку флакона с препаратом АДВЕЙТ. За счёт вакуума растворитель перетечёт во флакон с препаратом АДВЕЙТ (см. рис. В).
Осторожно вращайте флакон до полного растворения препарата. Убедитесь, что АДВЕЙТ растворился полностью, в противном случае действующее вещество не пройдёт через фильтр устройства. Препарат растворяется быстро (обычно менее чем за 1 мин), Восстановленный раствор должен быть прозрачным, бесцветным и свободным от механических включений.
Введение препарата:
Соблюдайте правила асептики!
Перед применением восстановленный препарат необходимо проверить на отсутствие механических включений. Следует использовать только прозрачный и бесцветный раствор.
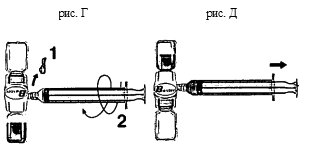
- Удалите голубой колпачок с устройства БАКСЖЕКТ II. Не втягивайте воздух в шприц! Введите шприц в БАКСЖЕКТ II (см. рис. Г).
- Переверните систему (флакон с препаратом должен находиться сверху). Наберите восстановленный раствор в ширит медленно оттянув поршень (см. рис. Д).
- Отсоедините шприц.
- Подсоедините к шприцу иглу-бабочку. Раствор следует вводить внутривенно, медленно. Скорость введения препарата не должна превышать 10 мл в минуту. До введения и во время введении препарата АДВЕЙТ необходимо контролировать частоту пульса пациента. При значительном учащении пульса, снижение скорости введения препарата или временное прекращение введения в большинстве случаев помогает быстро купировать указанные симптомы.
Побочное действие
Краткое описание профиля безопасности
В клинических исследованиях препарата АДВЕЙТ приняли участие 418 пациентов, получивших, как минимум, одно введение препарата АДВЕЙТ. Были зарегистрированы 93 нежелательные лекарственные реакции (НЛР). Наиболее часто были отмечены следующие НЛР: появление ингибиторов (нейтрализующих антител к фактору VIII), головная боль и лихорадка.
Гиперчувствительность или аллергические реакции (которые могут включать ангионевротический отёк, жжение и зуд в месте введения препарата, озноб, покраснение, распространённую крапивницу, головную боль, локализованную крапивницу, гипотензию, летаргию, тошноту, беспокойство, тахикардию, стеснение в груди, покалывание, рвоту, свистящее дыхание) наблюдались нечасто, но в некоторых случаях прогрессировали с развитием тяжёлой анафилаксии (включая анафилактический шок).
Может наблюдаться возникновение антител к белкам мышей и/или хомяков и ассоциированные реакции гиперчувствительности.
У пациентов с гемофилией А могут возникать нейтрализующие антитела (ингибиторы) к фактору VIII. Появление таких ингибиторов проявляется в виде недостаточного клинического ответа. Во всех таких случаях рекомендуется связываться со специализированным центром гемофилии.
В Таблице 4 представлены данные о частоте нежелательных реакций, информация о которых была получена в клинических исследованиях и из спонтанных сообщений. Нежелательные реакции классифицированы в соответствии с поражением органов и систем органов; названия органов и систем органов приведены в соответствии с терминологией медицинского словаря для нормативно-правовой деятельности (MedDRA).
Частота возникновения нежелательных реакций оценивалась в соответствии с классификацией ВОЗ НЛР по частоте развития: очень частые (≥1/10 назначений), частые (≥1/100 до <1/10 назначений), нечастые (≥1/1 000 до <1/100 назначений), редкие (≥1/10 000 до <1/1 000 назначений), очень редкие (<1/10 000 назначении), частота неизвестна (не может быть установлена по имеющимся данным). В пределах каждой градации частоты нежелательные эффекты представлены в порядке уменьшения степени серьёзности.
Таблица 4. Частота нежелательных реакций по системам и органам
| Классификации органов и систем органов (MedDRA) | Нежелательная реакция (MedDRA) | Частота возникновенияа |
|---|---|---|
| Инфекционные заболевания | Грипп | Нечастые |
| Ларингит | Нечастые | |
| Нарушения со стороны крови и лимфатической системы | Появление ингибиторов фактора VIIIв | Частые |
| Лимфангит | Нечастые | |
| Нарушения со стороны иммунной системы | Анафилактическая реакция | Частота неизвестна |
| Гиперчувствительностьв | Частота неизвестна | |
Нарушения со стороны нервной системы | Головная боль | Частые |
| Головокружение | Нечастые | |
| Снижение памяти | Нечастые | |
| Обморок | Нечастые | |
| Тремор | Нечастые | |
| Мигрень | Нечастые | |
| Дисгевзия | Нечастые | |
| Нарушения со стороны органа зрения | Воспаление глаза | Нечастые |
Нарушения со стороны сосудов | Гематома | Нечастые |
| Приливы жара | Нечастые | |
| Бледность | Нечастые | |
| Нарушения со стороны сердца | Ощущение сердцебиения | Нечастые |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Диспноэ | Нечастые |
| Нарушения со стороны желудочно-кишечного тракта | Диарея | Нечастые |
| Боль в верхних отделах живота | Нечастые | |
| Тошнота | Нечастые | |
| Рвота | Нечастые | |
| Нарушения со стороны кожи и подкожных тканей | Зуд | Нечастые |
| Сыпь | Нечастые | |
| Гипергидроз | Нечастые | |
| Крапивница | Нечастые | |
Общие расстройства и нарушения в месте введения | Лихорадка | Часто |
| Периферический отёк | Нечастые | |
| Боль в груди | Нечастые | |
| Ощущение дискомфорта в груди | Нечастые | |
| озноб | нечастые | |
| изменение самочувствия | нечастые | |
| гематома в месте пункции сосуда | нечастые | |
| утомляемость | частота неизвестна | |
| реакции в месте инъекции | частота неизвестна | |
| недомогание | частота неизвестна | |
| Лабораторные и инструментальные данные | понижение активности
фактора свёртывания крови VIIIб | нечастые |
| увеличение количества моноцитов | нечастые | |
| снижение гематокрита | нечастые | |
| отклонения от нормы в результатах лабораторных тестов | нечастые | |
Травмы, интоксикации и осложнения манипуляций | постпроцедурное осложнение | нечастые |
| постпроцедурное осложнение | нечастые | |
| реакция в месте проведения процедуры | нечастые |
а) частота рассчитывалась по отношению к общему числу пациентов, получавших препарат АДВЕЙТ (n = 418).
б) неожиданное снижение активности фактора VIII произошло у одного пациента во время непрерывной инфузии препарата АДВЕЙТ на 10–14 дни после хирургического вмешательства. в течение этого периода обеспечивалось поддержание гемостаза. активность фактора VIII в плазме и клиренс вернулись к нормальным значениям к 15-му дню после операции. анализы на ингибиторы к фактору VIII, проведённые по окончании непрерывной инфузии и в конце исследования, дали отрицательные результаты.
в) информация о данной нежелательной реакции приведена ниже.
Описание отдельных нежелательных реакций
Появление ингибиторов фактора VIII
Иммуногенность препарата Адвейт была изучена в клинических исследованиях с участием 233 пациентов (дети и взрослые) с тяжёлой гемофилией а (уровень фактора VIII ≤1 %) ранее получавших лечение концентратами фактора VIII (не менее чем 150 дней введения препарата у взрослых и детей в возрасте ≥6 лет и не менее чем 50 дней введения у детей младше 6 лет). У одного пациента после 26 дней введения препарата АДВЕЙТ отмечено появление ингибиторов в низком титре (2,4 бетезда единицы [БЕ] по результатам модифицированного теста бетезда). После прекращения участия пациента в исследовании ингибиторы больше не обнаруживались.
Медиана продолжительности применения препарата АДВЕЙТ у ранее леченных пациентов во всех клинических исследованиях составила 97 дней (размах от 1 до 709 дней введения). Общая частота появления ингибиторов (как с высоким, так и с низким титром) составила 0,4 % (у 1 из 233 пациентов).
В завершённом неконтролируемом клиническом исследовании 060103, у 16 из 45 (35,6 %) ранее нелеченых пациентов с тяжёлой гемофилией а (уровень фактора VIII ≤1 %), получивших препарата АДВЕЙТ в течение не менее чем 25 дней применения, развились ингибиторы фактора VIII. У 7 (15,6 %) пациентов выявлен высокий титр ингибиторов и у 9 (20 %) пациентов — низкий титр ингибиторов (включая одного пациента, у которого появление ингибиторов было классифицировано как транзиторное).
факторами риска развития ингибиторов в данном исследовании являлись: неевропеоидная этническая принадлежность, семейный анамнез появления ингибиторов к фактору VIII и интенсивная терапия высокими дозами препарата АДВЕЙТ в первые 20 дней введения. У 20 пациентов, не имевших перечисленных факторов риска, появление ингибиторов не отмечено.
Были получены данные по индукции иммунной толерантности (ИИТ), у ранее нелеченых пациентов, пациентов, у которых при применении препарата АДВЕЙТ были выявлены ингибиторы к фактору VIII. В ходе подисследования в рамках исследования 060103 с участием пациентов, ранее не получавших лечения, лечение ИИТ было документально зарегистрировано у 11 пациентов, ранее не получавших лечения. У 30 пациентов с ИИТ (исследование 060703) был осуществлён ретроспективный анализ медицинской документации. сбор данных для реестра пациентов с ИИТ в настоящее время продолжается.
В исследовании 060201 был проведён сравнительный анализ двух режимов длительного профилактического лечения у 53 пациентов, ранее получавших лечение (РЛП): схема дозирования, подобранная на основе индивидуальных фармакокинетических параметров (в пределах диапазона от 20 до 80 me фактора VIII на 1 кг массы тела с интервалами 72 ± 6 часов; n = 23), и стандартная профилактическая схема дозирования (от 20 до 40 me/кг каждые 48 ± 6 часов; n = 30). Цель схемы дозирования, подобранной на основе индивидуальных фармакокинетических параметров (и рассчитанной по специальной формуле), заключалась в поддержании минимального уровня фактора VIII ≥1 % при 72-часовых интервалах между введениями. Данные этого исследования доказывают, что обе профилактические схемы дозирования сопоставимы по показателям уменьшения частоты кровотечений.
Нежелательные реакции, связанные с веществами, используемыми в производственном процессе
Из 229 пациентов, которые получили лечение препаратом АДВЕЙТ и были обследованы на наличие антител к белкам клеток яичника китайского хомячка (сно), у 3 пациентов было отмечено статистически значимое возрастание титра антител, у 4 пациентов были выявлены устойчивые пики или транзиторные подъёмы титра антител, и у одного пациента было отмечено и то, и другое. Все указанные изменения титров антител не сопровождались клиническими проявлениями.
Из этих 229 леченных пациентов, которые получили лечение препаратом АДВЕЙТ и были обследованы на наличие антител к мышиному иммуноглобулину G (IgG), у 10 пациентов было отмечено статистически значимое возрастание титра антител, у 2 пациентов были выявлены устойчивые пики или транзиторные подъёмы тигра антител и у одного пациента и то, и другое. У четверых из этих пациентов были отмечены отдельные случаи появления крапивницы, зуда, сыпи, незначительного повышения количества эозинофилов (всем указанным пациентам препарат АДВЕЙТ вводили многократно).
Гиперчувствительность
Реакции аллергического типа включали анафилаксию и проявлялись головокружением, парестезией, сыпью, приливами, отёком лица, крапивницей и зудом.
Применение препарата у детей
За исключением образования ингибиторов у ранее нелеченых пациентов и катетер-ассоциированных осложнений, никакие различия по частоте нежелательных реакций у пациентов разного возраста в клинических исследованиях выявлены не были.
Сообщения о подозреваемых нежелательных реакциях
Информация о подозреваемых нежелательных реакциях позволяет постоянно следить за соотношением пользы/риска применения лекарственного препарата АДВЕЙТ. Врачи, применяющие препарат АДВЕЙТ для лечения пациентов с гемофилией а, должны сообщать о подозреваемых нежелательных реакциях, развившихся в период после выдачи регистрационного удостоверения на лекарственный препарат, в национальные органы фармакологического надзора в соответствии со стандартной процедурой.
Передозировка
О случаях передозировки препаратов рекомбинантного фактора свёртывания крови VIII не сообщалось. Симптомы передозировки неизвестны.
Взаимодействие с другими лекарственными средствами
Исследования взаимодействий препарата АДВЕЙТ с другими лекарственными средствами не проводились.
Особые указания
Реакции гиперчувствительности
При внутривенном введении белковых препаратов возможно развитие аллергических реакций. Препарат АДВЕЙТ является белком, а также содержит следовые количества белков мышей и хомячков.
При применении препарата АДВЕЙТ сообщалось о развитии реакций гиперчувствительности аллергического типа, включая анафилаксию, которые проявлялись в виде головокружения, парестезии, сыпи, покраснения и отёка лица, крапивницы и зуда. Пациенты должны быть проинформированы о признаках реакций гиперчувствительности немедленного типа, таких как крапивница, зуд. генерализованная сыпь, ангионевротический отёк, гипотония (сопровождающаяся головокружением и обмороками), шок и острое расстройство дыхания (чувство стеснения в груди, свистящее дыхание). Пациентам должно быть рекомендовано при возникновении этих симптомов немедленно прекратить применение препарата и обратиться к лечащему врачу.
При анафилактическом шоке необходимо провести общепринятые противошоковые мероприятия.
Образование ингибиторов фактора VIII
Появление нейтрализующих антител к фактору VIII (ингибиторов) является известным осложнением при лечении пациентов с гемофилией А, которое клинически проявляется снижением прокоагулянтной активности препарата фактора VIII. Ингибиторы представляют собой иммуноглобулины класса G. Титр ингибиторов измеряется в Бетезда Единицах (БE) на мл плазмы с помощью модифицированного метода Бетезда.
При появлении ингибиторов фактора VIII у пациентов может наблюдаться недостаточный клинический ответ на препарата АДВЕЙТ. В таком случае рекомендуется обращаться в специализированный центр лечения гемофилии. Риск развития ингибиторов коррелирует с длительностью применения препарата фактора VIII (риск наиболее высок в течение первых 20 дней введения), а также е генетическими факторами и факторами окружающей среды. Редко ингибиторы могут появляться после первых 100 дней введения.
Наблюдались случаи повторного образования ингибиторов (в низком титре) у ранее леченных пациентов (получивших терапию в течение более 100 дней введения) после перевода пациента с одного препарат фактора VIII на другой. Поэтому после перехода с лечения одним препаратом фактора VIII на другой следует осуществлять постоянный контроль (как клинический, гак и лабораторный) за пациентами, получающими лечение препаратом фактора VIII, с целью своевременного обнаружения ингибиторов.
В целом, за пациентами, получавшими лечение препаратами фактора свёртывания VIII, следует проводить тщательное наблюдение на предмет появления ингибиторов путём соответствующего клинического наблюдения и проведения лабораторных тестов. Если ожидаемый уровень активности фактора VIII в плазме не достигнут, или если при применении адекватной дозы не удаётся контролировать кровотечение, необходимо выполнить соответствующий анализ для выявления ингибиторов фактора VIII. У пациентов с высоким уровнем ингибиторов фактора VIII лечение может быть неэффективным, при этом необходимо рассмотреть применение альтернативных методов лечения. Лечение таких пациентов должен проводить врач, имеющий опыт лечения гемофилии при наличии ингибиторов фактора VIII.
Профилактическая терапия препаратом АДВЕЙТ с индивидуализированным подбором дозы
Для поддержания базового уровня фактора VIII ≥1 % при междозовом интервале, составляющем 72 ч, разовая доза препарата АДВЕЙТ может быть индивидуально подобрана врачом с учётом значений индивидуальных фармакокинетических показателей. В клиническом исследовании было показано, что профилактический режим дозирования 20–40 МЕ/кг каждые 48 ± 6 часов имеет сходную клиническую эффективность с режимом 20–80 МЕ/кг с интервалом 72 ± 6 часов, при этом доказано значительное снижение частоты кровотечений при проведении профилактического лечения в сравнении с лечением по требованию.
Режим стандартной профилактики с введением препарата через день и режим индивидуального профилактического лечения с подбором дозы в зависимости от фармакокинетических параметров и с введением препарата каждый третий день имеют сравнимую эффективность.
Катетер-ассоциированные осложнения при лечении
Если требуется применение устройства для центрального венозного доступа, то существует риск развития катетер-ассоциированных осложнений, таких как местная инфекция, бактериемия, тромбоз в месте установки катетера.
Информация, касающаяся вспомогательных веществ
После восстановления раствор препарата содержит 0,45 ммоль натрия (10 мг) на флакон. Это следует учитывать при назначении препарата пациентам, находящимся на диете с ограничением натрия.
Для исключения возможности микробиологического загрязнения препарат следует вводить сразу после приготовления раствора. Однако, было показано, что приготовленный раствор АДВЕЙТ химически и физически стабилен в течение 3 часов при температуре 25 °C.
В пределах срока годности препарат можно хранить при комнатной температуре (не выше 25 °C) в течение не более 6 месяцев. Следует записывать дату начала и дату окончания хранения препарата при комнатной температуре на упаковке препарата. После храпения при комнатной температуре нельзя помещать препарат для дальнейшего хранения в холодильник.
Рекомендуется при каждом введении препарата АДВЕЙТ фиксировать название препарата и номер партии в медицинской документации для возможности установления связи между пациентом и партией препарата.
Влияние на способность управлять транспортными средствами, механизмами
Препарат АДВЕЙТ не оказывает влияние ни способность управления транспортными средствами и способность работать с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения, по 250, 500, 1000 или 1500 МЕ.
Во флаконе из бесцветного прозрачного стекла гидролитического Типа I, укупоренном резиновой пробкой с алюминиевой обкаткой и пластмассовой крышкой в комплекте с растворителем (вода для инъекций) по 5 мл во флаконе из бесцветного прозрачного стекла гидролитического Типа I, укупоренном резиновой пробкой с алюминиевой обкаткой и пластмассовой крышкой.
1 флакон с лиофилизатом, 1 флакон с растворителем и 1 устройство для безыгольпого разведении БАКСЖЕКТ II со встроенным фильтром (15 мкм) вместе е инструкцией по применению помешают в картонную коробку. В дополнительную картонную коробку помещают иглу-бабочку, одноразовый шприц (10 мл), две спиртовые салфетки, два пластыря. Обе картонные коробки объединены бандерольной лентой из прозрачного пластика.
Хранение
Хранить при температуре от 2 до 8 °C. Не замораживать.
Хранить в недоступном для детей месте.
Хранить в картонной коробке для защиты от действия света.
Срок годности
2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Baxter, AG, Австрия
Baxter Bioscience Manufacturing, Sarl, Швейцария
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Адвейт:
