Эрелзи®
Лекарственная форма
раствор для подкожного введения
Состав
1 мл раствора содержит:
Действующее вещество: этанерцепт 50 мг; вспомогательные вещества: лимонная кислота безводная 0,786 мг, натрия цитрат дигидрат 13,52 мг, натрия хлорид 1,500 мг, сахароза 10,00 мг, L-лизина гидрохлорид 4,600 мг, натрия гидроксид q.s. (для доведения при необходимости до pH 6,1–6,5), хлористоводородная кислота q.s. (для доведения при необходимости до pH 6,1–6,5), вода для инъекций до 1,0 мл.
Описание
От прозрачного до слабо опалесцирующего бесцветный или светло-жёлтого цвета раствор. Допускается наличие небольших полупрозрачных или белых плавающих частиц.
Фармакологическое действие
Фармакодинамика
Фактор некроза опухоли (INF, ФНО) является основным цитокином, поддерживающим воспалительный процесс при ревматоидном артрите.
Повышение концентрации ФНО также обнаружено в синовиальных оболочках и псориатических бляшках у пациентов с псориатическим артритом, а так же в плазме крови и синовиальных тканях пациентов с анкилозирующим спондилитом. Этанерцепт является конкурентным ингибитором связывания ФНО с его рецепторами на поверхности клетки, и, таким образом, ингибирует биологическую активность ФНО. ФНО и лимфотоксин относятся к провоспалительным цитокинам, которые связываются с двумя чётко различимыми рецепторами ФНО на поверхности клетки: 55-килодальтон (р55) и 75-килодальтон (р75). Оба рецептора ФНО присутствуют в организме в мембраносвязанной и свободной формах. Свободные (растворимые) рецепторы ФНО регулируют биологическую активность ФНО.
ФНО и лимфотоксин существуют преимущественно как гомотримеры, их биологическая активность зависит от перекрестной сшивки рецепторов ФНО, находящихся на поверхности клетки. Димерные растворимые рецепторы, такие как этанерцепт, имеют значительно более сильное сродство к ФНО, чем мономерные рецепторы, и являются более сильными конкурентными ингибиторами связывания ФНО с его клеточными рецепторами. Кроме того, использование Fc-фрагмента иммуноглобулина как элемента связывания в структуре димерного рецептора удлиняет период полувыведения из сыворотки крови.
Значительная часть патологических изменений в суставах при ревматоидном артрите и анкилозирующем спондилите, а также изменения кожи в виде псориатических бляшек возникают за счёт воздействия провоспалительных молекул, вовлечённых в систему, контролируемую ФНО. Механизм действия этанерцепта, по-видимому, заключается в конкурентном ингибировании связывания ФНО с его рецепторами на поверхности клетки. Таким образом, этанерцепт предупреждает клеточный ответ, опосредованный ФНО, способствуя биологической инактивации ФНО. Этанерцепт также может модулировать (стимулировать или контролировать) биологический ответ, контролируемый другими молекулами, передающими сигнал по нисходящей (например, цитокины, молекулы адгезии или протеиназы).
У пациентов с активным псориатическим артритом этанерцепт ингибирует прогрессирование структурных повреждений, улучшает физическую активность и снижает вероятность развития поражения периферических суставов.
После прекращения терапии этанерцептом в течение месяца возможно обострение заболевания. Эффективность повторного назначения препарата в течение 24 месяцев после прекращения терапии сравнима с таковой у пациентов, не прерывавших лечение.
Фармакокинетика
Фармакокинетические характеристики этанерцепта у пациентов с ревматоидным артритом, анкилозирующим спондилитом и псориазом сходны.
Всасывание
Этанерцепт медленно абсорбируется из места подкожной инъекции, достигая максимальной концентрации приблизительно через 48 ч после введения однократной дозы препарата. Абсолютная биодоступность составляет 76 %.
При введении препарата дважды в неделю достигаются в два раза более высокие равновесные концентрации, чем после введения однократной дозы.
После однократного подкожного введения 25 мг этанерцепта средняя максимальная концентрация в плазме крови составляет 1,65 ± 0,66 мкг/мл, площадь под кривой «концентрация-время» (AUC) — 235 ± 96,6 мкг × ч/мл.
Видимого насыщения клиренса в границах дозы не наблюдалось.
Введённая однократно доза этанерцепта 50 мг биоэквивалентна дозе, полученной путём двух инъекций по 25 мг препарата, сделанных практически одновременно.
Распределение
Зависимость концентрации этанерцепта от времени описывается биэкспоненциальной кривой. Среднее значение объёма распределения составляет 7,6 л, в то время как объём распределения при равновесном состоянии составляет 10,4 л.
Выведение
Этанерцепт медленно выводится из организма. Период полувыведения (T½) составляет около 70 ч. У пациентов с ревматоидным артритом клиренс составляет приблизительно 0,066 л/ч, что несколько ниже значения 0,11 л/ч у здоровых добровольцев.
Особые группы пациентов
Пожилые пациенты
Клиренс и кажущиеся объёмы распределения этанерцепта в группе пациентов от 65 до 87 лет сходны с таковыми у пациентов моложе 65 лет.
Дети
Ювенильный идиопатический артрит Профиль концентраций в сыворотке крови аналогичен таковому у взрослых пациентов с ревматоидным артритом. Моделирование позволяет предположить, что у детей старшего возраста (10–17 лет) и взрослых пациентов концентрация этанерцепта в сыворотке крови примерно одинакова, а у детей младшего возраста он будет существенно ниже.
Псориаз
Равновесные концентрации этанерцепта в сыворотке крови детей в возрасте от 4 до 17 лет с псориазом и детей с ювенильным идиопатическим артритом, которые получали этанерцепт, соответственно, в дозе 0,8 мг/кг 1 раз в неделю (максимальная доза 50 мг в неделю) и 0,4 мг/кг 2 раза в неделю (максимальная доза 50 мг в неделю) на протяжении 48 и 12 недель были сходными (1,6–2,1 мкг/мл). Значение этого показателя совпадало с таковым у взрослых пациентов с псориазом, которым этанерцепт вводился в дозе 25 мг 2 раза в неделю.
Нарушения функции почек и печени
Несмотря на то, что у пациентов и здоровых добровольцев после введения меченого этанерцепта радиоактивная метка элиминируется через почки, у пациентов с острой почечной или печёночной недостаточностью не наблюдалось увеличения концентрации этанерцепта в плазме крови.
Пол
Явных различий в фармакокинетике этанерцепта у мужчин и женщин нет.
Показания
Ревматоидный артрит
Лечение активного ревматоидного артрита средней и высокой степени тяжести у взрослых в комбинации с метотрексатом, когда ответ на базисные противовоспалительные препараты (БПВП), включая метотрексат, был неадекватным.
Лечение ревматоидного артрита в виде монотерапии препаратом Эрелзик в случае неэффективности или непереносимости метотрексата.
Лечение тяжёлого, активного и прогрессирующего ревматоидного артрита у взрослых, не получавших ранее терапию метотрексатом.
Псориатический артрит
Лечение активного и прогрессирующего псориатического артрита у взрослых, когда ответ на терапию БПВП был неадекватным.
Аксиальная форма спондилоартрита
Анкилозирующий спондилит
Лечение взрослых с тяжёлым активным анкилозирующим спондилитом, у которых стандартная терапия не привела к существенному улучшению.
Дорентгенологическая стадия аксиальной формы спондилоартрита
Лечение взрослых пациентов с тяжёлым течением дорентгенологической стадии аксиальной формы спондилоартрита, у которых отмечался неадекватный ответ или резистентность к стандартной терапии, а также имеются объективные признаки активности заболевания, подтверждённые повышением концентрации C-реактивного белка (СРБ) и/или данными МРТ-сканирования.
Псориаз
Лечение взрослых с псориазом умеренной и тяжёлой степени выраженности, у которых имеются противопоказания или непереносимость другой системной терапии, включающей циклоспорин, метотрексат или PUVA-терапию.
Лечение детей и подростков в возрасте старше 12 лет и с массой тела более 62,5 кг с хроническим псориазом тяжёлой степени выраженности, у которых наблюдалась непереносимость или недостаточный ответ на другую системную или фототерапию.
Ювенильный идиопатический артрит
Лечение активного ювенильного идиопатического полиартрита (серопозитивного и серонегативного) у детей и подростков в возрасте старше 12 лет и с массой тела более 62,5 кг, у которых наблюдалась недостаточная эффективность или непереносимость метотрексата.
Лечение распространённого олигоартрита у детей и подростков в возрасте старше 12 лет и с массой тела более 62,5 кг, у которых наблюдалась недостаточная эффективность или непереносимость метотрексата.
Лечение псориатического артрита у подростков в возрасте старше 12 лет и с массой тела более 62,5 кг, у которых наблюдалась недостаточная эффективность или непереносимость метотрексата.
Лечение энтезит-ассоциированного артрита у подростков в возрасте старше 12 лет и с массой тела более 62,5 кг, у которых наблюдалась недостаточная эффективность или непереносимость стандартной терапии.
Противопоказания
- Повышенная чувствительность к этанерцепту или любому другому компоненту препарата.
- Сепсис или риск возникновения сепсиса.
- Активная инфекция, включая хронические или локализованные инфекции.
- Период грудного вскармливания.
- Пациенты в возрасте младше 12 лет и с массой тела менее 62,5 кг.
С осторожностью
Демиелинизирующие заболевания (рассеянный склероз), хроническая сердечная недостаточность (ХСН), иммунодефицитные состояния, заболевания, предрасполагающие к развитию или активации инфекций (сахарный диабет, гепатиты), алкогольный гепатит среднетяжёлого и тяжёлого течения, вирусный гепатит C, дискразия крови, заболевания нервной системы (неврит зрительного нерва, поперечный миелит).
Беременность и лактация
Женщины, способные к деторождению Женщинам, способным к деторождению, следует рекомендовать использовать соответствующий способ контрацепции во избежание наступления беременности в течение терапии препаратом Эрелзи® и в течение трёх недель после её прекращения.
Беременность Влияние этанерцепта на исходы беременности было изучено в двух наблюдательных когортных исследованиях. В ходе наблюдательного исследования, посвящённого сравнению исходов беременности у женщин, принимавших этанерцепт в первом триместре, было зарегистрировано повышение частоты возникновения значительных врождённых пороков развития, чем в группе пациентов, не получавших этанерцепт или иные антагонисты ФНО. Типы значительных врождённых пороков соответствовали выявленным в общей популяции; каких-либо особых вариантов таких осложнений выявлено не было. Изменения частоты спонтанных абортов, мертворождений или незначительных врождённых пороков развития отмечено не было. В другом наблюдательном международном реестровом исследовании, в котором сравнивали риск возникновения нежелательных исходов беременности у женщин, получавших этанерцепт в течение первых 90 дней беременности, и у женщин, получавших терапию небиологическими препаратами, не было обнаружено повышения риска возникновения значительных врождённых пороков развития. Данное исследование также не выявило повышения риска возникновения незначительных врождённых пороков развития, преждевременных родов, рождения мёртвого плода или инфекций в течение первого года жизни для младенцев, рождённых женщинами, получавшими этанерцепт во время беременности. Применять препарат Эрелзи® во время беременности возможно только при очевидной необходимости.
Этанерцепт проникает в плаценту и обнаруживается в сыворотке крови младенцев, матери которых получали терапию этанерцептом во время беременности. Клиническое значение этого явления неизвестно, однако, у таких младенцев может увеличиваться риск инфекции. Не рекомендуется введение живых вакцин младенцам в течение 16 недель после получения матерью последней дозы этанерцепта.
Грудное вскармливание Этанерцепт проникает в грудное молоко после подкожного введения.
Поскольку иммуноглобулины, как и многие другие лекарственные препараты, могут проникать в грудное молоко, следует либо прекратить грудное вскармливание, либо прекратить приём препарата Эрелзи® во время грудного вкармливания, принимая во внимание пользу от грудного вскармливания для ребёнка и пользу от терапии для матери.
Репродуктивная функция Доклинические данные по перинатальной и постнатальной токсичности этанерцепта и о влиянии этанерцепта на фертильность и общую репродуктивную способность отсутствуют.
Способ применения и дозы
Подкожно.
Лечение препаратом Эрелзи® должно назначаться и контролироваться врачом, имеющим опыт в диагностике и лечении ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, дорентгенологической стадии анкилозирующего спондилита (аксиальный спондилоартрит), псориаза или ювенильного идиопатического артрита.
Препарат Эрелзи® может назначаться только пациентам с массой тела более 62,5 кг. У пациентов с массой тела менее 62,5 кг следует использовать этанерцепт в других лекарственных формах.
Перед введением препарата Эрелзи® необходимо внимательно изучить инструкцию по применению шприца/шприц-ручки (в конце данного раздела).
Взрослые
Ревматоидный артрит
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня.
Альтернативная доза — 50 мг 1 раз в неделю, которая может быть введена путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Псориатический артрит
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня.
Альтернативная доза — 50 мг 1 раз в неделю, которая может быть введена путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Аксиальная форма спондилоартрита
Анкилозирующий спондилит
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня.
Альтернативная доза — 50 мг 1 раз в неделю, которая может быть введена путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Дорентгенологическая стадия аксиальной формы спондилоартрита
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня.
Альтернативная доза — 50 мг 1 раз в неделю, которая может быть введена путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Псориаз
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня или 50 мг 1 раз в неделю (путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно). В качестве альтернативы можно применять препарат Эрелзи® по 50 мг 2 раза в неделю на протяжении не более 12 недель. При необходимости продолжения лечения препарат Эрелзи® следует вводить в дозе 25 мг 2 раза в неделю или 50 мг 1 раз в неделю.
Терапию следует проводить до достижения ремиссии и, как правило, не более 24 недель. Введение препарата следует прекратить, если после 12 недель лечения не наблюдается положительной динамики симптомов. В некоторых случаях продолжительность лечения может составлять более 24 недель.
Продолжительность лечения
У взрослых пациентов в зависимости от оценки врача и индивидуальных особенностей пациента терапию можно проводить непрерывно или с перерывами.
При необходимости повторного назначения препарата Эрелзи® следует соблюдать длительность лечения, указанную выше. Рекомендуется назначать дозу 25 мг 2 раза в неделю или 50 мг 1 раз в неделю.
Длительность терапии у некоторых пациентов может превышать 24 недели.
В случае пропуска дозы в положенное время необходимо ввести препарат сразу
же, как только об этом вспомнили, но при условии, что следующая инъекция должна быть не ранее, чем через день. В противном случае необходимо пропустить забытую инъекцию и сделать вовремя очередную инъекцию.
Пожилые пациенты (старше 65 лет): не требуется корректировать дозу или способ применения.
Нарушение функции печени и почек: не требуется корректировать дозу.
Дети (старше 12 лет и имеющие массу тела 62,5 кг и более)
У детей в возрасте младше 12 лет и с массой тела менее 62,5 кг применение препарата Эрелзи® противопоказано.
Ювенильный идиопатический артрит
Рекомендуемая доза составляет 25 мг препарата Эрелзи® 2 раза в неделю с интервалом 3–4 дня.
Альтернативная доза — 50 мг 1 раз в неделю, которая может быть введена путём однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Лечение препаратом следует прекратить, если после 4 месяцев терапии не наблюдается положительной динамики симптомов.
Псориаз
Рекомендуемая доза составляет 50 мг 1 раз в неделю. Длительность терапии составляет не более 24 недель.
Введение препарата следует прекратить, если после 12 недель лечения не наблюдается ответа на проводимую терапию.
При необходимости повторного назначения препарата Эрелзи® следует соблюдать длительность лечения, указанную выше. Разовая доза препарата составляет 50 мг 1 раз в неделю.
Ниже представлены инструкции по подготовке и введению раствора для подкожного введения препарата Эрелзи8 в предварительно заполненных шприцах и в шприц-ручках.
Пациенты или их родители/опекуны, которые будут проводить инъекции, должны быть проинформированы о том, как правильно проводить инъекцию. В случае, если в дальнейшем инъекции будут проводиться самим пациентом или его родителями/опекуном, то первое введение необходимо осуществить под контролем квалифицированного медицинского персонала.
Перед введением препарата проверяйте дату окончания срока годности. В случае, если эта дата уже прошла, не используйте шприц или шприц-ручку!
Препарат Эрелзи® следует хранить в оригинальной упаковке (картонной пачке) при температуре от 2 до 8 °С. Однократно препарат можно хранить при температуре 25 ± 2 °С в течение не более 28 дней (после этого следует вводить препарат, нельзя повторно помещать в холодильник).
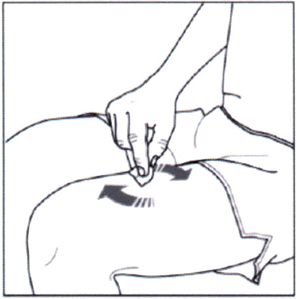
Выбор места инъекции
Рекомендуются следующие места для введения препарата Эрелзи®: передняя поверхность средней трети бедра; нижняя часть живота, кроме области размером 5 см вокруг пупка; наружная поверхность плеча (см. рисунок ниже).
Если вы делаете инъекцию себе, не следует использовать наружную поверхность плеча.
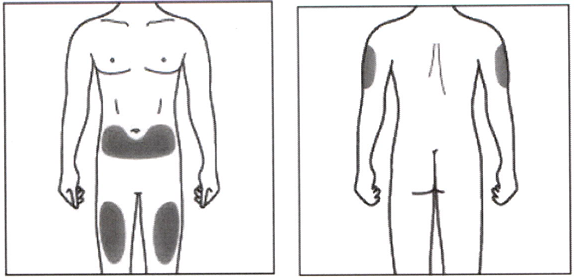
Каждую последующую инъекцию следует выполнять в новое место. Место новой инъекции должно быть на расстоянии не менее 3 см от места предыдущих инъекций. НЕ ВВОДИТЕ препарат в участки, где есть болезненность, покраснение кожи, кровоподтёк или уплотнение. Не вводите в участки со шрамами или растяжками.
Для пациентов с псориазом: старайтесь не вводить препарат непосредственно в участки, приподнятые над поверхностью кожи, утолщённые, покрасневшие или в очаги с шелушением («псориатические бляшки»).
Инструкция по подготовке и введению раствора для подкожного введения препарата Эрелзи® в предварительно заполненном шприце
Подготовка к инъекции
Препарат Эрелзи® нельзя смешивать в одном шприце или флаконе с любыми другими препаратами!
Всегда кладите шприц в места, недоступные для детей.
- Извлеките картонную коробку с предварительно заполненными шприцами с препаратом Эрелзи® из холодильника и поместите её на чистую хорошо освещённую ровную рабочую поверхность. Возьмите один предварительно заполненный шприц. Не встряхивайте шприц. Поместите картонную коробку с оставшимися предварительно заполненными шприцами обратно в холодильник.
- Оставьте шприц с раствором Эрелзи® на 15–30 минут, чтобы он согрелся до комнатной температуры. НЕ ОТКРЫВАЙТЕ блистер и НЕ СНИМАЙТЕ колпачок с иглы шприца, пока он не достигнет комнатной температуры. Не подогревайте шприц каким-либо другим способом (например, в микроволновой печи или в горячей воде).
- Тщательно вымойте руки с мылом в тёплой воде.
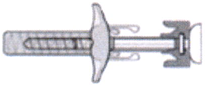
- Достаньте шприц из блистера и убедитесь, что раствор в шприце прозрачный или слегка опалесцирующий, допускается наличие небольших полупрозрачных или белых плавающих частиц. В противном случае не вводите раствор. Используйте другой шприц, предварительно заполненный препаратом Эрелзи®. Не вводите препарат, если шприц сломан или предохранитель иглы активирован (см. рисунок ниже).
- Вам также понадобятся: спиртовая салфетка и ватный шарик или марлевая салфетка.
Подготовка участка кожи и введение раствора Эрелзи®
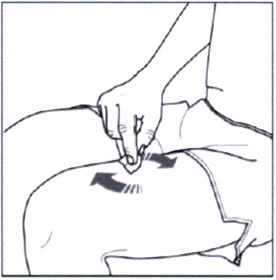
- Круговыми движениями протрите участок кожи, в который будете вводить препарат Эрелзи®, чистой спиртовой салфеткой.
- НЕ КАСАЙТЕСЬ этой области до выполнения инъекции.
- Снимите колпачок с иглы. Соблюдайте осторожность, не сгибайте и не перекручивайте колпачок во время удаления, чтобы не повредить иглу.
- При удалении колпачка на конце иглы может появиться капля жидкости — это допустимо.
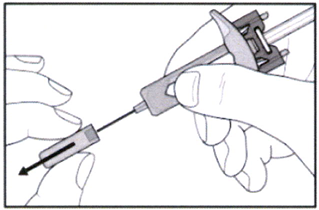
Не касайтесь иглы и избегайте её соприкосновения с любой другой поверхностью. Не касайтесь поршня и не надавливайте на него. Это может привести к вытеканию жидкости из шприца.
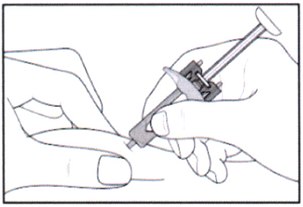
- Одной рукой соберите кожу в складку и удерживайте её.
- Второй рукой держите шприц, как карандаш.
- Быстрым коротким движением направьте иглу в кожу под углом от 45° до 90° (со временем вы найдёте угол, наиболее удобный для введения).
- Старайтесь не вводить иглу в кожу медленно или с чрезмерным усилием.
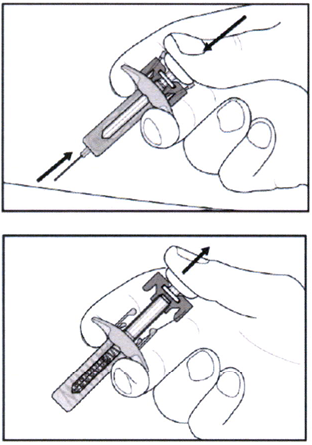
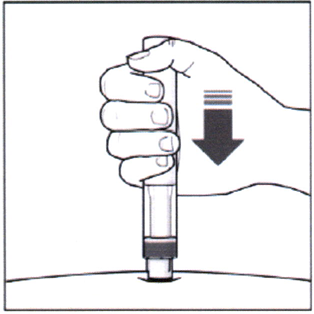
- Затем надавите на поршень, чтобы ввести весь раствор медленно и с постоянной скоростью.
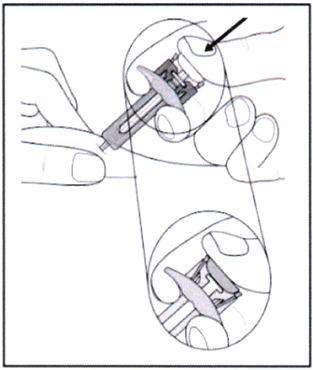
- Удерживайте поршень нажатым, как указано на рисунке, около 5 секунд.
- Удерживая поршень нажатым, осторожно извлеките иглу из кожи. Старайтесь держать шприц под тем же углом, под которым вводили.
- Осторожно отпустите поршень — игла автоматически закроется предохранителем.
В месте инъекции может возникнуть небольшая кровоточивость. Надавите ватным шариком или марлевой салфеткой на место инъекции в течение 10 секунд. Не трите место инъекции. Если необходимо, можно наложить повязку.
Утилизация использованного шприца
Предварительно заполненный шприц предназначен только для одноразового применения. Не используйте шприц и иглу повторно. Не пытайтесь закрыть иглу колпачком повторно! Утилизируйте иглу, шприц и колпачок в соответствии с указаниями Вашего врача или медсестры.
Если у Вас есть вопросы, пожалуйста, обратитесь к врачу или медицинской сестре, которые работают с препаратом Эрелзи®.
Инструкция по подготовке и введению раствора для подкожного введения препарата Эрелзи® в предварительно заполненной шприц-ручке
Предварительно заполненная шприц-ручка
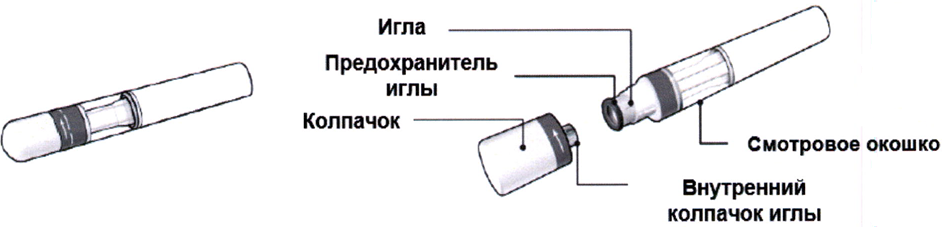
Не пытайтесь выполнить инъекцию самостоятельно, если вы не поняли, как следует надлежащим образом использовать шприц-ручку. При наличии у вас вопросов, касающихся инъекции, пожалуйста, задайте их врачу или медицинской сестре.
Подготовка к инъекции
Препарат Эрелзи® нельзя смешивать в одном шприце или флаконе с другими препаратами!
Всегда кладите шприц-ручку в места, недоступные для детей.
- Извлеките картонную коробку с предварительно заполненными шприц-ручками с препаратом Эрелзи® из холодильника и поместите её на чистую хорошо освещённую ровную рабочую поверхность. Возьмите одну предварительно заполненную шприц-ручку. Не встряхивайте шприц-ручку. Поместите картонную коробку с оставшимися предварительно заполненными шприц-ручками обратно в холодильник.
- Оставьте шприц-ручку с раствором Эрелзи® на 15–30 минут, чтобы она достигла комнатной температуры. НЕ СНИМАЙТЕ колпачок шприц-ручки. Не подогревайте шприц-ручку каким-либо другим способом (например, в микроволновой печи или в горячей воде).
- Убедитесь, что раствор в шприц-ручке прозрачный или слегка опалесцирующий, допускается наличие небольших полупрозрачных или белых плавающих частиц. В противном случае не вводите раствор. Используйте другую шприц-ручку Эрелзи®. Не вводите препарат, если шприц-ручка сломана.
- Вам также понадобятся: спиртовая салфетка и ватный шарик или марлевая салфетка.
- Вымойте руки с мылом в тёплой воде.
Подготовка участка кожи перед введением раствора Эрелзи®
- Круговыми движениями протрите участок кожи, в который будете вводить препарат Эрелзи®, чистой спиртовой салфеткой и дайте высохнуть.
- НЕ КАСАЙТЕСЬ этой области до выполнения инъекции.
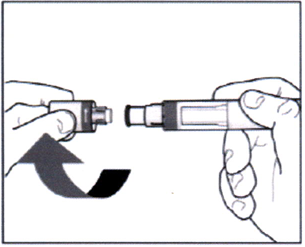
- Снимите колпачок шприц-ручки, повернув его, как показано на рисунке. Не пытайтесь закрыть шприц-ручку колпачком повторно!
- Используйте шприц-ручку в течение 5 минут после снятия колпачка.
- Не используйте шприц-ручку, если она упала, после того как Вы сняли защитный колпачок.
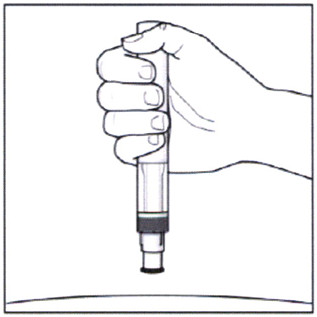
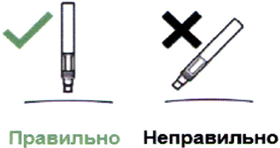
- Держите шприц-ручку под прямым углом (90°) к месту введения.
Введение препарата Эрелзи®
- Плотно прижмите шприц-ручку к коже для введения препарата. Вы должны услышать два щелчка:
- 1-ый щелчок означает начало введения препарата. Продолжайте плотно прижимать шприц-ручку к коже.
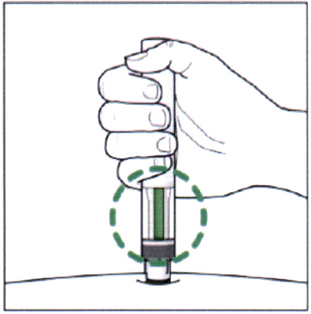
- Зелёный индикатор в смотровом окошке указывает на процесс введения препарата.
- Через несколько секунд Вы услышите 2-ой щелчок — он указывает на то, что введение почти завершено.
- Проверьте, что окошко стало полностью зелёным и индикатор больше не смещается.
Введение препарата завершено.
Примечание: если индикатор не стал полностью зелёным, следует обратиться к врачу.
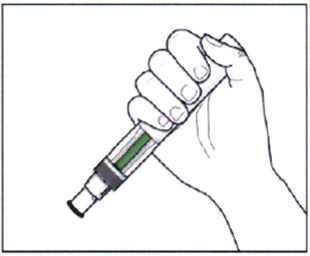
В месте инъекции может возникнуть небольшая кровоточивость. Надавите ватным шариком или марлевой салфеткой на место инъекции в течение 10 секунд. Не трите место инъекции. Если необходимо, можно наложить повязку.
Утилизация использованной шприц-ручки
Предварительно заполненная шприц-ручка предназначена только для одноразового применения. Не используйте шприц-ручку повторно. Не пытайтесь закрыть шприц-ручку колпачком повторно! Утилизируйте шприц- ручку и колпачок в соответствии с указаниями Вашего врача или медсестры.
Если у Вас есть вопросы, пожалуйста, обратитесь к врачу или медицинской сестре, которые работают с препаратом Эрелзи®.
Побочные эффекты
Краткие сведения о профиле безопасности
К наиболее распространённым нежелательным реакциям относятся реакции в месте инъекции (такие как боль, припухлость, зуд, покраснение и кровотечение в месте прокола), инфекции (такие как инфекции верхних дыхательных путей, бронхит, инфекции мочевого пузыря и инфекции кожи), аллергические реакции, образование антител, зуд и повышение температуры.
При применении этанерцепта были также зарегистрированы серьёзные нежелательные реакции. Антагонисты ФИО, такие как этанерцепт, отрицательно влияют на иммунную систему, а их применение может отрицательно повлиять на защитные свойства организма от инфекций и злокачественных новообразований. Серьёзные инфекции поражают менее 1 из 100 пациентов, получающих лечение этанерцептом. Отчёты включали сообщения о летальных и угрожающих жизни инфекциях и сепсисе. Были также зарегистрированы случаи разных злокачественных новообразований при применении этанерцепта, включая рак молочной железы, лёгкого, кожи и лимфатических узлов (лимфома).
Были также зарегистрированы случаи серьёзных гематологических, неврологических и аутоиммунных реакций. К таковым относятся редкие сообщения о панцитопении и очень редкие сообщения об апластической анемии. При применении этанерцепта центральные и периферические димиелинизирующие заболевания наблюдались редко и очень редко, соответственно. Регистрировались редкие случаи волчанки, патологических состояний, связанных с волчанкой, и васкулита.
Список нежелательных реакций в виде таблицы Следующий список нежелательных реакций основан на опыте применения препарата у взрослых пациентов в клинических исследованиях и на опыте пострегистрационного применения препарата.
В рамках системно-органного класса нежелательные реакции распределены по следующим категориям частоты (прогнозируемое количество пациентов, у которых возникает реакция): очень часто (>1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна — по имеющимся данным установить частоту возникновения не представлялось возможным.
| Системно-органный класс | Очень часто | Часто | Нечасто | Редко | Очень редко | Частота неизвестна |
| Инфекционные и паразитарные заболевания | Инфекции (включая инфекции верхних дыхательных путей, бронхит, цистит, инфекции кожи)* | Серьёзные инфекции (включая пневмонию, панникулит, бактериальный артрит, сепсис и паразитарные инфекции)* | Туберкулёз, оппортунистические инфекции (включая инвазивные грибковые, протозойные, бактериальные, атипичные микобактериальные, вирусные инфекции и инфекции, вызванные бактериями рода Legionella )* | Реактивация вируса гепатита B, листериоз | ||
| Доброкачественные, злокачественные и неуточнённые новообразования (включая кисты и полипы) | Немеланомные злокачественные опухоли кожи* (см. раздел «Особые указания») | Злокачественная меланома (см. раздел «Особые указания»), лимфома, лейкоз | Карцинома Меркеля (см. раздел «Особые указания» | |||
| Нарушения со стороны крови и лимфатической системы | Тромбоцитопения, анемия, лейкопения, нейтропения | Панцитопения* | Апластическая анемия* | Гематофагоцитарный синдром (синдром активации макрофагов)* | ||
| Нарушения со стороны иммунной системы | Аллергическ ие реакции (см. подраздел «Нарушения со стороны кожи и подкожных тканей»), образование аутоантител* | Васкулит (включая васкулит с образованием антинейтрофильных цитоплазматических антител) | Серьёзные аллергические/анафилактические реакции (включая ангионевротический отёк, бронхоспазм) , саркоидоз | Усугубление симптомов дерматомиозита | ||
| Нарушения со стороны нервной системы | Явления, связанные с демиелинизацией ЦНС, свидетельствующие о рассеянном склерозе или местных демиелинизирующих заболеваниях, таких как неврит зрительного нерва и поперечный миелит (см. раздел «Особые указания), периферические демиелинизи рующие заболевания, включая синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полинейропатию, демиелинизирующую полинейропатию и мультифокальную моторную нейропатию (см. раздел «Особые указания»), судорожный приступ | |||||
| Нарушения со стороны органа зрения | Увеит, склерит | |||||
| Нарушения со стороны сердца | Усугубление симптомов сердечной недостататочности (см. раздел «Особые указания») | Новый приступ застойной сердечной недостаточности (см. раздел «Особые указания») | ||||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Интерстициальная болезнь лёгких (включая пневмонит и лёгочный фиброз)* | |||||
| Нарушения со стороны печени и желчевыводящих путей | Повышение уровня печёночных ферментов* | Аутоиммунный гепатит* | ||||
| Нарушения со стороны кожи и подкожных тканей | Кожный зуд, кожная сыпь | Ангионевротический отёк, псориаз (включая новый случай возникновения или обострение, а также пустулёзный псориаз с преимущественным поражением кистей и стоп), крапивница, псориазоподобная сыпь | Синдром Стивенса-Джонсона, кожный васкулит (включая васкулит при гиперчувствительности), многоформная эритема, лихеноидные реакции | Токсический эпидермальный некролиз | ||
| Нарушения со стороны скелетно-мышечной системы и соединительной ткани | Кожная красная волчанка, подострая кожная красная волчанка, волчаночноподобный синдром | |||||
| Общие расстройства и нарушения в месте введения | Реакции в месте инъекции (включая кровотечение, образование синяков, эритему, зуд, боль и припухлость)* | Пирексия |
* См. «Описание отдельных нежелательных реакций» ниже.
Описание отдельных нежелательных реакций
Злокачественные новообразования и лимфопролиферативные заболевания
Сто двадцать девять (129) новых злокачественных новообразований различных видов наблюдалось у 4114 пациентов с ревматоидным артритом, получавших лечение этанерцептом в ходе клинических исследований продолжительностью 6 лет, включая 231 пациента, в течение 2 лет получавших лечение этанерцептом в комбинации с метотраксатом в исследовании с активным контролем.
Полученные в этих клинических исследованиях значения частоты и заболеваемости соответствовали значениям, ожидаемым для исследуемой популяции. В клинических исследованиях продолжительностью до 2 лет с участием 240 пациентов с псориатическим артритом, получавших этанерцепт, было зарегистрировано всего 2 случая развития злокачественных новообразований. В клинических исследованиях с участием 351 пациента с анкилозирующим спондилитом, продолжительность которых превышала 2 года, было зарегистрировано 6 случаев злокачественных новообразований у пациентов, получавших этанерцепт. В группе, включавшей 2711 пациентов с бляшковидным псориазом, получавших этанерцепт в двойных слепых и открытых исследованиях продолжительностью до 2,5 лет, было зарегистрировано 30 случаев злокачественных новообразований и 43 случая немеланоцитарного рака кожи.
В группе, включавшей 7416 пациентов, получавших лечение этанерцептом в клинических исследованиях ревматоиного артрита, псориатического артрита, анкилозирующего спондилита и псориаза, было зарегистрировано 18 случаев развития лимфомы.
В период пострегистрационного наблюдения также сообщалось о развитии злокачественных новообразований различных видов, включая рак молочной железы и лёгких, а также лимфому (см. раздел «Особые указания»).
Реакции в месте введения препарата
У пациентов с ревматическими заболеваниями, получавших этанерцепт, отмечалась значительно более высокая частота развития реакций в месте введения препарата по сравнению с группой плацебо (36 % vs. 9 %). Реакции в месте введения препарата, как правило, развивались в первый месяц применения. Средняя продолжительность реакций составляла приблизительно от 3 до 5 дней. В большинстве случаев лечение, в связи с развитием реакций в месте введения препарата, в группах, принимавших этанерцепт, не проводилось. Большинство пациентов, которым назначали лечение по данному поводу, получали средства для наружного применения, такие как кортикостероиды, или антигистаминные препараты внутрь. Кроме того, у некоторых пациентов отмечалось повторное развитие реакций в месте введения препарата, характеризующееся одновременным развитием реакций как в месте самых последних, так и предшествующих инъекций. Как правило, данные реакции носили транзиторый характер и при лечении повторно не развивались.
В контролируемых исследованиях с участием пациентов с бляшковидным псориазом в течение первых 12 недель лечения примерно 13,6 % пациентов, получавших лечение этанерцептом, развивались реакции в месте введения препарата по сравнению с 3,4 % пациентов, получавших плацебо.
Серьёзные инфекционные заболевания
В плацебоконтролируемых исследованиях повышение частоты серьёзных инфекций (фатальных, угрожающих жизни, требующих госпитализации или внутривенное применение антибиотиков) не наблюдалось. Серьёзные инфекции, включавшие абсцесс (различной локализации), бактериемию, бронхит, бурсит, воспаление подкожной клетчатки, холецистит, диарею, дивертикулит, эндокардит (подозреваемый), гастроэнтерит, гепатит B, herpes zoster, язву нижней конечности, инфекцию ротовой полости, остеомиелит, отит, перитонит, пневмонию, пиелонефрит, сепсис, септический артрит, синусит, инфекцию кожных покровов, язву кожных покровов, инфекцию мочевыводящих путей, васкулит и раневую инфекцию, были зарегистрированы у 6,3 % пациентов с ревматоидным артритом, получавших лечение этанерцептом до 48 месяцев. В 2-х летнем исследовании с активным контролем, в течение которого пациенты получали монотерапию этанерцептом, монотерапию метотрексатом или этанерцепт в комбинации с метотрексатом, частота возникновения серьёзных инфекций была одинаковой в трёх разных группах. Тем не менее, нельзя исключить вероятность того, что применение этанерцепта в комбинации с метотрексатом могло быть связано с повышением риска развития инфекций.
В плацебоконтролируемых исследованиях продолжительностью до 24 недель не было выявлено различий в частоте возникновения инфекций между группами пациентов с бляшковидным псориазом, получавших этанерцепт и плацебо. Серьезные инфекции, развивавшиеся у пациентов, получавших лечение этанерцептом, включали воспаление подкожной клетчатки, гастроэнтерит, пневмонию, холецистит, остеомиелит, гастрит, аппендицит, стрептококковый фасциит, миозит, септический шок, дивертикулит и абсцесс.
В двойных слепых и открытых исследованиях псориатического артрита была зарегистрирована серьёзная инфекция (пневмония) у 1 пациента.
Сообщалось о развитии серьёзных и фатальных инфекций при применении этанерцепта, которые были вызваны бактериями, микобактериями (включая туберкулёз), вирусами и грибами. В некоторых случаях инфекции развивались в течение нескольких недель после начала лечения этанерцептом у пациентов, имеющих помимо ревматоидного артрита предрасполагающие основные заболевания (например, сахарный диабет, хроническую сердечную недостаточность, с активными и хроническими инфекциями в анамнезе) (см. раздел «Особые указания»). Лечение этанерцептом может повышать смертность пациентов с подтверждённым сепсисом.
При лечении этанерцептом отмечалось развитие оппортунистических инфекций, включая инвазивную грибковую, паразитарную (в том числе вызванную простейшими), вирусную (в том числе herpes zoster), бактериальную (в том числе вызванную листериями и легионеллами), а также атипичную микобактериальную инфекцию. В объединённых данных клинических исследований общая частота оппортунистических инфекций у 15 402 пациентов, получавших этанерцепт, составляла 0,09 %. Частота явлений с поправкой на воздействие препарата составляла 0,06 явлений на 100 пациенто-лет. В период пострегистрационного применения препарата приблизительно половина всех клинических случаев оппортунистических инфекций во всем мире была обусловлена инвазивными грибковыми инфекциями. Чаще всего регистрировались инвазивные грибковые инфекции, вызванные грибками рода
Candida, Pneumocystis, Aspergillus, и Histoplasma.
Более половины летальных исходов пациентов с оппортунистическими инфекциями было обусловлено инвазивными грибковыми инфекциями. Большинство летальных исходов были зарегистрированы у пациентов с пневмонией, вызванной Pneumocystis, системными грибковыми инфекциями неустановленной этиологии и аспергиллезом (см. раздел «Особые указания»).
Выработка аутоантител
У взрослых пациентов с целью обнаружения аутоантител проводился анализ образцов сыворотки крови, взятых в разные временные точки. Среди пациентов с ревматоидным артритом, у которых проводилось определение антинуклеарных антител (АНА), доля пациентов, у которых впервые был получен положительный результат теста на антинуклеарные антитела (>1 : 40), была выше у пациентов, получавших этанерцепт (11 %), по сравнению с пациентами, получавшими плацебо (5 %). Доля пациентов, у которых впервые отмечалась выработка антител к двуспиральной ДНК, также была выше при оценке с помощью радиоиммунологического анализа (15 % пациентов, получавших этанерцепт, по сравнению с 4 % пациентов, получавшими плацебо) и с помощью иммунофлуоресцентного анализа на клетках Crithidia luciliae (3 % пациентов, получавших этанерцепт, по сравнению с отсутствием антител к двуспиральной ДНК у пациентов, получавших плацебо). Доля пациентов, получавших этанерцепт, у которых отмечалась выработка антикардиолипиновых антител, увеличивалась аналогичным образом по сравнению с пациентами, получавшими плацебо. Влияние длительного лечения этанерцептом на развитие аутоиммунных заболеваний неизвестно.
У пациентов, включая пациентов с положительным ревматоидным фактором, были зарегистрированы редкие случаи образования других аутоантител в сочетании с волчаночноподобным синдромом или сыпью, которые по данным клинического обследования и биопсии соместимы с подострой кожной формой красной волчанки или дискоидной формой красной волчанки.
Панцитопения и апластическая анемия
В период пострегистрационного наблюдения сообщалось о случаях развития панцитопении и апластической анемии, некоторые из которых имели летальный исход (см. раздел «Особые указания»).
Интерстициальные заболевания лёгких
В контролируемых клинических исследованиях этанерцепта при его применении по всем показаниям частота (доля пациентов) нежелательных явлений в виде интерстициальных заболеваний лёгких у пациентов, получающих этанерцепт без сопутствующей терапии метотрексатом, составляла 0,06 % (категория частоты «редко»). В контролируемых клинических исследованиях, в которых разрешалось сопутствующее применение этанерцепта и метотреката, частота (доля пациентов) нежелательных явлений в виде интерстициальных заболеваний лёгких составляла 0,47 % (категория частоты «нечасто»). В постмаркетинговых исследованиях сообщались случаи проявления интерстициальных заболеваний лёгких (включая пневмонит и фиброз лёгкого), некоторые из которых были со смертельным исходом.
Сопутствующая терапия анакинрой
В исследованиях, в которых взрослые пациенты получали сопутствующее лечение этанерцептом и анакинрой, наблюдалась более высокая частота возникновения серьёзных инфекций по сравнению с применением этанерцепта в виде монотерапии, и у 2 % пациентов (3/139) развивалась нейтропения (абсолютное количество нейтрофилов <1000/мм3. Во время нейтропении у одного пациента развился панникулит, который разрешился после госпитализации (см. разделы «Особые указания» и «Взаимодействие с другими лекарственными средствами»).
Повышение активности печёночных ферментов
В двойных слепых контролируемых клинических исследованиях этанерцепта при его применении по всем показаниям частота (доля пациентов) нежелательных явлений в виде повышения активности печёночных ферментов у пациентов, получавших этанерцепт без сопутствующей терапии метотрексатом, составляла 0,54 % (категория частоты «нечасто»). В двойных слепых контролируемых клинических исследованиях, в которых разрешалось сопутствующее применение этанерцепта и метотрексата, частота (доля пациентов) нежелательных явлений в виде повышения активности печёночных ферментов составяла 4,18 % (категория частоты «часто»).
Аутоиммунный гепатит
В контролируемых клинических исследованиях этанерцепта при его применении по всем показаниям частота (доля пациентов) нежелательных явлений в виде аутоиммунного гепатита у пациентов, получающих этанерцепт без сопутствующей терапии метотрексатом составляла 0,02 % (категория частоты «редко»), В контролируемых клинических исследованиях, в которых разрешалось сопутствующее применение этанерцепта и метотрексата, частота (доля пациентов) нежелательных явлений в виде аутоиммунного гепатита составляла 0,24 % (категория частоты «нечасто»).
Побочные реакции у детей
Нежелательные явления у пациентов детского возраста с ювенильным идиопатическим артритом
В целом частота и виды побочных реакций у детей были похожи на те, которые наблюдались у взрослых пациентов. Отличия от взрослых и другие характерные особенности описаны ниже.
Инфекции, которые наблюдались в клинических исследованиях у детей с ювенильным идиопатическим полиартритом в возрасте от 2 до 18 лет, были лёгкой и умеренной степени выраженности, а их виды не противоречили тем, которые обычно встречаются среди амбулаторных пациентов. Сообщения о тяжёлых нежелательных явлениях включали ветряную оспу с симптомами асептического менингита, которые разрешились без осложнений (см. раздел «Особые указания»), аппендицит, гастроэнтерит, депрессию/расстройства личности, язвы кожи, эзофагит/гастрит, септический шок, вызванный стрептококками группы А, сахарный диабет I типа и инфекции мягких тканей и послеоперационных ран.
В одном исследовании у детей в возрасте от 4 до 17 лет с ювенильным идиопатическим артритом у 43 из 69 (62 %) детей была зарегистрирована инфекция во время лечения этанерцептом после 3 месяцев исследования (часть 1, открытое), при этом частота и степень тяжести инфекций была аналогичной у 58 пациентов, которые завершили 12-месячную фазу открытой дополнительной терапии. Типы и частота нежелательных реакций у пациентов с ювенильным идиопатическим артритом были аналогичными таковым в исследованиях применения этанерцепта у взрослых пациентов с ревматоидным артритом, причём большинство были лёгкой степени тяжести. Несколько нежелательных явлений регистрировались чаще у 69 пациентов с ювенильным идиопатическим артритом, которые получали этанерцепт в течение 3 месяцев, в сравнении с 349 взрослыми пациентами с равматоидным артритом. Эти явления включали головную боль (19 % пациентов, 1,7 явления на пациенто-год), тошноту (9 %, 1,0 явления на пациенто-год), боль в животе (19 %, 0,74 явления на пациенто-год) и рвоту (13 %, 0,74 явления на пациенто-год).
В клинических исследованиях ювенильного идиопатического артирита было зарегистрировано 4 случая синдрома активации макрофагов.
В пострегистрационный период были зарегистрированы случаи воспалительного заболевания кишечника и увеита у пациентов с ювенильным идиопатическим полиартритом, получавших лечение этанерцептом, включая очень незначительное количество случаев, свидетельствующих о возобновлении реакций при повторном назначении препарата (см. раздел «Особые указания»).
Нежелательные явления у пациентов детского возраста с бляшечным псориазом
В 48-недельном исследовании у 211 детей возрасте от 4 до 17 лет с детским бляшечным псориазом зарегистрированные нежелательные явления были аналогичными таковым в предыдущих исследованиях у взрослых с бляшечным псориазом.
Передозировка
При передозировке препаратом Эрелзи® немедленно сообщите об этом врачу или фармацевту.
Сохраните картонную упаковку препарата Эрелзи®, даже если она пустая, в соответствии с указаниями лечащего врача.
Максимальная доза препарата Эрелзи® не установлена. В рамках клинического исследования здоровым добровольцам вводилась доза 60 мг/м2 однократно, что не привело к развитию лимитирующей дозу токсичности. При лечении пациентов с ревматоидным артритом не было зарегистрировано случаев превышения предельной токсичной дозы. Наивысшая доза, введённая внутривенно, составила 32 мг/м2 с последующим подкожным введением 16 мг/м2 2 раза в неделю. Специфический антидот для препарата Эрелзи® неизвестен.
Взаимодействие
Анакинра
На фоне комбинированной терапии этанерцептом и анакинрой наблюдалось значительное повышение частоты развития серьёзных инфекций и нейтропении по сравнению с пациентами, которым вводили только этанерцепт или только анакинру. Совместное применение этанерцепта и анакинры не показало клинического преимущества, поэтому не рекомендуется.
Абатацепт
Одновременное применение абатацепта и этанерцепта сопровождалось повышением частоты серьезных нежелательных явлений. Данная комбинация лекарственных препаратов не продемонстрировала клинических преимуществ, поэтому не рекомендуется.
Сульфасалазин
У пациентов, которым на фоне лечения сульфасалазином вводили этанерцепт, описано значительное снижение числа лейкоцитов по сравнению с теми пациентами, которые принимали только этанерцепт или только сульфасалазин.
Следует соблюдать осторожность при одновременном назначении этанерцепта и сульфасалазина.
Отсутствие взаимодействия
Не наблюдалось нежелательных взаимодействий при одновременном применении этанерцепта с глюкокортикостероидами, салицилатами (за исключением сульфасалазина), нестероидными противовоспалительными препаратами (НПВП), анальгетиками или метотрексатом.
Метотрексат
Метотрексат не оказывает влияния на фармакокинетику этанерцепта. Влияние этанерцепта на фармакокинетику метотрексата у человека не изучалось.
Дигоксин
Не обнаружено клинически значимого влияния на фармакокинетику этанерцепта.
Варфарин
Не обнаружено клинически значимого влияния на фармакокинетику этанерцепта.
Вакцинация
Живые вакцины не следует вводить на фоне лечения этанерцептом. Нет данных о вторичной передаче инфекции через живую вакцину пациентам, получающим этанерцепт.
Рекомендуется, чтобы до начала лечения этанерцептом дети и подростки по возможности получили все необходимые прививки в соответствии с действующим национальным календарём прививок.
У большинства пациентов с псориатическим артритом, получающих этанерцепт, наблюдалось повышение B-клеточного иммунного ответа на пневмококковую полисахаридную вакцину, но титры в целом были несколько ниже, двукратное увеличение титров наблюдалось у меньшего числа пациентов по сравнению с пациентами, не получающими этанерцепт.
Особые указания
После прекращения лечения препаратом Эрелзи® симптомы заболевания могут рецидивировать.
Инфекции
Пациенты должны обследоваться на наличие инфекций до начала применения препарата Эрелзи®, в ходе лечения и после окончания курса терапии, принимая во внимание среднюю продолжительность периода полувыведения этанерцепта, равную примерно 70 ч (7–300 ч).
При применении препарата Эрелзи® сообщалось о сепсисе, туберкулёзе, паразитарных инфекциях (включая вызванные простейшими организмами) и тяжёлых инфекциях, в том числе оппортунистических, включая инвазивные грибковые инфекции, листериоз и легионеллёз (некоторые с летальным исходом), вирусные инфекции (включая вызванные Herpes Zoster). Наиболее часто регистрируемые инвазивные грибковые инфекции были вызваны Candida Pneumocystis, Aspergillus и Histoplasma.
Неправильная диагностика перечисленных инфекций, особенно грибковых и других оппортунистических инфекций, приводила к запоздалому назначению необходимого лечения и, в некоторых случаях, летальному исходу. Во многих случаях пациенты получали терапию другими лекарственными средствами, в том числе иммунодепрессантами. При обследовании пациентов нужно принимать во внимание возможность развития у них оппортунистических инфекций, например, эндемичных микозов. Пациенты, у которых новые инфекции развиваются на фоне лечения препаратом Эрелзи®, должны находиться под тщательным наблюдением. Лечение препаратом Эрелзи® следует прервать, если у пациента развивается тяжёлая инфекция. Следует с осторожностью назначать препарат Эрелзи® пациентам с частыми или хроническими инфекциями в анамнезе или имеющим сопутствующие заболевания, которые могут способствовать развитию инфекций (например, тяжёлый или плохо контролируемый сахарный диабет). Безопасность и эффективность препарата Эрелзи® у пациентов с хроническими инфекциями не оценивалась. Следует соблюдать осторожность при применении этанерцепта у пожилых пациентов и обращать особое внимание на развитие инфекций.
Туберкулёз
На фоне терапии этанерцептом сообщалось о случаях активного туберкулёза, включая милиарный туберкулёз и туберкулёз внелёгочной локализации. Среди пациентов с ревматоидным артритом, по всей видимости, отмечается более высокая частота развития туберкулёзной инфекции. Развитие туберкулёза может быть связано с реактивацией латентной инфекции, а также с развитием новой инфекции. До начала терапии все пациенты должны быть обследованы на наличие активного или латентного туберкулёза. Обследование должно включать детальное изучение анамнеза относительно заболевания туберкулёзом или наличия контактов с туберкулёзными пациентами и данных о предшествующей или текущей иммуносупрессивной терапии. У всех пациентов должны быть выполнены необходимые скрининговые исследования, соответствующие локальным требованиям, обязательно включающие туберкулиновый кожный тест и рентгенографию лёгких. Следует учитывать возможность ложноотрицательного туберкулинового теста, особенно у пациентов в тяжёлом состоянии или у пациентов с нарушенным иммунитетом.
Также необходимо учитывать возможность развития туберкулёза у пациентов, у которых до начала терапии препаратом Эрелзи® не было обнаружено признаков туберкулёзной инфекции. Лечащий врач должен контролировать состояние пациента на предмет появления признаков туберкулёза, в том числе у пациентов с изначально отрицательными результатами тестов на наличие туберкулёзной инфекции.
Не следует применять препарат Эрелзи® при наличии у пациента активного туберкулёза. В случае наличия неактивного туберкулёза перед началом терапии препаратом Эрелзи* необходимо назначение стандартной противотуберкулёзной терапии в соответствии с локальными рекомендациями.
В этом случае должно быть тщательно проанализировано соотношение пользы и риска лечения препаратом Эрелзи®.
Все пациенты должны быть проинформированы о необходимости обращения к врачу при появлении на фоне лечения препаратом Эрелзи® или после него жалоб или симптомов, характерных для туберкулёза (например, упорного кашля, потери массы тела, субфебрилитета).
Активация вируса гепатита B
Сообщалось о случаях активации вируса гепатита B у носителей (в том числе у пациентов с положительным результатом на анти-НВс и отрицательным HBsAg), которые получали ингибиторы ФНО-α, включая этанерцепт. Большая часть этих случаев имела место у пациентов, одновременно получающих другие лекарственные средства, подавляющие иммунную систему, которые также могут способствовать реактивации вируса гепатита B. Перед применением препарата Эрелзи® у пациентов, входящих в группу высокого риска заболевания гепатитом B, необходимо провести соответствующий диагностический поиск. Несмотря на то, что связь с применением этанерцепта не доказана, следует соблюдать особую осторожность при применении препарата Эрелзи® у пациентов-носителей вируса гепатита B. Необходимо проводить контроль состояния пациентов на предмет признаков гепатита B в период применения этанерцепта и в течение нескольких недель после окончания лечения. При появлении симптомов этого заболевания, следует обсудить возможность проведения специфической терапии.
Обострение гепатита C
Зарегистрированы случаи обострения гепатита C у пациентов, получавших терапию этанерцептом, однако причинно-следственная связь с применением препарата не доказана. Тем не менее, следует соблюдать осторожность при применении препарата Эрелзи® у пациентов с гепатитом C в анамнезе.
Аллергические реакции
Аллергические реакции часто сопутствуют применению этанерцепта. При любых тяжёлых аллергических или анафилактических реакциях следует немедленно прекратить лечение препаратом Эрелзи ® и начать соответствующее лечение.
Иммуносупрессия
При терапии ингибиторами ФНО-α, в том числе препаратом Эрелзи®, существует возможность угнетения защитных механизмов организма человека против инфекций и злокачественных новообразований, поскольку ФНО участвует в процессах воспаления и модулирует клеточный иммунный ответ.
Однако у взрослых пациентов с ревматоидным артритом на фоне лечения этанерцептом не было выявлено случаев угнетения реакций отсроченной гиперчувствительности, падения концентрации иммуноглобулина или изменения численности популяции клеток-эффекторов.
У детей с ювенильным идиопатическим артритом в редких случаях развивалась ветряная оспа и симптомы асептического менингита, которые разрешались без осложнений. Пациентам, бывшим в контакте с больными ветряной оспой, следует временно прекратить лечение препаратом Эрелзи® и назначить профилактическое лечение иммуноглобулином против вируса Varicella Zoster.
Эффективность и безопасность лечения препаратом Эрелзи® пациентов с иммуносупрессией не изучались.
Злокачественные и лимфопролиферативные заболевания
В постмаркетинговом периоде (см. раздел «Побочное действие») были получены отчёты о различных злокачественных новообразованиях (включая карциному молочной железы и лёгкого, а также лимфому).
В ряде контролируемых клинических исследований лимфома чаще диагностировалась у пациентов, принимающих ингибиторы ФНО-α, чем у пациентов, которые их не получали. С другой стороны, эти случаи были редкими, а период наблюдения за пациентами из группы плацебо был короче, чем за пациентами, получающими лечение ингибиторами ФНО-α. Имеются сообщения о развитии лейкоза на фоне терапии ингибиторами ФНО-α.
Существует высокий риск возникновения лимфомы и лейкоза у пациентов с ревматоидным артритом, являющимся длительным заболеванием, характеризующимся активным воспалением, что само по себе осложняет оценку риска. Последующий анализ клинических исследований этанерцепта у пациентов с ревматоидным артритом не подтвердил и не исключил повышения риска развития онкологических заболеваний на фоне применения этанерцепта.
В соответствии с современными данными нельзя исключить возможный риск развития лимфомы, лейкоза или других злокачественных новообразований у пациентов, получающих ингибиторы ФНО-α.
Есть сообщения о развитии злокачественных новообразований (в половине случаев Ходжкинских и неходжкинских лимфом), часть которых имели летальный исход, у детей и подростков, получавших лечение ингибиторами ФНО-α, в том числе этанерцептом. Большинство пациентов получали сопутствующую терапию иммунодепрессантами. В других случаях имели место другие злокачественные новообразования, включая редкие варианты, связанные с иммуносупрессией. При применении препарата необходимо учитывать риск развития злокачественных новообразований.
Рак кожи
Меланома и рак кожи, не относящийся к меланоме (РКНМ), были зарегистрированы у пациентов, получавших лечение ингибиторами ФНО-а, включая этанерцепт. Чаще всего РКНМ диагностируют у пациентов с псориазом. Были получены сообщения о развитии карциномы Меркеля. Для всех пациентов, входящих в группу риска, рекомендуются периодическое обследование кожных покровов.
Выработка аутоиммунных антител
Лечение препаратом Эрелзи® может сопровождаться образованием аутоиммунных антител (см. раздел «Побочное действие»). Эти антитела не относятся к нейтрализующим и обычно быстро исчезают. Не отмечено корреляции между образованием антител и клинической эффективностью препарата, а также частотой развития побочных реакций.
Единичные случаи формирования аутоантител в сочетании с волчаночноподобным синдромом или сыпью, сходной с подострой формой красной волчанки или дискоидной формой красной волчанки (данные клинического обследования и биопсии) отмечались у пациентов, включая пациентов с ревматоидным артритом с положительным ревматоидным фактором.
Гематологические реакции
Сообщалось о редких случаях развития панцитопении и очень редких случаях апластической анемии, в том числе с летальным исходом, у пациентов, получавших этанерцепт. Следует проявить осторожность при применении препарата Эрелзи® у пациентов с указанием на заболевания крови в анамнезе.
Все пациенты, их родственники/сиделки должны быть осведомлены о том, что, если у пациента во время лечения препаратом Эрелзи® развиваются признаки и симптомы, характерные для инфекции или гематологических нарушений (например, продолжительная лихорадка, ангина, синяки, кровотечение, бледность), им следует немедленно обратиться за медицинской помощью. У таких пациентов рекомендуется срочно провести обследование, включая полный анализ крови. При подтверждении диагноза гематологического заболевания, лечение препаратом Эрелзи® следует прекратить.
Поражение ЦНС
Имеются редкие сообщения о развитии демиелинизирующих заболеваний ЦНС у пациентов, получавших терапию этанерцептом. Очень редко сообщалось о развитии периферических демиелинизирующих полинейропатий (включая синдром Гийена-Барре). Исследований применения препарата Эрелзи® у пациентов с рассеянным склерозом не проводилось, однако исследования других ингибиторов ФНО при этом заболевании показали возможность его обострения. Перед началом терапии препаратом Эрелзи® рекомендуется тщательно оценить соотношение польза-риск, неврологический статус у пациентов с демиелинизирующими заболеваниями, в том числе недавно возникшими, а также у пациентов, имеющих повышенный риск развития демиелинизирующего заболевания.
ХСН
Следует соблюдать осторожность в отношении назначения препарата Эрелзи® пациентам с ХСН. Сообщалось о редких (<0,1 %) случаях развития ХСН, в том числе у пациентов без подтверждённого имеющегося заболевания сердечно-сосудистой системы. Некоторые из пациентов были моложе 50 лет. Данные ряда исследований позволяют предположить возможность ухудшения течения ХСН у пациентов, получающих этанерцепт.
Комбинированная терапия
Комбинация этанерцепта и метотрексата не дала неожиданных результатов при исследовании безопасности. Долгосрочное изучение продолжается. Данные по безопасности препарата Эрелзи®, который назначали в комбинации с метотрексатом, были схожи с таковыми при применении препарата Эрелзи® и метотрексата по отдельности.
Долгосрочная безопасность применения препарата Эрелзи® в комбинации с другими базисными противовоспалительными препаратами не исследовалась.
Изучение применения препарата Эрелзи® в комбинации с другой системной терапией или фототерапией псориаза не проводилось.
Гранулематоз Вегенера
Частота развития различного типа злокачественных опухолей внекожной локализации была значительно выше у пациентов с гранулематозом Вегенера, получавших этанерцепт, чем в контрольной группе. Поэтому препарат Эрелзи® не рекомендуется для лечения пациентов с гранулематозом Вегенера.
Алкогольный гепатит
Применение этанерцепта для лечения алкогольного гепатита не рекомендуется.
Сахарный диабет
Сообщалось о случаях гипогликемии на фоне терапии этанерцептом у пациентов, принимающих гипогликемические препараты, что требовало коррекции их дозы.
Влияние на способность управлять транспортными средствами или работать с механизмами
Изучение влияния на способность управлять автомобилем и пользоваться сложной техникой при применении препарата Эрелзи® не проводилось. В связи с этим, управлять автомобилем или пользоваться сложной техникой следует с осторожностью.
Форма выпуска
Раствор для подкожного введения, 50 мг/мл.
Хранение
Хранить в оригинальной упаковке при температуре от 2 до 8 °C.
Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2,5 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Эрелзи:
