Респиум®
, ингаляцииРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
капсулы с порошком для ингаляций
Состав
Состав на одну капсулу:
Действующее вещество:
Тиотропия бромида моногидрат — 22,5 мг (в пересчёте на тиотропий — 18 мкг).
Вспомогательное вещество:
Лактозы моногидрат — до 15 мг.
Состав капсулы:
Корпус: калия ацетат — 0,4500 мг, каррагинан — 0,6000 мг, вода очищенная — 1,5000 мг, гипромеллоза — 27,4500 мг.
Крышечка: краситель «солнечный закат» жёлтый FCF (E110) — 0,0010 мг, краситель зелёный прочный FCF (E143) — 0,0050 мг, краситель хинолиновый жёлтый (E104) — 0,2008 мг, калия ацетат — 0,3000 мг, каррагинан — 0,4000 мг, титана диоксид — 0,4894 мг, вода очищенная — 1,0000 мг, гипромеллоза — 17,6038 мг.
Описание
Белый или почти белый порошок в капсулах № 3.
Корпус бесцветный прозрачный и крышечка зелёная.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Тиотропия бромид — антимускариновый препарат продолжительного действия М-холиноблокатор, в клинической практике часто называемый антихолинергическим средством. Он обладает одинаковым сродством к различным подтипам мускариновых рецепторов от M1 до М5. Результатом ингибирования М3-рецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется не менее 24 часов. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией от М3-рецепторов, по сравнению с ипратропия бромидом. При ингаляционном способе введения тиотропия бромид как N-четвертичное антихолинергическое средство оказывает местный избирательный эффект, при этом в терапевтических дозах не вызывает системных м-холиноблокирующих побочных эффектов. Диссоциация от М2-рецепторов происходит быстрее, чем от М3. Высокое сродство к рецепторам и медленная диссоциация обуславливают выраженный и продолжительный бронходилатирующий эффект у пациентов с хронической обструктивной болезнью лёгких.
Бронходилатация после ингаляции тиотропия бромида является следствием местного, а не системного эффекта.
Было показано, что тиотропия бромид значительно увеличивает функцию лёгких (объём форсированного выдоха в 1 секунду ОФВ1, форсированную жизненную ёмкость лёгких ФЖЕЛ) спустя 30 минут после однократной дозы на протяжении 24 часов.
Фармакодинамическое равновесие достигалось в течение первой недели, а выраженный бронходилатирующий эффект наблюдался на 3 день. Тиотропия бромид значительно увеличивает утреннюю и вечернюю пиковую потоковую скорость выдоха, измеряемую пациентами. Бронходилатирующий эффект тиотропия бромида, оцениваемый на протяжении года, не выявил проявлений толерантности.
Тиотропия бромид значительно уменьшает одышку на протяжении всего периода лечения. В двух рандомизированных двойных слепых плацебо-контролируемых исследованиях было доказано, что тиотропия бромид значительно улучшал переносимость физической нагрузки по сравнению с плацебо.
Тиотропия бромид значительно снижает число обострений хронической обструктивной болезни лёгких (ХОБЛ), и увеличивает период до момента первого обострения по сравнению с плацебо.
Тиотропия бромид значительно улучшает качество жизни. Это улучшение наблюдается на протяжении всего периода лечения.
Было показано, что тиотропия бромид значительно снижает количество случаев госпитализации, связанной с обострением ХОБЛ, и увеличивает время до момента первой госпитализации.
Также было показано, что тиотропия бромид приводит к стойкому улучшению ОФВ1 после применения в течение 4-х лет без изменения темпов ежегодного снижения ОФВ1.
Во время лечения наблюдается снижение риска смерти на 16 %.
По сравнению с приёмом салметерола, применение тиотропия бромида увеличивает время до первого обострения (187 дней против 145), со снижением риска развития обострений на 17 % (отношение рисков 0,83; 95 % доверительный интервал [ДИ], от 0,77 до 0,90; Р <0,001). Также приём тиотропия бромида увеличивает время наступления первого тяжёлого (требующего госпитализации) обострения (отношение рисков 0,72; 95 % ДИ от 0,61 до 0,85; Р <0,001), снижает ежегодное число средних или тяжелых (требующих госпитализации) обострений (0,64 против 0,72; отношение рисков 0,89; 95 % ДИ от 0,83 до 0,96; Р = 0,002), снижает ежегодное число тяжёлых (требующих госпитализации) обострений (0,09 против 0,13; отношение рисков 0,73; 95 % ДИ от 0,66 до 0,82; Р <0,001).
Фармакокинетика
Тиотропий — четвертичное аммониевое соединение, умеренно растворимое в воде.
Всасывание
При ингаляционном способе введения абсолютная биодоступность тиотропия составляет 19,5 %, свидетельствуя о том, что фракция препарата, достигающая лёгкие, высоко биодоступна.
Тиотропий в растворе при приёме внутрь имеет абсолютную биодоступность равную 2–3 %. Приём пищи не влияет на всасывание тиотропия. Максимальная концентрация тиотропия в плазме (Cmax) после ингаляции достигается через 5–7 минут. На стадии динамического равновесия пиковая концентрация тиотропия в плазме крови у пациентов с ХОБЛ составляет 12,9 пг/мл и быстро снижается. Это указывает на мультикомпартментный тип распределения препарата. На стадии динамического равновесия базальная концентрация тиотропия в плазме крови составляет 1,71 пг/мл.
Распределение
72 % от принятой дозы препарата связывается с белками плазмы и объём распределения равен 32 л/кг.
Исследования показали, что тиотропий не проникает через гематоэнцефалический барьер.
Биотрансформация
Степень биотрансформации незначительна. Это подтверждается тем, что после внутривенного введения препарата здоровым молодым добровольцам, в моче обнаруживается 74 % неизменной субстанции. Тиотропий расщепляется неферментным способом до алкоголь-N-метилскопина и дитиенилгликоливой кислоты, которые не связываются с мускариновыми рецепторами.
При исследованиях показано, что препарат (<20 % от дозы после внутривенного применения) метаболизируется цитохромом P450, этот процесс зависит от оксидации и последующей коньюгации с глутатионом с образованием различных метаболитов. Нарушение метаболизма может иметь место при использовании ингибиторов CYP 450, 2D6 и 3A4 (хинидина, кетоконазола и гестодена). Таким образом CYP 450, 2D6 и 3A4 включаются в метаболизм препарата. Тиотропий даже в сверхтерапевтических концентрациях не ингибирует цитохром P450, 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1, или 3A в микросомах печени человека.
Выведение
Период полувыведения тиотропия после ингаляции варьирует от 27 до 45 часов. Общий клиренс при внутривенном введении здоровым молодым добровольцам составляет 880 мл/мин. Тиотропий после внутривенного введения в основном выводится почками в неизменном виде (74 %). После ингаляции сухого порошка на стадии динамического равновесия почечная экскреция составляет 7 % в сутки от дозы, оставшаяся невсосавшаяся часть, выводится через кишечник. Почечный клиренс тиотропия превышает клиренс креатинина, что свидетельствует о канальцевой секреции препарата. После длительного приёма препарата однократно в сутки пациентами с ХОБЛ, фармакокинетическое равновесие достигается на 7 день, при этом не наблюдается аккумуляции в дальнейшем.
Тиотропий имеет линейную фармакокинетику в терапевтических пределах независимо от лекарственной формы препарата.
Пожилые пациенты
У пожилых пациентов наблюдается снижение почечного клиренса тиотропия (365 мл/мин у пациентов с ХОБЛ младше 65 лет, до 271 мл/мин у пациентов с ХОБЛ старше 65 лет). Эти изменения не приводили к соответствующему увеличению значений площади под кривой «концентрация-время» (AUC0–6) или Cmax.
Пациенты с нарушенной функцией почек
У пациентов с ХОБЛ и легкими нарушениями функции почек (клиренс креатинина 50–80 мл/мин) ингаляционное применение тиотропия один раз в сутки на стадии динамического равновесия приводило к повышению значения AUC0–6 на 1,8–30 %. Значение Cmax сохранялось таким же, как у пациентов с нормальной функцией почек (клиренс креатинина >80 мл/мин). У пациентов с ХОБЛ и средними или тяжёлыми нарушениями функции почек (клиренс креатинина <50 мл/мин) внутривенное введение тиотропия приводило к двукратному увеличению концентрации препарата в плазме (значение AUC0–4 ч увеличивалось на 82 %, а значение Cmax увеличивалось на 52 %) по сравнению с пациентами с ХОБЛ и нормальной функцией почек. Аналогичное повышение концентрации тиотропия в плазме отмечалось и после ингаляции сухого порошка.
Пациенты с нарушенной функцией печени
Предполагается, что печёночная недостаточность не будет оказывать значительного влияния на фармакокинетику тиотропия, так как тиотропий в основном выводится почками, и с помощью неферментативного расщепления эфирных связей, с образованием метаболитов, которые не связываются с мускариновыми рецепторами.
Показания
Тиотропия бромид показан в качестве поддерживающей терапии у пациентов с ХОБЛ, включая хронический бронхит и эмфизему (поддерживающая терапия при сохраняющейся одышке и для предупреждения обострений).
Противопоказания
- Повышенная чувствительность к атропину или его производным (например, ипратропию или окситропию) или к компонентам данного препарата (в частности, к лактозы моногидрату, который содержит молочный белок, вследствие дефицита лактазы, непереносимости лактозы, глюкозо-галактозной мальабсорбции).
- I триместр беременности.
- Возраст до 18 лет.
С осторожностью
Следует с осторожностью назначать тиотропия бромид пациентам с такими заболеваниями, как закрытоугольная глаукома, обструкция шейки мочевого пузыря, гиперплазия предстательной железы. При применении препарата тиотропия бромид следует тщательно наблюдать пациентов со средней и тяжёлой степенью почечной недостаточность (клиренс креатинина ≤50 мл/мин).
Применение при беременности и в период грудного вскармливания
Данные об использовании тиотропия при беременности у человека ограничены. В исследованиях на животных не получено указаний на прямые или опосредованные неблагоприятные влияния на беременность, развитие эмбриона/плода, процесс родов или постнатальное развитие.
В качестве меры предосторожности предпочтительнее воздержаться от применения препарата тиотропия бромид во время беременности. Клинических данных о применении тиотропия у женщин, кормящих грудью, не имеется. В доклинических исследованиях были получены данные что, небольшое количество тиотропия экскретируется в грудное молоко.
Тиотропия бромид не должен применяться у беременных или кормящих грудью женщин, если только ожидаемая польза не превышает возможный риск для плода или ребёнка.
Способ применения и дозы
Ингаляционно.
При использовании тиотропия бромида в виде ингаляций с помощью ингалятора рекомендуется применять одну капсулу в сутки в одно и тоже время.
Препарат не нужно глотать.
Пожилые пациенты должны принимать тиотропия бромид в рекомендуемых дозах.
Пациенты с нарушенной функцией почек могут использовать препарат в рекомендуемых дозах. Однако необходимо тщательное наблюдение за пациентами с умеренной или тяжёлой почечной недостаточностью, получающими тиотропия бромид (как и в случае с другими препаратами, эскретирующимися в основном почками).
Пациенты с печёночной недостаточностью могут принимать тиотропия бромид в рекомендуемых дозах.
Инструкция по использованию ингалятора:
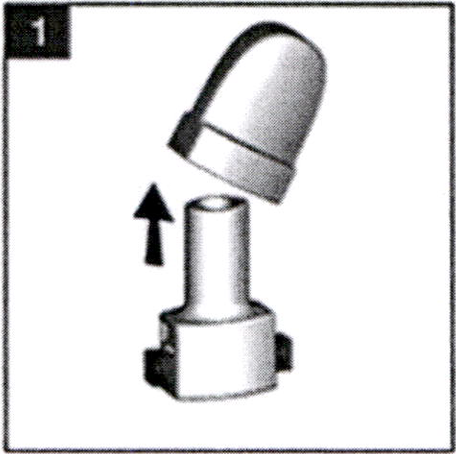
- Снимите защитный колпачок с ингалятора.
- Возьмитесь за середину мундштука и основание ингалятора, поверните мундштук по направлению, указанному стрелкой на корпусе, и откройте ячейку для капсулы в основании ингалятора.
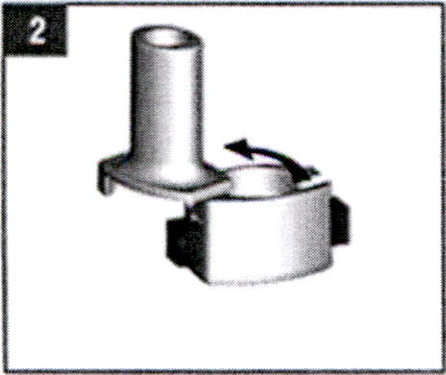
- Сухими руками возьмите одну капсулу из флакона или блистера и поместите капсулу в ячейку для капсул. Внимание! Не вставляйте капсулы прямо в отверстие мундштука. Не глотать!
- Закройте мундштук, вращая его в противоположную сторону от указания стрелки, удерживайте ингалятор в вертикальном положении.
- Удерживая ингалятор в вертикальном положении, нажмите на кнопки в основании ингалятора и проткните капсулу.
- Отпустите кнопки. Сделайте полный выдох.
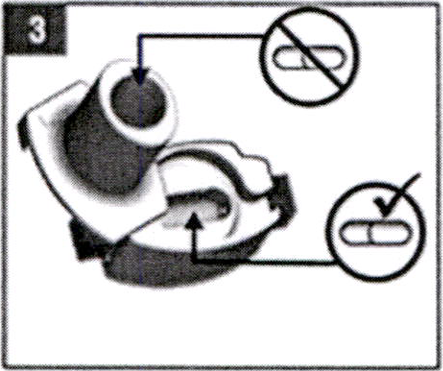
Поместите ингалятор в рот, плотно обхватив мундштук губами. Глубоко вдохните.
Внимание! Не нажимайте кнопки и не закрывайте отверстия для входа воздуха.
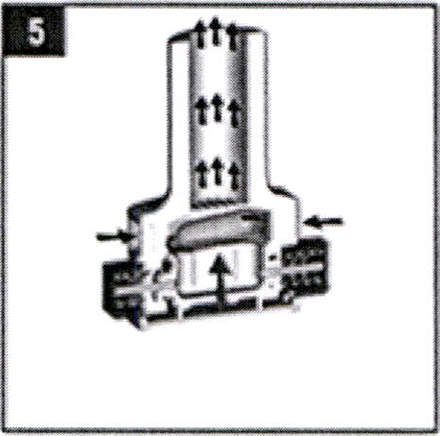
Выньте мундштук изо рта и задержите дыхание как можно дольше. Затем выдохните.
Внимание! Не выдыхайте через мундштук!
- Откройте ячейку для капсулы: возьмитесь за середину мундштука и основание ингалятора, поверните мундштук по направлению, указанному стрелкой на корпусе.
Извлеките оболочку капсулы и визуально проверьте, на наличие проколов и порошка.
Если капсула не проколота и ещё полная, повторите процедуру начиная с пункта 3.
Если капсула проколота, но не пустая, повторно вставьте капсулу в ячейку для капсул и повторите процедуру начиная с п. 7. Не нажимайте кнопку повторно!
Если капсула пустая – выбросите её.
- После использования, при необходимости, протрите мундштук сухой салфеткой или тряпочкой, закройте мундштук и верните на место защитный колпачок.

Побочное действие
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований и отдельных сообщений в течение пострегистрационного использования тиотропия бромида.
Побочные явления отражены ниже с разделением по частоте встречаемости: очень часто (≥10 %), часто (от ≥1 до <10 %), нечасто (от ≥0,1 до <1 %), редко (от ≥0,01 до <0,1 %), очень редко (<0,01 %), частота неизвестна.
Нарушения со стороны обмена веществ и питания:
частота неизвестна — дегидратация*.
Нарушения со стороны желудочно-кишечного тракта:
часто — сухость во рту, обычно лёгкой степени выраженности;
нечасто — стоматиты, запор, гастроэзофагеальный рефлюкс;
редко — кандидоз ротоглотки, гингивиты, глосситы; кишечная непроходимость, включая паралитический илеус, дисфагия.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
нечасто — дисфония, кашель, фарингиты;
редко — пародоксальный бронхоспазм, ларингиты, синуситы, носовое кровотечение.
Нарушения со стороны сердечно-сосудистой системы:
нечасто — мерцательная аритмия;
редко — тахикардия (включая суправентрикулярную тахикардию), ощущение сердцебиения.
Нарушения со стороны почек и мочевыводящих путей:
нечасто — затруднённое мочеиспускание и задержка мочеиспускания (у мужчин с предрасполагающими факторами), дизурия;
редко — инфекции мочевыводящих путей.
Аллергические реакции:
нечасто сыпь;
редко — крапивница, зуд, реакции повышенной чувствительности, включая реакции немедленного типа.
частота неизвестна — ангионевротический отёк*.
Нарушения со стороны кожных покровов:
частота неизвестна — кожные инфекции и язвы на коже, сухость кожи*.
Костно-мышечная система и связанные с ней заболевания соединительной ткани:
частота неизвестна — припухание суставов*.
Нарушения со стороны нервной системы:
нечасто — головокружение;
редко — бессонница.
Нарушения со стороны органа зрения:
нечасто — нечёткое зрение;
редко — повышение внутриглазного давления, глаукома.
* в объединённой базе клинических исследований данные побочные реакции не были выявлены: отмечены лишь единичные сообщения о данных побочных реакциях при широком применении препарата, однако связь с м-холиноблокирующим действием препарата тиотропия бромид не доказана; частоту этих редких явлений трудно оценить.
Передозировка
При применении высоких доз возможны проявления антихолинергического действия. Однако системные антихолинергические побочные эффекты не выявлялись после однократной ингаляционной дозы до 282 мкг тиотропия при приёме здоровыми добровольцами.
Билатеральный конъюнктивит в сочетании с сухостью во рту наблюдались у здоровых добровольцев после повторного приёма однократной суточной дозы 141 мкг, которые исчезали при продолжении лечения. При исследовании, в котором изучался эффект многократных доз тиотропия у пациентов с ХОБЛ, получавших максимально 36 мкг препарата более 4 недель, сухость во рту была единственным побочным эффектом.
Острая интоксикация, связанная со случайным приёмом капсул внутрь, маловероятна в связи с низкой биодоступностью препарата.
Взаимодействие с другими лекарственными средствами
Возможно применение тиотропия в комбинации с другими препаратами, обычно использующимися для лечения ХОБЛ: симпатомиметиками, метилксантинами, пероральными и ингаляционными глюкокортикостероидами. Совместное применение с длительнодействующими β2-агонистами, ингаляционными глюкокортикостероидами и их комбинациями не влияет на действие тиотропия.
Ограниченная информация о совместном применении с антихолинергическими препаратами получена из 2-х клинических исследований: разовое назначение одной дозы ипратропия бромида на фоне постоянного приёма тиотропия у пациентов с ХОБЛ (64 пациента) и у здоровых добровольцев (20 человек) не приводило к уменьшению побочных реакций, изменению жизненных параметров и электрокардиограммы. Однако постоянное совместное применение антихолинергических препаратов и тиотропия не изучалось, и, следовательно, не рекомендуется.
Особые указания
Тиотропия бромид, как бронходилататор, применяемый раз в сутки для поддерживающего лечения, не должен использоваться в качестве начальной терапии при острых приступах бронхоспазма, то есть в неотложных случаях.
После ингаляции порошка тиотропия бромида могут развиваться немедленные реакции повышенной чувствительности.
Ингаляция препарата может привести к бронхоспазму.
Пациентов с умеренной или выраженной почечной недостаточностью (клиренс креатинина ≤50 мл/мин) при приёме тиотропия бромида следует тщательно наблюдать, как это необходимо и в других случаях назначения лекарств, экскретирующихся преимущественно почками.
Пациенты должны быть ознакомлены с правилами использования капсул препарата тиотропия бромид. Не следует допускать попадания порошка в глаза. Боль в глазу или дискомфорт, нечёткое зрение, зрительные ореолы в сочетании с покраснением глаз, конъюнктивальным застоем и отёком роговицы могут свидетельствовать об остром приступе закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Применение препаратов, вызывающих миоз, не является эффективным способом лечения в данном случае.
Тиотропия бромид не следует применять чаще, чем раз в день.
Капсулы тиотропия бромида должны применяться только с прибором для ингаляций.
В одной дозе/капсуле содержится до 15 мг лактозы моногидрата.
Влияние на способность управлять транспортными средствами, механизмами
Исследований по изучению влияния препарата тиотропия бромид на способность к вождению автотранспорта и управления механизмами не проводилось. В случае развития таких нежелательных реакций, как головокружение, головная боль и нечёткость зрения, необходимо воздержаться от вождения автотранспорта и управления механизмами, а также от занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Капсулы с порошком для ингаляций, 18 мкг.
По 10 капсул в контурную ячейковую упаковку из фольги Ал и материала комбинированного ОПА/ПВХ/Ал.
По 1, 3 или 6 контурных ячейковых упаковок вместе с устройством для ингаляций производства Plastiape S.p.A., Италия или без него и инструкцией по медицинскому применению помещают в пачку из картона.
На пачку из картона может быть нанесена этикетка контрольного вскрытия.
Хранение
В оригинальной упаковке (контурная ячейковая упаковка в пачке) при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
ПСК Фарма, ООО, Российская Федерация
Юридический адрес:
141983, Московская обл., г. Дубна, ул. Программистов, 4, стр. 2, помещение 215.
Адрес места производства:
Московская обл., г.о. Дубна, г. Дубна, ул. Программистов, д. 5, стр. 1.
Владелец регистрационного удостоверения / Организация, принимающая претензии потребителей
ООО «Рус Биофарм», 664009, Россия, г. Иркутск, ул. Ширямова, 36, офис 204.
Тел.: 8 (800) 234-16-99.
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Респиум:
