Грасальва
GrasalvaРегистрационный номер
Торговое наименование
Грасальва
Международное непатентованное наименование
Лекарственная форма
раствор для внутривенного и подкожного введения
Состав
Активное вещество:
Грасальва 48 млн. МЕ/0,8 мл:
0,8 мл раствора содержит филграстим 48 млн. МЕ (480 мкг).
Вспомогательные вещества: уксусная кислота, натрия гидроксид, сорбитол, полисорбат 80, вода для инъекций.
Описание
Прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Активным веществом препарата является филграстим — рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ). Филграстим обладает такой же биологической активностью, как и эндогенный человеческий Г-КСФ, и от последнего отличается лишь тем, что представляет собой негликозилированный белок с дополнительным N-концевым остатком метионина. Филграстим, получаемый по технологии рекомбинантной ДНК, выделяют из клеток бактерии Escherichia coli, в состав генетического аппарата которых введен ген, кодирующий белок Г-КСФ.
Человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ) — гликопротеин, регулирующий образование функционально активных нейтрофилов и их выход в кровь из костного мозга. Филграстим, обладающий активностью Г-КСФ, значительно увеличивает число нейтрофилов в периферической крови уже в первые 24 ч после введения с небольшим увеличением числа моноцитов. У некоторых больных с тяжёлой хронической нейтропенией филграстим может также вызывать незначительное повышение числа циркулирующих эозинофилов и базофилов по сравнению с исходным.
В интервале рекомендуемых доз филграстима наблюдается дозозависимое увеличение количества нейтрофилов с нормальной или повышенной хемотаксической и фагоцитарной активностью. После окончания лечения число нейтрофилов в периферической крови снижается на 50 % в течение 1–2 дней и возвращается к нормальному уровню в течение последующих 1–7 дней.
Филграстим значительно уменьшает частоту, тяжесть и продолжительность нейтропении и фебрильной нейтропении после цитотоксической химиотерапии.
Филграстим значительно сокращает продолжительность фебрильной нейтропении, длительность антибиотикотерапии и госпитализации после индукционной химиотерапии при остром миелолейкозе, а также после миелоаблативной терапии с последующей трансплантацией костного мозга, не влияя на частоту лихорадки и инфекционных осложнений и не уменьшая продолжительность лихорадочного периода у пациентов после миелоаблативной терапии с последующей трансплантацией костного мозга.
Применение филграстима как самостоятельно, так и после химиотерапии мобилизует выход гемопоэтических стволовых клеток в периферический кровоток. Аутологичную или аллогенную трансплантацию периферических стволовых клеток крови (ПСКК) можно проводить после высокодозного лечения цитостатиками либо вместо трансплантации костного мозга, либо в дополнение к ней. Трансплантация ПСКК ускоряет восстановление кроветворения, уменьшая опасность геморрагических осложнений и потребность в переливании тромбоцитарной массы.
Применение филграстима у реципиентов мобилизованных аллогенных ПСКК приводит к более быстрой нормализации гематологических показателей в сравнении с трансплантацией аллогенного костного мозга. Восстанавливается нормальное число тромбоцитов и отпадает необходимость контроля тромбоцитопении.
Назначение здоровым донорам филграстима по 10 мкг/кг массы тела/сутки подкожно ежедневно в течение 4–5 дней обычно позволяет при проведении двух лейкаферезов получить количество ПСКК, равное или превышающее 4 × 106 СD34+-клеток/кг массы тела реципиента.
У детей и взрослых с тяжёлой хронической нейтропенией (врождённой, периодической или идиопатической) филграстим стабильно увеличивает количество нейтрофилов в периферической крови, снижает частоту инфекций и связанных с ними осложнений. Назначение филграстима пациентам с ВИЧ-инфекцией позволяет поддержать нормальный уровень нейтрофилов, что способствует планомерному проведению противовирусной и/или миелосупрессивной терапии. Не отмечено признаков увеличения репликации ВИЧ при лечении филграстимом.
Как и другие гемопоэтические факторы роста, филграстим стимулирует in vitro пролиферацию эндотелиальных клеток человека.
Фармакокинетика
Как при внутривенном, так и при подкожном введении препарата, элиминация филграстима протекает по правилам кинетики 1-го порядка. Среднее значение периода полувыведения филграстима из сыворотки крови составляет около 3,5 ч, клиренс равен 0,6 мл/мин/кг. При длительном применении филграстима до 28 дней после аутологичной трансплантации костного мозга не наблюдалось признаков кумуляции и увеличения периода полувыведения.
При внутривенном и подкожном введении филграстима наблюдается положительная линейная зависимость между дозой и концентрацией в сыворотке крови. После подкожного введения терапевтических доз филграстима его концентрация в сыворотке крови превышает 10 нг/мл в течение 8-16 ч. Объём распределения составляет около 150 мл/кг.
Показания
Грасальву назначают в качестве профилактического и лечебного средства в следующих целях:
- Сокращение продолжительности нейтропении и снижение частоты фебрильной нейтропении у больных, получающих цитотоксическую химиотерапию по поводу злокачественных заболеваний (за исключением хронического миелолейкоза и миелодиспластического синдрома).
- Сокращение продолжительности нейтропении у больных, получающих миелоаблативную терапию с последующей трансплантацией костного мозга.
- Мобилизация периферических стволовых клеток крови у пациентов.
- Длительная терапия для увеличения количества нейтрофилов и снижения частоты и продолжительности инфекционных осложнений у детей и взрослых с тяжёлой хронической врождённой, периодической или идиопатической нейтропенией (абсолютное количество нейтрофилов ≤0,5 × 109/л) и тяжёлыми или рецидивирующими инфекциями в анамнезе.
- Снижение риска бактериальных инфекций при стойкой нейтропении (абсолютное количество нейтрофилов ≤1,0 × 109/л) у пациентов с развёрнутой стадией ВИЧ-инфекции при неэффективности других средств контроля нейтропении.
- Мобилизация периферических стволовых клеток крови (ПСКК) у здоровых доноров для аллогенной трансплантации ПСКК.
Противопоказания
- Повышенная чувствительность к филграстиму или другим компонентам препарата.
- Хронический миелолейкоз и миелодиспластический синдром (см. «Особые указания и меры предосторожности»).
- Тяжёлая врождённая нейтропения (синдром Костманна) с цитогенетическими нарушениями (см. «Особые указания и меры предосторожности»).
- Применение с целью увеличения доз цитотоксических химиотерапевтических препаратов выше рекомендованных.
- Лактация.Применение при беременности и в период грудного вскармливания
Безопасность филграстима для беременных женщин не установлена. Имеются литературные данные о проникновении филграстима через плацентарный барьер. Данных о тератогенности филграстима в исследованиях на крысах и кроликах не получено. У кроликов, получавших филграстим, наблюдалась повышенная частота выкидышей, однако аномалий развития не отмечалось.
При назначении Грасальвы беременным следует соотнести ожидаемый терапевтический эффект с возможным риском для плода.Способ применения и дозы
Больные, получающие цитотоксическую химиотерапию по поводу злокачественных заболеваний
Рекомендуемая доза — 0,5 млн. МЕ (5 мкг)/кг массы тела 1 раз в сутки. Первую дозу следует вводить не ранее, чем через 24 ч после окончания курса цитотоксической химиотерапии. Грасальву можно вводить путём ежедневных п/к инъекций или ежедневных коротких (30-минутных) в/в инфузий на 5 % растворе глюкозы (см. «Указания по применению»). Предпочтителен п/к путь введения, при в/в введении действие филграстима может укорачиваться.
Грасальву вводят ежедневно до тех пор, пока количество нейтрофилов не превысит ожидаемый минимум (надир) и не достигнет диапазона нормальных значений. У больных, получающих цитотоксическую химиотерапию по поводу солидных опухолей, лимфом и лимфолейкоза, длительность терапий до 14 дней. После индукционной и консолидационной терапии острого миелолейкоза продолжительность применения Грасальвы может увеличиться до 38 дней. Длительность лечения Грасальвой находится в зависимости от типа, доз и использованной схемы цитотоксической химиотерапии.
Обычно преходящее увеличение числа нейтрофилов наблюдается через 1–2 дня после начала лечения филграстимом. Для достижения стабильного терапевтического эффекта необходимо продолжать терапию Грасальвой до тех пор, пока количество нейтрофилов не превысит ожидаемый минимум (надир) и не достигнет нормального уровня. Не рекомендуется отменять лечение преждевременно, до перехода количества нейтрофилов через надир.
Больные, получающие миелоаблативную терапию с последующей трансплантацией костного мозга
Начальная доза — 1 млн. МЕ (10 мкг)/кг массы тела в сутки — назначается в виде 30-минутной или непрерывной 24-часовой в/в инфузии или непрерывной 24-часовой п/к инфузии. Для в/в и п/к инфузии Грасальву разводят 20 мл 5 % раствора глюкозы (см. «Указания по применению»).
Первую дозу Грасальвы следует вводить не ранее, чем через 24 ч после проведения химиотерапии и не позже, чем через 24 ч после трансплантации костного мозга.
После того, как пройдет момент максимального снижения числа нейтрофилов, суточная доза корригируется в зависимости от динамики содержания нейтрофилов следующим образом:
Количество нейтрофилов | Доза филграстима |
Более 1,0 × 109/л в течение 3-х дней подряд | Снижают до 0,5 млн. МЕ (5 мкг)/кг/сутки |
Более 1,0 × 109/л в течение последующих 3-х дней подряд | Филграстим отменяют |
Если во время лечения абсолютное количество нейтрофилов снижается до уровня менее 1,0 × 109/л, дозу препарата увеличивают вновь в соответствии с вышеприведенной схемой. | |
Мобилизация периферических стволовых клеток крови (ПСКК) у пациентов, получающих миелосупрессивную или миелоаблативную терапию с последующей аутологичной трансфузией ПСКК
Для мобилизации ПСКК, проводимой в качестве самостоятельной терапии — 1 млн. МЕ(10мкг)/кг в сутки в виде непрерывной 24-часовой п/к инфузии или путём п/к инъекции 1 раз в сутки в течение 5–7 дней подряд. Для инфузии Грасальву разводят 20 мл 5 % раствора глюкозы (см.«Указания по применению»). Обычно достаточно одного или двух лейкаферезов на 5-й или 6-й дни. В случае дополнительного лейкафереза назначение Грасальвы в той же дозе необходимо продолжить до завершающего лейкафереза.
Для мобилизации ПСКК после миелосупрессивной химиотерапии 0,5 млн. МЕ (5 мкг)/кг в сутки путём ежедневных п/к инъекций, начиная с первого дня после завершения химиотерапии и до тех пор, пока количество нейтрофилов не перейдет через ожидаемый минимум и не достигнет нормальных значений. Лейкаферез следует проводить в течение периода возрастания числа нейтрофилов с <0,5 × 109/л до >5,0 × 109/л. Больным, не получавшим интенсивной химиотерапии, бывает достаточно одного лейкафереза. В отдельных случаях рекомендуется проводить дополнительные лейкаферезы.
Больные с тяжёлой хронической нейтропенией (ТХН)
При врождённой нейтропении Грасальва назначается в начальной дозе 1,2 млн. МЕ (12 мкг)/кг в сутки путём п/к инъекций однократно или разделив на несколько введений.
При идиопатической или периодической нейтропении назначается начальная доза 0,5 млн. МЕ(5 мкг)/кг/сутки п/к однократно или путём нескольких введений.
Коррекция дозы: Грасальву вводят ежедневно до стабильного превышения количества нейтрофилов 1,5 × 109/л. После достижения терапевтического эффекта определяют минимальную эффективную дозу для поддержания этого уровня. Для поддержания нужного количества нейтрофилов требуется длительное ежедневное введение препарата. Через 1–2 недели лечения начальную дозу можно удвоить или наполовину уменьшить, в зависимости от эффекта терапии. Впоследствии каждые 1–2 недели проводят индивидуальную коррекцию дозы для поддержания среднего количества нейтрофилов в диапазоне от 1,5 × 109/л до 10 × 109/л. У больных с тяжёлыми инфекциями можно применить схему с более быстрым увеличением дозы. Безопасность применения филграстима при длительном лечении больных с ТХН дозами более 2,4 млн. МЕ (24 мкг)/кг в сутки не установлена.
Пациенты с ВИЧ-инфекцией
Для восстановления числа нейтрофилов
Начальная доза — 0,1 млн. МЕ (1 мкг)/кг в сутки ежедневно путём однократной п/к инъекции, с увеличением дозы максимально до 0,4 млн. МЕ (4 мкг)/кг/сутки — до нормализации количества нейтрофилов (более 2,0 × 109/л).
Для поддержания нормального количества нейтрофилов
По окончании нейтропении определяют минимальную эффективную дозу препарата для поддержания нормального количества нейтрофилов. Рекомендуется начинать с введения 30 млн. МЕ (300 мкг) (независимо от массы тела) п/к через день. Необходимо поддерживать количество нейтрофилов более 2,0 × 109/л, поэтому впоследствии может потребоваться индивидуальная коррекция дозы в зависимости от уровня нейтрофилов у пациента. Обычно эту дозу достаточно вводить 3 раза в неделю, иногда для поддержания количества нейтрофилов >2,0 × 109/л требуется длительное назначение препарата.
Мобилизация периферических стволовых клеток крови (ПСКК) у здоровых доноров для аллогенной трансплантации ПСКК
Рекомендуемая доза — 1 млн. МЕ (10 мкг)/кг в сутки путём 24-часовой п/к инфузии (см. «Указания по применению») или п/к инъекции 1 раз в сутки в течение 4–5 дней подряд. Лейкаферез проводят с 5-го дня и при необходимости до 6-го дня с целью получить 4 × 106 СD34+-клеток/кг массы тела реципиента.
Данных по безопасности и эффективности применения филграстима у доноров младше 16 и старше 60 лет нет.
Особые указания по дозированию
Дети: Грасальва применяется у больных с ТХН и онкологическими заболеваниями в тех же дозах, что и у взрослых, получающих миелосупрессивную цитотоксическую химиотерапию.
Пожилой возраст: специальных рекомендаций для больных старческого возраста не установлено из-за недостаточного числа исследований.
Указания по применению
Грасальву разводят только 5 % раствором глюкозы (декстрозы), не допускается разведение 0,9 % раствором натрия хлорида.
Препарат после разведения может адсорбироваться стеклом и пластмассами.
Если Грасальва разводится до концентрации менее 1,5 млн. МЕ (15 мкг) в 1 мл, для предупреждения адсорбции необходимо добавлять сывороточный альбумин человека в количестве, чтобы конечная концентрация альбумина составляла 2 мг/мл. Например, при разведении общей дозы Грасальвы менее 30 млн. МЕ (300 мкг) до конечного объёма раствора 20 мл следует добавить 0,2 мл 20%-ного раствора альбумина.
Нельзя разводить Грасальву до концентрации менее 0,2 млн. МЕ (2 мкг)/мл.
Должным образом разведённая 5 % раствором глюкозы или 5 % раствором глюкозы с альбумином Грасальва совместима со стеклом и рядом пластмасс, в том числе поливинилхлоридом (PVC), полиолефином (сополимер полипропилена и полиэтилена) и полипропиленом.
Разведённый раствор Грасальвы может храниться при температуре от 2 до 8 °C не более 24 ч. После использования шприц с остатком раствора уничтожают.
Предпочтительные участки тела для подкожного введения Грасальвы показаны на рисунке: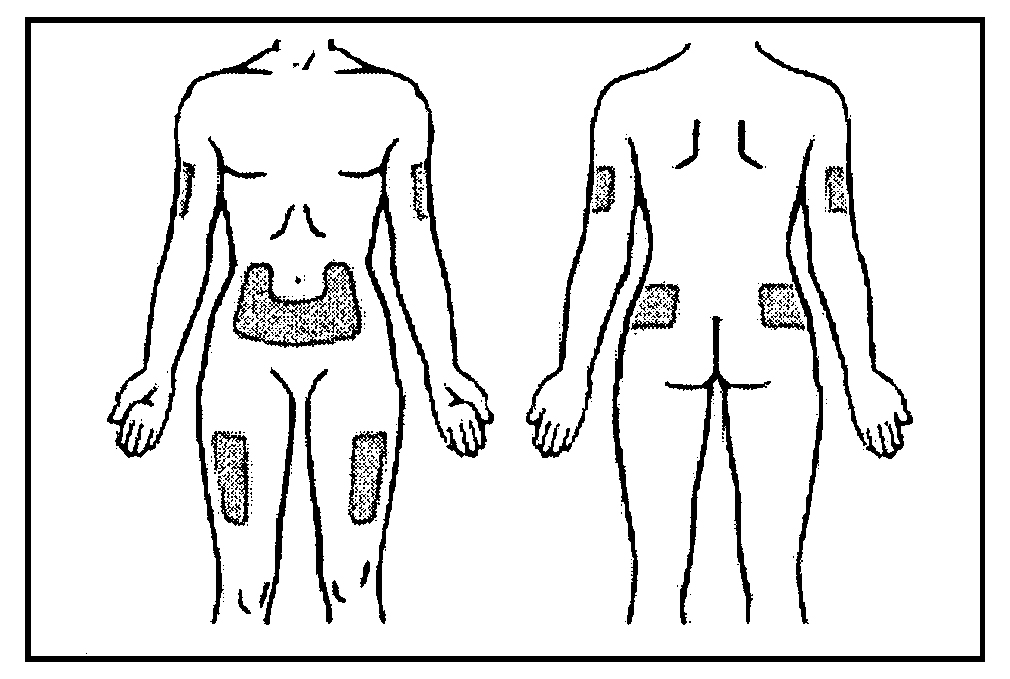
Следует вводить препарат ежедневно в одно и то же время. Во избежание боли лучше всего ежедневно менять место введения.
Побочное действие
У онкологических больных
Лечение филграстимом в рекомендованных дозах часто сопровождается болями в костях и мышцах. Как правило, они бывают слабыми или умеренными (10 %), однако иногда сильными (3 %), и в большинстве случаев купируются обычными анальгетиками. Реже побочные явления включают расстройства мочеиспускания (главным образом, слабую или умеренную дизурию).
По данным рандомизированных плацебо-контролированных клинических исследований филграстим не увеличивал частоту побочных реакций на цитотоксическую химиотерапию. Нежелательные явления, с одинаковой частотой отмечавшиеся у больных, получавших филграстим/химиотерапию и плацебо/химиотерапию, включали тошноту, рвоту, алопецию, диарею, вялость, общую слабость, анорексию, воспаление слизистых оболочек, головную боль, кашель, кожную сыпь, боли в грудной клетке, боль в горле, запоры и неспецифические боли (без указания диагноза).
При лечении филграстимом в рекомендованных дозах наблюдалось обратимое, дозозависимое и обычно слабое или умеренное повышение концентраций лактатдегидрогеназы, щелочной фосфатазы, сывороточной мочевой кислоты и γ-глутамилтрансферазы, соответственно у 50 %, 35%, 25% и 10% больных.
Изредка возможно преходящее снижение артериального давления, не требующее лечения.
Иногда у больных, получавших высокодозную химиотерапию с последующей аутологичной трансплантацией костного мозга, отмечались сосудистые нарушения, например, вено-окклюзионная болезнь и нарушения водного обмена. Их причинная связь с филграстимом установлена не была.
В редких случаях у получавших филграстим больных наблюдался кожный васкулит, механизм которого неясен.
Отмечались случаи синдрома Свита (острый фебрильный нейтрофильный дерматоз). Не известна причинная связь с филграстимом в этих случаях, так как значительная их часть относилась к больным лейкозом, а синдром Свита характерен для этого заболевания.
В отдельных случаях наблюдалось обострение ревматоидного артрита.
У некоторых больных отмечено образование инфильтратов в лёгких, приводивших к развитию лёгочной недостаточности или респираторного дистресс-синдрома взрослых, который может закончиться смертью.
Описаны редкие случаи возникновения симптомов, указывающих на реакции аллергического типа, при этом около половины их были связаны с введением первой дозы. Таких реакций было больше после внутривенного применения препарата. Иногда возобновление лечения сопровождалось рецидивом симптомов.
У больных с ТХН
Наиболее частой побочной реакцией, приписываемой филграстиму, является боль в костях, иногда вместе с мышечной болью.
Другие побочные явления включают увеличение селезенки, которое у небольшого числа больных может прогрессировать, а также тромбоцитопению.
Описаны головные боли и диарея вскоре после начала лечения филграстимом менее чем у 10 % больных, примерно с такой же частотой отмечены анемия и носовые кровотечения после длительного лечения.
Наблюдалось преходящее и клинически бессимптомное увеличение сывороточных концентраций мочевой кислоты, лактатдегидрогеназы и щелочной фосфатазы, а также преходящее умеренное снижение концентрации глюкозы в крови после еды.
Побочные явления, связанные с лечением филграстимом и отмечавшиеся менее чем у 2 % больных с ТХН, включали реакции в месте инъекции, головную боль, увеличение печени, боль в суставах, алопецию, остеопороз и кожную сыпь. При длительной терапии у 2 % больных с ТХН наблюдался кожный васкулит, а в очень редких случаях — протеинурия и/или гематурия.
Частота вышеупомянутых симптомов у некоторых больных с ТХН со временем снижалась.
У ВИЧ-инфицированных
Клиническими исследованиями установлено, что наиболее часто возникающей нежелательной реакцией, которую можно отнести на счёт филграстима, является боль в костях и мышцах, как правило, слабая или умеренная. Частота симптомов примерно такая же, как у онкологических больных.
Менее чем у 3 % пациентов, получающих лечение филграстимом, отмечается небольшое или среднее увеличение селезёнки с благоприятным клиническим течением; гиперспленизма, как и спленэктомии, не было ни у одного из больных. Так как при ВИЧ-инфекции и СПИД обычно селезенка бывает увеличена, связь этого явления с приёмом филграстима остаётся невыясненной.
У здоровых доноров при мобилизации периферических стволовых клеток крови (ПСКК)
У здоровых доноров ПСКК нежелательные реакции на филграстим чаще всего проявлялись слабой или умеренно выраженной болью в костях и мышцах. У 41 % доноров наблюдался лейкоцитоз (более 50 × 109/л), а у 35 % — после введения филграстима и проведения лейкафереза обнаруживалась преходящая тромбоцитопения (количество тромбоцитов менее 100 × 109/л).
У отдельных здоровых доноров наблюдалось клинически бессимптомное увеличение концентраций щелочной фосфатазы, лактатдегидрогеназы, аспартатаминотрансферазы и мочевой кислоты.
В редких случаях проявлялись симптомы обострения артрита, очень редко — тяжёлые аллергические реакции.
Головная боль, отмечаемая донорами ПСКК, как полагают, связана с приёмом филграстима.
В единичных случаях у здоровых доноров ПСКК, получавших гранулоцитарный колониестимулирующий фактор, происходил разрыв селезёнки.
Передозировка
Действие Грасальвы при передозировке не установлено. После отмены препарата число циркулирующих нейтрофилов обычно сначала снижается и затем возвращается к норме.
Взаимодействие с другими лекарственными средствами
Безопасность и эффективность введения филграстима в тот же день, что и миелосупрессивных противоопухолевых препаратов не установлены. Ввиду чувствительности быстро делящихся миелоидных клеток к цитотоксическим химиотерапевтическим препаратам, не рекомендуется вводить филграстим в течение 24 ч до их применения или ранее чем через 24 ч после окончания введения этих препаратов.
Имеются отдельные сообщения об усилении тяжести нейтропении при одновременном назначении филграстима и 5-фторурацила.
Данные о возможном взаимодействии с другими гемопоэтическими факторами роста и цитокинами отсутствуют.
Литий, стимулирующий выход нейтрофилов, может усиливать действие филграстима. Это взаимодействие не исследовано, но сведений о его нежелательных последствиях нет.
Грасальва фармацевтически не совместима с 0,9 % раствором натрия хлорида.
Особые указания
Лечение Грасальвой должно проводиться только в сотрудничестве с онкологическим центром, располагающим специалистами с опытом лечения филграстимом больных с гематологическими заболеваниями и при наличии необходимых диагностических возможностей.
Процедуры мобилизации и афереза клеток должны проводиться в сотрудничестве с онкологическим или гематологическим центром, располагающим специалистами с достаточным опытом работы в этой области и возможностями адекватного мониторинга клеток-предшественников гемопоэза.
Рост злокачественных клеток
Филграстим может вызывать рост миелоидных клеток in vitro. Аналогичные эффекты могут наблюдаться in vitro и на некоторых немиелоидных клетках.
Безопасность и эффективность применения филграстима у больных с миелодиспластическим синдромом и хроническим миелолейкозом не установлены, поэтому при этих заболеваниях Грасальву назначать нельзя. Особое внимание должно быть обращено на дифференциальный диагноз между бластным кризом хронического миелолейкоза и острым миелолейкозом.
Безопасность и эффективность применения филграстима у больных с вторичным острым миелолейкозом исследованы недостаточно, поэтому назначать им Грасальву следует с осторожностью.
Не установлены безопасность и эффективность применения филграстима при de novo остром миелолейкозе у больных моложе 55 лет в случаях прогностически благоприятных цитогенетических факторов (t(8;21), t(15;17) и inv(16)).
Прочие меры предосторожности
Больным с сопутствующими костной патологией и остеопорозом, получающим непрерывное лечение Грасальвой в течение более 6 мес, показан контроль плотности костного вещества.
У больных с нарушениями функции почек или печени коррекция дозы не требуется.
При лечении филграстимом возможно развитие респираторного дистресс-синдрома взрослых (РДСВ), первыми признаками которого могут быть кашель, лихорадка и одышка, также возможны образование в лёгких инфильтратов, выявляемых рентгенологически, и расстройство функции дыхания. В этом случае следует отменить Грасальву и назначить необходимое лечение.
Особые предосторожности у больных раком
Лейкоцитоз
У больных, получающих химиотерапию цитотоксическими средствами
Учитывая возможный риск, связанный с высоким лейкоцитозом, во время лечения Грасальвой нужно регулярно контролировать количество лейкоцитов. В первые 2–3 дня лечения рекомендуется ежедневно определять число нейтрофилов, затем на протяжении двух первых недель терапии — не реже двух раз в неделю, и во время поддерживающего лечения — по крайней мере один раз в неделю или через неделю. Если число лейкоцитов после прохождения ожидаемого минимума превысит 50 × 109/л, лечение Грасальвой следует немедленно отменить. Однако, если филграстим применяется для мобилизации ПСКК, препарат отменяют или снижают дозу при превышении количества лейкоцитов 70 × 109/л.
Риск, связанный с высокодозной химиотерапией
Особую осторожность следует проявлять при лечении больных, получающих высокодозную химиотерапию, поскольку в этих случаях улучшения исхода злокачественного новообразования не установлено, в то время как повышенные дозы химиопрепаратов обладали более выраженной токсичностью, приводя к развитию сердечных, лёгочных, неврологических и дерматологических реакций.
Монотерапия филграстимом не предотвращает тромбоцитопению и анемию, обусловленные миелосупрессивной химиотерапией. Из-за возможности применения более высоких доз химиопрепаратов (например, полные дозы в соответствии со схемами) больной может подвергаться большему риску развития тромбоцитопении и анемии, поэтому рекомендуется регулярно определять количество тромбоцитов и гематокрит.
Особую осторожность следует проявлять при применении однокомпонентных или комбинированных химиотерапевтических схем, известных своей способностью вызывать тяжёлую тромбоцитопению.
Применение ПСКК, мобилизованных с помощью филграстима, уменьшает выраженность и продолжительность тромбоцитопении после миелосупрессивной или миелоаблативной химиотерапии.
Другие предосторожности
Действие филграстима у больных со значительно пониженным количеством миелоидных клеток-предшественников не изучалось. Препарат увеличивает число нейтрофилов путём воздействия, прежде всего, на клетки-предшественники нейтрофилов. Поэтому у больных с пониженным содержанием клеток-предшественников (например, подвергшихся интенсивной лучевой терапии или химиотерапии, а также при опухолевой инфильтрации костного мозга) степень увеличения количества нейтрофилов может быть снижена.
Наследственная непереносимость фруктозы. Содержащийся в препарате сорбитол в количестве 50 мг/мл не должен оказывать отрицательного влияния на больных с наследственной непереносимостью фруктозы. Однако применять Грасальву у таких пациентов следует с осторожностью.
Особые предосторожности у больных, проходящих мобилизацию периферических j стволовых клеток крови (ПСКК)
Мобилизация
Проспективных рандомизированных исследований по сравнению двух рекомендуемых методов мобилизации (только филграстим или в комбинации с миелосупрессивной химиотерапией) на одном и том же контингенте больных не проводилось. Индивидуальные особенности больных в различных исследованиях и степень расхождения результатов лабораторного определения числа СD34+-клеток затрудняют непосредственное сравнение результатов этих исследований. Поэтому оптимальный метод рекомендовать трудно. Выбор метода мобилизации следует проводить в зависимости от целей лечения данного больного.
До назначения цитотоксических средств
У больных, которым в прошлом проводилась активная миелосупрессивная терапия, может не происходить достаточной активации ПСКК до рекомендуемого минимального уровня (≥ 2,0 × 106СD34+-клеток/кг) или ускорения нормализации числа тромбоцитов.
Некоторые цитостатики обладают особой токсичностью по отношению к клеткам- предшественникам гемопоэза и могут отрицательно влиять на их мобилизацию. Такие средства, как мелфалан, кармустин (BCNU) и карбоплатин, если они назначались в течение длительного времени до попыток мобилизации стволовых клеток, могут снижать её эффективность. Однако применение мелфалана, карбоплатина или кармустина совместно с филграстимом оказалось эффективным при активации стволовых клеток. Если планируется трансплантация ПСКК, рекомендуется запланировать мобилизацию стволовых клеток на ранней стадии курса лечения. Особое внимание следует обратить на число стволовых клеток, активированных у таких больных до высокодозной химиотерапии. Если результаты мобилизации в соответствии с вышеприведёнными критериями недостаточны, следует рассмотреть альтернативные виды лечения, не требующие использования клеток-предшественников.
Оценка количества мобилизованных периферических стволовых клеток крови
Оценивая число ПСКК, мобилизованных у больных с помощью филграстима, следует уделить особое внимание методу количественного определения. Результаты проточного цитометрического анализа числа СD34+-клеток различаются в зависимости от конкретной методики, поэтому нужно с осторожностью относиться к рекомендациям по их числу, основанным на исследованиях, проведённых в других лабораториях.
Скорость нормализации количества тромбоцитов после высокодозной химиотерапии зависит от числа введенных в реинфузию СD34+-клеток. Рекомендованное минимальное количество ПСКК составляет ≥2,0 × 106 СD34+-клеток/кг. Количество клеток-предшественников, превосходящее это значение, по-видимому, сопровождается более быстрой нормализацией, тогда как количество менее указанного — более медленной нормализацией состава крови.
Особые предосторожности у здоровых доноров, проходящих мобилизацию ПСКК
Мобилизация ПСКК у доноров не безразлична для их здоровья и применяется только перед трансплантацией аллогенных клеток-предшественников.
Мобилизация ПСКК может проводиться у доноров только в случае соответствия обычным клиническим и лабораторным критериям донорства клеток-предшественников гемопоэза, в особенности следует обращать внимание на гематологические показатели и наличие инфекционных болезней.
Безопасность и эффективность применения филграстима у здоровых доноров в возрасте моложе 16 лет и старше 60 лет не оценивались.
Грасальву не рекомендуется принимать беременным и кормящим женщинам.
При необходимости проведения более чем одного лейкафереза особое внимание должно быть обращено на доноров, у которых число тромбоцитов до лейкафереза составляет менее 100 × 109/л. Проведение лейкафереза не рекомендуется, если количество тромбоцитов менее 75 × 109/л, при назначении антикоагулянтов или известных нарушениях гемостаза.
Грасальва должна быть отменена или доза препарата снижена, если количество лейкоцитов более 70 × 109/л.
Период наблюдения за донором должен быть длительным для оценки безопасности лекарственного средства. Доноры, принимавшие филграстим для мобилизации ПСКК, должны находиться под наблюдением до нормализации гематологических показателей.
Кроме того, не исключён риск стимулирования злокачественного миелоидного клона. Центрам афереза рекомендуется регистрировать и проводить наблюдение за донорами ПСКК для обеспечения дальнейшего сбора данных по безопасности применения препарата.
После применения филграстима у здоровых доноров возможен разрыв селезёнки. В связи с этим у них рекомендуется контролировать размеры селезёнки (пальпация, УЗИ). Следует иметь в виду возможность разрыва селезёнки при жалобах на боль в верхней левой части живота или в левом плече.
Особые предосторожности у реципиентов аллогенных ПСКК, мобилизованных филграстимом
Литературные данные свидетельствуют о том, что иммунологическое взаимодействие аллогенных ПСКК и реципиента характеризуется большей степенью риска развития острой реакции трансплантата против хозяина в сравнении с пересадкой костного мозга.
Особые предосторожности у пациентов с ТХН
Исследование состава крови
Необходимо тщательно контролировать количество тромбоцитов, особенно в течение первых нескольких недель лечения филграстимом. Если у больного проявляется тромбоцитопения (число тромбоцитов стабильно ниже 100 × 109/л), следует рассмотреть вопрос о временной отмене препарата или уменьшения дозы. Могут наблюдаться и другие изменения формулы крови, требующие её тщательного контроля, в том числе анемия и преходящее увеличение количества миелоидных клеток-предшественников.
Трансформация в лейкоз или миелодиспластический синдром
Особую осторожность следует проявлять в случае диагностики тяжёлых хронических нейтропений, необходимо дифференцировать их от других гематологических заболеваний, таких как апластическая анемия, миелодисплазия и миелолейкоз. До начала лечения следует провести полный клинический анализ крови с определением лейкоцитарной формулы и количества тромбоцитов, а также исследовать морфологическую картину костного мозга и кариотип.
Если у больных с ТХН появляются цитогенетические нарушения, необходимо тщательно оценить преимущества и риск продолжения терапии. При развитии миелодиспластического синдрома (МДС) или лейкоза Грасальву следует отменить. В настоящее время не ясно, предрасполагает ли длительное лечение филграстимом больных с тяжёлой хронической нейтропенией к развитию цитогенетических аномалий, МДС и лейкоза. Таким больным рекомендуется регулярно (приблизительно каждые 12 мес) проводить морфологические и цитогенетические исследования костного мозга.
Прочие случаи
Следует исключить такие причины преходящей нейтропении, как вирусные инфекции. Увеличение селезёнки является прямым следствием лечения филграстимом, уменьшение дозы замедляет или останавливает увеличение размера селезенки. Размеры селезёнки необходимо контролировать регулярно, для обнаружения аномального увеличения объёма селезёнки достаточно произвести пальпацию живота.
У небольшого числа больных выявлялись гематурия и/или протеинурия, для контроля за ними следует регулярно проводить лабораторное исследование мочи.
Безопасность и эффективность применения препарата у новорождённых и больных с аутоиммунной нейтропенией не установлены.
Особые предосторожности при ВИЧ-инфекции
Исследование клеток крови
Нужно тщательно контролировать количество нейтрофилов, особенно в течение первых нескольких недель лечения филграстимом. У некоторых пациентов уже после первой инъекции очень быстро проявляется лечебный эффект и количество нейтрофилов значительно увеличивается. Рекомендуется проводить контроль числа нейтрофилов в первые 2–3 дня лечения филграстимом ежедневно, затем в первые две недели лечения — не реже двух раз в неделю, и во время поддерживающего лечения — по крайней мере один раз в неделю или в 2 недели.
Если доза 30 млн. МЕ (300 мкг) в сутки вводится пациенту не ежедневно, через некоторое время начинают наблюдаться сильные колебания числа нейтрофилов. Для определения уменьшения количества нейтрофилов или истинного минимального их уровня (надир) рекомендуется брать для анализа образцы крови пациента непосредственного перед введением очередной дозы препарата.
Риск в связи с высокодозной миелосупрессивной терапией
Монотерапия филграстимом не предотвращает тромбоцитопению и анемию, обусловленные миелосупрессивной химиотерапией. Из-за возможности применения совместно с филграстимом большего количества химиопрепаратов или их высоких доз, больной может подвергаться большему риску развития тромбоцитопении и анемии, в связи с чем рекомендуется регулярно определять число клеток крови (см. выше).
Инфекции и злокачественные новообразования, вызывающие миелосупрессию
У больных с нейтропенией, вызванной инфильтрацией костного мозга инфекционными возбудителями (напр., при диссеминированной инфекции бактериями группы Mycobacterium avium) или опухолевым поражением костного мозга (лимфома), помимо назначения филграстима должно быть применено специфическое лечение. Воздействие филграстима на нейтропению, вызванную инфекционными возбудителями или злокачественными опухолями костного мозга, исследовано недостаточно.
Особые предосторожности у больных серповидно-клеточной анемией
В литературе опубликованы данные о том, что большое число лейкоцитов в случае серповидно-клеточной анемии является прогностически неблагоприятным фактором. Поэтому больным серповидно-клеточной анемией филграстимВлияние на способность управлять транспортными средствами, механизмами
Влияние на способность к вождению транспортных средств или работу с механизмами не установлено.
Форма выпуска
Раствор для внутривенного и подкожного введения, 48 млн. МЕ/0,8 мл.
Грасальва 48 млн. МЕ/0,8 мл:
по 0,8 мл (48 млн. МЕ, что соответствует 480 мкг филграстима) в стеклянном шприце одноразового использования (стекло I типа по Евр. Ф. 3.2.1), градуированном до 1 мл (деления шкалы 0,1 мл), с фиксированной инъекционной иглой, покрытой защитным колпачком, с уплотнением поршня в цилиндре шприца из эластомера I типа (по Евр. Ф. 3.2.9). Шприц помещен в контурную ячейковую упаковку из ПВХ. Один шприц с препаратом в контурной ячейковой упаковке из ПВХ вместе с инструкцией по применению помещают в картонную пачку.Хранение
При температуре от 2 °C до 8 °C в защищённом от света месте.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не использовать после истечения срока годности, указанного на упаковке.Условия отпуска из аптек
Отпускают по рецепту
Производитель
Lemery, S.A. de C.V., Мексика
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Грасальва:
