Лизегора
, имплантатРегистрационный номер
Торговое наименование
Лизегора
Международное непатентованное наименование
Лекарственная форма
имплантат
Состав
1 имплантат содержит:
Действующее вещество: гозерелина ацетат — 12,5 мг (эквивалентно 10,8 мг гозерелина).
Вспомогательные вещества: Резомер® R202H Поли-D,L-лактид — 22,0 мг, Резомер® RG752H Поли-(B,b-лактид-ко-гликолид) 75:25 — 9,4 мг.
Описание
Белые или почти белые цилиндрические стержни твёрдого полимерного материала.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Гозерелин является синтетическим аналогом природного гонадотропин-рилизинг-гормона (ГнРГ). При постоянном применении гозерелин ингибирует выделение гипофизом лютеинизирующего гормона (ЛГ), что ведёт к снижению концентрации в плазме крови тестостерона (у мужчин) и эстрадиола (у женщин). Данное действие обратимо после прекращения терапии. В начале терапии гозерелином, как и другими агонистами ГнРГ, может наблюдаться временное увеличение концентрации в плазме крови тестостерона (у мужчин) и эстрадиола (у женщин), у некоторых женщин могут отмечаться кровотечения из влагалища различной длительности и интенсивности.
У мужчин примерно к 21 дню после введения первого имплантата концентрация тестостерона снижается до кастрационных уровней и продолжает оставаться сниженной при постоянном введении гозерелина в дозе 10,8 мг каждые 3 месяца. Такое снижение концентрации тестостерона на фоне терапии гозерелином у большинства пациентов приводит к регрессии опухоли предстательной железы и улучшению клинической симптоматики.
В сравнительных клинических исследованиях было показано, что применение гозерелина у пациентов с метастатическим раком предстательной железы обеспечивает такую же выживаемость, как и хирургическая кастрация.
В объединённом анализе двух рандомизированных контролируемых исследований, в которых сравнивали монотерапию бикалутамидом в дозе 150 мг с кастрацией (преимущественно с помощью гозерелина), не выявлено статистически значимых различий в общей выживаемости между пациентами, получавшими бикалутамид, и пациентов с медицинской кастрацией (отношение рисков = 1,05 [ДИ 0,81–1,36]) при местно-распространённом раке предстательной железы. Однако невозможно сделать статистические выводы об эквивалентности двух видов лечения.
В сравнительных исследованиях было показано, что при применении в качестве адъювантной терапии в дополнение к лучевой терапии у пациентов в группе высокого риска с локализованным раком предстательной железы (Т1-Т2 и ПСА не менее 10 нг/мл, или индекс Глисона не менее 7) или местно-распространённым (ТЗ-Т4) раком предстательной железы гозерелин улучшает выживаемость без симптомов заболевания и общую выживаемость. Оптимальная продолжительность адъювантной терапии не установлена. В сравнительном исследовании было показано, что адъювантная терапия гозерелином в течение 3 лет сопровождалась статистически значимым увеличением выживаемости по сравнению с одной лучевой терапией. Показано, что неоадъювантная терапия гозерелином перед лучевой терапией улучшает выживаемость без симптомов заболевания у пациентов с локализованным или местно-распространённым раком предстательной железы высокого риска.
После простатэктомии у пациентов с выявленным распространением опухоли за пределы предстательной железы адъювант гозерелин может увеличивать длительность периодов выживаемости без симптомов заболевания, однако статистически значимое улучшение выживаемости обнаружено только у пациентов с признаками поражения лимфоузлов на момент хирургического лечения. У пациентов с установленными морфологически стадиями заболевания для принятия решения о назначении адъювантной терапии гозерелином должны иметься дополнительные факторы риска, например, уровень ПСА не менее 10 нг/мл или индекс Глисона не менее 7 баллов. Доказательства улучшения клинических исходов при применении неоадъювантной терапии гозерелином перед радикальной простатэктомией отсутствуют.
После введения гозерелина 10,8 мг концентрация эстрадиола в сыворотке у женщин снижается в течение 4 недель после введения первого имплантата и остаётся сниженной до уровня сравнимого с тем, что наблюдается у женщин в менопаузе. При начальном применении других аналогов ГнРГ и переходе на гозерелин 10,8 мг, снижение концентрации эстрадиола в плазме крови сохраняется. Снижение концентрации эстрадиола оказывает терапевтический эффект при эндометриозе и фибромиомах матки. На фоне терапии агонистами ГнРГ у женщин возможно наступление менопаузы.
В редких случаях у некоторых женщин не происходит восстановления менструаций после окончания терапии.
Фармакокинетика
Всасывание и распределение
Биодоступность гозерелина практически полная (около 100 %). Введение имплантата гозерелина в дозе 10,8 мг каждые 12 недель обеспечивает поддержание эффективных концентраций без какой-либо кумуляции в тканях. Гозерелин плохо связывается с белками плазмы.
Метаболизм и выведение
Период полувыведения (T½) гозерелина из плазмы крови составляет 2–4 часа у пациентов с нормальной функцией почек.
Фармакокинетика у особых групп пациентов
Дети и подростки до 18 лет
Фармакокинетика гозерелина в данной возрастной популяции не изучалась.
У пациентов с нарушением функции почек
У пациентов с почечной недостаточностью T½ увеличивается. При рекомендуемом режиме дозирования имплантата гозерелина в дозировке 10,8 мг (1 раз в 3 месяца) это изменение будет иметь минимальное значение, коррекции дозы для данной популяции пациентов не требуется.
У пациентов с нарушением функции печени
У пациентов с печёночной недостаточностью значительных изменений фармакокинетики не наблюдалось.
Показания
- Рак предстательной железы
- эндометриоз
- фибромиома матки (в сочетании с терапией препаратами железа с целью улучшения гематологических показателей и состояния пациенток с фибромиомой и анемией перед оперативным вмешательством).
Противопоказания
- Гиперчувствительность к гозерелину или другим агонистам ГнРГ, и/или к любому вспомогательному веществу в составе препарата;
- беременность;
- период грудного вскармливания;
- возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности в данной возрастной популяции).
С осторожностью
У пациентов мужского пола с высоким риском возникновения обструкции мочевыводящих путей или компрессии спинного мозга.
Совместное применение с лекарственными средствами, способными удлинять интервал QT или вызывать желудочковую тахисистолическую аритмию типа «пируэт».
При введении препарата, особенно пациентам с низким индексом массы тела и/или получающим антикоагулянты в полной дозе.
Применение при беременности и в период грудного вскармливания
Беременность
Применение гозерелина во время беременности противопоказано, так как введение агонистов ГнРГ теоретически связано с риском прерывания беременности или аномалий развития плода.
Клинических данных, подтверждающих причинно-следственную связь терапии гозерелином и последующих аномалий развития ооцитов, патологии беременности или её исхода нет.
Период грудного вскармливания
Применение гозерелина в период грудного вскармливания противопоказано. Пациенткам, получающим терапию гозерелином, следует отказаться от грудного вскармливания.
Способ применения и дозы
Препарат Лизегора вводится подкожно в дозе 10,8 мг 1 раз каждые 12 недель.
У мужчин
Для терапии рака предстательной железы препарат Лизегора вводится длительно.
У женщин
При эндометриозе длительность терапии не более 6 месяцев (нет клинических данных по безопасности более длительного периода терапии гозерелином). Проведение повторных курсов терапии не рекомендуется в виду риска потери минеральной плотности костной ткани. Добавление заместительной гормональной терапии комбинированными препаратами (эстроген+гестаген) у пациенток, получающих терапию гозерелином, снижает потерю костной ткани и уменьшает клинические проявления вазомоторных симптомов.
При фибромиоме матки длительность терапии до 3-х месяцев перед оперативным вмешательством (в сочетании с антианемической терапией препаратами железа).
Применение препарата в особых клинических группах пациентов
Дети и подростки до 18 лет
Применение препарата Лизегора у детей и подростков в возрасте до 18 лет противопоказано (в связи с отсутствием клинических данных по эффективности и безопасности гозерелина в данной возрастной популяции).
У пожилых пациентов
Коррекции дозы гозерелина у пожилых пациентов не требуется.
У пациентов с нарушением функции почек
Несмотря на увеличение периода полувыведения у пациентов с почечной недостаточностью коррекции дозы препарата Лизегора не требуется.
У пациентов с нарушением функции печени
У пациентов с печёночной недостаточностью коррекции дозы препарата Лизегора не требуется.
Способ применения
Препарат Лизегора вводится подкожно, в области передней брюшной стенки.
Рисунок 1
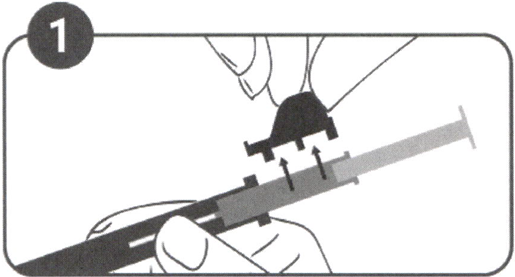
Проведите осмотр пакета-саше на наличие повреждений. Извлеките шприц-аппликатор из стерильной упаковки.
Проверьте, в правильном ли положении находится имплантат в шприце-аппликаторе.
Снимите защитный механизм.
Рисунок 2
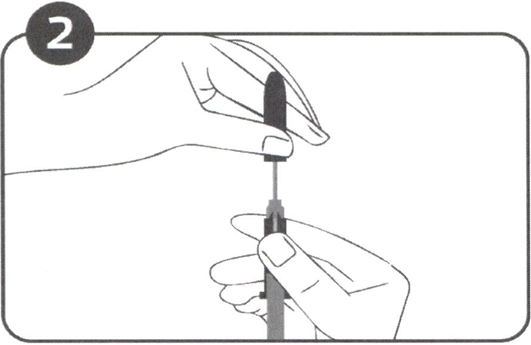
Удерживая шприц-аппликатор одной рукой, другой рукой аккуратно снимите с иглы защитный колпачок (Рисунок 2), не касаясь иглы колпачком, чтобы избежать искривления иглы.
В отличие от инъекций растворов, в данном случае не требуется удалять воздушные пузыри, поскольку при попытке это сделать может произойти смещение имплантата.
Рисунок 3
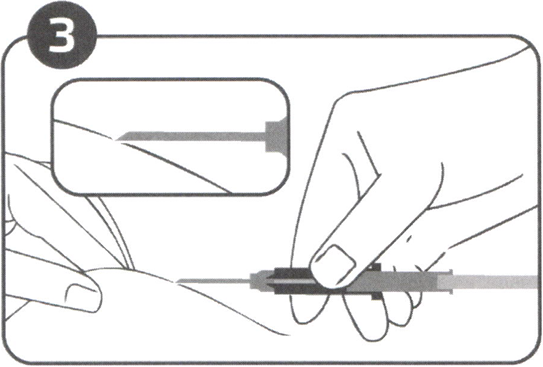
Введите иглу в подкожную ткань (не в мышцы или брюшную полость) передней брюшной стенки выше линии пупка. Захватите кожу пациента и удерживая цилиндр шприца-аппликатора, введите иглу под углом 30–45 градусов (почти параллельно коже), располагая иглу срезом вверх (Рисунок 3).
Иглу вводите до тех пор, пока цилиндр шприца-аппликатора не опрётся в кожу пациента.
Данный контакт с кожей должен сохраняться на протяжении всего процесса введения имплантата!
Рисунок 4
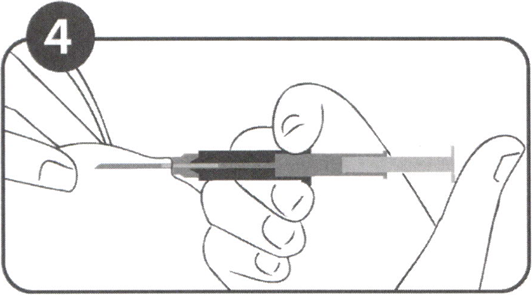
Нажмите на поршень шприца-аппликатора. Имплантат переместится в кончик иглы (Рисунок 4). Ни в коем случае не вытягивайте шприц-аппликатор. В процессе введения цилиндр шприца-аппликатора должен касаться кожи пациента!
Рисунок 5
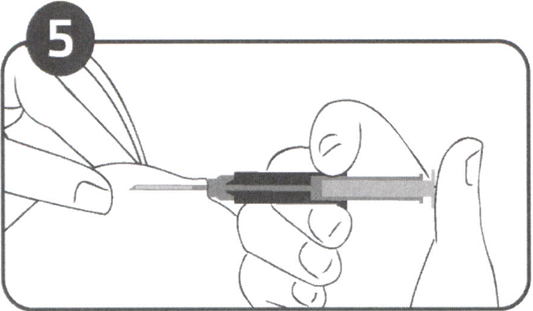
После того, как поршень упрётся, процесс извлечения иглы разблокируется автоматически (Рисунок 5).
Рисунок 6
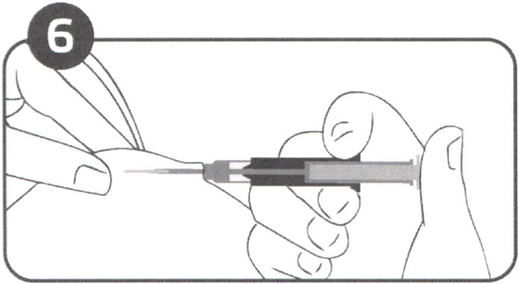
Игла втянется из кожи в цилиндр шприца-аппликатора (Рисунок 6). Цилиндр шприца- аппликатора должен оставаться в контакте с кожей пациента. В норме, перемещение поршня и втягивание иглы происходят одним плавным движением.
Рисунок 7
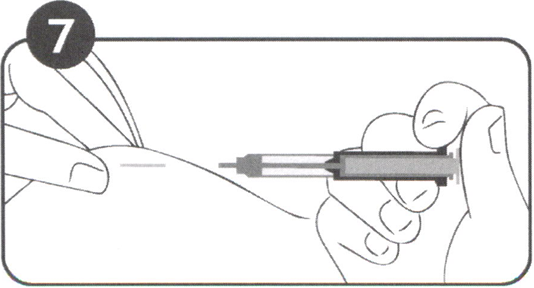
Процедура введения имплантата завершена. Игла полностью втянулась в цилиндр шприца-аппликатора (Рисунок 7). Выступающий мандрен предохраняет кончик иглы от повреждения.
Рисунок 8
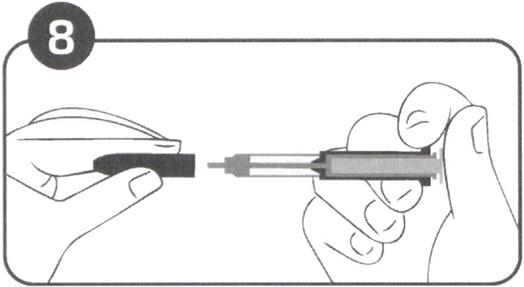
Снова наденьте защитный колпачок (Рисунок 8).
Утилизируйте использованный шприц-аппликатор разрешенным для острых предметов способом (см. раздел «Особые указания»).
Следует соблюдать осторожность при введении гозерелина в переднюю брюшную стенку в связи с близким расположением нижней надчревной артерии и ее ветвей.
С особой осторожностью следует вводить гозерелин пациентам с низким индексом массы тела и/или получающим антикоагулянты в полной дозе (см. раздел «Особые указания»). Следует соблюдать осторожность при подкожном введении препарата. Не вводить в кровеносный сосуд, мышцу или брюшину.
В случае необходимости хирургического удаления имплантата гозерелина, его местонахождение может быть определено с помощью УЗИ.
Подробная инструкция по введению лекарственного препарата Лизегора 10,8 мг также приведена на внутренней стороне картонной пачки (потребительской упаковки).
Побочное действие
Возможные на фоне терапии гозерелином нежелательные реакции распределены по системно-органным классам с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко, включая отдельные сообщения (<1/10000), частота неизвестна (невозможно оценить на основании имеющихся данных).
Доброкачественные, злокачественные и неуточнённые новообразования (включая кисты и полипы): очень редко: опухоль гипофиза; частота неизвестна: дегенерация фиброматозных узлов у женщин с фибромой матки;
Нарушения со стороны иммунной системы: нечасто: реакции гиперчувствительности; редко: анафилактические реакции;
Нарушения со стороны эндокринной системы: очень редко: кровоизлияние в гипофиз;
Нарушения со стороны обмена веществ и питания: часто: нарушение толерантности к глюкозе (у мужчин). У мужчин, получавших агонисты ГнРГ, наблюдалось снижение толерантности к глюкозе. Снижение толерантности к глюкозе проявлялось развитием сахарного диабета или ухудшением гликемического контроля (концентрации глюкозы в крови) у пациентов с сахарным диабетом в анамнезе; нечасто: гиперкальциемия (у женщин);
Нарушения со стороны нервной системы: часто: парестезия, компрессия спинного мозга (у мужчин), головная боль (у женщин);
Нарушения психики: очень часто: снижение либидо, связанное с фармакологическим действием препарата, в редких случаях, приводившее к прекращению терапии гозерелином; часто: изменение настроения, депрессия; очень редко: психотическое расстройство;
Нарушения со стороны сердца: часто: инфаркт миокарда (у мужчин), риск которого повышается при одновременном назначении антиандрогенных препаратов (наблюдался в фармако-эпидемиологическом исследовании агонистов ГнРГ, применявшихся для лечения рака предстательной железы); сердечная недостаточность (у мужчин), риск которой повышается при одновременном назначении антиандрогенных препаратов (наблюдалась в фармако-эпидемиологическом исследовании агонистов ГнРГ, применявшихся для лечения рака предстательной железы). Эти изменения обычно транзиторные, и разрешаются либо в процессе терапии гозерелином, либо после её прекращения. В редких случаях эти изменения требовали медицинского вмешательства, включая отмену гозерелина; частота неизвестна: удлинение интервала QT (см. разделы «Взаимодействие с другими лекарственными средствами» и «Особые указания»);
Нарушения со стороны сосудов: очень часто: «приливы», связанные с фармакологическим действием препарата, в редких случаях, приводившие к отмене терапии гозерелином (могут сохраняться после прекращения введения гозерелина); часто: изменения уровня артериального давления (АД), повышение АД или снижение АД; эти изменения обычно носят транзиторный характер и разрешаются либо в процессе терапии гозерелином, либо после её прекращения (в редких случаях требовалась медицинская коррекция АД или прекращение лечения);
Нарушения со стороны кожи и подкожных тканей: очень часто: повышенное потоотделение, связанное с фармакологическим действием препарата и, в редких случаях, приводившее к его отмене, может сохраняться после прекращения введения гозерелина; акне (у женщин), в большинстве случаев возникает в течение 1 месяца после начала терапии гозерелином; часто: алопеция (у женщин), как правило, незначительно выраженная, но иногда может быть значительная (в том числе у молодых пациенток с доброкачественными новообразованиями), сыпь, в основном, незначительно выраженная, которая часто разрешалась на фоне продолжения терапии; частота неизвестна: алопеция (у мужчин), которая проявлялась как выпадение волос по всему телу вследствие снижения концентрации андрогенов в плазме крови;
Нарушения со стороны скелетно-мышечной и соединительной ткани: часто: артралгия (у женщин), боль в костях (у мужчин). В начале лечения пациенты с раком предстательной железы часто могут испытывать временное усиление боли в костях (симптоматическое лечение); нечасто: артралгия (у мужчин);
Нарушения со стороны почек и мочевыводящих путей: нечасто: обструкция мочеточников (у мужчин);
Нарушения со стороны половых органов и молочной/грудной железы: очень часто: эректильная дисфункция (у мужчин), сухость слизистой оболочки влагалища и увеличение размера молочных желез (у женщин); часто — гинекомастия (у мужчин); нечасто — болезненность грудных желёз (у мужчин), редко — киста яичника (у женщин), синдром гиперстимуляции яичников (у женщин, при совместном применении с гонадотропинами); частота неизвестна: вагинальное кровотечение (у женщин);
Общие расстройства и нарушения в месте введения: очень часто: реакция в месте введения препарата (у женщин); часто: реакция в месте введения препарата (у мужчин);
Лабораторные и инструментальные данные: часто: снижение минеральной плотности костной ткани, увеличение массы тела;
Пострегистрационный период наблюдения
В процессе применения гозерелина отмечены единичные случаи изменений показателей анализа крови, нарушения функции печени, тромбоэмболии лёгочной артерии и интерстициальной пневмонии.
Кроме того, у женщин, получавших лечение по поводу эндометриоза и фибромиомы матки, сообщалось о следующих нежелательных реакциях: акне, изменение роста волос на теле, сухость кожи, увеличение массы тела, увеличение концентрации холестерина в плазме крови, синдром гиперстимуляции яичников (при применении в комбинации с гонадотропинами), вагинит, влагалищные выделения, нервозность, нарушение сна, усталость, периферические отёки, миалгии, судороги в икроножных мышцах, тошнота, рвота, диарея, запор, ощущение дискомфорта в животе, изменения тембра голоса.
В редких случаях у некоторых женщин возможно развитие менопаузы во время лечения аналогами ГнРГ и отсутствие возобновления менструаций после прекращения терапии. Неизвестно, является ли это следствием терапии гозерелином или отражением гинекологического статуса пациенток.
Если любые из указанных в инструкции побочных действий усугубляются, или Вы заметили любые нежелательные реакции, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Случаи передозировки гозерелина у человека немногочисленны. В случае непреднамеренного введения гозерелина ранее запланированного времени или в более высокой дозе не отмечалось клинически значимых нежелательных реакций.
Лечение: проведение симптоматической терапии.
Взаимодействие с другими лекарственными средствами
Не известно.
Поскольку андрогенная депривация может удлинять интервал QT, необходимо соблюдать осторожность при совместном применении гозерелина с лекарственными средствами, способными удлинять интервал QT или вызывать желудочковую тахисистолическую аритмию типа «пируэт» (Torsade de Pointes), такими, как антиаритмические препараты IA класса (например, хинидин, дизопирамид) или III класса (например, амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, антипсихотические препараты (см. раздел «Особые указания»).
Особые указания
При применении гозерелина сообщалось о реакциях в месте введения препарата, включая боль, гематому, кровотечение и повреждение кровеносного сосуда. В этих случаях необходимо наблюдать пациента с целью выявления возможных признаков или симптомов внутрибрюшного кровотечения. В очень редких случаях ошибка при введении препарата приводила к повреждению кровеносного сосуда и геморрагическому шоку, требующих гемотрансфузии и оперативного вмешательства. С особой осторожностью следует вводить гозерелин пациентам с низким индексом массы тела и/или получающим антикоагулянты в полной дозе.
Следует с осторожностью применять гозерелин у пациентов мужского пола с высоким риском развития обструкции мочевыводящих путей или компрессии спинного мозга. У данных пациентов следует осуществлять тщательный мониторинг в течение первого месяца терапии. В случае наличия компрессии спинного мозга или нарушения функции почек, обусловленного обструкцией мочевыводящих путей, или развития этих осложнений следует проводить стандартную терапию данных состояний.
При применении гозерелина у женщин до восстановления менструаций должны применяться негормональные методы контрацепции.
Перед началом терапии гозерелином у женщин с сохранённым репродуктивным потенциалом следует исключить беременность.
Применение агонистов ГнРГ у женщин может вызывать снижение минеральной плотности костной ткани. После окончания лечения у большинства женщин происходит восстановление минеральной плотности костной ткани. У пациенток, получавших гозерелин 3,6 мг для лечения эндометриоза, добавление гормоно-заместительной терапии (эстрогенный и прогестагенный препараты ежедневно) снижало потерю минеральной плотности костей и вазомоторные симптомы. В настоящее время нет опыта применения гормонально-заместительной терапии на фоне терапии гозерелином в дозировке 10,8 мг. Возобновление менструаций после окончания лечения гозерелином у некоторых пациенток может происходить с задержкой. В редких случаях у некоторых женщин во время лечения аналогами ГнРГ может иметь место наступление менопаузы без восстановления менструаций после окончания терапии.
Применение гозерелина может приводить к увеличению цервикальной резистентности, необходимо соблюдать осторожность при дилатации шейки матки.
Нет данных об эффективности и безопасности терапии гозерелином доброкачественных гинекологических заболеваний продолжительностью более 6 месяцев.
Андрогенная депривация может сопровождаться увеличением интервала QT, хотя причинно-следственная связь с применением гозерелина не установлена. У пациентов с удлинением интервала QT в анамнезе или факторами риска его развития, а также у пациентов, принимающих сопутствующие препараты, способные удлинять интервал QT (см. раздел Взаимодействие с другими лекарственными средствами»), до начала применения гозерелина следует оценить соотношение ожидаемой пользы и потенциального риска, включая возможность развития желудочковой тахисистолической аритмии типа «пируэт».
По предварительным данным применение бисфосфоната в комбинации с агонистами ГнРГ у мужчин способствует уменьшению потери минеральной плотности костной ткани. В связи с возможностью развития снижения толерантности к глюкозе на фоне приёма агонистов ГнРГ у мужчин, рекомендуется периодически контролировать концентрацию глюкозы в крови.
Применение гозерелина может привести к положительным результатам антидопинговых тестов.
У пациентов, получающих терапию агонистами гонадолиберина, такими как гозерелин, существует повышенный риск возникновения депрессии (которая может быть тяжёлой). Пациенты должны быть проинформированы об этом, при появлении симптомов депрессии следует обратиться за медицинской помощью для получения соответствующего лечения.
Применять препарат Лизегора можно только в том случае, если пакет не повреждён. Препарат применяется немедленно после вскрытия. Пакет-саше содержит капсулу осушителя (силикагель), которую следует выбросить после вскрытия пакета. Не есть!
Утилизируйте использованный шприц-аппликатор разрешённым для острых предметов способом.
Влияние на способность управлять транспортными средствами, механизмами
Лекарственный препарат Лизегора не влияет или незначительно влияет на способность к управлению транспортными средствами и механизмами.
Форма выпуска
Имплантат, 10,8 мг.
Один имплантат по 10,8 мг в шприце-аппликаторе с защитным механизмом и капсулой осушителя помещают в пакет-саше из ПЭТФ-плёнки/А1/ПЭ-плёнки.
Один пакет-саше с инструкцией по применению упаковывают в картонную пачку. На внутренней стороне пачки приведено подробное описание с иллюстрациями способа введения лекарственного препарата Лизегора 10,8 мг.
Хранение
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
AMW GmbH Arzneimittelwerk Warngau, Германия
Владелец (держатель) регистрационного удостоверения препарата
Алвоген Фарма Трейдинг Юроп ЕООД, Болгария
Производитель
Все стадии производственного процесса:
АМВ ГмбХ Арцнаймиттельверк Варнгау, Германия
Биркерфельд 11, 83627 Варнгау, Германия
Организация, принимающая претензии от потребителей:
ООО «АЛВОГЕН ФАРМА»,
127055, г. Москва, ул. Новослободская, д. 31, строение 4, помещение VI.
Тел: (499) 940-01-77
Факс: (499) 940-01-55
www.alvogen.ru
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Лизегора:
