Протромплекс 600
Protromplex 600Регистрационный номер
Торговое наименование
Протромплекс 600
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для внутривенного введения
Состав
| Компонент | Количество во флаконе |
| Активные вещества: | |
| Фактор свёртывания крови II | 600 МЕ |
| 500 МЕ | |
| 600 МЕ | |
| 600 МЕ | |
| Протеин С | не менее 400 МЕ |
| в виде белка, содержащегося в плазме | 300–750 мг |
| Вспомогательные вещества: | |
| Натрия цитрата дигидрат | 80 мг |
| 160 мг | |
| не более 0,5 МЕ гепарина/ ME фактора IX | |
| от 15 до 30 МЕ | |
| Флакон с растворителем содержит: | |
| 20 мл | |
Активность факторов свёртывания крови II, VII, IX, X, протеина С, антитромбина III и гепарина определяли в соответствии с международными стандартами Всемирной Организации Здравоохранения (ВОЗ).
Описание
Лиофилизат представляет собой белый или белый с желтоватым оттенком порошок, или рыхлую твердую массу без посторонних включений.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Факторы свёртывания крови Ⅱ, Ⅶ, Ⅸ и Ⅹ вместе формируют протромбиновый комплекс. Синтез этих факторов зависит от витамина K и осуществляется в печени.
Фактор VII является зимогеном активного серин-протеазного фактора VIIa, посредством которого инициируется внешний путь свёртывания крови. Комплекс тканевой фактор-фактор VIIa активирует факторы свёртывания X и IX, в результате чего образуются факторы Ха и IХа. При дальнейшей активации каскада свёртывания происходит активация протромбина (фактора II) и его превращение в тромбин. Под действием тромбина фибриноген превращается в фибрин, что приводит к образованию сгустка. Тромбин необходим также для нормального функционирования тромбоцитов и их участия в первичном гемостазе.
Дефицит названных факторов свёртывания крови проявляется повышенной кровоточивостью, кровоизлияниями, а в тяжёлых случаях — кровотечениями различной локализации, в том числе ретроперитонеальными, церебральными, желудочно-кишечными. Приобретённый дефицит факторов свёртывания является следствием дефицита витамина K, который, в свою очередь, может развиться вследствие нарушений его синтеза или всасывания. В данном случае наблюдается дефицит всех четырёх факторов свёртывания, а также естественного антикоагулянта протеина С.
Врождённый дефицит имеет наследственную природу и обычно имеет изолированный характер, то есть проявляется дефицитом какого-либо одного фактора свёртывания.
Врождённая изолированная недостаточность фактора IX является одним из классических видов гемофилии (гемофилия В). Изолированная недостаточность фактора VII приводит к снижению образования тромбина и вызывает повышенную кровоточивость вследствие снижения образования фибрина и нарушения первичного гемостаза. Изолированная недостаточность фактора II или фактора X встречается очень редко; при тяжёлых формах сопровождается повышенной кровоточивостью, как в случаях классической гемофилии.
Применение препарата протромбинового комплекса человека обеспечивает повышение уровней витамин K-зависимых факторов свёртывания в плазме и временно устраняет коагуляционные нарушения у пациентов с приобретенным или врождённым дефицитом всех или одного фактора свёртывания крови.
Фармакокинетика
При внутривенном введении препарата происходит повышение уровней в плазме крови всех четырёх факторов свёртывания, зависящее от величины введённой дозы. В ходе последующего потребления концентрации факторов в плазме постепенно снижаются. Самый короткий период полувыведения имеет VII фактор — 3–5 ч. Период полувыведения IX фактора составляет 16-30 ч; II фактора — 40–60 ч и X фактора — 30–60 ч.
Показания
Лечение и профилактика кровотечений при оперативных вмешательствах у пациентов с приобретенным дефицитом факторов протромбинового комплекса, например, при дефиците, вызванном лечением антагонистами витамина K или их передозировкой, в случаях, когда требуется быстрая коррекция дефицита.
Лечение и профилактика кровотечений при оперативных вмешательствах у пациентов с врождённым дефицитом одного из витамин K-зависимых факторов свертывания, в тех случаях, когда недоступен монокомпонентный препарат дефицитного фактора свёртывания.
Противопоказания
Повышенная чувствительность к активным компонентам или к любому из вспомогательных веществ.
Аллергия на гепарин или гепарин-индуцированная тромбоцитопения в анамнезе.
С осторожностью
Из-за опасности тромбоэмболических осложнений препарат следует применять с осторожностью у пациентов, имеющих в анамнезе ишемическую болезнь сердца, инфаркт миокарда, заболевания печени, а также у пациентов в послеоперационном периоде, у новорождённых и у пациентов с высоким риском развития тромбоэмболических осложнений и синдрома диссеминированного внутрисосудистого свёртывания. В этих случаях необходимо соотносить ожидаемую пользу от применения препарата с риском развития осложнений.
Применение при беременности и в период грудного вскармливания
Безопасность применения препаратов протромбинового комплекса человека у беременных женщин и в период лактации не изучалась.
Исследования на животных не подходят для оценки безопасности в отношении беременности, эмбрионального/фетального развития, родовой деятельности и постнатального развития. Поэтому применение препарата Протромплекс 600 во время беременности и в период грудного вскармливания возможно только при наличии строгих показаний и если польза от ожидаемого эффекта превышает потенциальный риск для плода и ребёнка.
Способ применения и дозы
Дозы
Разовую дозу и частоту введения устанавливают индивидуально, с учётом исходных показателей системы свёртывания, локализации и выраженности кровотечения, клинического состояния пациента.
При назначении пациентам с приобретенным дефицитом факторов протромбинового комплекса, в частности, для лечения и профилактика кровотечений при передозировке непрямых антикоагулянтов — антагонистов витамина K, — при расчёте дозы следует ориентироваться на значение либо протромбина по Квику, либо международного нормализованного отношения (МНО), — в зависимости от того, какой показатель определяет лаборатория.
Если ориентироваться на значение протромбина по Квику, то следует исходить из допущения, что 1 МЕ препарата на 1 кг массы тела повышает значение протромбина примерно на 1 %.
Если же учитывать исходное значение МНО, то расчёт дозы проводят следующим образом (см. таблицу).
| Исходное значение MHO | Разовая доза препарата из расчёта на 1 кг массы тела |
| 2,0-3,9 | 25 МЕ/кг |
| 4,0-5,9 | 35 МЕ/кг |
| ≥6,0 | 50 МЕ/кг |
Целью лечения является достижение значения МНО 1,0-1,2; иногда до 1,5, в зависимости от клинической ситуации. Вопрос о введении повторной дозы препарата следует решать индивидуально, с учётом динамики клинического состояния пациента, сопутствующей терапии и достигнутого значения МНО.
При назначении пациентам с врождённым изолированным дефицитом одного из факторов протромбинового комплекса разовую дозу рассчитывают для каждого пациента индивидуально (см. формулы расчёта необходимой дозы), а интервалы между введениями устанавливают в зависимости от значения периода полувыведения дефицитного фактора. Лечение должно начинаться под контролем врача, имеющего опыт лечения нарушений свёртывания крови.
Формулы расчёта необходимой дозы
фактора II: доза (ME) = масса тела (кг) × желаемое повышение фактора (%) × 0,5;
фактора VII: доза (ME) = масса тела (кг) × желаемое повышение фактора (%) × 0,6;
фактора IX: доза (ME) = масса тела (кг) × желаемое повышение фактора (%) × 1,2;
фактора X: доза (ME) = масса тела (кг) × желаемое повышение фактора (%) × 0,6.
В случае массивного оперативного вмешательства необходим тщательный мониторинг уровня дефицитного фактора свёртывания и/или показателя протромбина по Квику и коррекция терапии препаратом Протромплекс 600 в зависимости от динамики этих показателей.
Примечание. Вводимая доза специфического фактора выражается в Международных единицах (ME), которые определяются в соответствии с действующим стандартом ВОЗ для каждого фактора. Активность фактора свёртывания в плазме выражают либо в процентах (по отношению к нормальной плазме), либо в Международных единицах (в соответствии с международным стандартом для конкретного фактора свёртывания).
Одна Международная единица (ME) активности фактора свёртывания является эквивалентом количества в одном мл нормальной плазмы человека.
Приготовление раствора и его введение
Содержимое флакона с лиофилизатом растворяют непосредственно перед введением. С этой целью необходимо использовать только прилагаемый набор для растворения и введения. Восстановленный раствор должен быть прозрачным или слегка опалесцирующим. Нельзя использовать раствор, если он мутный или в нем есть включения. Неиспользованный раствор подлежит утилизации в соответствии с установленными правилами.
Приготовление восстановленного раствора:
- Неоткрытый флакон с растворителем (водой для инъекций) довести до комнатной температуры (не выше 37 °C).
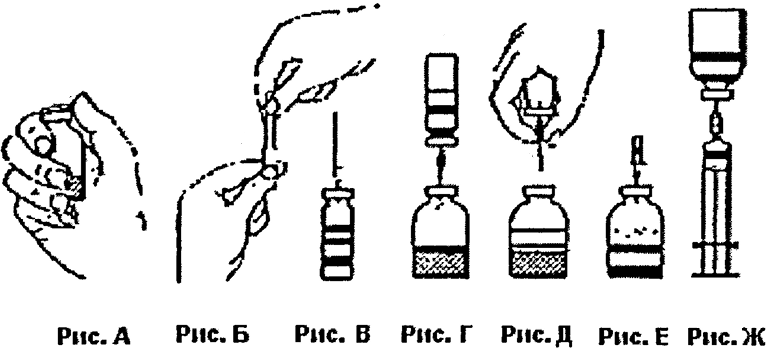
- Удалить защитные колпачки с флаконов с лиофилизатом и с растворителем (рис. А) и продезинфицировать этиловым спиртом резиновые пробки на обоих флаконах.
- Провернуть, а затем снять защитную упаковку с одного конца иглы для переноса (рис. Б), входящей в комплект. Проколоть этим концом иглы резиновую пробку флакона с растворителем (рис. В).
- Осторожно удалить защитную упаковку с другого конца иглы для переноса, не дотрагиваясь до самой иглы.
- Перевернуть флакон с растворителем и проколоть свободным концом иглы для переноса резиновую пробку флакона с лиофилизатом (рис. Г). За счёт вакуума вода для инъекций поступит во флакон с лиофилизатом.
- Отсоединить флаконы, удалив иглу для переноса из флакона с лиофилизатом (рис. Д). Для более быстрого растворения препарата флакон можно осторожно вращать и покачивать.
- Для осаждения пены после полного растворения лиофилизата вставить во флакон имеющуюся в комплекте воздуховодную иглу (рис. Е). Удалить воздуховодную иглу после оседания пены (см. рис 1).
Внутривенное введение
Необходимо соблюдать правила асептики!
- Провернуть, а затем снять защитную упаковку с иглы-фильтра и укрепить её на стерильный одноразовый шприц. Набрать раствор в шприц (рис. Ж).
- Отсоединить иглу-фильтр от шприца, укрепить на шприце иглу-«бабочку» или одноразовую иглу для инъекций и ввести раствор внутривенно медленно (со скоростью не более 2 мл/мин).
Для приготовления раствора препарата Протромплекс 600 и для его введения следует использовать только прилагаемый комплект для растворения и введения.
Побочное действие
При применении концентратов факторов протромбинового комплекса существует риск развития тромбоэмболий, диссеминированного внутрисосудистого свёртывания и реакций повышенной чувствительности, включая анафилактические реакции и анафилактический шок.
При проведении заместительной терапии концентратом факторов протромбинового комплекса возможна выработка циркулирующих антител, ингибирующих один или несколько факторов свёртывания. Появление ингибиторов проявляется в виде недостаточного клинического ответа.
О безопасности в отношении инфекционных агентов см. раздел «Особые указания». Нежелательные явления, наблюдавшиеся в ходе постмаркетингового применения препарата Протромплекс 600, сгруппированы по системам органов и описаны в терминах MedDRA (Медицинский словарь регуляторной деятельности).
Со стороны кровеносной и лимфатической системы: диссеминированное внутрисосудистое свёртывание; развитие ингибиторов одного или нескольких факторов свёртывания крови (факторы II, VII, IX, X).
Со стороны иммунной системы: анафилактический шок, анафилактические реакции, реакции гиперчувствительности.
Со стороны нервной системы: инсульт, головная боль.
Со стороны сердечно-сосудистой системы: сердечная недостаточность, инфаркт миокарда, тахикардия; артериальный тромбоз, венозный тромбоз, артериальная гипотензия, «приливы» крови к коже лица.
Со стороны кожи и подкожных тканей: крапивница, эритематозные высыпания, кожный зуд.
Со стороны органов дыхания, грудной клетки, средостения: тромбоэмболия лёгочной артерии, одышка, свистящее дыхание.
Со стороны почек: нефротический синдром.
Со стороны желудочно-кишечного тракта: рвота, тошнота.
Общие расстройства: лихорадка.
Нежелательные реакции, присущие данному фармакологическому классу средств
Расстройства со стороны кожи и подкожных тканей: ангионевротический отёк, парестезии.
Общие расстройства и состояние места введения: реакции в месте введения.
Расстройства нервной системы: сонливость.
Расстройства психической сферы: беспокойство.
Передозировка
Случаи передозировки препаратов протромбинового комплекса не описаны. Основываясь на фармакодинамических свойствах препарата, можно предполагать, что возможными проявлениями передозировки будут тромботические осложнения.
Взаимодействие с другими лекарственными средствами
Препараты протромбинового комплекса нейтрализуют эффекты антагонистов витамина K. Исследования по изучению взаимодействия с другими лекарственными средствами не проводились.
Несовместимость
Протромплекс 600 нельзя смешивать с другими лекарственными средствами или растворителями, кроме прилагаемой воды для инъекций.
Эффективность и переносимость препарата могут быть ослаблены при смешивании его с другими лекарственными средствами. Рекомендуется промывать венозный катетер изотоническим раствором натрия хлорида до и после применения Протромплекса 600.
Особые указания
У пациентов с приобретенным дефицитом факторов свёртывания протромбинового комплекса (например, вследствие лечения антагонистами витамина K) Протромплекс 600 применяют в тех случаях, когда необходима быстрая коррекция уровней факторов, в частности, при жизнеугрожающих и тяжёлых кровотечениях, особенно ретроперитонеальном, церебральном, желудочно-кишечном, а также при необходимости неотложного хирургического вмешательства. В других случаях, как правило, достаточно снижения дозы антагониста витамина K и/или применения витамина K.
При врождённом изолированном дефиците одного из витамин K-зависимых факторов в первую очередь следует применять монокомпонентный препарат дефицитного фактора свёртывания. Пациенты с врождённым дефицитом фактора свёртывания должны быть проконсультированы специалистом, имеющим опыт лечения пациентов с данной патологией.
Кровотечения у пациентов с приобретенным дефицитом витамин K-зависимых факторов свёртывания могут возникать при длительной терапии или передозировке оральных непрямых антикоагулянтов (антагонистов витамина K); при заболеваниях органов гепатопанкреатодуоденальной зоны (цирроз, гепатоцеллюлярная карцинома, обструкция общего желчного протока камнем или стриктурой, дренирование общего желчного протока, хронический панкреатит); при заболеваниях кишечника, приводящих к нарушению всасывания витамина K (синдром «короткой кишки» вследствие хирургического вмешательства; болезнь Крона); при длительном парентеральном питании без добавления витамина K; как результат воздействия терапии некоторыми лекарственными средствами (цефамандол, цефоперазон, рифампицин, изониазид, барбитураты, химиотерапевтические средства, повреждающие паренхиму печени); при заболеваниях, сопровождающихся выработкой ингибиторов свёртывания (волчаночный антикоагулянт, множественная миелома и другие парапротеинемии), при остром промиелоцитарном лейкозе, при массивной кровопотере.
Многоцентровые клинические исследования препарата Протромплекс 600 у детей не проводились.
При возникновении аллергических или анафилактических реакций введение препарата должно быть немедленно прекращено. В случае шока должно быть обеспечено проведение стандартных противошоковых медицинских мероприятий.
Стандартные меры по предотвращению инфекций, являющихся результатом применения лекарственных препаратов, полученных из крови или плазмы человека, включают отбор доноров, скрининг индивидуальных донорских образцов и пулов плазмы с целью выявления специфических маркеров инфекции, а также использование при производстве эффективных процессов инактивации/удаления вирусов. Несмотря на это, при применении лекарственных препаратов, полученных из крови и плазмы человека, передача инфекционного агента не может быть полностью исключена. Это также применимо к неизвестным или новым вирусам и другим патогенным возбудителям. Предпринимаемые меры считаются эффективными в отношении оболочечных вирусов, таких как ВИЧ-1/2, вирусы гепатита B и С и безоболочечного вируса гепатита А. Применяемые технологии по удалению и инактивации могут быть недостаточно эффективны в отношении некоторых безоболочечных вирусов, таких, например, как парвовирус В19. Инфекция парвовирусом В19 может быть опасна для беременных женщин (инфицирование плода) и пациентов с иммунодефицитом, для пациентов с повышенным распадом эритроцитов (например, при гемолитической анемии).
При регулярном применении препаратов, произведенных из плазмы человека, следует предусмотреть проведение вакцинации пациента против гепатита А и гепатита B.
Каждый раз при введении пациенту препарата Протромплекс 600 необходимо записывать название препарата и номер серии в истории болезни или карте пациента.
При повторных введениях препаратов протромбинового комплекса человека, в том числе препарата Протромплекс 600, существует риск развития тромбоза и диссеминированного внутрисосудистого свёртывания. Риск может быть выше при лечении изолированной недостаточности фактора VII, так как другие витамин K-зависимые факторы свёртывания с более длительным периодом полувыведения могут накапливаться до уровней, существенно превышающих нормальные.
За пациентами, которым проводится терапия препаратом протромбинового комплекса, должно быть установлено тщательное наблюдение на предмет выявления симптомов внутрисосудистого свёртывания или тромбоза. Показан контроль за пациентами с ишемической болезнью сердца, заболеваниями печени, пациентами, имеющими склонность к тромбозам, за новорождёнными, а также за пациентами в пред- и послеоперационном периодах. У этих пациентов потенциальная польза от лечения должна быть соотнесена с риском развития осложнений.
Лабораторные тесты. Следует учитывать, что в состав препарата входит гепарин, что важно при выполнении гепарин-чувствительных коагуляционных тестов, особенно в случае применения высоких доз препарата.
Поскольку гепарин может вызывать аллергические реакции и снижение количества клеток крови, что влияет на систему свёртывания, следует избегать назначения гепаринсодержащих лекарственных препаратов пациентам, имеющим в анамнезе гепарин индуцированные аллергические реакции.
Флакон с препаратом Протромплекс 600 содержит 80 мг натрия. Это должно быть принято во внимание при назначении препарата пациентам, находящимся на диете с низким содержанием натрия.
В пределах указанного срока годности пациенты могут хранить препарат при комнатной температуре (не выше 25 °C) в течение 6 месяцев. Дату начала хранения при комнатной температуре следует отмечать на упаковке. Если препарат хранили при комнатной температуре 6 месяцев, он подлежит либо введению пациенту, либо утилизации.
Последующее хранение в холодильнике недопустимо.
Восстановленный раствор химически и физически стабилен при хранении в течение 3 часов при температуре от 20 до 25 °C. Восстановленный раствор нельзя хранить в холодильнике. Поскольку препарат не содержит консервантов, с микробиологической точки зрения приготовленный раствор должен быть использован немедленно.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния препарата на управление транспортными средствами и механизмами не проводились.
Форма выпуска
Лиофилизат для приготовления раствора для внутривенного введения.
Во флаконах из прозрачного бесцветного стекла гидролитического типа II вместимостью 50 мл, укупоренных пробками из галогенбутилового каучука, которые фиксируются алюминиевыми колпачками и пластмассовыми крышками типа "flip off". Растворитель (вода для инъекций) по 20 мл во флаконах прозрачного бесцветного стекла гидролитического типа I и II, укупоренных пробками из галогенбутилового каучука, которые фиксируются алюминиевыми колпачками и пластмассовыми крышками типа "flip off".
По одному флакону с препаратом в комплекте с одним флаконом растворителя, иглой для переноса, иглой-фильтром, воздуховодной иглой, одноразовой иглой для инъекций и иглой-«бабочкой» вместе с инструкцией по применению помещают в картонную пачку.
Хранение
Хранить при температуре от 2 до 8 °C в защищённом от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Baxter, S.A., Бельгия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Протромплекс 600:
