Мелитид
MelitideРегистрационный номер
Торговое наименование
Мелитид
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
В 1 мл препарата содержится:
действующее вещество: лираглутид 6,0 мг (в 1 предварительно заполненной шприц-ручке объёмом 3 мл содержится 18 мг лираглутида).
вспомогательные вещества: натрия гидрофосфата дигидрат, фенол, хлористоводородной кислоты раствор 0,2М или натрия гидроксида 1М раствор (для коррекции pH), вода для инъекций.
Описание
Прозрачная или опалесцирующая бесцветная или слегка жёлтая жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Лираглутид представляет собой аналог человеческого глюкагоноподобного пептида-1 (ГПП-1), произведённый методом биотехнологии рекомбинантной ДНК с использованием штамма E. coli, имеющий 97 % гомологичности с человеческим ГПП-1, который связывается и активирует рецепторы ГПП-1 у человека. Рецептор ГПП-1 служит мишенью для нативного ГПП-1 — эндогенного гормона инкретина, вызывающего стимуляцию глюкозозависимой секреции инсулина в бета-клетках поджелудочной железы. В отличие от нативного ГПП-1, фармакокинетический и фармакодинамический профили лираглутида позволяют вводить его пациентам подкожно 1 раз в сутки.
Длительный период полувыведения препарата из плазмы обеспечивается тремя механизмами: самоассоциацией, в результате которой происходит замедленное всасывание препарата, связыванием с альбумином и более высоким уровнем ферментативной стабильности по отношению к дипептидилпептидазе-4 (ДПП-4) и ферменту нейтральной эндопептидазы (НЭП).
Лираглутида взаимодействует с рецепторами ГПП-1, в результате чего повышается концентрация циклического аденозинмонофосфата (цАМФ). Тем самым под действием лираглутида происходит глюкозозависимая стимуляция секреции инсулина и улучшение функции бета-клеток поджелудочной железы. В то же время, под действием лираглутида происходит глюкозозависимое подавление излишне высокой секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. С другой стороны, во время гипогликемии лираглутид снижает секрецию инсулина, но не подавляет секрецию глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка. Лираглутид снижает массу тела и уменьшает жировую массу тела при помощи механизмов, вызывающих уменьшение чувства голода и снижение расхода энергии.
ГПП-1 является физиологическим регулятором аппетита и потребления калорий, а рецепторы ГПП-1 расположены в нескольких областях головного мозга, участвующих в процессах регуляции аппетита.
В исследованиях на животных периферическое введение лираглутида приводило к захвату препарата в специфических областях головного мозга, включая гипоталамус, где лираглутид посредством специфической активации рецепторов ГПП-1 усиливал сигналы насыщения и ослаблял сигналы голода, тем самым приводя к уменьшению массы тела. Рецепторы ГПП-1 представлены также в специфических областях сердца, сосудов, иммунной системы и почек. Исследования с участием людей и животных показали, что активация лираглутидом рецепторов ГПП-1 может оказывать сердечно-сосудистые и микроциркуляторные эффекты, в том числе уменьшение воспаления. Исследования на животных показали, что лираглутид замедляет развитие атеросклероза.
Исследования на экспериментальных животных моделях с предиабетом показали, что лираглутид замедляет развитие сахарного диабета (СД). Диагностика in vitro показала, что лираглутид является мощным фактором специфической стимуляции пролиферации бета-клеток поджелудочной железы и предупреждает гибель бета-клеток (апоптоз), индуцируемую цитокинами и свободными жирными кислотами. In vivo лираглутид повышает биосинтез инсулина и увеличивает массу бета-клеток у экспериментальных животных моделей с СД. Когда концентрация глюкозы нормализуется, лираглутид перестаёт увеличивать массу бета-клеток поджелудочной железы.
Препарат Мелитид обладает длительным 24-часовым действием и улучшает гликемический контроль путём снижения концентрации глюкозы крови натощак и после еды у пациентов с сахарным диабетом 2 типа (СД2).
Глюкозозависимая секреция инсулина
При возрастании концентрации глюкозы в плазме препарат Мелитид увеличивает секрецию инсулина. При применении поэтапной инфузии глюкозы секреция инсулина после введения однократной дозы препарата Мелитид пациентам с СД2 возрастает до уровня, сопоставимого с таковым у здоровых добровольцев.
В ходе фармакодинамических исследований лираглутид улучшал функцию бета-клеток поджелудочной железы у пациентов с СД2, что подтверждается первой и второй фазой инсулинового ответа и максимальной секреторной активностью бета-клеток.
Клинические исследования продолжительностью до 52 недель показали, что терапия лираглутидом привела к улучшению функции бета-клеток поджелудочной железы.
Секреция глюкагона
Препарат Мелитид, стимулируя секрецию инсулина и подавляя секрецию глюкагона, уменьшает концентрацию глюкозы в крови. Препарат Мелитид не подавляет глюкагоновый ответ на низкую концентрацию глюкозы крови. Кроме того, на фоне применения препарата Мелитид наблюдалась более низкая выработка эндогенной глюкозы.
Опорожнение желудка
Препарат Мелитид вызывал небольшую задержку опорожнения желудка, что приводило к снижению скорости поступления постпрандиальной глюкозы (ПНГ) в кровь.
Влияние на массу тела и расход энергии
Применение лираглутида у пациентов с повышенной массой тела в долгосрочных клинических исследованиях приводило к значительному снижению массы тела. Сканирование тела показало, что снижение массы тела происходило в первую очередь из-за уменьшения жировой ткани у пациентов. Снижение массы тела объясняется тем, что во время терапии лираглутидом у пациентов снижаются ощущение голода и расход энергии.
Электрофизиология сердца (ЭФс)
Действие лираглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение лираглутида в равновесной концентрации в ежедневной дозе до 1,8 мг не продуцировало удлинения скорректированного интервала QT.
Клиническая эффективность и безопасность
Оценка влияния лираглутида на гликемический контроль осуществлялась в 5 двойных слепых контролируемых клинических исследованиях. В эти исследования были рандомизированы 3992 взрослых пациента с СД2 (из 3978 пациентов, получавших терапию СД2, 2501 — получали лираглутид). Терапия лираглутидом вызвала клинически значимое улучшение показателей гликированного гемоглобина (HbA1c), концентраций глюкозы плазмы натощак (ГПН) и ППГ.
Гликемический контроль
Показатель HbA1c по неделям терапии для лираглутида и глимепирида (оба в виде монотерапии в течение 52 недель) представлен на рисунке 1.
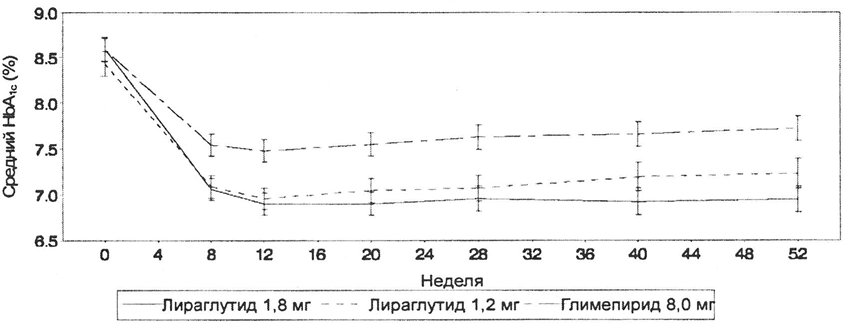
Рисунок 1. Показатель HbA1c составил менее 7 % и сохранялся на протяжении 12 месяцев при назначении лираглутида пациентам, ранее получавшим терапию в виде диеты и физических нагрузок.
У пациентов с HbA1c выше 9,5 % в исходной точке исследования данный показатель снизился на 2,1 % на фоне монотерапии лираглутидом, в то время как у пациентов, участвующих в клинических исследованиях комбинированного применения лираглутида, средний показатель НЬА)с снизился на 1,1–2,5 %.
У пациентов, не достигших адекватного гликемического контроля на фоне терапии лираглутидом и метформином, добавление базального инсулина обеспечило снижение показателя HbA1c от исходного значения на 1,1 %.
Лираглутид в течение 26-недельной комбинированной терапии с одним или несколькими пероральными гипогликемическими препаратами (ПГГП) привёл к устойчивому снижению показателя HbA1c в диапазоне от 1,1 % до 1,5 %. В тех же исследованиях после 26 недель терапии изменения показателя HbA1c составили от -0,4 % до -1,1 % в группах активного препарата сравнения и от -0,5 % до 0,2 % в группах плацебо.
Доля пациентов, достигших снижения показателя HbA1c
На фоне монотерапии лираглутидом доля пациентов, достигших показателя НЬА]с < 7 %, составила 51 %. При применении лираглутида в сочетании с одним или несколькими ПГГП доля пациентов, достигших показателя HbA1c < 6,5 %, составила от 42 % до 54 %.
В группах пациентов, не достигших адекватного гликемического контроля на фоне терапии лираглутидом 1,8 мг и м, доля пациентов, достигших целевого показателя HbA1c (<7 % и ≤6,5 %) после добавления базального инсулина, составила 43 % и 17 %, соответственно.
Во всех 26-недельных исследованиях комбинированного применения лираглутида удалось достичь показателя HbA1c < 7 % у большего числа пациентов, получавших препарат в виде комбинированной терапии, по сравнению с числом пациентов, получавших его в виде монотерапии.
Применение у пациентов с нарушением функции почек
В двойном слепом плацебо-контролируемом исследовании в качестве дополнения к инсулину и/или ПГГП у пациентов с СД2 и нарушением функции почек средней степени тяжести через 26 недель лираглутид 1,8 мг снижал показатель HbA1c на 1,05 % против 0,38 % у пациентов, получавших плацебо. Доля пациентов, достигших показателя HbA1c < 7 %, при применении лираглутида составила 52,8 % против 19,5 % при применении плацебо. У пациентов, получавших лираглутид, было отмечено снижение массы тела на 2,41 кг против 1,09 кг у пациентов, получавших плацебо.
Риск развития эпизодов гипогликемии между двумя группами терапии был сопоставим.
Профиль безопасности лираглутида был, в целом, аналогичен таковому, отмеченному в других исследованиях препарата.
Концентрация глюкозы плазмы натощак
Концентрация ГПН снизилась на 13–43,5 мг/дл (0,72–2,42 ммоль/л) на фоне применения лираглутида, как в виде монотерапии, так и в комбинации с одним или двумя ПГГП.
Это снижение наблюдалось уже в течение первых двух недель терапии.
Постпрандиальный уровень гликемии
При применении лираглутида наблюдалось снижение концентрации ППГ после каждого из трёх ежедневных приёмов пищи на 31–49 мг/дл (1,68–2,71 ммоль/л).
Масса тела
52-недельная монотерапия лираглутидом ассоциировалась с устойчивым снижением массы тела.
На протяжении всего периода клинических исследований устойчивое снижение массы тела также ассоциировалось с применением лираглутида в комбинации с ПГГП.
Снижение массы тела у пациентов, получавших лираглутид в комбинации с метформином, также продолжалось после добавления базального инсулина.
Наибольшее снижение массы тела наблюдалось у пациентов, имевших в исходной точке исследования повышенный индекс массы тела (ИМТ).
Снижение массы тела наблюдалось у всех пациентов, получавших терапию лираглутидом, независимо от того, испытывали они или нет нежелательную реакцию в виде тошноты.
Монотерапия лираглутидом в течение 52 недель привела к уменьшению окружности талии в среднем, на 3,0–3,6 см.
Лираглутид в комбинации с метформином снизил объём висцерального жира на 13–17 %.
Неалкогольный стеатогепатоз
Лираглутид уменьшает выраженность стеатогепатоза у пациентов с СД2.
Иммуногенность
При применении лираглутида в среднем у 8,6 % пациентов отмечалось образование антител к лираглутиду. Образование антител не приводило к снижению эффективности лираглутида.
Оценка влияния на сердечно-сосудистую систему
В ретроспективном анализе серьёзных сердечно-сосудистых событий (СССС) (смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода и инсульт без смертельного исхода) по данным всех долгосрочных исследований и исследований средней продолжительности II и III фазы было продемонстрировано отсутствие увеличения риска развития СССС.
Было проведено многоцентровое, плацебо-контролируемое, двойное слепое клиническое исследование «Эффект и воздействие лираглутида при сахарном диабете: оценка сердечно-сосудистых рисков» (LEADER®).
Лираглутид значительно снижал риск развития СССС по сравнению с плацебо (Рисунок 2). Относительный риск (ОР) развития СССС был стабильно ниже 1 для всех трёх сердечно-сосудистых событий.
Лираглутид также существенно снижал риск развития расширенных СССС (первичное СССС, нестабильная стенокардия, приводящая к госпитализации, реваскуляризация миокарда или госпитализация по причине сердечной недостаточности) по сравнению с плацебо, а также снижал риск развития прочих вторичных конечных точек (Рисунок 3).
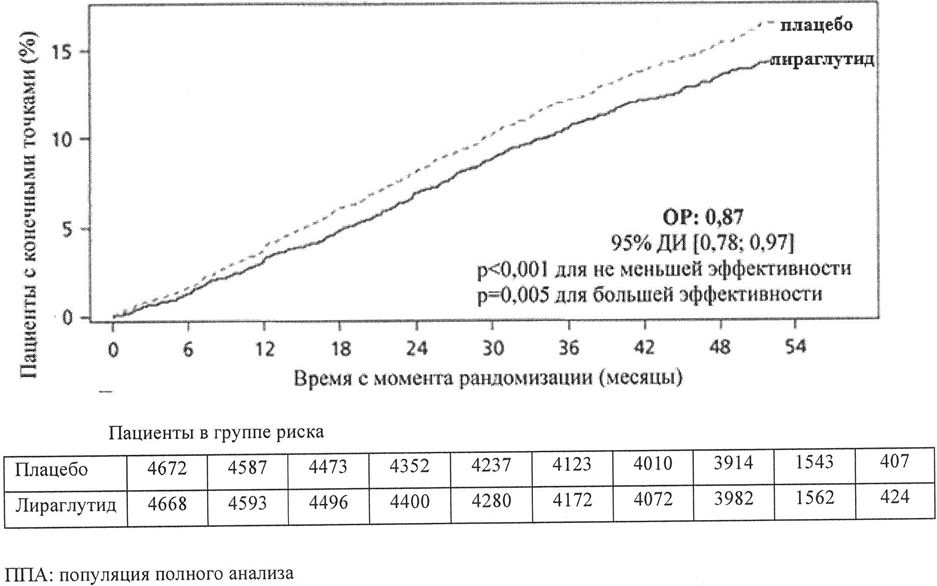
Рисунок 2. График Каплан-Мейера — время до возникновения первого СССС — Популяция полного анализа (ППА).
При применении лираглутида по сравнению с плацебо наблюдалось устойчивое снижение HbA1c через 36 месяцев по сравнению с исходным показателем. У инсулин-наивных в начале исследования пациентов необходимость интенсификации терапии инсулином сократилась на 48 % при применении лираглутида по сравнению с плацебо (ОР 0,52). При применении лираглутида в сравнении с плацебо наблюдалось устойчивое снижение массы тела через 36 месяцев по сравнению с исходным значением. Характер нежелательных явлений был, в целом, сопоставим с характером явлений, наблюдавшихся в ходе завершённых клинических исследований лираглутида, применявшегося для терапии СД2 (см. раздел «Побочное действие»).
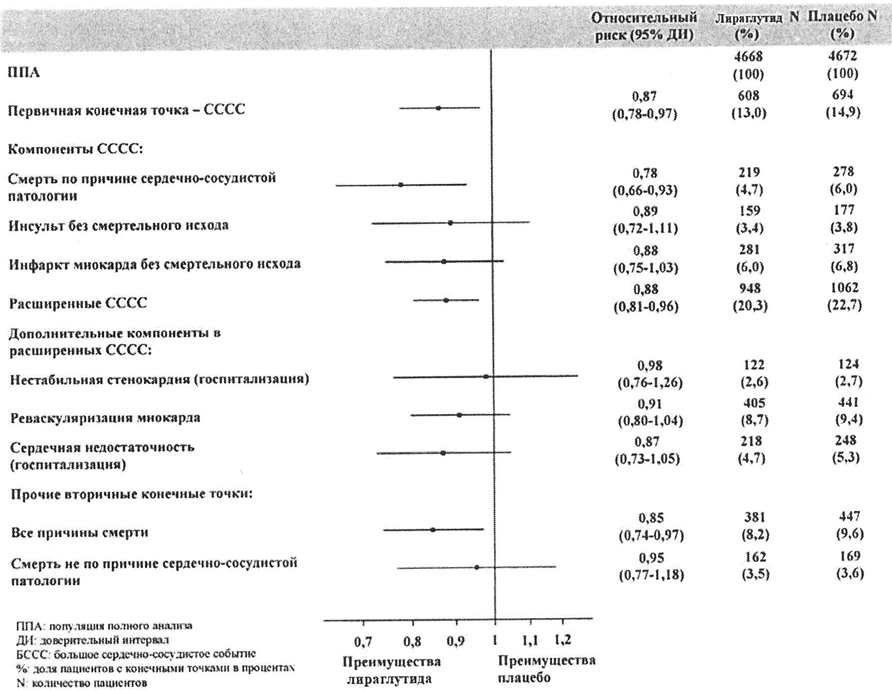
Рисунок 3. Форест-диаграмма, отражающая анализ отдельных типов явлений со стороны сердечно-сосудистой системы — ППА.
Артериальное давление (АД) и част от а сердечных сокращений (ЧСС)
Долгосрочные клинические исследования показали, что лираглутид снижает показатели систолического АД в среднем на 2,3–6,7 мм рт. ст. в первые две недели терапии. Лираглутид снижал количество случаев развития метаболического синдрома, согласно определению -III Экспертной группы по лечению взрослых (the Adult Treatment Panel III, АТРШ). Снижение систолического АД происходило до снижения массы тела.
В исследовании LEADER® отмечалось снижение систолического АД при применении лираглутида по сравнению с плацебо, при этом диастолическое АД через 36 месяцев снижалось в меньшей степени при приёме лираглутида по сравнению с плацебо. В ходе долгосрочных клинических исследований, в том числе исследования LEADER®, при применении лираглутида среднее увеличение ЧСС от исходного значения составило от 2 до 3 ударов в минуту. В ходе исследования LEADER® не было выявлено отдалённого клинического влияния повышенной ЧСС на риск сердечно-сосудистых событий.
Оценка влияния на микроциркуляторное русло
В ходе исследования LEADER® оценка микроциркуляторных событий включала оценку нефропатии и ретинопатии. При анализе времени, прошедшего до появления первого микроциркуляторного события, при введении лираглутида по сравнению с плацебо ОР составил 0,84. ОР при введении лираглутида по сравнению с плацебо составил 0,78 при анализе времени до первого появления нефропатии и 1,15 — до первого появления ретинопатии.
Соотношение между схемами терапии по изменению содержания альбумина/креатинина в моче по сравнению с исходной величиной через 36 месяцев составило 0,81.
Дети и подростки
В двойном слепом исследовании по сравнению эффективности и безопасности лираглутида в дозе 1,8 мг и плацебо в качестве дополнения к метформину ± инсулин у подростков и детей в возрасте 10 лет и старше с СД2 лираглутид был эффективнее плацебо в снижении показателя HbA1c через 26 недель (-1,06 % [-1,65;0,46]). Разница между видами терапии для показателя HbA1c составляла 1,3 % после дополнительных 26 недель открытой продолженной фазы, подтверждая стойкий гликемический контроль при терапии лираглутидом.
Профиль эффективности и безопасности лираглутида был сравним с наблюдавшимся во взрослой популяции, применявшей лираглутид.
На основании адекватного гликемического контроля или переносимости 30 % пациентов исследования продолжали получать дозу 0,6 мг и 70 % пациентов исследования продолжали терапию в дозе 1,2 мг или 1,8 мг.
Фармакокинетика
Всасывание
Всасывание лираглутида после подкожного введения происходит медленно, время достижения максимальной концентрации в плазме — 8–12 часов после введения дозы препарата. Максимальная концентрация (Cmax) лираглутида в плазме после подкожной инъекции в однократной дозе 0,6 мг составляет 9,4 нмоль/л. При введении лираглутида в дозе 1,8 мг средний показатель его равновесной концентрации в плазме (AUCτ/24) достигает приблизительно 34 нмоль/л. Экспозиция лираглутида усиливается пропорционально введённой дозе. После введения лираглутида в однократной дозе внутрииндивидуальный коэффициент вариации площади под кривой «концентрация-время» (AUC) составляет 11 %. Абсолютная биодоступность лираглутида после подкожного введения составляет приблизительно 55 %.
Распределение
Кажущийся объём распределения лираглутида в тканях после подкожного введения составляет 11–17 л. Средний объем распределения лираглутида после внутривенного введения составляет 0,07 л/кг. Лираглутид в значительной степени связывается с белками плазмы крови (>98 %).
Метаболизм
На протяжении 24 часов после введения здоровым добровольцам однократной дозы меченого радиоактивным изотопом [3Н]-лираглутида главным компонентом плазмы оставался неизмененный лираглутид. Были обнаружены два метаболита в плазме (≤9 % и ≤5 % от уровня общей радиоактивности в плазме крови). Лираглутид метаболизируется эндогенно без привлечения какого-либо специфического органа в качестве пути выведения.
Выведение
После введения дозы [3Н]-лираглутида неизменённый лираглутид не определялся в моче или кале. Лишь незначительная часть введённой радиоактивности в виде связанных с лираглутидом метаболитов (6 % и 5 %, соответственно) выводилась почками или через кишечник. Радиоактивные вещества почками или через кишечник выводятся, в основном, в течение первых 6-8 дней после введения дозы препарата и представляют собой три метаболита.
Средний клиренс из организма после подкожного введения лираглутида в однократной дозе составляет приблизительно 1,2 л/ч с элиминационным периодом полувыведения примерно 13 часов.
Особые группы пациентов
Пациент ы пожилого возраста
Не требуется коррекции дозы в зависимости от возраста. Данные фармакокинетических исследований в группе здоровых добровольцев и анализ фармакокинетических данных, полученных в популяции пациентов (от 18 до 80 лет), свидетельствуют о том, что возраст не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Пол
Не требуется коррекции дозы в зависимости от пола. Популяционный фармакокинетический анализ (ФК) данных, полученных при исследовании действия лираглутида у пациентов женского и мужского пола, и данные фармакокинетических исследований в группе здоровых добровольцев свидетельствуют о том, что пол не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Этническая принадлежность
Не требуется коррекции дозы в зависимости от этнической принадлежности. Популяционный ФК анализ данных, полученных при исследовании действия лираглутида у пациентов европеоидной, негроидной, азиатской и латиноамериканской расовых групп, свидетельствует о том, что этническая принадлежность не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Ожирение
Популяционный ФК анализ данных свидетельствует о том, что ИМТ не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Печёночная недостаточность
Фармакокинетические свойства лираглутида исследовались в ходе клинического исследования однократной дозы препарата у пациентов с различной степенью печёночной недостаточности. В исследование были включены пациенты с печёночной недостаточностью от лёгкой (по классификации Чайлд-Пью тяжесть заболевания 5–6 баллов) до тяжёлой степени (по классификации Чайлд-Пью тяжесть заболевания >9 баллов). Наблюдалось снижение экспозиции лираглутида на 13–23 % у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести и значительное снижение экспозиции лираглутида (на 44 %) у пациентов с печёночной недостаточностью тяжёлой степени в сравнении со здоровыми добровольцами.
Почечная недостаточность
Фармакокинетика лираглутида изучалась у пациентов с различной степенью почечной недостаточности в исследовании однократной дозы. В данное исследование были включены пациенты с различной степенью почечной недостаточности: от лёгкой (оценка клиренса креатинина (КК) 50–80 мл/мин) до тяжёлой (оценка КК <30 мл/мин) и пациенты с терминальной стадией почечной недостаточности, нуждающиеся в гемодиализе. Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику лираглутида.
Дети и подростки
Фармакокинетические свойства оценивались в клинических исследованиях с участием детей и подростков с СД2 в возрасте 10 лет и старше. Экспозиция лираглутида у подростков и детей была сравнимой с наблюдаемой во взрослой популяции.
Показания
Препарат Мелитид показан к применению у пациентов с сахарным диабетом 2 типа для достижения адекватного гликемического контроля в дополнение к диетотерапии и физическим упражнениям в качестве:
- монотерапии — у взрослых, подростков и детей в возрасте от 10 лет и старше;
- комбинированной терапии с одним или несколькими пероральными гипогликемическими препаратами (метформином, производным сульфонилмочевины, ингибитором натрийзависимого переносчика глюкозы 2 типа [иНГЛТ-2] или препаратом из группы тиазолидиндионов) — у взрослых пациентов (≥18 лет), не достигших адекватного гликемического контроля на предшествующей терапии;
- комбинированной терапии с метформином — у подростков и детей в возрасте от 10 лет и старше, не достигших адекватного гликемического контроля при проведении терапии метформином;
- комбинированной терапии с инсулином — у взрослых пациентов, подростков и детей в возрасте от 10 лет и старше, не достигших адекватного гликемического контроля при проведении терапии препаратом Мелитид и метформином.
Препарат Мелитид показан для снижения риска развития серьёзных сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и диагностированным сердечно-сосудистым заболеванием в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого серьёзного сердечно-сосудистого события — см. раздел «Фармакологические свойства», подраздел «Оценка влияния на сердечно-сосудистую систему»).
* серьёзные сердечно-сосудистые события включают: смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Противопоказания
- Гиперчувствительность к лираглутиду или любому из вспомогательных веществ препарата;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
- множественная эндокринная неоплазия 2 типа;
- сахарный диабет 1 типа (СД1); диабетический кетоацидоз (см. «Особые указания»).
В связи с отсутсвием данных по эффективности и безопасности лирагрутида, применение препарата Метилид противопоказано при следующих состояниях/заболеваниях:
- беременность и период грудного вскармливания (см. «Применение во время беременности и в период грудного вскармливания»);
- терминальная стадия почечной недостаточности (КК <15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация));
- воспалительные заболевания кишечника (см. «Особые указания»)-,
- диабетический гастропарез (см. «Особыеуказания»)-,
- детский возраст до 10 лет (см. «Способ применения и дозы»).
Не рекомендуется к применению у пациентов с печёночной недостаточностью тяжёлой степени.
С осторожностью
В связи с ограниченными клиническими данными препарат Мелитид следует применять с соблюдением мер предосторожности у пациентов с заболеваниями щитовидной железы и наличием острого панкреатита в анамнезе (см. «Особыеуказания»).
Применение при беременности и в период грудного вскармливания
Беременность
Применение препарата Мелитид во время беременности противопоказано.
Клинических данных об эффективности и безопасности применения лираглутида у беременных нет. Исследования на животных выявили репродуктивную токсичность лираглутида. Потенциальный риск для человека неизвестен.
В случае планирования беременности или диагностирования беременности на фоне терапии лираглутидом, применение препарата Мелитид следует прекратить и перевести пациентку на инсулинотерапию.
Период грудного вскармливания
Неизвестно, проникает ли лираглутид в грудное молоко у человека. Доклинические исследования показали, что лираглутид проникает в молоко лактирующих животных в небольших количествах. В связи с отсутствием клинических данных об эффективности и безопасности лираглутида применение препарата Мелитид в период грудного вскармливания противопоказано.
Способ применения и дозы
Препарат Мелитид применяют подкожно 1 раз в сутки в любое время, независимо от приёма пищи, его можно вводить в живот, бедро или плечо. Место и время инъекции могут меняться без коррекции дозы. Однако, предпочтительнее вводить препарат приблизительно в одно и то же время суток, в наиболее удобное для пациента время. Дальнейшая информация по способу применения препарата Мелитид содержится в разделе «Руководство по использованию».
Препарат Мелитид нельзя вводить внутривенно или внутримышечно.
Дозы
Для улучшения переносимости со стороны желудочно-кишечного тракта (ЖКТ) препарат Мелитид следует вводить в начальной дозе 0,6 мг 1 раз в сутки. После применения препарата в течение как минимум 1 недели дозу следует увеличить до 1,2 мг. С целью достижения лучшего гликемического контроля у пациента, после введения лираглутида в дозе 1,2 мг в течение минимум 1 недели, дозу препарата Мелитид можно увеличивать до 1,8 мг 1 раз в сутки. Применение препарата в суточной дозе выше 1,8 мг не рекомендуется. Препарат Мелитид можно применять в комбинированной терапии с другими препаратами, снижающими концентрацию глюкозы, без изменения дозы метформина, тиазолидиндиона и ингибитора НГЛТ-2.
При добавлении препарата Мелитид к терапии производными сульфонилмочевины или инсулином следует предусмотреть возможное снижение дозы производных сульфонилмочевины или инсулина с целью минимизации риска возникновения гипогликемий (см. раздел «Особые указания»).
Для коррекции дозы препарата Мелитид не требуется проведения самоконтроля концентрации глюкозы крови. Однако, в начале терапии препаратом Мелитид в комбинации с производными сульфонилмочевины или инсулином такой самоконтроль концентрации глюкозы крови может потребоваться для коррекции дозы производных сульфонилмочевины или инсулина.
Особые группы пациентов
Пациенты пожилого возраста (>65 лет)
Не требуется коррекции дозы в зависимости от возраста (см. подраздел «Фармакокинетика»).
Пациенты с почечной недостаточностью
Не требуется коррекции дозы у пациентов с почечной недостаточностью лёгкой, средней и тяжёлой степени. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует. Применение препарата Мелитид у таких пациентов противопоказано (см. подраздел «Фармакокинетика»).
Пациент ы с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести (см. подраздел «Фармакокинетика»). Препарат Мелитид не рекомендуется к применению у пациентов с печёночной недостаточностью тяжёлой степени.
Дети и подростки
Коррекция дозы для подростков и детей в возрасте 10 лет и старше не требуется. Данные по применению лираглутида у детей младше 10 лет отсутствуют.
Нарушения режима дозирования препарата
В случае пропуска дозы препарат Мелитид следует ввести как можно быстрее в пределах 12 часов с момента запланированного введения дозы.
Если продолжительность пропуска составляет более 12 часов, препарат Мелитид следует ввести на следующий день в запланированное время.
Не следует вводить на следующий день дополнительную или увеличенную дозу препарата Мелитид для компенсации пропущенной дозы.
В случае перерыва в терапии, если с момента введения последней дозы препарата прошло более 3 суток, начинать лечение вновь следует с дозы 0,6 мг 1 раз в сутки для смягчения любых возможных нежелательных реакций со стороны ЖКТ. После повторного начала лечения дозу препарата Мелитид следует титровать по рекомендации лечащего врача.
Побочное действие
Наиболее частыми нежелательными реакциями (HP), зарегистрированными в клинических исследованиях лираглутида, были нарушения со стороны ЖКТ (очень часто — тошнота, диарея; часто — рвота, запор, боль в животе, диспепсия); часто наблюдались головная боль и инфекции верхних дыхательных путей. HP со стороны ЖКТ могут возникать чаще в начале терапии лираглутидом, после нескольких дней или недель применения степень их выраженности обычно уменьшается. При применении лираглутида в комбинации с производными сульфонилмочевины часто и очень часто регистрировалась гипогликемия. На фоне такой комбинации также чаще отмечались эпизоды гипогликемии тяжёлой степени.
Ниже представлены возможные на фоне терапии лираглутидом HP, распределённые по системно-органным классам с указанием частоты их возникновения согласно рекомендации ВОЗ: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10 000, но <1/1 000) и очень редко (<1/10 000), частота неизвестна (на основании имеющихся данных оценить невозможно).
| Очень часто | Часто | Нечасто | Редко | Очень редко | |||||
| Инфекции и инвазии | |||||||||
|
| Инфекции верхних дыхательных путей |
|
|
| |||||
| Нарушения со стороны иммунной системы | |||||||||
|
|
|
| Анафилактические реакции |
| |||||
| Нарушения метаболизма и питания | |||||||||
|
| Гипокалиемия* | Дегидратация# |
|
| |||||
|
| Анорексия |
|
|
| |||||
|
| Снижение аппетита |
|
|
| |||||
| Нарушения со стороны нервной системы | |||||||||
|
| Головная боль |
|
|
| |||||
|
| Головокружение |
|
|
| |||||
| Нарушение со стороны сердца | |||||||||
|
| Увеличение ЧСС |
|
|
| |||||
| Желудочно-кишечные нарушения | |||||||||
| Тошнота | Рвота | Задержка опорожнения желудка | Кишечная непроходимость | Панкреатит (включая панкреонекроз) | |||||
| Диарея | Диспепсия |
|
|
| |||||
|
| Боли в верхней части живота |
|
|
| |||||
|
| Запор |
|
|
| |||||
|
| Гастрит |
|
|
| |||||
|
| Метеоризм |
|
|
| |||||
|
| Вздутие живота |
|
|
| |||||
|
| Гастроэзофагеаль-ная рефлюксная болезнь |
|
|
| |||||
|
| Отрыжка |
|
|
| |||||
| Нарушения со стороны печени и желчевыводящих путей | |||||||||
|
|
| Холелитиаз |
|
| |||||
|
|
| Холецистит |
|
| |||||
| Нарушения со стороны кожи и подкожных тканей | |||||||||
|
| Сыпь | Крапивница |
|
| |||||
|
|
| Зуд |
|
| |||||
| Нарушение со стороны почек и мочевыводящих путей | |||||||||
|
|
| Нарушение функции почек* |
|
| |||||
|
|
| Острая почечная и недостаточность |
|
| |||||
| Очень часто | Часто | Нечасто | Редко | Очень редко |
| ||||
| Общие нарушения и реакции в месте введения |
| ||||||||
|
| Повышенная утомляемость | Недомогание |
|
|
| ||||
|
| Реакции в месте введения |
|
|
|
| ||||
| Лабораторные и инструментальные данные |
| ||||||||
|
| Повышение активности липазы** |
|
|
|
| ||||
|
| Повышение активности амилазы** |
|
|
|
| ||||
* НР встречается очень часто при применении в комбинации с инсулином.
** Данные получены только в ходе клинических исследований IIIb и IV фазы, во время которых измерялись указанные параметры.
# см. «Особые указания»
Описание отдельных нежелательных реакций
Гипогликемия
Большинство эпизодов подтверждённой гипогликемии, зарегистрированных в ходе клинических исследований, были лёгкими.
Во время клинических исследований при применении лираглутида в виде монотерапии не отмечено случаев возникновения тяжёлой гипогликемии. Тяжёлые гипогликемии возникают нечасто и, главным образом, наблюдаются при применении лираглутида в комбинации с производными сульфонилмочевины (0,02 случая/пациента в год). При применении лираглутида в сочетании с другими ПГГП (не производными сульфонилмочевины) наблюдались отдельные случаи гипогликемии (0,001 случая/пациента в год). В ходе исследования LEADER® были зарегистрированы эпизоды тяжёлой гипогликемии, но частота их была меньшей при применении лираглутида по сравнению с плацебо (1,0 против 1,5 явлений на 100 пациенто-лет; соотношение 0,69 [0,51–0,93]) (см. подраздел «Оценка влияния на сердечно-сосудистую систему»).
При терапии лираглутидом в дозе 1,8 мг в комбинации с инсулином и метформином не было отмечено случаев тяжёлых гипогликемий. Частота случаев лёгкой гипогликемии составила 0,228 случая/пациента в год. В группах пациентов, получавших терапию лираглутидом 1,8 мг и метформином, частота случаев лёгкой гипогликемии составила 0,034 и 0,115 случая/пациента в год, соответственно.
Нежелательные реакции со стороны ЖКТ
В большинстве случаев тошнота имела лёгкий или умеренный характер, была преходящей и редко приводила к отмене терапии.
20,7 % пациентов, получавших лираглутид в комбинации с метформином, и 9,1 % пациентов, получавших лираглутид в комбинации с производными сульфонилмочевины, перенесли как минимум один эпизод тошноты. 12,6 % пациентов, получавших лираглутид в комбинации с метформином, и 7,9 % пациентов, получавших лираглутид в комбинации с производными сульфонилмочевины, перенесли как минимум один эпизод диареи.
В ходе долгосрочных контролируемых клинических исследований (26 недель или более) частота прекращения участия пациентов в исследовании из-за развития HP составила 7,8 % в группе пациентов, получавших лираглутид, и 3,4 % в группе пациентов, получавших препараты сравнения. Наиболее частыми HP, которые приводили к отмене лираглутида, были тошнота (2,8 % пациентов) и рвота (1,5 %).
У пациентов в возрасте старше 70 лет частота развития HP со стороны ЖКТ при применении лираглутида может быть выше.
При применении лираглутида у пациентов с лёгкой и средней степенью почечной недостаточности (КК 60–90 мл/мин и 30–59 мл/мин, соответственно) частота HP со стороны ЖКТ может быть выше.
Нарушения со стороны печени и желчевыводящих путей
Сообщалось о возникновении холангита и холестатической желтухи.
Холелитиаз и холецистит
В ходе долгосрочных контролируемых клинических исследований IIIa фазы сообщалось о нескольких случаях развития холелитиаза (0,4 %) и холецистита (0,1 %) у пациентов, получавших лираглутид. В ходе исследования LEADER® частота развития холелитиаза и холецистита составила 1,5 % и 1,1 % при применении лираглутида и 0,7 % при применении плацебо (см. подраздел «Оценка влияния на сердечно-сосудистую систему»).
Реакции в мест е введения
В ходе долгосрочных (26 недель или более) контролируемых исследований приблизительно у 2 % пациентов, получавших лираглутид, отмечались реакции в месте введения препарата. Эти реакции носили, как правило, лёгкий характер.
Панкреатит
Сообщалось о нескольких случаях развития острого панкреатита (<0,2 %) в ходе долгосрочных клинических исследований III фазы у пациентов, получавших лираглутид. Имеются сообщения о случаях развития панкреатита в пострегистрационном периоде. В ходе исследования LEADER® частота развития подтверждённого острого панкреатита составила 0,4 % при применении лираглутида и 0,5 % при применении плацебо (см. подраздел «Оценка влияния на сердечно-сосудистую систему»).
Аллергические реакции
В пострегистрационном периоде сообщалось о возникновении аллергических реакций, таких как крапивница, сыпь и зуд.
В пострегистрационном периоде при применении лираглутида описано несколько случаев анафилактических реакций, сопровождаемых такими симптомами, как артериальная гипотония, учащённое сердцебиение, одышка, периферические отеки.
Дети и подростки
В целом, частота развития, тип и степень тяжести нежелательных реакций у подростков и детей в возрасте 10 лет и старше были сравнимы с наблюдавшимися во взрослой популяции. Частота развития подтверждённых эпизодов гипогликемии была выше с лираглутидом (0,58 явления/пациенто-год) по сравнению с плацебо (0,29 явления/пациенто-год). В группе терапии лираглутидом не было отмечено эпизодов тяжёлой гипогликемии.
Передозировка
По данным клинических исследований и пострегистрационного применения лираглутида были зарегистрированы случаи передозировки с увеличением дозы до превышающей рекомендованную дозу в 40 раз (72 мг). Сообщалось о случаях тяжёлой тошноты, рвоты, диареи и тяжёлой гипогликемии.
В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Пациента следует наблюдать на предмет клинических признаков обезвоживания и контролировать концентрацию глюкозы крови.
Взаимодействие с другими лекарственными средствами
Оценка взаимодействия лекарственных средств in vitro
Лираглутид показал очень низкую способность к лекарственному фармакокинетическому взаимодействию, обусловленному метаболизмом в системе цитохрома Р-450 (CYP), а также связыванием с белками плазмы.
Оценка взаимодействия лекарственных средств in vivo
Небольшая задержка опорожнения желудка при применении лираглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Исследования лекарственного взаимодействия не показали какого-либо клинически значимого замедления всасывания этих препаратов, поэтому коррекции дозы не требуется. У нескольких пациентов, получавших лечение лираглутидом, отмечалось как минимум по одному эпизоду острой диареи. Диарея может оказывать влияние на всасывание пероральных лекарственных препаратов, которые применяются одновременно с препаратом Мелитид.
Варфарин и другие производные кумарина
Исследования по взаимодействию не проводились. Не может быть исключено клинически значимое взаимодействие с действующими веществами с низкой растворимостью или узким терапевтическим индексом, такими как варфарин. В начале лечения препаратом Мелитид у пациентов, получающих варфарин или другие производные кумарина, рекомендуется чаще проводить мониторинг Международного нормализованного отношения (МНО).
Парацетамол
Однократное применение парацетамола в дозе 1000 мг на фоне применения лираглутида не вызывает изменения системной экспозиции. Cmax парацетамола в плазме снизилась на 31 %, а среднее время достижения максимальной концентрации в плазме крови Tmax увеличилось на 15 минут. При одновременном применении препарата Мелитид и парацетамола коррекция дозы последнего не требуется.
Аторвастатин
Однократное применение аторвастатина в дозе 40 мг на фоне применения лираглутида не вызывает изменения системной экспозиции. Таким образом, на фоне применения препарата Мелитид коррекция дозы аторвастатина не требуется. Cmax аторвастатина в плазме снизилась на 38 %, а среднее значение Tmax в плазме на фоне применения лираглутида увеличилось с 1 до 3 часов.
Гризеофульвин
Однократное применение гризеофульвина в дозе 500 мг на фоне применения лираглутида не вызывает изменения системной экспозиции. Cmax гризеофульвина возросла на 37 %, в то время как среднее значение Tmax в плазме не изменилось. Коррекция дозы гризеофульвина и других лекарственных средств, имеющих низкую растворимость и высокую проницаемость, не требуется.
Дигоксин
При одновременном однократном введении дигоксина в дозе 1 мг и лираглутида отмечалось уменьшение площади под кривой AUC дигоксина на 16 %; Cmax дигоксина снизилась на 31 %. Среднее значение Tmax дигоксина в плазме увеличилось с 1 до 1,5 часов. Исходя из полученных результатов, коррекция дозы дигоксина не требуется.
Лизиноприл
Однократное применение лизиноприла в дозе 20 мг на фоне применения лираглутида привело к уменьшению площади под кривой AUC лизиноприла на 15 %; Cmax лизиноприла снизилась на 27 %. Среднее значение Tmax лизиноприла в плазме на фоне приёма лираглутида увеличилось с 6 до 8 часов. Исходя из полученных результатов, коррекция дозы лизиноприла не требуется.
Пероральные контрацептивы
Cmax этинилэстрадиола и левоноргестрела после их однократного применения на фоне терапии лираглутидом снизилась на 12 % и 13 %, соответственно. Применение обоих препаратов вместе с лираглутидом сопровождалось увеличением Tmax этих лекарственных средств на 1,5 часа. Клинически значимого эффекта на системную экспозицию этинилэстрадиола и левоноргестрела в организме лираглутид не оказывает. Таким образом, ожидаемый контрацептивный эффект обоих лекарственных средств на фоне терапии лираглутидом не изменяется.
Инсулин
Не было выявлено фармакокинетического или фармакодинамического взаимодействия лираглутида с инсулином при однократном введении инсулина детемир в дозе 0,5 ЕД/кг с лираглутидом в дозе 1,8 мг у пациентов с СД2.
Дети и подростки
Исследования взаимодействия были проведены только с участием взрослых.
Фармацевтическая несовместимость
Препарат Мелитид нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами, в связи с возможной деградацией лираглутида.
Особые указания
Применение препарата Мелитид противопоказано у пациентов с СД 1 типа или для лечения диабетического кетоацидоза.
Препарат Мелитид не заменяет инсулин.
Отсутствует опыт применения лираглутида у пациентов с ХСН IV функционального класса в соответствии с классификацией ХСН NYHA. Применение препарата Мелитид у таких пациентов противопоказано.
Опыт применения лираглутида у пациентов с воспалительными заболеваниями кишечника и диабетическим гастропарезом ограничен. Применение препарата Мелитид в данных группах пациентов противопоказано, так как ассоциируется с развитием преходящих HP со стороны ЖКТ, таких как тошнота, рвота и диарея.
Острый панкреатит
Применение агонистов ГПП-1 ассоциировалось с риском развития острого панкреатита. Пациенты должны быть информированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия лираглутидом должна быть немедленно прекращена. В случае подтверждения острого панкреатита терапию лираглутидом возобновлять не следует. При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Имеются ограниченные данные по применению лираглутида у пациентов с панкреатитом в анамнезе. Неизвестно, подвергаются ли пациенты с панкреатитом в анамнезе повышенному риску развития панкреатита при применении лираглутида. В связи с этим препарат Мелитид у таких пациентов следует применять с осторожностью (см. раздел «С осторожностью»).
Заболевания щитовидной железы
В ходе клинических исследований лираглутида у отдельных пациентов (в частности, у пациентов, уже имеющих заболевания щитовидной железы) сообщалось о HP со стороны щитовидной железы, включая повышение концентрации кальцитонина в сыворотке крови, зоб и новообразования щитовидной железы, в связи с этим препарат Мелитид у таких пациентов следует применять с осторожностью (см. раздел «С осторожностью»). В пострегистрационном периоде наблюдения у пациентов, получавших терапию лираглутидом, были зарегистрированы случаи медуллярного рака щитовидной железы. Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения медуллярного рака щитовидной железы с применением лираглутида у человека.
Необходимо проинформировать пациента о риске медуллярного рака щитовидной железы и о симптомах опухоли щитовидной железы (уплотнения в области шеи, дисфагия, одышка, непроходящая охриплость голоса).
При выявлении повышения концентрации кальцитонина в сыворотке крови необходимо провести дальнейшее обследование пациента. Пациенты с узлами щитовидной железы, выявленными при медосмотре или при УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Гипогликемия
Пациенты, получающие препарат Мелитид в комбинации с производными сульфонилмочевины или инсулином, имеют повышенный риск развития гипогликемии (см. раздел «Побочное деиствие»). Риск развития гипогликемии можно снизить, уменьшив дозу производных сульфонилмочевины или инсулина.
Дегидратация
В ходе проведения клинических исследований сообщалось о появлении признаков и симптомов дегидратации и почечной недостаточности у пациентов, получавших терапию лираглутидом. Пациенты, получающие препарат Мелитид, должны быть предупреждены о возможном риске обезвоживания в связи с HP со стороны ЖКТ и о необходимости соблюдения ими мер предосторожности, чтобы избежать развития гиповолемии.
Фертильность
За исключением незначительного уменьшения числа живых эмбрионов, в исследованиях на животных не было получено свидетельств неблагоприятного влияния на фертильность. Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
Влияние на способность управлять транспортными средствами, механизмами
Исследований влияния лираглутида на способность управлять транспортными средствами и работу с механизмами не проводилось. Маловероятно, что лираглутид может влиять на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Мелитид в комбинации с производными сульфонилмочевины или инсулином.
Руководство по использованию
Шприц-ручка Мелитид предназначена только для индивидуального использования.
Препарат Мелитид нельзя применять, если он выглядит иначе, чем прозрачная бесцветная или коричневого цвета жидкость.
Препарат Мелитид нельзя применять, если он подвергся замораживанию.
Препарат Мелитид можно вводить при помощи игл длиной до 8 мм и толщиной до 32G. Шприц-ручка предназначена для использования в комбинации с одноразовыми инъекционными иглами. Инъекционные иглы не включены в упаковку.
Пациент должен быть проинформирован о том, что использованную иглу следует выбрасывать после каждой инъекции, а так же о том, что нельзя хранить шприц-ручку с присоединённой иглой. Такая мера позволит предотвратить загрязнение, инфицирование и утечку препарата из шприц-ручки и гарантирует точность дозирования.
Форма выпуска
Раствор для подкожного введения, 6 мг/мл.
По 3 мл в картриджи бесцветного нейтрального стекла I гидролитического класса с плунжерами резиновыми из бромбутилкаучука, укупоренные колпачками алюминиевыми с прокладками резиновыми из бромбутилкаучука. Картридж помещают в держатель для картриджей из полипропилена с нанесённой шкалой объёмов. Картридж вместе с держателем помещают в мультидозовую одноразовую шприц-ручку для многократных инъекций. На каждую пластиковую мультидозовую одноразовую шприц-ручку для многократных инъекций наклеивают самоклеящуюся этикетку.
По 1, 2, 3 или 6 предварительно заполненных мультидозовых одноразовых шприц-ручек для многократных инъекций вместе с инструкцией по применению в пачку из картона. На пачку может быть нанесена голограмма производителя в качестве этикетки первого вскрытия.
Каждая предварительно заполненная мультидозовая одноразовая шприц-ручка (3 мл) для многократных инъекций содержит 30 доз по 0,6 мг, 15 доз по 1,2 мг или 10 доз по 1,8 мг лирагрутида.
Хранение
Хранить в недоступном для детей месте.
При температуре от 2 до 8 °C. Не замораживать.
После начала использования хранить шприц-ручку в холодильнике при температуре от 2 до 8 °C не более 1 месяца.
Закрывать шприц-ручку колпачком для защиты от света.
Препарат Метилид следует предохранять от воздействия избыточного тепла и света.
Срок годности
2 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
CinnaGen, Co., Иран
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Мелитид:
