Трулисити™
Лекарственная форма
раствор для подкожного введения
Состав
В 0,5 мл препарата содержится:
Для дозировки 0,75 мг:
Действующее вещество: дулаглутид 0,75 мг;
Вспомогательные вещества: лимонная кислота безводная 0,07 мг; маннитол 23,2 мг; полисорбат 80 (растительный) 0,10 мг; натрия цитрата дигидрат 1,37 мг; вода для инъекций q.s. до 0,5 мл.
Для дозировки 1,5 мг:
Действующее вещество: дулаглутид 1,5 мг;
Вспомогательные вещества: лимонная кислота безводная 0,07 мг; маннитол 23,2 мг; полисорбат 80 (растительный) 0,10 мг; натрия цитрата дигидрат 1,37 мг; вода для инъекций q.s. до 0,5 мл.
Описание
Прозрачный, бесцветный раствор.
Фармакологические свойства
Механизм действия
Дулаглутид является агонистом рецепторов глюкагоноподобного пептида 1 (ГПП-1) длительного действия. Его молекула состоит из двух идентичных цепей, связанных дисульфидными связями, каждая из которых содержит аналог модифицированного человеческого ГПП-1. ковалентно связанный с фрагментом тяжёлой цепи (Fc) модифицированного человеческого иммуноглобулина G4 (IgG4) с помощью небольшой полипептидной цепи. Часть дулаглутида, которая является аналогом ГПП-1, приблизительно на 90 % гомологична нативному человеческому ГПП-1. Период полувыведения (t½) нативного человеческого ГПП-1 вследствие расщепления дипептидилпептидазой-4 (ДПП-4) и почечного клиренса составляет 1,5–2 мин. В отличие от нативного ГПП-1 дулаглутида резистентен к расщеплению ДПП-4 и имеет большой размер, что замедляет абсорбцию и снижает почечный клиренс. Такие особенности строения обеспечивают растворимую форму и период полувыведения продолжительностью 4,7 дней, благодаря чему препарат подходит для подкожного введения 1 раз в неделю. Кроме того, молекула дулаглутида была создана с целью снижения иммунного ответа, опосредованного Fcγ-рецептором, и снижения иммуногенного потенциала.
Гипогликемический эффект дулаглутида обусловлен несколькими механизмами действия ГПП-1. При повышенной концентрации глюкозы дулаглутид увеличивает содержание внутриклеточного циклического аденозинмонофосфата (цАМФ) в бета-клетках поджелудочной железы, что приводит к увеличению секреции инсулина. Дулаглутид подавляет избыточную секрецию глюкагона у пациентов с сахарным диабетом 2 типа, что приводит к снижению выброса глюкозы печенью. Кроме того, дулаглутид замедляет скорость опорожнения желудка.
Фармакодинамика
У пациентов с сахарным диабетом 2 типа, начиная уже с первого введения, дулаглутид улучшает контроль гликемии за счёт устойчивого снижения концентрации глюкозы крови натощак, перед едой и после приёма пищи, которое поддерживается в течение недели до введения следующей дозы.
Фармакодинамическое исследование дулаглутида показало, что у пациентов с сахарным диабетом 2 типа наблюдалось восстановление первой фазы секреции инсулина до значения, наблюдаемого у здоровых лиц, получавших плацебо, и улучшение второй фазы секреции инсулина в ответ на внутривенное болюсное введение глюкозы. В том же исследовании было также показано, что при однократном введении дулаглутида в дозе 1,5 мг увеличивалась максимальная секреция инсулина β-клетками поджелудочной железы и улучшалась функция β-клеток у пациентов с сахарным диабетом 2 типа по сравнению с плацебо.
Фармакокинетический профиль и соответствующий фармакодинамический профиль дулаглутида позволяет вводить препарат 1 раз в неделю.
Клиническая эффективность и безопасность
Контроль гликемии
Безопасность и эффективность дулаглутида оценивали в ходе 6 рандомизированных контролируемых исследований III фазы, в которых приняли участие 5171 пациент с сахарным диабетом 2 типа. Из них 958 были в возрасте старше 65 лет, из которых 93 были в возрасте старше 75 лет. Данные исследования включали 3136 пациентов, которые получали дулаглутид, из них 1719 получали дулаглутид в дозе 1,5 мг 1 раз в неделю, а 1417 получали дулаглутид в дозе 0,75 мг 1 раз в неделю. Во всех исследованиях дулаглутид обеспечивал клинически значимое улучшение контроля гликемии, который оценивали по гликированному гемоглобину (HbAlc).
Монотерапия
Применение дулаглутида в монотерапии изучали в ходе клинического исследования с активным контролем продолжительностью 52 недели в сравнении с метформином. Эффективность дулаглутида при применении в дозах 1,5 мг или 0,75 мг 1 раз в неделю превосходила эффективность метформина в дозе 1500-2000 мг/сут в отношении снижения HbAlc и значимо большее число пациентов достигло целевого показателя HbAlc <7,0 % и ≤6,5 % при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю, чем при применении метформина через 26 недель.
Частота документированных случаев симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю и при применении метформина составила 0,62; 0,15 и 0,09 эпизодов/пациент/год соответственно. Случаев тяжёлой гипогликемии при применении дулаглутида не наблюдалось.
Терапия в комбинации с метформином
Безопасность и эффективность дулаглутида оценивали в плацебо-контролируемом и активно-контролируемом клиническом исследовании (ситаглиптин 100 мг/сут) продолжительностью 104 недели, в котором все препараты применяли в комбинации с метформином. Применение дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю через 52 недели приводило к большему снижению HbAlc по сравнению с применением ситаглиптина, при этом значимо большее число пациентов при применении дулаглутида достигло целевого показателя HbAlc <7,0 % и ≤6,5 %. Данные эффекты сохранялись до конца исследования (104 недели).
Частота документированной симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю и при применении ситаглиптина составила 0,19; 0,18 и 0,17 эпизодов/пациент/год соответственно. Случаев тяжёлой гипогликемии при применении дулаглутида не наблюдалось.
Безопасность и эффективность дулаглутида также оценивали в ходе активноконтролируемого исследования в сравнении с применением лираглутида в дозе 1,8 мг/сут (начальная доза 0,6 мг/сут; после 1 недели дозу повышали до 1,2 мг/сут, а затем на 2 неделе — до 1,8 мг/сут) продолжительностью 26 недель; оба препарата применяли в сочетании с метформином. Применение дулаглутида в дозе 1,5 мг 1 раз в неделю приводило к сопоставимому снижению HbAlc и числу пациентов, достигавших целевого показателя HbAlc <7,0 % и ≤6,5%, по сравнению с терапией лираглутидом.
Частота документированной симптоматической гипогликемии при применении дулаглутида в дозе 1,5 мг 1 раз в неделю составила 0,12 эпизодов/пациент/год, а при применении лираглутида — 0,29 эпизодов/пациент/год. Случаев тяжёлой гипогликемии не наблюдалось.
Терапия в комбинации с метформином и производными сульфонилмочевины
В исследовании с активным контролем продолжительностью 78 недель дулаглутид сравнивали с инсулином гларгин, оба препарата применялись в сочетании с метформином и производными сульфонилмочевины. Через 52 недели применение дулаглутида в дозе 1,5 мг 1 раз в неделю привело к достоверно большему снижению HbAlc по сравнению с применением инсулина гларгин, которое сохранялось и через 78 недель; тогда как снижение HbAlc при применении дулаглутида в дозе 0,75 мг 1 раз в неделю было сопоставимым со снижением HbAlc при применении инсулина гларгин. В группе применения дулаглутида в дозе 1,5 мг достоверно большее число пациентов достигло целевого HbAlc <7,0 % или ≤6,5 % через 52 и через 78 недель по сравнению с группой применения инсулина гларгин.
Частота документированных случаев симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю и при применении инсулина гларгин, составила 1,67; 1,67 и 3,02 эпизодов/пациент/год соответственно. При применении дулаглутида в дозе 1,5 мг 1 раз в неделю и при применении инсулина гларгин наблюдалось одинаковое количество случаев тяжёлой гипогликемии (по 2 случая).
Терапия в комбинации с метформином и пиоглитазоном
В плацебо-контролируемых исследованиях и исследованиях с активным контролем (доза эксенатида составляла 5 мкг 2 раза в сутки в течение первых 4 недель и 10 мкг 2 раза в сутки далее), при применении обоих препаратов в сочетании с метформином и пиоглитазоном, при введении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю продемонстрировано достоверно более значимое снижение HbAlc по сравнению с плацебо и эксенатидом, которое сопровождалось значимо большим числом пациентов, достигавших целевого показателя HbAlc <7,0 % или ≤6,5 %.
Частота документированных случаев симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю и при применении эксенатида 2 раза в сутки, составила 0,19; 0,14 и 0,75 эпизодов/пациент/год соответственно. При применении дулаглутида не наблюдалось случаев тяжёлой гипогликемии, при применении эксенатида было отмечено 2 случая тяжёлой гипогликемии.
Терапия в комбинации с инсулином, с метформином или без метформина
В клиническом исследовании пациенты, которые получали инсулин 1 или 2 раза в сутки до начала исследования, прекращали прежний режим терапии и были рандомизированы в группы применения дулаглутида 1 раз в неделю или инсулина гларгин 1 раз в сутки; оба режима терапии проводились в сочетании с прандиальным инсулином лизпро. вводимым 3 раза в сутки в комбинации с метформином или без метформина. Через 26 недель эффективность дулаглутида при применении в дозах 1,5 мг или 0,75 мг 1 раз в неделю превосходила эффективность инсулина гларгин в отношении снижения HbAlc, такой же эффект сохранялся и к 52 неделе исследования. Среднее изменение HbAlc для групп применения дулаглутида в дозе 1,5 мг или 0,75 мг 1 раз в неделю и группы применения инсулина гларгин 1 раз в сутки составило: -1,64 % [р<0,025], -1,59% [р<0,025] и -1,41 % соответственно, через 26 недель; -1,48 % [р<0,025], -1,42% [р<0,025] и -1,23 % соответственно, через 52 недели. Большее число пациентов при применении дулаглутида достигало целевого показателя HbAlc <7,0 % или ≤6,5 % через 26 недель и <7,0 % через 52 недели, чем при применении инсулина гларгин.
Частота документированных случаев симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг 1 раз в неделю и при применении инсулина гларгин, составила 31,06; 35,66 и 40,95 эпизодов/пациент/год соответственно. 10 пациентов сообщили о тяжёлой гипогликемии при применении дулаглутида в дозе 1,5 мг 1 раз в неделю, 7 пациентов — при применении дулаглутида в дозе 0,75 мг 1 раз в неделю, и 15 пациентов — при применении инсулина гларгин.
Концентрация глюкозы крови натощак
Применение дулаглутида приводило к достоверно большему снижению концентрации глюкозы крови натощак по сравнению с исходным значением. Основной эффект в отношении концентрации глюкозы крови натощак наблюдался через 2 недели. Улучшение концентрации глюкозы крови натощак сохранялось на протяжении самого длительного периода исследования — 104 недели.
Концентрация глюкозы крови после еды (постпрандиальная гликемия)
Применение дулаглутида приводило к значимому снижению средней постпрандиальной гликемии по сравнению с исходной (изменение гликемии от исходного значения до первичной временной точки составило от -1,95 ммоль/л до -4,23 ммоль/л).
Функция бета-клеток поджелудочной железы
Результаты клинических исследований показали улучшение функции бета-клеток поджелудочной железы при применении дулаглутида, определённое с помощью гомеостатической модели оценки (НОМА2-%В). Эффект в отношении функции бета-клеток сохранялся в течение самого длительного периода исследования — 104 недели.
Масса тела
При применении дулаглутида в дозе 1,5 мг 1 раз в неделю отмечалось устойчивое снижение массы тела на протяжении исследования (изменение среднего значения от исходного значения до финальной временной точки составило от -0,35 кг до -2,90 кг). Изменение массы тела при применении дулаглутида в дозе 0,75 мг 1 раз в неделю варьировало от 0,86 кг до -2,63 кг. Снижение массы тела наблюдалось у пациентов, которые получали дулаглутид, независимо от появления тошноты, хотя численно снижение было больше в группе пациентов, у которых наблюдалась тошнота.
Результаты, основанные на опросе пациентов
Дулаглутид значительно улучшал общий показатель удовлетворенности терапией по сравнению с терапией эксенатидом 2 раза в сутки. Кроме того, выявленная частота гипергликемии и гипогликемии при применении дулаглутида была значимо ниже, чем при применении эксенатида 2 раза в сутки.
Артериальное давление (АД)
Влияние дулаглутида на АД оценивали в ходе исследования с участием 755 пациентов с сахарным диабетом 2 типа с помощью амбулаторного контроля АД. Терапия дулаглутидом сопровождалась снижением систолического АД (разница -2,8 мм рт. ст. по сравнению с плацебо) через 16 недель. Разницы в диастолическом АД не наблюдалось. Сходные результаты для систолического и диастолического АД были показаны в конечной точке исследования — 26 недель.
Риск для сердечно-сосудистой системы
По результатам мета-анализа исследований II и III фазы у 51 пациента (дулаглутид: 26 (N = 3885); все препараты сравнения: 25 (N = 2125)) наблюдалось хотя бы одно явление со стороны сердечно-сосудистой системы (смерть, вызванная нарушениями со стороны сердечно-сосудистой системы; нелетальный инфаркт миокарда, нелетальный инсульт или госпитализация по причине нестабильной стенокардии). Результаты показали, что при применении дулаглутида риск нарушений со стороны сердечно-сосудистой системы не увеличивался по сравнению с терапией препаратами сравнения (отношение рисков: 0,57; доверительный интервал: (0,30; 1,10)).
Доклиническая безопасность
Доклинические исследования дулаглутида не выявили особого риска для человека согласно стандартным исследованиям фармакологической безопасности и токсичности многократных доз.
В ходе 6-месячного исследования канцерогенности на трансгенных мышах не наблюдалось онкогенного ответа. В ходе 2-летнего исследования канцерогенности на крысах при концентрации дулаглутида, в ≥7 раз превышающей терапевтическую дозу дулаглутида у человека, составляющую 1,5 мг 1 раз в неделю, дулаглутид вызывал значимое дозозависимое увеличение частоты С-клеточных опухолей щитовидной железы (аденомы и карциномы). Значимость таких результатов для человека на данный момент не известна.
В ходе исследований фертильности при дозах, которые ассоциировались со снижением потребления пищи и прироста массы тела у матери, наблюдалось снижение числа жёлтых тел и увеличение продолжительности эстрального цикла; однако влияния на показатели фертильности и зачатия или на эмбриональное развитие не наблюдалось. В ходе исследований репродуктивной токсичности у крыс и кроликов наблюдалось влияние на формирование скелета и снижение роста плода при экспозиции дулаглутида, которая в 11–44 раза превышала клиническую, но врождённых аномалий не наблюдалось. Введение дулаглутида крысам в течение периода беременности и лактации вызывало дефицит памяти у потомков женского пола при экспозиции, которая в 16 раз превышала предложенную клиническую экспозицию.
Фармакокинетика
Всасывание
После подкожного введения пациентам с сахарным диабетом 2 типа максимальная концентрация (Сmах) дулаглутида в плазме наблюдается через 48 ч. После многократного подкожного введения дулаглутида в дозе 1,5 мг пациентам с сахарным диабетом 2 типа средняя Сmах и площадь под кривой «концентрация–время» (AUC) составляли приблизительно 114 нг/мл и 14000 нгч/мл соответственно. Равновесная концентрация в плазме наблюдалась после 2–4 недель введения дулаглутида в дозе 1,5 мг 1 раз в неделю. Концентрации после подкожного введения однократной дозы дулаглутида (1,5 мг) в область живота, бедра или плеча были сопоставимы. Средняя абсолютная биодоступность дулаглутида после однократного подкожного введения в дозе 1,5 мг или 0,75 мг составляла 47 % и 65 % соответственно.
Распределение
После подкожного введения дулаглутида в дозах 0,75 мг или 1,5 мг пациентам с сахарным диабетом 2 типа в равновесном состоянии средний объём распределения составлял приблизительно 19,2 л и 17,4 л соответственно.
Метаболизм
Считается, что дулаглутид расщепляется на составляющие аминокислоты через основные пути катаболизма белков.
Выведение
Средний клиренс дулаглутида у человека в равновесном состоянии после введения в дозах 0,75 мг или 1,5 мг составлял 0,073 л/ч и 0,107 л/ч соответственно, с периодом полувыведения 4,5 и 4,7 дней соответственно.
Особые группы пациентов
Пациенты пожилого возраста (старше 65 лет)
Возраст пациента не оказывал клинически значимого влияния на фармакокинетические и фармакодинамические свойства дулаглутида.
Пол и расовая принадлежность
Пол и расовая принадлежность не оказывали клинически значимого влияния на фармакокинетику дулаглутида.
Масса тела или индекс массы тела
Фармакокинетический анализ показал статистически значимую обратную связь между массой тела или индексом массы тела (ИМТ) и терапией дулаглутидом, однако клинически значимого влияния массы тела или ИМТ на контроль гликемии отмечено не было.
Пациенты с нарушением функции почек
Фармакокинетику дулаглутида оценивали в ходе клинико-фармакологического исследования, в целом она была сходной у здоровых участников и у пациентов с нарушением функции почек от лёгкой до тяжёлой степени (клиренс креатинина <30 мл/мин), включая терминальную стадию почечной недостаточности (при проведении гемодиализа). В клинических исследованиях профиль безопасности дулаглутида у пациентов с нарушением функции почек средней степени был сходен с профилем безопасности в общей популяции пациентов с сахарным диабетом 2 типа. Данные исследования не включали пациентов с тяжёлым нарушением функции почек или с терминальной стадией почечной недостаточности.
Пациенты с нарушением функции печени
Фармакокинетику дулаглутида оценивали в ходе клинико-фармакологического исследования, в котором у пациентов с нарушением функции печени наблюдалось статистически значимое снижение средних значений Сmах и AUC на 30 % и 33 % соответственно, по сравнению со здоровыми пациентами. При ухудшении функции печени увеличивалось время достижения Cmax (tmax) дулаглутида. Фармакокинетические показатели дулаглутида не зависели от степени нарушения функции печени. Такие изменения не считались клинически значимыми.
Дети
Исследования фармакокинетики дулаглутида у детей не проводились.
Показания
Препарат Трулисити™ показан у взрослых пациентов с сахарным диабетом 2 типа с целью улучшения гликемического контроля в виде:
• Монотерапии
В случае, если диета и физические упражнения не обеспечивают необходимого гликемического контроля у пациентов, которым не показано применение метформина по причине непереносимости или наличия противопоказаний.
• Комбинированной терапии
В сочетании с другими гипогликемическими препаратами, включая инсулин, если данные препараты вместе с диетой и физическими упражнениями не обеспечивают необходимого гликемического контроля.
Противопоказания
- Гиперчувствительность к активному или любому из вспомогательных веществ, входящих в состав препарата;
- сахарный диабет 1 типа;
- диабетический кетоацидоз;
- тяжёлые нарушения функции почек;
- хроническая сердечная недостаточность;
- беременность;
- период грудного вскармливания;
- тяжёлые заболевания желудочно-кишечного тракта, в том числе тяжёлый парез желудка;
- острый панкреатит;
- детский возраст до 18 лет.
С осторожностью
У пациентов, принимающих пероральные препараты, которые требуют быстрого всасывания в желудочно-кишечном тракте; у пациентов в возрасте 75 лет и старше.
Беременность и лактация
Беременность
Данные о применении дулаглутида у беременных женщин отсутствуют или их объём ограничен. Исследования на животных показали наличие репродуктивной токсичности, поэтому применение дулаглутида противопоказано во время беременности.
Грудное вскармливание
Сведения о проникновении дулаглутида в грудное молоко отсутствуют. Нельзя исключить риск для новорождённых/грудных детей. Применение дулаглутида в период грудного вскармливания противопоказано.
Способ применения и дозы
Препарат Трулисити™ следует вводить подкожно в область живота, бедра или плеча. Препарат нельзя вводить внутривенно или внутримышечно.
Препарат можно вводить в любое время суток вне зависимости от приёма пищи.
Монотерапия
Рекомендуемая доза составляет 0,75 мг 1 раз в неделю.
Комбинированная терапия
Рекомендуемая доза составляет 1,5 мг 1 раз в неделю.
У пациентов в возрасте 75 лет и старше рекомендованная начальная доза препарата составляет 0,75 мг 1 раз в неделю.
При добавлении дулаглутида к текущей терапии метформином и/или пиоглитазоном приём метформина и/или пиоглитазона можно продолжать в той же дозе.
При добавлении дулаглутида к текущей терапии производными сульфонилмочевины или прандиальным инсулином может потребоваться снижение дозы производного сульфонилмочевины или прандиального инсулина для уменьшения риска развития гипогликемии.
Дополнительно контроля гликемии для коррекции дозы дулаглутида не требуется. Дополнительный контроль гликемии может потребоваться для коррекции дозы производных сульфонилмочевины или прандиального инсулина.
Пропуск дозы
Если доза препарата Трулисити™ была пропущена, её следует ввести как можно скорее, если до введения следующей запланированной дозы осталось не менее 3 дней (72 ч). Если до введения следующей запланированной дозы остаётся менее 3 дней (72 ч), необходимо пропустить введение препарата и ввести следующую дозу в соответствии с графиком. В каждом случае пациенты могут возобновить обычный режим введения препарата 1 раз в неделю.
День введения препарата при необходимости можно изменить при условии, что последняя доза была введена не менее 3 дней (72 часов) назад.
Пациенты пожилого возраста (старше 65 лет)
Коррекции дозы в зависимости от возраста не требуется. Однако опыт терапии пациентов в возрасте ≥75 лет очень ограничен, у таких пациентов рекомендованная начальная доза препарата составляет 0,75 мг 1 раз в неделю.
Пациенты с нарушением функции почек
У пациентов с нарушением функции почек лёгкой или средней степени тяжести коррекции дозы не требуется. Имеется очень ограниченный опыт применения дулаглутида у пациентов с тяжёлым нарушением функции почек (расчётная скорость клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2) или терминальной стадией почечной недостаточности, поэтому применение дулаглутида в данной популяции не рекомендовано.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени коррекции дозы не требуется.
Дети
Безопасность и эффективность применениядулаглутида у детей младше 18 лет не установлена. Данные отсутствуют.
Побочные эффекты
Обзор профиля безопасности
В ходе проведённых клинических исследований II и III фазы 4006 пациентов получали дулаглутид в виде монотерапии или в сочетании с другими гипогликемическими препаратами. Наиболее частыми нежелательными реакциями в клинических исследованиях были реакции со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. В целом, данные реакции были лёгкими или умеренными и временными по характеру.
Приведённые ниже нежелательные реакции были выявлены в ходе оценки результатов клинических исследований II и III фазы; они указаны в таблице в соответствии с поражением органов и систем органов в порядке уменьшения частоты (очень часто: ≥1/10; часто: ≥1/100 — <1/10; нечасто: ≥1/1000 — <1/100; редко: ≥1/10000 — <1/1000; очень редко: <1/10000). Внутри каждой категории нежелательные реакции представлены в порядке уменьшения частоты.
| Органы и системы органов | Очень часто | Часто | Нечасто | Редко |
| Нарушения обмена веществ и питания | Гипогликемия* (при применении в сочетании с прандиальным инсулином, метформином† или метформином и глимепиридом) | Гипогликемия* (при применении в качестве монотерапии или в сочетании с метформином плюс пиоглитазон) | ||
| Нарушения со стороны желудочно-кишечного тракта | Тошнота, диарея, рвота†, боль в животе† | Снижение аппетита, диспепсия, запор, метеоризм, вздутие живота, гастроэзофагеальная рефлюксная болезнь, отрыжка | Острый панкреатит | |
| Общие расстройства и нарушения в месте введения | Слабость | Реакции в месте ведения | ||
| Лабораторные и инструментальные данные | Синусовая тахикардия, атриовентрикулярная блокада (AVB) первой степени |
* Документированная симптоматическая гипогликемия и концентрация глюкозы крови ≤3,9 ммоль/л.
† Только для дулаглутида в дозе 1,5 мг. Частота нежелательных реакций для дулаглутида в дозе 0,75 мг соответствует более низкой категории.
Описание отдельных нежелательных реакций
Гипогликемия
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в виде монотерапии или в сочетании с метформином или метформином и пиоглитазоном частота документированной симптоматической гипогликемии составляла от 5,9 % до 10,9% или от 0,14 до 0,62 явлений/пациент/год, случаев тяжёлой гипогликемии не отмечалось.
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в сочетании с производными сульфонилмочевины (плюс метформин) частота документированной симптоматической гипогликемии составляла 39,0 % и 40,3% или 1,67 и 1,67 явлений/пациент/год соответственно. Частота явлений тяжёлой гипогликемии составляла 0 % и 0,7% или 0,00 и 0,01 явлений/пациент/год соответственно.
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в сочетании с прандиальным инсулином частота гипогликемии составляла 85,3 % и 80,0% или 35,66 и 31,06 явлений/пациент/год соответственно. Частота явлений тяжёлой гипогликемии составляла 2,4 % и 3,4% или 0,05 и 0,06 явлений/пациент/год соответственно.
Нежелательные реакции со стороны желудочно-кишечного тракта
Совокупная отчетность о явлениях со стороны желудочно-кишечного тракта в течение периода до 104 недель при применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю соответственно, включали тошноту (12,9 % и 21,2%), диарею (10,7 % и 13,7%) и рвоту (6,9% и 11,5 %). Обычно они имели лёгкую или умеренную степень тяжести, их максимальная частота отмечалась в течение первых 2-х недель терапии и быстро снижалась в течение следующих 4-х недель, после чего частота оставалась относительно постоянной.
В клинико-фармакологических исследованиях, которые проводились с участием пациентов с сахарным диабетом 2 типа и продолжались до 6 недель, большинство явлений со стороны желудочно-кишечного тракта отмечались в течение первых 2-3-х дней после приёма первой дозы, их частота снижалась при применении следующих доз.
Острый панкреатит
Частота острого панкреатита в клинических исследованиях II и III фазы составила 0,07 % при применении дулаглутида по сравнению с 0,14 % при применении плацебо и 0,19 % при применении препаратов сравнения, при дополнительной базовой гипогликемической терапии или без неё.
Ферменты поджелудочной железы
Применение дулаглутида связано со средним увеличением активности ферментов поджелудочной железы (липазы и/или панкреатической амилазы) на 11-21 % по сравнению с исходными показателями. В отсутствие других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором для развития острого панкреатита.
Увеличение частоты сердечных сокращении
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю наблюдалось небольшое среднее увеличение частоты сердечных сокращений на 2-4 удара в минуту (уд/мин) и частоты синусовой тахикардии на 1,3 % и 1,4% соответственно, которая сопровождалась увеличением по сравнению с исходным показателем на >15 уд/мин.
Атриовентрикулярная блокада Ⅰ степени/увеличение интервала PR
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю наблюдалось небольшое среднее увеличение интервала PR на 2-3 мс, по сравнению с исходным показателем, и частоты атриовентрикулярной блокады I степени на 1,5 % и 2,4% соответственно.
Иммуногенность
В ходе клинических исследований применение дулаглутида сопровождалось выявлением появившихся в ходе терапии антител к дулаглутиду с частотой 1,6 %, что указывает на то, что структурные изменения в ГПП-1 и модифицированные участки IgG4 в молекуле дулаглутида наряду с высокой гомологичностью нативному ГПП-1 и нативному IgG4 минимизируют риск развития иммунного ответа при терапии дулаглутидом. Пациенты, у которых вырабатывались антитела к дулаглутиду, обычно имели низкий титр антител; тем не менее, несмотря на небольшое число пациентов, у которых формировались антитела к дулаглутиду, оценка результатов клинических исследований III фазы не выявила явного влияния антител к дулаглутиду на изменение показателя HbAlc.
Гиперчувствительность
В клинических исследованиях II и III фазы явления системной гиперчувствительности (тяжёлая крапивница, обширные высыпания, отёк лица, отёк губ) наблюдались у 0,5 % пациентов, которые получали дулаглутид. Ни у одного пациента с системной гиперчувствительностью не вырабатывались антитела к дулаглутиду.
Реакции в месте введения
Реакции в месте введения наблюдались у 1,9 % пациентов, получавших дулаглутид. Потенциально иммуноопосредованные нежелательные явления в месте инъекции (например, сыпь, эритема) отмечались у 0,7 % пациентов и обычно были лёгкими.
Досрочное прекращение участия в клинических исследованиях по причине нежелательного явления
В ходе исследований продолжительностью 26 недель частота досрочного прекращения участия по причине нежелательных явлений составляла 2,6 % (0,75 мг 1 раз в неделю) и 6,1 % (1,5 мг 1 раз в неделю) при применении дулаглутида по сравнению с 3,7 % при применении плацебо. На всем протяжении исследования (до 104 недель) частота досрочного прекращения участия по причине нежелательных явлений при применении дулаглутида составляла 5,1 % (0,75 мг 1 раз в неделю) и 8,4 % (1,5 мг 1 раз в неделю). Наиболее частыми нежелательными реакциями, которые вели к досрочному прекращению участия в группах применения дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю, были тошнота (1,0 % и 1,9%), диарея (0,5% и 0,6 %) и рвота (0,4% и 0,6%), в основном такие реакции отмечались в течение первых 4–6 недель терапии.
Передозировка
Симптомы передозировки дулаглутида в клинических исследованиях включали нарушения со стороны желудочно-кишечного тракта и гипогликемию.
Лечение
В случае передозировки необходимо начать симптоматическую терапию в соответствии с клиническими признаками и симптомами.
Взаимодействие
Дулаглутид вызывает задержку скорости опорожнения желудка, следовательно, обладает способностью воздействовать на всасывание пероральных препаратов при одновременном применении. Дулаглутид следует применять с осторожностью у пациентов, принимающих пероральные препараты, которые требуют быстрого всасывания в желудочно-кишечном тракте. Задержка скорости опорожнения желудка может незначительно увеличить экспозицию препаратов с замедленным высвобождением за счёт увеличения времени высвобождения препарата.
Парацетамол
После введения первой дозы дулаглутида в дозах 1 или 3 мг Сmах парацетамола снижалась на 36 % и 50% соответственно, а медиана tmax достигалась позднее (через 3 и 4 ч соответственно). После одновременного применения с дулаглутидом в дозе до 3 мг в равновесном состоянии не наблюдалось статистически значимой разницы значений AUC (0-12) (площадь под кривой «концентрация–время» от 0 до 12 ч), Сmах или tmax парацетамола. При применении с дулаглутидом коррекции дозы парацетамола не требуется.
Аторвастатин
Одновременное применение дулаглутида с аторвастатином вызывало снижение Сmax и AUC(0-∞) аторвастатина и его основного метаболита o-гидроксиаторвастатина до 70 % и 21% соответственно. Средний t½ аторвастатина и o-гидроксиаторвастатина после введения дулаглутида увеличивался на 17 % и 41% соответственно. Такие изменения не считаются клинически значимыми. При совместном применении с дулаглутидом коррекции дозы аторвастатина не требуется.
Дигоксин
После одновременного применения дигоксина в равновесном состоянии с двумя последовательными дозами дулаглутида общая экспозиция (AUCτ) и tmax дигоксина не изменялись; Сmах снижалась на 22 % максимально. Считается, что такое изменение не имеет клинических последствий. При применении с дулаглутидом коррекции дозы дигоксина не требуется.
Гипотензивные препараты
Одновременное применение многократных доз дулаглутида с лизиноприлом в равновесном состоянии не вызывало клинически значимых изменений AUC или Cmax лизиноприла. Статистически значимая задержка tmax лизиноприла приблизительно на 1 ч наблюдалась в 3 и 24 дни исследования. При одновременном применении однократной дозы дулаглутида с метопрололом AUC или Сmах метопролола увеличивались на 19 % и 32% соответственно. Несмотря на то, что tmax метопролола достигалось на 1 ч позже, такое изменение не было статистически значимым. Данные изменения не считались значимыми с клинической точки зрения; таким образом, коррекции дозы лизиноприла или метопролола при применении с дулаглутидом не требуется.
Варфарин
После одновременного применения с дулаглутидом концентрация S- и R-варфарина, а также Сmах R-варфарина не изменялись, а Сmах S-варфарина снижалась до 22 %. площадь под кривой «концентрация–время» для международного нормализованного отношения (AUCМНО) увеличивалась на 2 %, что, вероятно, не имеет клинического значения, влияния на максимальное значение международного нормализованного отношения (МНОmах) не наблюдалось. Время ответа по международному нормализованному отношению (tMHOmax) удлинялось на 6 ч, что согласуется с задержкой tmax приблизительно на 4 и 6 ч для S- и R-варфарина соответственно. Такие изменения не считаются клинически значимыми. Коррекции дозы варфарина при применении с дулаглутидом не требуется.
Пероральные контрацептивы
Одновременное применение дулаглутида с пероральными контрацептивами (норгестимат 0,18 мг/этинилэстрадиол 0,025 мг) не оказывало влияния на общую экспозицию норэлгестромина и этинилэстрадиола. Для норэлгестромина и этинилэстрадиола наблюдалось статистически значимое снижение Сmах на 26 % и 13 % и задержка tmax на 2 и 0,30 ч соответственно. Такие наблюдения не считаются клинически значимыми. Коррекции дозы пероральных контрацептивов при применении с дулаглутидом не требуется.
Метформин
После одновременного применения многократных доз дулаглутида и метформина с обычным высвобождением в равновесном состоянии AUCτ увеличивалась до 15 %, а Сmах снижалась до 12 %, tmax не изменялось. Такие изменения соответствуют задержке опорожнения желудка, которую вызывает дулаглутид, и находятся в пределах вариабельности фармакокинетики метформина и поэтому не считаются клинически значимыми. Коррекции дозы метформина обычного высвобождения при одновременном применении с дулаглутидом не требуется.
Ситаглиптин
При одновременном применении с однократной дозой дулаглутида концентрация ситаглиптина не изменялась. После одновременного применения с двумя последовательными дозами дулаглутида AUC(0-τ) и Сmах ситаглиптина снижались приблизительно на 7,4 % и 23,1% соответственно. tmax ситаглиптина увеличивалось приблизительно на 0,5 ч после одновременного применения с дулаглутидом по сравнению с монотерапией ситаглиптином.
Ситаглиптин может вызывать ингибирование на 80 % ДПП-4 в течение 24 ч. При одновременном применении дулаглутида и ситаглиптина экспозиция и Cmaxдулаглутида увеличивались приблизительно на 38 % и 27% соответственно, а медианное tmax увеличивалось примерно до 24 ч. Таким образом, дулаглутид обладает высокой степенью защиты от инактивации ДПП-4.
Особые указания
Дулаглутид не рекомендуется применять у пациентов с сахарным диабетом 1 типа или для лечения диабетического кетоацидоза.
Нарушения со стороны желудочно-кишечного тракта
Применение агонистов рецепторов ГПП-1 может быть связано с нежелательными реакциями со стороны желудочно-кишечного тракта. Это следует учитывать при применении дулаглутида у пациентов с нарушением функции почек, так как диспептические явления (тошнота, рвота и/или диарея) могут вызвать обезвоживание, которое может привести к ухудшению функции почек. Применение дулаглутида у пациентов с тяжёлыми заболеваниями желудочно-кишечного тракта, включая тяжёлый парез желудка, не изучалось, поэтому препарат не рекомендован данной группе пациентов.
Острый панкреатит
Применение агонистов рецепторов ГПП-1 связано с риском развития острого панкреатита. В клинических исследованиях отмечались случаи острого панкреатита, связанные с терапией дулаглутидом.
Пациентов следует информировать о характерных симптомах острого панкреатита, включая постоянные сильные боли в области живота. При подозрении на панкреатит терапию дулаглутидом следует прекратить. При подтверждении диагноза панкреатита дулаглутид следует отменить без возобновления терапии. В отсутствие других признаков и характерных симптомов острого панкреатита повышение активности ферментов поджелудочной железы само по себе не является прогностическим фактором для острого панкреатита.
Гипогликемия
У пациентов, получающих дулаглутид одновременно с производными сульфонилмочевины или инсулином, может быть повышен риск гипогликемии. Риск гипогликемии можно снизить за счёт уменьшения дозы производных сульфонилмочевины или инсулина.
Неизученные группы пациентов
Опыт применения дулаглутида у пациентов с хронической сердечной недостаточностью ограничен.
Содержание натрия
Препарат содержит менее 1 ммоль натрия (23 мг) на дозу 1,5 мг, то есть практически не содержит натрия.
Фертильность
Данные о влиянии дулаглутида на фертильность у человека отсутствуют. У крыс не наблюдалось прямого влияния на спаривание или фертильность после применения дулаглутида.
РУКОВОДСТВО ПО ИСПОЛЬЗОВАНИЮ ТРУЛИСИТИ™
Дулаглутид
Раствор для подкожного введения 0,75 мг/0,5 мл в шприц-ручке для однократного применения один раз в неделю

ИНФОРМАЦИЯ О ШПРИЦ-РУЧКЕ ДЛЯ ОДНОКРАТНОГО ПРИМЕНЕНИЯ ПРЕПАРАТА ТРУЛИСИТИ™
Пожалуйста, внимательно и полностью прочитайте данное Руководство по использованию и Инструкцию по медицинскому применению препарата перед использованием шприц-ручки для однократного применения препарата ТРУЛИСИТИ™. Поговорите с Вашим лечащим врачом о том, как правильно вводить препарат ТРУЛИСИТИ™.
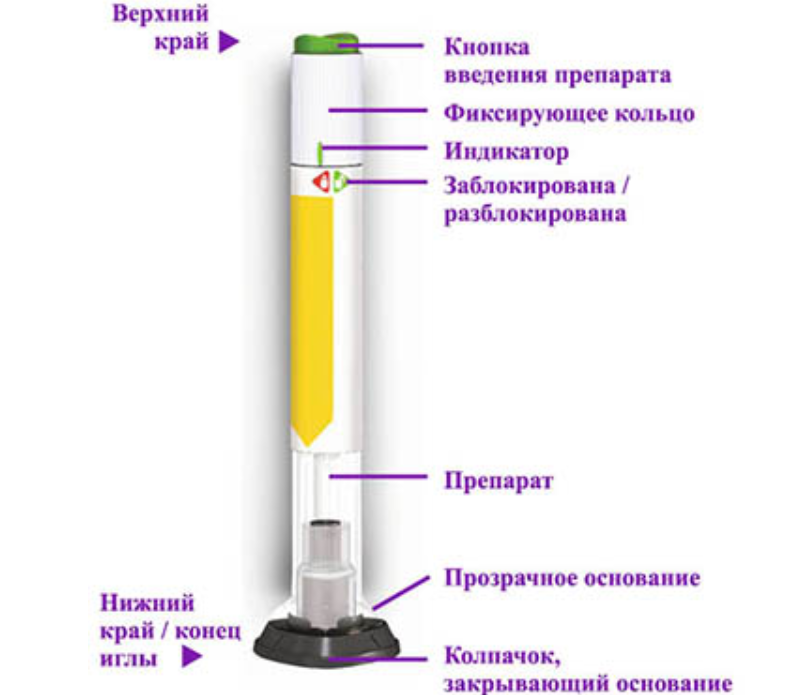
- Шприц-ручка для однократного применения препарата ТРУЛИСИТИ™ (шприц-ручка) представляет собой одноразовое предзаполненное устройство для введения препарата, готовое к использованию. Каждая шприц-ручка содержит одну еженедельную дозу препарата ТРУЛИСИТИ™ (0,75 мг/0,5 мл). Каждая шприц-ручка предназначена для введения только одной дозы.
- Препарат ТРУЛИСИТИ™ вводят один раз в неделю. Возможно, Вы захотите сделать пометку в Вашем календаре, чтобы не забыть о введении следующей дозы.
- Когда Вы нажимаете на зелёную кнопку введения препарата, шприц-ручка автоматически вводит иглу в кожу, вводит препарат и извлекает иглу после завершения инъекции.
ПЕРЕД ТЕМ КАК ПРИСТУПИТЬ К ИСПОЛЬЗОВАНИЮ:
- Достаньте из холодильника.
- Проверьте маркировку, чтобы убедиться, что Вы взяли правильный препарат, и что его срок годности не истёк.
- Осмотрите шприц-ручку. Не используйте её, если Вы заметили, что шприц-ручка повреждена или препарат мутный, изменил цвет или содержит частицы.
- Подготовьтесь, вымыв руки.
ВЫБЕРИТЕ МЕСТО ДЛЯ ВВЕДЕНИЯ
Ваш лечащий врач может помочь выбрать место для введения, которое наилучшим образом Вам подходит.
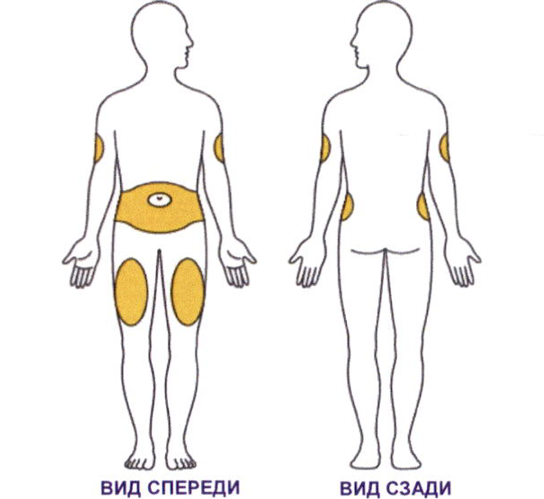
- Вы можете вводить препарат в область живота или бедра.
- Другой человек может сделать Вам инъекцию в область плеча.
Меняйте (чередуйте) места введения препарата каждую неделю. Вы можете использовать один и тот же участок, но обязательно выбирайте разные точки для инъекции.
- СНИМИТЕ КОЛПАЧОК
- РАСПОЛОЖИТЕ И РАЗБЛОКИРУЙТЕ
- НАЖМИТЕ И УДЕРЖИВАЙТЕ (см. рис. 3)
1. СНИМИТЕ КОЛПАЧОК
! Убедитесь, что шприц-ручка заблокирована.
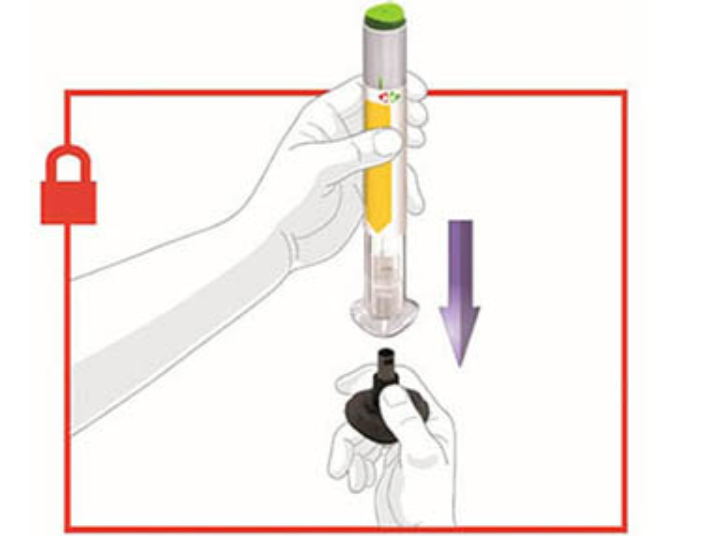
- Снимите и выбросьте серый колпачок, закрывающий основание.
Не надевайте колпачок обратно, это может повредить иглу. Не прикасайтесь к игле.
2. РАСПОЛОЖИТЕ И РАЗБЛОКИРУЙТЕ
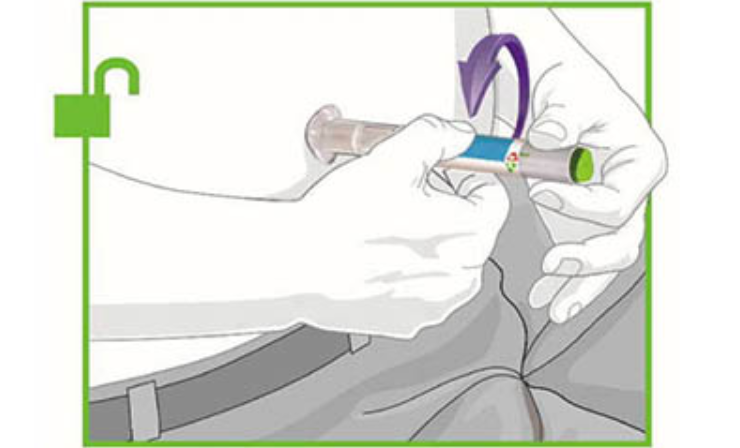
- Плотно прижмите прозрачное основание к поверхности кожи в месте инъекции.
! Разблокируйте, повернув фиксирующее кольцо.
3. НАЖМИТЕ И УДЕРЖИВАЙТЕ
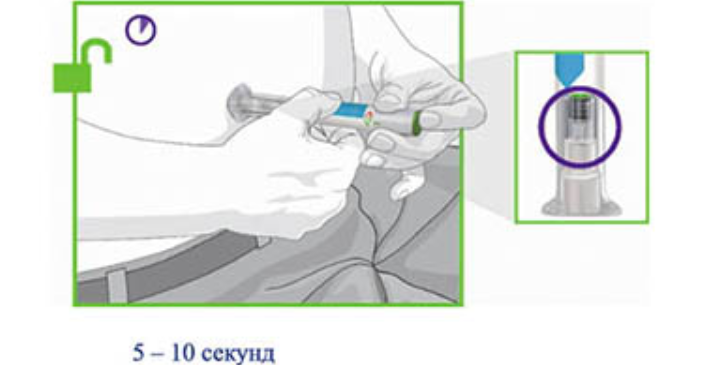
- Нажмите и удерживайте зелёную кнопку введения препарата; Вы услышите громкий щелчок.
! Продолжайте плотно прижимать прозрачное основание к коже, пока не услышите второй щелчок. Это произойдёт, когда игла начнёт втягиваться обратно, приблизительно через 5–10 секунд.
- Уберите шприц-ручку с кожи.
- Вы узнаете о том, что инъекция завершена, когда станет видна серая часть механизма.
ВАЖНАЯ ИНФОРМАЦИЯ:
- Хранение и обращение
- Утилизация шприц-ручки
- Часто задаваемые вопросы
- Другая информация
- Где найти дополнительную информацию
ХРАНЕНИЕ И ОБРАЩЕНИЕ
- В шприц-ручке имеются стеклянные детали. Обращайтесь с устройством аккуратно. Если Вы уроните его на твёрдую поверхность, не пользуйтесь им. Используйте для инъекции новую шприц-ручку.
- Храните шприц-ручку в холодильнике.
- Если после приобретения в аптеке хранение в холодильнике невозможно, Вы можете хранить шприц-ручку при температуре не выше 30 °C не более 14 дней.
- Не замораживайте шприц-ручку. Если шприц-ручка была заморожена, НЕ ИСПОЛЬЗУЙТЕ ЕЁ.
- Храните шприц-ручку в оригинальной картонной упаковке для защиты от света.
- Храните шприц-ручку в местах, недоступных для детей.
- Полную информацию о надлежащих условиях хранения читайте в Инструкции по медицинскому применению препарата.
УТИЛИЗАЦИЯ ШПРИЦ-РУЧКИ
- Утилизируйте шприц-ручку в контейнере для острых предметов или как рекомендовано Вашим лечащим врачом.
- Не подвергайте повторной переработке заполненный контейнер для острых предметов.
- Спросите Вашего лечащего врача о возможных способах утилизации препаратов, которые Вы больше не используете.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
- Что делать, если я замечу пузырек воздуха в шприц-ручке?
Наличие пузырьков воздуха является нормой. Они не причинят Вам вреда и не повлияют на Вашу дозу.
- Что делать, если я разблокирую ручку и нажму на зеленую кнопку введения препарата, не сняв колпачок с основания?
Не снимайте колпачок с основания и не используйте шприц-ручку. Выбросьте шприц-ручку как указано в Руководстве по использованию. Введите препарат с помощью другой шприц-ручки.
- Что делать, если на кончике иглы видна капля жидкости, когда я снимаю колпачок с основания?
Капля жидкости на кончике иглы не является чем-то необычным и не повлияет на Вашу дозу.
- Нужно ли удерживать кнопку введения препарата до завершения инъекции?
Это не обязательно, но может помочь плотно и неподвижно прижимать шприц-ручку к поверхности кожи.
- Я услышал(-а) более двух щелчков во время инъекции: два громких щелчка и один тихий. Был ли препарат введен полностью?
Некоторые пациенты могут услышать тихий щелчок непосредственно перед вторым громким щелчком. Это нормально для шприц-ручки. Продолжайте прижимать шприц-ручку к поверхности кожи, пока не услышите второй громкий щелчок.
- Что делать, если после инъекции на коже осталась капля жидкости или крови?
Это не является чем-то необычным и не повлияет на Вашу дозу.
- Я не уверен(-а), что шприц-ручка работает правильно.
Проверьте, ввели ли Вы полную дозу. Доза введена правильно, если видна серая часть механизма. (См. шаг 3.) Свяжитесь с Московским Представительством АО "Эли Лилли Восток С. А.", Швейцария по телефону +7-495-258-50-01 или с Вашим лечащим врачом для получения дальнейших указаний. До тех пор храните шприц-ручку так, чтобы избежать случайного укола иглой.
ДРУГАЯ ИНФОРМАЦИЯ
- Если у Вас имеются нарушения зрения, НЕ используйте шприц-ручку для однократного применения препарата ТРУЛИСИТИ™ без помощи специально обученного её использованию лица.
ГДЕ НАЙТИ ДОПОЛНИТЕЛЬНУЮ ИНФОРМАЦИЮ
- Если у вас возникнут вопросы или проблемы при использовании шприц-ручки для однократного применения препарата ТРУЛИСИТИ™. свяжитесь с Московским Представительством АО "Эли Лилли Восток С. А.", Швейцария по телефону +7-495-258-50-01 или с Вашим лечащим врачом.
Название и адрес производителя:
«Эли Лилли энд Компани», США "Eli Lilly and Company", USA
Эли Лилли энд Компани, Корпоративный центр Лилли, Индианаполис, Индиана 46285, США
Eli Lilly and Company, Lilly Corporate Center, Indianapolis, Indiana 46285, USA Представительство в России:
Московское Представительство АО "Эли Лилли Восток С. А.", Швейцария 123317, Москва, Пресненская наб., д. 10 тел. +7 (495) 258-50-01 факс +7 (495) 258-50-05
ТРУЛИСИТИ™ является торговой маркой компании «Эли Лилли энд Компани».
Шприц-ручка для однократного применения препарата ТРУЛИСИТИ™ соответствует текущим требованиям к точности дозировки и функционированию согласно ISO 11608-1:2012 и 11608-5:2012.
РУКОВОДСТВО ПО ИСПОЛЬЗОВАНИЮ ТРУЛИСИТИ™
Дулаглутид
Раствор для подкожного введения 1,5 мг/0,5 мл в шприц-ручке для однократного применения один раз в неделю
ИНФОРМАЦИЯ О ШПРИЦ-РУЧКЕ ДЛЯ ОДНОКРАТНОГО ПРИМЕНЕНИЯ ПРЕПАРАТА ТРУЛИСИТИ™
Пожалуйста, внимательно и полностью прочитайте данное Руководство по использованию и Инструкцию по медицинскому применению препарата перед использованием шприц-ручки для однократного применения препарата ТРУЛИСИТИ™. Поговорите с Вашим лечащим врачом о том, как правильно вводить препарат ТРУЛИСИТИ™.
- Шприц-ручка для однократного применения препарата ТРУЛИСИТИ™ (шприц-ручка) представляет собой одноразовое предзаполненное устройство для введения препарата, готовое к использованию. Каждая шприц-ручка содержит одну еженедельную дозу препарата ТРУЛИСИТИ™ (1,5 мг/0,5 мл). Каждая шприц-ручка предназначена для введения только одной дозы.
- Препарат ТРУЛИСИТИ™ вводят один раз в неделю. Возможно, Вы захотите сделать пометку в Вашем календаре, чтобы не забыть о введении следующей дозы.
Когда Вы нажимаете на зелёную кнопку введения препарата, шприц-ручка автоматически вводит иглу в кожу, вводит препарат и извлекает иглу после завершения инъекции.
ПЕРЕД ТЕМ КАК ПРИСТУПИТЬ К ИСПОЛЬЗОВАНИЮ:
- Достаньте из холодильника.
- Проверьте маркировку, чтобы убедиться, что Вы взяли правильный препарат, и что его срок годности не истёк.
- Осмотрите шприц-ручку. Не используйте её, если Вы заметили, что шприц-ручка повреждена или препарат мутный, изменил цвет или содержит частицы.
- Подготовьтесь, вымыв руки.
ВЫБЕРИТЕ МЕСТО ДЛЯ ВВЕДЕНИЯ
- Ваш лечащий врач может помочь выбрать место для введения, которое наилучшим образом Вам подходит.
- Вы можете вводить препарат в область живота или бедра.
- Другой человек может сделать Вам инъекцию в область плеча.
- Меняйте (чередуйте) места введения препарата каждую неделю. Вы можете использовать один и тот же участок, но обязательно выбирайте разные точки для инъекции.
- СНИМИТЕ КОЛПАЧОК
- РАСПОЛОЖИТЕ И РАЗБЛОКИРУЙТЕ
- НАЖМИТЕ И УДЕРЖИВАЙТЕ
1. СНИМИТЕ КОЛПАЧОК
! Убедитесь, что шприц-ручка заблокирована.
- Снимите и выбросьте серый колпачок, закрывающий основание.
Не надевайте колпачок обратно, это может повредить иглу. Не прикасайтесь к игле.
2. РАСПОЛОЖИТЕ И РАЗБЛОКИРУЙТЕ
- Плотно прижмите прозрачное основание к поверхности кожи в месте инъекции.
Разблокируйте, повернув фиксирующее кольцо.
3. НАЖМИТЕ И УДЕРЖИВАЙТЕ
- Нажмите и удерживайте зелёную кнопку введения препарата; Вы услышите громкий щелчок.
! Продолжайте плотно прижимать прозрачное основание к коже, пока не услышите второй щелчок. Это произойдёт, когда игла начнёт втягиваться обратно, приблизительно через 5–10 секунд.
- Уберите шприц-ручку с кожи.
- Вы узнаете о том, что инъекция завершена, когда станет видна серая часть механизма.
ВАЖНАЯ ИНФОРМАЦИЯ
- Хранение и обращение
- Утилизация шприц-ручки
- Часто задаваемые вопросы
- Другая информация
- Где найти дополнительную информацию
ХРАНЕНИЕ И ОБРАЩЕНИЕ
- В шприц-ручке имеются стеклянные детали. Обращайтесь с устройством аккуратно. Если Вы уроните его на твёрдую поверхность, не пользуйтесь им. Используйте для инъекции новую шприц-ручку.
- Храните шприц-ручку в холодильнике.
- Если после приобретения в аптеке хранение в холодильнике невозможно, Вы можете хранить шприц-ручку при температуре не выше 30 °C не более 14 дней.
- Не замораживайте шприц-ручку. Если шприц-ручка была заморожена, НЕ ИСПОЛЬЗУЙТЕ ЕЁ.
- Храните шприц-ручку в оригинальной картонной упаковке для защиты от света.
- Храните шприц-ручку в местах, недоступных для детей.
- Полную информацию о надлежащих условиях хранения читайте в Инструкции по медицинскому применению препарата.
УТИЛИЗАЦИЯ ШПРИЦ-РУЧКИ
- Утилизируйте шприц-ручку в контейнере для острых предметов или как рекомендовано Вашим лечащим врачом.
- Не подвергайте повторной переработке заполненный контейнер для острых предметов.
- Спросите Вашего лечащего врача о возможных способах утилизации препаратов, которые Вы больше не используете.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
- Что делать, если я замечу пузырёк воздуха в шприц-ручке?
Наличие пузырьков воздуха является нормой. Они не причинят Вам вреда и не повлияют на Вашу дозу.
- Что делать, если я разблокирую ручку и нажму на зеленую кнопку введения препарата, не сняв колпачок с основания?
Не снимайте колпачок с основания и не используйте шприц-ручку. Выбросьте шприц-ручку как указано в Руководстве по использованию. Введите препарат с помощью другой шприц-ручки.
- Что делать, если на кончике иглы видна капля жидкости, когда я снимаю колпачок с основания?
Капля жидкости на кончике иглы не является чем-то необычным и не повлияет на Вашу дозу.
- Нужно ли удерживать кнопку введения препарата до завершения инъекции?
Это не обязательно, но может помочь плотно и неподвижно прижимать шприц-ручку к поверхности кожи.
- Я услышал(-а) более двух щелчков во время инъекции: два громких щелчка и один тихий. Был ли препарат введён полностью?
Некоторые пациенты могут услышать тихий щелчок непосредственно перед вторым громким щелчком. Это нормально для шприц-ручки. Продолжайте прижимать шприц-ручку к поверхности кожи, пока не услышите второй громкий щелчок.
- Что делать, если после инъекции на коже осталась капля жидкости или крови?
Это не является чем-то необычным и не повлияет на Вашу дозу.
- Я не уверен(-а), что шприц-ручка работает правильно.
Проверьте, ввели ли Вы полную дозу. Доза введена правильно, если видна серая часть механизма. (См. шаг 3.) Свяжитесь с Московским Представительством АО "Эли Лилли Восток С. А.", Швейцария по телефону +7-495-258-50-01 или с Вашим лечащим врачом для получения дальнейших указаний. До тех пор храните шприц-ручку так, чтобы избежать случайного укола иглой.
ДРУГАЯ ИНФОРМАЦИЯ
- Если у Вас имеются нарушения зрения, НЕ используйте шприц-ручку для однократного применения препарата ТРУЛИСИТИ™ без помощи специально обученного её использованию лица.
ГДЕ НАЙТИ ДОПОЛНИТЕЛЬНУЮ ИНФОРМАЦИЮ
- Если у вас возникнут вопросы или проблемы при использовании шприц-ручки для однократного применения препарата ТРУЛИСИТИ™. свяжитесь с Московским Представительством АО "Эли Лилли Восток С. А.", Швейцария по телефону +7-495-258-50-01 или с Вашим лечащим врачом.
Название и адрес производителя:
«Эли Лилли энд Компани», США "Eli Lilly and Company", USA
Эли Лилли энд Компани, Корпоративный центр Лилли, Индианаполис, Индиана 46285, США
Eli Lilly and Company, Lilly Corporate Center, Indianapolis, Indiana 46285, USA Представительство в России:
Московское Представительство АО "Эли Лилли Восток С. А.", Швейцария 123317, Москва, Пресненская наб., д. 10 тел. +7(495)258-50-01 факс +7(495)258-50-05
ТРУЛИСИТИ™ является торговой маркой компании «Эли Лилли энд Компани».
Шприц-ручка для однократного применения препарата ТРУЛИСИТИ™ соответствует текущим требованиям к точности дозировки и функционированию согласно ISO 11608-1:2012 и 11608-5:2012.
Влияние на способность управлять транспортными средствами или работать с механизмами
Дулаглутид оказывает минимальное влияние или не оказывает влияния на способность управлять транспортными средствами и механизмами. При применении дулаглутида в сочетании с производными сульфонилмочевины или инсулином рекомендуется соблюдать осторожность во избежание развития гипогликемии при управлении транспортными средствами и механизмами.
Форма выпуска
Раствор для подкожного введения, 0,75 мг/0,5 мл или 1,5 мг/0,5 мл.
Хранение
В защищённом от света месте при температуре от 2 до 8 °C. Не замораживать.
Не применять препарат, если он был заморожен.
Приобретенный в аптеке препарат допускается хранить при температуре не выше 30 °C в течение 14 дней.
Хранить в местах, недоступных для детей.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Трулисити:
