Весфол
VesfolРегистрационный номер
Торговое наименование
Весфол
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
В 1 мл препарата содержится:
действующее вещество: лираглутид 6,0 мг (в одной предварительно заполненной шприц-ручке объёмом 3 мл содержится 18 мг лираглутида)
вспомогательные вещества: натрия гидрофосфата дигидрат, фенол, пропиленгликоль, натрия гидроксид/хлористоводородная кислота (для коррекции pH), вода для инъекций.
Описание
Прозрачный бесцветный раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Действующее вещество препарата Весфол — лираглутид — представляет собой ацилированный аналог человеческого ГПП-1, произведённый методом твёрдофазного химического синтеза. Лираглутид является агонистом рецепторов ГПП-1 (UGG-1H) и имеет 97 % гомологичности с аминокислотной последовательностью эндогенному человеческому ГПП-1. Лираглутид связывается и активирует рецептор ГПП-1 (ГПП-1Р). Лираглутид устойчив к метаболическому распаду, период его полувыведения из плазмы после подкожного введения составляет 13 ч. Фармакокинетический профиль лираглутида, позволяющий вводить его пациентам 1 раз в сутки, является результатом самоассоциации, в результате которой происходит замедленное всасывание препарата; связывания с белками плазмы; а также устойчивости к дипептидилпептидазе-4 (ДПП-4) и нейтральной эндопептидазе (НЭП).
ГПП-1 является физиологическим регулятором аппетита и потребления пищи, а ГПП-1 Р расположены в нескольких областях головного мозга, участвующих в процессах регуляции аппетита. В исследованиях на животных периферическое введение лираглутида приводило к связыванию с рецепторами в специфических областях головного мозга, включая гипоталамус, где лираглутид посредством специфической активации ГПП-1 Р усиливал сигналы насыщения и ослаблял сигналы голода, тем самым приводя к уменьшению массы тела.
ГПП-1 Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек. В экспериментах на мышах с атеросклерозом лираглутид предупреждал дальнейшее развитие аортальных бляшек и снижал в них воспаление. В дополнение, лираглутид оказывал благоприятный эффект на липиды в плазме. Лираглутид не уменьшал размер уже существующих бляшек.
Лираглутид уменьшает массу тела у человека преимущественно посредством уменьшения массы жировой ткани. Уменьшение массы тела происходит за счёт уменьшения потребления пищи. Лираглутид не увеличивает 24-часовой расход энергии. Лираглутид регулирует аппетит при помощи усиления чувства наполнения желудка и насыщения, одновременно ослабляя чувство голода и уменьшая предполагаемое потребление пищи.
Лираглутид стимулирует секрецию инсулина и уменьшает неоправданно высокую секрецию глюкагона глюкозозависимым образом, а также улучшает функцию бета-клеток поджелудочной железы, что приводит к снижению концентрации глюкозы натощак и после приёма пищи. Механизм снижения концентрации глюкозы также включает небольшую задержку опорожнения желудка.
В долгосрочных клинических исследованиях (КИ) с участием пациентов с избыточной массой тела и ожирением применение лираглутида в сочетании с низкокалорийной диетой и усиленной физической активностью приводило к значительному снижению массы тела.
Влияние на аппетит, потребление калорий и расход энергии, опорожнение желудка и концентрацию глюкозы натощак и после приёма пищи
Фармакодинамические эффекты лираглутида изучались в пятинедельном фармакологическом КИ с участием 49 пациентов с ожирением (индекс массы тела (ИМТ) 30–40 кг/м2) без сахарного диабета (СД).
Аппетит, потребление калорий и расход энергии
Считается, что снижение массы тела при применении лираглутида связано с регулированием аппетита и количества потребляемой пищи. Аппетит оценивали перед и в течение 5 ч после стандартизированного завтрака; неограниченное потребление пищи оценивали во время последующего обеда. По сравнению с плацебо лираглутид увеличивал чувство насыщения и наполнения желудка после приёма пищи и уменьшал чувство голода и оценочное количество предполагаемого потребления пищи, а также уменьшал неограниченное потребление пищи. При оценке с помощью респираторной камеры не было отмечено связанного с терапией увеличения 24-часового расхода энергии.
Опорожнение желудка
Применение лираглутида приводило к небольшой задержке опорожнения желудка в течение первого часа после приёма пищи, в результате чего уменьшалась скорость повышения концентрации глюкозы, а также общая концентрация глюкозы крови после приёма пищи.
Концентрации глюкозы, инсулина и глюкагона натощак и после приёма пищи
Концентрации глюкозы, инсулина и глюкагона натощак и после приёма пищи оценивали перед и в течение 5 ч после стандартизированного приёма пищи. По сравнению с плацебо лираглутид уменьшал концентрацию глюкозы натощак и после приёма пищи (AUC0–60 мин) в течение первого часа после приёма пищи, а также уменьшал 5-часовую площадь под кривой «концентрация-время» (AUC) глюкозы и нарастающую концентрацию глюкозы (AUC0–300 мин). Кроме того, по сравнению с плацебо лираглутид уменьшал постпрандиальные концентрации глюкагона (AUC0–300 мин) и инсулина (AUC0–60 мин) и нарастающую концентрацию инсулина (AUC0–60 мин) после приёма пищи.
Концентрации глюкозы и инсулина натощак и нарастающие концентрации глюкозы и инсулина также оценивали во время перорального теста толерантности к глюкозе (ПИТ) с 75 г глюкозы до начала терапии и через 1 год терапии у 3731 пациента с избыточной массой тела и с ожирением, а также с наличием или отсутствием предиабета. По сравнению с плацебо лираглутид уменьшал концентрацию натощак и нарастающую концентрацию глюкозы. Эффект был более выраженным у пациентов с предиабетом. Кроме того, по сравнению с плацебо лираглутид уменьшал концентрацию инсулина натощак и увеличивал нараставшею концентрацию инсулина.
После 160 недель продолжающейся терапии лираглутидом 3,0 мг AUC глюкозы плазмы снизилась, в то время как при применении плацебо оставалась неизменной. Дополнительно AUC инсулина оставалась относительно стабильной в течение 160-недельного периода лечения лираглутидом 3,0 мг, в то время как при применении плацебо наблюдалось её снижение. Все изученные эффекты от проводимой терапии были статистически значимыми в пользу лираглутида 3,0 мг.
Влияние на концентрацию глюкозы натощак и нарастающую концентрацию глюкозы у пациентов с сахарным диабетом 2 (СД2) типа с избыточной массой тела или ожирением
По сравнению с плацебо лираглутид снижал концентрацию глюкозы натощак и среднюю нарастающую постпрандиальную концентрацию глюкозы (через 90 минут после приёма пищи, среднее значение для 3-х приёмов пищи в сутки).
Функция бета-клеток поджелудочной железы
КИ продолжительностью до одного года с применением лираглутида у пациентов с избыточной массой тела, а также с наличием или отсутствием СД продемонстрировали улучшение и сохранение функции бета-клеток поджелудочной железы. Это было показано с использованием таких методов измерения, как гомеостатическая модель оценки функции бета-клеток (НОМА-В) и соотношение концентраций проинсулина и инсулина.
Клиническая эффективность и безопасность
Эффективность и безопасность применения лираглутида для длительной коррекции массы тела в сочетании с низкокалорийной диетой и усилением физической активности была изучена в 4-х рандомизированных двойных слепых плацебо-контролируемых исследованиях 3 фазы SCALE, включавших в общей сложности 5358 взрослых пациентов.
Масса тела
По сравнению с плацебо при применении лираглутида было достигнуто более выраженное снижение массы тела у пациентов с ожирением/избыточной массой тела во всех исследованных группах, в том числе с наличием или отсутствием предиабета, СД2 и обструктивным апноэ во сне средней или тяжёлой степени. Кроме того, среди популяции исследования большая часть пациентов достигла снижения массы тела ≥5 % и >10 % при применении лираглутида по сравнению с плацебо. Значительное снижение массы тела наблюдалось также в КИ, в котором пациенты достигли среднего показателя снижения массы тела 6,0 % с помощью низкокалорийной диеты в течение 12 недель до начала лечения лираглутидом. В этом исследовании большее количество пациентов сохранили потерю массы тела, которая была достигнута до начала лечения лираглутидом по сравнению с плацебо (81,4 % и 48,9 %, соответственно).
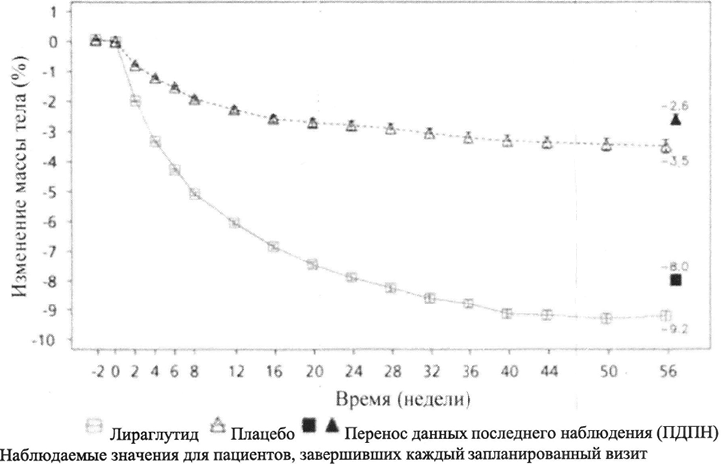
Рисунок 1. Изменение массы тела (%) в динамике по сравнению с исходным значением у пациентов (0–56 недели).
В КИ длительностью 160 недель пациенты, получавшие лираглутид, достигли более значительной потери массы тела по сравнению с пациентами, получавшими плацебо. В основном потеря массы тела произошла в первый год и удерживалась на протяжении 160 недель.
В КИ длительностью 160 недель средний процент изменения массы тела и доля пациентов, достигших потери массы тела от исходного значения до 160 недели не менее чем на 5 % и более 10 %, были также значительными по сравнению с плацебо.
Снижение массы тела после 12 недель терапии лираглутидом (лираглутид 3,0 мг)
В двух исследованиях продолжительностью 56 недель после 12 недель терапии лираглутидом в дозе 3,0 мг 67,5 % и 50,4 % пациентов достигли снижения массы тела не менее чем на 5 %. Для этих пациентов среднее снижение массы тела на момент завершения исследования (1 год) составило 11,2 % по сравнению с исходным значением. У пациентов, достигших снижения массы тела менее чем на 5 % после 12 недель терапии в дозе 3,0 мг и завершивших исследование (1 год), среднее снижение массы тела составило 3,8 %.
Контроль гликемии
Терапия лираглутидом существенно улучшала гликемические показатели в субпопуляциях с нормогликемией, предиабетом и СД2.
Через 56 недель у 0,2 % пациентов, получавших лираглутид, по сравнению с 1,1 % в группе плацебо развился СД2. У 69,2 % пациентов с предиабетом наблюдалось обратное развитие этого состояния при применении лираглутида по сравнению с 32,7 % в группе плацебо.
На 160-й неделе лечения диагноз СД2 был поставлен 3 % пациентов, получавшим лираглутид, и 11 % пациентов, получавшим плацебо. По сравнению с плацебо время до развития СД2 при применении лираглутида 3,0 мг было в 2,7 раза больше, а относительный риск (ОР) развития СД2 при применении лираглутида равен 0,2. На 160-й неделе в группе лираглутида 3,0 мг у 65,9 % пациентов с предиабетом наблюдалось обратное развитие этого состояния до нормогликемии по сравнению с 36,3 % в группе плацебо.
В одном из исследований 69,2 % и 56,5 % пациентов с ожирением и СД2, получавших лираглутид, достигли целевого значения HbA1C <7 % и ≤6,5 %, соответственно, по сравнению с 27,2 % и 15,0 % у пациентов, получавших плацебо.
Кардиометаболические параметры
По сравнению с плацебо лираглутид значительно улучшал показатели систолического артериального давления (АД), окружности талии и концентрации липидов натощак.
В КИ длительностью 160 недель среднее уменьшение окружности талии составило 8,2 см при применении лираглутида и 4,0 см при применении плацебо; уменьшение показателей систолического и диастолического АД составило 4,3 мм рт. ст. и 1,5 мм рт. ст. при применении лираглутида и 2,7 мм рт. ст. и 1,8 мм рт. ст. при применении плацебо соответственно; уменьшение концентрации холестерина липопротеинов низкой плотности (ЛПНП) составило 3,1 ммоль/л при применении лираглутида и 0,7 ммоль/л при применении плацебо; увеличение концентрации холестерина липопротеинов высокой плотности (ЛПВП) составило 2,3 ммоль/л при применении лираглутида и 0,5 ммоль/л при применении плацебо.
Индекс апноэ-гипноэ (ИАГ)
По сравнению с плацебо при применении лираглутида наблюдалось существенное снижение тяжести обструктивного апноэ во сне, которая оценивалась по изменению ИАГ относительно исходного значения.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к лираглутиду после терапии. В КИ у 2,5 % пациентов, получавших лираглутид, появились антитела к лираглутиду. Образование антител не привело к снижению эффективности препарата.
Оценка сердечно-сосудистых событий
Серьёзные сердечно-сосудистые события (СССС) были оценены группой внешних независимых экспертов и определены как инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода и смерть по причине сердечно-сосудистой патологии. 3 5 двойных слепых контролируемых КИ 2 и 3 фазы с применением лираглутида было отмечено 6 СССС у пациентов, получавших лираглутид и 10 СССС — у получавших плацебо пациентов. ОР с 95 % доверительным интервалом (ДИ) составил 0,33 при применении лираглутида по сравнению с плацебо. В КИ 3 фазы среднее увеличение частоты сердечных сокращений (ЧСС) составило 2,5 удара в минуту у пациентов, получавших лираглутид. Наибольшее увеличение ЧСС наблюдалось после 6 недель терапии. Это увеличение было обратимым и исчезало после прекращения терапии лираглутидом.
Было проведено многоцентровое, плацебо-контролируемое, двойное слепое КИ «Эффект и воздействие лираглутида при сахарном диабете: оценка сердечно-сосудистых рисков» (LEADER®).
По сравнению с плацебо лираглутид 1,8 мг существенно снижал риск развития СССС (Рисунок 2). ОР развития СССС был стабильно ниже 1 для всех трёх сердечно-сосудистых событий.
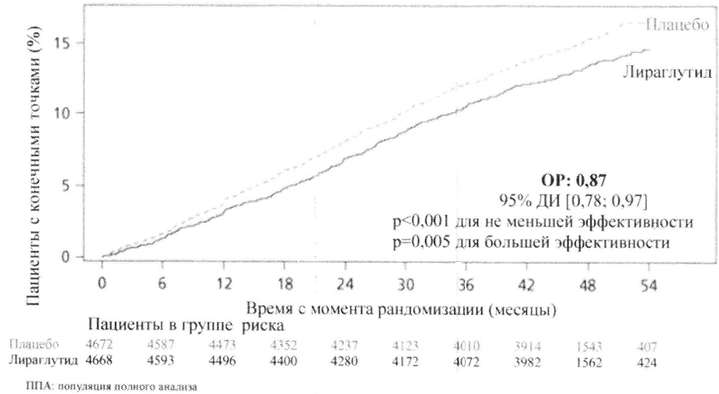
Рисунок 2 График Каплан-Мейера — время до возникновения первого СССС — Популяция полного анализа (ППА).
Лираглутид 1,8 мг также существенно снижал риск развития расширенных СССС (первичные СССС, нестабильная стенокардия, приводящая к госпитализации, реваскуляризация миокарда или госпитализация по причине сердечной недостаточности) и прочих вторичных конечных точек.
Дети и подростки
Европейское агентство лекарственных средств отложило обязательство по представлению результатов исследований лираглутида в одной или нескольких группах детей для лечения ожирения (см. раздел «Способ применения и дозы»).
В двойном слепом КИ, сравнивающем эффективность и безопасность лираглутида относительно плацебо в отношении снижения массы тела у подростков в возрасте 12 лет и старше с ожирением, лираглутид превосходил плацебо в снижении стандартного отклонения ИМТ (измеренного для оценки снижения массы тела) после 56 недель лечения.
Большее количество пациентов достигло ≥5% и ≥10% снижения ИМТ на терапии лираглутидом, чем пациенты, получавшие плацебо, при более значительном снижении среднего ИМТ и массы тела. В течение 26 недель последующего наблюдения без применения препарата наблюдалось восстановление массы тела в группе терапии лираглутидом по сравнению с плацебо (оценивалось как изменение стандартного отклонения ИМТ).
Исходя из переносимости лираглутида, большинству пациентов (82,4 %) доза препарата была увеличена до 3,0 мг, и они продолжили получать эту дозу, остальным пациентам дозы были увеличены, в соответствии с переносимостью терапии, и они продолжили получать препарат в диапазоне доз 0,6 мг — 2,4 мг (2,4 % — дозу 0,6 мг, 3,2 % — дозу 1,2 мг, 3,2 % — дозу 1,8 мг, 8,8 % — дозу 2,4 мг).
После 56 недель терапии препаратом не было выявлено влияния на рост или половое развитие.
Было проведено исследование с 16-недельным двойным слепым периодом и 36-недельным открытым периодом для оценки эффективности и безопасности лираглутида у детей и подростков с синдромом Прадера-Вилли и ожирением. В исследование были включены 32 пациента в возрасте от 12 до <18 лет (часть А) и 24 пациента в возрасте от 6 до <12 лет (часть В). Пациенты были рандомизированы в соотношении 2:1 для получения терапии лираглутидом или плацебо. У пациентов с массой тела менее 45 кг увеличение дозы начинали с более низкой дозы; 0,3 мг вместо 0,6 мг с повышением до максимальной дозы 2,4 мг.
Установленная разница средней оценки стандартного отклонения ИМТ (SDS ИМТ) после 16 недель (часть А: -0,20 против -0,13, часть В: -0,50 против -0,44) и после 52 недель (часть А: -0,31 против -0,17, часть В: -0,73 против -0,67) была сопоставимой на терапии лираглутидом и плацебо.
В ходе исследований не было выявлено никаких дополнительных рисков в отношении безопасности препарата.
Результаты определяемых пациентами показателей
Лираглутид по сравнению с плацебо улучшал определяемые пациентами оценки по нескольким показателям. Было отмечено значительное улучшение общей оценки по Упрощённому опроснику влияния массы тела на качество жизни (IWQoL-Lite) и по всем шкалам опросника для оценки качества жизни SF-36, что указывает на положительное влияние на физические и психологические параметры качества жизни.
Фармакокинетика
Всасывание
Всасывание лираглутида после подкожного введения происходит медленно, время достижения максимальной концентрации (tmax) — около 11 ч после введения. У пациентов с ожирением (ИМТ 30–40 кг/м2) после введения лираглутида в дозе 3,0 мг средняя равновесная концентрация лираглутида (AUCτ/24) достигает приблизительно 31 нмоль/л. В диапазоне доз от 0,6 мг до 3,0 мг экспозиция лираглутида увеличивается пропорционально дозе. Абсолютная биодоступность лираглутида после подкожного введения составляет приблизительно 55 %.
Распределение
Средний кажущийся объём распределения после подкожного введения лираглутида в дозе 3,0 мг составляет 20–25 л (у лиц с массой тела около 100 кг). Лираглутид в значительной степени связывается с белками плазмы крови (>98 %).
Метаболизм
На протяжении 24 ч после введения здоровым добровольцам однократной дозы [3H]-лираглутида главным компонентом в плазме оставался неизменённый лираглутид. Были обнаружены 2 метаболита (<9 % и <5 % от уровня общей радиоактивности в плазме крови).
Выведение
Лираглутид метаболизируется эндогенно без участия какого-либо специфического органа в качестве основного пути выведения. После введения дозы [3H]-лираглутида неизмененный лираглутид не определялся в моче или кале. Лишь незначительная часть введённой радиоактивности в виде метаболитов лираглутида выводилась почками или через кишечник (6 % и 5 % соответственно). Радиоактивные вещества выделяются почками или через кишечник, в основном в течение первых 6–8 дней и представляют собой 3 метаболита.
Средний клиренс после подкожного введения 3,0 мг лираглутида составляет приблизительно 0,9–1,4 л/ч, период полувыведения составляет примерно 13 ч.
Особые группы пациентов
Пациенты пожилого возраста
Коррекции дозы с учётом возраста не требуется. Согласно результатам популяционного фармакокинетического анализа у пациентов с избыточной массой тела и ожирением в возрасте 18–82 лет возраст не оказывал клинически значимого влияния на фармакокинетику лираглутида при подкожном введении в дозе 3,0 мг.
Пол
Основываясь на данных популяционного фармакокинетического анализа, у женщин скорректированный по массе тела клиренс лираглутида после подкожного введения в дозе 3,0 мг на 24 % меньше, чем у мужчин. На основании данных по ответной реакции на воздействие препарата, коррекции дозы с учётом пола не требуется.
Этническая принадлежность
Согласно результатам популяционного фармакокинетического анализа, в который были включены данные исследований у пациентов с избыточной массой тела и ожирением европеоидной, негроидной, азиатской и латиноамериканской расовых групп, этническая принадлежность не оказывала клинически значимого влияния на фармакокинетику лираглутида при подкожном введении в дозе 3,0 мг.
Масса тела
Экспозиция лираглутида уменьшается при увеличении исходной массы тела. Применение лираглутида в дозе 3,0 мг ежедневно обеспечивает адекватную экспозицию в диапазоне массы тела 60–234 кг, согласно оценке ответной реакции на системную экспозицию препарата в КИ.
Экспозицию лираглутида у пациентов с массой тела больше 234 кг не изучали.
Пациенты с печёночной недостаточностью
Фармакокинетику лираглутида оценивали у пациентов с различной степенью нарушения функции печени в исследовании однократной дозы (0,75 мг). Наблюдалось снижение экспозиции лираглутида на 13–23 % у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести и значительное снижение экспозиции лираглутида (на 44 %) у пациентов с печёночной недостаточностью тяжёлой степени (>9 баллов по классификации Чайлд-Пью) в сравнении со здоровыми добровольцами.
Пациенты с почечной недостаточностью
В исследовании однократной дозы (0,75 мг) экспозиция лираглутида была меньше у пациентов с почечной недостаточностью по сравнению с лицами с нормальной функцией почек.
Экспозиция лираглутида была меньше на 33 %, 14 %, 27 % и 26 %, соответственно, у пациентов с почечной недостаточностью лёгкой (клиренс креатинина (КК) 50–80 мл/мин), средней (КК 30–50 мл/мин), тяжёлой степени (КК <30 мл/мин) и у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе.
Дети и подростки
Фармакокинетические свойства лираглутида 3,0 мг оценивались в клинических исследованиях у подростков с ожирением в возрасте от 12 до 18 лет (134 пациента, масса тела 62–178 кг).
Экспозиция лираглутида у подростков в возрасте от 12 до 18 лет была сопоставима с наблюдаемой у взрослых пациентов с ожирением.
Фармакокинетические свойства были также оценены в клиническом фармакологическом исследовании с участием детей с ожирением в возрасте от 7 до 11 лет (13 пациентов, масса тела 54–87 кг). Экспозиция лираглутида 3,0 мг у детей в возрасте от 7 до 11 лет была сопоставима с наблюдаемой у взрослых пациентов после поправки на массу тела.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В двухлетних исследованиях канцерогенности у крыс и мышей были выявлены опухоли С-клеток щитовидной железы, не приводившие к летальному исходу. Результаты, полученные в ходе исследований на грызунах, обусловлены тем, что грызуны проявляют особую чувствительность в отношении опосредуемого рецептором ГПП-1 негенотоксичного специфического механизма. Появления других новообразований, связанных с проводимой терапией, отмечено не было.
В исследованиях на животных не выявлено прямого неблагоприятного эффекта препарата на фертильность, но было отмечено незначительное увеличение частоты ранней эмбриональной смерти при применении самых высоких доз препарата.
У молодых крыс лираглутид вызывал задержку полового созревания как у самцов, так и у самок при клинически значимом воздействии. Эти задержки не повлияли на фертильность и репродуктивную способность обоих полов или на способность самок сохранять беременность.
Показания
Взрослые
Препарат Весфол показан в качестве дополнения к низкокалорийной диете и усиленной физической нагрузке для длительного применения с целью коррекции массы тела у взрослых пациентов с ИМТ:
- ≥30 кг/м2 (ожирение) или
- ≥27 кг/м2 до <30 кг/м2 (избыточная масса тела) при наличии хотя бы одного связанного с избыточной массой тела сопутствующего заболевания, такого как предиабет, сахарный диабет 2 типа, артериальная гипертензия, дислипидемия или синдром обструктивного апноэ во сне.
Подростки
Препарат Весфол может быть использован в качестве дополнения к здоровому питанию и усиленной физической нагрузке с целью коррекции массы тела у подростков в возрасте от 12 лет и старше с:
- массой тела >60 кг и
- ожирением (ИМТ, соответствующий ≥30 кг/м2 для взрослых согласно международным пороговым значениям)*.
| Возраст (количество лет) | Индекс массы тела 30 кг/м2 | |
| Мужской пол | Женский пол | |
| 12 | 26,02 | 26,67 |
| 12,5 | 26,43 | 27,24 |
| 13 | 26,84 | 27,76 |
| 13,5 | 27,25 | 28,20 |
| 14 | 27,63 | 28,57 |
| 14,5 | 27,98 | 28,87 |
| 15 | 28,30 | 29,11 |
| 15,5 | 28,60 | 29,29 |
| 16 | 28,88 | 29,43 |
| 16,5 | 29,14 | 29,56 |
| 17 | 29,41 | 29,69 |
| 17,5 | 29,70 | 29,84 |
| 18 | 30,00 | 30,00 |
Противопоказания
- Гиперчувствительность к лираглутиду или любому из вспомогательных веществ препарата
- Медуллярный рак щитовидной железы в анамнезе, в том числе в семейном
- Множественная эндокринная неоплазия 2 типа
- Тяжёлая депрессия, суицидальные мысли или поведение, в том числе в анамнезе.
Противопоказано применение у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности:
- почечная недостаточность тяжёлой степени (КК <30 мл/мин);
- печёночная недостаточность тяжёлой степени;
- детский возраст до 12 лет;
- подростки в возрасте от 12 до 18 лет с массой тела ≤60 кг;
- у пациентов в возрасте ≥75 лет;
- период беременности и грудного вскармливания;
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация));
- одновременное применение других препаратов для коррекции массы тела;
- применение в комбинации с другими агонистами рецепторов ГПП-1;
- вторичное ожирение на фоне эндокринологических заболеваний или расстройств пищевого поведения или на фоне применения лекарственных препаратов, которые могут привести к увеличению массы тела.
У пациентов с сахарным диабетом лираглутид не должен применяться в качестве заменителя инсулина.
Опыт применения лираглутида у пациентов с воспалительными заболеваниями кишечника и диабетическим парезом желудка ограничен. Применение лираглутида у таких пациентов не рекомендуется, поскольку оно связано с транзиторными нежелательными реакциями со стороны желудочно- кишечного тракта (ЖКТ), включая тошноту, рвоту и диарею.
С осторожностью
Лираглутид рекомендуется применять с осторожностью у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести, заболеваниями щитовидной железы и наличием острого панкреатита в анамнезе.
Применение при беременности и в период грудного вскармливания
Беременность
Данные по применению лираглутида у беременных женщин ограничены.
В исследованиях на животных была продемонстрирована репродуктивная токсичность.
Потенциальный риск для человека неизвестен. Применение препарата Весфол в период беременности противопоказано. При планировании или наступлении беременности терапию препаратом Весфол необходимо прекратить.
Период грудного вскармливания
Неизвестно, проникает ли лираглутид в грудное молоко человека. В исследованиях на животных было продемонстрировано, что проникновение лираглутида и структурно близких метаболитов в грудное молоко является низким. В доклинических исследованиях было продемонстрировано связанное с терапией замедление роста новорождённых крысят, находящихся на грудном вскармливании. В связи с отсутствием опыта применения, препарат Весфол противопоказан во время грудного вскармливания.
Фертильность
За исключением незначительного уменьшения числа живых эмбрионов, результаты исследований на животных не указывают на наличие неблагоприятного влияния на фертильность (см. подраздел «Доклинические данные по безопасности»).
Способ применения и дозы
Дозы
Взрослые
Начальная доза составляет 0,6 мг в сутки. Дозу увеличивают до 3,0 мг в сутки, прибавляя по 0,6 мг с интервалами не менее одной недели для улучшения желудочно-кишечной переносимости (см. Таблицу 2). Если при увеличении дозы новая доза плохо переносится пациентом в течение 2 недель подряд, следует рассмотреть вопрос о прекращении терапии.
Применение препарата в суточной дозе больше 3,0 мг не рекомендуется.
Терапию препаратом Весфол следует прекратить, если после 12 недель применения препарата в дозе 3,0 мг в сутки потеря в массе тела составила менее 5 % от исходного значения.
|
| Доза | Недели |
| Увеличение дозы в течение 4 недель | 0,6 мг | 1 |
| 1,2 мг | 1 | |
| 1,8 мг | 1 | |
| 2,4 мг | 1 | |
| Терапевтическая доза | 3,0 мг | |
Подростки (≥12 лет)
Для подростков в возрасте от 12 до 18 лет следует применять такой же режим увеличения дозы, как и для взрослых (см. Таблицу 2). Дозу препарата следует увеличивать до тех пор, пока не будет достигнуто значение 3,0 мг (терапевтическая доза) или максимально переносимая доза.
Применение препарата в суточной дозе больше 3,0 мг не рекомендуется.
Терапию препаратом Весфол следует прекратить и пересмотреть, если после 12 недель применения препарата в дозе 3,0 мг в сутки или максимальной переносимой дозе пациенты потеряли менее 4 % от своего ИМТ или z-показателя ИМТ.
Пропущенная доза
Если после обычного времени введения дозы прошло менее 12 ч, пациент должен ввести дозу как можно быстрее. Если до обычного времени введения следующей дозы осталось менее 12 ч, пациент не должен вводить пропущенную дозу, а должен возобновить введение препарата со следующей запланированной дозы. Не следует вводить дополнительную или повышенную дозу для компенсации пропущенной дозы.
Пациенты с СД2
Препарат Весфол не следует применять в комбинации с другими агонистами рецепторов ГПП-1.
В начале терапии препаратом Весфол рекомендуется уменьшить дозу одновременно применяемого препарата инсулина или секретагогов инсулина (таких как препараты сульфонилмочевины) для уменьшения риска развития гипогликемии. Самоконтроль концентрации глюкозы крови может быть необходим для корректировки дозы инсулина или секретагогов инсулина (см. раздел «Особые указания»).
Особые группы пациентов
Пациенты пожилого возраста (≥65 лет)
Коррекции дозы с учётом возраста не требуется. Опыт применения препарата у пациентов в возрасте ≥75 лет ограничен, применение препарата у этих пациентов не рекомендуется (См. подраздел «Фармакокинетика» и раздел «Противопоказания»).
Пациенты с почечной недостаточностью
У пациентов с почечной недостаточностью лёгкой или средней степени (КК ≥30 мл/мин) коррекции дозы не требуется. Применение препарата Весфол у пациентов с почечной недостаточностью тяжёлой степени (КК <30 мл/мин), включая пациентов с терминальной стадией почечной недостаточности, противопоказано (см. подраздел «Фармакокинетика» и раздел «Противопоказания»).
Пациенты с печёночной недостаточностью
У пациентов с печёночной недостаточностью лёгкой и средней степени тяжести коррекции дозы не требуется. Применение препарата Весфол у пациентов с печёночной недостаточностью тяжёлой степени противопоказано (см. подраздел «Фармакокинетика» и раздел «Противопоказания»). У пациентов с печёночной недостаточностью лёгкой или средней степени тяжести препарат следует применять с осторожностью (см. подраздел «Фармакокинетика» и раздел «С осторожностью»).
Дети и подростки
У детей и подростков в возрасте от 12 лет и старше коррекции дозы не требуется.
Безопасность и эффективность препарата Весфол у детей в возрасте до 12 лет не установлены (см. подраздел «Фармакодинамика»).
Способ применения
Препарат Весфол предназначен только для подкожного введения. Его нельзя вводить внутривенно или внутримышечно.
Препарат Весфол вводят один раз в сутки в любое время, независимо от приёма пищи. Его следует вводить в область живота, бедра или плеча. Место и время инъекции могут быть изменены без коррекции дозы. Тем не менее, желательно делать инъекции примерно в одно и то же время суток после выбора наиболее удобного времени.
Побочное действие
Безопасность препарата лираглутид была оценена в 5 двойных слепых плацебо- контролируемых исследованиях, в которых приняли участие 5813 взрослых пациентов с ожирением или с избыточной массой тела и, как минимум, с одним связанным с избыточной массой тела сопутствующим заболеванием. В целом, нарушения со стороны ЖКТ являлись наиболее часто отмечаемыми нежелательными реакциями во время терапии лираглутидом (67,9 %) (см. подраздел «Описание отдельных нежелательных реакций»).
В Таблице 3 представлен перечень нежелательных реакций, зарегистрированных в ходе исследований для взрослых пациентов. Нежелательные реакции распределены по группам в соответствии с системами органов MedDRA и частотой. Частота определена следующим образом: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1 000 до <1/100); редко (≥1/10 000 до <1/1 000); очень редко (<1/10 000).
| Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | |||
|
|
|
| Анафилактические реакции |
| Нарушения метаболизма и питания | |||
|
| Гипогликемия* | Дегидратация |
|
| Психические нарушения | |||
|
| Бессонница** |
|
|
| Нарушения со стороны нервной системы | |||
| Головная боль | Головокружение |
|
|
|
| Дисгевзия |
|
|
| Нарушение со стороны сердца | |||
|
|
| Тахикардия |
|
| Желудочно-кишечные нарушения | |||
| Тошнота | Сухость во рту | Панкреатит*** |
|
| Рвота | Диспепсия | Задержка опорожнения желудка |
|
| Диарея | Гастрит |
|
|
| Запор | Гастроэзофагеаль- ная рефлюксная болезнь |
|
|
|
| Боль в верхних отделах живота |
|
|
|
| Метеоризм |
|
|
|
| Отрыжка |
|
|
|
| Вздутие живота |
|
|
| Нарушения со стороны печени и желчевыводящих путей | |||
|
| Холелитиаз*** | Холецистит*** |
|
| Нарушения со стороны кожи и подкожных тканей | |||
|
|
| Крапивница |
|
| Нарушение со стороны почек и мочевыводящих путей | |||
|
|
|
| Острая почечная недостаточность |
|
|
|
| Нарушение функции почек |
| Общие нарушения и реакции в месте введения | |||
|
| Реакции в месте инъекции | Недомогание |
|
|
| Астения |
|
|
|
| Утомляемость |
|
|
| Лабораторные и инструментальные данные | |||
|
| Повышение активности липазы |
|
|
|
| Повышение активности амилазы |
|
|
* Гипогликемия (на основании отмеченных пациентами симптомов и не подтверждённая измерениями концентрации глюкозы крови), отмеченная пациентов без СД2, получавших лираглутид в сочетании с диетой и физическими нагрузками. Подробную информацию см. в подразделе «Описание от дельных нежелательных реакций».
** Бессонницу отмечали во время первых 3-х месяцев терапии.
*** См. раздел «Особыеуказания».
**** В соответствии с фазами 2, Зa и Зb контролируемого клинического исследования.
Описание отдельных нежелательных реакций
Гипогликемия у пациентов без СД2
В КИ с участием пациентов с избыточной массой тела или ожирением без СД2, получавших терапию лираглутидом в сочетании с диетой и физическими нагрузками, тяжёлых гипогликемий (требующих оказания помощи третьим лицом) отмечено не было. О симптомах гипогликемии сообщали 1,6 % пациентов, получавших лираглутид, и 1,1 % пациентов, получавших плацебо; однако эти случаи не были подтверждены измерениями концентрации глюкозы крови. В большинстве случаев отмечалась лёгкая гипогликемия.
Гипогликемия у пациентов с СД2
В КИ с участием пациентов с избыточной массой тела или ожирением и СД2, получавших терапию лираглутидом в сочетании с диетой и физическими нагрузками, случаи тяжёлой гипогликемии (требующие оказания помощи третьим лицом) были отмечены у 0,7 % пациентов, получавших лираглутид, и только у пациентов, одновременно получавших терапию производными сульфонилмочевины. Также в этой группе пациентов подтвержденная гипогликемия была отмечена у 43,6 % пациентов, получавших лираглутид, и 27,3 % пациентов, получавших плацебо. Среди пациентов, не получавших одновременно препарат сульфонилмочевины, подтверждённая гипогликемия была отмечена у 15,7 % пациентов, получавших лираглутид, и у 7,6 % пациентов, получавших плацебо (концентрация глюкозы ≤3,9 ммоль/л в сочетании с симптомами).
Гипогликемия у пациентов с СД2, получающих инсулин
В КИ с участием пациентов с избыточной массой тела или ожирением с СД2 типа, получавших терапию инсулином и лираглутидом в сочетании с диетой и физическими нагрузками и до двух пероральных гипогликемических препаратов, тяжёлая гипогликемия (требующая оказания помощи третьим лицом) была отмечена у 1,5 % пациентов, получавших терапию лираглутидом. В данном исследовании подтверждённая гипогликемия (определяемая как уровень глюкозы в плазме ≤3,9 ммоль/л, сопровождаемая симптомами) была зарегистрирована у 47,2 % пациентов, получавших терапию лираглутидом, и у 51,8 % пациентов, получавших плацебо. Сообщалось о подтверждённых гипогликемических эпизодах среди пациентов, одновременно получавших производные сульфонилмочевины, у 60,9 % пациентов, получавших терапию лираглутидом, и у 60,0 % пациентов, получавших плацебо.
Нежелательные реакции со стороны желудочно-кишечного тракта
Большинство реакций со стороны ЖКТ были лёгкой или средней степени тяжести, преходящими и, в большинстве случаев, не приводили к прекращению терапии. Реакции обычно возникали в первые недели терапии, и их проявления постепенно уменьшались в течение нескольких дней или недель при продолжении терапии.
У пациентов в возрасте ≥65 лет могут наблюдаться более выраженные проявления нежелательных реакций со стороны ЖКТ во время терапии лираглутидом.
У пациентов с почечной недостаточностью лёгкой или средней степени тяжести (КК ≥30 мл/мин) могут наблюдаться более выраженные проявления нежелательных реакций со стороны ЖКТ во время терапии лираглутидом.
Острая почечная недостаточность
У пациентов на терапии агонистом рецепторов ГПП-1 отмечались случаи острой почечной недостаточности. Большинство зарегистрированных случаев произошло у пациентов, которые испытывали тошноту, рвоту или диарею, приводившую к уменьшению объёма циркулирующей крови.
Нарушения со стороны печени и желчевыводящих путей
Сообщалось о возникновении холангита и холестатической желтухи.
Аллергические реакции
В пострегистрационном периоде сообщалось о возникновении нескольких случаев анафилактических реакций с такими симптомами, как артериальная гипотензия, ощущение сердцебиения, одышка или периферические отеки. Анафилактические реакции потенциально могут быть угрожающими жизни. При подозрении на анафилактическую реакцию необходимо отменить терапию лираглутидом и не возобновлять лечение (см. раздел «Противопоказания»).
Реакции в месте введения
Сообщалось о реакциях в месте введения у пациентов, получавших лираглутид. Эти реакции, как правило, были лёгкой степени, носили транзиторный характер и в большинстве случаев исчезали при продолжении терапии.
Тахикардия
В КИ тахикардия была отмечена у 0,6 % пациентов, получавших лираглутид, и у 0,1 % пациентов, получавших плацебо. Большинство реакций были лёгкой или средней степени тяжести. Реакции были единичными и в большинстве случаев проходили при продолжении терапии лираглутидом.
Дети и подростки
В КИ, проведённом с участием подростков с ожирением в возрасте от 12 до 18 лет, 125 пациентов получали терапию лираглутидом в течение 56 недель.
В целом, частота развития, тип и степень тяжести нежелательных реакций у подростков с ожирением были сопоставимы с таковыми у взрослых пациентов. Рвота у подростков возникала в два раза чаще по сравнению со взрослыми пациентами.
Количество пациентов, сообщивших хотя бы об одном эпизоде клинически значимой гипогликемии, было выше в группе терапии лираглутидом (1,6 %) по сравнению с плацебо (0,8 %). Эпизодов тяжёлой гипогликемии в ходе исследования выявлено не было.
Передозировка
По данным КИ и пострегистрационного применения лираглутида были зарегистрированы случаи передозировки при применении препарата в дозе до 72 мг (в 24 раза больше рекомендуемой дозы для коррекции массы тела).
Пациенты отмечали сильную тошноту, сильную рвоту и тяжёлую гипогликемию.
В случае передозировки необходимо начать соответствующую поддерживающую терапию в соответствии с клиническими признаками и симптомами.
Пациента следует наблюдать на предмет клинических признаков дегидратации и контролировать концентрацию глюкозы крови.
Взаимодействие с другими лекарственными средствами
In vitro лираглутид показал очень низкую способность к лекарственному фармакокинетическому взаимодействию, обусловленному метаболизмом в системе цитохрома Р-450 (CYP), а также связыванием с белками плазмы.
Небольшая задержка опорожнения желудка при применении лираглутида может влиять на всасывание одновременно применяемых препаратов для приёма внутрь. Исследования лекарственного взаимодействия не показали какого-либо клинически значимого замедления всасывания этих препаратов, поэтому коррекции дозы не требуется.
Исследования взаимодействия проводили с применением лираглутида в дозе 1,8 мг. Влияние на скорость опорожнения желудка было одинаковым при применении лираглутида в дозе 1,8 мг и 3,0 мг (AUC0–300 мин парацетамола). У нескольких пациентов, получавших лечение лираглутидом, отмечалось как минимум по одному эпизоду тяжёлой диареи. Диарея может оказывать влияние на всасывание пероральных лекарственных препаратов, которые применяются одновременно с лираглутидом.
Варфарин и другие производные кумарина
Исследования по взаимодействию не проводились. Не может быть исключено клинически значимое взаимодействие с действующими веществами с низкой растворимостью или узким терапевтическим индексом, такими как варфарин. В начале лечения лираглутидом у пациентов, получающих варфарин или другие производные кумарина, рекомендуется чаще проводить мониторинг международного нормализованного отношения (МНО).
Парацетамол (ацетаминофен)
Лираглутид не изменял общую экспозицию парацетамола после введения однократной дозы парацетамола 1000 мг. Максимальная концентрация (Cmax) парацетамола была снижена на 31 %, а медиана tmax увеличена на 15 мин. Коррекции дозы при сопутствующем применении парацетамола не требуется.
Аторвастатин
Лираглутид не изменял общую экспозицию аторвастатина после применения однократной дозы аторвастатина 40 мг. Поэтому коррекции дозы аторвастатина при применении в сочетании с лираглутидом не требуется. Cmax аторвастатина была снижена на 38 %, а медиана tmax увеличена с 1 ч до 3 ч при применении лираглутида.
Гризеофулъвин
Лираглутид не изменял общую экспозицию гризеофульвина после применения однократной дозы гризеофульвина 500 мг. Cmax гризеофульвина была увеличена на 37 %, а медиана tmax не изменилась. Коррекции дозы гризеофульвина и других соединений с низкой растворимостью и высокой проникающей способностью не требуется.
Дигоксин
Применение однократной дозы дигоксина 1 мг в сочетании с лираглутидом привело к уменьшению AUC дигоксина на 16 %, уменьшению Cmax на 31 %. Медиана tmax дигоксина увеличилась с 1 ч до 1,5 ч. С учётом данных результатов коррекции дозы дигоксина не требуется.
Лизиноприл
Применение однократной дозы лизиноприла 20 мг в сочетании с лираглутидом привело к уменьшению AUC лизиноприла на 15 %, уменьшению Cmax на 27 %. При применении лираглутида медиана tmax лизиноприла увеличилась с 6 ч до 8 ч. С учётом данных результатов коррекции дозы лизиноприла не требуется.
Пероральные контрацептивы
Лираглутид приводил к уменьшению Cmax этинилэстрадиола и левоноргестрела на 12 % и 13 %, соответственно, после применения однократной дозы перорального гормонального контрацептивного препарата, tmax обоих лекарственных веществ на фоне применения лираглутида увеличивалась на 1,5 ч. Не было отмечено клинически значимого влияния на системную экспозицию этинилэстрадиола или левоноргестрела. Таким образом, не ожидается влияния на контрацептивный эффект при совместном применении с лираглутидом.
Дети и подростки
Исследования взаимодействия проводились только на взрослых пациентах.
Несовместимость
Лекарственные вещества, добавленные к препарату Весфол, могут вызвать разрушение лираглутида. В связи с отсутствием исследований совместимости данный лекарственный препарат нельзя смешивать с другими лекарственными препаратами.
Особые указания
Контроль применения препарата
Для улучшения контроля применения лекарственного препарата следует чётко указывать название и номер серии применяемого препарата.
Панкреатит
Применение агонистов рецепторов ГПП-1 ассоциировалось с развитием острого панкреатита.
Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. В случае подозрения на развитие панкреатита применение препарата Весфол следует прекратить; в случае подтверждения острого панкреатита терапию препаратом Весфол возобновлять не следует.
Холелитиаз и холецистит
В КИ была отмечена более высокая частота развития холелитиаза и холецистита у пациентов, получавших лираглутид, по сравнению с получавшими плацебо пациентами. Это может быть частично объяснено тем, что значительное снижение массы тела при применении лираглутида может увеличить риск развития холелитиаза и, следовательно, холецистита. Холелитиаз и холецистит могут привести к госпитализации и холецистэктомии. Пациенты должны быть проинформированы о характерных симптомах холелитиаза и холецистита.
Заболевания щитовидной железы
В ходе КИ с участием пациентов с СД2 были отмечены нежелательные реакции со стороны щитовидной железы, включая увеличение концентрации кальцитонина в сыворотке крови, зоб и новообразование щитовидной железы, в особенности у пациентов, уже имеющих заболевания щитовидной железы. У пациентов с заболеваниями щитовидной железы лираглутид следует применять с осторожностью.
В постмаркетинговом периоде у пациентов, получавших лираглутид, были отмечены случаи медуллярного рака щитовидной железы. Имеющихся данных недостаточно для установления или исключения причинно- следственной связи возникновения медуллярного рака щитовидной железы с применением лираглутида у человека. Препарат Весфол противопоказан к применению у пациентов с медуллярным раком щитовидной железы в анамнезе, в том числе в семейном, и множественной эндокринной неоплазией 2 типа. Необходимо проинформировать пациента о риске медуллярного рака щитовидной железы и о симптомах опухоли щитовидной железы (уплотнения в области шеи, дисфагия, одышка, непроходящая охриплость голоса).
Текущий контроль концентрации кальцитонина в сыворотке крови или ультразвуковое исследование (УЗИ) щитовидной железы не имеют существенного значения для раннего выявления медуллярного рака щитовидной железы у пациентов, применяющих лираглутид. Значительное повышение концентрации кальцитонина в сыворотке крови может свидетельствовать о наличии медуллярного рака щитовидной железы, пациенты с медуллярным раком щитовидной железы обычно имеют концентрацию кальцитонина более 50 нг/л. При выявлении повышения концентрации кальцитонина в сыворотке крови необходимо провести дальнейшее обследование пациента. Пациенты с узлами щитовидной железы, выявленными при медосмотре: или при УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Частота сердечных сокращений
В КИ было отмечено увеличение ЧСС (см. подраздел «Клиническая эффективность и безопасность»). Следует проводить контроль ЧСС с интервалами, соответствующими обычной клинической практике. Пациентов следует проинформировать о симптомах тахикардии (ощущение сердцебиения или ощущение учащённого сердцебиения в покое). У пациентов с клинически значимой постоянной тахикардией в состоянии покоя следует прекратить терапию препаратом Весфол.
Дегидратация
Признаки и симптомы дегидратации, включая нарушение функции почек и острую почечную недостаточность, были отмечены у пациентов, получавших агонисты рецепторов ГПП-1.
Пациенты, получающие препарат Весфол, должны быть проинформированы о потенциальном риске дегидратации, связанном с нежелательными реакциями со стороны ЖКТ, и о необходимости профилактики гиповолемии.
Гипогликемия у пациентов с СД2
Риск развития гипогликемии может быть выше у пациентов с СД2, получающих лираглутид в комбинации с инсулином и/или производными сульфонилмочевины. Этот риск может быть уменьшен путём снижения дозы инсулина и/или производного сульфонилмочевины.
Дети и подростки
Сообщалось об эпизодах клинически значимой гипогликемии у подростков (> 12 лет), получавших терапию лираглутидом. Пациенты должны быть проинформированы о характерных симптомах гипогликемии и соответствующих действиях.
Гипергликемия у пациентов с сахарным диабетом, получавших инсулин
У пациентов с СД препарат Весфол не должен применяться в качестве замены инсулина.
Сообщалось о диабетическом кетоацидозе у инсулинзависимых пациентов после быстрой отмены или снижения дозы инсулина (см. раздел «Способ применения и дозы»).
Вспомогательные вещества
Препарат Весфол содержит менее 1 ммоль (23 мг)/доза натрия, то есть, по сути, не содержит натрия.
Суицидальные мысли и поведение
В ходе КИ 6 (0,2%) из 3384 пациентов, получавших лираглутид, сообщили о появлении суицидальных мыслей, один из пациентов предпринял попытку суицида. У пациентов (1941 человек), получавших плацебо, это отмечено не было. Пациентов необходимо контролировать в отношении появления или ухудшения депрессии, суицидальных мыслей или поведения, и/или любых неожиданных изменений в настроении или поведении. У пациентов с суицидальными мыслями или поведением применение препарата Весфол следует прекратить.
Противопоказано применять препарат Весфол у пациентов с суицидальными попытками или активными суицидальными мыслями в анамнезе.
Рак молочной железы (РМЖ)
В ходе КИ сообщалось о подтверждённом РМЖ у 14 (0,6 %) из 2379 женщин, получавших лираглутид, по сравнению с 3 (0,2 %) из 1300 женщин, получавших плацебо, включая инвазивный рак (11 случаев у женщин, получавших лираглутид, и 3 случая у женщин, получавших плацебо) и внутрипротоковую карциному in situ (3 случая у женщин, получавших лираглутид, и 1 случай у женщины, получавшей плацебо). Большинство случаев рака были эстроген- и прогестерон зависимыми. Невозможно определить, были ли эти случаи с вязаны с применением лираглутида из-за их слишком небольшого количества.
Кроме того, нет достаточных данных, чтобы определить, оказывает ли лираглутид влияние на уже существующие новообразования молочной железы.
Папиллярный рак щитовидной железы
В ходе КИ сообщалось о подтверждённой папиллярной карциноме щитовидной железы у 7 (0,2 %) из 3291 пациентов, получавших лираглутид, по сравнению с отсутствием её в группе пациентов, получавших плацебо (1843 пациента). Из всех случаев 4 карциномы были менее 1 см в наибольшем диаметре и 4 были диагностированы по результатам гистологии после проведённой по медицинским показаниям тиреоидэктомии.
Неоплазии ободочной и прямой кишки
В ходе КИ сообщалось о подтверждённых доброкачественных неоплазиях ободочной и прямой кишки (преимущественно аденомах ободочной кишки) у 17 (0,5 %) из 3291 пациентов, получавших лираглутид, по сравнению с 4 (0,2 %) из 1843 пациентов, получавших плацебо. Было зарегистрировано два подтвержденных случая злокачественной карциномы ободочной и прямой кишки (0,1 %) у пациентов, получавших лираглутид, и ни одного у пациентов, получавших плацебо.
Нарушения сердечной проводимости
В ходе КИ у 11 (0,3 %) из 3384 пациентов, получавших лираглутид, сообщалось о развитии нарушений сердечной проводимости, таких как атриовентрикулярная блокада 1 степени, блокада правой ножки пучка Гиса или блокада левой ножки пучка Гиса. У пациентов (1941 человек), получавших плацебо, о развитии нарушений сердечной проводимости не сообщалось.
Влияние на способность управлять транспортными средствами, механизмами
Лираглутид не влияет или незначительно влияет на способность управлять транспортными средствами и механизмами. Однако существует риск возникновения головокружения, в основном в течение первых 3 месяцев лечения препаратом Энлигрия. При возникновении головокружения следует соблюдать осторожность при управлении транспортным средством или работе с механизмами.
В связи с риском развития гипогликемии при применении препарата, особенно при комбинированном применении с препаратами сульфонилмочевины у пациентов с СД2, следует соблюдать осторожность при управлении транспортными средствами и механизмами.
Руководство по применению
Препарат Весфол нельзя применять, если он выглядит иначе, чем прозрачный бесцветный раствор.
Препарат Весфол нельзя применять, если он был заморожен.
Препарат Весфол можно вводить при помощи игл длиной до 8 мм. Шприц-ручка подходит для использования с иглами НовоФайн®.
Инъекционные иглы не включены в упаковку.
Пациент должен быть проинформирован о том, что использованную иглу следует выбрасывать после каждой инъекции в соответствии с местными требованиями, а также о том, что шприц-ручку Весфол необходимо хранить с отсоединённой иглой. Такая мера позволит предотвратить закупорку игл, загрязнение, инфицирование и вытекание препарата из шприц-ручки и гарантирует точность дозирования.
Хранить в недоступном для детей месте.
Не применять по истечении срока годности.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в соответствии с установленными национальным законодательством требованиями.
Инструкция для пациентов по применению препарата Весфол
Внимательно прочитайте данную инструкцию перед использованием предварительно заполненной шприц-ручки с препаратом Весфол.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки маркировки на этикетке шприц-ручки. чтобы убедиться, что она содержит препарат Весфол 6 мг/мл, а затем внимательно изучите представленные ниже иллюстрации, на которых показаны различные детали шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы не можете различить цифры на счётчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь Вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Весфол.
Предварительно заполненная шприц-ручка содержит 18 мг лираглутида и позволяет выбрать дозы 0,6 мг, 1,2 мг, 1.8 мг, 2,4 мг и 3,0 мг.
Шприц-ручка с препаратом Весфол подходит для использования с одноразовыми иглами НовоФайн® длиной до 8 мм и толщиной до 32G (0,25/0,23 мм).
Иглы не входят в состав упаковки.
Важная информация
⚠ Обратите особое внимание на информацию, отмеченную такими значками, это очень важно для безопасного использования шприц-ручки.
Рисунок 3.
- Подготовка шприц-ручки к инъекции
Проверьте название и цветовой код на этикетке шприц-ручки. чтобы убедиться, что в ней содержится лираглутид. Применение неправильного препарата может быть вредным для Вашего здоровья.
Снимите колпачок со шприц-ручки (Рисунок 4).
Рисунок 4.
Снимите с новой одноразовой иглы бумажную наклейку (Рисунок 5).
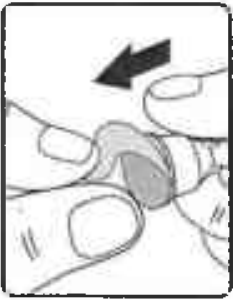
Рисунок 5.
Аккуратно и плотно накрутите иглу на шприц-ручку (Рисунок 6).
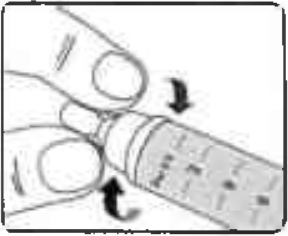
Рисунок 6.
Снимите наружный колпачок иглы и отложите его в сторону, не выбрасывая (Рисунок 7).
Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
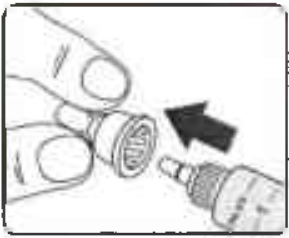
Рисунок 7.
Снимите внутренний колпачок иглы и выбросьте его (Рисунок 8).
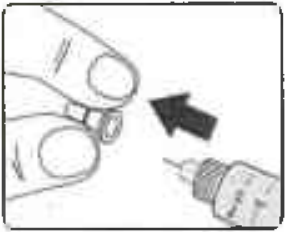
Рисунок 8.
⚠ При каждой инъекции всегда используйте новую иглу. Такая мера уменьшает риск загрязнения, инфицирования, утечки препарата из шприц-ручки. закупорки игл и гарантирует точность дозирования.
⚠ Обращайтесь с иглой аккуратно, чтобы не погнуть или не повредить её перед использованием.
⚠ Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
2. Уход за шприц-ручкой
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
- Предохраняйте шприц-ручку от попадания пыли, загрязнений и всех видов жидкостей.
- Шприц-ручку можно очищать тканью, смоченной мягким моющим средством.
- Не погружайте шприц-ручку в жидкость, не мойте и не смазывайте её, так как это может повредить механизм.
⚠ Важная информация
- Не передавайте шприц-ручку и иглы другим лицам.
- Храните шприц-ручку в недоступном для всех, а в особенности для детей, месте.
3. Проверка работы новой шприц-ручки
Всегда производите проверку работы шприц-ручки, как показано ниже, прежде чем использовать новую шприц-ручку для инъекций.
Если Вы уже используете шприц-ручку, переходите к этапу 4. «Установка дозы». Поворачивайте селектор дозы до тех пор, пока в индикаторном окошке символ проверки работы не поравняется с указателем дозы (Рисунок 9).
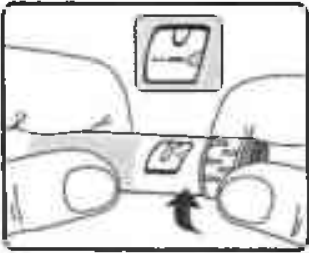
Рисунок 9.
Держа шприц-ручку иглой вверх, несколько раз постучите по картриджу пальцем, чтобы пузырьки воздуха переместились в верхнюю часть картриджа (Рисунок 10).
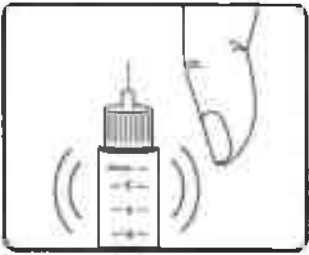
Рисунок 10.
Удерживая шприц-ручку иглой вверх, нажимайте пусковую кнопку до тех пор, пока в индикаторном окошке напротив указателя дозы не появится 0 мг (Рисунок 11).
На конце иглы должна появиться капля препарата.
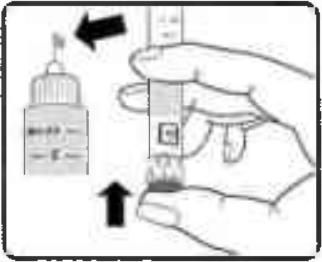
Рисунок 11.
Если капля не появилась, повторяйте операции, указанные на рисунках 9–11, пока на конце иглы не появится капля препарата. Если после 4 повторов указанных операций капля препарата на конце иглы так и не появилась, поменяйте иглу на новую и повторите операции, указанные на рисунках 9–11, ещё раз.
Если капля препарата на конце иглы так и не появилась, это означает, что шприц-ручка неисправна и Вы должны использовать новую шприц-ручку.
⚠ Если Вы уронили шприц-ручку на твёрдую поверхность или у Вас появились сомнения в её полной исправности, прежде чем начать введение препарата, прикрепите новую одноразовую иглу и осуществите проверку работы шприц-ручки.
4. Установка дозы
Прежде всего, удостоверьтесь, что в индикаторном окошке 0 мг находится напротив указателя дозы.
Поворачивайте селектор дозы до тех пор, пока нужная доза (0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг или 3,0 мг) в индикаторном окошке не поравняется с указателем дозы (Рисунок 12).
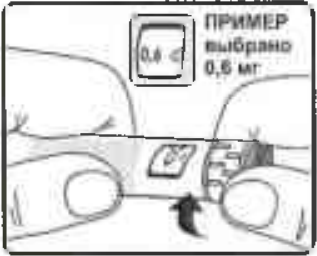
Рисунок 12.
Исправить ошибочно установленную лозу можно путём вращения селектора дозы вперёд или назад до тех пор, пока цифры нужной Вам дозы в индикаторном окошке не поравняются с указателем дозы. Максимальная доза, которую можно установить, составляет 3.0 мг.
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы (вперёд, назад или, если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке). Не считайте щелчки шприц-ручки.
При вращении селектора дозы назад соблюдайте осторожность, чтобы случайно не нажать на пусковую кнопку, во избежание выброса дозы препарата.
Если селектор дозы остановился до того, как в индикаторном окошке напротив указателя дозы появилась нужная Вам доза, это означает, что оставшегося в шприц-ручке препарата не хватает для введения полной дозы. В таком случае Вам следует выполнить одно из двух описанных ниже действий:
Ввести нужную дозу в два приёма:
Вращайте селектор дозы в любом направлении до тех пор, пока доза 0,6 мг, 1,2 мг, 1,8 мг или 2,4 мг не окажется напротив указателя дозы. Сделайте инъекцию. Затем подготовьте новую шприц-ручку для второй инъекции и введите остаток дозы препарата (в миллиграммах) для того, чтобы завершить введение полной дозы.
Вы можете разделить дозу препарата между используемой и новой шприц-ручкоЙ, только если Вас этому обучили или если это рекомендовал врач. Используйте калькулятор для планирования доз. Если Вы неправильно разделите дозу. Вы можете ввести недостаточное или слишком большое количество препарата.
Сделать инъекцию полной дозы препарата с помощью новой шприц-ручки:
Если селектор дозы остановился до того, как в индикаторном окошке напротив указателя дозы появились цифры 0,6 мг, подготовьте для инъекции новую шприц-ручку и введите полную дозу препарата с помощью новой шприц-ручки.
⚠ Не пытайтесь выбрать другие дозы, кроме доз 0,6 mi, 1,2 mi, 1,8 мг, 2,4 мг или 3,0 мг. Цифры в индикаторном окошке должны находиться точно напротив указателя дозы - такое положение гарантирует, что Вы получите правильную дозу препарата.
Селектор дозы при вращении издаёт щелчки. Не используйте эти щелчки для отмеривания дозы препарата, необходимой для инъекции.
Не используйте шкалу картриджа для отмеривания дозы препарата для инъекции - она показывает недостаточно точные значения.
5. Введение препарата
Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой. Затем следуйте инструкциям, данным ниже:
Нажмите пусковую кнопку до упора, пока в индикаторном окошке напротив указателя дозы не появится 0 мг. Будьте осторожны: не дотрагивайтесь пальцами до индикаторного окошка и не нажимайте на селектор дозы — это может вызвать блокировку механизма шприц-ручки (Рисунок 13).
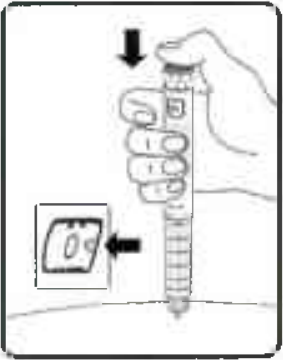
Рисунок 13.
Держите пусковую кнопку в нажатом до упора состоянии, а иглу под кожей в течение минимум 6 секунд (Рисунок 14). Это обеспечит введение полной дозы препарата.
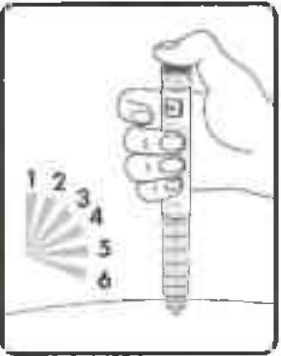
Рисунок 14.
Извлеките иглу из-под кожи (Рисунок 15).
Вы можете увидеть каплю препарата на конце иглы.
Это нормальное явление, которое никак не влияет на дозу препарата, которую Вы только что ввели.
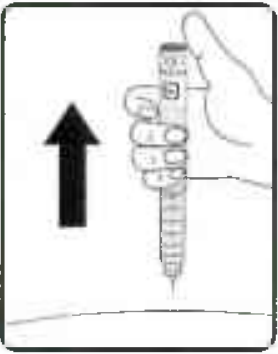
Рисунок 15.
Введите конец иглы внутрь наружного колпачка иглы, не дотрагиваясь до иглы и колпачка (Рисунок 16).
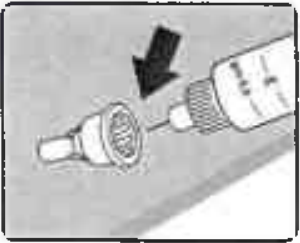
Рисунок 16.
Когда игла полностью окажется внутри колпачка, осторожно наденьте колпачок (Рисунок 17).
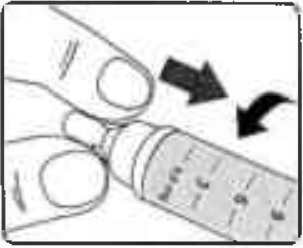
Рисунок 17.
Затем отвинтите иглу. Выбросьте иглу, соблюдая меры предосторожности, и закройте шприц-ручку колпачком (Рисунок 18).
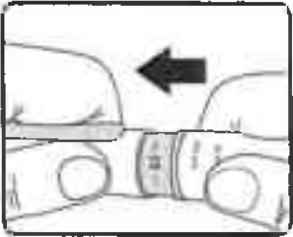
Рисунок 18.
Если шприц-ручка пуста, отвинтите иглу и, соблюдая меры предосторожности, выбросьте пустую шприц-ручку без иглы.
Соблюдайте местные требования по утилизации использованных медицинских материалов.
⚠ Удаляйте использованную иглу после каждой инъекции и не храните шприц-ручку с присоединённой иглой.
⚠ Это уменьшает риск загрязнения, инфицирования, утечки препарата из шприц-ручки и закупорки игл. Кроме того, это обеспечит точность дозирования.
⚠ Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы избежать случайных уколов и перекрёстного инфицирования.
Форма выпуска
Раствор для подкожного введения 6 мг/мл.
По 3 мл в картридж из стекла 1 гидролитического класса, укупоренный хлорбутиловым/полиизопреновым диском с одной стороны и бромбутиловым степпером с другой. Картридж запаян в пластиковую одноразовую шприц-ручку для многократных инъекций. По 3 или 5 пластиковых одноразовых шприц-ручек для многократных инъекций вместе с инструкцией по применению в картонную пачку. Картонная пачка может быть снабжена этикеткой контроля первого вскрытия.
Хранение
В защищённом от света месте при температуре от 2 до 8 °C (в холодильнике), но не рядом с морозильной камерой. Не замораживать.
Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30 °C или от 2 до 8 °C (в холодильнике) в течение 4 недель. Не замораживать. После использования закрывать шприц-ручку колпачком для защиты от света.
Срок годности
2 года.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
ПСК Фарма, ООО, Российская Федерация
Владелец регистрационного удостоверения:
ООО «Рус Биофарм»
664009 Иркутская обл., г. Иркутск, ул. Ширямова, д. 36 офис 204
Производитель:
Российская Федерация
ООО «ИСК Фарма»
141983, Московская обл., г.о. Дубна, г. Дубна, ул. Программистов, д. 5, стр. 1
Телефон: 8 (499) 400 16 99; 8 (496) 218 19 19
Электронная почта: officel@rusbiopharm.ru
Получить дополнительные данные о препарате, направить претензию на его качество, безопасность, сообщить нежелательных реакциях на препарат можно по телефону: 8 (800) 234 16 99 (бесплатная линия 24 часа) или по адресу электронной почты pv@rusbiopharm.ru
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Весфол:
