Зегфрови
Лекарственная форма
таблетки, для приёма внутрь
Листок вкладыш: информация для пациента
ОСНОВНЫЕ СВЕДЕНИЯ О ПРЕПАРАТЕ
Данная выдержка не включает всю информацию, необходимую для безопасного и эффективного применения препарата ЗЕГФРОВИ. См. полную инструкцию по медицинскому применению препарата ЗЕГФРОВИ.
ЗЕГФРОВИ™ (сурвозертиниб) таблетки, для приёма внутрь
Первое одобрение в США: 2025
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
ЗЕГФРОВИ является ингибитором киназ, показанным для лечения взрослых пациентов с местнораспространённым или метастатическим немелкоклеточным раком лёгкого (НМРЛ) с инсерционными мутациями экзона 20 гена рецептора эпидермального фактора роста (EGFR), выявленными с помощью одобренного FDA теста, у которых заболевание прогрессировало во время или после терапии препаратами платины. (1, 2.1)
Данное показание одобрено в рамках ускоренного одобрения на основе общей частоты ответа и продолжительности ответа. Продолжение одобрения для данного показания может быть обусловлено подтверждением и описанием клинической пользы в подтверждающих исследовании(ях). (1)
ДОЗИРОВКА И СПОСОБ ПРИМЕНЕНИЯ
Рекомендуемая доза: 200 мг внутрь один раз в день, принимается с пищей. (2.2)
ЛЕКАРСТВЕННАЯ ФОРМА И СОДЕРЖАНИЕ ДОЗ
Таблетки: 150 мг и 200 мг. (3)
ПРОТИВОПОКАЗАНИЯ
Отсутствуют. (4)
ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
Интерстициальная болезнь лёгких (ИБЛ)/Пневмонит: Наблюдайте за пациентами на предмет появления новых или ухудшения существующих лёгочных симптомов, указывающих на ИБЛ/пневмонит. Немедленно приостановите приём ЗЕГФРОВИ у пациентов с подозрением на ИБЛ/пневмонит и окончательно прекратите приём ЗЕГФРОВИ, если ИБЛ/пневмонит подтверждён. (2.3, 5.1)
Желудочно-кишечные нежелательные реакции: Принимайте ЗЕГФРОВИ с пищей для снижения желудочно-кишечных нежелательных реакций. Наблюдайте за пациентами на предмет тошноты, рвоты и диареи и обеспечивайте поддерживающую терапию, включая противодиарейные, противорвотные средства или регидратацию, по показаниям. Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести. (2.3, 5.2)
Дерматологические нежелательные реакции: Наблюдайте за пациентами на предмет сыпи и дерматологических нежелательных реакций. Инструктируйте пациентов использовать смягчающий крем, не содержащий спирта (например, не содержащий изопропанола, этанола) во время лечения ЗЕГФРОВИ, и избегать использования раздражающих средств по уходу за кожей (например, продуктов, содержащих ретинол или ретиноевую кислоту, бензоила пероксид). Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести. (2.3, 5.3)
Офтальмологическая токсичность: Немедленно направляйте пациентов с глазными симптомами, предполагающими кератит, к офтальмологу. Рекомендуйте прекратить использование контактных линз до оценки глазных симптомов. Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести. (2.3, 5.4)
Эмбрио-фетальная токсичность: Может вызывать вред для плода. Информируйте женщин репродуктивного потенциала о потенциальном риске для плода и о необходимости использования эффективной негормональной контрацепции. (5.5, 8.1, 8.3)
НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Наиболее частые (≥20%) нежелательные реакции: диарея, сыпь, снижение аппетита, стоматит, усталость, тошнота, паронихия, рвота, запор, боль в костно-мышечной системе, зуд, сухость кожи, инфекция мочевыводящих путей, боль в животе и снижение веса. (6.1)
Наиболее частые (≥25%) лабораторные отклонения 3 или 4 степени: снижение лимфоцитов, повышение липазы, снижение гемоглобина, повышение амилазы, повышение креатинкиназы, снижение нейтрофилов, снижение калия, повышение аспартатаминотрансферазы, повышение аланинаминотрансферазы, снижение натрия, повышение магния и повышение щелочной фосфатазы. (6.1)
Для сообщения о ПОДОЗРЕВАЕМЫХ НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ обращайтесь в Dizal (Jiangsu) Pharmaceutical Co., Ltd. по телефону +1-855-482-0653 или в FDA по телефону 1-800-FDA-1088 или на сайт www.fda.gov/medwatch.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Сильные ингибиторы CYP3A: Избегайте совместного применения. Если совместное применение неизбежно, снизьте дозу ЗЕГФРОВИ. (2.4, 7.1)
Сильные и умеренные индукторы CYP3A: Избегайте совместного применения. Если совместное применение неизбежно, увеличьте дозу ЗЕГФРОВИ. (2.4, 7.1)
Субстраты P-gp или BCRP: Наблюдайте за увеличением нежелательных реакций при совместном применении с ЗЕГФРОВИ. (7.2)
Гормональные контрацептивы: Избегайте совместного применения. (7.2)
ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ ПАЦИЕНТОВ
Лактация: Рекомендуется не кормить грудью. (8.2)
См. раздел 17 для ИНФОРМАЦИИ ДЛЯ КОНСУЛЬТИРОВАНИЯ ПАЦИЕНТОВ и одобренную FDA инструкцию для пациента.
Пересмотрено: 07/2025
Полная инструкция по медицинскому применению: Содержание*
1 ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
2 ДОЗИРОВКА И СПОСОБ ПРИМЕНЕНИЯ
2.1 Выбор пациентов
2.2 Рекомендуемая дозировка
2.3 Коррекция дозы при нежелательных реакциях
2.4 Коррекция дозы при лекарственных взаимодействиях
3 ЛЕКАРСТВЕННАЯ ФОРМА И СОДЕРЖАНИЕ ДОЗ
4 ПРОТИВОПОКАЗАНИЯ
5 ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
5.1 Интерстициальная болезнь лёгких/Пневмонит
5.2 Желудочно-кишечные нежелательные реакции
5.3 Дерматологические нежелательные реакции
5.4 Офтальмологическая токсичность
5.5 Эмбрио-фетальная токсичность
6 НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
6.1 Опыт клинических исследований
7 ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
7.1 Влияние других препаратов на ЗЕГФРОВИ
7.2 Влияние ЗЕГФРОВИ на другие препараты
8 ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ ПАЦИЕНТОВ
8.1 Беременность
8.2 Лактация
8.3 Женщины и мужчины репродуктивного потенциала
8.4 Применение у детей
8.5 Применение у пожилых пациентов
9 ОПИСАНИЕ
12 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
12.1 Механизм действия
12.2 Фармакодинамика
12.3 Фармакокинетика
13 ДОКЛИНИЧЕСКАЯ БЕЗОПАСНОСТЬ
13.1 Канцерогенность, мутагенность, нарушение фертильности
14 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
16 УСЛОВИЯ ОТПУСКА И ХРАНЕНИЯ
17 ИНФОРМАЦИЯ ДЛЯ КОНСУЛЬТИРОВАНИЯ ПАЦИЕНТОВ
* Разделы или подразделы, опущенные в полной инструкции по применению, не указаны.
1. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
ЗЕГФРОВИ показан для лечения взрослых пациентов с местнораспространённым или метастатическим немелкоклеточным раком лёгкого (НМРЛ) с инсерционными мутациями экзона 20 гена рецептора эпидермального фактора роста (EGFR), выявленными с помощью одобренного FDA теста [см. Дозировка и администрация (2.1)], у которых заболевание прогрессировало во время или после терапии препаратами платины.
Данное показание одобрено в рамках ускоренного одобрения на основе общей частоты ответа и продолжительности ответа [см. Клинические исследования (14)]. Продолжение одобрения для данного показания может быть обусловлено подтверждением и описанием клинической пользы в подтверждающих исследовании(ях).
2. ДОЗИРОВКА И СПОСОБ ПРИМЕНЕНИЯ
2.1 Выбор пациентов
Выбирайте пациентов для лечения ЗЕГФРОВИ по поводу местнораспространённого или метастатического НМРЛ на основании наличия инсерционных мутаций экзона 20 EGFR в ткани опухоли [см. Клинические исследования (14)]. Информация об одобренных FDA тестах доступна по адресу: http://www.fda.gov/CompanionDiagnostics.
2.2 Рекомендуемая дозировка
Рекомендуемая доза ЗЕГФРОВИ составляет 200 мг внутрь один раз в день с пищей [см. Предупреждения и меры предосторожности (5.2)] до прогрессирования заболевания или неприемлемой токсичности. Проглатывайте таблетки ЗЕГФРОВИ целиком. Не раскалывайте, не раздавливайте, не разжёвывайте и не растворяйте таблетки. Принимайте ЗЕГФРОВИ в одно и то же время каждый день.
Пропущенная доза
Если доза ЗЕГФРОВИ пропущена в течение 12 часов, примите дозу. Если с момента пропущенной дозы прошло более 12 часов, пропустите текущую дозу и примите следующую дозу в обычное запланированное время.
Рвота
Если доза ЗЕГФРОВИ вырвана, не принимайте дополнительную дозу. Примите следующую дозу в обычное запланированное время.
2.3 Коррекция дозы при нежелательных реакциях
Снизьте дозу ЗЕГФРОВИ до 150 мг внутрь один раз в день с пищей для купирования нежелательных реакций. Окончательно прекратите приём ЗЕГФРОВИ у пациентов, не переносящих 150 мг внутрь один раз в день.
Рекомендуемые коррекции дозы при нежелательных реакциях представлены в Таблице 1.
| Нежелательная реакция | Степень тяжести* | Коррекция дозы |
|---|---|---|
| Интерстициальная болезнь лёгких (ИБЛ)/Пневмонит [см. Предупреждения и меры предосторожности (5.1)] | Любая степень | • Приостановите приём ЗЕГФРОВИ при подозрении на ИБЛ/пневмонит. • Окончательно прекратите приём ЗЕГФРОВИ при подтверждении ИБЛ/пневмонита. |
| 1 степень | • Обеспечьте поддерживающую терапию, включая противорвотные средства. | |
| Тошнота или Рвота [см. Предупреждения и меры предосторожности (5.2)] | 2 степень | • Обеспечьте поддерживающую терапию, включая противорвотные средства. • Приостановите приём ЗЕГФРОВИ до восстановления до степени ≤1; затем возобновите приём ЗЕГФРОВИ в той же дозе. |
| 3 или 4 степень | • Обеспечьте поддерживающую терапию, включая противорвотные средства. • Приостановите приём ЗЕГФРОВИ до восстановления до степени ≤1; затем возобновите приём ЗЕГФРОВИ в следующей сниженной дозе. |
|
| Диарея [см. Предупреждения и меры предосторожности (5.2)] | 1 степень | • Обеспечьте поддерживающую терапию, включая противодиарейные средства (например, лоперамид). |
| 2 или 3 степень | Первое возникновение • Обеспечьте поддерживающую терапию и противодиарейные средства (например, лоперамид). • Приостановите приём ЗЕГФРОВИ до восстановления до степени ≤1; затем возобновите приём ЗЕГФРОВИ на том же уровне дозы. |
|
| Повторное возникновение • Приостановите приём ЗЕГФРОВИ до восстановления до степени ≤1; затем возобновите приём ЗЕГФРОВИ в следующей сниженной дозе. |
||
| 4 степень | Первое возникновение • Приостановите приём ЗЕГФРОВИ и обеспечьте поддерживающую терапию и противодиарейные средства (например, лоперамид). • Если разрешилась до степени ≤1 в течение 3 недель, возобновите приём ЗЕГФРОВИ в следующей сниженной дозе. • Если не разрешилась до степени ≤1 в течение 3 недель, окончательно прекратите приём ЗЕГФРОВИ. |
|
| Повторное возникновение • Окончательно прекратите приём ЗЕГФРОВИ. |
||
| Дерматологические нежелательные реакции [см. Предупреждения и меры предосторожности (5.3)] | 2 степень | • Обеспечьте поддерживающую терапию. • Проведите повторную оценку в течение 3 недель, если сыпь не улучшается, рассмотрите снижение дозы ЗЕГФРОВИ. |
| 3 степень | • Приостановите приём ЗЕГФРОВИ и обеспечьте поддерживающую терапию. • После восстановления до степени ≤1 возобновите приём ЗЕГФРОВИ в следующей сниженной дозе. • Если улучшения нет в течение 3 недель, окончательно прекратите приём ЗЕГФРОВИ. |
|
| 4 степень | • Окончательно прекратите приём ЗЕГФРОВИ. | |
| Офтальмологическая токсичность [см. Предупреждения и меры предосторожности (5.4)] | Любая степень | • Приостановите приём ЗЕГФРОВИ при подозрении на язвенный кератит. • Окончательно прекратите приём ЗЕГФРОВИ при подтверждении язвенного кератита. |
| 3 или 4 степень | • Приостановите приём ЗЕГФРОВИ. • Если разрешилась до степени ≤1 в течение 3 недель, возобновите приём ЗЕГФРОВИ в той же дозе или следующей сниженной дозе. • Если не разрешилась до степени ≤1 в течение 3 недель, окончательно прекратите приём ЗЕГФРОВИ. |
* Нежелательные реакции оценивались по Общим критериям терминологии для нежелательных явлений Национального института рака Версия 5.0 (NCI CTCAE v5.0).
2.4 Коррекция дозы при лекарственных взаимодействиях
Сильные ингибиторы CYP3A
Избегайте совместного применения сильных ингибиторов CYP3A. Если совместное применение неизбежно, снизьте дозу ЗЕГФРОВИ с 200 мг до 150 мг [см. Лекарственные взаимодействия (7.1)].
После отмены ингибитора CYP3A возобновите приём дозы ЗЕГФРОВИ (через 3–5 периодов полувыведения ингибитора CYP3A), которая принималась до начала приёма ингибитора CYP3A.
Сильные и умеренные индукторы CYP3A
Избегайте совместного применения сильных и умеренных индукторов CYP3A. Если совместное применение неизбежно, увеличьте дозу ЗЕГФРОВИ с 200 мг до 400 мг [см. Лекарственные взаимодействия (7.1)].
После отмены индуктора CYP3A возобновите приём дозы ЗЕГФРОВИ (через 7–14 дней после отмены индуктора CYP3A), которая принималась до начала приёма индуктора CYP3A.
3. ЛЕКАРСТВЕННАЯ ФОРМА И СОДЕРЖАНИЕ ДОЗ
Таблетки:
- 150 мг: жёлтые, двояковыпуклые, покрытые плёночной оболочкой таблетки, с гравировкой «150» на одной стороне и логотипом компании Dizal на другой стороне.
- 200 мг: жёлтые, двояковыпуклые, покрытые плёночной оболочкой таблетки, с гравировкой «200» на одной стороне и логотипом компании Dizal на другой стороне.
4. ПРОТИВОПОКАЗАНИЯ
Отсутствуют.
5. ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
5.1 Интерстициальная болезнь лёгких/Пневмонит
ЗЕГФРОВИ может вызывать тяжёлую и угрожающую жизни интерстициальную болезнь лёгких (ИБЛ)/пневмонит.
В популяции безопасности [см. Нежелательные реакции (6.1)] ИБЛ/пневмонит возникал у 1,7% пациентов. Медианное время до первого возникновения ИБЛ/пневмонита составило 61 день (диапазон: от 35 до 86 дней). Приём ЗЕГФРОВИ был прекращён из-за ИБЛ/пневмонита у 0,8% пациентов.
Наблюдайте за пациентами на предмет появления новых или ухудшения существующих лёгочных симптомов, указывающих на ИБЛ/пневмонит (например, одышка, кашель и лихорадка). Немедленно приостановите приём ЗЕГФРОВИ у пациентов с подозрением на ИБЛ/пневмонит и окончательно прекратите приём ЗЕГФРОВИ, если ИБЛ/пневмонит подтверждён [см. Дозировка и администрация (2.3)].
5.2 Желудочно-кишечные нежелательные реакции
ЗЕГФРОВИ может вызывать тяжёлые желудочно-кишечные нежелательные реакции, включая диарею, тошноту и рвоту.
В популяции безопасности [см. Нежелательные реакции (6.1)] серьёзные желудочно-кишечные нежелательные реакции возникали у 1,7% пациентов, включая тошноту 3 степени у 0,8%. Диарея возникала у 73% пациентов, получавших ЗЕГФРОВИ, включая 2,5% случаев 3 степени. Диарея, приведшая к перерыву в дозировании или снижению дозы, возникала у 5% пациентов и потребовала окончательной отмены ЗЕГФРОВИ у 0,8% пациентов. Тошнота и рвота возникали у 43% пациентов, включая 3,3% событий 3 степени. Тошнота и рвота, приведшие к перерыву в дозировании или снижению дозы, возникали у 7% пациентов и окончательной отмене ЗЕГФРОВИ у 0,8% пациентов.
Принимайте ЗЕГФРОВИ с пищей для снижения желудочно-кишечных нежелательных реакций. Наблюдайте за пациентами на предмет желудочно-кишечной токсичности и обеспечивайте поддерживающую терапию, включая противодиарейные, противорвотные средства или регидратацию, по показаниям. Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести [см. Дозировка и администрация (2.3)].
5.3 Дерматологические нежелательные реакции
ЗЕГФРОВИ может вызывать тяжёлую сыпь, включая акнеформный дерматит и зуд.
На основании популяции безопасности [см. Нежелательные реакции (6.1)] дерматологические нежелательные реакции возникали у 68% пациентов, включая 9% акнеформного дерматита. Дерматологические нежелательные реакции 3 степени составили: сыпь 7%, акнеформный дерматит 0,8% и зуд 0,8%.
Инструктируйте пациентов использовать смягчающий крем, не содержащий спирта (например, не содержащий изопропанола, этанола) во время лечения ЗЕГФРОВИ, и избегать использования раздражающих средств по уходу за кожей (например, продуктов, содержащих ретинол или ретиноевую кислоту, бензоила пероксид).
Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести [см. Дозировка и администрация (2.3)].
5.4 Офтальмологическая токсичность
ЗЕГФРОВИ может вызывать офтальмологическую токсичность, включая кератит, симптомы сухого глаза, нечёткость зрения и нарушение зрения.
На основании популяции безопасности [см. Нежелательные реакции (6.1)] офтальмологическая токсичность возникала у 13% пациентов, получавших ЗЕГФРОВИ, включая кератит (0,8%).
Немедленно направляйте пациентов с новыми или ухудшающимися глазными симптомами к офтальмологу. Рекомендуйте прекратить использование контактных линз до оценки глазных симптомов. Приостановите приём, снизьте дозу или окончательно прекратите приём ЗЕГФРОВИ в зависимости от степени тяжести [см. Дозировка и администрация (2.3)].
5.5 Эмбрио-фетальная токсичность
На основании данных исследований на животных и его механизма действия, ЗЕГФРОВИ может вызывать вред для плода при назначении беременной женщине.
В исследованиях репродукции у животных пероральное введение сурвозертиниба беременным животным в период органогенеза приводило к структурным аномалиям при концентрациях ниже воздействия на человека при рекомендуемой дозе на основании площади под кривой (AUC) [см. Применение в отдельных группах пациентов (8.1)].
Информируйте беременных женщин и женщин репродуктивного потенциала о потенциальном риске для плода. Информируйте женщин репродуктивного потенциала о необходимости использования эффективной негормональной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы, поскольку ЗЕГФРОВИ может делать некоторые гормональные контрацептивы неэффективными [см. Лекарственные взаимодействия (7.2)]. Информируйте пациентов мужского пола с партнёршами репродуктивного потенциала о необходимости использования эффективной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы [см. Применение в отдельных группах пациентов (8.1, 8.3)].
6. НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Следующие нежелательные реакции описаны в других разделах маркировки:
- Интерстициальная болезнь лёгких/Пневмонит [см. Предупреждения и меры предосторожности (5.1)]
- Желудочно-кишечные нежелательные реакции [см. Предупреждения и меры предосторожности (5.2)]
- Дерматологические нежелательные реакции [см. Предупреждения и меры предосторожности (5.3)]
- Офтальмологическая токсичность [см. Предупреждения и меры предосторожности (5.4)]
6.1 Опыт клинических исследований
Поскольку клинические исследования проводятся в широко варьирующихся условиях, частоты нежелательных реакций, наблюдаемые в клинических исследованиях одного препарата, нельзя напрямую сравнивать с частотами в клинических исследованиях другого препарата и они могут не отражать частоты, наблюдаемые на практике.
Объединённые популяции безопасности, описанные в разделе ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ, отражают воздействие ЗЕГФРОВИ в качестве монотерапии в дозе 200 мг внутрь один раз в день у 121 пациента с местнораспространённым или метастатическим НМРЛ из двух клинических исследований WU-KONG1 (NCT03974022) [см. Клинические исследования (14)] и WU-KONG2 (n=3). Среди 121 пациента, получавшего ЗЕГФРОВИ, 56% подвергались воздействию в течение 6 месяцев или дольше, а 28% — более одного года. В этой объединённой популяции безопасности наиболее частыми (≥20%) нежелательными реакциями были диарея, сыпь, снижение аппетита, стоматит, усталость, тошнота, паронихия, рвота, запор, боль в костно-мышечной системе, зуд, сухость кожи, инфекция мочевыводящих путей, боль в животе и снижение веса. Наиболее частыми (≥2%) лабораторными отклонениями 3 или 4 степени были снижение лимфоцитов, повышение липазы, снижение гемоглобина, повышение амилазы, повышение креатинкиназы, снижение нейтрофилов, снижение калия, повышение аспартатаминотрансферазы, повышение аланинаминотрансферазы, снижение натрия, повышение магния и повышение щелочной фосфатазы.
Местнораспространённый или метастатический НМРЛ с инсерционными мутациями экзона 20 EGFR, ранее леченный препаратами платины
Безопасность ЗЕГФРОВИ оценивалась в исследовании WU-KONG1B [см. Клинические исследования (14)] у пациентов с местнораспространённым или метастатическим НМРЛ с инсерционными мутациями экзона 20 EGFR в многонациональном, открытом, рандомизированном по дозам клиническом исследовании. Подходящие пациенты должны были иметь прогрессирование заболевания во время или после терапии препаратами платины и получали ЗЕГФРОВИ 200 мг внутрь один раз в день до прогрессирования заболевания или непереносимой токсичности. Медианный возраст пациентов, получавших ЗЕГФРОВИ, составил 62 года (диапазон: 35-88); 67% были женщинами; 65% были азиатами и 33% были белыми; 97% не были латиноамериканцами или латиносами.
Серьёзные нежелательные реакции возникали у 41% пациентов, получавших ЗЕГФРОВИ. Серьёзные нежелательные реакции у ≥2% пациентов, получавших ЗЕГФРОВИ, были: пневмония (9%); одышка (4,4%); и панкреатит, устройство-ассоциированная инфекция и сыпь (по 2,2% каждый). Летальные нежелательные реакции возникали у 2,2% пациентов, получавших ЗЕГФРОВИ, включая тромбоз (1,1%) и инфекцию COVID-19 (1,1%).
Окончательное прекращение приёма ЗЕГФРОВИ из-за нежелательных реакций произошло у 8% пациентов. Нежелательные реакции, приведшие к прекращению лечения ЗЕГФРОВИ у ≥2% пациентов, были пневмония и сыпь (по 2,2% каждая).
Перерыв в дозировании ЗЕГФРОВИ из-за нежелательных реакций произошёл у 48% пациентов. Нежелательные реакции, потребовавшие перерыва в дозировании ЗЕГФРОВИ у ≥5% пациентов, были рвота (9%), пневмония (8%) и сыпь (8%).
Снижение дозы ЗЕГФРОВИ из-за нежелательных реакций произошло у 23% пациентов. Нежелательные реакции, потребовавшие снижения дозы ЗЕГФРОВИ у ≥3% пациентов, были сыпь (4,4%) и диарея (3,3%).
В Таблице 2 приведены нежелательные реакции в исследовании WU-KONG1B.
| Нежелательная реакция | ЗЕГФРОВИ N=91 | |
|---|---|---|
| Все степени¹ (%) | 3 или 4 степень (%) | |
| Нарушения со стороны желудочно-кишечного тракта | ||
| Диарея* | 73 | 2.2 |
| Стоматит* | 40 | 2.2 |
| Рвота* | 35 | 0 |
| Тошнота | 32 | 2.2 |
| Запор | 27 | 0 |
| Снижение веса | 26 | 3.3 |
| Боль в животе* | 19 | 1.1 |
| Вздутие живота | 16 | 0 |
| Нарушения со стороны кожи и подкожных тканей | ||
| Сыпь* | 60 | 8 |
| Паронихия* | 30 | 0 |
| Зуд | 26 | 1.1 |
| Сухость кожи* | 21 | 0 |
| Нарушения обмена веществ и питания | ||
| Снижение аппетита | 52 | 0 |
| Общие нарушения и нарушения в месте введения | ||
| Усталость* | 41 | 1.1 |
| отёки* | 11 | 0 |
| Недомогание | 11 | 1.1 |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | ||
| Боль в костно-мышечной системе* | 26 | 2.2 |
| Инфекции и инвазии | ||
| Инфекция мочевыводящих путей* | 24 | 1.1 |
| Пневмония* | 25 | 11 |
| Нарушения со стороны органа зрения | ||
| Офтальмологическая токсичность* | 18 | 0 |
| Нарушения со стороны нервной системы | ||
| Периферическая нейропатия* | 14 | 0 |
| Нарушения со стороны сердца | ||
| Аритмия* | 12 | 1.1 |
¹NCI CTCAE v5.0.
*Группированные термины
Клинически значимые нежелательные реакции у <10% пациентов, получавших ЗЕГФРОВИ: кашель, головокружение, одышка, сухость глаза и кератит.
В Таблице 3 приведены лабораторные отклонения в исследовании WU-KONG1B.
| Лабораторное отклонение | ЗЕГФРОВИ¹ N=91 | |
|---|---|---|
| Все степени² (%) | 3 или 4 степень (%) | |
| Биохимия | ||
| Повышение креатинина | 62 | 0 |
| Повышение креатинкиназы | 57 | 8 |
| Повышение липазы | 47 | 13 |
| Повышение аспартатаминотрансферазы | 44 | 4.4 |
| Повышение амилазы | 37 | 9 |
| Снижение натрия | 33 | 3.4 |
| Снижение альбумина | 32 | 0 |
| Снижение калия | 29 | 3.4 |
| Повышение аланинаминотрансферазы | 28 | 4.4 |
| Повышение магния | 23 | 4.4 |
| Повышение щелочной фосфатазы | 21 | 2.2 |
| Гематология | ||
| Снижение гемоглобина | 61 | 12 |
| Снижение лимфоцитов | 54 | 20 |
| Снижение нейтрофилов | 41 | 4.4 |
| Анализ мочи | ||
| Повышение белка в моче | 38 | 0 |
¹Знаменатель, использованный для расчета частоты, варьировался от 89 до 90 в зависимости от количества пациентов с исходным значением и хотя бы одним значением после лечения.
²NCI CTCAE v5.0
Опыт других клинических исследований
Следующие нежелательные реакции возникали после приёма ЗЕГФРОВИ: Интерстициальная болезнь лёгких (ИБЛ)/Пневмонит
7. ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
7.1 Влияние других препаратов на ЗЕГФРОВИ
В Таблице 4 описаны лекарственные взаимодействия, при которых совместное применение с другим препаратом влияет на ЗЕГФРОВИ.
| Сильные ингибиторы CYP3A | |
|---|---|
| Профилактика или управление | Избегайте совместного применения с сильными ингибиторами CYP3A. • Если совместное применение неизбежно, снизьте дозу ЗЕГФРОВИ, как рекомендовано [см. Дозировка и администрация (2.4)], и наблюдайте за увеличением нежелательных реакций ЗЕГФРОВИ. |
| Механизм и клинический эффект(ы) | • Сурвозертиниб является субстратом CYP3A. • Совместное применение с сильными ингибиторами CYP3A увеличивает экспозицию сурвозертиниба [см. Клиническая фармакология (12.3)], что может увеличить риск связанных с ЗЕГФРОВИ нежелательных реакций. |
| Сильные или умеренные индукторы CYP3A | |
| Профилактика или управление | • Избегайте совместного применения с сильными и умеренными индукторами CYP3A. • Если совместное применение неизбежно, увеличьте дозу ЗЕГФРОВИ, как рекомендовано [см. Дозировка и администрация (2.4)]. |
| Механизм и клинический эффект(ы) | • Сурвозертиниб является субстратом CYP3A. • Совместное применение с сильными или умеренными индукторами CYP3A уменьшает экспозицию сурвозертиниба [см. Клиническая фармакология (12.3)], что может снизить эффективность ЗЕГФРОВИ. |
7.2 Влияние ЗЕГФРОВИ на другие препараты
В Таблице 5 описаны лекарственные взаимодействия, при которых совместное применение с ЗЕГФРОВИ влияет на другой препарат.
| Гормональные контрацептивы (субстраты CYP3A) | |
|---|---|
| Профилактика или управление | • Избегайте совместного применения ЗЕГФРОВИ с гормональными контрацептивами. • Информируйте женщин репродуктивного потенциала о необходимости использования эффективной негормональной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы. |
| Механизм и клинический эффект(ы) | • Сурвозертиниб является индуктором CYP3A4. • Совместное применение ЗЕГФРОВИ с субстратами CYP3A снижало их плазменные концентрации [см. Клиническая фармакология (12.3)], где минимальные изменения концентрации могут привести к терапевтической неудаче гормональных контрацептивов. |
| Субстраты P-gp или BCRP | |
| Профилактика или управление | • Наблюдайте за увеличением нежелательных реакций субстратов P-gp или BCRP, где минимальные изменения концентрации могут привести к серьёзным нежелательным реакциям, при совместном применении с ЗЕГФРОВИ. |
| Механизм и клинический эффект(ы) | • Сурвозертиниб является ингибитором P-gp и BCRP. • ЗЕГФРОВИ увеличивает экспозицию субстратов P-gp или BCRP [см. Клиническая фармакология (12.3)], что может увеличить риск нежелательных реакций, связанных с этими субстратами. |
8. ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ ПАЦИЕНТОВ
8.1 Беременность
Риски
На основании данных исследований на животных и его механизма действия [см. Клиническая фармакология (12.1)], ЗЕГФРОВИ может вызывать вред для плода при назначении беременной женщине. Нет доступных данных по применению ЗЕГФРОВИ у беременных женщин для информирования о риске, связанном с препаратом. Пероральное введение сурвозертиниба беременным животным в период органогенеза приводило к структурным аномалиям при концентрациях ниже воздействия на человека при рекомендуемой дозе на основании AUC (см. Данные). Информируйте беременных женщин и женщин репродуктивного потенциала о потенциальном риске для плода.
В общей популяции США оценочный фоновый риск основных врождённых дефектов и выкидыша при клинически распознанной беременности составляет от 2% до 4% и от 15% до 20% соответственно.
Данные
Данные по животным
В исследовании эмбрио-фетального развития беременные крысы получали пероральные дозы 10, 20 или 40 мг/кг/день сурвозертиниба в период органогенеза (дни гестации с 6 по 17). Сурвозертиниб вызывал материнскую токсичность (снижение массы тела и потребления пищи) и эмбрио-фетальную токсичность (скелетные вариации) в дозе 40 мг/кг/день (0,6 раза от воздействия на человека при рекомендуемой дозе на основании AUC).
В исследовании эмбрио-фетального развития беременные кролики получали пероральные дозы 0,5, 1,5 или 5 мг/кг/день сурвозертиниба в период органогенеза (дни гестации с 6 по 19). Сурвозертиниб вызывал материнскую токсичность (снижение массы тела и потребления пищи) и эмбрио-фетальную токсичность, включая увеличение частоты висцеральных мальформаций сердца и лёгких при ≥0,5 мг/кг/день (0,02 раза от воздействия на человека при рекомендуемой дозе на основании AUC) и скелетные вариации при ≥1,5 мг/кг/день (0,07 раза от воздействия на человека при рекомендуемой дозе на основании AUC).
8.2 Лактация
Риски
Нет данных о присутствии сурвозертиниба или его метаболитов в грудном молоке человека или их влиянии на ребёнка, вскармливаемого грудью, или на выработку молока. Ввиду потенциального риска серьёзных нежелательных реакций у детей, вскармливаемых грудью, рекомендуйте женщинам не кормить грудью во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы.
8.3 Женщины и мужчины репродуктивного потенциала
На основании данных по животным и механизма действия, ЗЕГФРОВИ может вызывать вред для плода при назначении беременным женщинам [см. Применение в отдельных группах пациентов (8.1)].
Тест на беременность
Проверяйте статус беременности у женщин репродуктивного потенциала до начала приёма ЗЕГФРОВИ.
Контрацепция
Женщины
Информируйте женщин репродуктивного потенциала о необходимости использования эффективной негормональной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы. ЗЕГФРОВИ может делать гормональные контрацептивы неэффективными [см. Лекарственные взаимодействия (7.2)].
Мужчины
Информируйте пациентов мужского пола с партнёршами репродуктивного потенциала о необходимости использования эффективной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы [см. Применение в отдельных группах пациентов (8.1)].
Бесплодие
Женщины
На основании исследований на животных, ЗЕГФРОВИ может нарушать фертильность у женщин. Обратимость эффектов на женскую фертильность не оценивалась [см. Доклиническая безопасность (13.1)].
Мужчины
На основании исследований на животных, ЗЕГФРОВИ может нарушать фертильность у мужчин. Эффекты на мужскую фертильность были обратимыми [см. Доклиническая безопасность (13)].
8.4 Применение у детей
Безопасность и эффективность ЗЕГФРОВИ у пациентов детского возраста не установлены.
8.5 Применение у пожилых пациентов
Из 121 пациента, получавшего ЗЕГФРОВИ 200 мг в клинических исследованиях, 43% были в возрасте 65 лет и старше, и 9% были в возрасте 75 лет и старше. Не было отмечено общей разницы в эффективности между пациентами в возрасте ≥65 лет и более молодыми пациентами. Наблюдалась более высокая частота нежелательных реакций степени ≥3 (69% против 52%) и серьёзных нежелательных реакций (48% против 38%) у пациентов в возрасте 65 лет и старше по сравнению с теми, кто моложе 65 лет.
11. ОПИСАНИЕ
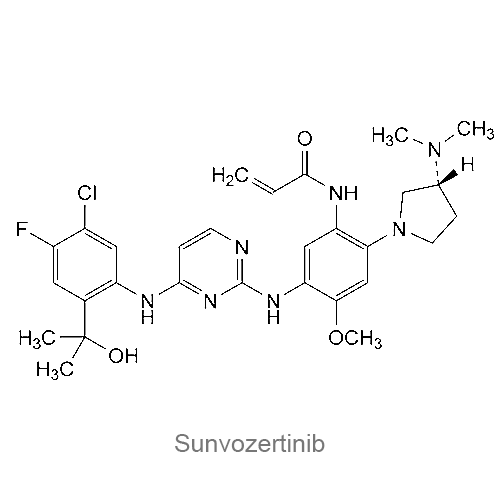
ЗЕГФРОВИ (сурвозертиниб) является ингибитором киназ. Молекулярная формула сурвозертиниба C29H45ClFN2O3, а молекулярная масса 584,09 г/моль. Химическое название сурвозертиниба: N-{5-[(4-{[5-хлор-4-фтор-2-(1-гидрокси-1-метилэтил)фенил]амино}пиримидин-2-ил)амино]-2-{[(3R)-3-(диметиламино)пирролидин-1-ил]-4-метоксифенил}проп-2-енамид. Сурвозертиниб имеет один хиральный атом углерода с R-конфигурацией. Химическая структура сурвозертиниба показана ниже:
Таблетки ЗЕГФРОВИ содержат 150 мг или 200 мг активного ингредиента сурвозертиниба. Неактивные ингредиенты в ядре таблеток ЗЕГФРОВИ: диоксид кремния коллоидный, кроскармеллоза натрия, гидроксипропилцеллюлоза, лактозы моногидрат, стеарат магния и микрокристаллическая целлюлоза. Плёночная оболочка таблетки состоит из гипромеллозы 2910, жёлтого оксида железа, диоксида титана и триацетина.
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
12.1 Механизм действия
Сурвозертиниб является ингибитором киназ рецептора эпидермального фактора роста (EGFR), который связывается и ингибирует инсерционные мутации экзона 20 EGFR при концентрациях, аналогичных таковым для дикого типа EGFR.
В моделях культивируемых клеток сурвозертиниб ингибировал фосфорилирование EGFR в клетках, экспрессирующих различные варианты инсерционных мутаций экзона 20 EGFR, при концентрациях примерно в 2–10 раз более низких, чем ингибирование сигналинга дикого типа EGFR. Сурвозертиниб проявлял противоопухолевую активность в ксенографтовых моделях НМРЛ с инсерционными мутациями экзона 20 EGFR.
12.2 Фармакодинамика
Связь экспозиция-ответ
Не было отмечено клинически значимых зависимостей «экспозиция-ответ» для общей частоты ответа (ORR) в диапазоне экспозиций между сурвозертинибом 200 мг и 300 мг (1,5 раза от одобренной рекомендуемой дозы).
Сердечная электрофизиология
При дозе, в 1,5 раза превышающей одобренную рекомендуемую дозу, клинически значимого удлинения интервала QTc не наблюдалось.
12.3 Фармакокинетика
Фармакокинетика сурвозертиниба наблюдалась в стационарном состоянии при одобренной рекомендуемой дозировке и представлена как среднее геометрическое (CV%), если не указано иное.
Общая системная экспозиция (AUC) и максимальная концентрация (Cmax) сурвозертиниба увеличиваются приблизительно пропорционально дозе в диапазоне доз от 50 мг (0,25 раза от одобренной рекомендуемой дозы) до 400 мг (2 раза от одобренной рекомендуемой дозы). Стационарное состояние достигается в течение 15 дней, и среднее накопление AUC составило приблизительно 3 раза. Стационарные Cmax и AUC сурвозертиниба составили 412 (45%) нг/мл и 8 060 (42%) ч × нг/мл соответственно.
Всасывание
Медианное (минимум, максимум) время достижения максимальной плазменной концентрации (tmax) сурвозертиниба составляет приблизительно 6 часов (3, 10 часов).
Влияние пищи
Не наблюдалось клинически значимых различий в AUC и Cmax сурвозертиниба после введения сурвозертиниба с пищей с высоким содержанием жиров (приблизительно 1000 калорий, приблизительно 50% жира).
Распределение
Кажущийся (пероральный) объём распределения составляет 2116 л (81%). Связывание сурвозертиниба с белками плазмы in vitro составляет от приблизительно 89% до 94%.
Выведение
Период полувыведения сурвозертиниба составляет 50 часов (27%) с кажущимся (пероральным) клиренсом 29 л/ч (54%).
Метаболизм
Сурвозертиниб в основном метаболизируется CYP3A с образованием активного деметилированного метаболита DZ0753. AUC DZ0753 составляет 10% от AUC родительского вещества.
Экскреция
После однократного перорального введения меченого радиоактивной меткой сурвозертиниба 79% дозы было обнаружено в фекалиях (7,3% в неизменённом виде) и 10% в моче (5,6% в неизменённом виде).
Особые популяции
Не наблюдалось клинически значимых различий в фармакокинетике сурвозертиниба на основании возраста (от 19 до 96 лет), пола, расы (азиаты 62%, белые 28%, черные или афроамериканцы 8%), массы тела (от 30 до 118 кг), статуса курения, лёгкой и умеренной почечной недостаточности (CLcr от 30 до 89 мл/мин, рассчитано по Кокрофту-Голту) и лёгкой (билирубин ≤ВГН и АСТ > ВГН или билирубин >1 до 1,5 × ВГН и любой АСТ) и умеренной (билирубин ≥1,5 до 3 × ВГН и любой АСТ) печёночной недостаточности. Влияние тяжёлой печёночной недостаточности (общий билирубин >3 × ВГН и любой АСТ) и тяжёлой почечной недостаточности (CLcr от 15 до 29 мл/мин) на фармакокинетику сурвозертиниба не изучалось.
Исследования лекарственных взаимодействий
Клинические исследования и подходы, основанные на моделировании
- Сильные ингибиторы CYP3A: AUC сурвозертиниба увеличилась в 1,5 раза, а Cmax в 1,3 раза после совместного введения итраконазола (сильный ингибитор CYP3A) 200 мг один раз в день.
- Сильные и умеренные индукторы CYP3A: AUC сурвозертиниба снизилась на 48%, а Cmax на 38% после совместного введения карбамазепина (сильный индуктор CYP3A) 300 мг два раза в день.
- Прогнозируется, что AUC сурвозертиниба снизится на 44% после совместного введения эфавиренза (умеренный индуктор CYP3A) 600 мг один раз в день.
- Субстраты CYP3A: AUC мидазолама (чувствительный субстрат CYP3A) снизилась на 23%, а Cmax на 15% после совместного введения ЗЕГФРОВИ.
- Субстраты P-гликопротеина (P-gp): AUC дигоксина (субстрат P-gp) увеличилась в 1,4 раза, а Cmax в 1,2 раза после совместного введения ЗЕГФРОВИ.
- Субстраты BCRP: AUC розувастатина (субстрат BCRP) увеличилась в 1,4 раза, а Cmax в 1,6 раза после совместного введения ЗЕГФРОВИ.
Другие препараты:
◦ Не прогнозируется клинически значимого влияния на фармакокинетику сурвозертиниба после совместного введения флуконазола (умеренный ингибитор CYP3A) 200 мг один раз в день.
◦ Не прогнозируется клинически значимого влияния на фармакокинетику сурвозертиниба после совместного введения дексаметазона (слабый индуктор CYP3A) 8 мг один раз в день.
◦ Не прогнозируется клинически значимого влияния на фармакокинетику дезипрамина (субстрат CYP2D6) при совместном применении с ЗЕГФРОВИ.
◦ Не наблюдалось клинически значимого влияния на фармакокинетику сурвозертиниба при совместном применении с средствами, снижающими кислотность (например, ингибитор протонной помпы).
Исследования in vitro
- Ферменты CYP450: Сурвозертиниб индуцирует CYP2C8.
- Транспортёрные системы: Сурвозертиниб является субстратом P-gp. Сурвозертиниб ингибирует OATP1B1.
13. ДОКЛИНИЧЕСКАЯ БЕЗОПАСНОСТЬ
13.1 Канцерогенность, мутагенность, нарушение фертильности
Канцерогенность
Исследования канцерогенности с сурвозертинибом не проводились.
Мутагенность
Сурвозертиниб не был генотоксичным в тесте бактериальной обратной мутации (Ames), в тесте хромосомных аберраций in vitro или в тесте микроядер in vivo на крысах.
Нарушение фертильности
Исследования фертильности с сурвозертинибом не проводились. В повторных токсикологических исследованиях продолжительностью до 4 недель на собаках пероральное введение сурвозертиниба вызывало атрофию вагинального эпителия и дегенерацию семенных канальцев в яичках в дозах всего 8 мг/кг/день (≥0,2 раза от воздействия на человека при рекомендуемой дозе на основании AUC). Обратимость находок у самок не оценивалась. Находки у самцов были обратимыми.
14. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Местнораспространённый или метастатический НМРЛ с инсерционными мутациями экзона 20 EGFR, ранее леченный препаратами платины
Эффективность ЗЕГФРОВИ оценивалась в исследовании WU-KONG1B (NCT03974022), многонациональном, открытом, рандомизированном по дозам клиническом исследовании. Подходящие пациенты имели местнораспространённый или метастатический НМРЛ с инсерционными мутациями экзона 20 EGFR с прогрессированием заболевания во время или после терапии препаратами платины и статус по шкале Восточной кооперативной онкологической группы (ECOG) 0 или 1. Пациенты с ранее леченными и стабильными внутричерепными метастазами имели право на включение. Пациенты с измеримым заболеванием на исходном уровне были рандомизированы для получения либо ЗЕГФРОВИ 200 мг (n=85), либо ЗЕГФРОВИ в неодобренной дозе перорально один раз в день с пищей до прогрессирования заболевания или непереносимой токсичности.
Основной мерой эффективности была общая частота ответа (ORR) в соответствии с Критериями оценки ответа при солидных опухолях (RECIST v 1.1), оцениваемая ослеплённым независимым комитетом по обзору (BIRC). Дополнительной мерой эффективности была продолжительность ответа (DOR) по оценке BIRC.
Популяция эффективности имела следующие демографические характеристики: медианный возраст составил 61 год (диапазон: от 35 до 88 лет); 67% были женщинами; 65% были азиатами; 33% были белыми; и 2% были других рас или раса не сообщалась; 2% были латиноамериканцами или латиносами; 71% никогда не курили. На исходном уровне 61% имели статус эффективности ECOG 1; 96% имели метастатическое заболевание; 94% имели гистологию аденокарциномы; и 25% имели метастазы в головном мозге. Все пациенты ранее получали терапию препаратами платины, 42% получали предшествующую анти-PD-(L)1 терапию, и 14% получали предшествующий амивантамаб.
Все 85 пациентов в популяции эффективности имели инсерционные мутации экзона 20 EGFR в опухоли по данным проспективного локального или центрального лабораторного тестирования. Образцы опухолей от пациентов были ретроспективно протестированы с использованием теста Life Technologies Corporation Oncomine™ Dx Express Test. В этих образцах опухолей 68% (58/85) были положительными на инсерционные мутации экзона 20 EGFR, 2,4% (2/85) не имели идентифицированной инсерционной мутации экзона 20 EGFR, и 29% (25/85) не дали репрезентативных результатов.
Результаты эффективности обобщены в Таблице 6.
| Параметр эффективности | ЗЕГФРОВИ (N=85) |
|---|---|
| Общая частота ответа (ORR), % (95% ДИ¹) | 46 (35, 57) |
| Полный ответ, % | 6 |
| Частичный ответ, % | 40 |
| Продолжительность ответа (DOR) | N=39 |
| Медиана², месяцев (95% ДИ) | 11.1 (8.2, NE) |
| Пациенты с DOR ≥6 месяцев | 72% |
ДИ = доверительный интервал
¹95% ДИ для ORR рассчитывался на основе точного метода Клоппера-Пирсона.
²Оценка Каплана-Мейера с использованием подтверждённых ответов.
16. УСЛОВИЯ ОТПУСКА И ХРАНЕНИЯ
Условия отпуска
Таблетки ЗЕГФРОВИ поставляются во флаконах с крышкой, защищённой от детей, следующим образом:
| Дозировка таблеток | Описание | Количество | Код NDC |
|---|---|---|---|
| 150 мг | Жёлтые, двояковыпуклые, покрытые плёночной оболочкой таблетки, с гравировкой «150» на одной стороне и логотипом компании Dizal на другой стороне. | 30 | 24538-101-01 |
| 200 мг | Жёлтые, двояковыпуклые, покрытые плёночной оболочкой таблетки, с гравировкой «200» на одной стороне и логотипом компании Dizal на другой стороне. | 30 | 24538-102-01 |
Хранение и обращение
Храните таблетки ЗЕГФРОВИ при температуре от 20°C до 25°C (от 68°F до 77°F); допускаются отклонения между 15°C и 30°C (от 59°F до 86°F) [см. Контролируемая комнатная температура USP].
17. ИНФОРМАЦИЯ ДЛЯ КОНСУЛЬТИРОВАНИЯ ПАЦИЕНТОВ
Рекомендуйте пациенту прочитать одобренную FDA инструкцию для пациента (Информация для пациента).
Интерстициальная болезнь лёгких/Пневмонит
Информируйте пациентов, что ЗЕГФРОВИ может вызывать интерстициальную болезнь лёгких/пневмонит. Рекомендуйте пациентам немедленно связаться со своим лечащим врачом при появлении новых или ухудшении респираторных симптомов [см. Предупреждения и меры предосторожности (5.1)].
Желудочно-кишечная токсичность
Информируйте пациентов, что ЗЕГФРОВИ может вызывать желудочно-кишечную токсичность, включая тошноту, рвоту и диарею. Рекомендуйте пациентам принимать ЗЕГФРОВИ с пищей для снижения желудочно-кишечных нежелательных реакций. Рекомендуйте пациентам немедленно связаться со своим лечащим врачом при появлении симптомов желудочно-кишечной токсичности [см. Предупреждения и меры предосторожности (5.2)].
Дерматологические нежелательные реакции
Информируйте пациентов, что ЗЕГФРОВИ может вызывать дерматологические нежелательные реакции, включая сыпь и зуд. Рекомендуйте пациентам использовать смягчающий крем, не содержащий спирта (например, не содержащий изопропанола, этанола) во время лечения ЗЕГФРОВИ, и избегать использования раздражающих средств по уходу за кожей (например, продуктов, содержащих ретинол или ретиноевую кислоту, бензоила пероксид). Рекомендуйте пациентам немедленно связаться со своим лечащим врачом при появлении симптомов дерматологических нежелательных реакций [см. Предупреждения и меры предосторожности (5.3)].
Офтальмологическая токсичность
Информируйте пациентов, что ЗЕГФРОВИ может вызывать офтальмологическую токсичность. Рекомендуйте пациентам связаться со своим лечащим врачом, если у них появятся глазные симптомы. Рекомендуйте прекратить использование контактных линз до оценки симптомов [см. Предупреждения и меры предосторожности (5.4)] и как минимум в течение одной недели после разрешения симптомов.
Эмбрио-фетальная токсичность
Информируйте женщин репродуктивного потенциала о потенциальном риске для плода и о необходимости сообщить своему лечащему врачу о известной или предполагаемой беременности [см. Предупреждения и меры предосторожности (5.5), Применение в отдельных группах пациентов (8.1)].
Информируйте женщин репродуктивного потенциала о необходимости использования эффективной негормональной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы [см. Применение в отдельных группы пациентов (8.3)], поскольку ЗЕГФРОВИ может делать некоторые гормональные контрацептивы неэффективными [см. Лекарственные взаимодействия (7.2)].
Информируйте мужчин с партнёршами репродуктивного потенциала о необходимости использования эффективной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы [см. Применение в отдельных группах пациентов (8.3)].
Лактация
Рекомендуйте женщинам не кормить грудью во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы [см. Применение в отдельных группах пациентов (8.2)].
Бесплодие
Информируйте женщин и мужчин репродуктивного потенциала, что ЗЕГФРОВИ может нарушать фертильность [см. Применение в отдельных группах пациентов (8.3) и Доклиническая безопасность (13.1)].
Лекарственные взаимодействия
Рекомендуйте пациентам информировать своих лечащих врачей обо всех сопутствующих препаратах, включая рецептурные лекарства, безрецептурные препараты, витамины и растительные продукты [см. Лекарственные взаимодействия (7.1, 7.2)].
Изготовлено для:
Dizal (Jiangsu) Pharmaceutical Co., Ltd.
Шанхай, 201203, Китай
ЗЕГФРОВИ™ является товарным знаком Dizal (Jiangsu) Pharmaceutical Co., Ltd.
DIZAL™ и логотип DIZAL являются товарными знаками Dizal (Jiangsu) Pharmaceutical Co., Ltd.
©2025 Dizal (Jiangsu) Pharmaceutical Co., Ltd. Все права защищены.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
ЗЕГФРОВИ (зег-ФРО-ви)
(сурвозертиниб)
таблетки, для приёма внутрь
Что такое ЗЕГФРОВИ?
ЗЕГФРОВИ — это лекарство, отпускаемое по рецепту, используемое для лечения взрослых с немелкоклеточным раком лёгкого (НМРЛ):
- который распространился на близлежащие ткани (местнораспространённый) или на другие части тела (метастатический), и
- имеет определённый аномальный ген рецептора эпидермального фактора роста (EGFR), и
- чьё заболевание ухудшилось во время или после химиотерапии, содержащей платину.
Ваш лечащий врач проведёт тест, чтобы убедиться, что ЗЕГФРОВИ подходит для вас.
Не известно, является ли ЗЕГФРОВИ безопасным и эффективным у детей.
Перед приёмом ЗЕГФРОВИ сообщите своему лечащему врачу обо всех своих медицинских состояниях, включая:
- если у вас есть история проблем с глазами или зрением.
- если вы беременны или планируете беременность. ЗЕГФРОВИ может нанести вред вашему будущему ребёнку.
Женщины, способные забеременеть:
- Ваш лечащий врач должен провести тест на беременность перед началом лечения ЗЕГФРОВИ.
- Вы должны использовать эффективную форму негормональной контрацепции во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы ЗЕГФРОВИ.
- Поговорите со своим лечащим врачом о методах контрацепции, которые могут быть подходящими для вас в это время.
- Немедленно сообщите своему лечащему врачу, если вы забеременеете или думаете, что можете быть беременной во время лечения ЗЕГФРОВИ.
Мужчины, у которых партнерши способны забеременеть:
- Вы должны использовать эффективную контрацепцию во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы ЗЕГФРОВИ.
Кормление грудью или планирование кормления грудью. Не известно, проникает ли ЗЕГФРОВИ в грудное молоко. Не кормите грудью во время лечения ЗЕГФРОВИ и в течение 2 недель после последней дозы ЗЕГФРОВИ. Поговорите со своим лечащим врачом о наилучшем способе кормления вашего ребёнка во время лечения ЗЕГФРОВИ.
Сообщите своему лечащему врачу обо всех лекарствах, которые вы принимаете, включая рецептурные и безрецептурные лекарства, витамины и растительные добавки. ЗЕГФРОВИ может влиять на действие других лекарств, а другие лекарства могут влиять на действие ЗЕГФРОВИ.
Как мне принимать ЗЕГФРОВИ?
- Принимайте ЗЕГФРОВИ точно так, как вам говорит ваш лечащий врач.
- Не изменяйте дозу и не прекращайте приём ЗЕГФРОВИ, если только ваш лечащий врач не скажет вам об этом.
- Ваш лечащий врач может изменить вашу дозу, временно прекратить или окончательно остановить лечение ЗЕГФРОВИ, если у вас разовьются определённые побочные эффекты.
- Принимайте предписанную дозу ЗЕГФРОВИ 1 раз в день в одно и то же время каждый день.
- Принимайте ЗЕГФРОВИ с пищей.
- Проглатывайте таблетки ЗЕГФРОВИ целиком. Не раскалывайте, не раздавливайте, не разжёвывайте и не растворяйте таблетки.
- Если вы пропустили дозу ЗЕГФРОВИ, примите её как можно скорее в течение 12 часов. Если прошло более 12 часов, пропустите пропущенную дозу и примите следующую дозу в обычное запланированное время.
- Если у вас была рвота после приёма дозы ЗЕГФРОВИ, не принимайте дополнительную дозу. Примите следующую дозу в обычное запланированное время.
Каковы возможные побочные эффекты ЗЕГФРОВИ?
ЗЕГФРОВИ может вызывать серьёзные побочные эффекты, включая:
- Проблемы с лёгкими. ЗЕГФРОВИ может вызывать проблемы с лёгкими, которые могут быть тяжёлыми и угрожающими жизни. Симптомы могут быть похожи на симптомы рака лёгких. Немедленно сообщите своему лечащему врачу, если у вас появятся новые или ухудшающиеся симптомы проблем с лёгкими во время лечения ЗЕГФРОВИ, включая одышку или затруднённое дыхание, кашель или лихорадку.
- Проблемы с желудком и кишечником (желудочно-кишечные). ЗЕГФРОВИ может вызывать проблемы с желудком и кишечником, которые могут быть тяжёлыми, включая диарею, тошноту и рвоту. Немедленно сообщите своему лечащему врачу, если у вас появятся любые из этих симптомов во время лечения ЗЕГФРОВИ. Ваш лечащий врач может назначить лекарства по мере необходимости или рекомендовать питье жидкостей или другие методы лечения, чтобы помочь справиться с вашими симптомами.
- Проблемы с кожей. ЗЕГФРОВИ может вызывать тяжёлые кожные сыпи. Используйте увлажняющий крем, не содержащий спирта (например, не содержащий изопропанола или этанола), во время лечения ЗЕГФРОВИ. Избегайте использования раздражающих средств по уходу за кожей, таких как средства, содержащие ретинол или ретиноевую кислоту, и бензоила пероксид. Немедленно сообщите своему лечащему врачу, если у вас появятся любые кожные реакции, включая небольшие выпуклые шишки на коже, которые выглядят как прыщи, или зуд кожи.
Проблемы с глазами. Ваш лечащий врач может направить вас к специалисту по глазам (офтальмологу), если у вас появятся новые или ухудшающиеся проблемы с глазами во время лечения ЗЕГФРОВИ. Вам не следует использовать контактные линзы до тех пор, пока ваши глазные симптомы не будут проверены лечащим врачом и как минимум в течение 1 недели после разрешения глазных симптомов. Немедленно сообщите своему лечащему врачу, если у вас появятся любые новые или ухудшающиеся симптомы проблем с глазами, включая:
◦ боль в глазах
◦ покраснение глаз
◦ светобоязнь
◦ ощущение, что что-то попало в глаза
◦ усиленное слезотечение
◦ выделения из глаз
◦ раздражение глаз
◦ сухость глаз
◦ корочки на глазах
◦ нечёткость зрения
◦ потеря зрения
◦ проблемы со зрением
Наиболее частые побочные эффекты ЗЕГФРОВИ включают:
- диарея
- сыпь
- снижение аппетита
- язвочки во рту
- чувство сильной усталости
- тошнота
- инфекция кожи вокруг ногтя
- рвота
- запор
- боль в мышцах или суставах
- зуд кожи
- сухость кожи
- инфекция мочевыводящих путей
- боль в области желудка
- снижение веса
Наиболее частые тяжёлые отклонения в лабораторных анализах при приёме ЗЕГФРОВИ включают:
- снижение количества белых и красных кровяных телец
- повышение уровня ферментов поджелудочной железы
- повышение уровня креатинкиназы
- снижение уровня калия и соли (натрия)
- повышение уровня печёночных ферментов
- повышение уровня магния
ЗЕГФРОВИ может влиять на фертильность у женщин и мужчин, что может повлиять на вашу способность иметь ребёнка. Поговорите со своим лечащим врачом, если это вызывает у вас беспокойство.
Это не все возможные побочные эффекты ЗЕГФРОВИ.
Обратитесь к врачу за медицинской консультацией о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Как мне хранить ЗЕГФРОВИ?
- Храните ЗЕГФРОВИ при комнатной температуре от 68°F до 77°F (от 20°C до 25°C).
Храните ЗЕГФРОВИ и все лекарства в недоступном для детей месте.
Общая информация о безопасном и эффективном использовании ЗЕГФРОВИ.
Лекарства иногда назначают для целей, не перечисленных в листовке информации для пациента. Не используйте ЗЕГФРОВИ при состоянии, для которого он не был назначен. Не давайте ЗЕГФРОВИ другим людям, даже если у них те же симптомы, что и у вас. Это может нанести им вред.
Вы можете попросить у своего фармацевта или лечащего врача информацию о ЗЕГФРОВИ, предназначенную для медицинских работников.
Какие ингредиенты входят в состав ЗЕГФРОВИ?
Активный ингредиент: сурвозертиниб
Неактивные ингредиенты: диоксид кремния коллоидный, кроскармеллоза натрия, гидроксипропилцеллюлоза, лактозы моногидрат, стеарат магния и микрокристаллическая целлюлоза. Плёночная оболочка таблетки содержит: гипромеллозу 2910, железа оксид жёлтый, диоксид титана и триацетин.
Изготовлено для: Dizal (Jiangsu) Pharmaceutical Co., Ltd., Шанхай, 201203, Китай
ЗЕГФРОВИ™ является товарным знаком Dizal (Jiangsu) Pharmaceutical Co., Ltd.
DIZAL™ и логотип DIZAL являются товарными знаками Dizal (Jiangsu) Pharmaceutical Co., Ltd.
©202X Dizal (Jiangsu) Pharmaceutical Co., Ltd. Все права защищены.
Для получения дополнительной информации звоните +1-855-482-0653.
Данная Информация для пациента была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Выпущено: 07/2025
▼ Лекарственный препарат в настоящий момент не зарегистрирован в Российской Федерации. |
Форма выпуска
Таблетки, для приёма внутрь, 150 мг, 200 мг.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Зегфрови:
