КАСПОФУНГИН-ДЖ
Caspofungin-JРегистрационный номер
Торговое наименование
КАСПОФУНГИН-ДЖ
Международное непатентованное наименование
Лекарственная форма
лиофилизат для приготовления раствора для инфузий
Состав
Каждый флакон содержит:
Действующее вещество: каспофунгина диацетат 60,6 мг (в пересчёте на каспофунгин 54,6 мг) или 83,9 мг (в пересчёте на каспофунгин 75,6 мг);
Вспомогательные вещества: сахароза — 39,0 мг или 54,0 мг; маннитол — 26,0 мг или 36,0 мг; уксусная кислота ледяная — 2,0 мг или 2,7 мг; натрия гидроксид — до pH 6,0
Описание
Пористая масса белого или почти белого цвета.
Фармакотерапевтическая группа
Фармакологические свойства
Фармакодинамика
Каспофунгина ацетат представляет собой полусинтетическое липопептидное соединение (эхинокандин), синтезированное из продукта ферментации Glarea lozoyensis.
Каспофунгина ацетат ингибирует синтез β-(1,3)-D-глюкана — важнейшего компонента клеточной стенки многих мицелиальных грибов и дрожжей. В клетках млекопитающих β-(1,3)-D-глюкан не присутствует.
In vitro каспофунгин обладает активностью против различных патогенных грибов родов Aspergillus (включая Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus и Aspergillus candidus) и Candida (включая Candida albicans, Candida dublinensis, Candida glabrata, Candida guilliermondii, Candida kefyr, Candida krusei, Candida lipolytica, Candida lusitaniae, Candida parapsilosis, Candida rugose и Candida tropicalis).
Исследования на чувствительность к каспофунгину проводились двумя модифицированными методами — М38-А2 (для рода Aspergillus) и N127-АЗ (для рода Candida) Института клинических и лабораторных стандартов (CLSI).
Стандарты интерпретации для каспофунгина против грибов рода Candida применимы для микродилюции бульона методом М27-АЗ (только для процедуры CLSI) для определения минимальной подавляющей концентрации (МИК), которую рассчитывают в конечной точке частичного ингибирования (24 часа). Величину МПК каспофунгина при CLSI микродилюции бульона методом М27-АЗ следует интерпретировать в соответствие с критериями, указанными в Таблице 1.
| Патогенные грибы | Микродилюция бульона | МПК*+ (мкг/мл) — 24 часа | ||
| Чувствительные | Умерено чувствительные | Резистентные | Не чувствительные | |
| Род Candida | ≤2 | - | - | >2 |
* — категория «чувствительные» указывает на высокую вероятность ингибирования патогенных грибов при достижении ожидаемой концентрации антимикробного препарата в крови.
+ — резистентная категория для эхинокандинов не установлена; изоляты с более высоким значением МПК могут характеризоваться как нечувствительные.
Для применения метода Европейского комитета по тестированию антимикробной чувствительности (EUCAST) стандарты интерпретации для каспофунгина против грибов рода Candida не установлены.
Для дрожжевых грибов комитетом EUCAST были разработаны стандартизированные методики определения чувствительности. Для грибов рода Aspergillus и других мицелиальных грибов не разработано стандартизованных методик определения чувствительности или стандартов интерпретации методами CLSI или EUCAST.
In vivo выявлена активность каспофунгина при парентеральном введении животным с нормальным и сниженным иммунитетом, инфицированным Aspergillus и Candida.
Применение каспофунгина в этих случаях способствует увеличению продолжительности жизни животных (Aspergillus и Candida) и эрадикации патогенных грибов (Candida) в поражённых органах. Каспофунгин также активен у животных с иммунодефицитом, заражённых Candida glabrata, Candida krusei, Candida lusitaniae, Candida parapsilosis, Candida tropicalis, у которых достигается эрадикация патогенных грибов Candida в поражённых органах. Каспофунгин проявляет высокую активность при профилактике и лечении лёгочных аспергиллезов, подтверждённую в исследованиях на моделях летальных лёгочных инфекций in vivo.
Перекрёстная устойчивость
Каспофунгин активен в отношении штаммов грибов Candida, резистентных к препаратам, имеющим другой механизм действия: флуконазолу, амфотерицину B или флуцитозину.
Лекарственная устойчивость
МПК < 2 мкг/мл каспофунгина (категория «чувствительные» по таблице 1) при использовании CLSI метода М27-АЗ указывает на высокую вероятность ингибирования изолятов Candida при достижении терапевтической концентрации каспофунгина.
Прорывные инфекции, вызванные изолятами Candida, для подавления роста которых требуются концентрации каспофунгина >2 мкг/мл, были изучены на модели мышей с инфекцией C. albicans. Также у некоторых пациентов в процессе лечения каспофунгином были обнаружены изоляты Candida со сниженной чувствительностью к каспофунгину (МПК > 2 мкг/мл каспофунгина при использовании CLSI стандартизованной методики определения МПК). Некоторые из этих изолятов имели мутации в гене FKS1/FKS2. Хотя частота таких случаев низкая, они, как правило, связаны с неблагоприятными клиническими исходами. У грибов рода Aspergillus обнаружено развитие in vitro лекарственной устойчивости к каспофунгину. В ходе клинического применения каспофунгина обнаружена лекарственная устойчивость к каспофунгину у пациентов с инвазивным аспергиллёзом. Механизм резистентности не установлен.
Частота случаев лекарственной устойчивости различных клинических изолятов Aspergillus и Candida низкая.
Лекарственные взаимодействия
Исследования каспофунгина in vitro и in vivo в комбинации с амфотерицином B демонстрируют отсутствие антагонизма в отношении противогрибковой активности против Aspergillus fumigatus или Candida albicans. Результаты исследований in vitro позволяют предположить наличие аддитивного влияния/отсутствия влияния или синергизма против Aspergillus fumigatus и наличие аддитивного влияния/отсутствие влияния против Candida albicans. Клиническая значимость полученных результатов неизвестна.
Фармакокинетика
Распределение
После однократной внутривенной инфузии в течение 1 часа концентрация каспофунгина в плазме крови снижается многофазно. Сразу после инфузии наступает короткая α-фаза, за которой следует β-фаза с периодом полувыведения (T½) от 9 до 11 часов, которая является главной характеристикой профиля распределения каспофунгина и имеет отчётливую логарифмически-линейную зависимость между 6 и 48 часами после введения.
За этот период концентрация каспофунгина в плазме крови существенно снижается.
Также имеется дополнительная γ-фаза с T½ от 40 до 50 часов. Распределение в большей степени, чем экскреция или биотрансформация, оказывает влияние на плазменный клиренс. Каспофунгин в значительной степени связывается с белками плазмы крови (приблизительно на 97 %) при минимальном связывании с эритроцитами. Около 92 % меченого (3H)-каспофунгина ацетата обнаруживается в тканях через 36–48 часов после введения разовой дозы 70 мг. В течение первых 30 часов после введения экскреция и биотрансформация каспофунгина незначительны.
Метаболизм
Каспофунгин медленно метаболизируется путём гидролиза и N-ацетилирования с образованием пептидного соединения с открытым кольцом. В более поздние сроки (через 5 и более дней после введения разовой дозы меченого (3H)-каспофунгина ацетата) в плазме крови отмечается низкий уровень (менее 7 пкмоль/мг белка или 1,3 % и менее от введённой дозы препарата) ковалентно связанного с белками меченого (3H)-каспофунгина ацетата, что обусловлено образованием двух активных промежуточных продуктов распада каспофунгина. Дальнейший процесс метаболизма включает в себя гидролиз до составляющих аминокислот и их производных с образованием дигидроксигомотирозина и N-ацетил-дигидроксигомотирозина. Эти производные тирозина обнаруживаются только в моче, что указывает на высокий почечный клиренс этих метаболитов.
Выведение
Выведению из организма подвергается около 75 % каспофунгина (фармакокинетическое исследование с радиоактивно меченым каспофунгином): 41 % с мочой и 31 % с фекалиями.
Концентрации в плазме крови метки и каспофунгина в течение первых 24–48 часов после введения дозы не различаются, затем концентрация каспофунгина снижается быстрее, причём снижение его концентрации ниже уровня количественного определения наблюдается через 6–8 дней после введения дозы, а радиоактивной метки — через 22,3 недели. Небольшое количество каспофунгина выделяется в неизменённом виде с мочой (приблизительно 1,4 % дозы). Почечный клиренс исходного препарата низкий и составляет приблизительно 0,15 мл/мин.
Фармакокинетические особенности у отдельных групп пациентов
В зависимости от половой принадлежности
Концентрация каспофунгина в плазме крови у здоровых мужчин и женщин в 1-й день после введения разовой дозы 70 мг одинаковая. После 13-ти ежедневных введений по 50 мг концентрация каспофунгина в плазме крови у некоторых женщин была приблизительно на 20 % выше, чем у мужчин.
Пациенты пожилого возраста
Концентрация каспофунгина в плазме крови здоровых мужчин и женщин пожилого возраста (65 лет и старше) выше на 28 % (оценка по показателю площади под фармакокинетической кривой «концентрация-время» (AUC)) по сравнению со здоровыми молодыми мужчинами. У пациентов пожилого возраста с инвазивным кандидозом или на фоне эмпирической терапии наблюдались такие же умеренные изменения концентрации каспофунгина в плазме крови, как и в группе здоровых пожилых пациентов по сравнению со здоровыми пациентами молодого возраста. Коррекция режима дозирования для пациентов пожилого возраста (65 лет и старше) не требуется.
У пациентов с печёночной недостаточностью
Концентрация каспофунгина в плазме крови пациентов с нарушениями функции печени лёгкой степени (5–6 баллов по шкале Чайлд-Пью) после введения разовой дозы 70 мг увеличивается приблизительно на 55 % (AUC) по сравнению со здоровыми лицами.
Введение препарата этим пациентам в течение 14 дней (70 мг 1 раз в день с последующим ежедневным введением по 50 мг) сопровождается повышением концентрации каспофунгина в плазме крови на 19–25 % (AUC) на 7 и 14 дни по сравнению со здоровыми добровольцами.
У взрослых пациентов с нарушениями функции печени средней степени тяжести (7–9 баллов по шкале Чайлд-Пью), получавших разовую дозу каспофунгина 70 мг, концентрация каспофунгина в плазме крови увеличивалась приблизительно на 76 % (AUC) по сравнению со здоровыми добровольцами.
Дети
Проведено пять длительных клинических исследований с изучением каспофунгина у пациентов до 18 лет, включая исследования фармакокинетики препарата (первоначально исследование у подростков 12–17 лет и детей 2–11 лет, затем у детей младшего возраста (3–23 месяца), у новорождённых и детей первых трёх месяцев жизни).
У подростков (12–17 лет), получавших каспофунгин в дозе 50 мг/м2 (максимальная суточная доза — 70 мг), концентрация в плазме крови (AUC0–24) в целом соответствовала концентрации у взрослых, принимавших 50 мг каспофунгина в сутки. Все подростки получали каспофунгин в дозе выше 50 мг, и 6 из 8 пациентов получали максимальную суточную дозу 70 мг. Концентрация каспофунгина в плазме вдовцу этих пациентов была ниже по сравнению с концентрацией у взрослых, получавших препарат в суточной дозе 70 мг, то есть дозе, которая наиболее часто назначалась подросткам.
У детей в возрасте 2–11 лет, получавших каспофунгин в дозе 50 мг/м2 в сутки (максимальная суточная доза 70 мг), его концентрация в плазме крови (AUC0–24) была сравнима с аналогичным показателем у взрослых пациентов, которым вводили каспофунгин в дозе 50 мг в сутки. В первый день применения концентрация каспофунгина в плазме крови (AUC0–24) была несколько выше у детей по сравнению со взрослыми (на 37 % при сравниваемых дозах 50 мг/м2 и 50 мг один раз в сутки). Однако необходимо подчеркнуть, что концентрация в плазме крови (AUC0–24) у детей в первый день была все же ниже, чем у взрослых при длительном лечении.
У детей в возрасте 3–23 месяцев, которым назначали каспофунгин в суточной дозе 50 мг/м2 (максимальная доза — 70 мг), концентрация каспофунгина в плазме крови при длительном применении была сопоставима с концентрацией у взрослых, которым назначалась доза препарата 50 мг в сутки. Как и у более старших детей, у детей данной возрастной группы, получавших каспофунгин в дозе 50 мг/м2, концентрация препарата в плазме крови была выше в первый день лечения по сравнению со взрослыми, получавшими стандартную дозу каспофунгина 50 мг. Фармакокинетические параметры каспофунгина в дозе 50 мг/м2 у детей младшей возрастной группы (3–23 месяца) и более старшей группы (2–11 лет) при одинаковом режиме дозирования были сопоставимы.
У новорождённых и детей до 3-х месяцев, которым каспофунгин назначали в дозе 25 мг/м2, пиковая концентрация каспофунгина (C1 ч) и его пороговая концентрация (C24 ч) после повторных введений соответствовали аналогичным показателям у взрослых, получавших каспофунгин в дозе 50 мг в сутки. В первый день пиковая концентрация C1 чбыла сопоставима со взрослыми, а пороговая концентрация C24 ч была умеренно увеличена у новорождённых и детей грудного возраста по сравнению с соответствующими показателями у взрослых. Определение концентрации препарата в плазме крови (AUC0–24) не проводилось в данном исследовании из-за сложностей отбора проб. Следует учесть, что изучение эффективности и безопасности в ходе проспективных адекватных клинических исследований каспофунгина у новорождённых и детей до 3 месяцев не проводилось.
Показания
- Эмпирическая терапия у пациентов с фебрильной нейтропенией при подозрении на грибковую инфекцию (вызванную Candida и Aspergillus);
- инвазивный кандидоз (в том числе кандидемия) у пациенту с нейтропенией и без неё;
- инвазивный аспергиллёз у пациентов, рефрактерных к другой терапии или не переносящих её, включая амфотерицин B, в том числе липосомальный и/или итраконазол;
- эзофагеальный кандидоз;
- орофарингеальный кандидоз.
Противопоказания
- Повышенная чувствительность к любому из компонентов препарата;
- детский возраст до 3-х месяцев;
- редкие наследственные заболевания непереносимости фруктозы или сахарозо-изомальтазная недостаточность (препарат содержит сахарозу).
С осторожностью
- Одновременное применение с циклоспорином;
- применение у пациентов с печёночной недостаточностью средней степени тяжести (от 7 до 9 баллов по шкале Чайлд-Пью);
- у пациентов с аллергическими реакциями со стороны кожи в анамнезе.
Нет достаточных данных о применении каспофунгина у детей и взрослых при эндокардите, остеомиелите и менингите, вызванных патогенными штаммами грибов рода Candida, а также у детей в качестве терапии первой линии при инвазивном аспергиллёзе.
Применение при беременности и в период грудного вскармливания
Клинического опыта применения каспофунгина у беременных и у женщин в период грудного вскармливания нет.
Беременность
В исследованиях на крысах применение каспофунгина в дозах, токсичных для беременных самок (5 мкг/кг в день), приводило к уменьшению массы тела плода и увеличению случаев неполной оссификации костей черепа и туловища. Кроме того, при применении каспофунгина в тех же дозах у крыс зафиксировано увеличение числа случаев формирования шейного ребра. У животных каспофунгин проникает через плацентарный барьер.
Каспофунгин не должен применяться у женщин во время беременности, за исключением случаев, когда применение препарата является жизненно необходимым.
Период грудного вскармливания
Не установлено, проникает ли каспофунгин в грудное молоко. При необходимости применения препарата в период лактации, грудное вскармливание необходимо отменить.
Способ применения и дозы
Взрослые
Суточная доза препарата Каспофунгин-ДЖ вводится взрослым (>18 лет) путём медленной внутривенной инфузии (>1 часа) 1 раз в сутки.
Эмпирическая терапия
В первый день вводится разовая нагрузочная доза 70 мг, во второй и последующие дни лечения суточная доза составляет 50 мг в сутки. Продолжительность терапии зависит от клинической и микробиологической эффективности препарата. Эмпирическая терапия должна проводиться до полного разрешения нейтропении. При подтверждении грибковой инфекции пациенты должны получать препарат не менее 14 дней. Терапию препаратом Каспофунгин-ДЖ следует продолжать не менее 7 дней после исчезновения клинических проявлений, как грибковой инфекции, так и нейтропении. Суточную дозу препарата Каспофунгин-ДЖ можно увеличить до 70 мг в том случае, когда суточная доза 50 мг хорошо переносится пациентом, но не даёт ожидаемого клинического эффекта. Несмотря на то, что увеличение суточной дозы до 70 мг не продемонстрировало увеличение эффективности, данные по безопасности предполагают, что приём препарата в вышеуказанной дозе имеет хорошую переносимость.
Инвазивный кандидоз
В первый день вводится разовая нагрузочная доза 70 мг, во второй и последующие дни лечения суточная доза составляет 50 мг в сутки. Продолжительность лечения инвазивного кандидоза определяется клиническим эффектом и микробиологической эффективностью.
Общим правилом является продолжение противогрибковой терапии не менее 14 дней после последнего получения положительного результата гемокультуры. Пациентам с персистирующей нейтропенией может потребоваться более длительное лечение до разрешения нейтропении.
Безопасность и эффективность многократного применения суточных доз каспофунгина до 150 мг (диапазон: от 1 до 51 дня, среднее: 14 дней) были изучены у 100 взрослых пациентов с инвазивным кандидозом. Высокая доза каспофунгина в целом хорошо переносилась пациентами, однако эффективность препарата в высокой дозе была в целом схожа с эффективностью препарата у пациентов, принимавших каспофунгин в суточной дозе 50 мг.
Инвазивный аспергиллёз
В первый день вводится разовая нагрузочная доза 70 мг, во второй и последующие дни лечения суточная доза составляет 50 мг в сутки.
Продолжительность лечения зависит от степени тяжести основного заболевания, степени восстановления пациента от иммуносупрессии и клинического эффекта. Информация об эффективности введения суточной дозы 70 мг пациентам, у которых суточная доза 50 мг не приводит к ожидаемому клиническому ответу, отсутствует. Данные по безопасность указывают на хорошую переносимость при увеличении суточной дозы до 70 мг.
Эффективность доз выше 70 мг у пациентов с инвазивным аспергиллёзом изучена недостаточно.
Эзофагеальный и орофарингеальный кандидоз
Суточная доза составляет 50 мг в сутки, терапию следует продолжать не менее 7–14 дней после исчезновения симптомов. Информация об эффективности введения нагрузочной дозы 70 мг отсутствует.
Пациенты пожилого возраста
Пожилым пациентам (65 лет и старше) коррекция дозы не требуется.
Снижение функции ночек, половые и расовые различия
Не требуют коррекции дозы.
Пациенты с печёночной недостаточностью
Взрослым пациентам с печёночной недостаточностью лёгкой степени (5–6 баллов по шкале Чайлд-Пью) коррекция дозы не требуется. Пациентам с печёночной недостаточностью средней степени тяжести (7–9 баллов по шкале Чайлд-Пью) поддерживающая суточная доза препарата Каспофунгин-ДЖ уменьшается до 35 мг в сутки (на основании фармакокинетических данных), однако нагрузочная доза 70 мг в первые сутки терапии сохраняется, если имеются соответствующие показания.
Клинического опыта применения каспофунгина у взрослых пациентов с тяжёлой печёночной недостаточностью (более 9 баллов по шкале Чайлд-Пью) нет.
При одновременном применении препарата Каспофунгин-ДЖ с индукторами клиренса лекарственных препаратов (рифампицином, эфавирензом, невирапином, фенитоином, дексаметазоном или карбамазепином) должна рассматриваться возможность повышения суточной дозы препарата Каспофунгин-ДЖ до 70 мг/м2 для указанной группы пациентов (но не превышая допустимую дозу 70 мг).
Дети
Суточная доза препарата Каспофунгин-ДЖ вводится детям (3 месяца до 18 лет) путём медленной внутривенной инфузии (>1 часа) 1 раз в сутки.
Доза препарата рассчитывается с учётом площади поверхности тела пациента по формуле Мостеллера (см. подраздел «Приготовление раствора препарата Каспофунгин-ДЖ для внутривенной инфузии детям»).
Для всех показаний в первый день вводится разовая нагрузочная доза 70 мг/м2 (не должна превышать допустимую дозу 70 мг), в последующие дни — 50 мг/м2 в сутки (не должна превышать допустимую дозу 70 мг). Продолжительность терапии определяется индивидуально и зависит от показания к применению (см. общие рекомендации по применению у взрослых пациентов в данном разделе).
Суточную дозу препарата Каспофунгин-ДЖ можно увеличить до 70 мг/м2, в том случае, если суточная доза 50 мг/м2 хорошо переносится пациентом, но не даёт ожидаемого клинического эффекта (не должна превышать допустимую дозу 70 мг). Несмотря на то, что увеличение суточной дозы до 70 мг/м2 не продемонстрировало увеличение эффективности, данные по безопасности предполагают, что приём препарата в вышеуказанной дозе имеет хорошую переносимость.
При одновременном применении препарата Каспофунгин-ДЖ с индукторами клиренса лекарственных препаратов (рифампицином, эфавирензом, невирапином, фенитоином, дексаметазоном или карбамазепином) должна рассматриваться возможность повышения суточной дозы препарата Каспофунгин-ДЖ до 70 мг/м2 для детей (но не должна превышать допустимую дозу 70 мг).
Клинического опыта применения каспофунгина у детей с любой степенью печёночной недостаточности нет.
Применение у детей
Эффективность и безопасность применения каспофунгина у детей (3 месяца — 18 лет) коррелирует с достаточной доказательной базой клинических исследований у взрослых пациентов, исследований фармакокинетики у детей и дополнительных данных проспективных исследований, на основании которых каспофунгин успешно применяется у детей по тем же показаниям, что и у взрослых пациентов (см. раздел «Показания к применению»).
Нет данных о безопасности и эффективности применения каспофунгина у новорождённых и детей младше 3-х месяцев.
Инструкция по приготовлению раствора
НЕ ИСПОЛЬЗУЮТСЯ РАСТВОРИТЕЛИ, СОДЕРЖАЩИЕ ДЕКСТРОЗУ (α-D-глюкозу), поскольку в инфузионных растворах, содержащих декстрозу, каспофунгин нестабилен.
Препарат Каспофунгин-ДЖ не смешивают и не вводят одновременно с любыми другими лекарственными препаратами, поскольку нет данных о его совместимости с другими препаратами для внутривенного введения.
Готовый инфузионный раствор осматривают, чтобы убедится в отсутствии в нем взвешенных частиц или изменения цвета.
Приготовление раствора препарата Каспофунгин-ДЖ для внутривенных инфузий взрослым
Этап 1. Приготовление первичного раствора во флаконе
Перед разведением холодный флакон с препаратом Каспофунгин-ДЖ доводят до комнатной температуры и в условиях соблюдения правил асептики добавляют: 10,8 мл одного из следующих растворителей: стерильная вода для инъекций, 0,9 % раствор натрия хлорида для инфузий, бактериостатическая вода для инъекций с метилпарабеном, пропилпарабеном или бактериостатическая вода для инъекций с 0,9 % бензиловым спиртом. Концентрация препарата в растворе составит 7,0 мг/мл (флакон 70 мг) или 5,0 мг/мл (флакон 50 мг).
Белый или почти белый порошок препарата Каспофунгин-ДЖ должен полностью раствориться. Осторожно перемешивают содержимое флакона до получения прозрачного раствора. Первичный раствор осматривают, чтобы убедиться в отсутствии взвешенного осадка или изменения цвета. Приготовленный таким образом первичный раствор можно хранить во флаконе до 24 часов при температуре не выше 25 °C.
Этап 2. Приготовление конечного инфузионного раствора
Раствор для инфузий готовят в условиях соблюдения правил асептики. В качестве растворителей используют 0,9 % раствор натрия хлорида для инфузий или раствор Рингера лактат. Для приготовления конечного инфузионного раствора, предназначенного для введения пациенту, в пластиковый инфузионный мешок или флакон, содержащий 250 мл инфузионного растворителя (стерильный 0,9 % раствор натрия хлорида для инфузий или раствор Рингера лактат), добавляют соответствующее количество подготовленного на этапе 1 восстановленного раствора препарата Каспофунгин-ДЖ (см. Таблица 2 «Приготовление конечного инфузионного раствора препарата Каспофунгин-ДЖ»), При введении суточной дозы 50 мг или 35 мг объём добавляемого растворителя может быть уменьшен до 100 мл.
Нельзя использовать мутный или содержащий осадок раствор.
Готовый конечный инфузионный раствор необходимо использовать:
- в течение 24 часов при хранении при комнатной температуре (не выше 25 °C);
- в течение 48 часов при хранении в холодильнике при температуре от 2 до 8 °C.
Препарат Каспофунгин-ДЖ вводят путём медленной внутривенной инфузии (≥1 часа).
| Доза* препарата | Объём первичного раствора препарата для добавления в ёмкость с растворителем для внутривенных инфузий | Стандартное разведение (первичный раствор препарата+250 мл растворителя) концентрация конечного инфузионного раствора | Разведение в уменьшенном объёме (первичный раствор препарата+100 мл растворителя) концентрация конечного инфузионного раствора |
| 70 мг | 10 мл | 0,27 мг/мл | не рекомендуется |
| 70 мг (из 2-х флаконов по 50 мг)** | 14 мл | 0,27 мг/мл | не рекомендуется |
| 50 мг | 10 мл | 0,19 мг/мл | 0,45 мг/мл |
| 35 мг (из 1 флакона 70 мг) при печёночной недостаточности средней степени тяжести | 5 мл | 0,14 мг/мл | 0,33 мг/мл |
| 35 мг (из 1 флакона 50 мг) при печёночной недостаточности средней степени тяжести | 7 мл | 0,14 мг/мл | 0,33 мг/мл |
* — во флакон с каспофунгином всегда добавляется 10,8 мл растворителя, независимо от его дозы (50 мг или 70 мг).
** — при отсутствии флакона по 70 мг, дозу можно приготовить из 2-х флаконов по 50 мг.
Приготовление раствора препарата Каспофунгин-ДЖ для внутривенных инфузий детям
Определение площади поверхности тела для расчёта дозы у детей
Перед приготовлением инфузионного раствора рассчитывают площадь поверхности тела (ППТ) ребёнка по следующей формуле (формула Мостеллера):
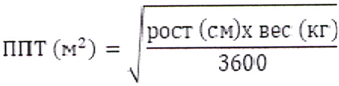
Подготовка раствора для введения детям в возрасте старше 3-х месяцев (используя флакон 70 мг)
Определяют необходимую для данного ребёнка нагрузочную дозу, используя ППТ (рассчитанную как описано выше) и следующее, уравнение:
ППТ (м2) × 70 мг/м2 = нагрузочная доза
Максимальная нагрузочная доза в первый день терапии не должна превышать 70 мг независимо от расчётной дозы для данного пациента.
- Перед разведением холодный флакон с препаратом Каспофунгин-ДЖ доводят до комнатной температуры.
- В условиях соблюдения асептики добавляют 10,5 мл одного из следующих растворителей: стерильная вода для инъекций, 0,9 % раствор натрия хлорида для инфузий, бактериостатическая вода для инъекций с метилпарабеном, пропилпарабеном или бактериостатическая вода для инъекций с 0,9 % бензиловым спиртом. Приготовленный таким образом первичный раствор можно хранить во флаконе до 24 часов при комнатной температуре не выше 25 °C. Концентрация препарата в растворе составит 7,2 мг/мл.
Извлекают из флакона объём препарата равный рассчитанной нагрузочной дозе (пункт 1). В асептических условиях переносят этот объём (мл) восстановленного препарата Каспофунгин-ДЖ в ёмкость для внутривенных инфузий, содержащую 250 мл 0,9 %, 0,45 % или 0,225 % раствора натрия хлорида для инъекций, либо раствор Рингера лактата для инъекций. При необходимости объём добавляемого растворителя может быть уменьшен так, чтобы итоговая концентрация препарата не превышала 0,5 мг/мл.
Готовый инфузионный раствор следует использовать в течение 24 часов при хранении при температуре не выше 25 °C или в течение 48 часов при хранении в холодильнике при температуре от 2 до 8 °C.
- Если определённая по формуле, приведённой выше, величина нагрузочной дозы составляет менее 50 мг, тогда можно приготовить инфузионный раствор из флакона 50 мг (см. ниже пункты 2–4 подраздел «Подготовка раствора препарата Каспофунгин-ДЖ для введения детям в возрасте старше 3-х месяцев (используя флакон 50 мг)»). При использовании флакона 50 мг концентрация препарата в первичном растворе составит 5,2 мг/мл.
Подготовка раствора препарата Каспофунгин-ДЖ для введения детям в возрасте старше 3-х месяцев (используя флакон 50 мг)
Определяют необходимую для данного ребёнка суточную поддерживающую дозу, используя ППТ (рассчитанную как описано выше) и следующее уравнение:
ППТ (м2) × 50 мг/м2 = суточная поддерживающая доза
Суточная поддерживающая доза не должна превышать 70 мг, независимо от расчётной дозы для данного пациента.
- Перед разведением холодный флакон с препаратом Каспофунгин-ДЖ доводят до комнатной температуры.
- В условиях соблюдения асептики добавляют 10,5 мл одного из следующих растворителей: стерильная вода для инъекций, 0,9 % раствор натрия хлорида для инфузий, бактериостатическая вода для инъекций с метилпарабеном, пропилпарабеном или бактериостатическая вода для инъекций с 0,9 % бензиловым спиртом. Приготовленный таким образом первичный раствор можно хранить во флаконе до 24 часов при комнатной температуре не выше 25 °C. Концентрация препарата в растворе составит 5,2 мг/мл.
Извлекают из флакона объём препарата равный рассчитанной нагрузочной дозе (пункт 1). В асептических условиях переносят этот объём (мл) восстановленного препарата Каспофунгин-ДЖ в ёмкость для внутривенных инфузий, содержащую 250 мл 0,9 %, 0,45 % или 0,225 % раствора натрия хлорида для инъекций, либо раствор Рингера лактата для инъекций. При необходимости объём добавляемого растворителя может быть уменьшен так, чтобы итоговая концентрация препарата не превышала 0,5 мг/мл.
Готовый инфузионный раствор следует использовать в течение 24 часов при хранении при комнатной температуре не выше 25 °C или в течение 48 часов при хранении в холодильнике при температуре от 2 до 8 °C.
- Если определённая по формуле, приведённой выше, величина суточной поддерживающей дозы составляет более 50 мг, тогда можно приготовить инфузионный раствор из флакона 70 мг (см. выше пункты 2–4 подраздел «Подготовка раствора препарата Каспофунгин-ДЖ для введения детям в возрасте старше 3-х месяцев (используя флакон 70 мг)»), при этом концентрация препарата в первичном растворе составит 7,2 мг/мл.
Побочное действие
Имеются отдельные сообщения о реакциях повышенной чувствительности (анафилаксия и аллергические реакции) (см. раздел «Особые указания»). У пациентов с инвазивным аспергиллёзом были зарегистрированы отёк лёгких, респираторный дистресс-синдром, инфильтраты на рентгенограмме.
У взрослых
В клинических исследованиях каспофунгина 1865 взрослых пациентов принимали однократную дозу или многократные дозы каспофунгина: 564 пациента с фебрильной нейтропенией (исследование по эмпирической терапии), 382 пациента с инвазивным кандидозом, 228 пациентов с инвазивным аспергиллёзом, 297 пациентов с локализованными инфекциями, вызванными штаммами грибов рода Candida, и 394 пациента, зарегистрированных в ходе исследований I фазы. В исследование по эмпирической терапии были включены пациенты, проходившие курс химиотерапии по поводу злокачественных новообразований, или пациенты после трансплантации гемопоэтических стволовых клеток (включая 39 случаев аллогенной трансплантации). В исследованиях, включавших пациентов с инфекциями, вызванными штаммами грибов рода Candida, большинство пациентов с инвазивным кандидозом находились в тяжёлом состоянии (например, онкогематологические заболевания или другие формы злокачественных новообразований, недавно перенесённая обширная хирургическая операция, ВИЧ), требующем применения сопутствующей комплексной лекарственной терапии. Пациенты с инфекциями, вызванными штаммами грибов рода Aspergillus, часто находились в тяжёлом состоянии (например, трансплантация костного мозга или периферических стволовых клеток, онкогематологическое заболевание, опухоли солидных органов или трансплантация органов), требующем применения сопутствующей комплексной лекарственной терапии.
У пациентов всех популяций частым побочным эффектом в месте введения был флебит, а также наблюдались другие местные реакции, включая эритему, боль/болезненность, кожный зуд и чувство жжения.
Выявленные побочные реакции, связанные с применением препарата, обычно протекали легко и редко требовали отмены препарата.
Частота побочных реакций приведена в следующей градации согласно классификации Всемирной организации здравоохранения: очень часто (>1/10); часто (>1/100, <1/10); нечасто (>1/1 000, <1/100); редко (>1/10 000, <1/1 000); очень редко (<1/10 000), включая отдельные сообщения; частота неизвестна (частота не может быть подсчитана по доступным данным).
Нарушения со стороны крови и лимфатической системы: часто — снижение гемоглобина, снижение гематокрита, снижение числа лейкоцитов; нечасто — анемия, тромбоцитопения, коагулопатия, лейкопения, повышение числа эозинофилов, снижение числа тромбоцитов, повышение числа тромбоцитов, снижение числа лимфоцитов, повышение числа лейкоцитов, снижение числа нейтрофилов.
Нарушения со стороны обмена веществ и питания: часто — гипокалиемия; нечасто —гиперволемия, гипомагниемия, анорексия, нарушение водно-электролитного баланса, гипергликемия, гипокальциемия, метаболический ацидоз.
Нарушения психики: нечасто — тревога, дезориентация, бессонница.
Нарушения со стороны нервной системы: часто — головная боль; нечасто — головокружение, нарушение вкуса, парестезия, сонливость, тремор, гипестезия.
Нарушения со стороны органа зрения: нечасто — желтушность склер, нечёткость зрения, отёк века, повышенное слезотечение.
Нарушения со стороны сердца: нечасто — ощущение сердцебиения, тахикардия, аритмия, фибрилляция предсердий, хроническая сердечная недостаточность.
Нарушения со стороны сосудов: часто — флебит; нечасто — тромбофлебит, гиперемия («приливы» крови), повышение артериального давления, снижение артериального давления.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто — одышка; нечасто — заложенность носа, боль в горле, учащённое дыхание, бронхоспазм, кашель, пароксизмальная ночная одышка, гипоксия, хрипы, затруднённое дыхание, патологические дыхательные шумы.
Нарушения со стороны желудочно-кишечного тракта: часто — тошнота, диарея, рвота; нечасто — боль в животе, боль в верхней части живота, ощущение сухости во рту, диспепсия, ощущение дискомфорта в желудке, вздутие живота, асцит, запор, метеоризм, затруднённое глотание.
Нарушения со стороны печени и желчевыводящих путей: часто — повышение функциональных показателей печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (ACT), щелочная фосфатаза, прямой и непрямой билирубин); нечасто — холестаз, гепатомегалия, гипербилирубинемия, желтуха, нарушения функции печени, гепатотоксичность, поражение печени.
Нарушения со стороны кожи и подкожных тканей: часто — кожная сыпь, кожный зуд, повышенное потоотделение, эритема; нечасто — мультиформная эритема, макулёзная сыпь, макулопапулёзная сыпь, зудящая сыпь, крапивница, аллергический дерматит, генерализованный зуд, эритематозная сыпь, генерализованная сыпь, кореподобная сыпь, поражение кожи.
Нарушения со стороны скелетно-мышечной и соединительной ткани: часто — артралгия; нечасто — боль в спине, боль в конечностях, боль в костях, мышечная слабость, миалгия.
Нарушения со стороны почек и мочевыводящих путей: нечасто — почечная недостаточность, острая почечная недостаточность.
Общие расстройства и нарушения в месте введения: часто — лихорадка, озноб, зуд в месте введения; нечасто — боль, боль в месте введения, повышенная утомляемость, ощущение холода, ощущение жара, эритема в месте введения, уплотнение в месте введения, припухлость в месте введения, флебит в месте введения, периферические отёки, слабость, ощущение дискомфорта в грудной клетке, отёк лица, ощущение изменения температуры тела, уплотнения и экстравазация в месте введения, раздражение в месте введения, сыпь в месте введения, крапивница в месте введения, отёк в месте введения, недомогание, отёк.
Лабораторные и инструментальные данные: часто — уменьшение концентрации калия в крови, уменьшение концентрации альбумина в крови; нечасто — повышение концентрации креатинина в крови, наличие эритроцитов в моче, уменьшение концентрации общего белка, наличие белка в моче, увеличение/уменьшение протромбинового времени, увеличение концентрации натрия в крови, уменьшение концентрации натрия в крови, повышение концентрации кальция в крови, уменьшение концентрации кальция в крови, увеличение/уменьшение концентрации хлоридов в крови, увеличение концентрации глюкозы в крови, увеличение/уменьшение концентрации фосфора в крови, уменьшение концентрации магния в крови, увеличение концентрации мочевины в крови, увеличение активности гамма-глутамилтрансферазы, увеличение частичного тромбопластинового времени, уменьшение концентрации гидрокарбонатов в крови, увеличение концентрации калия в крови, повышение артериального давления, уменьшение концентрации мочевой кислоты в крови, наличие крови в моче, снижение концентрации углекислого газа, повышение концентрации иммунодепрессивных препаратов, увеличение Международного нормализованного отношения (МНО), цилиндрурия, наличие лейкоцитов в моче, повышение pH мочи.
В исследованиях применения каспофунгина в суточной дозе 150 мг (до 51 дня) принимали участие 100 взрослых пациентов. Проводилась сравнительная оценка применения каспофунгина в суточной дозе 50 мг (с применением нагрузочной дозы 70 мг в первый день) и в суточной дозе 150 мг при лечении инвазивного кандидоза. Профиль безопасности каспофунгина в высокой дозе в целом сопоставим с таковым при применении препарата в суточной дозе 50 мг. В обеих группах пропорциональное соотношение числа пациентов с серьёзными побочными эффектами или с побочными эффектами, приведшими к отмене препарата, было сопоставимым.У детей
Результаты 5 клинических исследований каспофунгина с участием 171 ребёнка указывают, что общая частота побочных эффектов (26,3 %; 95 % доверительный интервал — 19,9; 33,6) не превышала таковую при лечении каспофунгином взрослых пациентов (43,1 %; 95 % доверительный интервал — 40,0; 46,2). Однако в сравнении с взрослыми пациентами дети имеют иной профиль побочных эффектов. Наиболее частыми побочными реакциями, зафиксированными при применении каспофунгина у детей, были лихорадка (11,7 %), кожная сыпь (4,7 %) и головная боль (2,9 %).
Зарегистрированные побочные реакции приведены в следующей градации согласно классификации Всемирной организации здравоохранения: очень часто (>1/10); часто (>1/100, <1/10); нечасто (>1/1 000, <1/100); редко (>1/10 000, <1/1 000); очень редко (<1/10 000), включая отдельные сообщения; частота неизвестна (частота не может быть подсчитана по доступным данным).
Нарушения со стороны крови и лимфатической системы: часто — повышение числа эозинофилов.
Нарушения со стороны нервной системы: часто — головная боль.
Нарушения со стороны сердца: часто — тахикардия.
Нарушения со стороны сосудов: часто — гиперемия, снижение артериального давления.
Нарушения со стороны печени и желчевыводящих путей: часто — повышение активности ACT, АЛТ.
Нарушения со стороны кожи и подкожных тканей: часто — кожная сыпь, кожный зуд.
Общие расстройства и нарушения в месте введения: очень часто — лихорадка; часто — озноб, боль в месте введения.
Лабораторные и инструментальные данные: часто — уменьшение концентрации калия в крови, уменьшение концентрации магния в крови, увеличение концентрации глюкозы, увеличение/уменьшение концентрации фосфора в крови.
Пострегистрационный опыт применения каспофунгина
В пострегистрационной практике применения каспофунгина сообщалось о следующих нежелательных эффектах:
Нарушения со стороны печени и желчевыводящих путей: нарушения функции печени.
Нарушения со стороны кожи и подкожных тканей: токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Общие расстройства и нарушения в месте введения: припухлость, периферические отёки.
Лабораторные и инструментальные данные: увеличение концентрации кальция в крови, повышение активности гамма-глутамилтрансферазы.
Передозировка
В клинических исследованиях каспофунгина хорошо переносилась самая высокая из изученных доз — однократная разовая доза 210 мг (6 здоровых добровольцев).
Также была показана хорошая переносимость каспофунгина при его введении в суточной дозе 150 мг в течение 51 дня (100 здоровых добровольцев).
При передозировке каспофунгина диализ неэффективен.
Взаимодействие с другими лекарственными средствами
В исследованиях in vitro было установлено, что каспофунгин не является ингибитором какого-либо изофермента системы цитохрома P450 (CYP), а также не является индуктором метаболизма других препаратов, опосредованного изоферментом CYP3A4. В клинических исследованиях установлено, что каспофунгин не является субстратом для Р-гликопротеина и представляет собой слабый субстрат для изоферментов системы цитохрома P450.
В двух клинических исследованиях у взрослых пациентов циклоспорин (однократная доза 4 мг/кг или две дозы по 3 мг/кг) увеличивал AUC каспофунгина приблизительно на 35 %.
Увеличение AUC, вероятно, связано с уменьшением печёночной экстракции каспофунгина. Каспофунгин не увеличивал концентрацию циклоспорина в плазме крови.
При совместном применении этих лекарственных препаратов было отмечено транзиторное повышение активности ACT и АЛТ. В ретроспективном исследовании 40 пациентов, принимавших каспофунгин и/или циклоспорин длительностью до 290 дней (в среднем 17,5 дней), не было отмечено серьёзных нежелательных явлений со стороны печени (см. раздел «Особые указания»), В клинических исследованиях у взрослых здоровых добровольцев было установлено, что итраконазол, амфотерицин B, микофенолата мофетил, нелфинавир или такролимус не оказывают влияния на фармакокинетику каспофунгина. В свою очередь каспофунгин не оказывает влияния на фармакокинетические показатели итраконазола, амфотерицина B, рифампицина или активных метаболитов микофенолата мофетила.
Каспофунгин снижает показатель 12-часовой концентрации (C12) в крови такролимуса на 26 %. У пациентов, получающих оба препарата, рекомендуется контролировать концентрацию такролимуса в крови и при необходимости корректировать его дозу.
Результаты двух клинических исследований взаимодействия лекарственных препаратов у взрослых здоровых добровольцев показывают, что рифампицин может, как ускорять, так и замедлять распределение каспофунгина. В одном из исследований рифампицин и каспофунгин назначали в течение 14 дней одновременно с первого дня лечения. Во втором исследовании первоначально назначали только рифампицин в течение 14 дней до достижения равновесной концентрации препарата в плазме крови, а затем в течение ещё в течение 14 дней оба препарата применяли одновременно. На этапе равновесной концентрации рифампицина было отмечено лишь незначительное изменение AUC каспофунгина или концентрации в момент завершения инфузии, однако остаточная концентрация каспофунгина снижалась приблизительно на 30 %.
Обратный эффект рифампицина наблюдался при одновременном совместном назначении рифампицина и каспофунгина с первого дня лечения: отмечалось преходящее увеличение концентрации каспофунгина в плазме крови в первый день (увеличение AUC приблизительно на 60 %). В то же время при введении каспофунгина на фоне проводившейся в течение 14 дней монотерапии рифампицином не отмечалось влияния рифампицина на концентрацию каспофунгина.
Кроме того, результаты фармакокинетического скрининга у взрослых пациентов показывают, что одновременное применение каспофунгина с индукторами клиренса лекарственных препаратов (эфавиренз, невирапин, фенитоин, дексаметазон или карбамазепин) может приводить к клинически значимому снижению концентрации каспофунгина. Имеющиеся данные свидетельствуют о том, что индуцированное этими препаратами снижение концентрации каспофунгина происходит за счёт ускорения элиминации, нежели метаболизма. Поэтому у взрослых пациентов при одновременном применении каспофунгина с эфавирензом, нелфинавиром, невирапином, фенитоином, рифампицином, дексаметазоном или карбамазепином следует рассмотреть возможность сохранения суточной дозы каспофунгина 70 мг, не снижая её после нагрузочной дозы 70 мг, назначаемой в первые сутки лечения. У детей результаты регрессивного анализа фармакокинетических данных показали, что совместное применение дексаметазона и каспофунгина может сопровождаться клинически значимым снижением пороговой концентрации каспофунгина. Эти данные могут указывать на то, что при одновременном применении с индукторами клиренса лекарственных препаратов у детей будет отмечаться такое же снижение концентрации каспофунгина, как и у взрослых пациентов. Одновременное применение с каспофунгином индукторов клиренса лекарственных препаратов (рифампицин, эфавиренз, невирапин, фенитоин, дексаметазон или карбамазепин) у детей, как и у взрослых, требует увеличения суточной дозы до 70 мг/м2 (суточная доза не должна превышать 70 мг, независимо от величины расчётной дозы для данного пациента).
Особые указания
При применении каспофунгина наблюдались случаи возникновения анафилаксии. При анафилаксии применение препарата Каспофунгин должно быть прекращено и назначено соответствующее лечение. Имеются отдельные сообщения об аллергических реакциях включающих кожную сыпь, отёк лица, ангионевротический отёк, кожный зуд, ощущение жара и бронхоспазм, при возникновении которых может потребоваться прекращение применения препарата Каспофунгин и/или назначение соответствующего лечения.
Случаи развития синдрома Стивенса-Джонсона и токсического эпидермального некролиза были зарегистрированы в ходе пострегистрационного мониторинга применения каспофунгина. Препарат следует применять с осторожностью у пациентов с аллергическими реакциями со стороны кожи в анамнезе.
Одновременное применение каспофунгина и циклоспорина изучалось у взрослых здоровых добровольцев и взрослых пациентов. У некоторых здоровых взрослых добровольцев, принимавших две дозы циклоспорина 3 мг/кг с каспофунгином, наблюдалось транзиторное повышение активности ACT и АЛТ (не более чем в 3 раза по сравнению с верхней границей нормы (ВГН)), которое проходило после отмены препаратов. Также при одновременном применении каспофунгина с циклоспорином наблюдалось увеличение показателя AUC для каспофунгина приблизительно на 35 % без изменения концентрации циклоспорина. В ретроспективном исследовании 40 пациентам, которым терапия каспофунгином и циклоспорином совместно проводилась в течение 1–290 дней (в среднем 17,5 дней) не было отмечено серьёзных нежелательных явлений со стороны печени. Как и следовало ожидать, у пациентов с аллогенной трансплантацией гемопоэтических стволовых клеток или трансплантацией целого органа отклонения со стороны активности «печёночных» ферментов встречались в большинстве случаев, однако, ни у одного пациента не было отмечено повышение активности АЛТ, связанное с применением препарата. Повышение активности ACT, возможно связанное с терапией каспофунгином и/или циклоспорином, было отмечено у 5 пациентов, но во всех случаях не более чем в 3,6 раза по сравнению с ВГН. У 4 пациентов каспофунгин был отменен в связи с отклонениями показателей активности «печёночных» ферментов по различным причинам. Из них 2 случая отмены могли быть обусловлены как терапией каспофунгином и/или циклоспорином, так и другими возможными причинами. В исследованиях инвазивного аспергиллёза принимали участие 6 взрослых пациентов, которым терапия каспофунгином и циклоспорином совместно проводилась в течение 2–56 дней; ни у одного из этих пациентов не отмечалось повышение активности «печёночных» ферментов. Полученные данные позволили предположить, что каспофунгин может применяться одновременно с циклоспорином в тех случаях, когда потенциальная польза такого назначения превышает возможный риск. При одновременном применении каспофунгина и циклоспорина необходимо мониторинг активности «печёночных» ферментов.
У здоровых добровольцев и пациентов взрослого и детского возраста, принимавших каспофунгин, наблюдались отклонения лабораторных показателей функции печени. У некоторых пациентов взрослого и детского возраста с тяжёлыми сопутствующими заболеваниями, принимавших каспофунгин в составе комбинированной терапии, были выявлены отдельные случаи клинически значимых нарушений функции печени, гепатита и печёночной недостаточности; причинно-следственная связь с применением каспофунгина не установлена. Пациенты, у которых на фоне применения каспофунгина наблюдаются отклонения лабораторных показателей функции печени, должны находиться под наблюдением с целью выявления признаков нарушения функции печени. В отношении таких пациентов следует оценить необходимость продолжения терапии каспофунгином в зависимости от соотношения польза/риск.
Влияние на способность управлять транспортными средствами, механизмами
Нет данных о влиянии препарата на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий, 50 мг, 70 мг.
По 50 мг или 70 мг каспофунгина во флаконы из бесцветного стекла первого гидролитического класса вместимостью 10 мл, герметично укупоренные пробками из резины, закрытые алюминиево-пластиковыми колпачками.
На флакон наклеивают этикетку.
По 1 флакону вместе с инструкцией по применению в пачку из картона.
Хранение
В защищённом от света месте при температуре от A2 до 8 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Stanex Drugs & Chemicals Pvt. Ltd., Индия
Станекс Драгз Энд Кемикалз Пвт. Лтд., Индия
Участок №: 112, ИДА, Черлапалли, Фаза III, Хайдарабад-500059, штат Телангана, Индия
Владелец регистрационного удостоверения/Организация, принимающая претензии потребителей
ООО «Джодас Экспоим», Россия
140202, Московская обл., Воскресенский р-он, г. Воскресенск, ул. Московская, д. 45м, офис 4.
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате КАСПОФУНГИН-ДЖ:
