Кабивен® центральный
Лекарственная форма
эмульсия для инфузий
Состав
Кабивен® центральный выпускается в трёхкамерном мешке и представлен в четырёх объёмах.
Каждый мешок содержит следующие объёмы разных растворов, в зависимости от размера мешка:
| Объём мешка | 2566 мл | 2053 мл | 1540 мл | 1026 мл |
| Глюкоза 19 % | 1316 мл | 1053 мл | 790 мл | 526 мл |
| Вамин 18 Новум | 750 мл | 600 мл | 450 мл | 300 мл |
| Интралипид 20 % | 500 мл | 400 мл | 300 мл | 200 мл |
| Энергетическая ценность | 2300 ккал | 1900 ккал | 1400 ккал | 900 ккал |
Состав:
после смешивания 3-х камер:
| Активные компоненты: | 2566 мл | 2053 мл | 1540 мл | 1026 мл |
| соевых бобов масло | 100 г | 80 г | 60 г | 40 г |
| глюкозы (декстрозы) моногидрат, | 275 г | 220 г | 165 г | 110 г |
| что соответствует декстрозе безводной | 250 г | 200 г | 150 г | 100 г |
| L-аланин | 12,0 г | 9,6 г | 7,2 г | 4,8 г |
| L-аргинин | 8,5 г | 6,8 г | 5,1 г | 3,4 г |
| L-аспарагиновая кислота | 2,6 г | 2,0 г | 1,5 г | 1,0 г |
| L-валин | 5,5 г | 4,4 г | 3,3 г | 2,2 г |
| L-гистидин | 5,1 г | 4,1 г | 3,1 г | 2,0 г |
| Глицин (аминоуксусная кислота) | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| L-глутаминовая кислота | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| L-изолейцин | 4,2 г | 3,4 г | 2,5 г | 1,7 т |
| L-лейцин | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| L-лизин гидрохлорид | 8,5 г | 6,8 г | 5,1 г | 3,4 г |
| что соответствует лизину | 6,8 г | 5,4 г | 4,1 г | 2,7 г |
| L-метионин | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| L-пролин | 5,1 г | 4,1 г | 3,1 г | 2,0 г |
| L-серин | 3,4 г | 2,7 г | 2,0 г | 1,4 г |
| L-тирозин | 0,17 г | 0,14 г | 0,10 г | 0,07 г |
| L-треонин | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| L-триптофан | 1,4 г | 1,1 г | 0,86 г | 0,57 г |
| L-фенилаланин | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| кальция хлорида дигидрат, | 0,74 г | 0,59 г | 0,44 г | 0,29 г |
| что соответствует кальцию хлориду | 0,56 г | 0,44 г | 0,33 г | 0,22 г |
| натрия глицерофосфат (безводный) | 3,8 г | 3,0 г | 2,3 г | 1,5 г |
| магния сульфата гептагидрат, | 2,5 г | 2,0 г | 1,5 г | 0,99 г |
| что соответствует магнию сульфату | 1,2 г | 0,96 г | 0,72 г | 0,48 г |
| калия хлорид | 4,5 г | 3,6 г | 2,7 г | 1,8 г |
| натрия ацетата тригидрат, | 6,1 г | 4,9 г | 3,7 г | 2,5 г |
| что соответствует натрию ацетату | 3,7 г | 2,9 г | 2,2 г | 1,5 г |
| вспомогательные компоненты: | ||||
| фосфолипиды яичного желтка | 6,0 г | 4,8 г | 3,6 г | 2,4 г |
| глицерол (безводный) | 11,0 г | 8,8 г | 6,6 г | 4,4 г |
| кислота уксусная ледяная | q s. для коррекции pH | |||
| натрия гидроксид | q.s. для коррекции pH | |||
| вода для инъекций | до 2566 мл | до 2053 мл | до 1540 мл | до 1026 мл |
| Аминокислоты | 85 г | 68 г | 51 г | 34 г |
| Азот | 13,5 г | 10,8 г | ЗДг | 5,4 г |
| Жиры | 100 г | 80 г | 60 г | 40 г |
| Углеводы | ||||
| глюкоза (безводная) | 250 г | 200 г | 150 г | 100 г |
| Энергия | ||||
| всего | 2300 ккал | 1900 ккал | 1400 ккал | 900 ккал |
| небелковая | 2000 ккал | 1600 ккал | 1200 ккал | 800 ккал |
| Электролиты | ||||
| натрий | 80 ммоль | 64 ммоль | 48 ммоль | 32 ммоль |
| калий | 60 ммоль | 48 ммоль | 36 ммоль | 24 ммоль |
| магний | 10 ммоль | 8 ммоль | 6 ммоль | 4 ммоль |
| кальций | 5 ммоль | 4 ммоль | 3 ммоль | 2 ммоль |
| фосфат | 25 ммоль | 20 ммоль | 15 ммоль | 10 ммоль |
| сульфат | 10 ммоль | 8 ммоль | 6 ммоль | 4 ммоль |
| хлорид | 116 ммоль | 93 ммоль | 70 ммоль | 46 ммоль |
| ацетат | 97 ммоль | 78 ммоль | 58 ммоль | 39 ммоль |
Осмоляльность около 1230 мосмоль/кг воды
Осмолярность около 1060 мосмоль/л
Описание
Глюкоза 19 % — прозрачный, почти бесцветный раствор, не содержащий посторонних частиц.
Вамин 18 Новум — прозрачный, бесцветный или слегка желтоватый раствор, не содержащий посторонних частиц.
Интралипид 20 % — белого или белого с кремовым оттенком цвета гомогенная эмульсия.
При смешивании содержимого трёх камер — белого цвета эмульсия.
Фармакологическое действие
Фармакодинамика
Фармакологические свойства препарата определяются его составом.
Вамин 18 Новум предназначен для парентерального питания больных с различной патологией с повышенной потребностью в белке, когда энтеральное питание неэффективно или невозможно.
Глюкоза является незаменимым источником быстро высвобождающейся энергии, необходимой, в том числе, и для метаболизма аминокислот.
Интралипид используется для парентерального питания больных как источник энергии и незаменимых жирных кислот. Интралипид показан больным с дефицитом незаменимых жирных кислот, неспособным к самостоятельному восполнению нормального баланса эссенциальных жирных кислот путём перорального потребления. Интралипид содержит очищенное соевое масло, эмульгированное с очищенными яичными фосфолипидами. Размеры липидных глобул и биологические свойства Интралипида сходны с характеристиками эндогенных хиломикронов. В отличие от хиломикронов, Интралипид не содержит эфиров холестерина и аполипопротеина, а содержание фосфолипидов в нем выше.
Фармакокинетика
ЖИРОВАЯ ЭМУЛЬСИЯ
Интралипид выводится из кровотока тем же путём, что и хиломикроны. Экзогенные частицы жира в основном гидролизуются в крови и захватываются рецепторами липопротеидов низкой плотности в печени и периферических тканях. Скорость выведения определяется составом жировых частиц, клиническим состоянием и состоянием питания больного, а также скоростью инфузии Максимальный клиренс Интралипида натощак эквивалентен 3,8 ± 1,5 гтриглицеридов/кг/сут.
АМИНОКИСЛОТЫ И ЭЛЕКТРОЛИТЫ
Фармакокинетические характеристики аминокислот и электролитов, вводимых внутривенно, такие же, как при их поступлении с пищей. Однако аминокислоты белков пищи сначала попадают в портальную вену печени, и лишь затем в системный кровоток, в то время как аминокислоты, вводимые в вену, попадают непосредственно в системный кровоток.
ГЛЮКОЗА
Фармакокинетические характеристики глюкозы, вводимой путём инфузии, такие же, как при её поступлении с обычной пищей.
Показания
Парентеральное питание взрослых и детей с 2 лет, когда пероральное или энтеральное питание невозможно, недостаточно или противопоказано.
Противопоказания
- Известная гиперчувствительность к яичным или соевым белкам или к любому вспомогательному компоненту препарата.
- Выраженная гиперлипидемия.
- Выраженная печёночная недостаточность.
- Выраженные нарушения свёртывания крови.
- Врождённые нарушения метаболизма аминокислот.
- Тяжёлая почечная недостаточность при отсутствии гемодиализа или гемофильтрации.
- Острая фаза шока.
- Гипергликемия, требующая введения инсулина в количестве более 6 ЕД/ч.
- Патологически повышенная концентрация в плазме крови любого из входящих в состав препарата электролитов.
- Общие противопоказания к инфузионной терапии: острый отёк лёгких, гипергидратация, декомпенсированная сердечная недостаточность и гипотоническая дегидратация.
- Нестабильные состояния (напр., посттравматическое состояние, некомпенсированный сахарный диабет, инфаркт миокарда в острой стадии, декомпенсированный метаболический ацидоз, тяжёлый сепсис и гиперосмолярная кома).
С осторожностью
При нарушении метаболизма липидов вследствие почечной недостаточности, сахарного диабета, панкреатита, нарушения функций печени, гипотиреоза (с гипертриглицеридемией) или сепсиса. При введении Кабивена® центрального больным с такими нарушениями обязательно необходим тщательный контроль концентрации триглицеридов в плазме крови.
Кабивен® центральный предназначен в первую очередь для пациентов старше 2 лет. У детей до 2 лет Кабивен® центральный может применяться только по жизненным показаниям при отсутствии специальных адаптированных аминокислотных растворов, содержащих таурин (Аминовен инфант).
Недоношенные дети и дети с низкой массой при рождении могут иметь нарушенный метаболизм жиров. Следует тщательно контролировать уровень триглицеридов.
Беременность и лактация
Специальных исследований безопасности Кабивена® центрального в период беременности и кормления грудью не проводилось.
Перед назначением Кабивена® центрального беременным и кормящим женщинам врач должен оценить соотношение риск/польза.
Способ применения и дозы
Внутривенно капельно, только в центральные вены.
Инфузию можно продолжать столько времени, сколько этого требует клиническое состояние больного, исходя из суточной потребности в глюкозе, липидах и аминокислотах.
Дозировка и скорость инфузии определяются способностью пациента выводить липиды и метаболизировать глюкозу.
Кабивен® центральный выпускается в мешках четырёх размеров, предназначенных для больных с нормальной, умеренно повышенной или сниженной потребностью в питательных веществах. Для проведения полного парентерального питания может потребоваться добавление витаминов, электролитов и микроэлементов.
Дозу следует подбирать индивидуально, и при выборе объёма мешка следует учитывать состояние больного, массу тела и потребность в питательных веществах.
У больных с ожирением дозу следует устанавливать, исходя из идеальной массы тела.
У пациентов с умеренным или тяжёлым катаболическим стрессом с или без недостаточности питания потребность в аминокислотах составляет 1,0–2,0 г/кг/сут, что равно потребности в азоте 0,15–0,30 г/кг/сут. Это соответствует 27–40 мл Кабивена центрального® на 1 кг массы тела в сутки.
У пациентов без тяжёлого катаболического стресса потребность в аминокислотах составляет 0,7–1,3 г/кг/сут, что равно потребности в азоте 0,10–0,20 г/кг/сут. Это соответствует 19–38 мл Кабивена центрального® на 1 кг массы тела в сутки.
Максимальная суточная доза
Взрослые
40 мл/кг/сут. Это равно одному мешку (наибольшего размера — 2566 мл) для пациента массой 64 кг и обеспечивает поступление 1,3 г амйнокислот/кг/сут (0,21 г азота/кг/сут), 31 ккал/кг/сут небелковой энергии, 3,9 г глюкозы/кг/сут и 1,6 г жиров/кг/сут..
Максимальная суточная доза зависит от клинического состояния пациента и может изменяться.
Дети
Дозировка определяется способностью пациента метаболизировать отдельные питательные вещества.
Инфузию детям (от 2 до 10 лет) следует начинать с низких доз (14–28 мл/кг/сут, дозу следует увеличивать по 10–15 мл/кг/сут, максимальная доза 40 мл/кг/сут).
У детей старше 10 лет можно применять такие же дозы, как и у взрослых.
Скорость инфузии:
Скорость инфузии Кабивена® центрального не должна превышать 2,6 мл/кг/ч, что соответствует скорости инфузии глюкозы 0,25 г/кг/ч, аминокислот 0,09 г/кг/ч и жиров 0,13 г/кг/ч.
Рекомендуемая длительность инфузии Кабивена® центрального составляет 12–24 часа.
Инструкция по использованию трёхкамерного мешка
- Снимите наружный пакет, разорвав его в месте надреза и потянув его вдоль мешка.
- Большими и указательными пальцами двух рук плотно возьмитесь за боковые стенки мешка над серединой фиксатора, разделяющего камеры 1 и 2. Потяните стенки мешка в стороны и полностью откройте фиксатор.
- Аналогичным образом откройте фиксатор между камерами 2 и 3. Перемешайте содержимое, перевернув мешок несколько раз.
- При необходимости введения добавки (с известной совместимостью, например, препараты витаминов, микроэлементов) протрите мембрану входного отверстия антисептиком.
- Положите мешок на стол, придерживая основание входного отверстия, полностью введите через центр мембраны иглу и введите добавку (с известной совместимостью). Перед введением другой добавки тщательно перемешайте содержимое, перевернув мешок несколько раз.
- Снимите колпачок с иглы инфузионной системы, взявшись за кольцо большим и указательным пальцами и потянув кольцо вверх. Используйте инфузионную систему без доступа воздуха или перекройте доступ воздуха на системе, имеющей доступ воздуха.
- Положите мешок на плоскую поверхность. Удерживая мешок выходным отверстием вверх, полностью введите иглу через мембрану, при необходимости поворачивая и проталкивая её. Для надёжного закрепления иглы она должна быть введена полностью.
- Повесьте мешок на стойку и выполняйте инструкции к инфузионной системе и инфузионному насосу.
- Другой способ открытия фиксаторов: положите мешок на плоскую поверхность и сворачивайте его со стороны ручки, пока фиксаторы не раскроются. Тщательно перемешайте содержимое, перевернув мешок несколько раз.
Примечание: раздельное введение компонентов из отдельных камер Кабивена® центрального технически невозможно (за исключением Интралипида), хотя каждый компонент Кабивена® центрального: Вамин, Интралипид и раствор глюкозы могут применяются в виде отдельных препаратов.
Побочные эффекты
Побочные эффекты при правильном введении чрезвычайно редки:
- аллергические реакции (анафилактическая реакция, лихорадка, озноб, дрожь, кожная сыпь, крапивница),
- изменения дыхания (тахипноэ) и гипер- или гипотензия,
- повышение активности ферментов печени,
- гемолиз,
- ретикулоцитоз,
- абдоминальные боли,
- головная боль,
- приапизм.
Передозировка
Синдром жировой перегрузки
Нарушенная способность выводить жиры может приводить к развитию синдрома жировой перегрузки. Это может явиться результатом передозировки, но также может наблюдаться при рекомендуемой скорости инфузии в том случае, если у больного резко меняется клиническое состояние и развивается тяжёлая почечная или печёночная недостаточность.
Синдром жировой перегрузки характеризуется гиперлипидемией, лихорадкой, гепатоспленомегалией, анемией, лейкопенией, тромбоцитопенией, коагулопатией и комой.
Лечение
Прекращение инфузии липидов, симптоматическая терапия.
Взаимодействие
Гепарин в клинически применяемых дозах вызывает преходящее высвобождение в кровоток липопротеин-липазы, что может привести в начале к усилению липолиза в плазме крови, а затем к преходящему ослаблению клиренса триглицеридов.
Инсулин тоже может влиять на активность липазы, но данные о неблагоприятном влиянии этого фактора на терапевтическую ценность препарата отсутствуют.
Витамин K1, содержащийся в соевом масле, является антагонистом производных кумарина, поэтому рекомендуется тщательно контролировать свёртываемость крови у больных, получающих эти препараты.
Совместимость
Кабивен® центральный можно смешивать только с теми лекарственными средствами и питательными растворами, для которых подтверждена совместимость с ним, например:
- Виталипид Н взрослый и Виталипид Н детский;
- Солувит Н;
- Аддамель Н;
- Дйпептивен.
Смешивание растворов должно проводиться в асептических условиях.
Особые указания
Растворы Кабивена® центрального имеют осмолярность 1060 мОсм/л и поэтому не пригодны для внутривенного введения в периферические вены как у взрослых, так и у детей из-за опасности развития тромбофлебита.
При введении Кабивена® центрального больным с нарушением метаболизма липидов вследствие почечной недостаточности, сахарного диабета, панкреатита, нарушения функций печени, гипотиреоза (с гипертриглицеридемией) или сепсиса обязательно необходим тщательный контроль концентрации триглицеридов в плазме крови.
При применении препарата следует контролировать способность к выведению липидов путём измерения концентрации триглицеридов в плазме крови через 5–6 часов после последнего приёма жиров.
Следует тщательно рассчитывать объём вводимого препарата и корректировать его в соответствии с водным балансом и состоянием питания пациента. Каждый контейнер предназначен для однократного использования.
Выраженные нарушения электролитного и водного баланса необходимо корректировать до начала инфузии.
В начале инфузии требуется наблюдение за больным. Поскольку любая инфузия в центральную вену сопровождается повышенным риском развития инфекции, во время введения катетера или при манипуляциях с ним следует соблюдать строгие правила асептики во избежание инфицирования.
Необходимо регулярно проверять концентрации глюкозы и электролитов в плазме крови, а также осмолярность, водный баланс, кислотно-основное состояние и активность ферментов печени.
При длительном введении липидов следует контролировать клеточный состав крови и показатели свёртывания крови.
В данном препарате отсутствуют витамины и микроэлементы, поэтому для проведения полного парентерального питания их следует вводить дополнительно. Для их восполнения рекомендуется использовать Виталипид Н взрослый или Виталипид Н детский, Солувит Н, Аддамель Н.
При появлении любых симптомов и признаков аллергических реакций инфузию следует немедленно прекратить.
Наличие липидов в Кабивене® центральном может изменять результаты некоторых лабораторных анализов (напр., концентрацию билирубина, активность лактатдегидрогеназы, насыщение гемоглобина кислородом), если образец крови был получен до момента достаточного выведения липидов из кровотока. У большинства больных введённые липиды выводятся через 5–6 часов.
Внутривенное введение аминокислот может сопровождаться усилением почечного выведения микроэлементов, особенно цинка. Пациентам, нуждающимся в длительном внутривенном питании, может потребоваться дополнительное введение микроэлементов. У сильно истощённых больных начало парентерального питания может вызвать сдвиг водного баланса, приводящий к отёку лёгких и застойной сердечной недостаточности. Кроме того, в течение 24–48 часов в плазме крови может наблюдаться снижение концентраций калия, фосфора, магния и водорастворимых витаминов. Рекомендуется начинать парентеральное питание медленно с тщательным контролем и соответствующей коррекцией количества жидкости, электролитов, витаминов и микроэлементов.
Кабивен® центральный не следует вводить через один катетер и одновременно с кровью или препаратами крови из-за риска развития псевдоагглютинации.
Больным с гипергликемией может потребоваться введение инсулина.
Венозный катетер, через который вводится полное парентеральное питание, не рекомендуется использовать для внутривенного введения других растворов и препаратов.
Любые остатки из открытого контейнера должны быть уничтожены.
Рекомендации по подготовке контейнера Биофин к использованию
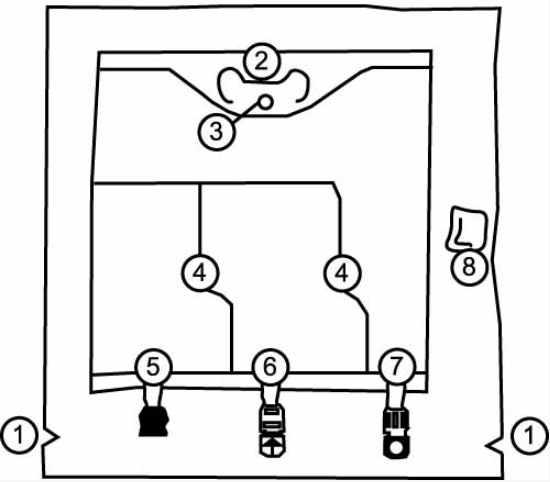
- Надрез на внешнем пакете
- Держатель
- Отверстие для подвешивания пакета
- Разделяющаяся перегородка
- Слепой порт (не используется)
- Входной порт (для добавок)
- Выходной порт (для инфузионной системы)
- Поглотитель кислорода (во внешнем пакете)
1. Удаление внешнего пакета
Положите контейнер на горизонтальную поверхность Разорвите внешний пакет в месте надреза, потянув вдоль края.
Снимите наружный пакет, выбросьте вместе в поглотителем кислорода
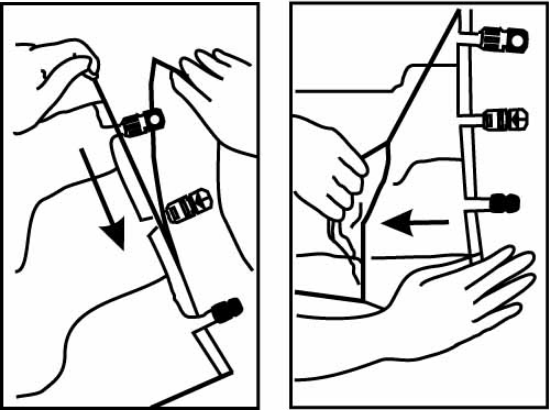
2. Смешивание
Положите трёхкамерный пакет на горизонтальную поверхность (см. рисунок).
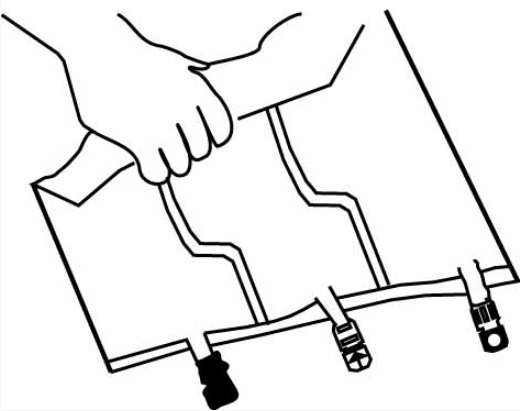
Сворачивайте пакет со стороны держателя в направлении портов сначала правой, затем сохраняя постоянное давление — приложите усилие левой рукой, до тех пор, пока вертикальные перегородки не раскроются.
Вертикальные перегородки раскрываются благодаря создаваемому давлению содержимого пакета! Горизонтальную перегородку раскрывать не нужно- содержимое камер легко смешивается после отрывания только вертикальных перегородок.
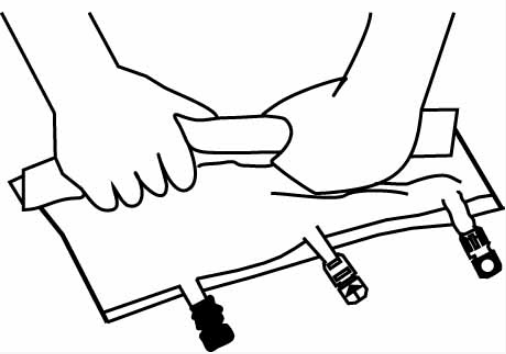
Смешайте содержимое камер, повернув пакет 2–3 раза. (Примечание: перегородки могут быть открыты во внешнем пакете, после можно удалить внешний пакет).
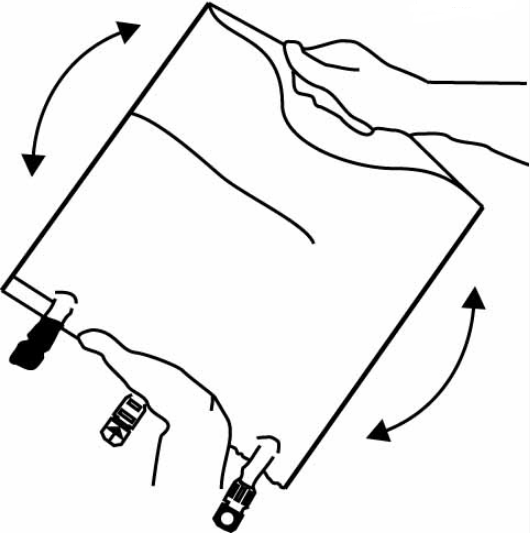
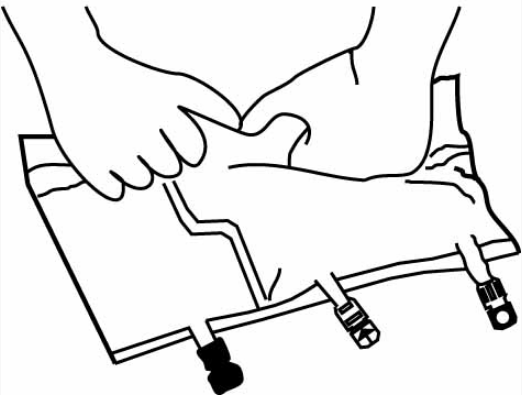
3. Подключение инфузионной системы
При необходимости введения добавки (с известной совместимостью, например специальные препараты витаминов, микроэлементов, омегавен, дипептивен), снимите (отломите) колпачок со стрелкой от порта белого цвета непосредственно перед введением
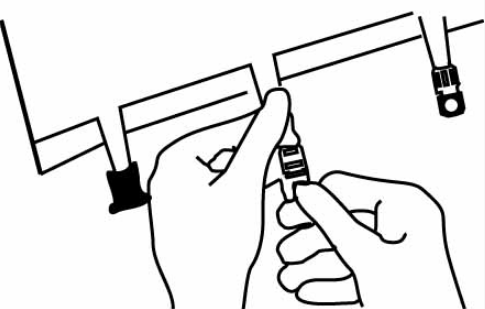
Придерживая основание входного отверстия, полностью введите через центр мембраны иглу и введите добавку (с известной совместимостью). Перед введением другой добавки тщательно перемешайте содержимое, перевернув мешок несколько раз.
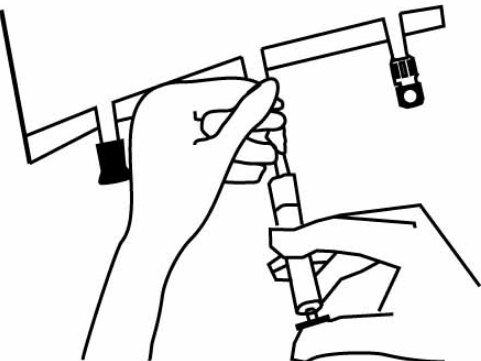
Подключение инфузионной системы: непосредственно перед введением иглы снимите колпачок с порта синего цвета.
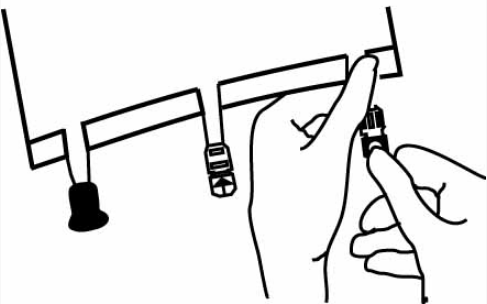
Удерживая мешок выходным отверстием вверх, введите иглу через мембрану, при необходимости поворачивая и проталкивая её. Используйте инфузионную систему без доступа воздуха или перекройте доступ воздуха на системе, имеющей доступ воздуха.
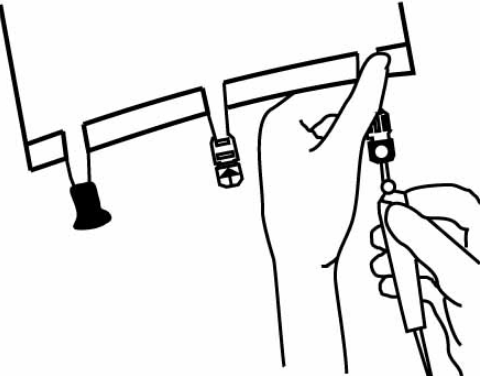
(Примечание — внутренняя часть портов стерильна)
4. Подвешивание на инфузионную стойку
Повесьте мешок на стойку (с помощью отверстия на держателе).
Форма выпуска
Эмульсия для инфузий.
Хранение
При температуре не выше 25 °C. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не использовать позже срока годности, указанного на упаковке.
Срок хранения после смешивания с добавками:
После раскрытия фиксаторов и смешивания трёх растворов к смеси можно добавлять совместимые добавки через входное отверстие.
После раскрытия фиксаторов химическая и физическая стабильность смешанного содержимого трёх камер сохраняется в течение 24 часов при 25 °C.
Для обеспечения микробиологической безопасности смесь следует использовать сразу после введения добавок. Если смесь не используется сразу, то, при условии соблюдения асептики при введении добавок, эмульсионную смесь можно хранить до 6 дней при 2–8 °C после чего смесь следует использовать в течение 24 часов.
Условия отпуска из аптек
Для стационаров
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Кабивен центральный:
