Олокизумаб
OlokizumabФармакологическое действие
Олокизумаб — гуманизированное (с присоединённым гипервариабельным участком) моноклональное антитело, относящееся к изотипу иммуноглобулина (immunoglobulin, Ig) G4/каппа. Олокизумаб селективно связывается с человеческим ИЛ-6 и эффективно нейтрализует эффекты ИЛ-6 in vivo и in vitro. Полученные данные свидетельствуют о том. что олокизумаб не связывается в значительной степени с другими молекулами семейства ИЛ-6 и не влияет на их функционирование, а также не активирует сигнальный путь ИЛ-6.
Механизм действия олокизумаба отличен от других ингибиторов ИЛ-6, одобренных для лечения ревматоидного артрита, тоцилизумаба и сарилумаба, поскольку олокизумаб таргетирован на лиганд IL-6.
Фармакодинамика
В двойных слепых рандомизированных клинических исследованиях 2 фазы подкожное введение олокизумаба в дозе от 60 до 480 мг/мес пациентам со среднетяжёлым или тяжёлым ревматоидным артритом вызывало выраженное снижение уровня С-реактивного белка (СРБ) в плазме в течение 7 дней от начала лечения, сохранявшееся в течение не менее 10 недель после однократного введения, и в течение всего периода терапии при многократном введении препарата.
У пациентов со среднетяжёлым или тяжёлым ревматоидным артритом, недостаточно контролируемым терапией метотрексатом, подкожное введение олокизумаба в дозе 64 мг каждые 2 недели (к2н) или 64 мг каждые 4 недели (к4н) вызывало резкое снижение среднего уровня СРБ в плазме ко 2 неделе лечения. Низкие уровни СРБ сохранялись в течение 24 недель на протяжении всего периода лечения.
Клиническая эффективность
Эффективность подкожного введения олокизумаба в дозе 64 мг каждые 2 недели (к2н) и каждые 4 недели (к4н) была изучена у пациентов со среднетяжёлым или тяжёлым ревматоидным артритом, недостаточно контролируемым терапией метотрексатом, в клиническом исследовании CREDO1.
Олокизумаб в обеих дозировках был значительно эффективнее плацебо в отношении снижения активности ревматоидного артрита вне зависимости от пола, индекса массы тела, активности заболевания, уровня антител к ревматоидному фактору и/или циклическому цитрирулированному пептиду. Длительность периода от постановки диагноза до начала лечения и продолжительность предшествующей терапии метотрексатом также не влияла на клиническую эффективность препарата. Кроме того, доля пациентов, достигших низкой активности заболевания и ремиссии, была значимо выше среди получавших олокизумаб по сравнению с плацебо. У пациентов, получавших олокизумаб, также чаще отмечалось улучшение качества жизни, уменьшение боли и количества болезненных и припухших суставов. Воздействие олокизумаба было заметным уже через 4 недели лечения, выраженный эффект развивался приблизительно через 12 недель от начала введения препарата и сохранялся в течение не менее чем 24 недель.
Фармакокинетика
Абсорбция
Биодоступность олокизумаба оценивалась на основании данных, полученных для 173 пациентов с лёгким или умеренным ревматоидным артритом, получавших олокизумаб в различных дозах в течение 12 недель, объединённых с данными, полученными у 40 пациентов с лёгким или умеренным ревматоидным артритом после однократного введения различных доз олокизумаба и данными, полученными у 41 здорового добровольца после однократного введения различных доз олокизумаба. При подкожном введении биодоступность составляет 63 % (доля относительной стандартной ошибки (% ОСО) = 4,9 %).
После однократного подкожного введения олокизумаба пациентам с лёгким или умеренным ревматоидным артритом в дозах от 0,3 до 6 мг/кг максимальная концентрация препарата в крови (Cmax) дозозависимо возрастала. Время достижения Cmax составляло от 4 до 12 дней, при этом поддающиеся определению уровни олокизумаба сохранялись приблизительно до 16 недель.
После однократного подкожного введения олокизумаба в дозе 64 мг пациентам с ревматоидным артритом средней и тяжёлой степени, недостаточно контролируемым на фоне лечения метотрексатом, Cmax достигалась в среднем через 7–10 дней (Таблица 1).
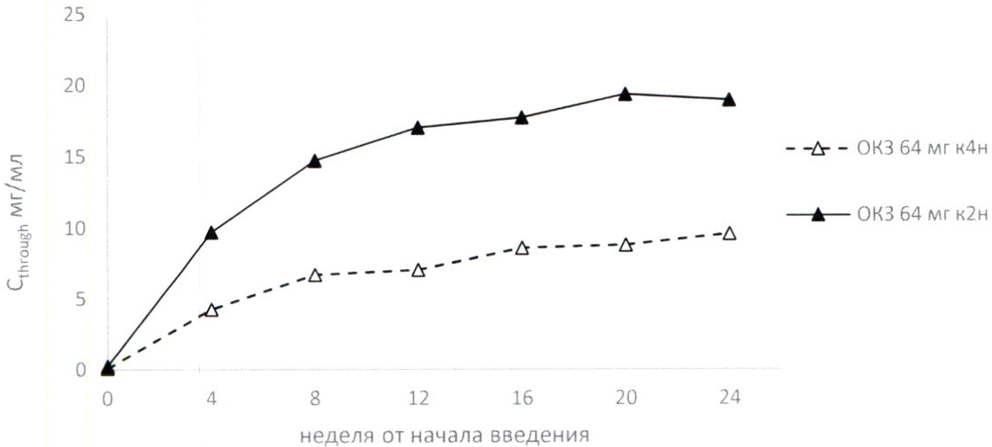
При многократном введении стационарная концентрация олокизумаба в крови нарастала в течение начального периода терапии и достигала равновесного состояния через 16 (64 мг к4н) и 14 (64 мг к2н) недель от начала лечения (Таблица 1. Рисунок 1).
| Фармакокинетический параметр | Исходные значения | Неделя 20 | ||
| ОКЗ 64 мг к4п N = 18 | ОКЗ 64 мг к2н N = 18 | ОКЗ 64 мг к4н N = 18 | ОКЗ 64 мг к2н N = 18 | |
| Cmax (мкг/мл) %CV | 6,18 50,0 | 6,22 39,2 | 17,00 55,7 | 21,55 25,0 |
| AUC0–t* (мкг × ч/мл) %CV | 2886 45,3 | 1556 38,9 | 8411 29,9 | 5485 31,8 |
| tmax (ч) Медиана Мин. – макс. | 190,2 166,5 92,8 – 402,3 | 234,4 236,7 95,8 – 359,2 | 244,5 167,6 95,4 – 670,7 | 127,8 96,7 0,0 – 334,7 |
РА — ревматоидный артрит; ОКЗ — олокизумаб; к2н — каждые 2 недели; к4н — каждые 4 недели; Cmax — максимальная концентрация препарата в крови; AUC0–t — площадь под кривой концентрация-время; tmax — время достижения максимальной концентрации препарата; *AUC для введения к4н рассчитывалась за период 672 часа (28 дней) и для введения к2н за период 336 часов (14 дней)
Рисунок 1. Динамика нарастания стационарной концентрации (Cthrough) при многократном подкожном введении пациентам с ревматоидным артритом средней и тяжёлой степени
Биотрансформация
В исследовании in vitro на криоконсервированных гепатоцитах человека олокизумаб обращал ингибиторный эффект ИЛ-6 на активность CYP1 A1/2, 2B6, 2C9, ЗA4/5 и 2C19, а также на активность NTCP.
Элиминация
Оценки клиренса олокизумаба у пациентов с лёгким или умеренным ревматоидным артритом составляли 0,17 л/сут (доля относительной стандартной ошибки [% ОСО] = 4,9 %) с низкой или средней индивидуальной вариабельностью.
Фармакокинетическая-фармакодинамическая зависимость Уровень снижения СРВ у пациентов с активным ревматоидным артритом, получавших олокизумаб, не зависел от дозы препарата. Кроме того, у пациентов с лёгким и умеренным ревматоидным артритом была выявлена положительная корреляция концентрации олокизумаба в плазме с уровнем нейтропении, повышением уровней ACT, АЛТ и триглицеридов в плазме, хотя величина эффекта была невелика. Также к 14 дню после введения олокизумаба наблюдалось стойкое снижение уровня VEGF и амилоидного сывороточного белка А во всех терапевтических группах без зависимости от дозы.
Показания
Терапия пациентов старше 18 лет с ревматоидным артритом средней или высокой степени активности в комбинации с метотрексатом, при недостаточной эффективности монотерапии метотрексатом.
Олокизумаб внесён в список препаратов упреждающей противовоспалительной терапии COVID-19 у взрослых пациентов.*
* См. подробнее Версия 19 (27.05.2025) — Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19) — Минздрав России.
Смотрите также код МКБ 10: U07.1 КОВИД-19 (COVID-19), вирус идентифицирован
Противопоказания
С осторожностью
- Серьёзные или оппортунистические инфекции в анамнезе; сопутствующие заболевания и состояния, являющиеся факторами риска развития инфекций (сахарный диабет, почечная недостаточность, приём иммуносупрессивных препаратов, пожилой возраст и др.).
- контактирование с больными туберкулёзом. Перед применением олокизумаба у таких пациентов следует оценить соотношение риска и пользы применения препарата.
- дивертикулит или перфорации кишечника в анамнезе и другие факторы риска перфорации кишечника.
- нарушения функции печени и печёночная недостаточность.
Беременность и грудное вскармливание
Перед назначением олокизумаба женщинам детородного возраста следует выполнить тест на беременность. Лечащий врач должен подробно разъяснить риски применения олокизумаба во время беременности и проинструктировать пациентку, способную к деторождению, о необходимости использования высокоэффективных методов контрацепции и выполнения регулярных тестов на беременность во время лечения и в течение по крайней мере 6 месяцев после получения последней дозы олокизумаба. В случае, если пациентка, получающая олокизумаб, забеременеет, она должна немедленно прекратить применение препарата и обратиться к врачу.
Беременность
Категория действия на плод по FDA — N.Адекватных и хорошо контролируемых исследований о возможности применения олокизумаба у беременных женщин не проведено. В связи с тем, что олокизумаб показан к применению в комбинации с метотрексатом, имеющим хорошо известное тератогенное действие, применение олокизумаба при беременности не рекомендуется.
В исследованиях на животных обнаружена репродуктивная токсичность. Предполагается, что ИЛ-6 играет важную роль в раскрытии шейки матки и, возможно, в рождении плаценты.
Таким образом, применение олокизумаба может нарушать родовую деятельность.
Лактация
Проникновение олокизумаба в грудное молоко не изучалось. Клинические данные о риске для ребёнка, находящегося на грудном вскармливании, отсутствуют. Так как олокизумаб показан к применению в комбинации с метотрексатом, который секретируется в грудное молоко, рекомендуется прекратить грудное вскармливание при назначении препарата.
Фертильность
Клинические данные о влиянии олокизумаба на фертильность у человека отсутствуют.
В исследованиях на животных отрицательного воздействия олокизумаба на фертильность самцов и самок яванских макак не обнаружено.
Способ применения и дозы
Подкожно.
Побочные действия
Безопасность применения препарата оценивалась в двойном слепом рандомизированном клиническом исследовании CREDO1. Всего в исследовании участвовало 428 пациентов со среднетяжёлым и тяжёлым ревматоидным артритом с недостаточным контролем на терапии метотрексатом. 142 пациента получали олокизумаб в дозе 64 мг один раз каждые 2 недели (к2н), 143 пациента получали олокизумаб 64 мг один раз каждые 4 недели (к4н), 143 пациента получали плацебо. Все пациенты находились на фоновой терапии метотрексатом.
Наиболее часто встречающимися нежелательными реакциями были лейкопения, нейтропения, повышение уровня печёночных трансаминаз.
Перечень нежелательных реакций приведён в соответствии с системно-органными классами (СОК) MedDRA. В пределах каждого класса нежелательные реакции распределены по категориям частоты встречаемости: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000), очень редко (<1/10 000) и частота неизвестна.
| Класс частоты | |||
|---|---|---|---|
| Перечень СОК | Очень часто | Часто | Нечасто |
| Инфекции и паразитарные заболевания | бронхит | лёгочный туберкулёз, кандидоз кожи, вульвовагинальный кандидоз, отрубевидный лишай, подкожный абсцесс, рожистое воспаление, сепсис. вызванный стафилококковой инфекцией, синдром токсического шока | Нарушения со стороны крови и лимфатической системы | лейкопения, нейтропения | эозинофилия |
| Нарушения метаболизма и питания | гиперхолестеринемия | ||
| Нарушения со стороны печени и желчевыводящих путей | повышение уровня ACT, повышение уровня АЛТ | повышение уровня ГГТ | |
| Нарушения со стороны кожи и подкожных тканей | зуд, сыпь | изменение цвета пота, дерматит, экхимоз, зудящая сыпь | |
| Общие нарушения и реакции в месте введения | боль в месте инъекции, эритема | ||
| Лабораторные и инструментальные данные | позитивный тест на микобактерию туберкулёза | ||
Перфорации дивертикула
Несмотря на то, что у пациентов в исследовании CREDO1 не было выявлено нежелательных явлений со стороны желудочно-кишечного тракта (ЖКТ), связанных с применением олокизумаба, в продолжающихся клинических исследованиях, включающих в общей сложности более 2000 пациентов с ревматоидным артритом, были зарегистрированы случаи перфорации дивертикула, связанные с применением олокизумаба. Частота данной нежелательной реакции неизвестна. В связи с тем. что риск перфорации желудочно-кишечного тракта характерен для ингибиторов ИЛ-6, следует соблюдать осторожность при применении препарата у пациентов с факторами риска перфорации ЖКТ.
Реакции гиперчувствительности
В исследовании CREDO1 наблюдалось дозозависимое увеличение реакций гиперчувствительности в группах пациентов, получавших олокизумаб: доля пациентов, у которых в ходе лечения возникло хотя бы одно нежелательное явление, относящееся к реакциям гиперчувствительности, включая: зуд, сыпь, аллергический дерматит, повышение уровня эозинофилов в крови, составила 4,2 % в группе, получавшей олокизумаб к4н, 7,0 % в группе, получавшей олокизумаб к2н и 2,1 % в группе плацебо.
В продолжающихся клинических исследованиях был зарегистрирован случай анафилактической реакции на введение олокизумаба (частота неизвестна).
Инфекции
В исследовании CREDO1 инфекции встречались с приблизительно одинаковой частотой во всех терапевтических группах: 14,1 % в группе, получавшей олокизумаб 64 мг к4н, 15,4 % в группе, получавшей олокизумаб 64 мг к2н и 16,2 % в группе плацебо.
В группе пациентов, получавших олокизумаб 64 мг к2н. чаще развивались связанные с инфекциями серьёзные нежелательные явления (2,8 %) по сравнению с группой пациентов, получавших олокизумаб 64 мг к4н (0 %) и плацебо (1,4 %).
В группах пациентов, получавших олокизумаб, были зарегистрированы следующие случаи серьёзных инфекций, не встречавшихся в группе плацебо: подкожный абсцесс (2), лёгочный туберкулёз (1), сепсис, вызванный стафилококковой инфекцией (1), и синдром токсического шока (1).
Повышение уровня печёночных трансаминаз
В исследовании CREDO1 частота повышения АЛТ, расценённого исследователями как нежелательное явление, составляла 23,2 % в группе, получавшей олокизумаб 64 мг к4н, 17,5 % в группе, получавшей олокизумаб 64 мг к2н и 17,7 % в группе плацебо. Частота повышения ACT, расцененного исследователями как нежелательное явление, составляла 15,5 % в группе, получавшей олокизумаб к4н, 11,2 % группе, получавшей олокизумаб к2н и 7,0 % в группе плацебо.
В целом в течение периода терапии наблюдались колебания индивидуальных уровней АЛТ. Всего подъем уровня АЛТ выше верхней границы нормы (1 × ВГН) отмечался хотя бы один раз за период лечения (24 недели) приблизительно у 50 % пациентов, получавших олокизумаб и у 27 % пациентов, получавших плацебо (Таблица 4). Ни у кого из пациентов не отмечалось одновременного повышения АЛТ и ACT > З × ВГН с повышением билирубина > 2 × ВГН.
| Уровень АЛТ | Доля пациентов | |||||
|---|---|---|---|---|---|---|
| Исходный уровень | За период лечения* | |||||
| ОКЗ 64 мг к4н | ОКЗ 64 мг к2н | Плацебо | ОКЗ 64 мг к4н | ОКЗ 64 мг к2н | Плацебо | |
| >1 × ВГН <З × ВГН | 9,9 % | 8,4 % | 9,9 % | 52,9 % | 47,5 % | 27,0 % |
| >З × ВГН <5 × ВГН | 0 | 0 | 0 | 5,7 % | 6,4 % | 3,5 % |
| >5 × ВГН | 0 | 0,7 % | 0 | 5,7 % | 2,8 % | 1,4 % |
* учитывалось наибольшее значение АЛТ у каждого пациента за 24-недельный период лечения ВГН — верхняя граница нормы; ОКЗ – олокизумаб
Гиперлипидемия
В исследовании CREDO1 повышение уровня липидов крови на фоне лечения, расцененное исследователями как нежелательное явление, наблюдалось у 8,5 % пациентов в группе, получавшей олокизумаб 64 мг к4н, 8,4 % пациентов в группе, получавшей олокизумаб 64 мг к2н и 2,8 % пациентов в группе плацебо.
В среднем уровни общего холестерина, ЛПНП и ЛПВП возрастали в группах пациентов, получавших олокизумаб, в течение первых 4 недель терапии. Затем в группе, получавшей олокизумаб 64 мг к2н, средние уровни липидов снижались и к концу периода лечения возвращались к значениям в группе плацебо, тогда как у пациентов, получавших олокизумаб 64 мг к4н, высокие средние уровни липидов в крови сохранялись до конца периода лечения.
Нейтропения
В исследовании CREDO1 среднее абсолютное число нейтрофилов через 12 недель терапии снизилось в группах, получавших олокизумаб, по сравнению с плацебо и затем оставалось стабильным до конца периода лечения (Таблица 5).
| Длительность лечения | Препарат и доза | ||
|---|---|---|---|
| ОКЗ 64 мг к4н | ОКЗ 64 мг к2н | Плацебо | |
| 0 | 5,9 × 109 /л | 5,2 × 109 /л | 5,7 × 109 /л |
| 12 недель | 3,9 × 109 /л | 3,4 × 109 /л | 5,6 × 109 /л |
| 24 недели | 3,7 × 109 /л | 3,2 × 109 /л | 5,З × 109/л |
Соответственно доля пациентов, у которых хотя бы один раз в ходе лечения регистрировалось такое нежелательное явление, как нейтропения, составляла 11,2 % пациентов в группе, получавшей олокизумаб 64 мг к4н, 7,7 % пациентов в группе, получавшей олокизумаб 64 мг к2н и 3,5 % пациентов в группе плацебо.
Передозировка
В клинических исследованиях случаев передозировки не наблюдалось. Однако дополнительные клинические данные показывают, что общий профиль безопасности олокизумаба у пациентов, получавших препарат в дозе 240 мг к2н (480 мг в месяц) в течение 12 недель сопоставим с общим профилем безопасности у пациентов, получавших препарат в рекомендованной дозе.
Дети
Данные о передозировке у детей отсутствуют.
Взаимодействие
Одновременное применение с метотрексатом не влияло на экспозицию олокизумаба. Не ожидается также влияния олокизумаба на экспозицию метотрексата при их одновременном применении, клинические данные отсутствуют. Во всех клинических исследованиях у пациентов с ревматоидным артритом олокизумаб применялся совместно с метотрексатом.
Специальные клинические исследования лекарственных взаимодействий олокизумаба не проводились. По результатам клинического исследования CREDO1 не сообщалось о случаях клинически значимых лекарственных взаимодействий олокизумаба с другими препаратами.
В исследовании in vitro на криоконсервированных гепатоцитах человека олокизумаб обращал ингибиторный эффект ИЛ-6 на активность CYP1A1/2, 2B6, 2C9, ЗA4/5 и 2C19. а также на активность NTCP. Таким образом, следует принимать во внимание, что у пациентов с активным ревматоидным артритом может потребоваться коррекция доз препаратов, метаболизируемых данными изоформами CYP, после начала применения олокизумаба.
Концентрация следующих препаратов может снизиться при совместном применении с олокизумабом (список не является исчерпывающим): статины (симвастатин, ловастатин, аторвастатин); оральные контрацептивы; блокаторы кальциевых каналов; глюкокортикоиды (дексаметазон, метилпреднизолон); варфарин; хинидин; теофиллин; тизанидин; фенитоин; пимозид; циклоспорин; сиролимус; такролимус; бензодиазепины (например, диазепам, алпразолам, триазолам, мидазолам, бромазепам).
Меры предосторожности
Назначать лечение олокизумабом и наблюдать за ходом лечения разрешается врачам, имеющим опыт в диагностике и лечении ревматоидного артрита.
Анафилактические или анафилактоидные реакции: введение препаратов, содержащих белки, может быть связано с возникновением иммунологических/аллергических или неиммунологических реакций повышенной чувствительности к препарату, которые могут быть тяжелыми. Эти реакции могут возникать в виде острой инфузионной реакции, аллергической реакции или реакции гиперчувствительности замедленного типа. Таким образом, первое введение олокизумаба следует выполнять в медицинском учреждении, где имеются лекарственные средства и оборудование для купирования анафилактических и анафилактоидных реакций. В клинических исследованиях был отмечен случай серьёзной анафилактической реакции на введение олокизумаба.
Инфекции: для пациентов, получающих иммуносупрессивные препараты, включая блокаторы сигнального пути ИЛ-6, характерна повышенная частота развития инфекций.
Применение олокизумаба связано с повышенным риском развития или активизациией инфекций. Не следует начинать терапию олокизумабом пациентам с инфекциями в активной фазе. Следует с осторожностью проводить лечение олокизумабом пациентов, имеющих факторы риска развития инфекций. При развитии серьёзных инфекций терапию олокизумабом следует прекратить. Пациентов следует проинструктировать о возможных признаках и симптомах развития инфекции, требующих немедленного обращения к врачу.
Туберкулёзная инфекция: перед началом терапии олокизумабом необходимо провести обследование пациента на наличие латентной формы туберкулёзной инфекции.
Пациентам с выявленной латентной формой туберкулёзной инфекции перед началом терапии олокизумабом следует провести стандартный курс противотуберкулёзной терапии.
Следует с осторожностью назначать олокизумаб пациентам, находящимся в тесном контакте (совместное проживание или нахождение в других замкнутых пространствах, например, на рабочем месте, на общественных собраниях или в здании на протяжении длительных периодов в течение дня) с лицом, страдающим активным туберкулёзом. Перед применением олокизумаба у таких пациентов следует тщательно оценить соотношение риска и пользы применения препарата.
Риск перфорации желудочно-кишечного тракта: при применении ингибиторов сигнального пути ИЛ-6 известны случаи перфорации желудочно-кишечного тракта, в основном на фоне дивертикулита. Следует соблюдать осторожность при применении олокизумаба у пациентов с дивертикулитом или перфорацией кишечника в анамнезе и другими факторами риска перфорации кишечника. При появлении желудочно-кишечных симптомов, таких как абдоминальная боль, на фоне лечения олокизумабом, следует незамедлительно провести обследование пациента.
Почечная недостаточность: пациентов с почечной недостаточностью не включали в клиническое исследование препарата Артлегиа. В связи с отсутствием данных следует соблюдать осторожность при применении олокизумаба у пациентов с нарушениями функции почек.
Нарушения функции печени: применение олокизумаба так же, как и других ингибиторов ИЛ-6, связано с повышением уровня АЛТ, ACT и гамма-глутамил грансферазы. Пациентов с уровнем АЛТ или ACT >1,5 × ВГН не включали в клиническое исследование. Следует соблюдать осторожность при применении олокизумаба у пациентов с нарушениями функции печени и печёночной недостаточностью.
Мониторинг лабораторных показателей крови: в клинических исследованиях было зарегистрировано снижение абсолютного числа нейтрофилов и лейкоцитов на фоне лечения олокизумабом и другими ингибиторами ИЛ-6. По данным применения других ингибиторов ИЛ-6, нейтропения на фоне лечения не приводила к повышению частоты инфекций.
Пациентов с уровнем лейкоцитов <3,5 × 109/л, уровнем нейтрофилов <2000 × 106/л (<2000/мм3) не включали в клиническое исследование.
Вакцинация: безопасность иммунизации живыми вакцинами на фоне применения ингибиторов ИЛ-6, в том числе олокизумаба, не установлена. Пациентов с необходимостью вакцинации живыми вакцинами не включали в клиническое исследование.
Злокачественные новообразования: данные о безопасности применения олокизумаба у пациентов со злокачественными новообразованиями отсутствуют, риск развития злокачественных опухолей на фоне терапии олокизумабом не известен.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Хотя на данный момент при терапии олокизумабом нежелательные реакции, связанные с головокружением, не отмечались, головокружение часто наблюдалось при терапии другими ингибиторами ИЛ-6. Пациентам, испытывающим головокружение во время терапии олокизумабом, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор. пока головокружение не прекратится.
Синонимы
Классификация
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Олокизумаб:
