Пегасис®
Лекарственная форма
раствор для подкожного введения
Состав
1 шприц-тюбик/автоинжектор ПроКлик™ (0,5 мл) с раствором для подкожного введения содержит:
активное вещество: пэгинтерферон альфа-2а (40 кДа) — 135 мкг или 180 мкг;
вспомогательные вещества: натрия хлорид — 4,0 мг, бензиловый спирт — 5,0 мг, натрия ацетата тригидрат — 1,3085 мг, уксусная кислота ледяная — 0,0231 мг, полисорбат 80 — 0,025 мг, натрия ацетата раствор 10 % до pH 6,0, уксусная кислота 10 % — до pH 6,0, вода для инъекций — до 0,5 мл.
Описание
Прозрачный раствор от бесцветного до светло-жёлтого цвета.
Фармакологическое действие
Фармакодинамика
Пегилированный интерферон альфа-2а представляет собой конъюгат ПЭГ (бис- монометоксиполиэтиленгликоля) с интерфероном альфа-2а. Интерферон альфа-2а производится биосинтетическим методом по технологии рекомбинантной ДНК и является производным продуктом клонированного гена человеческого лейкоцитарного интерферона, введённого и экспрессирующегося в клетках E. coli.
Интерферон альфа-2а конъюгирован с бис-монометоксиполиэтиленгликолем со степенью замещения одного моля полимера одним молем протеина.
Структура ПЭГ (бис-монометоксиполиэтиленгликоля) непосредственно влияет на клинико-фармакологические характеристики препарата Пегасис®. В частности, размер и степень разветвлённости ПЭГ с молекулярной массой 40 кДа определяет показатели всасывания, распределения и выведения пэгинтерферона альфа-2а.
Активность препарата Пегасис® не следует сравнивать с другими пегилированными или непегилированными белками того же терапевтического класса.
Так же как интерферон альфа-2а, Пегасис® обладает противовирусной и анти пролиферативной активностью in vitro.
У пациентов с хроническим гепатитом С (ХГС) снижение уровня РНК вируса гепатита С (ВГС) при ответе на терапию препаратом Пегасис® в дозе 180 мкг происходит в 2 фазы. Первая фаза отмечается через 24–36 ч после первой инъекции препарата, вторая фаза наступает в течение следующих 4–16 недель у пациентов с устойчивым вирусологическим ответом. Рибавирин не оказывает значительного воздействия на кинетику вируса в течение первых 4–6 недель у тех пациентов, которые получают комбинированную терапию рибавирином и пегилированным интерфероном альфа-2а или интерфероном альфа.
Фармакокинетика
Всасывание
После однократного подкожного введения 180 мкг пэгинтерферона альфа-2а здоровым лицам препарат определяется в сыворотке крови через 3–6 ч. Через 24 ч концентрация в сыворотке крови достигает 80 % от максимальной. Всасывание пэгинтерферона альфа-2а продолжительное, максимальные концентрации в сыворотке отмечаются через 72–96 ч после введения препарата. Абсолютная биодоступность пэгинтерферона альфа-2а 84 % и аналогична таковой у интерферона альфа-2а.
Распределение
Пэгинтерферон альфа-2а обнаруживается преимущественно в крови и внеклеточной жидкости. Объём распределения в равновесном состоянии (Vss) после внутривенного введения составляет 6–14 л. По данным масс-спектрометрии, распределения по тканям и ауторадиолюминографии, полученным в исследованиях на крысах, пэгинтерферон альфа-2а обнаруживается в высоких концентрациях в крови и также в печени, почках и костном мозге.
Метаболизм
Особенности метаболизма пэгинтерферона альфа-2а изучены не полностью; однако исследования на крысах свидетельствуют, что радиомаркированный препарат выводится преимущественно почками.
Выведение
Системный клиренс пэгинтерферона альфа-2а у человека в 100 раз ниже, чем аналогичный показатель для интерферона альфа-2а. После внутривенного введения терминальный период полувыведения у здоровых добровольцев 60–80 ч по сравнению с 3–4 ч для обычного интерферона. После подкожного введения терминальный период полувыведения около 160 ч (от 84 до 353 ч). Терминальный период полувыведения после подкожного введения может показывать не выведение, а продолжительность всасывания пэгинтерферона альфа-2а.
При введении пэгинтерферона альфа-2а 1 раз в неделю наблюдается дозозависимое увеличение системного воздействия у здоровых добровольцев и у пациентов с хроническим гепатитом B (ХГВ) или C. У больных хроническим гепатитом B и C через 6–8 недель терапии пэгинтерфероном альфа-2а один раз в неделю достигается равновесная концентрация, которая в 2–3 раза выше, чем после однократного введения. После 8-й недели лечения при введении препарата один раз в неделю дальнейшей кумуляции не происходит. Через 48 недель терапии соотношение максимальной и минимальной концентрации составляет 1,5–2,0. Концентрации пэгинтерферона альфа-2а в сыворотке поддерживаются в течение всей недели (168 ч) после введения (см. рис. 1).
- монотерапия, 48 недель
- комбинация с рибавирином, 48 недель
Ось X: Время (дни) после введения препарата Пегасис® 3 раз в неделю
Ось Y: Средняя равновесная концентрация (нг/мл)
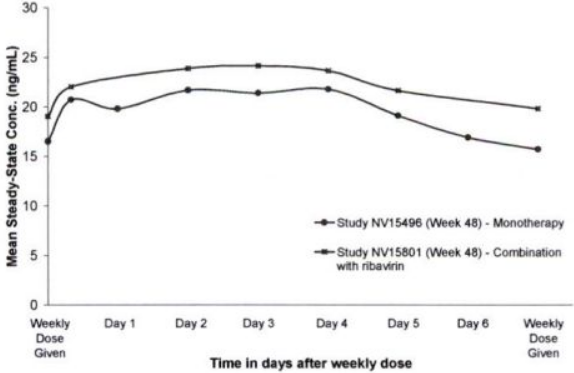
Рисунок 1. Средние равновесные концентрации пэгинтерферона альфа-2 а у больных хроническим гепатитом C, получавших монотерапию препаратом Пегасис® 180 мкг/неделю при комбинацию Пегасис® / рибавирин.
Фармакокинетика в особых популяциях больных
Больные с нарушением функции почек
Нарушение функции почек ассоциируется с незначительным снижением клиренса (CL/F) и увеличенном периода полувыведения.
У пациентов с клиренсом креатинина 20–40 мл/мин отмечается снижение клиренса пэгинтерферона альфа-2а на 25 % по сравнению с пациентами без нарушения функции почек. У пациентов с терминальной стадией хронической почечной недостаточности (ХИН), получающих сеансы гемодиализа, отмечается снижение клиренса пэгинтерферона альфа-2а на 25–45 %. Фармакокинетика препарата была сходной при назначении препарата Пегасис® в дозе 135 мкг больным с терминальной стадией ХПН и при назначении 180 мкг пациентам без нарушения функции почек.
Пол
Фармакокинетические показатели препарата Пегасис® у женщин и мужчин после однократной подкожной инъекции сопоставимы.
Пожилой возраст
У пациентов старше 62 лет всасывание препарата Пегасис® после однократной подкожной инъекции 180 мкг было замедленным (однако устойчивым) по сравнению с молодыми здоровыми добровольцами (tmax 115 часов против 82 часов). Площадь под кривой «концентрация–время» (AUC) слегка увеличивается у пациентов старше 62 лет (1663 против 1295 нг × ч/мл), но максимальные концетрации у пациентов моложе и старше 62 лет одинаковы (9,1 и 10,3 нг/мл, соответственно). На основании данных экспозиции, фармакодинамического ответа и переносимости снижения начальной дозы препарата у таких пациентов не требуется.
Больные с циррозом и без цирроза
Фармакокинетика препарата Пегасис® у здоровых лиц и больных гепатитом B или C одинакова. У больных с компенсированным циррозом фармакокинетические характеристики такие же, как у больных без цирроза (класс AА по шкале Чайлд-Пью).
Место инъекции
Подкожное введение препарата Пегасис® должно быть ограничено областью передней брюшной стенки и бёдер, поскольку степень всасывания, на основании AUC, была на 20–30 % выше при инъекции именно в эти области. Концентрация препарата была ниже в исследованиях, в которых Пегасис® вводили подкожно в области плеча.
Показания
Хронический гепатит C
Хронический гепатит C у взрослых пациентов с компенсированным заболеванием печени (в том числе с или без цирроза печени, с клинически стабильной ко-инфекцией ВИЧ) в комбинации с другими лекарственными препаратами для лечения хронического гепатита C.
Хронический гепатит B
Хронический гепатит B HBеAg-позитивный или HBeAg-негативный у взрослых пациентов с компенсированным поражением печени и признаками вирусной репликации, повышенной активностью АЛТ и гистологически подтверждённым воспалением печени и/или фиброзом.
Противопоказания
- Повышенная чувствительность к интерферонам альфа, к генно-инженерным препаратам, полученным с помощью E. сoli, к полиэтиленгликолю или любому другому компоненту препарата.
- Аутоиммунный гепатит.
- Тяжёлая печёночная недостаточность или декомпенсированный цирроз печени.
- Цирроз с суммой баллов ≥6 но шкале Чайлд-Пью у пациентов с ко-инфекцией ВИЧ-ХГС при условии, если повышение данного показателя не связано с непрямой гипербилирубинемией вследствие приёма препаратов, таких как атазанавир и индинавир.
- Тяжёлые сердечно-сосудистые заболевания в фазе декомпенсации, в том числе с нестабильным плохо контролируемым течением в предшествующие 6 месяцев.
- Одновременный приём с телбивудином.
- Детский возраст до 18 лет (для данной лекарственной формы в указанных дозировках).
- Беременность.
- Период кормления грудью.
Беременность и лактация
Влияние препарата Пегасис® на фертильность не изучалось. При назначении пэгинтерферона альфа-2а, как и других интерферонов альфа, отмечено удлинение менструального цикла со снижением и более поздним наступлением максимальных концентраций 17β- эстрадиола и прогестерона у животных. После отмены препарата наблюдалась нормализация менструального цикла.
Влияние пэгинтерферона альфа-2а на фертильность мужчин не изучалось. Однако введение интерферона альфа-2а в течение 5 месяцев не влияло на фертильность у животных.
Тератогенные эффекты препарата Пегасис® не изучались. Применение интерферона альфа-2а приводило к достоверному увеличению числа спонтанных абортов у макак-резус. У потомства, рождённого в срок, никаких тератогенных аффектов не отмечалось. Однако при лечении препаратом Пегасис®, как и другими интерферонами альфа, женщинам детородного возраста следует применять эффективные методы контрацепции.
Пегасис® не следует назначать при беременности.
Неизвестно, выводится ли Пегасис® или компоненты препарата с грудным молоком. Для исключения нежелательного воздействия препарата Пегасис® или рибавирина на ребёнка во время кормления грудью следует прекратить либо грудное вскармливание, либо терапию с учётом потенциальных преимуществ терапии для матери.
У рибавирина в исследованиях на животных выявлены выраженные тератогенные эффекты и способность вызывать смерть плода. Рибавирин противопоказан беременным и мужчинам, партнёрши которых беременны.
Терапию рибавирином не следует назначать до получения отрицательного теста на беременность, проведённого непосредственно перед предполагаемым началом терапии. Женщины, способные к деторождению, или мужчины, партнёрши которых способны к деторождению, должны быть проинформированы о тератогенных эффектах рибавирина и необходимости проведения эффективной контрацепции (не менее 2 способов) во время лечения и в течение 6 месяцев после окончания терапии (см. инструкцию но медицинскому применению рибавирина).
Способ применения и дозы
Для лиц старше 18 лет.
Лечение препаратом Пегасис® должно проводиться под наблюдением квалифицированного врача, имеющего опыт проведения терапии у пациентов с хроническим гепатитом B и C.
В случае использования препарата Пегасис® в комбинации с другими лекарственными препаратами следует ознакомиться с инструкцией по медицинскому применению данных препаратов.
Монотерапия препаратом Пегасис® показана только в случае наличия противопоказаний к другим лекарственными препаратам для лечения хронического гепатита C.
Стандартный режим дозирования
Препарат вводят подкожно (п/к) в область передней брюшной стенки или бедра 1 раз в неделю.
Перед введением препарат необходимо осматривать на предмет отсутствия посторонних примесей и изменения цвета.
Больных следует тщательно инструктировать о важности правильного хранения и уничтожения использованных материалов и предостерегать от повторного использования любых игл и шприцев.
Хронический гепатит B
При HBеAg-позитивном и HBeAg-негативном хроническом гепатите B — 1 раз в неделю в течение 48 недель в разовой дозе 180 мкг.
Хронический гепатит C
Пациенты, ранее не получавшие лечение
Рекомендованная доза препарата Пегасис® составляет 180 мкг 1 раз в неделю в комбинации с рибавирином (перорально) или в виде монотерапии.
Режим дозирования рибавирина, который следует использовать в комбинации с препаратом Пегасис®, приведён в таблице 1. Рибавирин следует принимать во время еды. Продолжительность терапии — двойная терапия (Пегасис® и рибавирин)
При комбинированной с рибавирином терапии продолжительность терапии и доза рибавирина зависят от генотипа вируса (см. таблицу 1).
| Генотип | Доза препарата Пегасис® | Доза рибавирина | Длительность |
|---|---|---|---|
| Генотип 1 с низкой вирусной нагрузкой и быстрым вирусологическим ответом * | 180 мкг | Все <75 кг = 1,000 мг | 24 или 48 недель |
| Вес ≥75 кг = 1,200 мг | |||
| Генотип 1 с высокой вирусной нагрузкой и быстрым вирусологическим ответом* | 180 мкг | Вес <75 кг = 1,000 мг | 48 недель |
| Вес ≥75 кг = 1,200 мг | |||
| Генотип 4 с быстрым вирусологическим ответом* | 180 мкг | Все <75 кг = 1,000 мг | 24 или 48 недель |
| Вес ≥75 кг = 1,200 мг | |||
| Генотип 1 или 4 без быстрого вирусологического ответа* | 180 мкг | Вес <75 кг = 1,000 мг | 48 недель |
| Вес ≥75 кг = 1,200 мг | |||
| Генотип 2 или 3 без быстрого вирусологического ответа** | 180 мкг | 800 мг | 24 недели |
| Генотип 2 или 3 с низкой вирусной нагрузкой и быстрым вирусологическим ответом** | 180 мкг | 800 мг | 16 или 24 недели |
| Генотип 2 или 3 с высокой вирусной нагрузкой и быстрым вирусологическим ответом** | 180 мкг | 800 мг | 24 недели |
*Быстрый вирусологическим ответ (РНК ВГС не определяется) на 4 и 24 неделе лечения.
** Быстрым вирусологическим ответ (результат определения РНК ВГС отрицательным) к 4 неделе лечения.
Низкая вирусная нагрузка = ≤800,000 МЕ/мл.
Высокая вирусная нагрузка = >800,000 МЕ/мл.
Продолжительность терапии у пациентов с генотипом 1, у которых на 4 неделе лечения определяется РНК ВГС, должна составлять 48 недель, независимо от исходной вирусной нагрузки.
Продолжительность терапии в течение 24 недель можно рассматривать у пациентов:
- с генотипом 1 и исходно низкой вирусной нагрузкой (≤800,000 МЕ/мл);
- с генотипом 4, у которых на 4 неделе результат определения РНК ВГС отрицательный и остаётся отрицательным на 24 неделе.
Однако общая продолжительность терапии в течение 24 недель может быть ассоциирована с большим риском рецидива, чем 48-недельная продолжительность лечения. При решении вопроса о продолжительности терапии у таких пациентов следует учитывать переносимость комбинированной терапии и дополнительные прогностические факторы, такие как степень фиброза. С ещё большей осторожностью следует подходить к вопросу о сокращении продолжительности терапии у пациентов с генотипом 1 и исходно высокой вирусной нагрузкой (>800,000 МЕ/мл), у которых на 4 неделе результат определения РНК ВГС отрицательный и остаётся отрицательным на 24 неделе, поскольку ограниченные доступные данные предполагают, что сокращение продолжительности терапии может крайне негативно повлиять на устойчивый вирусологический ответ. У пациентов с генотипом 2 или 3 и определяющейся РНК ВГС на 4 неделе лечения, независимо от исходной вирусной нагрузки, продолжительность терапии должна составлять 24 недели. Возможно сокращение терапии до 16 недель в отдельных группах пациентов с генотипом 2 или 3, низкой вирусной нагрузкой (исходно ≤800,000 МГ/мл), не определяющейся РНК ВГС к 4 неделе и остающейся отрицательной до 16 недели. При 16-недельной продолжительности терапии возможно увеличение риска рецидива по сравнению с 24-недельной терапией.
При решении вопроса о продолжительности терапии у таких пациентов следует учитывать переносимость комбинированной терапии и дополнительные клинические и прогностические факторы, такие как степень фиброза. С ещё большей осторожностью следует подходить к вопросу о сокращении продолжительности терапии у пациентов с генотипом 2 или 3 и исходно высокой вирусной нагрузкой (>800,000 МЕ/мл), у которых к 4 неделе результат определения РНК ВГС отрицательный, поскольку ограниченные данные предполагают, что сокращение продолжительности терапии может крайне негативно повлиять на устойчивость вирусологического ответа.
Клинические данные по пациентам с генотипом 5 и 6 ограничены, рекомендуется комбинированная терапия препаратом Пегасис® и рибавирином (1000/1200 мг) в течение 48 недель.
Рекомендуемая длительность монотерапии препаратом Пегасис® составляет 48 недель.
Пациенты, ранее получавшие лечение
Рекомендованная доза препарата Пегасис® в комбинации с рибавирином составляет 180 мкг 1 раз в неделю. Доза рибавирина составляет 1,000 мг в сутки (вес <75 кг) и 1,200 мг (вес ≥75 кг).
При обнаружении вируса на 12 неделе лечения терапию следует прекратить. Рекомендуемая общая продолжительность терапии составляет 48 недель. При решении вопроса о лечении пациентов с генотипом 1, не ответивших на предшествующее лечение пегилированным интерфероном и рибавирином, рекомендуемая общая продолжительность терапии должна составлять 72 недели.
Ко-инфекция ВИЧ-ХГС
180 мкг 1 раз в неделю в качестве монотерапии или в комбинации с рибавирином (800 мг) в течение 48 недель, независимо от генотипа. Безопасность и эффективность комбинированной терапии с рибавирином в дозе более 800 мг и продолжительностью менее 48 недель изучена недостаточно.
Продолжительность терапии при использовании препарата Пегасис® в комбинации с другими лекарственными препаратами
Следует также ознакомиться с инструкциями по медицинскому применению препаратов, используемых в комбинации с препаратом Пегасис®.
Прогнозирование эффективности лечения — двойная терапия (Пегасис® и рибавирин)
Пациенты, ранее не получавшие лечение
Определение раннего вирусологического ответа (снижение вирусной нагрузки ниже порога определения или не менее чем на 2log10) на 12 неделе терапии может прогнозировать достижение устойчивого вирусологического ответа (см. таблицу 2). Прогностическая ценность отсутствия устойчивого вирусологического ответа (УВО) при монотерапии препаратом Пегасис® составляет 98 %. Сходная прогностическая ценность отсутствия УВО обнаружена у пациентов с ко-инфекцией ВИЧ-ХГС, получавших монотерапию препаратом Пегасис® или комбинированную терапию препаратом Пегасис® и рибавирином (100 % и 98 % соответственно). При ко-инфекции ВИЧ-ХГС прогностическая ценность УВО 45 % и 70% выявлена, соответственно, у пациентов с генотипами 1 и 2/3, получавших комбинированную терапию.
| Генотип | Отрицательный результат | Положительный результат | ||||
|---|---|---|---|---|---|---|
| Отсутствие ответа на 12 неделе | Отсутствие устойчивого ответа | Прогностическая ценность | Ответ на 12 неделе | Устойчивый ответ | Прогностическая ценность | |
Генотип 1 (n = 569) | 102 | 97 | 95 % | 467 | 271 | 58 % |
Генотип 2 и 3 (n = 96) | 3 | 3 | 100 % | 93 | 81 | 87 % |
Пациенты, ранее получавшие лечение
У пациентов, ранее не ответивших на лечение, при повторном лечении течение 48 или 72 недель было показано, что супрессия вируса на 12 неделе (РНК ВГС ниже 50 МЕ/мл) является прогностическим критерием УВО. Вероятность отсутствия УВО после 48 или 72 недель лечения в случае, если подавление вируса не было отмечено на 12 неделе, составила 96 % и 96 % соответственно. Вероятность достижения УВО после 48 или 72 недель лечения в случае, если супрессия вируса была отмечена на 12 неделе, составила 35 % и 57 % соответственно.
Указания по коррекции дозы в связи с побочным действием
Общие
Если коррекция дозы требуется из-за клинических или лабораторных реакций средней и тяжёлой степени тяжести, обычно достаточно снизить дозу препарата до 135 мкг. Однако в некоторых случаях требуется уменьшить дозу до 90 мкг или 45 мкг. После разрешения побочных реакций можно рассмотреть вопрос об увеличении дозы препарата, вплоть до первоначальной (см. «Особые указания» и «Побочное действие»).
Гематологические
Уменьшение дозы рекомендуется при снижении числа нейтрофилов менее 750 клеток/мкл. У больных с абсолютным числом нейтрофилов (АЧН) менее 500 клеток/мкл лечение следует прервать до тех пор, пока этот показатель не превысит 1000 клеток/мкл. Применение препарата Пегасис® следует возобновить в дозе 90 мкг под периодическим контролем числа нейтрофилов (периодичность контроля определяется врачом в каждом конкретном случае индивидуально).
Уменьшение дозы до 90 мкг рекомендуется при снижении числа тромбоцитов менее 50000 клеток/мкл. У больных с числом тромбоцитов менее 25000 клеток/мкл препарат нужно отменить. Рекомендации по лечению анемии, возникшей во время терапии:
1) Доза рибавирина снижается до 600 мг/сут (200 мг утром и 400 мг вечером) в одной из следующих ситуаций:
- Нb снижается менее 10 г/дл, но остаётся более 8,5 г/дл у пациентов без сопутствующей сердечно-сосудистой патологии;
- Нb снижается на 2 г/дл или более в течение любых 4 недель терапии у пациентов со стабильным сердечно-сосудистым заболеванием.
Не рекомендуется увеличивать дозу рибавирина до первоначальной.
2) Приём рибавирина должен быть прекращён в одной из следующих ситуаций:
- Нb снижается менее 8,5 г/дл у пациентов без сопутствующей сердечно-сосудистой патологии;
- Нb остаётся менее 12 г/дл через 4 недели, несмотря на снижение дозы, у пациентов со стабильным сердечно-сосудистым заболеванием.
После прекращения приёма рибавирина и разрешения побочного действия возможно возобновить его приём в дозе 600 мг/сутки с последующим повышением до 800 мг/сутки по усмотрению врача. Не рекомендуется увеличивать дозу рибавирина до первоначальной (1000 мг или 1200 мг).
При непереносимости рибавирина следует продолжить монотерапию препаратом Пегасис®.
| Снижение дозы рибавирина до 600 мг | Приостановление приёма рибавирина | Уменьшение дозы препарата Пегасис® до135/90/45 мкг | Приостановление приёма препарата Пегасис® | Отмена комбинированного лечения | |
|---|---|---|---|---|---|
| Абсолютное число нейтрофилов | <750 клеток/мкл | <500 клеток/мкл | |||
| Число тромбоцитов | <50 000 клеток/мкл >25 000 клеток/мкл | <25 000 клеток/мкл | |||
Нb Отсутствие сердечно сосудистого заболевания | <10 г/дл и ≥8,5 г/дл | <8,5 г/дл | |||
Нb Стабильное сердечно сосудистое заболевание | снижение на ≥2 г/дл в течение любых 4 недель терапии | <12 г/дл, даже через 4 недели терапии в сниженной дозе |
Связанные с нарушением функции печени
У пациентов с хроническим гепатитом C характерны колебания в отклонениях от нормы результатов печёночных проб. Как и при терапии другими препаратами интерферона альфа, при терапии препаратом Пегасис® наблюдается повышение активности АЛТ выше показателя до лечения, в том числе и у пациентов с вирусологическим ответом.
В клинических исследованиях у 8 из 451 пациента с хроническим гепатитом C, получавших комбинированную терапию, наблюдалось изолированное повышение активности АЛТ (превышающее верхнюю границу нормы в ≥10 раз; или превышающее исходный уровень в ≥2 раза для пациентов с исходным уровнем активности АЛТ в 10 раз выше верхней границы нормы), которое исчезло без изменения дозы. При прогрессирующем повышении активности АЛТ по сравнению с показателями до лечения, дозу препарата Пегасис® нужно вначале уменьшить до 135 мкг. Если активность АЛТ, несмотря на снижение дозы, продолжает увеличиваться или сопровождается повышением концентрации билирубина или признаками декомпенсации печёночного процесса, препарат следует отменить.
У пациентов с хроническим гепатитом B возможно преходящее увеличение активности АЛТ, иногда превышающее верхнюю границу нормы в 10 раз, которое может свидетельствовать об иммунном клиренсе. Лечение обычно не следует начинать, если активность АЛТ превышает верхнюю границу нормы более чем в 10 раз. Продолжение терапии требует более частого контроля активности АЛТ. При снижении дозы или временной отмене препарата Пегасис® терапия может быть восстановлена после нормализации активности АЛТ.
Особые группы больных
Почечная недостаточность
Рекомендуется снижение дозы препарата Пегасис® до 135 мкг у пациентов с терминальной стадией почечной недостаточности. Независимо от начальной дозы и степени тяжести почечной недостаточности таких пациентов необходимо тщательно наблюдать и снижать дозу в случае возникновения побочных реакций.
Печёночная недостаточность
У больных с компенсированным циррозом печени (класс A по Чайлд-Пью) Пегасис® эффективен и безопасен.
У больных с декомпенсированным циррозом (класс B/C по Чайлд-Пью или кровотечение из варикозно расширенных вен пищевода) применение препарата Пегасис® не изучалось (см. «Особые указания»).
Пожилой возраст
У больных пожилого возраста коррекция рекомендуемой дозы (180 мкг, один раз в неделю) не требуется.
Дети и подростки
Препарат Пегасис® не зарегистрирован для применения у лиц моложе 18 лет.
Раствор препарата Пегасис® противопоказан новорождённым и детям до 3 лет, поскольку содержит бензиловый спирт, способный вызывать у данной возрастной категории больных неврологические и другие осложнения, иногда фатальные.
Инструкция по использованию автоинжектора ПроКлик™
Устройство предназначено только для однократного использования и после этого подлежит утилизации.
Перед применением автоинжектора ПроКлик™ следует внимательно ознакомиться с инструкцией.
Не следует выполнять следующее:
- пытаться открыть или разобрать автоинжектор ПроКлик™;
- подвергать автоинжектор ПроКлик™ воздействию значительной силы или ударам;
- вводить препарат через одежду, закрывающую кожу; использовать повреждённый автоинжектор ПроКлик™;
- использовать автоинжектор ПроКлик™ при помутнении раствора, изменении цвета или наличии посторонних видимых частиц;
- встряхивать;
- снимать колпачок до полной готовности к введению препарата;
- повторно использовать автоинжектор ПроКлик™;
- манипулировать с защищающим иглу цилиндром до, в течение или после использования автоинжектора, поскольку этот компонент является устройством обеспечения безопасности.
Компоненты автоинжектора ПроКлик™
- Защитный колпачок.
- Контрольное окошко.
- Кнопка активации.
- Защищающий иглу цилиндр (см. рис. 2).
1. Осмотр автоинжектора ПроКлик™
Извлеките автоинжектор ПроКлик™ из холодильника. Осмотрите его, а также лекарственный препарат, находящийся в нем, через контрольное окошко. Не встряхивать!
При наличии пены вновь поместите автоинжектор ПроКлик™ в холодильник, и используйте его позже.
Автоинжектор ПроКлик™ следует утилизировать и использовать другой автоинжектор в следующих ситуациях:
- при помутнении раствора;
- при наличии в препарате посторонних видимых частиц;
- если раствор имеет цвет, отличный от указанного в разделе «Описание»;
- при повреждении любых частей автоинжектора ПроКлик™;
- после истечения срока годности (годен до...), указанного на картонной пачке, а также на этикетке автоинжектора ПроКлик™.
Не снимайте колпачок автоинжектора ПроКлик™ ранее Этапа 5.
2. Доведение автоинжектора ПроКлик™ до комнатной температуры
Оставьте автоинжектор ПроКлик™ при комнатной температуре в течение приблизительно 20 минут. Не следует согревать автоинжектор ПроКлик™ любым другим способом.
3. Обработка рук
Вымойте руки водой с мылом.
4. Выбор и подготовка места инъекции
Препарат можно вводить в живот или бедро (см. рис. 3). Не следует использовать для этого пупок и участки, которые могут подвергаться раздражению ремнём или поясом одежды.
Необходимо каждый раз вводить препарат в различные места. С целью минимизации дискомфорта во время инъекции можно осторожно постучать в месте предполагаемой инъекции.
Протрите намеченную область спиртовой салфеткой. Дайте коже высохнуть в течение 10 секунд. Не касайтесь данной области до выполнения инъекции.
5. Подготовка автоинжектора ПроКлик™
Крепко удерживая автоинжектор ПроКлик™ одной рукой, другой рукой снимите его защитный колпачок.
ПРИМЕЧАНИЕ: колпачок содержит подвижную металлическую трубку.
После удаления колпачка следует немедленно использовать автоинжектор ПроКлик™. В случае, если автоинжектор ПроКлик™ не был использован в течение 5 минут после снятия колпачка, он подлежит утилизации, и вместо него следует использовать новый автоинжектор ПроКлик™. Не надевать защитный колпачок после того, как сняли его.
6. Расположение автоинжектора Про Клик™ к месту предполагаемой инъекции
Двумя пальцами соберите кожу в складку в месте предполагаемой инъекции. Удобно удерживая автоинжектор ПроКлик™ другой рукой, плотно приложите защищающий иглу цилиндр к вершине кожной складки.
Расположите автоинжектор ПроКлик™ под прямым углом (90°) к точке введения.
ПРИМЕЧАНИЕ: не нажимать на кнопку активации.
Плотно прижимайте автоинжектор ПроКлик™ к коже до тех пор, пока защищающий иглу цилиндр полностью не уйдёт внутрь автоинжектора.
Только после этого автоинжектор ПроКлик™ активируется и становится готовым к выполнению инъекции (см. рис. 4).
7. Введение препарата
Крепко удерживая автоинжектор ПроКлик™ на месте, нажмите кнопку активации большим пальцем и сразу отпустите её.
Слышимый щелчок свидетельствует о начале инъекции.
В процессе инъекции контрольное окошко постепенно заполняется красным индикатором.
Не отпускайте автоинжектор ПроКлик™ в течение 10 секунд для завершения инъекции. Во время возврата кнопки активации в исходное положение может быть слышен второй щелчок.
После завершении инъекции контрольное окошко станет полностью красным.
Убедитесь, что большой палец руки убран с кнопки активации автоинжектора ПроКлик™. Держа автоинжектор под прямым углом (90°) к коже, извлеките его.
Защищающий иглу цилиндр автоматически закроет се, что предупредит возможные повреждения, вызванные иглой.
ПРЕДОСТЕРЕЖЕНИЕ: если красный индикатор не полностью заполняет контрольное окошко:
- возможно, что защищающий иглу цилиндр закрыт не полностью — в этом случае не касайтесь кончика автоинжектора ПроКлик™, поскольку в данной ситуации возможны повреждения, вызванные иглой;
- возможно неполное введение препарата — не пытайтесь вновь использовать автоинжектор ПроКлик™, не повторяйте инъекцию, обратитесь к наблюдающему вас медицинскому специалисту.
После введения препарата протрите место инъекции спиртовой салфеткой.
8. Утилизация авто инжектора ПроКлик™
Надевать защитный колпачок на автоинжектор ПроКлик™ не требуется. Автоинжектор ПроКлик™ и колпачок следует поместить в защищённый от проколов контейнер (ёмкость). Данный контейнер (ёмкость) следует хранить в местах, недоступных для детей. Заполненный контейнер следует утилизировать в соответствии с рекомендациями медицинского специалиста.
Побочные эффекты
Хронический гепатит C
Частота и степень тяжести наиболее распространённых побочных реакций при лечении препаратом Пегасис® и интерфероном альфа-2а одинаковы.
Самые распространённые побочные реакции при лечении препаратом Пегасис® в дозе 180 мкг выражены, как правило, легко или умеренно и не требуют коррекции дозы или отмены препарата.
Хронический гепатит B
На протяжении курса терапии (48 недель) и во время наблюдения без лечения (24 недели) профиль безопасности препарата Пегасис® был сходным с таковым при ХГС, хотя частота побочных эффектов при ХГВ была значительно меньше, за исключением частоты возникновения лихорадки. У 88 % пациентов, получавших Пегасис®, были отмечены нежелательные явления по сравнению с 53 % пациентов, получавших ламивудин. Серьёзные нежелательные явления были зарегистрированы у 6 % и 4 % пациентов соответственно. У 5 % пациентов, получавших Пегасис®, и менее чем у 1 % пациентов, получавших ламивудин, терапия была отменена из-за нежелательных явлений. Частота отмены препарата не отличается у пациентов с циррозом и без цирроза печени.
Хронический гепатит C — пациенты, ранее не ответившие на лечение
В целом профиль безопасности препарата Пегасис® в комбинации с рибавирином у пациентов, ранее не ответивших на лечение, был сходным с таковым у пациентов, ранее не получавших лечение.
В клиническом исследовании, включавшем 72 и 48-недельное лечение пациентов, не ответивших на ранее проводившуюся терапию пегилированным интерфероном альфа-2b/рибавирином, лабораторные отклонения или нежелательные явления приводили к отмене препарата Пегасис® у 12 % больных, а отмене рибавирина у 13 % больных, получавших лечение в течение 72 недель. В группе больных, получавших лечение в течение 48 недель, лабораторные отклонения или нежелательные явления приводили к отмене препарата Пегасис® в 6 %, а отмене рибавирина — в 7 %. Аналогично у пациентов с циррозом частота отмены терапии препаратом Пегасис® и рибавирином была выше в группе больных, получавших лечение в течение 72 недель (13 % и 15 %), чем в группе больных, получавших лечение в течение 48 недель (6 % и 6 %). В исследование не включались пациенты с отменой ранее проводимой терапии (метилированным интерфероном альфа-2b/рибавирином) по причине гематологической токсичности.
В другое 48-недельное клиническое исследование были включены пациенты с выраженным фиброзом или циррозом (от 3 до 6 баллов по шкале Ishak), ранее не ответившие на терапию и имевшие исходное число тромбоцитов 50000 клеток/мкл. В первые 20 недель исследования наблюдались следующие лабораторные отклонения со стороны гематологических показателей: анемия (Нb менее 10 г/дл у 26 % пациентов); нейтропения (АЧН менее 750 клеток/мкл у 30 % пациентов); тромбоцитопения (число тромбоцитов менее 50000 клеток/мкл у 13 % пациентов).
Ко-инфекция ВИЧ-ХГС
Профиль безопасности препарата Пегасис® (монотерапия или комбинация с рибавирином) у пациентов с ко-инфекцией ВИЧ-ХГС сходен с таковым у пациентов с ХГС. К другим нежелательным явлениям, встречавшимся у ≥1 % — ≤2 % пациентов с ко-инфекцией ВИЧ-ХГС при лечении препаратом Пегасис® / рибавирином, относятся: гиперлактацидемия/лактатацидоз, грипп, пневмония, эмоциональная лабильность, апатия, звон в ушах, боли в горле и гортани, хейлит, приобретённая липодистрофия и хроматурия.
Терапия препаратом Пегасис® ассоциировалась со снижением абсолютного количества CD4+ лимфоцитов в первые 4 недели лечения без изменения их процентного содержания. Количество CD4+ лимфоцитов возвращалось к исходному при снижении дозы или после отмены терапии. Назначение препарата Пегасис® не влияло отрицательно на показатель вирусной нагрузки ВИЧ во время терапии и в период наблюдения после окончания терапии.
Данные по применению у пациентов с количеством CD4+ лимфоцитов менее 200 клеток/мкл ограничены.
Побочные реакции при монотерапии препаратом Пегасис® хронического гепатита B и хронического гепатита C, а также при терапии препаратом Пегасис® в комбинации с рибавирином хронического гепатита C в клинических исследованиях и при пострегистрационном использовании
Для описания частоты побочных реакций в клинических исследованиях используются следующие категории: очень часто (≥1/10), часто (≥1/100; <1/10), нечасто (≥1/1 000; <1/100), редко (≥1/10 000; <1/1 000), очень редко (<1/10 000). Для побочных реакций, полученных из спонтанных сообщений при пострегистрационном использовании препарата, используется категория частоты «неизвестно» (частота не может быть вычислена на основании имеющихся данных).
Инфекционные и паразитарные заболевания:
часто — инфекции верхних дыхательных путей, бронхит, кандидоз полости рта, простой герпес, грибковые, вирусные и бактериальные инфекции;
нечасто — пневмония, инфекции кожи;
редко — эндокардит, наружный отит;
неизвестно — сепсис.
Доброкачественные и злокачественные новообразования:
нечасто — новообразование печени.
Нарушения со стороны крови и лимфатической системы:
часто — тромбоцитопения, анемия, лимфаденопатия;
редко — панцитопения;
очень редко — апластическая анемия;
неизвестно — парциальная красноклеточная аплазия костного мозга.
Нарушения со стороны иммунной системы:
нечасто — саркоидоз, тиреоидит;
редко — анафилаксия, системная красная волчанка, ревматоидный артрит;
очень редко — идиопатическая или тромботическая тромбоцитопеническая пурпура, ангионевротический отёк;
неизвестно — отторжение печёночных и почечных трансплантатов, болезнь Фогга-Коянаги-Харада.
Нарушения со стороны эндокринной системы:
часто — гипотиреоз, гипертиреоз;
нечасто — сахарный диабет;
редко — диабетический кетоацидоз.
Нарушения со стороны обмена веществ и питания:
очень часто — анорексия;
нечасто — дегидратация.
Нарушения психики:
очень часто — депрессия*, беспокойство, бессонница*;
часто — эмоциональные расстройства, изменения настроения, агрессивность, нервозность, снижение либидо;
нечасто — суицидальные мысли, галлюцинации;
редко — суицид, психические расстройства;
неизвестно — мания, биполярные расстройства, гомицидальные идеи.
Нарушения со стороны нервной системы:
очень часто — головная боль, головокружение*, нарушение концентрации внимания;
часто — нарушения памяти, обморок, слабость, мигрень, гипестезия, гиперестезия, парестезия, тремор, нарушение вкусовых ощущений, ночные кошмары, сонливость;
нечасто — периферическая нейропатия; редко — кома, судороги, неврит лицевого нерва;
неизвестно — ишемический инсульт.
Нарушения со стороны органа зрения:
часто — затуманенное зрение, боль в глазном яблоке, воспалительные заболевания глаз, ксерофтальмия;
нечасто — кровоизлияние в сетчатку;
редко — неврит зрительного нерва, отёк диска зрительного нерва, поражения сосудов сетчатки, ретинопатия, язва роговицы;
очень редко — потеря зрения;
неизвестно — отслойка сетчатки (серьёзные случаи).
Нарушения со стороны органа слуха и лабиринтные нарушения:
часто — вертиго, боль в ухе;
нечасто — потеря слуха.
Нарушения со стороны сердечно-сосудистой системы:
часто — тахикардия, ощущение сердцебиения, периферические отёки, покраснение;
нечасто — артериальная гипертензия;
редко — инфаркт миокарда, хроническая сердечная недостаточность, стенокардия, суправентрикулярная тахикардия, аритмия, фибрилляция предсердий, перикардит, кардиомиопатия, кровоизлияние в головной мозг, васкулит;
неизвестно — ишемия периферических сосудов.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
очень часто — одышка, кашель;
часто — одышка при физической нагрузке, носовое кровотечение, назофарингит, отёк пазух, заложенность носа, ринит, боли в горле;
нечасто — свистящее дыхание;
редко — интерстициальный пневмонит (включая случаи с летальным исходом), эмболия лёгочной артерии.
Нарушения со стороны желудочно-кишечного тракта:
очень часто — диарея*, тошнота*, боль в животе*;
часто — рвота, диспепсия, дисфагия, изъязвление слизистой полости рта, кровоточивость
дёсен, глоссит, стоматит, метеоризм, сухость слизистой оболочки полости рта;
нечасто — желудочно-кишечное кровотечение;
редко — пептическая язва, панкреатит;
неизвестно — ишемический колит, пигментация языка.
Нарушения со стороны печени и желчевыводящих путей:
нечасто — нарушение функции печени;
редко — печёночная недостаточность, холангит, жировая дистрофия печени.
Нарушения со стороны колеи и подкожных тканей:
очень часто — алопеция, дерматит, зуд, сухость кожи;
часто — сыпь, повышенное потоотделение, псориаз, крапивница, экзема, поражения кожи, реакции фотосенсибилизации, ночные поты;
очень редко — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, мультиформная эритема.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
очень часто — миалгии, артралгии;
часто — боли в синие, шее, костях, артрит, мышечная слабость, костно-мышечная боль, мышечные спазмы;
редко — миозит; неизвестно — рабдомиолиз.
Нарушения со стороны почек и мочевыводящих путей:
редко — почечная недостаточность.
Нарушения со стороны половых органов и молочной железы:
часто — импотенция.
Общие расстройства и нарушения в месте введения:
очень часто — лихорадка, озноб*, боль*, астения, слабость, раздражительность*, реакции в месте инъекции*;
часто-боли в грудной клетке, гриппоподобный синдром, недомогание, заторможенность, «приливы», жажда, снижение массы тела.
Травмы, интоксикации и осложнения манипуляций:
редко — передозировка.
*Эти побочные реакции встречались часто (≥1/100; <1/10) у пациентов с хроническим гепатитом В, получавших монотерапию препаратом Пегасис®.
Описание отдельных нежелательных реакций
Лабораторные показатели
Терапия препаратом Пегасис® сопровождалась следующими изменениями лабораторных показателей: повышением активности АЛТ, гипербилирубинемией, электролитными нарушениями (гипокалиемия, гипокальциемия, гипофосфатемия), гипо- и гипергликемией, гипертриглицеридемией.
При монотерапии препаратом Пегасис® и при комбинированной терапии с рибавирином у 2 % пациентов наблюдалось повышение активности АЛТ, что приводило к уменьшению дозы или прекращению лечения.
Терапия препаратом Пегасис® ассоциировалась со снижением гематологических показателей (лейкопенией, нейтропенией, лимфопенией, тромбоцитопенией и снижением Нb), которые улучшались при изменении дозы и возвращались к исходному уровню через 4–8 недель после прекращения терапии. У 24 % пациентов, получавших 180 мкг препарата Пегасис® и 1000–1200 мг рибавирина в течение 48 недель, наблюдалась нейтропения средней степени тяжести (АЧН: 0,749–0,5 × 109), а у 5 % пациентов — тяжёлая нейтропения (АЧН: <0,5 × 109).
Антитела к интерферону: у 1–5 % пациентов, получавших Пегасис®, отмечалось образование нейтрализующих антител к интерферону. Как и при терапии другими интерферонами, нейтрализующие антитела к интерферону чаще наблюдались при хроническом гепатите B. Однако корреляция между появлением антител и эффективностью лечения не выявлена.
Функция щитовидной железы: терапия препаратом Пегасис® ассоциировалась с клинически значимыми изменениями лабораторных показателей функции щитовидной железы, которые потребовали медицинского вмешательства. Частота возникновения (4,9 %) этих изменений при терапии препаратом Пегасис® и другими интерферонами одинакова.
Лабораторные показатели при ко-инфекции ВИЧ-ХГС
Несмотря на то, что явления гематологической токсичности (нейтропения, тромбоцитопения, анемия) у пациентов с ко-инфекцией ВИЧ-ХГС встречаются чаще, большинство из них корректируются изменением дозы и использованием факторов роста, и преждевременная отмена терапии требуется редко. Снижение абсолютного числа нейтрофилов ниже 500 клеток/мкл наблюдалось у 13 % и 11% пациентов, получавших монотерапию препаратом Пегасис® и терапию препаратом Пегасис® / рибавирином, соответственно.
Снижение тромбоцитов ниже 50000 клеток/мкл наблюдалось при монотерапии препаратом Пегасис® у 10 % пациентов, а при комбинированной терапии — у 8 %. У 7% больных, получавших монотерапию препаратом Пегасис®, и у 14 % больных, получавших Пегасис® / рибавирин, была зарегистрирована анемия (Нb <10 г/дл).
Передозировка
Описаны случаи передозировки препарата Пегасис® при введении препарата в течение двух дней подряд (без соблюдения недельного интервала) и при ежедневном введении на протяжении одной недели (суммарная доза 1260 мкг в неделю). Каких-либо необычных, серьёзных и влияющих на лечение нежелательных явлений не отмечено. В клинических исследованиях при раке почки и хроническом миелолейкозе препарат вводили в дозах до 540 и 630 мкг в неделю. Признаками токсичности, ограничивающими дальнейшее применение в этих дозах, были слабость, повышение активности печёночных ферментов, нейтропения и тромбоцитопения, которые могут возникнуть и при лечении обычными интерферонами.
Специфический антидот отсутствует. Гемодиализ и перитонеальный диализ неэффективны.
Взаимодействие
Исследования по изучению взаимодействия проводились только у взрослых.
Терапия препаратом Пегасис® 180 мкг/неделю в течение 4-х недель не влияла на фармакокинетический профиль толбутамида, мефенитоина, дебризохина и дапсона у здоровых мужчин-добровольцев, что свидетельствует о том, что Пегасис® in vivo не оказывает влияние на метаболическую активность изоферментов цитохрома P450 2C9, 2C19, 2D6 и 3A4.
Пегасис® является умеренным ингибитором активности изофермента 1A2 цитохрома P450, выявлено увеличение площади под кривой «концентрация–время» (AUC) теофиллина примерно на 25 %. У больных, одновременно получающих теофиллин и Пегасис®, необходимо контролировать концентрацию теофиллина в сыворотке и проводить соответствующую коррекцию дозы теофиллина. Взаимодействие между теофиллином и препаратом Пегасис®, по-видимому, достигают максимума более чем через 4 недели терапии препаратом Пегасис®.
Моноинфекция вирусом гепатита C и вирусом гепатита B
В фармакокинетическом исследовании у 24 пациентов с XГС терапия препаратом Пегасис® 180 мкг/неделю в течение 4 недель сопровождалась увеличением средних уровней метаболитов метадона (одновременная терапия метадоном в дозе от 30 мг до 150 мг; медиана дозы 95 мг) на 10–15 %. Клиническое значение этого взаимодействия не определено, рекомендуется тщательно контролировать симптомы интоксикации метадоном. В частности, у пациентов, принимающих высокие дозы метадона, имеется риск удлинения интервала QTc.
Азатиоприн: при применении рибавирина в комбинации с азатиоприном возможно усиление миелотоксического действия азатиоприна. Рибавирин ингибирует инозинмонофосфат дегидрогеназу — фермент, участвующий в метаболизме азатиоприна. В свою очередь, подавление активности данного фермента приводит к повышению уровня 6-метилтиоинозинмонофосфата, что ассоциировано с риском миелотоксичности у пациентов, получающих азатиоприн. Возможно назначение рибавирина в комбинации с азатиоприном, если ожидаемая польза терапии превышает потенциальный риск. В таких случаях необходимо проводить тщательный мониторинг состава крови на предмет развития миелотоксичности. При возникновении миелотоксичности комбинированную терапию следует отменить (см. также «Особые указания»).
Не выявлено фармакокинетического взаимодействия между препаратом Пегасис® и рибавирином у пациентов с ХГС и препаратом Пегасис® и ламивудином у пациентов с ХГВ.
Комбинация телбивудина в дозе 600 мг/сутки и пегилированного интерферона альфа-2а в дозе 180 мкг 1 раз в неделю подкожно для лечения ХГВ ассоциируется с повышенным риском развития периферической нейропатии, механизм развития которой неизвестен. Нельзя исключить повышенный риск развития периферической нейропатии и для других интерферонов (как стандартных, так и пегилированных). Кроме того, в настоящее время не установлена польза комбинации телбивудина и интерферонов альфа (пегилированных или стандартных). Таким образом, комбинация препарата Пегасис® и телбивудина противопоказана.
Ко-инфекция ВИЧ-ХГС
В дополнительном 12-недельном фармакокинетическом исследовании у 47 пациентов с ко-инфекцией ВИЧ-ХГС, целью которого было определить влияние рибавирина на внутриклеточное фосфорилирование некоторых нуклеозидных ингибиторов обратной транскриптазы (НИОТ) (ламивудин и зидовудин или ставудин), очевидных доказательств межлекарственного взаимодействия не обнаружено. Однако из-за существенных колебаний значений, доверительные интервалы были достаточно широки. Одновременный приём НИОТ, очевидно, не влиял на экспозицию рибавирина в плазме.
Не рекомендуется комбинация диданозина и рибавирина. Рибавирин увеличивает экспозицию диданозина и его активного метаболита (дидеоксиаденозин 5-трифосфат) in vitro, что может приводить к развитию фатальной печёночной недостаточности, периферической нейропатии, панкреатита, симптоматической гиперлактатемии/лактатацидозу.
При использовании зидовудина в комплексной терапии ВИЧ сообщалось об ухудшении анемии, связанной с рибавирином. Однако точный механизм этого явления ещё подлежит определению. Из-за повышенного риска возникновения анемии одновременное применение рибавирина и зидовудина не рекомендуется. Если комбинированная антиретровирусная терапия уже проводится, следует рассмотреть возможность замены зидовудина, особенно у пациентов, имевших в анамнезе анемию, вызванную зидовудином.
Фармацевтическая несовместимость
Запрещается смешивать Пегасис® с другими лекарственными средствами, поскольку исследования по совместимости отсутствуют.
Особые указания
В медицинской документации больного следует указывать торговое наименование препарата (Пегасис® ). Замена препарата на какой-либо другой биологический лекарственный препарат требует согласования с лечащим врачом. Информация, представленная в данной инструкции, относится только к препарату Пегасис®.
Нейропсихические расстройства
У некоторых больных, как во время лечения препаратом Пегасис®, так и в течение 6 месяцев после прекращения лечения, наблюдались тяжёлые побочные реакции со стороны центральной нервной системы (ЦНС), в частности: депрессия, суицидальная настроенность и суицидальные попытки.
При терапии интерферонами альфа наблюдались и другие побочные реакции со стороны ЦНС, в том числе агрессивное поведение, иногда направленное против других людей (например, гомицидальные идеи), спутанность сознания, нарушения психического статуса. Следует внимательно наблюдать за состоянием пациентов (независимо от возраста) для выявления признаков или симптомов психических расстройств. Если такие симптомы возникают, то врач должен помнить о потенциальной серьёзности этих нежелательных явлений в необходимости соответствующего лечения. В случае, если симптомы психических расстройств сохраняются или ухудшаются или выявляется суицидальная настроенность, рекомендуется отменить терапию препаратом Пегасис® и оказать необходимое соответствующее лечение.
Пациенты с тяжёлыми психическими заболеваниями (в том числе в анамнезе)
Если принято решение о необходимости лечения препаратом Пегасис® пациентов с тяжёлыми психическими заболеваниями (в том числе в анамнезе), то терапию следует начинать только после проведения соответствующего обследования и лечения психического расстройства.
Пациенты, употребляющие/злоупотребляющие психоактивными веществами
Пациенты, инфицированные ВГС и имеющие нарушения, связанные с употреблением психоактивных веществ (алкоголь, каннабиоиды и т.д,), находятся в группе повышенного риска развития психических расстройств или обострения уже существующих при лечении интерферонами альфа. Если лечение интерферонами альфа является необходимым у этих больных, следует тщательно оценить наличие сопутствующих психических заболеваний и потенциал использования других веществ, а также адекватно их контролировать до начала терапии. Следует тщательно наблюдать за пациентами как во время терапии, так и после её прекращения. Для оценки рисков перед началом лечения, во время терапии и при наблюдении после завершения терапии следует использовать междисциплинарный подход с привлечением при необходимости психиатра и нарколога. В случае повторного возникновения пли развития психических нарушений и употребления психоактивных веществ рекомендуется раннее вмешательство.
Лабораторные показатели до и во время лечения
До начала лечения препаратом Пегасис® всем больным рекомендуется пройти стандартные общие клинические и биохимические анализы крови.
Инициация терапии возможна при следующих исходных показателях:
- число тромбоцитов ≥90000 клеток/мкл,
- абсолютное число нейтрофилов ≥1500 клеток/мкл,
- компенсированная функция щитовидной железы (ТТГ и Т4 в пределах нормальных показателей),
- количество CD4+ лимфоцитов ≥200 клеток/мкл или CD4+ ≥100 — <200 клеток/мкл, а РНК ВИЧ-1 <5000 копий/мл (ВИЧ-1 Monitor Test, v. 1,5) у пациентов с ко-инфекцией ВИЧ-ХГС. Пегасис® (в виде монотерапии или в комбинации с рибавирином) следует применять с осторожностью при гемоглобине менее 12 г/дл.
После начала терапии общий клинический анализ крови необходимо повторить через 2 и 4 недели, а биохимический — через 4 недели; дополнительные лабораторные анализы следует проводить периодически во время терапии (в том числе мониторинг концентрации глюкозы в крови).
В клинических исследованиях при лечении препаратом Пегасис® снижалось как общее количество лейкоцитов, так и абсолютное число нейтрофилов (АЧН) обычно со второй недели терапии. Прогрессирующее снижение АЧН через 8 недель терапии встречалось нечасто. Снижение АЧН было обратимым после уменьшения дозы или отмены препарата, у большинства пациентов показатель АЧН достигал нормального значения через 8 недель и возвращался к исходному значению у всех пациентов примерно через 16 недель.
Терапия препаратом Пегасис® связана со снижением числа тромбоцитов, которые возвращались к исходному уровню в течение периода наблюдения после лечения. В некоторых случаях может потребоваться изменение дозы.
В клинических исследованиях при комбинированном лечении препаратом Пегасис® и рибавирином возникновение анемии (Нb <10 г/дл) наблюдалось у 15 % пациентов с хроническим гепатитом C. Частота возникновения анемии зависит от длительности курса терапии и дозы рибавирина. У женщин риск развития анемии выше.
Нужно соблюдать осторожность при назначении препарата Пегасис® в комбинации с другими миелотоксичными препаратами.
В литературе описаны случаи возникновения панцитопении и супрессии костного мозга через 3–7 недель после начала применения рибавирина в комбинации с азатиоприном. Миелотоксичность носила обратимый характер и исчезала в течение 4–6 недель после отмены противовирусной терапии ХГС и азатиоприна. После возобновления одного из видов лечения (противовирусная терапия или азатиоприн) подобный эффект в дальнейшем не развивался (см. также «Взаимодействие с другими лекарственными средствами»). Необходимо взвесить потенциальный риск и пользу перед началом терапии у больных ХГС с неудачей ранее проводимой терапии и прервавших терапию в связи с гематологическими нежелательными явлениями, поскольку использование препарата Пегасис® у таких пациентов недостаточно изучено.
Эндокринная система
При использовании интерферонов альфа, в том числе препарата Пегасис®, наблюдались нарушения функции щитовидной железы или ухудшение ранее существовавших заболеваний щитовидной железы. Перед началом терапии препаратом Пегасис® следует исследовать уровни ТТГ и Т4. Лечение препаратом Пегасис® может быть начато или продолжено, если уровень ТТГ может поддерживаться в пределах нормальных значений медикаментозно. При возникновении клинических симптомов возможной дисфункции щитовидной железы необходимо исследовать ТТГ во время терапии.
Как и при терапии другими интерферонами, при применении препарата Пегасис® наблюдались гипогликемия, гипергликемия и сахарный диабет. Пациенты с вышеперечисленными состояниями, которые не поддаются адекватной коррекции, не должны начинать монотерапию препаратом Пегасис® или комбинированную терапию препаратом Пегасис® / рибавирином, а в случае развития подобных состояний во время лечения терапию следует прекратить.
Сердечно-сосудистая система
Артериальная гипертензия, суправентрикулярные аритмии, хроническая сердечная недостаточность, боль в грудной клетке и инфаркт миокарда ассоциировались с терапией интерферонами альфа, включая Пегасис®. Пациентам с сердечно-сосудистой патологией перед началом терапии рекомендуется делать электрокардиограмму. В случае ухудшения сердечно-сосудистого статуса терапию следует прервать или отменить. У пациентов с сердечно-сосудистыми заболеваниями анемия может привести к необходимости снизить дозу или прекратить приём рибавирина.
Нарушение функции печени
При развитии печёночной недостаточности Пегасис® следует отменить. Так же как и при терапии другими интерферонами альфа, увеличение активности АЛТ по сравнению с исходным значением наблюдалось во время терапии препаратом Пегасис®, включая пациентов с вирусологическим ответом. При прогрессирующем или клинически значимом увеличении активности AЛT, несмотря на снижение дозы, или, если это увеличение сопровождается повышением концентрации прямого билирубина, терапию следует отменить.
В отличие от ХГС, при ХГВ обострение заболевания печени встречается нередко и сопровождается преходящим и потенциально значимым повышением активности АЛТ. В клинических исследованиях внезапное выраженное повышение активности АЛТ при терапии препаратом Пегасис® у пациентов с ХГВ сопровождалось лёгкими изменениями других лабораторных показателей без признаков декомпенсации функции печени. В половине случаев внезапного повышения активности АЛТ, в 10 раз превышающего верхнюю границу нормы, доза препарата Пегасис® была снижена или терапия была временно отменена до нормализации показателя, в то время как у второй половины пациентов терапию продолжали без изменений. Рекомендуется более часто контролировать функцию печени во всех случаях.
Реакции гиперчувствительности
При терапии интерфероном альфа редко наблюдаются серьёзные реакции гиперчувствительности немедленного типа (например, крапивница, ангионевротический отёк, бронхоспазм, анафилаксия). В случае развития подобных реакций терапию отменяют и немедленно назначают соответствующую медикаментозную терапию. Преходящая сыпь не требует отмены терапии.
Аутоиммунные заболевания
При лечении интерферонами альфа описано возникновение аутоантител и аутоиммунных заболеваний. В группе повышенного риска находятся пациенты с предрасположенностью к развитию аутоиммунных заболеваний. Пациенты с признаками или симптомами, сходными с признаками аутоиммунных заболеваний, должны проходить тщательное обследование и повторную оценку соотношения пользы и риска от продолжения терапии интерфероном.
Имеются сообщения о случаях развития синдрома Фогта-Коянаги-Харада (Vogt-Koyanagi-Harada (VKH) syndrome) у пациентов ХГС, получавших лечение интерфероном. Этот синдром представляет собой гранулематозное воспалительное заболевание, поражающее глаза, слуховой аппарат, мозговые оболочки и кожу. При подозрении на синдром Фогта-Коянаги-Харада необходимо прекратить противовирусное лечение и рассмотреть возможность назначения глюкокортикостероидной терапии.
Лихорадка и инфекции
Несмотря на то, что лихорадка может быть связана с гриппоподобным синдромом, часто возникающим при терапии интерфероном, необходимо исключить другие причины персистирующей лихорадки (в частности, серьёзные бактериальные, вирусные и грибковые инфекции), особенно у пациентов с нейтропенией. При приёме интерферонов альфа, включая Пегасис®, сообщалось о серьёзных инфекциях (бактериальных, вирусных, грибковых). Следует немедленно назначить соответствующую специфическую терапию и отменить Пегасис®.
Офтальмологические изменения
Как и при терапии другими интерферонами, при лечении препаратом Пегасис® в редких случаях отмечалась ретинопатия, включая кровоизлияния в сетчатку, «ватные» экссудаты, отёк диска зрительного нерва, неврит зрительного нерпа и тромбоз артерий или вен сетчатки. Всем пациентам перед назначением терапии необходимо провести офтальмологическое обследование для выявления патологии глазного дна. При появлении жалоб на ухудшение остроты зрения или сужение полей зрения следует немедленно провести полное офтальмологическое обследование. Пациентам с сопутствующими заболеваниями органа зрения (например, диабетическая или гипертоническая ретинопатия) необходимо проводить дополнительные осмотры во время терапии препаратом Пегасис®. При возникновении или ухудшении офтальмологического заболевания терапию следует отменить.
Изменения со стороны органов дыхания
Как и при терапии интерферонами альфа, при лечении препаратом Пегасис® наблюдались побочные реакции со стороны органов дыхания, включая одышку, лёгочные инфильтраты, пневмонию и пневмонит. При появлении персистирующих (стойких) инфильтратов или инфильтратов неясного генеза или при нарушении функции дыхания терапию следует отменить.
Изменения со стороны кожи
Применение интерферонов альфа ассоциировалось с обострением или индуцированием псориаза и саркоидоза. Больным псориазом Пегасис® следует назначать с осторожностью, а при появлении или обострении заболевания рассмотреть вопрос об отмене терапии.
Больные после трансплантации
Безопасность и эффективность монотерапии препаратом Пегасис® или его комбинации с рибавирином у больных после трансплантации печени и других органов и тканей не установлены. Как при назначении других интерферонов альфа, при применении препарата Пегасис® в качестве монотерапии или в комбинации с рибавирином выявлены случаи отторжения печёночных и почечных трансплантатов.
Ко-инфекция ВИЧ-ХГС
Перед началом лечения следует внимательно ознакомиться с возможными побочными эффектами антиретровирусных препаратов, которые пациент будет принимать совместно с препаратами для терапии ХГС. У пациентов, одновременно получавших ставудин и интерферон с или без рибавирина, частота возникновения панкреатита и/или лактацидоза составила 3 %.
Пациенты с ко-инфекцией ВИЧ-ХГС, получающие высокоактивную антиретровирусную терапию (ВААРТ), могут находиться в группе риска в отношении развития лактацидоза. Поэтому следует соблюдать осторожность при добавлении препарата Пегасис® и рибавирина к ВААРТ (см. инструкцию по медицинскому применению рибавирина).
У пациентов с ко-инфекцией и выраженным циррозом, получающих ВААРТ, при комбинированной терапии рибавирином и интерферонами, включая Пегасис®, повышен риск развития фатальной печёночной недостаточности. Исходные показатели, которые могут быть связаны с печёночной декомпенсацией у пациентов с ко-инфекцией и циррозом, включают в себя: повышенный сывороточный билирубин, сниженный Нb, повышенную щелочную фосфатазу или пониженный уровень тромбоцитов и лечение диданозином (ddI). Одновременное применение рибавирина и зидовудина не рекомендуется из-за повышенного риска возникновения анемии.
Необходим тщательный мониторинг на предмет выявления признаков и симптомов печёночной декомпенсации (включая асцит, энцефалопатию, кровотечение из варикозно расширенных вен, нарушение синтетической функции печени; показатель ≥7 баллов по шкале Чайлд-Пью) у пациентов с ко-инфекцией. Показатель по шкале Чайлд-Пью не всегда достоверно отражает наличие печёночной декомпенсации и может изменяться под влиянием таких факторов, как непрямая гипербилирубинемия, гипоальбуминемия вследствие медикаментозной терапии. При развитии печёночной декомпенсации терапию препаратом Пегасис® следует немедленно отменить.
Следует проявлять осторожность при назначении препарата Пегасис® пациентам с низким уровнем CD4+ лимфоцитов из-за недостаточности данных по эффективности и безопасности применения препарата Пегасис® у пациентов с ко-инфекцией ВИЧ-ХГС с количеством CD4+ лимфоцитов менее 200 клеток/мкл.
Стоматологические изменения
У пациентов, получающих комбинированную терапию препаратом Пегасис® и рибавирином, наблюдалась патология зубов и пародонта, которая может привести к потере зубов. Кроме того, длительный курс лечения препаратом Пегасис® и рибавирином может вызывать сухость полости рта, разрушающе воздействующую на зубы и слизистую оболочку ротовой полости. Пациенты должны тщательно чистить зубы дважды в день и регулярно проходить обследование у стоматолога. У некоторых пациентов может возникать рвота, после которой рекомендуется тщательно полоскать рот.
Использование пэгинтерферона в качестве длительной поддерживающей терапии (использование вне зарегистрированных показаний)
В рандомизированном контролируемом исследовании (HALT-C) у пациентов с XГС и фиброзом различной стадии, не ответивших на предшествующую терапию, при монотерапии препаратом Пегасис® в дозе 90 мкг в неделю в течение 3,5 лет не отмечалось значимого сокращения скорости прогрессирования фиброза или связанных с ним клинических явлений.
Рост и развитие (дети)
У детей и подростков в возрасте от 5 до 17 лет, получавших препарат Пегасис® в комбинации с рибавирином, после 48 недель терапии часто наблюдалась задержка роста и замедление прироста массы тела. Через 2 года после завершения лечения снижение процентиля для массы тела на 15 и более процентилей по сравнению с исходными значениями наблюдалось у 16 % детей, а снижение процентиля для роста на 15 и более процентилей — у 11 % детей.
Данные длительного периода наблюдения предполагают маловероятность ассоциации терапии препаратом Пегасис® с устойчивым торможением роста у детей. Через 5–6 лет после завершения лечения у детей с наблюдавшимся снижением процентиля для роста на 15 и более процентилей по сравнению с исходными значениями через 2 года после завершения лечения показатели роста возвращались к показателям, сравнимым с исходными значениями, или были выявлены причины задержки роста, не связанные с проводимым лечением.
Влияние на способность управлять транспортными средствами или работать с механизмами
Пегасис® оказывает слабое или небольшое влияние на способность к вождению транспортных средств и работу с машинами и механизмами. При возникновении головокружения, сонливости, спутанности сознания и слабости, следует отказаться от вождения транспортного средства или работы с машинами и механизмами.
Форма выпуска
Раствор для подкожного введения, 135 мкг/0,5 мл и 180 мкг/0,5 мл.
Хранение
Хранить при температуре 2–8 °C в защищённом от света месте.
Не замораживать.
Хранить в недоступном для детей месте.
Транспортирование
При температуре 2–8 °C в защищённом от света месте.
Не замораживать.
Срок годности
3 года (шприц-тюбики).
2 года (автоинжекторы ПроКлик™).
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
Фармакотерапевтическая группа
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Пегасис:
