Виндамэкс
VyndamaxРегистрационный номер
Торговое наименование
Виндамэкс
Международное непатентованное наименование
Лекарственная форма
капсулы
Состав
Состав на 1 капсулу:
действующее вещество: тафамидис 61,0 мг.
вспомогательные вещества:
макрогол 400 471,1 мг, полисорбат 20 55,5 мг, повидон (К-90) 12,0 мг, бутилгидрокситолуол 0,4 мг
Состав желатиновой оболочки:
Желатин прозрачный (L3DXHBAHR) 367,9 мг состоит из: желатин (195 Кислотный тип) 217,3 мг, сорбитола специальная глицериновая смесь 150,6 мг; краситель железа оксид красный (E172) 1,29 мг.
Количество твёрдых веществ из чернил для надписи остающееся на капсуле, является следовым (не более 0,8 мг/капсула).
Надпись «VYN 61» наносится белыми чернилами Opacode® (WB) NSP-78-18022.
Чернила Colorcon® Ink, White Opacode® (WB) NSP-78-18022 содержат следующие компоненты: спирт SDA 35А* (24,9 % м/м), аммония гидроксид* 28 % (0,9 % м/м), изопропанол* (8,2 % м/м), вода очищенная* (9,9 % м/м), макрогол MW400 (полиэтиленгликоль) (2,3 % м/м), поливинилацетата фталат (10,4 % м/м), пропиленгликоль (24,0 % м/м), титана диоксид (19,6 % м/м).
* удаляется в процессе производства и в конечном продукте отсутствует.
Лецитин соевый и триглицериды со средней длиной цепи используются в производственном процессе в качестве лубрикантов для смазки желатиновой ленты.
Описание
Продолговатые, непрозрачные мягкие желатиновые капсулы красновато-коричневого цвета с надписью белого цвета «VYN 61». Содержимое капсулы — суспензия от белого до розового цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Тафамидис является селективным стабилизатором транстиретина (TTR). Тафамидис связывается с ТТР в участках связывания тироксина, стабилизируя тетрамер и замедляя диссоциацию на мономеры — фактор, ограничивающий скорость, в процессе амилоидогенеза.
Фармакодинамические эффекты
Транстиретиновый амилоидоз — это тяжёлое инвалидизирующее заболевание, вызываемое накоплением в тканях различных нерастворимых фибриллярных белков, или амилоида, в количестве, достаточном для нарушения нормального функционирования. Диссоциация тетрамера транстиретина на мономеры является фактором, ограничивающим скорость, в патогенезе транстиретинового амилоидоза. Свёрнутые мономеры подвергаются частичной денатурации для образования альтернативно свёрнутых мономерных амилоидогенных промежуточных продуктов. Эти промежуточные вещества впоследствии неправильным образом собираются в растворимые олигомеры, профиламенты, филаменты и амилоидные фибриллы. Тафамидис связывается с отрицательной кооперативностью с двумя участками связывания тироксина на нативной тетрамерной форме транстиретина, что препятствует диссоциации на мономеры. Ингибирование диссоциации тетрамеров ТТР обосновывает применение тафамидиса у пациентов с транстиретиновой амилоидной кардиомиопатией (ATTR-КМП).
Анализ стабилизации ТТР использовался в качестве фармакодинамического маркера и для оценки стабильности тетрамера ТТР.
Тафамидис стабилизировал как тетрамер ТТР дикого типа, так и тетрамеры 14 клинически испытанных вариантов ТТР после приёма тафамидиса один раз в сутки. Тафамидис также стабилизировал тетрамер ТТР для 25 вариантов, испытанных ex vivo, демонстрируя тем самым стабилизацию 40 амилоидогенных генотипов ТТР.
В многоцентровом международном двойном слепом плацебо-контролируемом рандомизированном исследовании стабилизация ТТР наблюдалась в месяц 1 и сохранялась до месяца 30.
Биомаркеры, ассоциированные с сердечной недостаточностью (NT-proBNP и тропонин I), указывали в пользу тафамидиса относительно плацебо.
Клиническая эффективность и безопасность
Эффективность была продемонстрирована в многоцентровом международном двойном слепом плацебо-контролируемом рандомизированном исследовании 3 режимов лечения с участием 441 пациента с диким типом или с наследственным ATTR-КМП.
Пациенты были рандомизированы для получения либо тафамидиса меглюмина 20 мг (n = 88) или 80 мг [которые применялись в виде четырёх капсул по 20 мг тафамидиса меглюмина] (n = 176), либо подобранного плацебо (n = 177) один раз в сутки в дополнение к стандартному лечению (например, диуретикам) на протяжении 30 месяцев. Распределение лечения стратифицировалось по наличию или отсутствию вариантного генотипа ТТР, а также по исходной степени тяжести заболевания (класс по NYHA). В таблице 1 описаны демографические данные пациентов и характеристики на исходном уровне.
| Характеристика | Объединённая группа терапии тафамидисом N = 264 | Плацебо N = 177 |
Возраст — лет | ||
| Среднее значение (стандартное отклонение) | 74,5 (7,2) | 74,1 (6,7) |
| Медиана (минимум, максимум) | 75 (46, 88) | 74 (51, 89) |
Пол — число (%) | ||
| Мужчины | 241 (91,3) | 157 (88,7) |
| Женщины | 23 (8,7) | 20(11,3) |
Генотип ТТР — число (%) | ||
| ATTRm | 63 (23,9) | 43 (24,3) |
| ATTRwt | 201 (76,1) | 134 (75,7) |
| Класс — по NYHA (%) | ||
| Класс I по NYHA | 24 (9,1) | 13 (7,3) |
| Класс II по NYHA | 162 (61,4) | 101 (57,1) |
| Класс III по NYHA | 78 (29,5) | 63 (35,6) |
Сокращения: ATTRm — вариантный транстиретиновый амилоид; ATTRwt — транстиретиновый амилоид дикого типа; NYHA — Нью- Йоркская кардиологическая ассоциация (New York Heart Association).
В рамках первичного анализа использовали иерархическую комбинацию, применяя метод Финкельштейна — Шенфельда для оценки смертности от всех причин и частоты госпитализации в связи заболеваниями сердечно-сосудистой системы, которую определяли как число госпитализаций пациента (то есть поступлений в больницу) в связи с сердечно-сосудистым заболеванием. Используя данный метод, сравнивали каждого пациента со всеми остальными пациентами в рамках каждой страты попарно, что продолжали далее, используя иерархический подход и смертность от всех причин, за которой следовала частота госпитализаций в связи с заболеваниями сердечно-сосудистой системы, когда пациентов невозможно было дифференцировать на основании смертности.
Этот анализ показал значительное снижение (p = 0,0006) смертности от всех причин и частоты госпитализаций в связи с заболеваниями сердечно-сосудистой системы в объединённой группе, получавшей тафамидис в дозе 20 мг и 80 мг, в сопоставлении с плацебо (таблица 2).
| Первичный анализ | Объединённая группа терапии тафамидисом N = 264 | Плацебо N = 177 |
| Число (%) пациентов, которые оставались живы* к месяцу 30 | 186 (70,5) | 101 (57,1) |
| Среднее число госпитализаций в связи с заболеваниями сердечно-сосудистой системы в течение 30 месяцев (на пациента в год) среди пациентов, которые оставались живы к месяцу 30‡ | 0,297 | 0,455 |
| P-значение из метода Ф-Ш | 0,0006 | |
*Трансплантация сердца и имплантация устройств для механической поддержки сердца считаются факторами, указывающими на приближение к терминальной стадии. Вследствие чего эти пациенты рассматриваются в анализе как эквивалентные смерти. Следовательно, подобных пациентов не включали в число «Число (%) пациентов, которые оставались живы к месяцу 30» даже при условии, что эти пациенты живы по результатам оценки состояния здоровья при последующем наблюдении через 30 месяцев.
‡Описательное среднее значение среди тех, кто пережил 30 месяцев.
Анализ отдельных компонентов первичного анализа (смертность от всех причин и госпитализация в связи с заболеваниями сердечно-сосудистой системы) также показал значительное снижение значений для тафамидиса в сопоставлении с плацебо.
Отношение рисков для смертности от всех причин в модели пропорциональных рисков Кокса для объединённой группы получения тафамидиса составило 0,698 (95 % ДИ 0,508; 0,958), что указывает на снижение риска летального исхода на 30,2 % относительно группы получения плацебо (p = 0,0259). График Каплана— Майера времени до явления для смертности от всех причин представлен на рисунке 1.
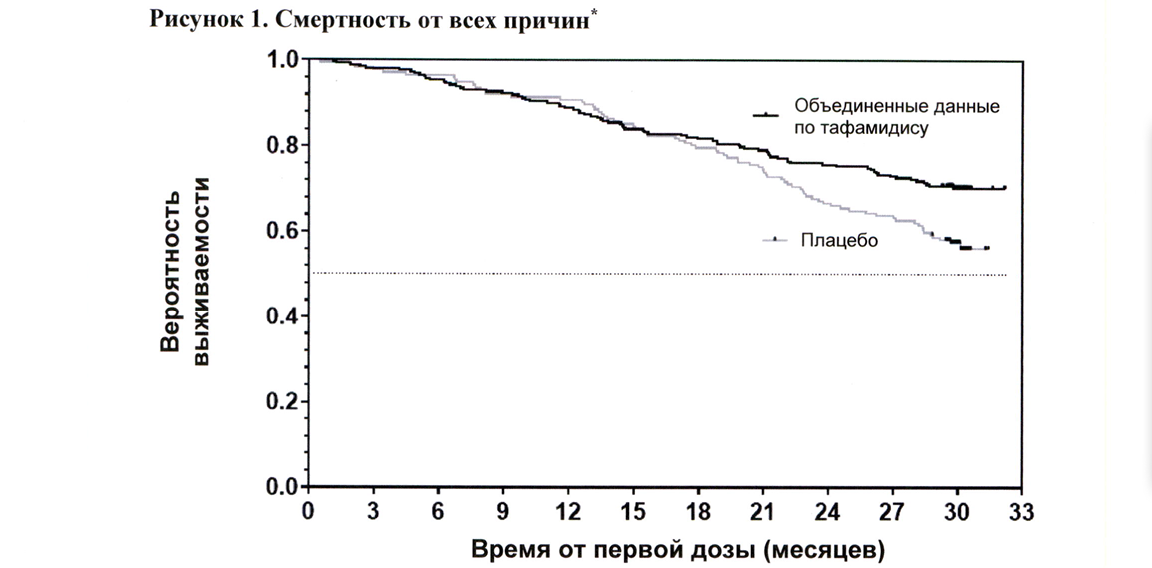

Отмечалось значительно меньше госпитализаций в связи с заболеваниями сердечно-сосудистой системы при применении тафамидиса в сравнении с плацебо при снижении риска на 32,4 % (таблица 3).
| Объединённая группа терапии тафамидисом N = 264 | Плацебо N = 177 | |
| Общее (%) число пациентов с госпитализациями в связи с заболеваниями сердечно-сосудистой системы | 138 (52,3) | 107 (60,5) |
| Госпитализации в связи с заболеваниями сердечно-сосудистой системы в год* | 0,4750 | 0,7025 |
| Отличие лечения в объединённой группа получения тафамидиса в сопоставлении с плацебо (отношение относительных рисков)* | 0,6761 | |
| р-значение* | <0,0001 | |
Сокращение: NYHA — Нью-Йоркская кардиологическая ассоциация (New York Heart Association).
* Этот анализ был основан на модели с пуассоновской регрессией с лечением, генотипом ТТР (вариантный или дикий тип), классом по классификации Нью-Йоркской кардиологической ассоциации (NYHA) (классы I и II по NYHA вместе и класс III по NYHA) на исходном уровне, зависимостью лечения от генотипа ТТР и зависимостью лечения от класса по NYHA на исходном уровне в качестве факторов.
Эффект лечения тафамидисом на функциональную способность и состояние здоровья оценивался при помощи 6-минутного теста с ходьбой (6-Minute Walk Test (6MWT)) и оценки по Канзасскому вопросника для пациентов с кардиомиопатией — общему резюме (Kansas City Cardiomyopathy Questionnaire-Overall Summary (KCCQ-OS)) (состоящему из таких доменов, как общие симптомы, физические ограничения, качество жизни и социальные ограничения) соответственно. Значительный эффект лечения в пользу тафамидиса впервые наблюдался к месяцу 6 и оставался стабильным до месяца 30 по результатам, как расстояния в 6MWT, так и оценки по KCCQ-OS (таблица 4).
| Конечные точки | Средний исходный уровень (СО) | Изменение от исходного уровня к месяцу 30, среднее значение, рассчитанное методом наименьших квадратов (СО) | Отличие лечения от плацебо Среднее значение, рассчитанное методом наименьших квадратов (95 % ДИ) | р-значение | ||
| Объединённая группа терапии тафамидисом N = 264 | Плацебо N = 177 | Объединённая группа терапии тафамидисом | Плацебо | |||
| 6MWT* (метры) | 350,55 (121,30) | 353,26 (125,98) | -54,87 (5,07) | -130,55 (9,80) | 75,68 (57,56, 93,80) | р< 0,0001 |
| KCCQ-OS* | 67,27 (21,36) | 65,90 (21,74) | -7,16 (1,42) | -20,81 (1,97) | 13,65 (9,48, 17,83) | р<0,0001 |
Результаты применения метода Ф-Ш, представленные коэффициентом выигрыша для объединённой конечной точки и её компонентов (смертность от всех причин и частота госпитализаций в связи с заболеваниями сердечно-сосудистой системы), неизменно указывали в пользу тафамидиса в сопоставлении с плацебо с учётом дозы и по всем подгруппам (дикий тип, вариантный и класс I и II и III по NYHA) за исключением частоты госпитализаций в связи с заболевания и сердечно-сосудистой системы при классе III по NYHA (рисунок 2), которая выше в группе, получавшей лечение тафамидисом, по сравнению с плацебо (см. раздел «Способ применения и дозы»). Анализы 6MWT и KCCQ-OS также были в пользу тафамидиса относительно плацебо в каждой подгруппе.
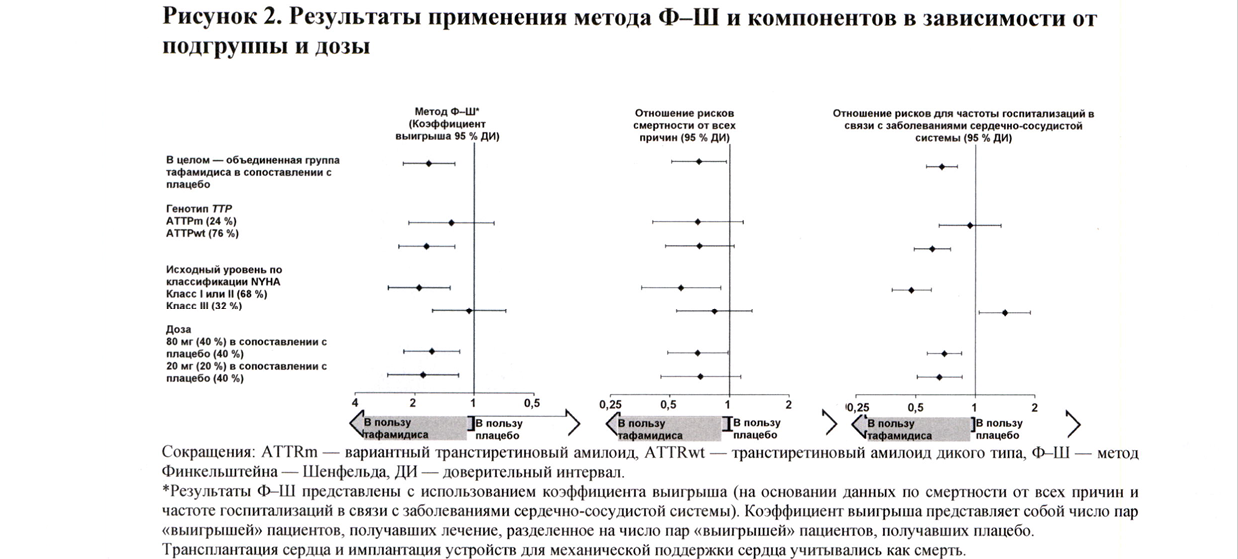
При применении метода Ф-Ш индивидуально к каждой группе, получавшей определённую дозу, применение тафамидиса снижало объединённый показатель смертности от всех причин и частоты госпитализации в связи с заболеваниями сердечно-сосудистой системы, как для дозы 80 мг, так и для дозы 20 мг по сравнению с плацебо (p = 0,0030 и p = 0,0048 соответственно). Результаты первичного анализа, 6MWT к месяцу 30 и KCCQ-OS к месяцу 30 были статистически значимыми для обеих доз тафамидиса меглюмина, 80 мг и 20 мг, в сопоставлении с плацебо, при этом результаты для обеих дозы были сходными.
Данные по эффективности для тафамидиса 61 мг недоступны, так как эта лекарственная форма не оценивалась в двойном слепом плацебо-контролируемом рандомизированном исследовании фазы 3. Виндамэкс 61 мг (тафамидис) соответствует 80 мг тафамидиса меглюмина. Тафамидис и тафамидис меглюмин не являются взаимозаменяемыми в пересчёте на мг. Относительная биодоступность тафамидиса 61 мг сходна с тафамидиса меглюмином 80 мг в равновесном состоянии (см. раздел «Фармакокинетика»), Однократная пероральная сверхтерапевтическая доза 400 мг раствора тафамидиса меглюмина у здоровых добровольцев, как было показано, не приводила к удлинению интервала QTc.
Европейское агентство по лекарственным средствам отклонило требование о представлении результатов исследований с тафамидисом во всех подгруппах пациентов детского возраста при транстиретиновом амилоидозе (см. раздел «Способ применения и дозы» для ознакомления с информацией о применении у детей).
Фармакокинетика
Всасывание
При однократном приёме внутрь одной капсулы препарата Виндамэкс натощак максимальная концентрация в плазме (Cmax) достигалась спустя 4 часа (tmax — медиана времени достижения максимальной концентрации).
Одновременный приём высококалорийной пищи с высоким содержанием жиров снижал скорость, но не степень всасывания. Полученные результаты подтвердили возможность приёма препарата Виндамэкс в независимости от приёма пищи.
Распределение
Тафамидис очень хорошо связывается с белками (>99 %) плазмы крови. Наблюдаемый равновесный объём распределения тафамидиса составляет 18,5 литра.
Степень связывания тафамидиса с белками плазмы крови была оценена в исследованиях с плазмой крови животных и человека. Сродство тафамидиса к TTR выше, чем к альбумину. В результате тафамидис преимущественно связывается с TTR, несмотря на то, что концентрация альбумина в плазме крови (600 мкМ) значительно превышает концентрацию TTR (3,6 мкМ).
Метаболизм и выведение
Однозначное подтверждение того, что тафамидис выводится у .человека с желчью, отсутствует, однако на основании результатов доклинических исследований предполагается, что метаболизм тафамидиса протекает путём глюкуронирования с последующим выведением с желчью. Этот путь метаболизма и выведения наиболее вероятен для человека, так как примерно 59 % от всей принятой дозы обнаруживается в фекалиях и примерно 22 % обнаруживается в моче. Исходя из результатов популяционного фармакокинетического анализа, кажущийся пероральный клиренс тафамидиса составляет 0,263 л/ч, а средний период полувыведения для популяции — приблизительно 49 часов.
Линейность по дозе и времени
Воздействие приёма однократной суточной дозы тафамидиса меглюмина увеличивалось с увеличением однократной дозы до 480 мг и многократных доз до 80 мг в сутки. В целом, увеличение было пропорционально или почти пропорционально дозе, и клиренс тафамидиса был постоянным на протяжении времени.
Относительная биодостпуность тафамидиса 61 мг сходна с биодоступностью тафамидиса меглюмина 80 мг в равновесном состоянии. Тафамидис и тафамидис меглюмин не являются взаимозаменяемыми в пересчёте на мг.
Фармакокинетические параметры были схожими после однократного и многократного приёма тафамидиса меглюмина в дозе 20 мг, что указывает на отсутствие индукции или ингибирования метаболизма тафамидиса.
Результаты однократного ежедневного приёма перорального раствора тафамидиса меглюмина в дозе от 15 до 60 мг в течение 14 дней продемонстрировали достижение равновесного (ss) состояния в 14 день.
Применение в особых популяциях
Пациенты пожилого возраста: по результатам популяционного фармакокинетического анализа у пациентов в возрасте 65 лет и старше расчётный кажущийся пероральный клиренс препарата в равновесном состоянии был в среднем на 15 % ниже, чем у пациентов младше 65 лет. Однако такое различие в клиренсе вызывает увеличение на <20 % средних значений Cmax и AUC в сравнении с более молодыми людьми и не является клинически значимым.
Пациенты с нарушениями функции почек: применение препарата Виндамэкс у пациентов с нарушениями функции почек специально не изучалось. Влияние клиренса креатинина на фармакокинетику (ФК) тафамидиса было изучено в популяционном фармакокинетическом анализе у пациентов с клиренсом креатинина >18 мл/мин. При вычислении фармакокинетических показателей не было выявлено никаких различий кажущегося перорального клиренса тафамидиса между пациентами с клиренсом креатинина <80 мл/мин и пациентами с клиренсом креатинина ≥80 мл/мин. У пациентов с нарушениями функции почек коррекция дозы препарата не требуется.
Пациенты с нарушениями функции печени: Фармакокинетические данные указывали на снижение системной экспозиции (примерно на 40 %) и повышение общего клиренса (0,52 л/ч по сравнению с 0,31 л/ч) тафамидиса меглюмина у людей с нарушениями функции печени средней степени (7–9 баллов по шкале Чайлда-Пью включительно) по сравнению со здоровыми людьми, что было связано с более высокой концентрацией несвязанной фракции тафамидиса. Поскольку у пациентов с нарушениями функции печени средней степени концентрации TTR снижены в сравнении со здоровыми людьми, коррекция дозировки не требуется, так как стехиометрии тафамидиса с его белком-мишенью (TTR) будет достаточно для стабилизации тетрамера TTR. Информация об экспозиции препарата Виндамэкс у пациентов с нарушениями функции печени тяжёлой степени отсутствует.
Взаимосвязь параметров фармакокинетики и фармакодинамики
Данные исследований in vitro показали, что тафамидис не оказывает значительного ингибирующего влияния на ферменты CYP1A2, CYP3A4, CYP3A5, CYP2B6, CYP2C8, CYP2C9, CYP2C19 и CYP2D6 цитохрома Р450. Ожидается, что тафамидис не будет вступать в клинически значимые межлекарственные взаимодействия, обусловленные индукцией CYP1A2, CYP2B6 или CYP3A4.
Исследования in vitro указывают на то, что маловероятно, что тафамидис будет вступать в межлекарственные взаимодействия при клинически значимых концентрациях с субстратами УДФ-глюкуронозилтрансферазы (UGT) на системном уровне. Тафамидис может ингибировать активность UGT 1А1 в кишечнике.
Тафамидис продемонстрировал низкий потенциал к ингибированию белка множественной лекарственной устойчивости (Multi-Drug Resistant Protein — MDR1) (также известного как Р-гликопротеин; P-gp) на системном уровне и в желудочно-кишечном (ЖК) тракте, переносчика органических катионов 2 (organic cation transporter 2 — ОСТ2), переносчика экструзии лекарственных препаратов и токсинов 1 (multidrug and toxin extrusion transporter 1 — MATE1) и MATE2K, полипептидного переносчика органических анионов 1В1 (organic anion transporting polypeptide 1B1 — OATP1B1) и OATP1B3 при клинически значимых концентрациях.
Показания
Препарат Виндамэкс показан для лечения транстиретинового амилоидоза, обусловленного транстиретином дикого типа или наследственной формой заболевания, у взрослых пациентов с кардиомиопатией (ATTR-КМП).
Противопоказания
Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, входящих в состав препарата.
С осторожностью
Препарат Виндамэкс следует применять с осторожностью у пациентов с нарушением функции печени тяжёлой степени.
Применение при беременности и в период грудного вскармливания
Женщины, способные к деторождению
Женщины, способные к деторождению, должны использовать эффективные методы контрацепции в период лечения препаратом Виндамэкс и, вследствие продолжительного периода полувыведения, в течение одного месяца после завершения лечения.
Беременность
Данные по применению препарата Виндамэкс у беременных женщин отсутствуют. Исследования на животных показали эмбриофетальную токсичность. Препарат Виндамэкс не рекомендуется применять во время беременности, а также женщинам способным к деторождению, и не использующих контрацептивы.
Период грудного вскармливания
Доступные данные у животных показали, что тафамидис проникает в грудное молоко. Нельзя исключить риск для новорождённого/младенца. Препарат Виндамэкс не следует принимать во время грудного вскармливания.
Фертильность
В доклинических исследованиях отрицательного влияния на репродуктивную функцию не наблюдалось.
Способ применения и дозы
Лечение следует начинать под контролем врача, имеющего опыт оказания медицинской помощи пациентам с амилоидозом или кардиомиопатией.
Если у пациента имеется специфический медицинский анамнез или признаки сердечной недостаточности или кардиомиопатии, этиологический диагноз должен устанавливаться врачом, обладающим знаниями по оказанию медицинской помощи пациентам с амилоидозом или кардиомиопатией, для того, чтобы подтвердить ATTR-КМП и исключить AL-амилоидоз до начала приёма тафамидиса при помощи соответствующих инструментов оценки, таких как сцинтиграфия с остеотропными радиофармацевтическими препаратами и анализы крови/мочи и/или гистологическое исследование биоптатов, а также генотипирование транстиретина (ТТР) для того, чтобы охарактеризовать процесс как дикий тип или наследственный.
Режим дозирования
Рекомендуемая доза препарата Виндамэкс составляет одну капсулу 61 мг тафамидиса внутрь один раз в сутки.
Способ применения
Для приёма внутрь.
Капсулы следует глотать целиком, не измельчая и не разрезая. Препарат Виндамэкс можно принимать в независимости от приёма пищи.
Виндамэкс 61 мг (тафамидис) соответствует 80 мг тафамидиса меглюмина. Тафамидис и тафамидис меглюмин не являются взаимозаменяемыми в пересчёте на мг.
Применение Виндамэкса следует начинать как можно раньше в течение заболевания, когда клиническая польза в отношении прогрессирования заболевания может быть более очевидной. В то же время, если обусловленное амилоидом повреждение сердца является более выраженным, как в случае класса III по NYHA, решение о начале или продолжении терапии должно приниматься на усмотрение врача, обладающего знаниями по оказанию медицинской помощи пациентам с амилоидозом или кардиомиопатией. Имеются ограниченные клинические данные у пациентов с классом IV по NYHA.
Если после приёма препарата возникает рвота, и в рвотных массах обнаруживается неповреждённая капсула Виндамэкса, то при возможности следует принять дополнительную дозу Виндамэкса. Если капсула не обнаружена, то нет необходимости принимать дополнительную дозу и следует вернуться к обычному режиму приёма препарата на следующий день.
Особые группы пациентов
Применение у детей
Значимые данные по применению препарата Виндамэкс у пациентов детского возраста отсутствуют. Препарат Виндамэкс не следует применять у пациентов детского возраста в связи с отсутствием данных.
Применение у пациентов пожилого возраста
У пациентов пожилого возраста (в возрасте ≥65 лет) коррекции дозы препарата не требуется (смотрите раздел «Фармакокинетика»).
Применение у пациентов с нарушением функции почек или печени
У пациентов с нарушениями функции почек или с нарушениями функции печени лёгкой или средней степени коррекции дозы препарата не требуется. Доступны ограниченные данные о пациентах с тяжёлым нарушением функции почек (при клиренсе креатинина меньше или равном 30 мл/мин). Применение препарата Виндамэкс не изучалось у пациентов с тяжёлыми нарушениями функции печени, поэтому его следует применять с осторожностью в этой группе пациентов.
Побочное действие
Резюме профиля безопасности
В данных по безопасности отражён уровень воздействия у 176 пациентов с ATTR-КМП, которые получали по 80 мг (которые принимались как 4 × 20 мг) тафамидиса меглюмина ежедневно в 30-месячном плацебо-контролируемом исследовании у пациентов с установленным диагнозом ATTR-КМП.
Частота нежелательных явлений у пациентов, получавших лечение с применением 80 мг тафамидиса меглюмина, была сходной и сопоставимой с плацебо.
О следующих нежелательных явлениях сообщалось чаще у пациентов, получавших лечение тафамидисом меглюмином в дозе 80 мг, в сравнении с плацебо: метеоризм [8 пациентов (4,5%) в сравнении с 3 пациентами (1,7%)] и повышение значений функциональных печёночных проб [6 пациентов (3,4 %) в сравнении с 2 пациентами (1,1 %)]. Причинно- следственная связь не была установлена.
Виндамэкс 61 мг (тафамидис) соответствует 80 мг тафамидиса меглюмина. Тафамидис и тафамидис меглюмин не являются взаимозаменяемыми в пересчёте на мг. Данные по безопасности для тафамидиса 61 мг недоступны, так как эта лекарственная форма не оценивалась в двойном слепом плацебо-контролируемом рандомизированном исследовании фазы 3.
Передозировка
Симптомы
Объём клинических данных о случаях передозировки препаратом минимален. В ходе клинических испытаний два пациента с диагнозом ATTR-КМП случайно приняли одну дозу тафамидиса меглюмина 160 мг, не испытав при этом каких-либо нежелательных явлений. В клинических исследованиях у здоровых добровольцев наивысшая доза тафамидиса меглюмина составляла 480 мг однократно. При приёме этой дозы было зарегистрировано одно нежелательное явление, связанное с лечением в виде гордеолума лёгкой степени тяжести.
Лечение
В случае передозировки следует при необходимости принять стандартные меры поддерживающей терапии.
Взаимодействие с другими лекарственными средствами
В ходе клинического исследования среди здоровых добровольцев тафамидис меглюмин в дозировке 20 мг не индуцировал и не ингибировал изофермент CYP3A4 системы цитохрома Р450.
В исследованиях in vitro тафамидис ингибирует эффлюксный переносчик BCR.P (белок резистентности рака молочной железы (breast cancer resistant protein)) при дозе тафамидиса 61 мг/сутки при ИК50 на уровне 1,16 мкМ, а также может вызывать межлекарственные взаимодействия при клинически значимых концентрациях с субстратами этого переносчика (например, метотрексат, розувастатин, иматиниб).
В клиническом исследовании среди здоровых участников экспозиция розувастатина, субстрата BCRP, увеличивалась примерно в 2 раза после многократного ежедневного приёма 61 мг тафамида.
Аналогичным образом тафамидис ингибирует активность переносчиков захвата ОАТ1 и ОАТЗ (переносчики органических анионов) при ИК50 на уровне 2,9 мкМ и 2,36 мкМ соответственно; и при клинически значимых концентрациях он может вызывать межлекарственные взаимодействия с субстратами этих переносчиков (например, с нестероидными противовоспалительными препаратами, буметанидом, фуросемидом, ламивудином, метотрексатом, осельтамивиром, тенофовиром, ганцикловиром, адефовиром, цидофовиром, зидовудином и зальцитабином). На основании данных in vitro максимальные прогнозируемые изменения в AUC субстратов ОАТ1 и ОАТЗ, по результатам определений, были менее 1,25 для дозы 61 мг тафамидиса, следовательно, ожидается, что ингибирование тафамидисом переносчиков OAT1 или OAT3 не будет приводить к клинически значимым взаимодействиям.
Исследования лекарственного взаимодействия тафамидиса с другими лекарственными препаратами не проводились.
Отклонения от нормы результатов лабораторных исследований
Тафамидис может снижать сывороточные концентрации общего тироксина без сопутствующего изменения свободного тироксина (Т4) или тиреотропного гормона (ТТГ). Это наблюдение в отношении общих значений тироксина, вероятно, может быть результатом снижения связывания тироксина с транстиретином (TTR) или его вытеснения из-за высокой аффинности связывания тафамидиса с рецептором тироксина TTR. Никаких соответствующих клинических результатов, соответствующих дисфункции щитовидной железы, не наблюдалось.
Особые указания
Женщинам, способным к деторождению, следует использовать надлежащие методы контрацепции в период приёма тафамидиса и продолжить применение надлежащего метода контрацепции на протяжении 1 месяца после прекращения лечения тафамидисом (см. раздел «Применение при беременности и в период грудного вскармливания»).
Тафамидис следует добавить к стандарту оказания медицинской помощи для пациентов с транстиретиновым амилоидозом. Врачам следует проводить наблюдение за пациентами и продолжать оценивать потребность пациента в ином лечении, включая необходимость трансплантации органа, как часть стандарта оказания медицинской помощи. В связи с отсутствием доступных данных в отношении применения тафамидиса при трансплантации органов, применение тафамидиса следует прекращать у пациентов, которым проводится трансплантация органа.
Может возникать повышение показателей функциональных печёночных проб и снижение уровня тироксина (см. раздел «Взаимодействие с другими лекарственными средствами» и «Побочное действие»).
Этот лекарственный препарат содержит не более 44 мг сорбитола в каждой капсуле. Сорбитол является источником фруктозы.
Следует учитывать аддитивный эффект принимаемых одновременно препаратов, содержащих сорбитол (или фруктозу), а также потребление сорбитола (или фруктозы) с пищей.
Содержание сорбитола в лекарственных препаратах для перорального применения может повлиять на биодоступность других лекарственных препаратов для перорального применения при одновременном применении.
Влияние на способность управлять транспортными средствами, механизмами
На основании фармакодинамического и фармакокинетического профиля можно полагать, что тафамидис не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Капсулы, 61 мг.
По 10 капсул в блистере ПВХ/ПА/Ал/ПВХ с подложкой из Ал/ПЭТ/бумаги.
3 блистера по 10 капсул вместе с инструкцией по применению помещают в картонную пачку с контролем первого вскрытия.
Хранение
Хранить при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять препарат по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
AndersonBrecon (UK) Limited, Великобритания
Catalent Pharma Solutions LLC, США
AndersonBrecon Inc., США
Юридическое лицо, на имя которого выдано регистрационное удостоверение
Пфайзер Инк., США
235 Ист 42-ая Стрит, Нью-Йорк, штат Нью-Йорк, 10017, США
Производитель
Каталент Фарма Солюшнз ЭлЭлСи, США
2725 Шерер Драйв Норт, Ст. Петербург, Флорида, 33716-1016, США
Выпускающий контроль качества
Андерсонбрекон (ЮК) Лимитед, Соединенное Королевство
Блоки 2-7, Уай Вэлли Бизнес Парк, Брекон Роуд, Хэй-Он-Уай, Херефорд, HR3 5PG, Соединенное Королевство
Претензии потребителей направлять по адресу ООО «Пфайзер Инновации»
123112 Москва, Пресненская наб., д. 10, БЦ «Башня на Набережной» (Блок С)
Телефон: +7 (495) 287-5000
Факс: +7 (495) 287-5300/287-5067
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Виндамэкс:
