Убрелви
Лекарственная форма
таблетки для приёма внутрь
Листок-вкладыш — информация для пациента
Убрелви®
(Уброгепант) таблетки для приёма внутрь
ОСНОВНЫЕ ПОЛОЖЕНИЯ ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Эти основные положения содержат не всю информацию, необходимую для безопасного и эффективного использования препарата Убрелви. Смотрите полную инструкцию по применению лекарственного препарата Убрелви.
Убрелви® (уброгепант) таблетки для перорального применения Первоначально одобрен для применения в США: 2019 г.
ПОСЛЕДНИЕ СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ
Предостережения и меры предосторожности (5.2, 5.3) март 2025 г.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Убрелви — это антагонист рецептора кальцитонин-ген-связанного пептида, который показан для неотложного лечения мигрени с аурой или без неё у взрослых. (1)
Ограничения применения
Препарат Убрелви не показан для профилактического лечения мигрени.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
- Рекомендуемая доза составляет 50 мг или 100 мг перорально, по мере необходимости. (2.1)
- При необходимости вторую дозу можно принять не менее чем через 2 часа после приёма первой дозы. (2.1)
- Максимальная доза за 24-часовой период составляет 200 мг. (2.1) • Тяжёлая печёночная или тяжёлая почечная недостаточность: Рекомендованная доза составляет 50 мг; при необходимости вторую дозу 50 мг можно принять по меньшей мере через 2 часа после приёма первой дозы. (2.2, 8.6, 8.7)
ЛЕКАРСТВЕННЫЕ ФОРМЫ И ДОЗИРОВКИ
Таблетки: 50 мг и 100 мг. (3)
ПРОТИВОПОКАЗАНИЯ
- Сопутствующее применение с сильными ингибиторами CYP3A4. (4)
- Наличие в анамнезе серьёзной гиперчувствительности к уброгепанту или любому компоненту препарата Убрелви. (4)
ПРЕДОСТЕРЕЖЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
- Реакции гиперчувствительности. При возникновении серьёзной реакции гиперчувствительности следует прекратить приём препарата Убрелви и начать соответствующее лечение. Тяжёлые реакции гиперчувствительности включали анафилактическую реакцию и одышку. Эти реакции могут возникать в течение нескольких минут, часов или дней после приёма препарата. (5.1)
- Гипертензия. Может впервые возникнуть гипертензия или усугубиться уже имеющаяся гипертензия. (5.2)
- Болезнь Рейно. Может впервые возникнуть болезнь Рейно или усугубиться уже имеющаяся болезнь Рейно. (5.3)
НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
Наиболее частыми нежелательными реакциями (как минимум 2 % и более, чем в группе плацебо) являются тошнота и сонливость. (6.1) Чтобы сообщить о ПРЕДПОЛАГАЕМЫХ НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ, обращайтесь в компанию «ЭббВи Инкорпорейтед» по телефону 1-800-678-1605 или в Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) по телефону 1-800-FDA-1088 или через веб-сайт www.fda.gov/medwatch.
МЕЖЛЕКАРСТВЕННОЕ ВЗАИМОДЕЙСТВИЕ
- Сильные индукторы CYP3A4: следует избегать, поскольку сопутствующее применение приведет к снижению экспозиции уброгепанта. (2.2, 7.2)
- Дополнительные изменения дозы для умеренных или слабых ингибиторов и индукторов CYP3A4 или ингибиторов BCRP и/или только P-gp см. в разделе 2.2. (7.1, 7.2, 7.3)
ПРИМЕНЕНИЕ У ОСОБЫХ КАТЕГОРИЙ ПАЦИЕНТОВ
- Беременность: на основании данных, полученных в исследованиях на животных, может нанести вред плоду. (8.1)
- Избегайте применения у пациентов с терминальной стадией почечной недостаточности. (8.7)
В разделе 17 см. ИНФОРМАЦИЮ ДЛЯ КОНСУЛЬТИРОВАНИЯ ПАЦИЕНТА и информацию о лекарственном препарате для пациента, одобренную FDA.
Пересмотрено: июнь 2025 г.
ПОЛНАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА:
СОДЕРЖАНИЕ* 1 ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
2 СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
2.1 Рекомендуемая доза
2.2 Изменение дозы
3 ЛЕКАРСТВЕННЫЕ ФОРМЫ И ДОЗИРОВКИ
4 ПРОТИВОПОКАЗАНИЯ
5 ПРЕДОСТЕРЕЖЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ5.1 Реакции гиперчувствительности
5.2 Гипертензия
5.3 Болезнь Рейно
6 НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
6.1 Результаты клинических исследований
6.2 Опыт пострегистрационного применения
7 МЕЖЛЕКАРСТВЕННОЕ ВЗАИМОДЕЙСТВИЕ
7.1 Ингибиторы CYP3A4
7.2 Индукторы CYP3A4
7.3 Ингибиторы BCRP и/или только P-gp
8 ПРИМЕНЕНИЕ У ОСОБЫХ КАТЕГОРИЙ ПАЦИЕНТОВ8.1 Беременность
8.2 Грудное вскармливание
8.4 Применение у детей
8.5 Применение у пациентов пожилого возраста
8.6 Нарушение функции печени
8.7 Нарушение функции почек
10 ПЕРЕДОЗИРОВКА
11 ОПИСАНИЕ
12 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
12.1 Механизм действия
12.2 Фармакодинамика
12.3 Фармакокинетика
13 ДОКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ
13.1 Канцерогенез, мутагенез, нарушение репродуктивной функции
14 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
16 ФОРМА ВЫПУСКА, УСЛОВИЯ ХРАНЕНИЯ ПРЕПАРАТА И ОБРАЩЕНИЕ С НИМ
16.1 Форма выпуска
16.2 Условия хранения препарата и обращение с ним
17 ИНФОРМАЦИЯ ДЛЯ КОНСУЛЬТИРОВАНИЯ ПАЦИЕНТА* Разделы и подразделы, не включённые в полную инструкцию по применению лекарственного препарата, опущены.
Полная инструкция по применению лекарственного препарата
1. Показания к применению
Препарат Убрелви показан для неотложного лечения мигрени у взрослых с аурой или без неё.
Ограничения применения
Препарат Убрелви не показан для профилактического лечения мигрени.
2. Способ применения и дозы
2.1 Рекомендуемая доза
Рекомендуемая доза препарата Убрелви составляет 50 мг или 100 мг, принимается перорально независимо от приёма пищи.
При необходимости вторую дозу можно принять не менее чем через 2 часа после приёма первой дозы. Максимальная доза за 24-часовой период составляет 200 мг. Безопасность лечения более 8 эпизодов мигрени в течение 30-дневного периода не установлена.
2.2 Изменение дозы
Изменения дозы при сопутствующем применении определённых препаратов и для пациентов с нарушением функции печени и почек представлены в таблице 1.
Таблица 1. Изменение дозы при межлекарственных взаимодействиях и для особых категорий пациентов
| Изменение дозы | Первая доза | Вторая дозаa (по необходимости) |
| Сопутствующие лекарственные препараты[см. «Межлекарственное взаимодействие» (7)] | ||
| Умеренные ингибиторы CYP3A4 (7.1) | 50 мг | Избегайте втечение 24 часов |
| Слабые ингибиторы CYP3A4 (7.1) | 50 мг | 50 мг |
| Сильные индукторы CYP3A4 (7.2) | Избегайте сопутствующего применения | |
| Слабые и умеренные индукторы CYP3A4 (7.2) | 100 мг | 100 мг |
| Ингибиторы BCRP и/или только P-gp (7.3) | 50 мг | 50 мг |
| Особые категории пациентов[см. «Применение у особых категорий пациентов» (8)] | ||
| Тяжёлая печёночная недостаточность (класс С по классификации Чайлда–Пью) (8.6) | 50 мг | 50 мг |
| Тяжёлая почечная недостаточность (клиренскреатинина [КК] 15–29 мл/мин) (8.7) | 50 мг | 50 мг |
| Терминальная стадия почечнойнедостаточности (КК < 15 мл/мин) (8.7) | Избегать использования | |
a Вторую дозу можно принять не менее чем через 2 часа после приёма первой дозы
3. Лекарственные формы и дозировки
Препарат Убрелви 50 мг выпускается в виде двояковыпуклых таблеток в форме капсул белого или почти белого цвета с гравировкой «U50» на одной стороне.
Препарат Убрелви 100 мг выпускается в виде двояковыпуклых таблеток в форме капсул белого или почти белого цвета с гравировкой «U100» на одной стороне.
4. Противопоказания
Препарат Убрелви противопоказан:
- При сопутствующем применении сильных ингибиторов CYP3A4 [см. «Межлекарственное взаимодействие» (7.1)]
- У пациентов с наличием в анамнезе серьёзной гиперчувствительности к уброгепанту или любому компоненту препарата Убрелви. Реакции включали анафилактическую реакцию, одышку и отёк лица или горла [см. «Предостережения и меры предосторожности» (5.1)]
5. Меры предосторожности
ПРЕДОСТОРОЖНОСТИ
5.1 Реакции гиперчувствительности
При применении препарата Убрелви были зарегистрированы реакции гиперчувствительности, включая анафилактическую реакцию, одышку, отёк лица или горла, сыпь, зуд и крапивницу. Реакции гиперчувствительности могут возникать через несколько минут, часов или дней после приёма препарата. Большинство реакций возникали в течение нескольких часов после приёма препарата и не были серьёзными, а некоторые реакции привели к прекращению лечения. В случае развития серьёзной или тяжёлой реакции гиперчувствительности следует прекратить применение препарата Убрелви и начать соответствующее лечение [см. «Противопоказания» (4) и «Нежелательные реакции» (6.2)].
5.2 Гипертензия
После применения антагонистов CGRP, в том числе Убрелви, в условиях пострегистрационного применения сообщалось о развитии гипертензии и усугублении уже имеющейся гипертензии. У некоторых пациентов, у которых впервые зарегистрирована гипертензия, имелись факторы риска развития гипертензии. Были зарегистрированы случаи, требующие начала медикаментозного лечения гипертензии и, в некоторых случаях, госпитализации. Гипертензия может возникать в любое время в ходе лечения, но чаще всего регистрировалась в течение 7 дней после начала терапии. Антагонист CGRP был отменён во многих из зарегистрированных случаев.
Следует наблюдать за пациентами, получающими лечение препаратом Убрелви, на предмет развития гипертензии или усугубления уже имеющейся гипертензии и рассмотреть целесообразность отмены Убрелви, если оценка не позволяет установить альтернативную этиологию или артериальное давление недостаточно контролируется.
5.3 Болезнь Рейно
В условиях пострегистрационного применения после применения антагонистов CGRP, в том числе Убрелви, сообщалось о развитии болезни Рейно и рецидиве или усугублении уже имеющейся болезни Рейно. В зарегистрированных случаях при применении низкомолекулярных антагонистов CGRP медиана начала симптомов составляла 1,5 дня после введения препарата. Во многих случаях сообщалось о серьёзных исходах, включая госпитализации и потерю трудоспособности, которые, как правило, были связаны с изнуряющей болью. В большинстве зарегистрированных случаев отмена антагониста CGRP приводила к разрешению симптомов.
При развитии признаков или симптомов болезни Рейно лечение препаратом Убрелви следует отменить, а при сохранении симптомов пациент должен обратиться к лечащему врачу для обследования. Пациенты с болезнью Рейно в анамнезе должны находиться под наблюдением и должны быть проинформированы о возможности усугубления или рецидива признаков и симптомов.
6. Нежелательные реакции
Следующие клинически значимые нежелательные реакции описаны в других разделах инструкции по применению:
- Реакции гиперчувствительности [см. «Предостережения и меры предосторожности» (5.1)]
- Гипертензия [см. «Предостережения и меры предосторожности» (5.2)]• Болезнь Рейно [см. «Предостережения и меры предосторожности» (5.3)]
6.1 Результаты клинических исследований
Так как клинические исследования различных препаратов проводятся в различных условиях, нельзя напрямую сравнивать частоту развития нежелательных реакций на один препарат с частотой развития нежелательных реакций на другой препарат по результатам клинических исследований; при этом полученные в исследованиях данные могут не отражать частоту реакций, наблюдаемую на практике.
Безопасность препарата Убрелви оценивали у 3624 пациентов, получивших по меньшей мере одну дозу Убрелви. В двух рандомизированных, двойных слепых, плацебо-контролируемых исследованиях фазы 3 с участием взрослых пациентов с мигренью (исследования 1 и 2) в общей сложности 1439 пациентов получали препарат Убрелви 50 мг или 100 мг [см. «Клинические исследования» (14)].Среди пациентов, получавших лечение препаратом Убрелви в этих 2 исследованиях, приблизительно 89 % были женщинами, 82 % принадлежали к европеоидной расе, 15 % — к негроидной расе и 17 % — к латиноамериканской расе. Средний возраст на момент включения в исследование составлял 41 год (диапазон от 18 до 75 лет).
Долгосрочную безопасность оценивали у 813 пациентов, получавших препарат с перерывами в течение периода до 1 года в рамках открытого дополнительного исследования. Пациентам разрешалось лечить до 8 эпизодов мигреней в месяц препаратом Убрелви. Из этих 813 пациентов 421 пациент получал препарат в дозе 50 мг или 100 мг в течение как минимум 6 месяцев, и 364 пациента получали препарат в этих дозах в течение как минимум одного года, при этом все они получали лечение как минимум двух эпизодов мигрени в месяц, в среднем. В этом исследовании препарат Убрелви был отменен из-за нежелательной реакции у 2,5 % пациентов. Наиболее частой нежелательной реакцией, приводящей к прекращению участия в долгосрочном исследовании безопасности, была тошнота.
Нежелательные реакции в исследованиях 1 и 2 представлены в таблице 2. Таблица 2. Нежелательные реакции, возникавшие в исследованиях 1 и 2 с частотой не менее 2 % и чаще, чем в группе плацебо
|
| Плацебо (N = 984) % | Убрелви50 мг (N = 954) % | Убрелви100 мг (N = 485) % |
| Тошнота | 2 | 2 | 4 |
| Сонливость* | 1 | 2 | 3 |
| Сухость во рту | 1 | < 1 | 2 |
*Сонливость включает термины «седация» и «утомляемость», связанные с нежелательными реакциями.
6.2 Опыт пострегистрационного применения
В ходе пострегистрационного применения препарата Убрелви отмечались следующие нежелательные реакции. Данные об этих реакциях получены из добровольных сообщений пациентов. Так как общее количество пациентов, принимавших препарат, неизвестно, невозможно всегда точно рассчитать частоту побочных реакций и определить их причинно-следственную связь с приёмом препарата.
Нарушения со стороны иммунной системы: гиперчувствительность (например, анафилактическая реакция, одышка, отёк лица или горла, сыпь, крапивница, зуд) [см. «Противопоказания» (4) и «Предостережения и меры предосторожности» (5.1)]
Нарушения со стороны сосудов: гипертензия [см. «Предостережения и меры предосторожности» (5.2)], болезнь Рейно [см. «Предостережения и меры предосторожности» (5.3)]
7. Межлекарственное взаимодействие
7.1 Ингибиторы CYP3A4
Совместное применение препарата Убрелви с кетоконазолом, сильным ингибитором CYP3A4, приводило к значительному увеличению экспозиции уброгепанта [см. «Клиническая фармакология» (12.3)]. Препарат Убрелви не следует применять с сильными ингибиторами CYP3A4 (например, кетоконазолом, итраконазолом, кларитромицином) [см. «Противопоказания» (4)].
Совместное применение препарата Убрелви с верапамилом, умеренным ингибитором CYP3A4, приводило к увеличению экспозиции уброгепанта [см. «Клиническая фармакология» (12.3)]. При сопутствующем применении препарата Убрелви и умеренных ингибиторов CYP3A4 (например, циклоспорина, ципрофлоксацина, флуконазола, флувоксамина, грейпфрутового сока) рекомендуется коррекция дозы [см. «Способ применения и дозы» (2.2)].
Специальные исследования межлекарственного взаимодействия с уброгепантом и слабыми ингибиторами CYP3A4 не проводились. При сопутствующем применении препарата Убрелви со слабыми ингибиторами CYP3A4 рекомендуется коррекция дозы [см. «Способ применения и дозы» (2.2)].
7.2 Индукторы CYP3A4
Совместное применение препарата Убрелви с рифампином, сильным индуктором CYP3A4, приводило к значительному снижению экспозиции уброгепанта [см. «Клиническая фармакология» (12.3)]. У пациентов, принимающих сильные индукторы CYP3A4 (например, фенитоин, барбитураты, рифампин, зверобой), ожидается утрата эффективности уброгепанта, и сопутствующего применения следует избегать.
Совместное применение препарата Убрелви с умеренными или слабыми индукторами CYP3A4 не оценивалось в клиническом исследовании. При сопутствующем применении препарата Убрелви и умеренных или слабых индукторов CYP3A4 рекомендуется коррекция дозы [см. «Способ применения и дозы» (2.2)].
7.3 Ингибиторы BCRP и/или только P-gp
Уброгепант является субстратом эффлюксных переносчиков BCRP и P-gp. Применение ингибиторов BCRP и/или только P-gp (например, хинидина, карведилола, элтромбопага, куркумина) может увеличивать экспозицию уброгепанта [см. «Клиническая фармакология» (12.3)]. Клинические исследования межлекарственного взаимодействия с ингибиторами этих переносчиков не проводились. Коррекция дозы рекомендуется при применении ингибиторов BCRP и/или только P-gp [см. «Способ применения и дозы» (2.2)].
8. Применение у особых категорий пациентов
8.1 Беременность
Регистр воздействия при беременности
Существует регистр воздействия при беременности, который отслеживает исходы у женщин, которые забеременели во время приёма препарата Убрелви. Пациентам следует рекомендовать зарегистрироваться, позвонив по телефону 1-833-277-0206 или посетив веб-сайт http://empresspregnancyregistry.com.
Заключение о риске
Достаточные данные о риске для развития плода, связанном с применением препарата Убрелви у беременных женщин, отсутствуют. В исследованиях на животных нежелательные эффекты на внутриутробное развитие наблюдались после введения уброгепанта во время беременности (повышенная внутриутробная смертность у кроликов) или в период беременности и лактации (снижение массы тела у потомства у крыс) в дозах, превышающих используемые в клинических исследованиях, которые были связаны с материнской токсичностью (см. «Данные»).
В общей популяции США расчётный фоновый риск возникновения серьёзных врождённых пороков и выкидышей при клинически признанных беременностях составляет 2–4 % и 15–20 % соответственно. Расчётная частота серьёзных врождённых пороков (2,2–2,9 %) и выкидышей (17 %) у женщин с мигренью аналогична частоте, зарегистрированной у женщин без мигрени.
Клинические соображения
Материнский и (или) внутриутробный риск, ассоциированный с заболеванием
Опубликованные данные свидетельствуют о том, что женщины с мигренью могут подвергаться повышенному риску преэклампсии и гестационной гипертензии во время беременности.
Данные
Данные исследований на животных
Пероральное применение уброгепанта (0, 1,5, 5, 25, 125 мг/кг/сут) у беременных крыс в период органогенеза не приводило к нежелательным эффектам на внутриутробное развитие. Экспозиция в плазме (AUC) при самых высоких дозах приблизительно в 45 раз выше, чем у человека при максимальной рекомендуемой дозе для человека (МРДЧ) 200 мг/сут.
В двух отдельных исследованиях беременным кроликам на протяжении всего периода органогенеза перорально вводили уброгепант (0, 15, 45, 75 или 250 мг/кг/сут). В обоих исследованиях наивысшая исследованная доза (250 мг/кг/сут) была связана с материнской токсичностью. В первом исследовании уброгепант вызывал выкидыш и повышал внутриутробную смертность у выжившего потомства при высокой дозе (250 мг/кг/сут). Во втором исследовании чрезмерная материнская токсичность при применении высокой дозы (250 мг/кг/сут) привела к досрочному завершению исследования и отсутствию данных по плодам для этой дозовой группы. При дозе, не вызывающей нежелательного воздействия на внутриутробное развитие у кроликов (75 мг/кг/сут), экспозиция в плазме (AUC) была приблизительно в 8 раз выше, чем у человека при МРДЧ.
Пероральное введение уброгепанта (0, 25, 60 или 160 мг/кг/сут) крысам на протяжении всего периода беременности и лактации приводило к снижению массы тела потомства при рождении и в период лактации при средней и высокой дозах, что было связано с материнской токсичностью. При дозе, не вызывающей нежелательных эффектов на пре- и постнатальное развитие у крыс (25 мг/кг/сут), экспозиция в плазме (AUC) была приблизительно в 15 раз выше, чем у человека при МРДЧ.
8.2 Грудное вскармливание
Заключение о риске
Данные исследования при лактации с участием двенадцати здоровых взрослых женщин указывают на то, что уброгепант выделяется в грудное молоко в небольших количествах. Расчетная относительная доза для младенца составляет приблизительно 0,15 % от дозы матери, скорректированной по массе тела, а соотношение концентраций в молоке/ плазме составляет 0,23 (см. раздел «Данные»). Данные о влиянии уброгепанта на детей, получающих грудное вскармливание, или на выработку молока отсутствуют. Следует учитывать пользу грудного вскармливания для развития и здоровья, а также клиническую потребность матери в препарате Убрелви и любые потенциальные нежелательные эффекты на ребёнка на грудном вскармливании, связанные с препаратом Убрелви или основным заболеванием матери.
Данные
Исследование проводилось с участием двенадцати здоровых взрослых женщин в возрасте от 24 до 34 лет, в период от 1 до 6 месяцев после родов, у которых наблюдалась лактация. Каждой испытуемой однократно перорально давали уброгепант в дозе 100 мг. Образцы плазмы крови и грудного молока матери собирали в течение 24 часов после приёма препарата. При использовании расчётного потребления молока младенцами в объёме 150 мл/ кг/сут средняя расчётная относительная доза для младенца составляла приблизительно 0,15 % от дозы, скорректированной по массе тела матери. Среднее соотношение концентраций молоко-плазма составило 0,23. Во время исследования у всех пациенток обнаруживались уровни уброгепанта в грудном молоке; через 16–24 часа после приёма препарата уброгепант в грудном молоке обнаруживался у 17 % женщин в исследовании. Среднее совокупное количество уброгепанта, выделяемого с грудным молоком в течение 24 часов, составляло менее 0,02 мг при дозе 100 мг.
8.4 Применение у детей
Безопасность и эффективность применения препарата у пациентов детского возраста не установлена.
8.5 Применение у пациентов пожилого возраста
Фармакокинетические исследования указывают на отсутствие клинически значимых фармакокинетических различий между пожилыми и более молодыми пациентами. Клинические исследования препарата Убрелви не включали достаточное количество пациентов в возрасте 65 лет и старше для определения отличий в ответе на лечение по сравнению с молодыми пациентами. В целом, следует проявлять осторожность при выборе дозы для пожилого пациента, как правило, рекомендуется начинать с нижней границы диапазона доз.
8.6 Нарушение функции печени
У пациентов с ранее существовавшими лёгкими (класс А по классификации Чайлда–Пью), умеренными (класс В по классификации Чайлда–Пью) или тяжёлыми нарушениями функции печени (класс С по классификации Чайлда–Пью) общая экспозиция уброгепанта увеличилась на 7 %, 50 % и 115 % соответственно. Пациентам с нарушением функции печени лёгкой или умеренной степени коррекция дозы не рекомендуется. Пациентам с тяжёлым нарушением функции печени рекомендуется коррекция дозы препарата Убрелви [см. «Способ применения и дозы» (2.2)].
8.7 Нарушение функции почек
Почечный путь выведения играет незначительную роль в клиренсе уброгепанта [см. «Клиническая фармакология» (12.3)].Пациентам с нарушением функции почек лёгкой или умеренной степени коррекция дозы не требуется. Пациентам с тяжёлым нарушением функции почек (КК 15–29 мл/мин) рекомендуется коррекция дозы [см. «Способ применения и дозы» (2.2) и «Клиническая фармакология» (12.3)]. Следует избегать применения препарата Убрелви у пациентов с терминальной стадией почечной недостаточности (ТСПН) (КК < 15 мл/мин).
10. ПЕРЕДОЗИРОВКА
Период полувыведения уброгепанта составляет приблизительно 5–7 часов; поэтому мониторинг пациентов после передозировки препаратом Убрелви должен продолжаться в течение как минимум 24 часов, или пока сохраняются симптомы или признаки.
11. ОПИСАНИЕ
Активным ингредиентом препарата Убрелви является уброгепант, антагонист рецептора кальцитонин-ген-связанного пептида (CGRP). Химическое наименование уброгепанта — (3’S)-N-[(3S,5S,6R)-6-метил-2- оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил]-2’-оксо-1’,2’,5,7- тетрагидроспиро[циклопента[b]пиридин-6,3’-пирроло[2,3-b]пиридин]-3- карбоксамид, и он имеет следующую структурную формулу:
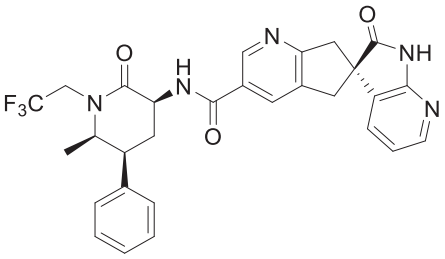
Молекулярная формула — C29H26F3N5O3, молекулярная масса составляет 549,6. Уброгепант представляет собой порошок белого или почти белого цвета. Он легко растворим в этаноле, метаноле, ацетоне и ацетонитриле и практически нерастворим в воде.
Препарат Убрелви выпускается в виде таблеток для перорального применения, содержащих 50 мг или 100 мг уброгепанта. Вспомогательные вещества включают коллоидный диоксид кремния, кроскармеллозу натрия, маннитол, микрокристаллическую целлюлозу, сополимер поливинилпирролидона и винилацетата, хлорид натрия, стеарилфумарат натрия и витамин Е полиэтиленгликоль сукцинат.
12. Клиническая фармакология
12.1 Механизм действия
Уброгепант — антагонист рецептора кальцитонин-ген-связанного пептида.
12.2 Фармакодинамика
Кардиоэлектрофизиология
Препарат Убрелви не удлиняет интервал QT в какой-либо клинически значимой степени в дозе, в 2 раза превышающей максимальную рекомендуемую суточную дозу.
12.3 Фармакокинетика
Всасывание
После перорального введения препарата Убрелви уброгепант всасывается с достижением пиковых концентраций в плазме приблизительно через 1,5 часа. Уброгепант демонстрирует дозопропорциональную фармакокинетику в пределах рекомендуемого диапазона доз [см. «Способ применения и дозы» (2.1)].
Влияние пищи
При приёме препарата Убрелви с пищей с высоким содержанием жиров время достижения максимальной концентрации уброгепанта в плазме было отсрочено на 2 часа и привело к снижению Cmax на 22 % без изменения AUC. В исследованиях клинической эффективности препарат Убрелви применялся независимо от приёма пищи [см. «Способ применения и дозы» (2.1)].
Распределение
Связывание уброгепанта с белками плазмы составляет 87 % in vitro. Средний кажущийся центральный объём распределения уброгепанта (V/F) после перорального приёма однократной дозы составляет приблизительно 350 л. Выведение
Метаболизм
Уброгепант выводится главным образом посредством метаболизма, в основном с помощью CYP3A4. Исходное соединение (уброгепант) и 2 метаболита глюкуронидного конъюгата были наиболее распространёнными
циркулирующими компонентами в плазме крови человека. Предполагается, что метаболиты глюкуронида не будут вносить вклад в фармакологическую активность уброгепанта, поскольку в анализе связывания с рецепторами CGRP они были примерно в 6000 раз менее активными.
Экскреция
Период полувыведения уброгепанта составляет приблизительно 5–7 часов. Средний кажущийся клиренс при пероральном приёме (CL/F) уброгепанта составляет приблизительно 87 л/ч. Уброгепант выводится главным образом с желчью/калом, в то время как почечный путь является незначительным путём выведения. После однократного перорального приёма [14C]-уброгепанта здоровыми добровольцами мужского пола 42 % и 6 % дозы выводилось в виде неизменённого уброгепанта с калом и мочой соответственно.
Особые категории пациентов
Пациенты с нарушением функции почек
Популяционный фармакокинетический анализ, основанный на объединённых данных клинических исследований, использовался для оценки влияния нарушения функции почек, характеризуемого на основании расчётного клиренса креатинина (КК) по формуле Кокрофта–Голта (C-G). Нарушение функции почек не приводило к значимым различиям в фармакокинетике уброгепанта у пациентов с нарушением функции почек лёгкой или умеренной степени (КК 30–89 мл/мин) по сравнению с пациентами с нормальной функцией почек (КК > 90 мл/мин). Пациенты с тяжёлой почечной недостаточностью или ТСПН (рСКФ < 30 мл/мин) не изучались. Коррекция дозы у пациентов с тяжёлым нарушением функции почек (КК 15–29 мл/ мин) рекомендуется на основании информации о ADME и консервативного предположения о том, что тяжёлое нарушение функции почек вряд ли вызовет более чем двукратное увеличение экспозиции уброгепанта [см. «Способ применения и дозы» (2.2)]. Рекомендации по дозированию для пациентов с ТСПН (КК < 15 мл/мин) не предусмотрены.
Пациенты с нарушением функции печени
У пациентов с ранее существовавшими лёгкими (класс А по классификации Чайлда–Пью), умеренными (класс В по классификации Чайлда–Пью) или тяжёлыми нарушениями функции печени (класс С по классификации Чайлда–Пью) общая экспозиция уброгепанта увеличилась на 7 %, 50 % и 115 % соответственно. Пациентам с тяжёлым нарушением функции печени требуется коррекция дозы [см. «Способ применения и дозы» (2.2)].
Другие особые категории пациентов
По данным популяционного фармакокинетического анализа возраст, пол, расовая принадлежность и масса тела не оказывали значимого влияния на фармакокинетику (Cmax и AUC) уброгепанта. Таким образом коррекция дозы на основании этих факторов не требуется.
Межлекарственное взаимодействие
Исследования in vitro
Ферменты
Уброгепант не является ингибитором CYP1A2, 2B6 или 3A4. Уброгепант является слабым ингибитором CYP2C8, 2C9, 2D6, 2C19, MAO-A и UGT1A1. Ожидается, что потенциал ингибирования in vitro не будет клинически значимым. Уброгепант не является индуктором CYP1A2, 2B6 или 3A4 в клинически значимых концентрациях.
Переносчики
Уброгепант является субстратом переносчиков BCRP и P-gp in vitro; поэтому использование ингибиторов BCRP и/или P-gp может увеличить экспозицию уброгепанта. Коррекция дозы при сопутствующем применении препарата Убрелви с ингибиторами BCRP и/или P-gp рекомендуется на основании результатов исследований ADME и клинических взаимодействий с ингибиторами CYP3A4/P-gp, которые показывают наибольшее прогнозируемое потенциальное увеличение экспозиции уброгепанта не более чем в два раза [см. «Способ применения и дозы» (2.2) и «Межлекарственное взаимодействие» (7.3)].
Уброгепант является слабым субстратом OATP1B1, OATP1B3 и OAT1, но не субстратом OAT3. Он не является ингибитором переносчиков P-gp, BCRP, BSEP, MRP3, MRP4, OAT1, OAT3 или NTCP, но является слабым ингибитором переносчиков OATP1B1, OATP1B3 и OCT2. Коррекция дозы требуется только для ингибиторов P-gp или BCRP. Никаких клинических межлекарственных взаимодействий с другими переносчиками при применении препарата Убрелви не ожидается.
Исследования in vivo
Ингибиторы CYP3A4 [см. «Способ применения и дозы» (2.2), «Противопоказания» (4) и «Межлекарственное взаимодействие» (7.1)]: Совместное применение препарата Убрелви с кетоконазолом, сильным ингибитором CYP3A4, приводило к 9,7-кратному и 5,3-кратному увеличению AUCinf и Cmax уброгепанта соответственно.
Совместное применение препарата Убрелви с верапамилом, умеренным ингибитором CYP3A4, приводило к увеличению AUCinf и Cmax уброгепанта приблизительно в 3,5 и 2,8 раза соответственно. Специального исследования лекарственного взаимодействия для оценки сопутствующего применения со слабыми ингибиторами CYP3A4 не проводилось. В соответствии с консервативным прогнозом, при применении слабых ингибиторов CYP3A4 ожидается максимальное потенциальное увеличение экспозиции уброгепанта не более чем в 2 раза.
Индукторы CYP3A4 [см. «Способ применения и дозы» (2.2) и «Межлекарственное взаимодействие» (7.2)]:
Совместное применение препарата Убрелви с рифампином, сильным индуктором CYP3A4, приводило к снижению экспозиции уброгепанта на 80 %. Специальные исследования межлекарственного взаимодействия для оценки сопутствующего применения с умеренными или слабыми индукторами CYP3A4 не проводились. Коррекция дозы при сопутствующем применении препарата Убрелви со слабыми или умеренными индукторами CYP3A4 рекомендуется на основании консервативного прогноза снижения экспозиции уброгепанта на 50 %.
Другие оценки лекарственного взаимодействия.
При применении препарата Убрелви с пероральными контрацептивами (содержащими норгестимат и этинилэстрадиол), ацетаминофеном, напроксеном, суматриптаном, эзомепразолом, эренумабом, галканезумабом или атогепантом значимых фармакокинетических взаимодействий не наблюдалось ни для уброгепанта, ни для сопутствующих препаратов.
13. ДОКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ
13.1 Канцерогенез, мутагенез, нарушение репродуктивной функции
Канцерогенность
Двухлетние исследования канцерогенности уброгепанта при пероральном введении проводились на мышах (0, 5, 15 или 50 мг/кг/сут) и крысах (0, 10, 30 или 100 мг/кг у самцов; 0, 10, 30 или 150 мг/кг у самок). Ни у одного из видов не наблюдалось никаких признаков опухолей, связанных с препаратом. Наивысшая исследованная доза у мышей аналогична максимальной рекомендованной дозе для человека (200 мг/сут) в пересчёте на площадь поверхности тела (мг/м2). Экспозиция в плазме (AUC) при самых высоких дозах, исследованных на крысах, приблизительно в 25 раз выше, чем у человека при максимальной рекомендуемой дозе для человека (МРДЧ) 200 мг/сут.
Мутагенность
В условиях in vitro (тест Эймса, анализ хромосомных аберраций в клетках яичников китайского хомячка) и in vivo (микроядерный тест на клетках костного мозга крыс) уброгепант дал отрицательный результат. Нарушение репродуктивной функции
Пероральное введение уброгепанта (0, 20, 80 или 160 мг/кг/сут) самцам и самкам крыс (которых спаривали с самками и самцами, ранее не получавшими препарат, соответственно) не приводило к нежелательным эффектам на фертильность или репродуктивную функцию. Экспозиция в плазме (AUC) при самой высокой исследованной дозе приблизительно в 30 раз превышала таковую у человека при МРДЧ.
14. Клинические исследования
Эффективность препарата Убрелви при неотложном лечении мигрени была продемонстрирована в двух рандомизированных, двойных слепых, плацебо-контролируемых исследованиях [исследование 1 (NCT02828020) и исследование 2 (NCT02867709)]. В исследовании 1 были рандомизированы пациенты, получавшие плацебо (n = 559) или Убрелви 50 мг (n = 556) или 100 мг (n = 557), а в исследовании 2 — плацебо (n = 563) или Убрелви 50 мг (n = 562). Во всех исследованиях пациентов проинструктировали о необходимости лечения мигрени с интенсивностью головной боли от умеренной до сильной. Вторая доза исследуемого препарата (Убрелви или плацебо) или обычное неотложное лечение мигрени у пациента разрешалось в период от 2 до 48 часов после первоначального лечения не ответившей на лечение или рецидивирующей мигрени. До 23 % пациентов принимали профилактические препараты от мигрени на исходном уровне. Ни один из этих пациентов не принимал сопутствующие профилактические препараты, действующие на путь CGRP.
Первичный анализ эффективности проводился у пациентов, которые лечили эпизод мигрени с умеренной или сильной болью. Эффективность препарата Убрелви была установлена по влиянию на отсутствие боли через 2 часа после введения дозы и на отсутствие наиболее беспокоящего симптома (most bothersome symptom, MBS) через 2 часа после введения дозы по сравнению с плацебо в исследованиях 1 и 2. Отсутствие боли определялось как уменьшение умеренной или сильной головной боли до отсутствия боли, а отсутствие MBS определялось как отсутствие самостоятельно выявленного MBS (т. е. светобоязни, фонофобии или тошноты). Среди пациентов, выбравших MBS, наиболее часто выбирали светобоязнь (56 %), затем — фонофобия (24 %) и тошнота (19 %).
В обоих исследованиях процентная доля пациентов, достигших отсутствия головной боли и MBS через 2 часа после введения дозы, была значительно выше у пациентов, получавших Убрелви, по сравнению с пациентами, получавшими плацебо (см. таблицу 3). В таблице 3 также представлены результаты анализов процентной доли пациентов, достигших облегчения боли через 2 часа (определяемой как уменьшение боли при мигрени от умеренной или тяжёлой до лёгкой степени или её отсутствие) после введения препарата, и процентной доли пациентов, достигших устойчивого отсутствия боли через 2–24 часа после введения препарата.
Частота случаев светобоязни и фонофобии была ниже после введения препарата Убрелви в обеих дозах (50 мг и 100 мг) по сравнению с плацебо.
Таблица 3. Конечные точки эффективности при мигрени для исследования 1 и исследования 2
|
| Исследование 1 | Исследование 2 | |||
|
| Убрелви50 мг | Убрелви100 мг | Плацебо | Убрелви50 мг | Плацебо |
| Отсутствие боли через 2 часа | |||||
| N | 422 | 448 | 456 | 464 | 456 |
| % ответившихна лечение | 19.2 | 21,2 | 11.8 | 21,8 | 14,3 |
| Отличие отплацебо (%) | 7,4 | 9,4 | 7,5 | ||
| p-величина | 0,002 | < 0,001 | 0,007 | ||
| Отсутствие наиболее беспокоящего симптома через 2 часа |
|
| |||
| N | 420 | 448 | 454 | 463 | 456 |
| % ответивших на лечение | 38,6 | 37,7 | 27,8 | 38,9 | 27,4 |
| Отличие отплацебо (%) | 10,8 | 9,9 | 11,5 | ||
| p-величина | < 0,001 | < 0,001 | < 0,001 | ||
| Облегчение боли через 2 часа |
|
| |||
| N | 422 | 448 | 456 | 464 | 456 |
| %ответившихна лечение | 60,7 | 61,4 | 49,1 | 62,7 | 48,2 |
| p-величина | < 0,001 | < 0,001 | < 0,001 | ||
| Устойчивое устранение боли в течение 2–24 часов |
|
| |||
| N | 418 | 441 | 452 | 457 | 451 |
| %ответившихна лечение | 12,7 | 15,4 | 8,6 | 14,4 | 8,2 |
| p-величина | *Н/З | 0,002 | 0,005 | ||
* Статистически не значимо (Н/З).
На рисунке 1 представлена процентная доля пациентов, достигших отсутствия боли при мигрени в течение 2 часов после лечения, в исследованиях 1 и 2.
Рисунок 1. Процентная доля пациентов, достигших отсутствия боли в течение 2 часов, в объединённых исследованиях 1 и 2
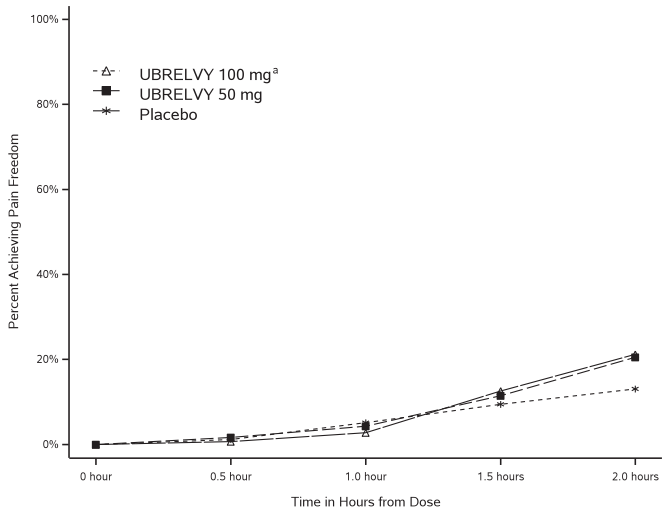
a Группа 100 мг была включена только в исследование 1.
На рисунке 2 представлена доля пациентов, достигших отсутствия MBS в течение 2 часов, в исследованиях 1 и 2.
Рисунок 2. Процентная доля пациентов, достигших отсутствия MBS в течение 2 часов, в объединённых исследованиях 1 и 2
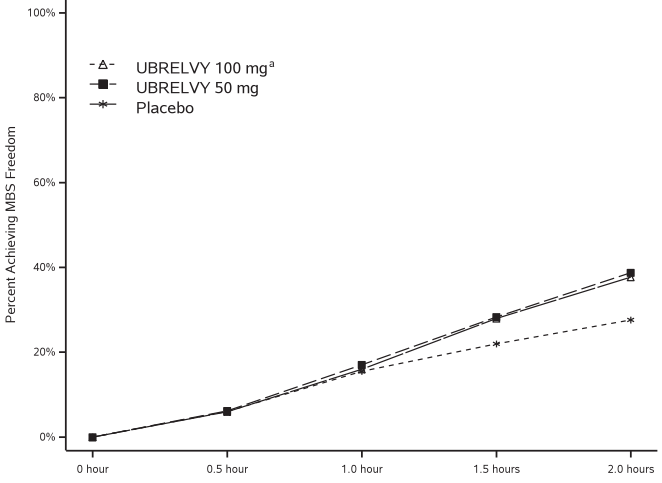
a Группа 100 мг была включена только в исследование 1.
16. Форма выпуска, условия хранения препарата и обращение с ним
16.1 Форма выпуска
Препарат Убрелви 50 мг выпускается в виде двояковыпуклых таблеток в форме капсул белого или почти белого цвета с гравировкой «U50» на одной стороне в пакетах с разовой дозой (каждый пакет содержит 1 таблетку): • Коробка с 10 пакетами, NDC: 0023-6498-10
- Коробка с 16 пакетами, NDC: 0023-6498-16
- Коробка с 30 пакетами, NDC: 0023-6498-30
Препарат Убрелви 100 мг выпускается в виде двояковыпуклых таблеток в форме капсул белого или почти белого цвета с гравировкой «U100» на одной стороне в пакетах с разовой дозой (каждый пакет содержит 1 таблетку): • Коробка с 10 пакетами, NDC: 0023-6501-10
- Коробка с 16 пакетами, NDC: 0023-6501-16
- Коробка с 30 пакетами, NDC: 0023-6501-30
16.2 Условия хранения препарата и обращение с ним
Хранить при температуре от 20 °C до 25 °C (68–77 °F): допустимы колебания температуры от 15 °C до 30 °C (59–86 °F) [см. определение термина «контролируемая комнатная температура» в Фармакопее США].
17. Информация для консультирования пациента
Рекомендуйте пациенту прочитать одобренную FDA информацию о лекарственном препарате для пациента (инструкцию по применению лекарственного препарата для пациента).
Реакции гиперчувствительности
Проинформируйте пациентов о признаках и симптомах реакций гиперчувствительности и о том, что эти реакции могут возникать при применении препарата Убрелви. Рекомендуйте пациентам прекратить лечение препаратом Убрелви и немедленно обратиться за медицинской помощью, если у них возникнут какие-либо симптомы серьёзной реакции гиперчувствительности [см. «Предостережения и меры предосторожности» (5.1)].
Гипертензия
Проинформируйте пациентов о том, что при применении препарата Убрелви может развиться или усугубиться уже имеющаяся гипертензия, и что при повышении артериального давления им следует обратиться к лечащему врачу [см. «Предостережения и меры предосторожности» (5.2)].
Болезнь Рейно
Сообщите пациентам, что при применении препарата Убрелви может развиться или усугубиться болезнь Рейно. Рекомендуйте пациентам прекратить лечение препаратом Убрелви и связаться со своим лечащим врачом, если у них возникнут признаки или симптомы болезни Рейно [см. «Предостережения и меры предосторожности» (5.3)].
Межлекарственное взаимодействие
Проинформируйте пациентов о том, что Убрелви может взаимодействовать с некоторыми другими лекарственными препаратами; поэтому посоветуйте пациентам сообщать своему лечащему врачу о применении любых других рецептурных, безрецептурных или растительных препаратов [см. «Противопоказания» (4) и «Межлекарственное взаимодействие» (7.1, 7.2, 7.3)]. Рекомендуйте пациентам сообщать своему лечащему врачу о приёме грейпфрутового сока, поскольку при его совместном применении рекомендуется изменение дозы.
Беременность
Рекомендуйте пациентам сообщать своему лечащему врачу, если они забеременеют во время лечения или планируют забеременеть. Рекомендуйте беременным пациентам зарегистрироваться в регистре, который контролирует исходы беременности у женщин, получавших препарат Убрелви во время беременности [см. «Применение у особых категорий пациентов» (8.1)].
Грудное вскармливание
Проинформируйте пациентов о необходимости сообщать своему лечащему врачу, если они кормят грудью или планируют кормить грудью [см. «Применение у особых категорий пациентов» (8.2)].
Произведено для:
«ЭббВи Инкорпорейтед» (AbbVie Inc.)
Норт-Чикаго, штат Иллинойс, 60064
© 2025 г. «ЭббВи Инкорпорейтед». Все права защищены.
Препарат Убрелви и его дизайн являются товарными знаками «Аллерган Фармасьютикалс Интернейшнл Лимитед», компании «ЭббВи Инкорпорейтед».
| Информация для пациента Убрелви®(you-brel-vee) (ubrogepant) tablets, for oral use |
| Что такое препарат Убрелви? Препарат Убрелви — это рецептурный лекарственный препарат, применяемый для неотложного лечения приступов мигрени у взрослых с аурой или без неё. Препарат Убрелви не используется для профилактики мигрени. Неизвестно, является ли препарат Убрелви безопасным и эффективным у детей. |
| Кому не следует применять препарат Убрелви? Не принимайте препарат Убрелви, если:• Если вы принимаете лекарственные препараты, известные как сильный ингибитор CYP3A4, такие как кетоконазол, кларитромицин или итраконазол. Если вы не уверены, относится ли принимаемый вами препарат к ним, проконсультируйтесь с лечащим врачом. Ваш лечащий врач может сообщить вам, безопасно ли принимать препарат Убрелви совместно с другими лекарственными препаратами. • У вас аллергия на уброгепант или любой из компонентов препарата Убрелви. Полный список компонентов препарата Убрелви приведен в конце листка-вкладыша. |
|
Перед началом приёма препарата Убрелви сообщите врачу обо всех ваших заболеваниях, особенно если: • У вас повышенное артериальное давление. • У вас проблемы с кровообращением в пальцах рук и ног. • У вас проблемы с печенью. • У вас проблемы с почками. • Вы беременны или планируете беременность. Данные о вреде препарата Убрелви для плода неизвестны. ° Регистр воздействия на беременность: существует Регистр воздействия на беременность для женщин, принимающих препарат Убрелви. Целью этого регистра является сбор информации о состоянии вашего здоровья и здоровья вашего ребёнка. Поговорите со своим лечащим врачом или позвоните по телефону 1-833-277-0206, чтобы зарегистрироваться в этом регистре. Вы также можете посетить веб-сайт по адресу http://empresspregnancyregistry.com. • Вы кормите грудью или планируете грудное вскармливание. Очень небольшое количество препарата Убрелви попадает в грудное молоко. Если вы планируете кормить грудью, поговорите со своим лечащим врачом. Сообщите лечащему врачу обо всех принимаемых препаратах,в том числе о рецептурных, безрецептурных препаратах, витаминах и растительных добавках. В частности, сообщите своему лечащему врачу, если вы принимаете что-либо из перечисленного ниже, поскольку вашему лечащему врачу может потребоваться изменить дозу препарата Убрелви: • зверобой • фенитоин • барбитураты • рифампин • куркумин • хинидин Это не полный список лекарственных препаратов, которые могут повлиять на действие препарата Убрелви. Ваш лечащий врач может сообщить вам, безопасно ли принимать препарат Убрелви совместно с другими лекарственными препаратами. Ведите список принимаемых лекарственных препаратов и покажите его лечащему врачу или фармацевту при назначении вам нового препарата. |
|
Как следует принимать препарат Убрелви? • Принимайте препарат Убрелви в точном соответствии с указаниями врача. • Принимайте препарат Убрелви независимо от приёма пищи. • Большинство пациентов могут принять вторую таблетку через 2 часа после приёма первой таблетки, по мере необходимости. • Вам не следует принимать вторую таблетку в течение 24 часов, если вы употребили грейпфруты или грейпфрутовый сок или приняли лекарственные препараты, которые могут включать следующие: • Неизвестно, безопасен ли приём препарата Убрелви при лечении более чем 8 эпизодов головных болей при мигрени в течение 30 дней. • Вам следует записывать, когда у вас возникают головные боли и когда вы принимаете препарат Убрелви, чтобы вы могли поговорить со своим врачом, как Убрелви действует на вас. • Если вы приняли слишком много препарата Убрелви, немедленно позвоните своему врачу или обратитесь в ближайшее отделение неотложной помощи. |
|
Каковы возможные побочные эффекты препарата Убрелви? Препарат Убрелви способен вызывать серьёзные побочные эффекты, в том числе:• Аллергические реакции. Аллергические реакции могут развиться после приёма препарата Убрелви. Большинство реакций возникали в течение нескольких часов и не были серьёзными. Некоторые реакции могут возникать через несколько дней после приёма препарата Убрелви. Немедленно позвоните своему лечащему врачу или обратитесь за неотложной помощью, если у вас возникнут какие-либо из следующих симптомов, которые могут быть проявлением аллергической реакции: ° отёк лица, рта, языка или горла; ◦ затруднённое дыхание. • Повышенное артериальное давление: при приёме препарата Убрелви может повышаться артериальное давление или усугубляться повышенное артериальное давление. Если у вас повысилось артериальное давление, обратитесь к своему лечащему врачу. • Болезнь Рейно: при приёме препарата Убрелви может усугубиться или возникнуть проблема с кровообращением. При болезни Рейно пальцы рук и ног могут онеметь, стать холодными или болезненными, а их цвет может меняться от бледного до синего или красного. При возникновении этих симптомов обратитесь к своему лечащему врачу. Наиболее распространёнными побочными эффектами препарата Убрелви являются тошнота и сонливость. Это не все возможные побочные эффекты препарата Убрелви. Позвоните своему лечащему врачу, чтобы получить медицинскую консультацию касательно побочных эффектов. О возникших побочных эффектах можно сообщить в Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) по телефону: 1-800-FDA-1088. |
|
Как следует хранить препарат Убрелви? • Храните препарат Убрелви при комнатной температуре от 68 ºF до 77 ºF (от 20 ºС до 25 ºС). Храните препарат Убрелви и другие лекарственные препараты в недоступном для детей месте. |
|
Общие сведения об эффективном и безопасном использовании препарата Убрелви. Лекарственные препараты иногда назначаются по показаниям, отличающимся от перечисленных в инструкции по применению лекарственного препарата для пациента. Запрещается принимать препарат Убрелви для лечения заболевания не по показаниям. Не давайте препарат Убрелви другим людям, даже если у них те же симптомы, что у вас. Препарат может причинить вред их здоровью. Вы также можете попросить у фармацевта или врача информацию о Убрелви, предназначенную для медицинских работников. |
|
Какие вещества входят в состав препарата Убрелви? Активный ингредиент: уброгепант. Вспомогательные вещества: коллоидный диоксид кремния, кроскармеллоза натрия, маннитол, микрокристаллическая целлюлоза, сополимерполивинил пирролидона и винилацетата, хлорид натрия, стеарилфумарат натрия и витамин Е полиэтиленгликоль сукцинат. Произведено для: «ЭббВи Инкорпорейтед» Норт-Чикаго, штат Иллинойс, 60064 © 2025 г. «ЭббВи Инкорпорейтед». Все права защищены. Препарат Убрелви и его дизайн являются товарными знаками «Аллерган Фармасьютикалс Интернейшнл Лимитед», компании «ЭббВи Инкорпорейтед». |
Данный листок-вкладыш для пациента был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США. Ссылка: 20093630
Выдан: июнь 2025 г.
Форма выпуска
Таблетки для приёма внутрь.
Условия отпуска из аптек
Отпускают по рецепту
Классификация
-
АТХ
-
Действующее вещество
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Убрелви:
