Афинитор®
, 2, 3 и 5 мгРегистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
таблетки диспергируемые
Состав
1 диспергируемая таблетка содержит:
действующее вещество — эверолимус 2,00 мг, 3,00 мг и 5,00 мг;
вспомогательные вещества: бутилгидрокситолуол 0,04 мг, 0,06 мг и 0,10 мг, лактозы моногидрат 1,96 мг, 2,94 мг и 4,90 мг, гипромеллоза (тип 2910) 18,00 мг, 27,00 мг и 45,00 мг, маннитол 108.00 мг, 162,00 мг и 270,00 мг, целлюлоза микрокристаллическая 62,50 мг, 93,75 мг и 156,25 мг, кросповидон 50,00 мг, 75,00 мг и 125.00 мг, магния стеарат 5,00 мг, 7,50 мг и 12.50 мг, кремния диоксид коллоидный 2.50 мг, 3,75 мг и 6,25 мг.
Описание
Диспергируемые таблетки 2 мг: круглые плоские таблетки с фаской, от белого до белого с желтоватым оттенком цвета, с тиснением "D2« на одной стороне и »NVR" на другой.
Диспергируемые таблетки 3 мг: круглые плоские таблетки с фаской, от белого до белого с желтоватым оттенком цвета, с тиснением "D3« на одной стороне и »NVR" на другой.
Диспергируемые таблетки 5 мг: круглые плоские таблетки с фаской, от белого до белого с желтоватым оттенком цвета, с тиснением "D5« на одной стороне и »NVR" на другой.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Активное вещество препарата Афинитор®, эверолимус, является ингибитором передачи пролиферативного сигнала.
Эверолимус является избирательным ингибитором серин-треониновой киназы mTOR (мишень рапамицина млекопитающих), специфически воздействующим на комплекс mTORCl сигнал-преобразующей mTOR-киназы и регуляторного raptor-протеина (regulatory associated protein of mTOR). Комплекс mTORCl является важнейшим регулятором синтеза белка в дистальной части PI3K7AKT-зависимого каскада, регуляция которого нарушена в большинстве злокачественных опухолей человека. Эверолимус проявляет свою активность за счёт высоко аффинного взаимодействия с внутриклеточным рецепторным белком FKBP12. Комплекс РКВР12-эверолимус связывается с mTORCl, ингибируя его способность к передаче сигналов.
Сигнальная функция mTORCl реализуется через модулирование фосфорилирования дистальных эффекторов, из которых наиболее полно охарактеризованы регуляторы трансляции: киназа рибосомального белка S6 (S6K1) и фактор инициации эукариотных клеток, 4Е-связывающий белок (4Е-ВР1). Нарушение функции S6K1 и 4Е-ВР1 вследствие ингибирования mTORCl нарушает трансляцию кодируемых мРНК основных белков, участвующих в регуляции клеточного цикла, гликолиза и адаптации клеток к низкому уровню кислорода (гипоксии). Это подавляет рост опухоли и экспрессию индуцируемых гипоксией факторов (например, транскрипционного фактора HIF-1). Последнее приводит к уменьшению экспрессии факторов, обеспечивающих усиление процессов ангиогенеза в опухоли (например, сосудистого эндотелиального фактора роста — СЭФР). Сигнальная передача через mTORCl регулируется генами-супрессорами опухолевого роста: генами туберозного склероза 1 и 2 (TSC1, TSC2). При туберозном склерозе, генетически обусловленном заболевании, инактивирующие мутации в одном или обоих генах TSC1 и TSC2 ведут к образованию множественных гамартом различных локализаций.
Эверолимус является активным ингибитором роста и пролиферации опухолевых клеток, эндотелиальных клеток, фибробластов и гладкомышечных клеток кровеносных сосудов.
У пациентов с субэпендимальными гигантоклеточными астроцитомами (СЭГА), ассоциированными с туберозным склерозом (ТС), после 6 месяцев лечения эверолимусом отмечалось статистически значимое уменьшение объёма опухоли, при этом у 75 % пациентов объём опухоли сократился не менее чем на 30 %, а у 32% — не менее чем на 50 %. При этом новых очагов, усиления гидроцефалии, признаков повышения внутричерепного давления и необходимости в хирургическом лечении СЭГА не возникло. Продолжительное наблюдение за пациентами с СЭГА, ассоциированными с ТС, подтвердили устойчивую эффективность эверолимуса.
Фармакокинетика
Всасывание
Максимальная концентрация (Сmах) эверолимуса в крови после приёма препарата внутрь в дозах от 5 до 70 мг (натощак или с небольшим количеством нежирной пищи) достигается через 1–2 часа. Сmах при приёме препарата ежедневно изменяется пропорционально дозе в диапазоне от 5 до 10 мг. При приёме эверолимуса однократно в дозе 20 мг и выше возрастание Cmaxпроисходит менее чем пропорционально дозе, однако значения площади под кривой «концентрация–время» (AUC) увеличиваются пропорционально дозе при приёме от 5 мг до 70 мг препарата.
При приёме эверолимуса в дозе 10 мг в форме таблеток с пищей с высоким содержанием жиров AUC и Сmах препарата снижались соответственно на 22 % и 54%.
Одновременный приём пищи с низким содержание жиров снижал AUC и Сmах на 32 % и 42%, соответственно. У здоровых добровольцев, получавших 9 мг эверолимуса однократно (в виде диспергируемых таблеток, 3 мг) при приёме с пищей с высоким и низким содержанием жиров AUC эверолимуса снижалась на 11,7 % и 29,5%, соответственно, с уменьшением Сmах на 59,8 % и 50,2%, соответственно.
Однако приём пищи не оказывал значимого влияния на показатели элиминации препарата в течение 24 часов (для обеих лекарственных форм).
Относительная биодоступность диспергируемых таблеток
Значение площади под кривой «концентрация–время» (AUC0–∞) было эквивалентно при приёме диспергируемых таблеток эверолимуса в виде водной суспензии и при приёме таблеток эверолимуса с немедленным высвобождением. Минимальные значения концентрации эверолимуса, достигаемые через сутки после приёма препарата, были сравнимы для обеих лекарственных форм эверолимуса. Сmах эверолимуса при приёме диспергируемых таблеток была несколько ниже: от 64 % до 80% от значений, наблюдаемых при приёме таблеток с немедленным высвобождением.
Распределение
Процентное отношение концентрации эверолимуса в крови и плазме крови, которое является зависимым от концентрации соединения в диапазоне от 5 до 5000 нг/мл, изменяется от 17 % до 73%. Количество эверолимуса в плазме крови составляет примерно 20 % от его количества в цельной крови при концентрациях вещества, регистрируемых в крови пациентов с раком, принимающих эверолимус по 10 мг в день. Связь с белками плазмы крови составляет примерно 74 % как у здоровых добровольцев, так и у пациентов с нарушением функции печени средней степени тяжести.
В экспериментальных исследованиях было показано, что после внутривенного введения проникновение эверолимуса через гематоэнцефалический барьер зависит от дозы нелинейно, что предполагает насыщение насоса гематоэнцефалического барьера, обеспечивающего попадание препарата из крови в ткани мозга. Проникновение эверолимуса через гематоэнцефалический барьер продемонстрировано также у животных, получавших препарат внутрь.
Метаболизм
Эверолимус является субстратом изофермента CYP3A4 и Р-гликопротеина (Р-ГП). После приёма препарата внутрь в крови эверолимус циркулирует в основном в неизменённом виде. В крови человека определены шесть основных метаболитов эверолимуса, представленных тремя моногидроксилированными метаболитами, двумя продуктами гидролитического превращения с открытым кольцом и фосфатидилхолиновым конъюгатом эверолимуса. Указанные метаболиты по активности уступали эверолимусу примерно в 100 раз. Принято считать, что большая часть общей фармакологической активности эверолимуса обусловлена действием неизменённого соединения.
Экскреция
После введения однократной дозы меченого радиоактивной меткой эверолимуса большая часть (80 %) радиоактивности определялась в кале, небольшое количество (5 %) выделялось почками. Неизменённое вещество не определялось ни в моче, ни в кале.
Фармакокинетика в равновесном состоянии
После ежедневного или еженедельного приёма эверолимуса величины AUC0-τ были пропорциональны дозе препарата при его применении в дозах от 5 до 10 мг в день и от 5 до 70 мг в неделю. Равновесное состояние достигалось в пределах двух недель при ежедневном приёме эверолимуса. Сmах эверолимуса была пропорциональна дозе при применении препарата в дозах от 5 до 10 мг в день или в неделю. При дозах 20 мг в неделю и выше возрастание Сmах было менее чем пропорциональным дозе. Время достижения максимальной концентрации в плазме крови (Tmах) составляло 1–2 часа. При ежедневном приёме эверолимуса по достижении равновесного состояния имелась достоверная корреляция между величиной AUC0-τ и концентрацией препарата в крови перед приёмом очередной дозы. Период полувыведения эверолимуса составляет около 30 часов.
Фармакокинетика у отдельных групп пациентов
Пациенты с нарушением функции печени
При приёме эверолимуса пациентами с нарушениями функции печени системное воздействие препарата повышается в 1,6, 3,3 и 3,6 раз, соответственно, при нарушении функции печени лёгкой степени тяжести (класс A по классификации Чайлд-Пью), средней степени тяжести (класс B по классификации Чайлд-Пью) и тяжёлой степени (класс C по классификации Чайлд-Пью). Необходима коррекция дозы эверолимуса при нарушении функции печени (см. «Способ применения и дозы»).
Пациенты с нарушением функции почек
Существенного влияния величины клиренса креатинина (от 25 до 178 мл/мин) на клиренс (CL/F) эверолимуса не выявлено у пациентов с прогрессирующими солидными опухолями.
Посттрансплантационные нарушения функции почек (клиренс креатинина от 11 до 107 мл/мин) не влияли на фармакокинетику эверолимуса у пациентов после трансплантации органов.
Пациенты в возрасте ≤18 лет
- У пациентов с СЭГА индивидуальная равновесная минимальная терапевтическая концентрация (Cmin) эверолимуса была прямо пропорциональна суточной дозе и находилась в пределах 1,35 — 14,4 мг/м2.
- У пациентов с СЭГА среднее геометрическое значение минимальной терапевтической концентрации эверолимуса нормализованное к дозе в мг/м2 у пациентов младше 10 лет и от 10 до 18 лет статистически значимо ниже, чем у взрослых пациентов, что может указывать на повышенный клиренс эверолимуса у молодых пациентов.
Пациенты в возрасте ≥ 65 лет
Существенного влияния возраста пациентов (от 27 до 85 лет) на клиренс эверолимуса (CL/F от 4,8 до 54,7 л/ч) после приёма препарата внутрь не было выявлено.
Влияние расовой принадлежности
Клиренс эверолимуса (CL/F) после приёма препарата внутрь у лиц европеоидной и монголоидной рас при сходной функции печени не различается.
По данным популяционного фармакокинетического анализа у лиц негроидной расы после пересадки органов клиренс эверолимуса (CL/F) (после приёма внутрь) был в среднем на 20 % больше, чем у представителей европеоидной.
Влияние экспозиции на эффективность
Имелась некоторая корреляция между снижением фосфорилирования 4Е-ВР1 в ткани опухоли и средней минимальной концентрацией (Cmin) эверолимуса в крови в равновесном состояния после ежедневного приёма 5 или 10 мг препарата.
Дополнительные данные свидетельствуют о том, что уменьшение фосфорилирования киназы S6 очень чувствительно к ингибированию mTOR под влиянием эверолимуса. Подавление фосфорилирования фактора инициации трансляции eIF-4G было полным при всех значениях Cmin эверолимуса, определяемых в крови при ежедневном приёме препарата в дозе 10 мг.
Было показано, что у пациентов с СЭГА увеличение Cmin в 2 раза ведёт к уменьшению размера опухоли на 13 %, при этом статистически значимым считается уменьшение размера опухоли на 5%.
Показания
Субэпендимальные гигантоклеточные астроцитомы, ассоциированные с туберозным склерозом, при невозможности выполнения хирургической резекции опухоли.
Противопоказания
- Повышенная чувствительность к эверолимусу, другим производным рапамицина или любому из вспомогательных компонентов препарата.
- Выраженные нарушения функции печени у пациентов с субэпендимальными гигантоклеточными астроцитомами (класс C по классификации Чайлд-Пью).
- Беременность и период кормления грудью.
- Непереносимость лактозы, тяжёлая лактазная недостаточность или глюкозо-галактозная мальабсорбция.
Следует избегать одновременного применения эверолимуса с мощными индукторами изофермента CYP3A4 или индукторами Р-гликопротеина (Р-ГП-насоса).
С осторожностью
Следует соблюдать осторожность при одновременном применении эверолимуса с умеренными ингибиторами CYP3A4 или ингибиторами Р-ГП.
Эверолимус не рекомендуется при тяжёлой печёночной недостаточности (класс C по классификации Чайлд-Пью) за исключением случаев, когда польза от приёма препарата превышает возможный риск.
Поскольку при применении производных рапамицина, включая препарат Афинитор®, может замедляться процесс заживления ран, следует соблюдать осторожность при назначении препарата пациентам перед хирургическими вмешательствами.
Применение при беременности и в период грудного вскармливания
Препарат Афинитор® противопоказан к применению в период беременности и грудного вскармливания.
Во время терапии препаратом Афинитор® и как минимум в течение 2-х месяцев после завершения терапии следует использовать надёжные способы контрацепции.
Способ применения и дозы
Лечение препаратом Афинитор® следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами или лечения пациентов с туберозным склерозом. Препарат Афинитор® следует принимать внутрь один раз в день ежедневно в одно и то же время (предпочтительно утром) натощак или после приёма небольшого количества пищи, не содержащей жира.
Препарат Афинитор® в форме диспергируемых таблеток предназначен только для лечения пациентов с СЭГА, ассоциированными с туберозным склерозом (ТС), в сочетании с контролем концентрации эверолимуса в крови. Диспергируемые таблетки быстро растворяются в воде с образованием суспензии, которую можно принимать внутрь с помощью шприца для приёма суспензий или маленького стаканчика.
Лечение препаратом проводят до тех пор, пока сохраняется клинический эффект и нет признаков непереносимой токсичности.
Препарат Афинитор® в форме диспергируемых таблеток предназначен для приготовления суспензии, не следует проглатывать таблетки целиком, разжёвывать или измельчать. Суспензию можно приготовить в шприце для суспензий или маленьком стаканчике. Следует обеспечить приём полной приготовленной дозы препарата. Суспензию следует принимать непосредственно после приготовления.
Приготовленную суспензию следует утилизировать в том случае, если она хранилась более 60 мин. Для приготовления суспензии следует использовать только воду.
Приготовление раствора с помощью шприца
Требуемое количество диспергируемых таблеток поместить в 10 мл шприц для суспензий. Максимальное количество препарата в одном шприце для приготовления суспензий не должно превышать 10 мг, при необходимости применения более высокой дозы следует использовать несколько шприцов. Набрать около 5 мл воды и около 4 мл воздуха.
Заполненный шприц поместить в стакан (поршнем вниз) на 3 мин для растворения содержимого.
Перед приёмом препарата аккуратно перевернуть шприц пять раз, держа шприц кончиком вверх, удалить излишек воздуха и сразу же медленно ввести содержимое шприца в рот пациента.
Для обеспечения приёма полной дозы набрать ещё раз такой же объём воды и воздуха в шприц, вращая шприц смыть частицы препарата со стенок и ввести содержимое в рот пациента.
Приготовление раствора с помощью стаканчика
Требуемое количество диспергируемых таблеток поместить в маленький стаканчик (максимальный объём 100 мл), содержащий приблизительно 25 мл воды и оставить на 3 мин. Максимальное количество препарата в одном стаканчике не должно превышать 10 мг, при необходимости применения более высокой дозы следует использовать несколько стаканчиков. Не следует дробить или разламывать таблетки. Непосредственно перед приёмом препарата аккуратно перемешать содержимое ложечкой. Для обеспечения приёма полной дозы набрать в стакан такой же объём воды, смыть со стенок оставшиеся частицы препарата, перемешать содержимое этой же ложечкой и дать выпить пациенту.
Подбор дозы препарата Афинитор® пациентам с СЭГА, ассоциированными с туберозным склерозом
Доза препарата определяется, исходя из площади поверхности тела (BSA, м2), рассчитанной по формуле Дюбуа.
Рекомендуемая начальная доза препарата Афинитор® для лечения пациентов с СЭГА, составляет 4,5 мг/м2, округлённая до ближайшей дозировки диспергируемых таблеток или таблеток препарата Афинитор®.
Диспергируемые таблетки препарата Афинитор® различных дозировок можно комбинировать для получения необходимой дозы, однако, комбинировать разные лекарственные формы препарата Афинитор® (например, таблетки и диспергируемые таблетки) с этой целью не следует.
У пациентов, получающих терапию эверолимусом по поводу СЭГА, надлежит контролировать концентрацию эверолимуса в крови.
Концентрацию эверолимуса в крови следует определить приблизительно через 2 недели после начала лечения. Cmin препарата в крови должна находиться в диапазоне 5-15 нг/мл.
Доза может быть увеличена для достижения большей концентрации в пределах терапевтического диапазона с целью достижения оптимальной эффективности с учётом переносимости препарата.
После начала терапии препаратом Афинитор® объём опухоли СЭГА следует измерять каждые 3 месяца. При индивидуальном подборе дозы следует учитывать ответ опухоли на лечение, концентрацию эверолимуса в крови и индивидуальную переносимость препарата.
После подбора дозы, следует контролировать концентрацию эверолимуса в плазме крови каждые 3–6 месяцев у пациентов, у которых площадь поверхности тела меняется, и каждые 6–12 месяцев у пациентов, у которых площадь поверхности тела остаётся неизменной на протяжении всего срока лечения.
Рекомендации по изменению дозы препарата Афинитор® при развитии нежелательных явлений
Коррекция тяжёлых и/или труднопереносимых нежелательных явлений (НЯ) может потребовать временного прекращения терапии с/без уменьшения дозы. Если требуется снижение дозы препарата, рекомендуется использовать дозу приблизительно на 50 % меньше предыдущей (см Табл 1). У пациентов, получающих 2 мг препарата Афинитор® в сутки, возможно применение режима дозирования с приёмом препарата через день.
Таблица 1 Рекомендации нежелательных явлений
| Нежелательная реакция | Степень тяжести | Рекомендации по изменению дозы и коррекции нежелательных явлений2 |
| Неинфекционный пневмонит | Степень 1 | Изменение дозы не требуется. |
| Отсутствие симптомов, за исключением рентгенологических признаков | Контроль состояния. | |
| Степень 2 | ||
| Симптомы, не оказывающие влияние на повседневную жизнедеятельность | Временное прекращение терапии препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами до снижения тяжести симптомов ниже 1 степени. | |
| Возобновление лечения препаратом Афинитор® в более низкой дозе. | ||
| Прекращение терапии если восстановление не наступило в течение 3 недель. | ||
| Степень 3 | ||
| Симптомы, оказывающие влияние на повседневную жизнедеятельность; применение кислородотерапии | Прекращение лечения препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами до снижения тяжести симптомов ниже степени. | |
| Возобновление терапии препаратом Афинитор® с более низкой дозы. | ||
| При повторном развитии симптомов до 3 степени — прекращение терапии препаратом Афинитор®. | ||
| Степень 4 | Прекращение лечения препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами. | |
| Стоматит | Степень 1 Симптомы лёгкой степени тяжести; специальная диета не требуется | Изменение дозы не требуется Полоскание рта неспиртосодержащими или водносолевыми растворами (0,9 %) несколько раз в день. |
| Степень 2 Симптомы средней степени тяжести с сохранением способности к приёму пищи внутрь и глотанию; требуется специальная диета | Временное прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с той же дозы. При повторном возникновении симптомов стоматита степени 2 — прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. Лечение анальгетиками для наружного применения (бензокаин, бутиламинобензоат, тетракаина гидрохлорид, ментол или фенол) с/без глюкокортикостероидов для наружного применения3. | |
| Степень 3 Выраженные симптомы; способность к приёму пищи и жидкостей внутрь ограничена | Временное прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. Лечение анальгетиками для наружного применения (бензокаин, бутиламинобензоат, тетракаина гидрохлорид, метол или фенол) с/без глюкокортикостероидов для наружного применения3. | |
| Степень 4 Жизнеугрожающее состояние | Прекращение лечения препаратом Афинитор® и лечение стоматита с использованием соответствующей терапии. | |
| Другая не гематологическая токсичность (исключая метаболические нарушения) | Степень 1 | При переносимости симптомов изменение дозы не требуется. Лечение соответствующими методами и контроль состояния. |
| Степень 2 | При переносимости симптомов изменение дозы не требуется. Лечение соответствующими методами и контроль состояния. При непереносимости симптомов — временное прекращение лечения препаратом до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. | |
| Степень 3 | Временное прекращение приёма препарата до снижения тяжести симптомов до степени 1 и ниже. Лечение соответствующими методами и контроль состояния. Возобновление приёма препарата с более низкой дозы. При повторном развитии симптомов до 3 степени — прекращение терапии препаратом Афинитор®. | |
| Степень 4 | Прекращение приёма препарата и лечение соответствующими методами. | |
| Метаболические нарушения (например, гипергликемия, дислипидемия) | Степень 1 | Изменение дозы не требуется при переносимости симптомов. Лечение соответствующими методами и контроль состояния. |
| Степень 2 | Изменение дозы не требуется при переносимости симптомов. Лечение соответствующими методами и контроль состояния. | |
| Степень 3 | Временное прекращение приёма препарата. Возобновление приёма препарата с более низкой дозы. Лечение соответствующими методами и контроль состояния | |
| Степень 4 | Прекращение приёма препарата и лечение соответствующими методами. | |
| 1Степени тяжести: 1 = слабые симптомы; 2 = умеренные симптомы; 3 = тяжёлые симптомы; 4 = жизнеугрожающие симптомы. 2Если требуется снижение дозы препарата, рекомендуется использовать дозу приблизительно на 50 % меньше предыдущей. 3Избегать применения препаратов, содержащих пероксид водорода, йод и производные чабреца в лечении стоматита (могут провоцировать усиление изъязвления в ротовой полости) | ||
Лечение препаратом Афинитор® следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами или лечения пациентов с туберозным склерозом. Препарат Афинитор® следует принимать внутрь один раз в день ежедневно в одно и то же время (предпочтительно утром) натощак или после приёма небольшого количества пищи, не содержащей жира.
Препарат Афинитор® в форме диспергируемых таблеток предназначен только для лечения пациентов с СЭГА, ассоциированными с туберозным склерозом (ТС), в сочетании с контролем концентрации эверолимуса в крови. Диспергируемые таблетки быстро растворяются в воде с образованием суспензии, которую можно принимать внутрь с помощью шприца для приёма суспензий или маленького стаканчика.
Лечение препаратом проводят до тех пор, пока сохраняется клинический эффект и нет признаков непереносимой токсичности.
Препарат Афинитор® в форме диспергируемых таблеток предназначен для приготовления суспензии, не следует проглатывать таблетки целиком, разжёвывать или измельчать. Суспензию можно приготовить в шприце для суспензий или маленьком стаканчике. Следует обеспечить приём полной приготовленной дозы препарата. Суспензию следует принимать непосредственно после приготовления.
Приготовленную суспензию следует утилизировать в том случае, если она хранилась более 60 мин. Для приготовления суспензии следует использовать только воду.
Приготовление раствора с помощью шприца
Требуемое количество диспергируемых таблеток поместить в 10 мл шприц для суспензий. Максимальное количество препарата в одном шприце для приготовления суспензий не должно превышать 10 мг, при необходимости применения более высокой дозы следует использовать несколько шприцов. Набрать около 5 мл воды и около 4 мл воздуха.
Заполненный шприц поместить в стакан (поршнем вниз) на 3 мин для растворения содержимого.
Перед приёмом препарата аккуратно перевернуть шприц пять раз, держа шприц кончиком вверх, удалить излишек воздуха и сразу же медленно ввести содержимое шприца в рот пациента.
Для обеспечения приёма полной дозы набрать ещё раз такой же объём воды и воздуха в шприц, вращая шприц смыть частицы препарата со стенок и ввести содержимое в рот пациента.
Приготовление раствора с помощью стаканчика
Требуемое количество диспергируемых таблеток поместить в маленький стаканчик (максимальный объём 100 мл), содержащий приблизительно 25 мл воды и оставить на 3 мин. Максимальное количество препарата в одном стаканчике не должно превышать 10 мг, при необходимости применения более высокой дозы следует использовать несколько стаканчиков. Не следует дробить или разламывать таблетки. Непосредственно перед приёмом препарата аккуратно перемешать содержимое ложечкой. Для обеспечения приёма полной дозы набрать в стакан такой же объём воды, смыть со стенок оставшиеся частицы препарата, перемешать содержимое этой же ложечкой и дать выпить пациенту.
Подбор дозы препарата Афинитор® пациентам с СЭГА, ассоциированными с туберозным склерозом
Доза препарата определяется, исходя из площади поверхности тела (BSA, м2), рассчитанной по формуле Дюбуа.
Рекомендуемая начальная доза препарата Афинитор® для лечения пациентов с СЭГА, составляет 4,5 мг/м2, округлённая до ближайшей дозировки диспергируемых таблеток или таблеток препарата Афинитор®.
Диспергируемые таблетки препарата Афинитор® различных дозировок можно комбинировать для получения необходимой дозы, однако, комбинировать разные лекарственные формы препарата Афинитор® (например, таблетки и диспергируемые таблетки) с этой целью не следует.
У пациентов, получающих терапию эверолимусом по поводу СЭГА, надлежит контролировать концентрацию эверолимуса в крови.
Концентрацию эверолимуса в крови следует определить приблизительно через 2 недели после начала лечения. Cmin препарата в крови должна находиться в диапазоне 5-15 нг/мл.
Доза может быть увеличена для достижения большей концентрации в пределах терапевтического диапазона с целью достижения оптимальной эффективности с учётом переносимости препарата.
После начала терапии препаратом Афинитор® объём опухоли СЭГА следует измерять каждые 3 месяца. При индивидуальном подборе дозы следует учитывать ответ опухоли на лечение, концентрацию эверолимуса в крови и индивидуальную переносимость препарата.
После подбора дозы, следует контролировать концентрацию эверолимуса в плазме крови каждые 3–6 месяцев у пациентов, у которых площадь поверхности тела меняется, и каждые 6–12 месяцев у пациентов, у которых площадь поверхности тела остаётся неизменной на протяжении всего срока лечения.
Рекомендации по изменению дозы препарата Афинитор® при развитии нежелательных явлений
Коррекция тяжёлых и/или труднопереносимых нежелательных явлений (НЯ) может потребовать временного прекращения терапии с/без уменьшения дозы. Если требуется снижение дозы препарата, рекомендуется использовать дозу приблизительно на 50 % меньше предыдущей (см Табл 1). У пациентов, получающих 2 мг препарата Афинитор® в сутки, возможно применение режима дозирования с приёмом препарата через день.
Таблица 1 Рекомендации нежелательных явлений
| Нежелательная реакция | Степень тяжести | Рекомендации по изменению дозы и коррекции нежелательных явлений2 |
| Неинфекционный пневмонит | Степень 1 | Изменение дозы не требуется. |
| Отсутствие симптомов, за исключением рентгенологических признаков | Контроль состояния. | |
| Степень 2 | ||
| Симптомы, не оказывающие влияние на повседневную жизнедеятельность | Временное прекращение терапии препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами до снижения тяжести симптомов ниже 1 степени. | |
| Возобновление лечения препаратом Афинитор® в более низкой дозе. | ||
| Прекращение терапии если восстановление не наступило в течение 3 недель. | ||
| Степень 3 | ||
| Симптомы, оказывающие влияние на повседневную жизнедеятельность; применение кислородотерапии | Прекращение лечения препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами до снижения тяжести симптомов ниже степени. | |
| Возобновление терапии препаратом Афинитор® с более низкой дозы. | ||
| При повторном развитии симптомов до 3 степени — прекращение терапии препаратом Афинитор®. | ||
| Степень 4 | Прекращение лечения препаратом Афинитор®, исключение инфекционного процесса, при необходимости лечение глюкокортикостероидами. | |
| Стоматит | Степень 1 Симптомы лёгкой степени тяжести; специальная диета не требуется | Изменение дозы не требуется Полоскание рта неспиртосодержащими или водносолевыми растворами (0,9 %) несколько раз в день. |
| Степень 2 Симптомы средней степени тяжести с сохранением способности к приёму пищи внутрь и глотанию; требуется специальная диета | Временное прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с той же дозы. При повторном возникновении симптомов стоматита степени 2 — прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. Лечение анальгетиками для наружного применения (бензокаин, бутиламинобензоат, тетракаина гидрохлорид, ментол или фенол) с/без глюкокортикостероидов для наружного применения3. | |
| Степень 3 Выраженные симптомы; способность к приёму пищи и жидкостей внутрь ограничена | Временное прекращение приёма до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. Лечение анальгетиками для наружного применения (бензокаин, бутиламинобензоат, тетракаина гидрохлорид, метол или фенол) с/без глюкокортикостероидов для наружного применения3. | |
| Степень 4 Жизнеугрожающее состояние | Прекращение лечения препаратом Афинитор® и лечение стоматита с использованием соответствующей терапии. | |
| Другая не гематологическая токсичность (исключая метаболические нарушения) | Степень 1 | При переносимости симптомов изменение дозы не требуется. Лечение соответствующими методами и контроль состояния. |
| Степень 2 | При переносимости симптомов изменение дозы не требуется. Лечение соответствующими методами и контроль состояния. При непереносимости симптомов — временное прекращение лечения препаратом до снижения тяжести симптомов до степени 1 и ниже. Возобновление приёма препарата с более низкой дозы. | |
| Степень 3 | Временное прекращение приёма препарата до снижения тяжести симптомов до степени 1 и ниже. Лечение соответствующими методами и контроль состояния. Возобновление приёма препарата с более низкой дозы. При повторном развитии симптомов до 3 степени — прекращение терапии препаратом Афинитор®. | |
| Степень 4 | Прекращение приёма препарата и лечение соответствующими методами. | |
| Метаболические нарушения (например, гипергликемия, дислипидемия) | Степень 1 | Изменение дозы не требуется при переносимости симптомов. Лечение соответствующими методами и контроль состояния. |
| Степень 2 | Изменение дозы не требуется при переносимости симптомов. Лечение соответствующими методами и контроль состояния. | |
| Степень 3 | Временное прекращение приёма препарата. Возобновление приёма препарата с более низкой дозы. Лечение соответствующими методами и контроль состояния | |
| Степень 4 | Прекращение приёма препарата и лечение соответствующими методами. | |
| 1Степени тяжести: 1 = слабые симптомы; 2 = умеренные симптомы; 3 = тяжёлые симптомы; 4 = жизнеугрожающие симптомы. 2Если требуется снижение дозы препарата, рекомендуется использовать дозу приблизительно на 50 % меньше предыдущей. 3Избегать применения препаратов, содержащих пероксид водорода, йод и производные чабреца в лечении стоматита (могут провоцировать усиление изъязвления в ротовой полости) | ||
При применении одновременно с умеренными ингибиторами изофермента CYP3A4 или ингибиторами Р-ГП дозу препарата Афинитор® следует снизить на 50 %. У пациентов, получающих 2 мг препарата Афинитор® в сутки, возможно применение режима дозирования с приёмом препарата через день. Дальнейшее снижение дозы может потребоваться при развитии тяжёлых и/или труднопереносимых нежелательных явлений. Концентрацию эверолимуса следует проконтролировать через 2 недели после добавления к терапии умеренных ингибиторов изофермента CYP3A4 или ингибиторов Р-ГП. При прекращении терапии умеренными ингибиторами изофермента CYP3A4 или ингибиторами Р-ГП дозу препарата Афинитор® следует вернуть к исходной после 2–3 дней «отмывочного периода» и через 2 недели измерить концентрацию эверолимуса в плазме крови. При применении препарата Афинитор® одновременно с мощными индукторами изофермента CYP3A4 (например, противоэпилептическими препаратами, в том числе карбамазепином, фенобарбиталом и фенитоином) может потребоваться увеличение дозы препарата Афинитор® для достижения терапевтической концентрации 5-15 нг/мл; следует увеличить суточную дозу препарата Афинитор® в 2 раза и оценить переносимость лечения препаратом. Через 2 недели следует измерить концентрацию эверолимуса в плазме крови, при необходимости скорректировать дозу препарата Афинитор® для достижения терапевтической концентрации 5-15 нг/мл. При прекращении приёма мощного индуктора изофермента CYP3A4 дозу препарата Афинитор® следует вернуть к исходной после 3–5 дней «отмывочного» периода, и через 2 недели измерить концентрацию эверолимуса в плазме крови.
При применении препарата Афинитор® одновременно с мощными индукторами изофермента CYP3A4 может потребоваться на основании фармакокинетических данных увеличение дозы с 10 мг до 20 мг (м.б. на 10–20 мг в сутки) в сутки с шагом в 5 мг. Предполагается, что при указанном изменении дозы препарата Афинитор® значение AUC будет соответствовать AUC, наблюдаемому без приёма индукторов изофермента, однако клинические данные с подобным изменением дозы у пациентов, получающих мощные индукторы изофермента CYP3A4, отсутствуют.
Перевод пациента с одной лекарственной формы на другую:
Не следует комбинировать две лекарственные формы препарата Афинитор®, для достижения оптимальной терапевтической дозы следует применять только одну лекарственную форму. При переводе пациента с одной другой лекарственной формы на другую следует подобрать ближайшую из существующих дозировок и через 2 недели измерить концентрацию эверолимуса в плазме крови.
Терапевтический мониторинг концентрации эверолимуса в крови у пациентов с СЭГА.
У пациентов с СЭГА следует контролировать концентрацию эверолимуса в плазме крови с помощью валидированных биоаналитических методов жидкостной хроматографии / массспектрометрии. Рекомендуется по возможности использовать один и тот же метод анализа и лабораторию для терапевтического мониторинга концентрации эверолимуса в плазме крови на протяжении всего периода лечения.
Терапевтический мониторинг концентрации эверолимуса следует проводить в сроки через 2 недели после начала терапии, после любого изменения дозы или смены лекарственной формы препарата или присоединения к терапии ингибиторов или индукторов изофермента CYP3A4 или появления признаков нарушения функции печени. Cmin эверолимуса в крови должна находиться в пределах 5-15 нг/мл. Дозу необходимо титровать до достижения значения минимальной терапевтической концентрации с учётом переносимости терапии пациентом. Дозу можно увеличивать для достижения более высокой концентрации препарата в крови (в диапазоне терапевтической) и оптимального терапевтического эффекта при этом необходимо учитывать переносимость препарата.
Пациенты в возрасте до 18 лет
При лечении СЭГА у детей и подростков рекомендованные дозы такие же, как для лечения взрослых пациентов с СЭГА, за исключением пациентов с нарушением функции печени.
Препарат Афинитор® противопоказан пациентам с СЭГА, ассоциированными с ТС в возрасте до 18 лет с нарушениями функции печени класс А, В, С по классификации Чайлд-Пью.
Эффективность и безопасность применения препарата у детей до 1 года не установлена, в связи с чем применение препарата у данной категории пациентов не рекомендовано.
Пациенты в возрасте ≥ 65 лет
Коррекции дозы препарата не требуется. Пациенты с нарушениями функции почек Коррекции дозы препарата не требуется.
Пациенты старше 18 лет с нарушениями функции печени
Нарушения функции печени лёгкой степени тяжести (класс A по классификации Чайлд-Пью)
75 % от дозы, рассчитанной по площади поверхности тела (округлённое до ближайшей дозировки).
Нарушения функции печени средней степени тяжести (класс B по классификации Чайлд-Пью)
25 % от дозы, рассчитанной по площади поверхности тела (округлённое до ближайшей дозировки).
Нарушения функции печени тяжёлой степени (класс C по классификации Чайлд-Пью): -противопоказано.
Концентрацию эверолимуса в цельной крови следует определить приблизительно через 2 недели после начала лечения или после любого изменения функции печени (по классификации Чайлд-Пью). Следует титровать дозу для достижения концентрации препарата в диапазоне от 5 до 15 нг/мл. При изменении степени тяжести нарушения функции печени следует титровать дозу препарата. Доза может быть увеличена для достижения большей концентрации в пределах терапевтического диапазона с целью достижения оптимальной эффективности с учётом переносимости препарата.
Инструкция по применению
Суспензию готовят с использованием шприца для перорального введения, не входит в комплект. Для правильного приготовления суспензии с использованием шприца внимательно прочтите и тщательно соблюдайте данную инструкцию.
Важная информация
Каждый шприц для перорального введения пригоден для приготовления суспензии с дозой препарата от 2 мг до 10 мг. Если назначена более высокая доза, её следует разделить и повторить процедуру с использованием того же шприца.
Для приготовления используйте только воду (водопроводную или негазированную бутилированную).
После каждого применения промывайте шприц для перорального введения чистой водой; между использованиями храните шприц для перорального введения сухим.
Шприц для перорального введения предназначен только для приготовления АФИНИТОРА суспензии для приёма внутрь.
Приготовление одной дозы АФИНИТОРА суспензии с использованием шприца для перорального введения
Перед тем как готовить лекарственный препарат, вымойте и высушите руки.
Возьмите шприц для перорального введения на 10 мл и выньте из него поршень.
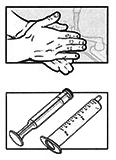
Выньте назначенное вам количество диспергируемых таблеток (максимум, пять таблеток 2 мг, три таблетки 3 мг или две таблетки 5 мг) и сразу же поместите их в шприц для перорального введения.
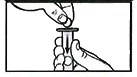
Снова вставьте поршень в шприц и протолкните его внутрь, пока он не упрется в диспергируемые таблетки.
Наполните питьевой стакан водой и отберите из него примерно 5 мл воды в шприц для перорального введения, медленно оттянув поршень вверх.
Примечание: Объём воды в шприце не обязательно должен быть точным. Все диспергируемые таблетки должны быть покрыты водой. Если диспергируемые таблетки остались в сухой верхней части шприца, аккуратно постучите по шприцу с тем, чтобы они переместились в воду.
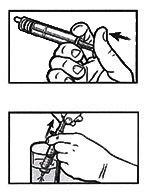
Переверните шприц и введите в шприц примерно 4 мл воздуха, оттянув поршень вниз.
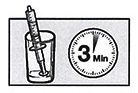
Поместите заполненный шприц в стакан, поставив его на поршень (наконечником вверх). Оставьте шприц на 3 минуты, чтобы диспергируемые таблетки распались. Переходите к следующей стадии только после того, как 3 минуты пройдут и диспергируемые таблетки полностью распадутся.
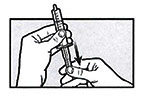
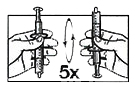
Аккуратно переверните шприц несколько раз. Встряхивать шприц для перорального введения не допускается.
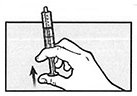
Удерживая шприц для перорального введения в положении наконечником вверх, аккуратно удалите лишний воздух.
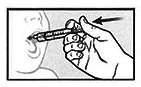
Сразу же после этого медленно и аккуратно введите содержимое шприца для перорального введения в рот пациента.
Аккуратно выньте шприц изо рта пациента. Введите в шприц примерно 5 мл воды, медленно оттянув поршень вверх.
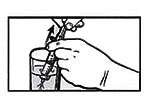
Переверните шприц и введите в шприц примерно 4 мл воздуха, оттянув поршень вниз.
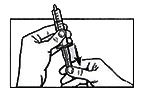
Вращая шприц вокруг вертикальной оси, суспендируйте оставшиеся частицы лекарственного препарата.

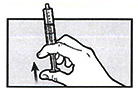
Удерживая шприц для перорального введения в положении наконечником вверх, аккуратно удалите лишний воздух.
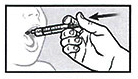
Медленно и аккуратно введите все содержимое шприца для перорального введения в рот пациента.
Выньте из шприца для перорального введения поршень и тщательно промойте все части водой. До следующего использования храните их в сухом и чистом месте.
Вымойте руки.
Побочное действие
При применении препарата наиболее частыми нежелательными явлениями (НЯ) (частота ≥10 %, НЯ перечислены по мере убывания частоты встречаемости) являлись: стоматит, инфекции верхних дыхательных путей, аменорея, гиперхолестеринемия, пазофарипгит, угревай сыпь, нерегулярный менструальный цикл, синусит, средний отит и пневмония.
Наиболее частыми НЯ 3-4 степени тяжести (частота ≥1 %) являлись: стоматит, аменорея, пневмония, нейтропения, лихорадка, вирусный гастроэнтерит, воспаление подкожной жировой клетчатки.
Ниже представлены НЯ, возникавшие при применении препарата Афинитор® с указанием частоты их возникновения: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (<1 /10000), в том числе отдельные сообщения. ИЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Инфекционные и паразитарные заболевания: очень часто — инфекции верхних дыхательных путей, назофарингит, синусит, средний отит, пневмония; часто — инфекции мочевыводящих путей, фарингит, воспаление подкожной клетчатки, стрептококковый фарингит, вирусный гастроэнтерит, гингивит, опоясывающий лишай; нечасто — бронхит вирусной этиологии.
Нарушения со стороны иммунной системы: нечасто — реакции гиперчувствительпости. Нарушения со стороны обмена веществ и питания: очень часто — гиперхолестеринемия; часто — гиперлипидемия, снижение аппетита, гипертриглицеридемия, гипофосфатсмия, гипергликемия.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто — кашель, носовые кровотечения; пневмонит.
Нарушения со стороны крови и лимфатической системы: часто нейтропения, анемия, лейкопения, лимфопения, тромбоцитопения.
Нарушения со стороны пищеварительной системы: очень часто — стоматит (включает изъязвление слизистой оболочки полости рта, губ и языка, глоссит, боль в деснах); часто — диарея, тошнота, рвота, боль в животе, боль в полости рта, метеоризм, запор, гастрит.
Нарушения со стороны кожи и подкожных тканей: очень часто — акне; часто — сыпь (включает сыпь, эритематозную сыпь, эритему, макуло-папуллезную сыпь, макулезную сыпь, генерализованную сыпь), акнеформный дерматит, сухость кожи; нечасто — ангионевротический отёк.
Нарушения со стороны почек и мочевыводящих путей: часто — протеинурия.
Общие расстройства и нарушения в месте введения: часто — утомляемость, повышение температуры тела.
Нарушения психики: часто — раздражительность, агрессивность; нечасто — бессонница.
Нарушения со стороны нервной системы: часто — головная боль, изменение восприятия вкуса.
Нарушения со стороны сосудов: часто — повышение артериального давления, лимфедема.
Нарушения со стороны половых органов и молочной железы: очень часто — аменорея, нерегулярный менструальный цикл; часто — влагалищное кровотечение, маточное кровотечение, киста яичника, онсоменорея.
Лабораторные и инструментальные данные: часто — повышение активности лактатдегидрогеназы (ЛДГ), повышение концентрации лютеинизирующего гормона (ЛГ) в плазме крови; нечасто — повышение концентрации фолликулостимулирующего гормона (ФСГ) в плазме крови.
Отклонения лабораторных и инструментальных показателей, отмечавшиеся с частотой ≥10 % (по мере убывания чистоты встречаемости):
гематологические: увеличение частичного тромбопластинового времени, снижение концентрации гемоглобина, снижение абсолютного количества нейтрофилов, лейкопения, лимфопения, тромбоцитоиения;
биохимические: гиперхолестеринемия, гипертриглицеридемия, повышение активности ACT, повышение активности АЛТ, гипофосфатемия, повышение активности щелочной фосфатазы (ЩФ), повышение концентрации глюкозы в плазме крови натощак, гипокалиемия.
Большинство из вышеуказанных НЯ были лёгкой (1-й) или средней (2-й) степени тяжести.
Тяжёлые (3-4 степени) отклонения включали:
гематологические: часто — снижение абсолютного количества нейтрофилов, снижение концентрации гемоглобина, увеличение частичного тромбопластинового времени, лимфопсиия; нечасто -лейкопения;
биохимические: часто — гипофосфатемия, повышение активности ЩФ, гипертриглицеридемпя, повышение активности ACT; нечасто — гиперхолестеринемия, повышение активности АЛТ, снижение содержания калия в плазме крови, повышение концентрации глюкозы крови натощак.
Описание отдельных НЯ по данным клинических исследований и при применении эверолимуса в клинической практике в пострегистрационном периоде Отмечались случаи обострения вирусного гепатита В, включая случаи с летальным исходом. Обострение инфекций является ожидаемым явлением в периоды иммуносупрессии.
Отмечались случаи почечной недостаточности (в том числе с легальным исходом) и протеинурии. Рекомендуется контролировать функцию почек.
Отмечались случаи аменореи (включая вторичную аменорею).
Отмечались случаи развития пневмоцистной пневмонии, некоторые с летальным исходом.
Отмечались случаи развития ангионевротического отёка как при одновременном применении с ингибиторами АПФ. так и при изолированном применении эверолимуса.
Если отмечено ухудшение клинического течения любого из указанных в инструкции побочных эффектов, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Взаимодействие с другими лекарственными средствами
Эверолимус является субстратом изофермента CYP3A4, а также субстратом и умеренно активным ингибитором Р-гликопротеина (Р-ГП-насоса), обеспечивающего выход из клеток многих лекарственных соединений. Поэтому на всасывание и последующее выведение эверолимуса могут влиять вещества, которые взаимодействуют с изоферментом CYP3A4 и/или Р-ГП.
In vitro эверолимус проявляет свойства конкурентного ингибитора изофермента CYP3A4 и смешанного ингибитора изофермента CYP2D6.
Лекарственные средства (ЛС), которые могут повысить концентрацию эверолимуса в крови:
Концентрация эверолимуса в крови может повышаться при одновременном применении с ЛС, являющимися ингибиторами изофермента CYP3A4 (снижение метаболизма эверолимуса) или Р-ГП-насоса (снижение эффлюкса эверолимуса из клеток кишечника). Следует избегать одновременного применения эверолимуса с мощными ингибиторами изофермента CYP3A4 или Р-ГП (включая кетоконазол, итраконазол, позаконазол, вориконазол, телитромицин, кларитромицин, нефазодон, ритонавир, атазанавир, саквинавир, дарунавир, индинавир, нелфинавир и другие ЛС со сходной активностью). Системная биодоступность эверолимуса существенно возрастала (увеличение Сmax и AUC соответственно в 4,1 и 15.3 раз) у здоровых добровольцев при совместном введении эверолимуса с кетоконазолом, являющимся мощным ингибитором изофермента CYP3A4 и Р-ГП.
Следует соблюдать осторожность при одновременном применении эверолимуса с умеренными ингибиторами CYP3A4 (включая эритромицин, верапамил, циклоспорин, флуконазол, дилтиазем, ампренавир, фосампренавир или апрепитант) или ингибиторами Р-ГП.
При применении вместе с умеренными ингибиторами изофермента CYP3A4 или ингибиторами Р-ГП дозу препарата Афинитор® следует снизить.
Системная биодоступность препарата у здоровых добровольцев возрастала при одновременном применении с:
- эритромицином (умеренно активный ингибитор изофермента CYP3A4 и Р-ГП; Cmax и AUC эверолимуса увеличивались соответственно в 2 и 4,4 раза),
-верапамилом (умеренно активный ингибитор изофермента CYP3A4 и Р-ГП; Cmax и AUC эверолимуса возрастали соответственно в 2,3 и 3.5 раза),
-циклоспорином (субстрат изофермента CYP3A4 и ингибитор Р-ГП; Cmax и AUC эверолимуса увеличивались соответственно в 1,8 и 2,7 раза).
К другим умеренным ингибиторам изофермента CYP3A4 и Р-ГП, которые могут повышать концентрацию эверолимуса в крови, относятся некоторые противогрибковые средства (например, флуконазол) и некоторые блокаторы «медленных» кальциевых каналов (например, дилтиазем).
Не было выявлено различий в Cmin эверолимуса, применяемого в ежедневной дозе 5 или 10 мг, при применении совместно или без субстратов изофермента CYP3A4 и/или Р-ГП. Совместное применение со слабыми ингибиторами изофермента CYP3A4 совместно или без ингибиторов Р-ГП не оказывало влияние на Cmin эверолимуса, применяемого в ежедневной дозе 5 или 10 мг.
ЛС, которые могут снизить концентрацию эверолимуса в крови:
Концентрация эверолимуса в крови может снижаться при одновременном применении ЛС, являющимися индукторами изофермента CYP3A4 (повышение метаболизма эверолимуса) или Р-ГП-насоса (увеличение выхода эверолимуса из клеток кишечника).
Следует избегать одновременного применения эверолимуса с мощными индукторами изофермента CYP3A4 или индукторами Р-ГП. При необходимости применения препарата Афинитор® совместно с мощными индукторами изофермента CYP3A4 или индукторами Р-ГП (например, рифампицином или рифабутином) дозу препарата следует увеличить.
У здоровых добровольцев, получавших предшествующую терапию рифампицином (600 мг/сут в течение 8 дней), при последующем применении эверолимуса в однократной дозе наблюдалось почти 3-кратное повышение клиренса последнего и снижение Сmax на 58 % и AUC — на 63%.
Другие мощные индукторы изофермента CYP3A4 также могут повышать метаболизм эверолимуса и уменьшать концентрации эверолимуса в крови (например, зверобой продырявленный; глюкокортикостероиды (например, дексаметазон, преднизон, преднизолон), некоторые противосудорожные средства: карбамазепин, фенобарбитал, фенитоин; препараты для лечения ВИЧ: эфавиренз, невирапин).
Влияние эверолимуса на концентрацию в плазме ЛС, применяемых в качестве сопутствующей терапии
У здоровых добровольцев одновременное применение эверолимуса с аторвастатином (субстрат изофермента CYP3A4) или правастатином (не является субстратом изофермента CYP3A4) клинически значимого фармакокинетического взаимодействия не отмечалось. При популяционном фармакокинетическом анализе не было выявлено также влияния симвастатина (субстрат изофермента CYP3A4) на клиренс эверолимуса.
In vitro эверолимус конкурентно ингибировал метаболизм субстрата изофермента CYP3A4 — циклоспорина и являлся смешанным ингибитором субстрата изофермента CYP2D6 -декстрометорфана. Средняя стационарная Cmax эверолимуса при приёме препарата внутрь в дозе 10 мг в день или 70 мг в неделю более чем в 12-36 раз ниже значений К; эверолимуса по ингибирующему действию in vitro на изоферменты CYP3A4 и CYP2D6. Поэтому влияние эверолимуса in vivo на метаболизм субстратов изоферментов CYP3A4 и CYP2D6 маловероятно.
Комбинированное применение эверолимуса и мидазолама (субстрат CYP3A4) приводит к увеличению Сmax мидазолама на 25 % и возрастанию AUC(o-inf) мидазолама на 30 %, при этом метаболическое отношение AUC (1-гидроксимидазолам/мидазолам) и период полувыведения мидазолама не изменяются. Это свидетельствует о том, что повышенная экспозиция мидазолама является следствием эффектов эверолимуса в желудочно-кишечном тракте, когда оба препарата принимаются в одно и то же время. Поэтому эверолимус может влиять на биодоступность одновременно принимаемых внутрь ЛС, которые являются субстратами изофермента CYP3A4. Маловероятно, что эверолимус изменяет экспозицию других ЛС, являющихся субстратами CYP3A4, вводимых не внутрь, а другими путями, например, внутривенно, подкожно и трансдермально.
Совместное применение эверолимуса и экземестана приводит к увеличению Сmах и С2 ч соответственно на 45 % и 71%. Тем не менее, соответствующие уровни эстрадиола в равновесном состоянии (4 недели) не отличались в двух группах терапии. У пациенток в постменопаузе с гормонозависимым распространённым раком молочной железы с положительными гормональными рецепторами, получавших соответствующую комбинацию, не наблюдалось увеличения частоты развития побочных эффектов. Маловероятно, чтобы увеличение концентрации экземестана оказывало влияние на эффективность и безопасность данного ЛС.
Комбинированное применение эверолимуса и октреотида пролонгированного действия приводит к увеличению Сmin октреотида, оказывающее незначительное влияние на клинический эффект эверолимуса у пациентов с метастазирующими нейроэндокринными опухолями.
Другие виды взаимодействия, которые могут повлиять па концентрацию эверолимуса Следует избегать одновременного применения эверолимуса с грейпфрутом, грейпфрутовым соком, плодами карамболы (тропической звезды), померанцем (горьким апельсином) и другими продуктами, влияющими на активность цитохрома P450 и Р-ГП. Вакцинация
Иммунодепрессанты могут оказывать влияние на ответ при вакцинации; на фоне лечения препаратом Афинитор® вакцинация может быть менее эффективной. Следует избегать использования живых вакцин.
Особые указания
Лечение препаратом Афинитор® следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.
Следует соблюдать осторожность при одновременном применении эверолимуса и умеренных ингибиторов изофермента CYP3A4 или ингибиторов Р-ГП. Следует избегать одновременного применения эверолимуса и мощных индукторов изофермента CYP3A4.
Во время терапии препаратом Афинитор® и как минимум в течение 2-х месяцев после следует использовать надёжные методы контрацепции.
До начала лечения препаратом Афинитор® и периодически во время терапии препаратом следует контролировать функцию почек, включая измерения концентрации азота мочевины крови, белка в моче или концентрации креатинина в сыворотке крови, проводить клинический анализ крови и определять концентрацию препарата у пациентов с СЭГА. Следует особо тщательно контролировать функцию почек у пациентов с дополнительными факторами риска.
До начала лечения препаратом Афинитор® и периодически во время терапии препаратом следует контролировать концентрацию глюкозы крови. Следует обеспечить адекватный контроль концентрации глюкозы крови до начала лечения препаратом Афинитор®. Следует обеспечить особо тщательный и более частый гликемический контроль у пациентов с дополнительными факторами риска.
До начала лечения препаратом Афинитор® и периодически во время терапии препаратом следует контролировать содержание форменных элементов крови.
До начала лечения препаратом Афинитор® и периодически во время терапии препаратом следует контролировать концентрацию холестерина и триглицеридов.
Неинфекционный пневмонит является класспецифичным побочным эффектом производных рапамицина. При применении препарата Афинитор® также отмечались случаи развития неинфекционного пневмонита (включая интерстициальную болезнь лёгких).
В ряде случаев наблюдались тяжёлые формы заболевания (редко со смертельным исходом). Диагноз неинфекционного пневмонита следует предположить у пациентов при развитии таких неспецифических проявлений со стороны органов дыхания, как гипоксия, плевральный выпот, кашель или одышка, а также при исключении с помощью соответствующих диагностических исследований инфекционной, опухолевой и других причин таких проявлений. При проведении дифференциальной диагностики неинфекционного пневмонита следует исключить оппортунистические инфекции, например, пневмоцистную пневмонию. Пациентам следует сообщать лечащему врачу о появлении любых новых или усилении имеющихся респираторных симптомов. Пациенты, имеющие только рентгенологические признаки неинфекционного пневмонита (при отсутствии или при наличии минимальных клинически значимых симптомов), могут продолжать лечение препаратом Афинитор® без изменения дозы препарата. Если симптомы пневмонита выражены умеренно, необходимо рассмотреть вопрос о временной приостановке терапии до исчезновения симптомов. Для купирования симптомов возможно применение глюкокортикостероидов. Лечение препаратом может быть возобновлено в дозе на 50 % ниже исходной.
При развитии выраженных симптомов (степень 3 или 4) неинфекционного пневмонита терапию препаратом Афинитор® следует временно прекратить до уменьшения степени тяжести симптомов до степени 1 и ниже. В клинических исследованиях случаи развития данного осложнения отмечались также и при применении сниженных доз препарата Афинитор®. Для купирования симптомов возможно применение глюкокортикостероидов. В зависимости от конкретных клинических условий после излечения пневмонита терапия препаратом может быть возобновлена в дозе на 50 % ниже исходной (см. Способ применения и дозы). При повторном возникновении симптомов степени тяжести 3 следует рассмотреть прекращение терапии препаратом. При степени тяжести симптомов 4 терапию препаратом Афинитор® следует прекратить.
У пациентов, получающих с целью лечения неинфекционного пневмонита глюкокортикостероидные препараты, следует рассмотреть возможность проведения профилактики развития пневмоцистной пневмонии.
Препарат Афинитор® обладает иммуносупрессивными свойствами и может способствовать развитию у пациентов бактериальных, грибковых, вирусных или протозойных инфекций, в особенности вызываемых условно патогенными микроорганизмами. У пациентов, принимавших препарат Афинитор®, были описаны местные и системные инфекции, включая пневмонию, другие бактериальные инфекции, грибковые инфекции, такие как аспергиллез или кандидоз, пневмоцистную пневмонию и вирусные инфекции, включая обострение вирусного гепатита B. Некоторые из этих инфекций были тяжёлыми (с развитием сепсиса, дыхательной или печёночной недостаточности) и иногда приводили к летальному исходу. Пациенты должны быть проинформированы о повышенном риске развития инфекций при применении препарата Афинитор®, быть внимательными к симптомам и признакам инфекций и при их появлении своевременно обращаться к врачу. Пациентам с инфекционными заболеваниями перед применением препарата Афинитор® следует провести надлежащее лечение.
В случае развития инвазивной системной грибковой инфекции терапию препаратом Афинитор® следует отменить и начать соответствующую противогрибковую терапию.
У пациентов, получавших лечение препаратом Афинитор®, наблюдались изъязвления слизистой оболочки ротовой полости, стоматит и воспаление слизистой оболочки полости рта. В таких случаях рекомендуют местную терапию, однако следует избегать средств для полоскания полости рта, содержащих спирт, перекись водорода, йод и тимьян, поскольку их применение может ухудшить состояние. Противогрибковые средства следует использовать только в случае подтверждения грибковой инфекции.
У пациентов, получающих терапию эверолимусом, описаны случаи развития пневмоцистной пневмонии, некоторые с летальным исходом. Развитие пневмоцистной пневмонии может быть связано с одновременным применением глюкокортикостероидов или других иммунодепрессивных препаратов. В случае одновременного лечения глюкокортикостероидами или другими препаратами, угнетающими иммунную систему, следует рассмотреть возможность проведения профилактики развития пневмоцистной пневмонии. Реакции гиперчувствительности при применении эверолимуса включали (но не ограничивались) анафилактический шок, одышку, покраснение кожных покровов, боль в грудной клетке или ангионевротический отёк (например, отёк дыхательных путей или языка с/без нарушения функции дыхания). Пациенты, получающие одновременное лечение ингибиторами АПФ могут иметь повышенный риск развития ангионевротического отёка (например, отёка дыхательных путей или языка с/без нарушения функции дыхания).
В случае применения препарата Афинитор® у пациентов младше 18 лет следует провести все рекомендованные местным календарём прививок противовирусные вакцинации.
Влияние на способность управлять транспортными средствами, механизмами
Форма выпуска
Таблетки диспергируемые по 2, 3 и 5 мг.
По 10 таблеток в блистер из ПА/Ал/ПВХ.
По 3 блистера вместе с инструкцией по применению в картонной пачке.
Хранение
В сухом защищённом от света месте при температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять препарат по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Novartis Pharma, AG, Швейцария
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Афинитор:
