Мавирет
, таблеткиРегистрационный номер
Торговое наименование
Мавирет
Международное непатентованное наименование
Лекарственная форма
таблетки, покрытые плёночной оболочкой
Состав
Действующие вещества: глекапревир 100,0 мг, пибрентасвир 40,0 мг.
Вспомогательные вещества: коповидон К 28, D-альфа-токоферола макрогола сукцинат, кремния диоксид коллоидный, кроскармеллоза натрия, натрия стеарилфумарат, пропиленгликоля монокаприлат тип II;
плёночное покрытие Опадрай II розовый (Opadry® II 32F240023): гипромеллоза 2910, лактозы моногидрат, титана диоксид, макрогол 3350, железа оксид красный.
Описание
Продолговатые двояковыпуклые таблетки, покрытые плёночной оболочкой розового цвета с гравировкой "NXT" на одной стороне.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Препарат Мавирет — это комбинация двух пангенотипных противовирусных средств прямого действия в фиксированных дозах — глекапревира (ингибитора протеазы NS3/4A) и пибрентасвира (ингибитора NS5A), воздействующих на различные этапы жизненного цикла вируса гепатита C.
Глекапревир
Глекапревир представляет собой ингибитор протеазы вируса гепатита C (ВГС) NS3/4A, которая необходима для протеолитического расщепления кодирующего вирус гепатита C полипротеина (для дальнейшего превращения в зрелые формы белков NS3, NS4A, NS4B, NS5A, и NS5B) и имеет важное значение для репликации вируса. В биохимических исследованиях глекапревир ингибировал протеолитическую активность рекомбинантных протеаз вируса гепатита C NS3/4A из клинических изолятов вируса генотипов la, lb, 2a, 2b, 3a, 4a, 5a и 6a со значениями IC50 от 3,5 до 11,3 нМ.
Пибрентасвир
Пибрентасвир является пангенотипным ингибитором белка NS5A вируса гепатита C, который необходим для репликации вирусной РНК и сборки вириона. Механизм действия пибрентасвира был изучен в ходе исследований противовирусной активности на клеточных культурах и исследований по определению характера лекарственной резистентности.
Противовирусная активность
Значения ЕС50 глекапревира и пибрентасвира против полноразмерных или гибридных репликонов, кодирующих NS3 или NS5A из лабораторных штаммов, представлены в таблице 1.
| Подтип ВГС | ЕС50 глекапревира, нМ | ЕС50 пибрентасвира, нМ |
|---|---|---|
| 1a | 0,85 | 0,0018 |
| lb | 0,94 | 0,0043 |
| 2a | 2,2 | 0,0023 |
| 2b | 4,6 | 0,0019 |
| 3a | 1,9 | 0,0021 |
| 4a | 2,8 | 0,0019 |
| 5a | Н/П | 0,0014 |
| 6a | 0,86 | 0,0028 |
Н/П — неприменимо.
Значения ЕС50 глекапревира и пибрентасвира против гибридных репликонов, кодирующих NS3 или NS5A из клинических изолятов, представлены в таблице 2.
| Подтип ВГС | Глекапревир | Пибрентасвир | ||
|---|---|---|---|---|
| Количество клинических изолятов | Медиана ЕС50, нМ (диапазон) | Количество клинических изолятов | Медиана ЕС50, нМ (диапазон) | |
| 1a | 11 | 0,08 (0,05–0,12) | 11 | 0,0009 (0,0006–0,0017) |
| 1b | 9 | 0,29 (0,20–0,68) | 8 | 0,0027 (0,0014–0,0035) |
| 2a | 4 | 1,6 (0,66–1,9) | 6 | 0,0009
(0,0005–0,0019) |
| 2b | 4 | 2,2 (1,4–3,2) | 11 | 0,0013
(0,0011–0,0019) |
| Зa | 2 | 2,3 (0,71–3,8) | 14 | 0,0007
(0,0005–0,0017) |
| 4а | 6 | 0,41 (0,31–0,55) | 8 | 0,0005
(0,0003–0,0013) |
| 4b | Н/П | Н/П | 3 | 0,0012 (0,0005–0,0018) |
| 4d | 3 | 0,17 (0,13–0,25) | 7 | 0,0014 (0,0010–0,0018) |
| 5a | 1 | 0,12 | 1 | 0,0011 |
| 6а | Н/П | Н/П | 3 | 0,0007 (0,0006–0,0010) |
| 6e | Н/П | Н/П | 1 | 0,0008 |
| 6p | Н/П | Н/П | 1 | 0,0005 |
Н/П — неприменимо.
Активность in vitro
Оценка комбинации глекапревира и пибрентасвира на репликонных клеточных культурах генотипа ВГС 1 не выявила каких-либо признаков антагонизма противовирусной активности.
Резистентность
В культуре клеток
Для репликонов был проведён фенотипический анализ аминокислотных замен в белках NS3 или NS5A. выделенных в культуре клеток или значимых для класса ингибиторов.
Замены, значимые для класса ингибиторов протеазы ВГС, в положениях 36, 43, 54, 55, 56, 155, 166 или 170 в белке NS3 не оказывают влияния на активность глекапревира. Для генотипа 2 аминокислотные замены в NS3 в положении 168 не оказывают влияния, в то время как некоторые замены в положении 168 вызывают снижение чувствительности к глекапревиру до 55 раз (генотипы 1, 3, 4) или снижение чувствительности более чем в 100 раз (генотип 6). Некоторые замены в положении 156 вызывают снижение чувствительности к глекапревиру более чем в 100 раз (генотипы 1–4). Аминокислотные замены в положении 80 не снижают чувствительность к глекапревиру, кроме замены Q80R в генотипе Зa, которая снижает чувствительность к глекапревиру в 21 раз.
Единичные замены, важные для класса ингибиторов протеазы NS5A в положениях 24, 28, 30, 31, 58, 92 или 93 в NS5A в генотипах 1–6 не оказывают никакого влияния на активность пибрентасвира. Например, в генотипе 3а замены в аминокислотах А30К или Y93H не влияют на активность пибрентасвира. Некоторые комбинации замен в генотипах 1a и 3a (включая A30K+Y93H в генотипе 3a) демонстрируют снижение чувствительности к пибрентасвиру.
Применение у детей
Нет данных о применении препарата у детей.
Применение у пациентов пожилого возраста
В клинические исследования препарата Мавирет были включены 328 пациентов в возрасте 65 лет и старше (13,8 % от общего числа пациентов). Частота достижения вирусологического ответа в группе пациентов в возрасте ≥65 лет была аналогична таковой у пациентов в возрасте <65 лет.
Фармакокинетика
Фармакокинетические свойства компонентов препарата Мавирет представлены в таблице 3.
| Глекапревир | Пибрентасвир | |
|---|---|---|
| Всасывание | ||
| Tmax (ч)а | 5,0 | 5,0 |
| Влияние пищи (по сравнению с приёмом натощак)b | ↑83–163 % | ↑40–53 % |
| Распределение | ||
| % связывания с белками плазмы | 97,5 | >99,9 |
| Коэффициент распределения кровь/плазма | 0,57 | 0,62 |
| Биотрансформация | ||
| Метаболизм | вторичный | отсутствует |
| Выведение | ||
| Основной путь выведения | с желчью | с желчью |
| T½ (ч) в равновесном состоянии | 6-9 | 23-29 |
| % выведения с мочойс | 0,7 | 0 |
| % выведения с каломс | 92,1d | 96,6 |
| Клеточный транспорт | ||
| Субстрат для транспортёра | Р-гликопротеин, BCRP и OATP1B1/3 | Р-гликопротеин и не исключая BCRP |
a Медиана Тmax у здоровых добровольцев после приёма однократной дозы глекапревира и пибрентасвира.
b Среднее системное воздействие при приёме с пищей со средним и высоким содержанием жиров.
c Приём однократной дозы [14C] глекапревира или [14C] пибрентасвира в исследованиях массового баланса.
d Окислительные метаболиты или их продукты обмена составляли 26 % радиоактивной дозы. Метаболиты глекапревира в плазме не наблюдались.
У пациентов с хроническим гепатитом C без цирроза, после 3 дней монотерапии либо только глекапревиром 300 мг в день (N = 6) или только пибрентасвиром 120 мг в день (N = 8), геометрическое среднее значения AUC24 составило 13600 нг × ч/мл для глекапревира и 459 нг × ч/мл для пибрентасвира. Оценка фармакокинетических параметров с использованием популяционных фармакокинетических моделей имеет присущую им неопределённость из-за нелинейности дозы и перекресного взаимодействия между глекапревиром и пибрентасвиром. Основываясь на популяционной фармакокинетической модели для препарата Мавирет при хроническом гепатите С, установившиеся значения AUC24 для глекапревира и пибрентасвира были 4800 и 1430 нг × ч/мл у пациентов без цирроза (N = 1804), и 10500 и 1530 нг × ч/мл у пациентов с циррозом печени (N=280), соответственно. По сравнению со здоровыми пациентами (N = 230), популяционные оценки AUC24, ss были аналогичны (разница в 10 %) для глекапревира и на 34 % ниже для пибрентасвира у пациентов, инфицированных вирусом гепатита C без цирроза.
Линейность / нелинейность
AUC глекапревира увеличивалась в степени большей, чем пропорциональная степень увеличения дозы (при приёме 1200 мг один раз в день, наблюдалась в 516 раз больше экспозиция, чем 200 мг один раз в день). Данное явление может быть вызвано насыщением механизмов транспорта или эффлюксных переносчиков.
AUC пибрентасвира увеличивалась в степени большей, чем пропорциональная степень увеличения дозы до 120 мг (120 мг один раз в день наблюдалось увеличение экспозиции более чем в 10 раз по сравнению с приёмом 30 мг один раз в день), но установленная линейная фармакокинетика в дозах >120 мг. Нелинейное увеличение экспозиции <120 мг может быть связано с насыщением эффлюксных переносчиков.
Биодоступность пибрентасвира при взаимодействии с глекапревиром составляет в 3 раза выше по сравнению с применением только пибрентасвира. У глекапревира наблюдалось меньшее влияние пибрентасвира.
Особые группы пациентов
Раса/этническая принадлежность
Не требуется коррекция дозы препарата Мавирет в зависимости от расы или этнической принадлежности.
Пол/масса тела
Не требуется коррекция дозы препарата Мавирет в зависимости от пола или массы тела.
Пациенты пожилого возраста
У пациентов пожилого возраста коррекция дозы препарата Мавирет не требуется. Популяционный фармакокинетический анализ ВГС-инфицированных пациентов в возрасте от 18 до 88 лет показал, что возраст не оказывает клинически значимого влияния на действие глекапревира и пибрентасвира.
Пациенты с нарушением почечной функции
Значение AUC глекапревира и пибрентасвира повышалось не более, чем на 56 % у пациентов без ВГС с лёгкой, умеренной и тяжёлой степенью нарушения функции почек, не получавших диализ, по сравнению с пациентами с нормальной функцией почек. Значение AUC глекапревира и пибрентасвира было одинаковым у пациентов без ВГС на диализе и пациентов, не получающих его (разница <18 %). В популяционном фармакокинетическом анализе у пациентов с ВГС и терминальной стадией почечной недостаточности, на диализе или без него, наблюдались значения AUC глекапревира на 86 % выше, а пибрентасвира на 54 % выше, чем у пациентов с нормальной функцией почек. При оценке концентраций несвязанных глекапревира и пибрентасвира может иметь место более выраженный рост AUC.
В целом, изменения воздействия препарата Мавирет у ВГС-инфицированных пациентов с нарушением функции почек на диализе или без него, не были клинически значимыми.
Пациенты с печёночной недостаточностью
При приёме рекомендованнной дозы значение AUC глекапревира у пациентов с печёночной недостаточностью класса A по шкале Чайлд-Пью было на 33 % выше, класса B — на 100 % выше, а класса C — в 11 раз выше, чем у пациентов без ВГС с нормальной функцией печени. Значение AUC пибрентасвира не менялось у пациентов с печёночной недостаточностью класса А по шкале Чайлд-Пью и было на 26 % выше у пациентов с печёночной недостаточностью класса B и на 114 % — класса C. При оценке концентраций несвязанных глекапревира и пибрентасвира может иметь место более выраженный рост AUC.
Популяционный фармакокинетический анализ показал, что после приёма препарата Мавирет пациентами с ВГС и компенсированным циррозом печени, воздействие глекапревира было примерно в 2 раза выше, а пибрентасвира — аналогичным таковому у пациентов с ВГС без цирроза. Механизм различий между экспозицией глекапревира у пациентов с хроническим гепатитом C с циррозом или без цирроза неизвестен.
Взаимодействие с другими лекарственными средствами
Были проведены исследования взаимодействия глекапревира/пибрентасвира с другими лекарственными средствами, которые могут вступать во взаимодействия с глекапревиром/пибрентасвиром и препаратами, которые часто применяются в исследованиях фармакокинетического взаимодействия. В таблицах ниже показаны фармакокинетические эффекты при взаимодействии глекапревира/пибрентасвира с другими лекарственными препаратами, которые показали потенциальные клинически значимые изменения.
| Совместно применяемый препарат | Доза совместно применяемого препарата (мг) | Доза ГЛЕ/ПИБ (мг) | N | Препарат прямого противовирусного действия | Соотношение центральных значений (90 % ДИ) | ||
|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||||
| Карбамазепин | 200 два раза в день | 300/120 однократно | 10 | ГЛЕ | 0,33 (0,27:0.41) | 0,34 (0,28:0,40) | — |
| ПИБ | 0,50 (0,42; 0,59) |
0,49 (0,43;0,55) |
— | ||||
| Рифампицин | 600 (первая доза) | 300/120 однократно |
12 | ГЛЕ | 6,52 (5,06:8.41) |
8,55 (7,01; 10,4) |
— |
| ПИБ | ↔ | ↔ | — | ||||
| 600 один раз в день | 300/120 однократно1 |
12 | ГЛЕ | 0,14 (0.1 1; 0,19) |
0,12 (0,09; 0,15) |
— | |
| ПИБ | 0,17 (0,14; 0,20) |
0,13 (0,11; 0,15) |
— | ||||
| Циклоспорин | 100 однократно | 300/120 один раз в день | 12 | ГЛЕb | 1,30 (0,95. 1,78) |
1,37 (1,13, 1.66) |
1,34 (1.12, 1,60) |
| ПИБ | ↔ | ↔ | 1.26 (1,15, 1,37) |
||||
| 400 однократно | 300/120 однократно |
11 | ГЛЕ | 4,51 (3,63.6,05) |
5,08 (4,11,6,29) |
— | |
| ПИБ | ↔ | 1,93 (1,78.2,09) |
— | ||||
| Атазанавир (ATZ) + ритонавир (RTV) | ATZ 300 + RTV 100 один раз в день | 300/120 один раз в деньс | 12 | ГЛЕ | >4,06 (3,15,5,23) |
>6,53 (5,24, 8,14) |
>14,3 (9.85. 20,7) |
| ПИБ | >1,29 (1,15, 1,45) |
>1,64 (1,48, 1,82) |
>2,29 (1,95, 2,68) |
||||
| Дарунавир (DRV) + RTV | DRV 800 RTV 100 один раз в день |
300/120 один раз в день | 8 | ГЛЕ | 3.09 (2,26.4,20) |
4,97 (3,62,6,84) |
8.24 (4,40. 15,4) |
| ПИБ | ↔ | 1.66 (1,25,2.21) |
|||||
| 400/100 2 раза в день | 300/120 один раз в день | 9 | ГЛЕ | 2,55 (1.84,3,52) |
4,38 (3,02,6,36) |
18,6 (10,4, 33,5) |
|
| ПИБ | 1,40 (1,17, 1.67) |
2,46 (2,07, 2,92) |
5,24 (4,18. 6.58) |
||||
= без изменений (соотношение центральных значений от 0,80 до 1,25)
d Влияние рифампицина на глекапревир и пибрентасвир через 24 часа после приёма последней дозы рифампицина.
e У пациентов после трансплантации печени, инфицированных ВГС, которые получали лечение циклоспорином в дозе 100 мг или менее в день, экспозиция глекапревира была в 2,4 раза выше по сравнению с пациентами, которые не принимали циклоспорин.
f Было отмечено влияние атазанавира и ритонавира на концентрацию глекапревира и пибрентасвира после приёма первой дозы глекапревира и пибрентасвира.
| Совместно применяемый препарат | Доза совместно применяемого препарата (мг) | доза ГЛЕ/ПИБ (мг) | N | Соотношение центральных значений (90 % ДИ) | ||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| Дигоксин | 0,5 однократно | 400/120 один раз в день | 12 | 1,72 (1,45:2.04) |
1,48 (1,40; 1,57) |
-- |
| Дабигатран | дабигатрана этексилат 150 однократно | 300/120 один раз в день | 11 | 2,05 (1,72; 2,44) |
2,38 (2,11; 2,70) |
-- |
| Правастатин | 10 один раз в день | 400/120 один раз в день | 12 | 2,23 (1,87:2,65) |
2,30 (1,91;2,76) |
-- |
| Розувастатин | 5 один раз в день | 400/120 один раз в день | 11 | 5,62 (4,80:6,59) |
2,15 (1,88; 2,46) |
-- |
| Аторвастатин | 10 один раз в день | 400/120 один раз в день | 11 | 22,0 (16,4:29,6) |
8,28 (6,06; 11,3) |
-- |
| Ловастатин | Ловастатин 10 один раз в день | 300/120 один раз в день | 12 | ↔ | 1,70 (1,40; 2.06) |
- |
Метаболит ловастатина, ловастатиновая кислота |
5,73 (4,65; 7,07) | 4,10 (3,45; 4,87) |
-- | |||
| Симвастатин | Симвастатин 5 один раз в день | 300/120 один раз в день | 12 | 1.99 (1,60; 2,48) |
2,32 (1,93; 2,79) |
-- |
| Метаболит симвастатина, симвастатиновая кислота | 10,7 (7,88; 14,6) |
4,48 (3,11; 6,46) |
-- | |||
| Этинилэстрадиол (ЭЭ) | ЭЭ/ Норгестимат 35 мкг/250 мкг 1 раз в день |
300/120 один раз в день | 11 | 1,31 (1,24; 1,38) |
1,28 (1,23; 1,32) |
1,38 (1,25; 1,52) |
| Норгестрел | 1,54 (1,34; 1,76) |
1,63 (1,50; 1,76) |
1,75 (1,62; 1,89) |
|||
| Норгестромин | ↔ | 1.44 (1,34; 1,54) |
1,45 (1,33, 1,58) |
|||
| Этинилэстрадиол | ЭЭ/ левоноргестрел 20 мкг/100 мкг 1 раз в день |
300/120 один раз в день | 12 | 1,30 (1,18, 1,44) |
1,40 (1,33; 1,48) |
1,56 (1,41; 1,72) |
| Норгестрел | 1,37 (1,23; 1,52) |
1,68 (1,57; 1,80) |
1,77 (1,58; 1,98) |
|||
↔ = без изменений (соотношение центральных значений от 0,80 до 1,25)
Показания
Лечение хронического гепатита С у взрослых и детей с 12 лет.
Противопоказания
- Повышенная чувствительность к любому действующему веществу препарата или к любому из вспомогательных веществ.
- Пациенты с тяжёлой печёночной недостаточностью (класс C по шкале Чайлд-Пью), см. разделы «Способ применения и дозы» и «Фармакокинетика».
- Совместное применение со следующими препаратами: атазанавир, аторвастатин, симвастатин, дабигатрана этексилат, препаратами, содержащими эстрадиол, сильными индукторами Р-гликопротеина и CYP3A, например, рифампицин, карбамазепин, препараты зверобоя продырявленного (Hypericum perforatum), фенобарбитал, фенитоин, примидон, (см. раздел «Взаимодействие с другими лекарственными средствами»).
- Детский возраст до 12 лет.
- Дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
С осторожностью
Препарат Мавирет не рекомендуется применять совместно с омепразолом (40 мг), дарунавиром/ритонавиром, эфавирензом, лопинавиром/ритонавиром, ловастатином, циклоспорином (>100 мг в день).
Препарат Мавирет следует применять с осторожностью со следующими препаратами: дигоксин, правастатин, розувастатин, флувастатин, питавастатин, такролимус.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении глекапревира или пибрентасвира у беременных женщин ограничены или отсутствуют. За время исследований имело место менее 300 случаев беременности. Исследования глекапревира и пибрентасвира на крысах и мышах не продемонстрировали наличие прямого токсического действия на репродуктивную функцию. Наличие токсического воздействия на беременную самку с последующим выкидышем наблюдалось у кроликов при применении глекапревира. что исключило возможность дальнейших исследований. В качестве меры предосторожности, препарат Мавирет не рекомендуется применять во время беременности.
Период грудного вскармливания
Неизвестно, выделяется ли глекапревир или пибрентасвир с грудным молоком. Доступные данные исследований фармакокинетики у животных показали экскрецию глекапревира и пибрентасвира с молоком, поэтому нельзя исключить риск для новорождённых и детей первого года жизни. Должно быть принято решение либо прекратить грудное вскармливание, либо прекратить терапию препаратом Мавирет или воздержаться от неё, принимая во внимание соотношение пользы грудного вскармливания для ребёнка и пользы терапии для женщины.
Фертильность
Исследования влияния глекапревира и/или пибрентасвира на фертильность у человека не проводились. Исследования у животных не показали негативного воздействия глекапревира или пибрентасвира на фертильность при экспозиции, превышающей значения, достигаемые у пациентов в результате приёма рекомендованных доз препаратов.
Способ применения и дозы
Для приёма внутрь.
Таблетки следует глотать целиком во время еды. не разжёвывать, не раздавливать и не ломать. Лечение препаратом Мавирет должно назначаться специалистом и проводиться под наблюдением врача, обладающего опытом лечения пациентов с хроническим гепатитом C.
Дозы у взрослых и детей с 12 лет
Рекомендуемая доза препарата Мавирет составляет 300 мг/120 мг (три таблетки по 100 мг/40 мг) один раз в сутки во время еды.
В таблицах 1 и 2 представлена рекомендуемая продолжительность лечения препаратом Мавирет на основе данных, полученных на популяции пациентов, инфицированных ВГС генотипов 1, 2, 3, 4, 5 или 6, с компенсированным циррозом печени или без него.
| Популяция пациентов | Рекомендованная продолжительность лечения | |
|---|---|---|
| Без цирроза печени | С циррозом печени | |
| ГТ 1-6 | 8 недель | 12 недель |
| Популяция пациентов | Предшествующий режим терапии | Рекомендованная продолжительность лечения | |
|---|---|---|---|
| Без цирроза печени | С циррозом печени | ||
| ГТ 1 | Ингибиторы NS5A1 без предшествующей терапии ингибиторами протеазы NS3/4A | 16 недель | 16 недель |
| Ингибиторы протеазы NS3/4A2 без предшествующей терапии | 12 недель | 12 недель | |
| ингибиторами NS5A | |||
| 1Т 1,2, 4, 5 или 6 | Предшествующая терапия, содержащая интерферон, пегилированный интерферон, рибавирин и/или софосбувир, но без предшествующей терапии ингибиторами протеазы NS3/4A или ингибиторами NS5A. | 8 недель | 12 недель |
| ГТЗ | Предшествующая терапия, содержащая интерферон, пегилированный интерферон, рибавирин и/или софосбувир. но без предшествующей терапии ингибиторами протеазы NS3/4A или ингибиторами NS5A. | 16 недель | 16 недель |
- В клинических исследованиях пациенты получали предшествующую терапию, содержащую ледипасвир и софосбувир или даклатасвир с пегилированным интерфероном и рибавирином.
- В клинических исследованиях пациенты получали предшествующую терапию, содержащую симепревир и софосбувир, или симепревир, боцепревир, или телапревир с пегилированным интерфероном или рибавирином.
Пропуск приёма препарата
В случае пропуска приёма препарата Мавирет его можно осуществить в течение 18 часов после планового времени приёма. Если с момента планового времени приёма препарата Мавирет прошло более 18 часов, не следует принимать пропущенную дозу, а следующую дозу следует принять в обычное время по расписанию. Не следует принимать двойную дозу препарата.
Если в течение 3 часов после приёма препарата Мавирет произошла рвота, то необходимо принять дополнительную дозу препарата. Если рвота произошла позднее 3 часов после применения препарата Мавирет, то приём дополнительной дозы не требуется.
Применение у пациентов пожилого возраста
У пожилых пациентов коррекция дозы препарата Мавирет не требуется.
Пациенты с нарушенной функцией почек
У пациентов с почечной недостаточностью, включая пациентов на диализе, коррекция дозы препарата Мавирет не требуется.
Пациенты с нарушением функции печени
У пациентов с печёночной недостаточностью лёгкой степени тяжести (класс A по шкале Чайлд-Пью) коррекция дозы препарата Мавирет не требуется. Препарат Мавирет не рекомендуется назначать пациентам с печёночной недостаточностью средней степени тяжести (класс B по шкале Чайлд-Пью) и противопоказан пациентам с печёночной недостаточностью тяжёлой степени (класс C по шкале Чайлд-Пью) (см. разделы «Противопоказания», «Особые указания»).
Дети
Отсутствуют данные о безопасности и эффективности применения препарата Мавирет у детей и подростков в возрасте до 12 лет.
Пациенты после трансплантации печени или почки
Пациенты после трансплантации печени или почки могут применять препарат Мавирет в течение 12 недель (см. раздел «Особые указания»). В случае если пациенту назначена более длительная терапия (в течение 16 недель), и во время терапии была проведена трансплантация печени, то 16 недельный курс лечения должен быть доведён до конца.
Пациенты с ко-инфекцией ВГС/ВИЧ-1
Следует выполнять рекомендации, указанные в Таблицах 1 и 2. Рекомендации по дозированию препарата Мавирет при совместном применении с препаратами для терапии ВИЧ-1 представлены в разделе «Взаимодействие с другими лекарственными средствами».
Побочное действие
Резюме профиля безопасности
Оценка безопасности препарата Мавирет у пациентов с компенсированной функцией печени (с циррозом печени или без него) была проведена по результатам исследований фазы 2 и 3, в которых участвовали около 2 300 пациентов, инфицированных ВГС генотипов 1, 2, 3, 4, 5 или 6, получавших Мавирет в течение 8, 12 или 16 недель.
Наиболее частыми нежелательными реакциями (частота >10 %) были головные боли и утомляемость. Менее чем у 0,1 % пациентов, получавших лечение препаратом Мавирет, развились серьёзные нежелательные реакции (транзиторная ишемическая атака). Доля пациентов, которые окончательно прекратили получать лечение препаратом Мавирет по причине развития нежелательных реакций, составила 0,1 %. Тип и тяжесть нежелательных реакций у пациентов с циррозом печени были сопоставимы с таковыми у пациентов без цирроза печени.
Таблица нежелательных реакции
Сообщалось о развитии следующих нежелательных реакций у пациентов, получавших лечение препаратом Мавирет. Ниже приведён список нежелательных реакций, сгруппированных согласно классу систем органов и по частоте встречаемости. Частота встречаемости определяется следующим образом: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от > 1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000) и очень редко (<1/10 000).
| Частота развития | Нежелательные реакции |
|---|---|
| Нарушения со стороны нервной системы | |
| Очень часто | Головная боль |
| Нарушения со стороны желудочно-кишечного тракта | |
| Часто | Тошнота, диарея |
| Общие нарушения и реакции в месте введения | |
| Очень часто | Утомляемость |
| Часто | Астения |
Описание отдельных нежелательных реакции
Нежелательные реакции у пациентов с тяжёлым нарушением функции почек, включая пациентов на диализе
Безопасность препарата Мавирет у пациентов с хронической болезнью почек (стадия 4 или стадия 5, включая пациентов на диализе) и хронической инфекцией, вызванной вирусом гепатита C генотипов 1, 2, 3, 4, 5 или 6 с компенсированной печёночной недостаточностью (с циррозом печени или без него) оценивалась на 104 пациентах. Наиболее частыми нежелательными реакциями у пациентов с тяжёлым нарушением функции почек были кожный зуд (17 %) и утомляемость (12 %).
Нежелательные реакции у пациентов после трансплантации почек или печени
Безопасность препарата Мавирет оценивалась на 100 пациентах после трансплантации печени или почек, инфицированных вирусом гепатита C генотипами 1, 2, 3, 4 или 6 без цирроза печени. Общий профиль безопасности у пациентов после трансплантации печени или почек был сопоставим с профилем безопасности у пациентов в исследованиях 2 и 3 фазы. Наблюдались следующие нежелательные реакции с частотой равной или более 5 % у пациентов, принимавших Мавирет в течение 12 недель: головная боль (17 %), усталость (16 %), тошнота (8 %) и зуд (7 %). У 81 % пациентов, принимавших препарат Мавирет, сообщались нежелательные реакции лёгкой степени тяжести. У 2 % пациентов наблюдались серьёзные нежелательные реакции. Не было ни одного случая полной отмены препарата из-за нежелательных реакций.
Оценка безопасности у пациентов с коинфекцией ВГС/ВИЧ-1
Общий профиль безопасности у пациентов с коинфекцией ВГС/ВИЧ-1 был сравним с таковым у пациентов с моноинфекцией ВГС.
Повышение уровня билирубина в сыворотке крови
У 1 % пациентов наблюдалось повышение уровня общего билирубина как минимум в 2 раза выше верхней границы нормы, что было связано с глекапревир-опосредованным ингибированием белков-переносчиков билирубина и метаболизма билирубина. Повышение уровня билирубина было бессимптомным, временным и обычно возникало на ранней стадии лечения. Повышение уровня билирубина возникало преимущественно за счёт непрямой фракции и не было ассоциировано с повышением уровня АЛТ.
Дети
Безопасность препарата Мавирет у детей от 12 до 18 лет оценивалась в открытом исследовании ⅔ фазы с участием 13 пациентов, инфицированных ВГС генотипами 1–3, получавших терапию в течение 8 недель. Нежелательные реакции, зафиксированные в ходе данного исследования были сопоставимы с реакциями, наблюдаемыми у взрослых пациентов (см таблицу 1).
Передозировка
Наибольшая задокументированная доза, принятая здоровыми добровольцами, составила 1200 мг один раз в день в течение 7 дней для глекапревира и 600 мг один раз в день в течение 10 дней для пибрентасвира. Бессимптомное повышение АЛТ в сыворотке (>5 раз ВГН) наблюдалось у 1 из 70 здоровых добровольцев после приёма нескольких доз глекапревира (700 мг или 800 мг) 1 раз в день в течение >7 дней. В случае передозировки, необходимо контролировать состояние пациента на наличие признаков токсического поражения (см. раздел «Побочное действие»). Соответствующее симптоматическое лечение должно быть начато немедленно. Гемодиализ в незначительной степени способствует выделению из организма глекапревира и пибрентасвира.
Взаимодействие с другими лекарственными средствами
Возможное влияние препарата Мавирет на другие лекарственные препараты Глекапревир и пибрентасвир — это ингибиторы Р-гликопротеина (P-GP), белка резистентности рака молочной железы (BCRP) и полипептида, транспортирующего органические анионы (OATP) 1B1/3.
Одновременное применение с препаратом Мавирет может привести к повышению концентрации в плазме препаратов, являющихся субстратами Р-гликопротеина (дабигатрана этексилат, дигоксин), BCRP (розувастатин) или OATP1B1/3 (аторвастатин, ловастатин, правастатин, розувастатин, симвастатин). См. рекомендации по лекарственному взаимодействию с чувствительными субстратами Р-гликопротеина, BCRP и OATP1B1/3 в таблице 1. Для других субстратов Р-гликопротеина, BCRP и OATP1B1/3 может потребоваться коррекция дозы.
Глекапревир и пибрентасвир — это слабые ингибиторы изоферментов системы цитохрома P450 CYP3A и уридин-глюкуронозилтрансферазы (UGT) 1A1 in vivo. Не отмечалось клинически значимого увеличения системного воздействия для чувствительных субстратов CYP3A (мидазолам, фелодипин) и UGT1A1 (ралтегравир) при одновременном приёме с препаратом Мавирет.
Применение глекапревира и пибрентасвира ингибирует помпу, экспортирующую желчные кислоты (BSEP) in vitro.
Не ожидается клинически значимого ингибирования субстратов CYP1А2, CYP2C9, CYP2C19, CYP2D6, UGT1А6, UGT1А9, UGT1A4, UGT2B7, OCT1, OCT2, OAT1, OAT3, MATE1 и MATE2K.
Пациенты, получающие антагонисты витамина K
На фоне лечения препаратом Мавирет может наступить изменение функции печени, поэтому рекомендуется тщательный мониторинг международного нормализованного отношения (МНО).
Потенциальное влияние других лекарственных препаратов на препарат Мавирет Совместный приём с сильными индукторами Р-гликопротеина/CYP3А
Лекарственные препараты, являющиеся сильными индукторами Р-гликопротеина и CYP3A (рифампицин, карбамазепин, зверобой продырявленный (Hypericum perforatum), фенобарбитал, фенитоин и примидон), могут вызвать существенное снижение концентрации глекапревира и пибрентасвира в плазме крови, привести к снижению терапевтического эффекта препарата Мавирет и потере вирусологического ответа. Применение таких препаратов одновременно с препаратом Мавирет противопоказано (см. раздел "Противопоказания").
Применение препарата Мавирет одновременно с лекарственными препаратами, которые являются умеренными индукторами Р-гликопротеина и CYP3A, может вызвать снижение концентрации глекапревира и пибрентасвира в плазме крови (окскарбазепин, эсликарбазепин, лумакафтор, кризотиниб«Особые указания»).
Глекапревир и пибрентасвир являются субстратами эффлюксных переносчиков Р-гликопротеина и (или) BCRP. Глекапревир также является субстратом транспортёров печёночного захвата OATP1B1/3. Применение препарата Мавирет одновременно с лекарственными препаратами, которые являются ингибиторами Р-гликопротеина и BCRP (циклоспорин, кобицистат, дронедарон, итраконазол, кетоконазол, ритонавир), может замедлить выведение глекапревира и пибрентасвира и может вызвать повышение экспозиции противовирусных препаратов в плазме крови. Лекарственные препараты, являющиеся ингибиторами OATP1BI/3 (элвитегравир, циклоспорин, дарунавир, лопинавир), могут вызвать повышение системной концентрации глекапревира.
Установленные и другие потенциально возможные лекарственные взаимодействия В таблице 1 приведено влияние отношения средних значений, вычисленных методом наименьших квадратов (90-процентный доверительный интервал) на концентрацию препарата Мавирет и сопутствующих лекарственных препаратов. Направление стрелки указывает направление изменения воздействия (Стах и AUC) глекапревира, пибрентасвира и сопутствующего лекарственного препарата (| — увеличение более чем на 25 %, | — снижение более чем на 20 %, — нет изменения (снижение на менее или равно 20 % или увеличение на менее или равно 25 %).
Таблица 1. Взаимодействия между препаратом Мавирет и другими лекарственными средствами

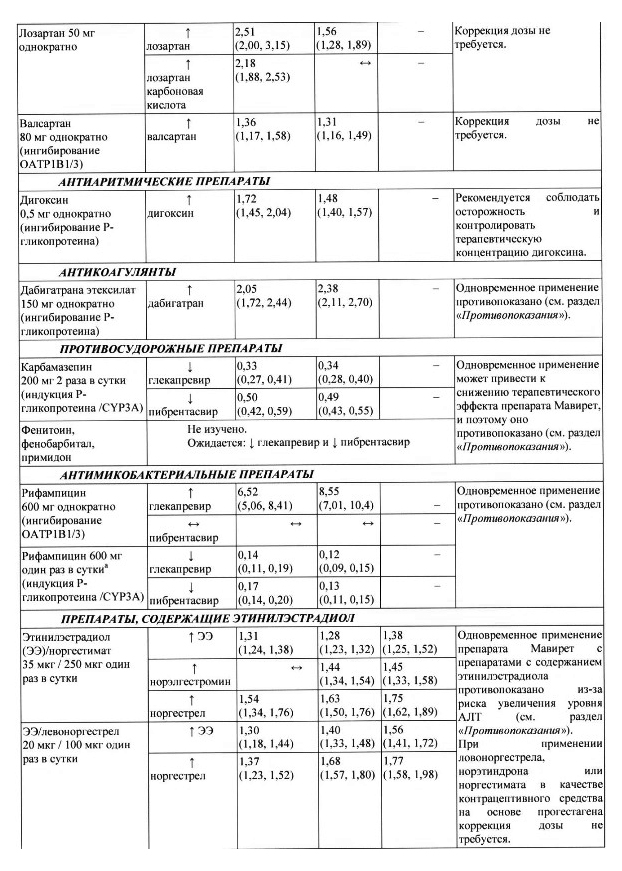
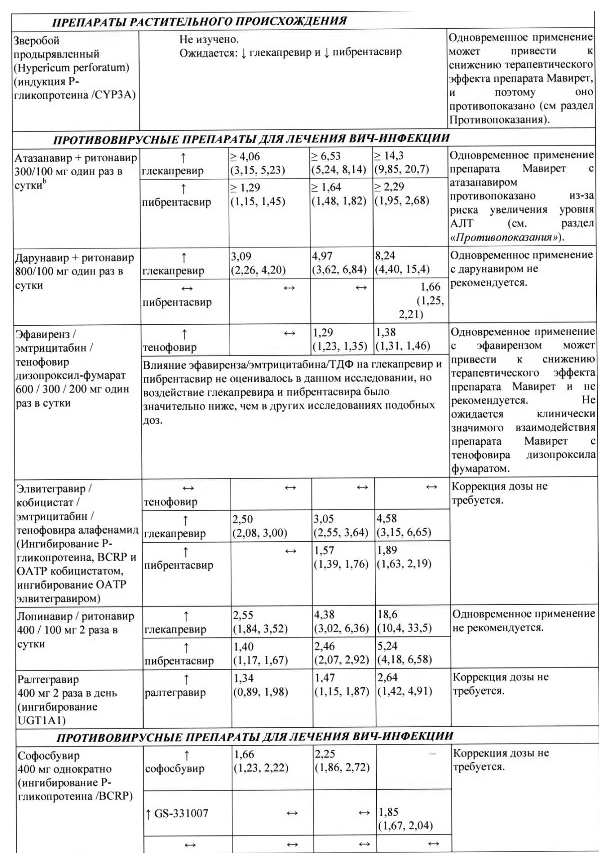
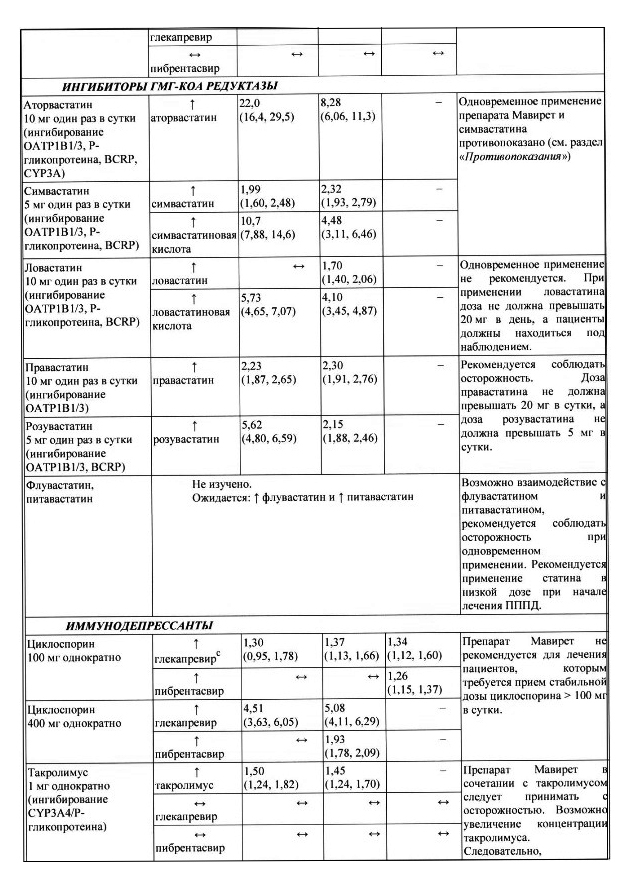
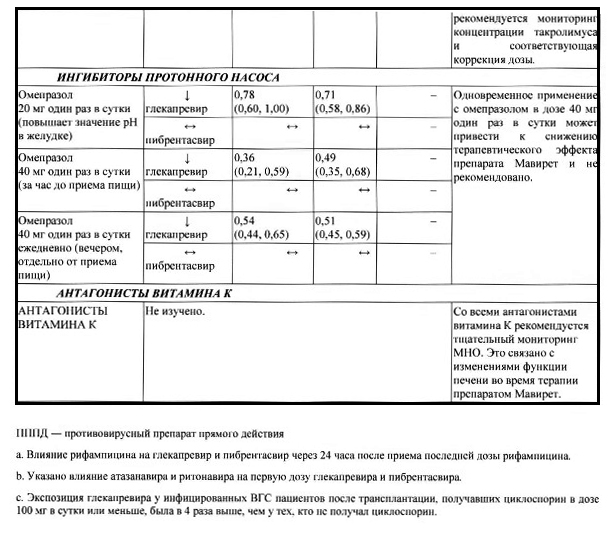
Дополнительные исследования межлекарственного взаимодействия проводились со следующими лекарственными препаратами: абакавир, амлодипин, бупренорфин, кофеин, декстрометорфан, долутегравир, эмтрицитабин, фелодипин, ламивудин, ламотриджин. метадон, мидазолам, налоксон, норэтиндрон или другие контрацептивные средства, содержащие прогестин, рилпивирин, тенофовир алафенамид и толбутамид. Клинически значимого взаимодействия не выявлено.
Особые указания
Реактивация вирусного гепатита B
Во время лечения противовирусными препаратами прямого действия сообщалось о реактивации вируса гепатита B. в некоторых случаях со смертельным исходом. Перед началом терапии все пациенты должны проходить обследование на наличие ВГВ. Пациенты с коинфекцией ВГВ/ВГС подвержены риску реактивации ВГВ, поэтому следует проводить их мониторинг и ведение с соблюдением современных рекомендаций.
Нарушение функции печени
Препарат Мавирет не рекомендуется назначать пациентам с печёночной недостаточностью средней степени тяжести (класс B по шкале Чайлд-Пью) и противопоказан пациентам с тяжёлой печёночной недостаточностью (класс C по шкале Чайлд-Пью) (см. разделы «Способ применения и дозы», «Противопоказания»).
Взаимодействие с другими лекарственными препаратами
Подробную информацию см. в разделе «Взаимодействие с другими лекарственными средствами».
Влияние на способность управлять транспортными средствами, механизмами
Препарат Мавирет не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортными средствами и управлению механизмами.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 100 мг + 40 мг.
По 3 таблетки, покрытые плёночной оболочкой, в блистере из поливинилхлорид / полиэтилен / полихлоротрифторэтилена и алюминиевой фольги.
По 7 блистеров вместе с инструкцией по применению в пачке картонной, по 4 пачки картонных в пачке картонной.
Хранение
При температуре не выше 25 °C.
Хранить в местах, недоступных для детей.
Срок годности
2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Fournier Laboratories Ireland, Limited, Ирландия
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Мавирет:
